MATERIAŁY WĘGLOWE
- otrzymywanie i właściwości
STANISŁAW BINIAK
Cz. 2.
2012
Cp
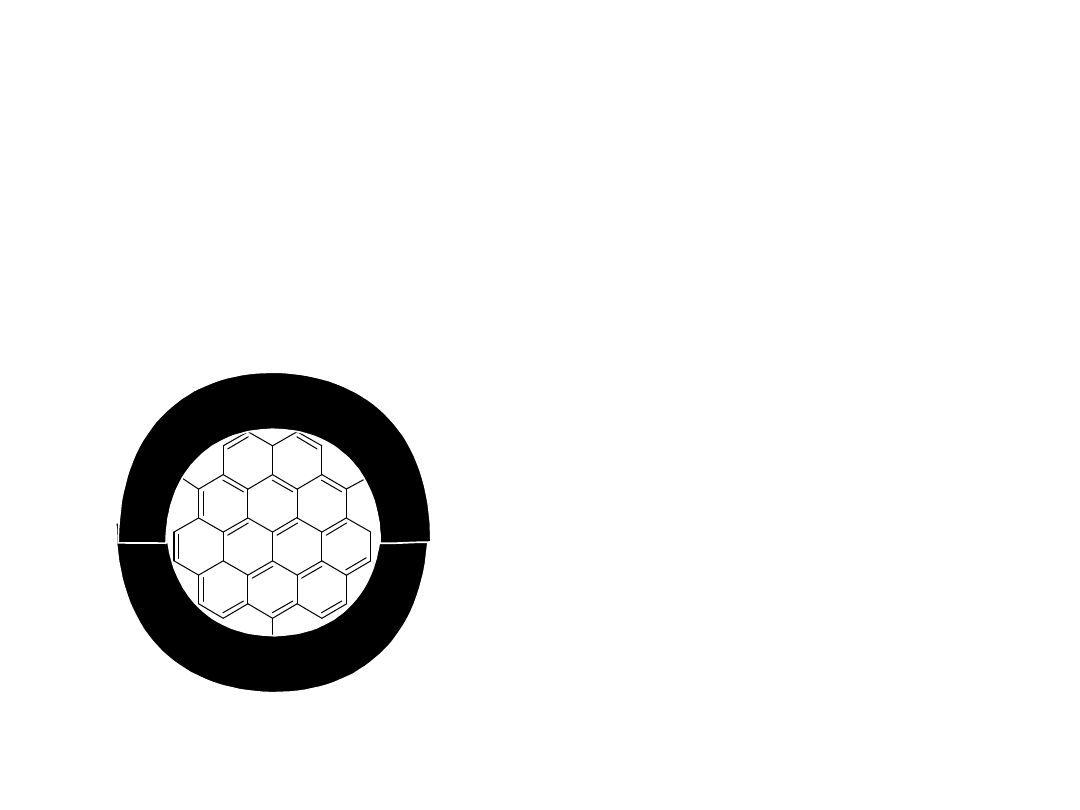
Model nanostruktury węgla aktywnego

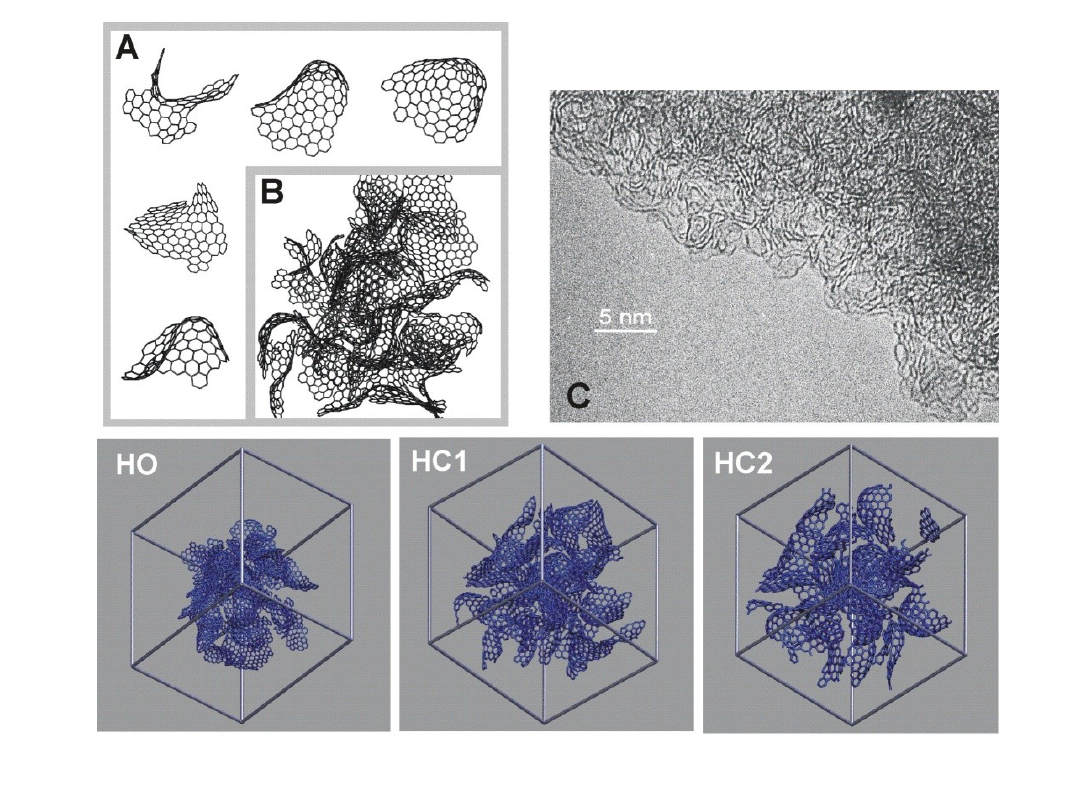
Nanostruktura węgli
aktywnych
Istotne cechy tych materiałów, które określają
ich potencjalnezastosowania są następujące:
• duże pole powierzchni właściwej (zdefiniowanej
jako S = F/m, gdzie F to pole powierzchni, a m to
masa);
• wysoka aktywność wynikająca z heterogeniczności
strukturalnej i energetycznej;
• powierzchnia katalitycznie czynna;
• duża pojemność adsorbentu;
• skłonność do aglomeracji;
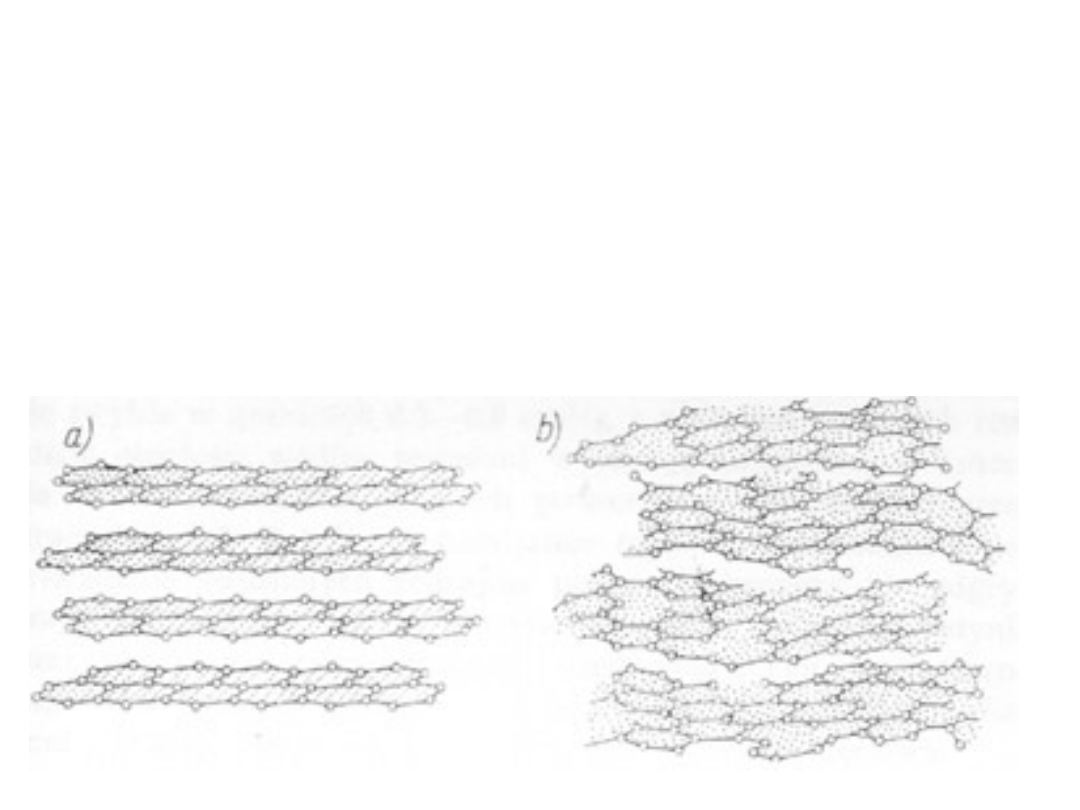
Porównanie sieci krystalicznej grafitu (a)
ze strukturą węgla aktywnego (b)
Podstawowe różnice stanowią:
• odległości międzywarstwowe, grafit -
0,3354 nm,
krystality węgli aktywnych 0,34 – 0,38 nm.
• różne zorientowanie krystalitów, które w
przypadku węgli aktywnych są ułożone mniej
regularnie


Węgle aktywne stosowane są masowo przede
wszystkim
w
procesach
adsorpcyjnego
oczyszczania powietrza i wody oraz odzyskiwania
lotnych związków z gazów poreakcyjnych. W
mniejszej
skali
są
wykorzystywane
jako
katalizatory i nośniki katalizatorów. Wśród
perspektywicznych zastosowań w tej dziedzinie
wymienić należy usuwanie ditlenku siarki i
tlenków azotu z gazów spalinowych. Nową
dziedziną zastosowania węgli aktywnych są
technologie tzw. „magazynowania energii”, np.
ciśnieniowa adsorpcja metanu i wodoru czy
elektrochemiczna
akumulacja
energii
elektrycznej
w
kondensatorach
podwójnej
warstwy elektrycznej.
Odrębną
klasę
porowatych
materiałów
węglowych stanowią węglowe sita molekularne i
węglowe
membrany.
Ich
skuteczność
w
procesach rozdziału mieszanin gazowych (np.
rozdział tlenu i azotu) zależy od bardzo
jednorodnej i precyzyjnie dobranej szerokości
porów, często w zakresie ultramikroporów (< 0,5
nm).
Wykorzystanie
węglowych
sit
molekularnych lub membran to jedno z
możliwych rozwiązań problemu koncentracji
ditlenku węgla z gazów spalinowych.

Produkcja węgli aktywnych jest oparta na naturalnych
surowcach organicznych o
budowie polimerycznej. Masowo wykorzystuje się do tego celu
drewno (35% udziału w ogólnym zużyciu surowców), węgiel
kamienny (28%), węgiel brunatny (14%), torf (10%) a lokalnie
produkty odpadowe, skorupy orzechów czy pestki owoców
(10%). Znacznie droższym surowcem są syntetyczne polimery,
np. odpadowe żywice fenolowo-formaldehydowe, alkohol
polifurfurylowy, polichlorek winylidenu (3%).
Produkty karbonizacji tego typu surowców cechują się
rozwiniętą w różnym stopniu mikroporowatością, której
charakter zależy od natury materiału organicznego i
mechanizmu karbonizacji. Występowanie mikroporów jest
wynikiem małych wymiarów i przypadkowej wzajemnej
orientacji pakietów warstw grafenowych (krystalitów). Dla
większości praktycznych zastosowań ta naturalna porowatość
jest niewystarczająca. Aktywacja jest procesem rozwijania
porowatości w mało porowatym materiale wyjściowym w
wyniku zastosowania specyficznej obróbki fizykochemicznej.
Przez poszerzenia już istniejących porów i udostępnienia
porowatości zamkniętej osiąga się w ten sposób znaczne
zwiększenie
zawartości mikroporów (<2 nm) i mezoporów (2-50 nm)
materiału. Otrzymane produkty charakteryzują się bardzo
wysoką powierzchnią właściwą, która w typowych handlowych
węglach aktywnych wynosi 1000 –1500 m
2
/g, a niekiedy może
sięgać 3000 m
2
/g.




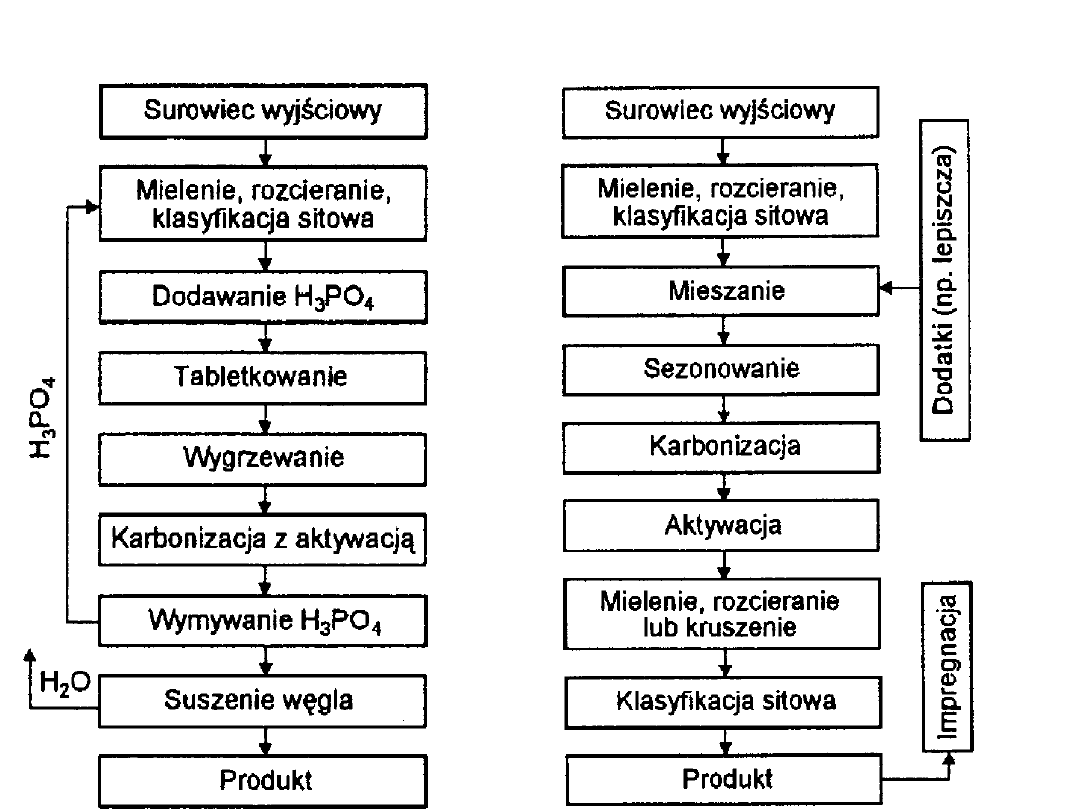
Aktywacja chemiczna
Aktywacja fizyczna
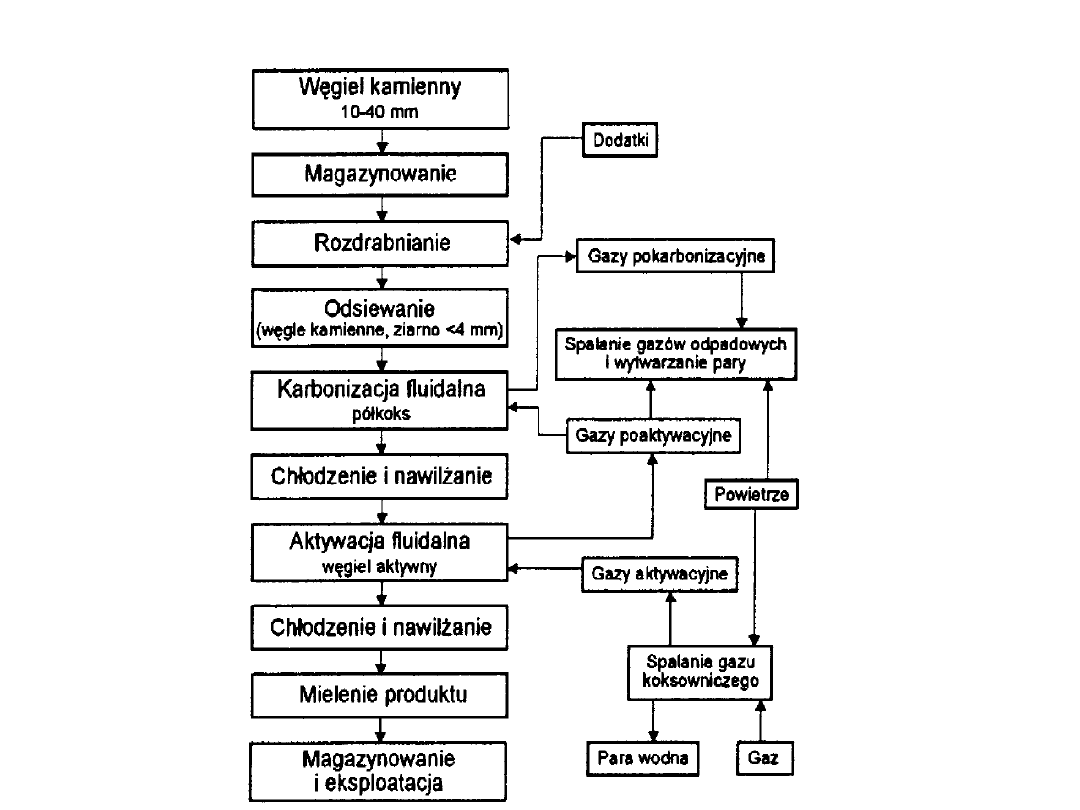
Aktywacja w fazie fluidalnej


Adsorpcja fizyczna
W przypadku adsorpcji fizycznej występują siły van der
Waalsa (siły międzycząsteczkowe, które ujawniają się
dopiero wtedy gdy cząsteczki znajdują się w odpowiedniej
odległości rzędu kilku nm). Proces ten zachodzi z dużą
prędkością w dowolnym miejscu powierzchni adsorbentu
przy niskiej temperaturze, ponadto cząsteczka adsorbatu nie
zmienia się pod względem chemicznym. Jest to proces
odwracalny, a grubość warstw adsorpcyjnych, w określonych
warunkach ciśnienia i temperatury, odpowiada kilku
średnicom cząsteczek adsorbatu.
Adsorpcja chemiczna
Chemisorpcja jest procesem prowadzącym do wytworzenia
wiązania chemicznego między ciałem stałym a adsorbowaną
cząsteczką, która zmienia się pod względem chemicznym. Do
przebiegu tego zjawiska konieczne jest doprowadzenie
odpowiedniej energii, zwanej energią aktywacji, która
zapoczątkowała by powstanie danego wiązania. Adsorpcja
chemiczna jest procesem nieodwracalnym a jej szybkość
rośnie wraz ze wzrostem temperatury, przy czym wartość tej
prędkości jest znacznie mniejsza porównując do adsorpcji
fizycznej.
Powstające
w
toku
chemisorpcji
warstwy
adsorpcyjne są jednocząsteczkowe.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
Wykład 2 od profesora Biniaka
Wykład 2 od profesora Biniaka
PiS(P) wszystkie wykłady od Ryśki
od profesora
materiały od profesorka
PŁwSL I 2013 wykł 9 C, Szkoła, Semestr 5, Przepływ ładunków w systemach logitycznych, Fijał - wykład
PŁwSL I 2013 wykł 9 A, Szkoła, Semestr 5, Przepływ ładunków w systemach logitycznych, Fijał - wykład
Wykłady od PODZIAŁU nieruchomości (97 2003)
cywil ogolna 1 wyklad do wywalenie 2 wyklad od str 5, prawo cywilne - cz੠ogˇlna (5) - 18.12.2010
wyklad od p kasza, 04.05.2009
notatki z wykladow od J Pudelko Nieznany
PŁwSL I 2013 wykł 9 D, Szkoła, Semestr 5, Przepływ ładunków w systemach logitycznych, Fijał - wykład
GLEBOZNAWSTWO wykłady od 3 6 notatka
cywil ogolna 1 wyklad do wywalenie 2 wyklad od str 5, prawo cywilne - cz੠ogˇlna (3) - 6.11.2010
cywil ogolna 1 wyklad do wywalenie 2 wyklad od str 5, prawo cywilne - cz੠ogˇlna (2) - 16.10.2010
notatki z wykładów od J.Pudełko statystyka nota1
wyklady od Kmiotek, zzl derekrutacja
wyklady od Kmiotek, zzl prawne
więcej podobnych podstron