
Układ krwiotwórczy

Metoda rozcienczeń
• Ilość substancji testowej w próbce podanej
do układu krążenia (stężenie x objętość
próbki) jest taka sama jak ilość tej substancji
w osoczu (stężenie x objętość osocza)
– Ocena:
• Wody całkowitej w ustroju
• Wody pozakomórkowej
• Wody komórkowej
– Pomocne w rozpoznawaniu stanów odwodnienia i
monitorowania leczenia

Objętość krwi
= objętość osocza + masa
erytrocytarna
• Objętość osocza
– albuminy iv – znakowane 125 I, 99m Tc,
51 Cr
• Masa erytrocytarna
– Erytrocyty znakowane 99mTc, 51 Cr
• Monitorowanie utraty krwi i skuteczności
leczenia za pomocą transfuzji i płynów
krwiozastępczych
• Masa erytrocytarna – rozpoznanie czerwienicy

Czas przeżycia
erytrocytów
•
Znakowane 51 Cr erytrocyty
•
15 min po podaniu zawiesiny znakowanych
erytrocytów pobiera się od chorego próbkę krwi
•
Następne po 3, 5, 8, 10, 12 dniach
– + pomiar hematokrytu
– krzywa logarytmiczna
– Półokres przeżycia > 24 dni = prawidłowo
– Można określić czy anemia wynika ze skrócenia okresu
przeżycia erytrocytów
• Zaburzenia biochemiczne lub strukturalne erytrocytów
• Zaburzenia w składzie osocza
• Zaburzenia w budowie ściany naczyń krwionośnych

Czas przeżycia
erytrocytów
• Do skrócenia przeżycia krwinek
dochodzi w
– Przebiegu anemii hemolitycznej,
– W procesach zapalnych
– Chorobie reumatycznej
– Nocnej hemoglobinurii
– Procesach nowotworowych
– Porfirii

Badanie kinetyki żelaza
• Żelazo podane i.v. ulega połączeniu z
ferrytyną i jest transportowane do
miejsc erytropoezy. Tam
wbudowywane jest do krwinek
czerwonych i uwalniane do
krwioobiegu. Po rozpadzie krwinek
żelazo uwolnione zostaje do krwi
gdzie ponownie łączy się z ferrytyną

Badanie kinetyki żelaza
• Żelazo podajemy i.v.
• Badanie składa się z 3 części:
– Pomiar radioaktywności w osoczu krwi w ciągu 2 godzin
po podaniu znacznika (15, 30, 45, 60, 90, 120 min)
– Pomiarów radioaktywności w osoczu krwi codziennie od
2 – 8 dnia, 10 i 12 dnia badania
– Pomiarów radioaktywności w rzucie serca, wątroby,
śledziony i kości krzyżowej za pomocą sondy
scyntylacyjnej.
• Aby obliczyć T ½ - krzywa logarytmiczna pomiary radioaktywność
mierzona w ciągu 2 godzin wynosi 60-120 minut
– Skrócenie – poicytemia, niedobór żelaza
– Wydłużenie - osteomielofibrozy

Badanie kinetyki żelaza
• Pomiary w kolejnych dniach – pomiar utylizacji
żelaza
• Obserwuje się narastanie radioaktywności
• Plateau 7- 10 dzień, radioaktywność = 80%
mierzonej w 12 dniu
• Kość krzyżowa –wzrost radioaktywności 4-8
godzina, utrzymuje się 1 - 2 dnia i obniża się
gwałtownie – wyrzut erytrocytów
• Rzut serca, wątroby i śledziony – szybki wzrost i
spadek (po 24 godz. – spadek wynosi 50%
wartości najwyższej), potem wolny wzrost
radioaktywności.

Zastosowanie izotopów
promieniotwórczych
w endokrynologii

Tarczyca
• Scyntygrafia tarczycy
– Z użyciem 99mTc
– Z użyciem 131-I
• jodochwytność
– Z użyciem MIBI – 99mTc

Scyntygrafia tarczycy
– Wykonuje się w celu zobrazowania (oceny
morfologicznej):
• wola zamostkowego,
• kontroli i ewentualnego odrostu po zabiegu
operacyjnym,
• zaburzeń rozwojowych tarczycy,
• wola guzowatego
• Nie wymaga wykonania scyntygrafii –
– wole miąższowe i proste

• Scyntygrafia Tc 99 m
– Metabolizm technetu różni się od jodowego; ulega on
czynnemu wychwytowi przez komórki pęcherzykowe (pompa
jodowa), nie podlega innym przemianom - tzn bierze udział w
nieorganicznej przemianie jodu nie ulegając wbudowaniu w
cząsteczkę tyrozyny.
– Zalety:
• dawka pochłonięta niższa niż przy scyntygrafii jodowej
• metoda tania
– Wady:
• technet wychwytywany jest także przez min ślinianki
(znacznik nieswoisty dla tarczycy)
– Sposób badania:
• Po 1 godz. od podania doustnego,
• 20-30 min od podania dożylnego dokonuje się
odczytu radioaktywności

• Wole guzowate
– Scyntygrafia tarczycy może pomóc w rozróżnieniu
charakteru guzka:
• zimne - słabo gromadzące znacznik - np. torbiel, rak,
krwiak, ograniczone zmiany zapalne
• ciepłe - wysycone w podobnym stopniu znacznikiem jak
pozostała tkanka gruczołowa
• gorące - w obrazie scyntygraficznym widoczny jest tylko
guzek gorący; pozostały miąższ tarczycy może nie
wychwytywać radioznacznika (z powodu hamowania
wydzielania TSH poprzez wytwarzane w tym guzku
hormony tarczycy).
• Uwaga:
– Przy każdym podejrzeniu nowotworu tarczycy na podstawie
wyniku pojedynczego badania (badanie kliniczne lub usg lub
scyntygrafii) należy dążyć do wykluczenia rozpoznania
nowotworu za pomocą wykonania następujących badań:
scyntygrafii, usg i biopsji cienkoigłowej.

Scyntygrafia 131-I
– Jod 131 bierze udział we wszystkich przemianach
jodu w tarczycy. Konieczne wykonanie scyntygrafii
jodowej w podejrzeniu:
• wola zamostkowego,
• zaburzeniach rozwojowych tarczycy,
• lokalizacji przerzutów nowotworowych tarczycy
– Wada:
• przy scyntygrafii jodowej dawka pochłonięta jest 60
razy wyższa niż przy scyntygrafii technetowej.
– Sposób badania:
» Po 24 godzinach od podania doustnego

• Uwaga:
– Wykonanie scyntygrafii tarczycy z użyciem MIBI Tc
99 m - pozwala na uwidocznienie gruczolaków oraz
wysoko zróżnicowanych raków tarczycy. Wychwyt
MIBI nie zależy od TSH (można wykonywać u
pacjentów stosujących lewotyroksynę).
• Uwaga:
– substancje blokujące tarczycę - wpływają na wynik
badania scyntygraficznego
• Uwaga:
– W diagnostyce chorób tarczycy scyntygrafia i usg to
badania wzajemnie się uzupełniające

• Jodochwytność tarczycy
– Wykonuje się celem ustalenia dawki 131-I przy
planowanej terapii 131-I nadczynności tarczycy i
polega na wyliczeniu frakcji 131-I wychwyconego
przez tarczycę w 6 i 24 godz. po doustnym podaniu
dawki diagnostycznej 4 MBq 131-I. Wynik podaje się
w % podanej aktywności izotopu. Średni zakres norm
- po 6 godz - 15-30%, a po 24 godz - 40-55%. Na
terenach gdzie istnieje niedobór jodu jodochwytność
w populacji jest zazwyczaj wyższa.
– Sposób wykonywania:
• kapsułkę diagnostyczną umieszcza się ok. 20 cm od sondy
(lub gamma kamery) i mierzy się radioaktywność przez 2 min.
Bezpośrednio po pomiarze chory połyka kapsułkę
• po 24 godz. (chętniej 6 i 24 godz.) mierzy się u pacjenta
radioaktywność w rzucie szyi w odległości 20 cm od sondy
(gamma kamery) przez 2 minuty.
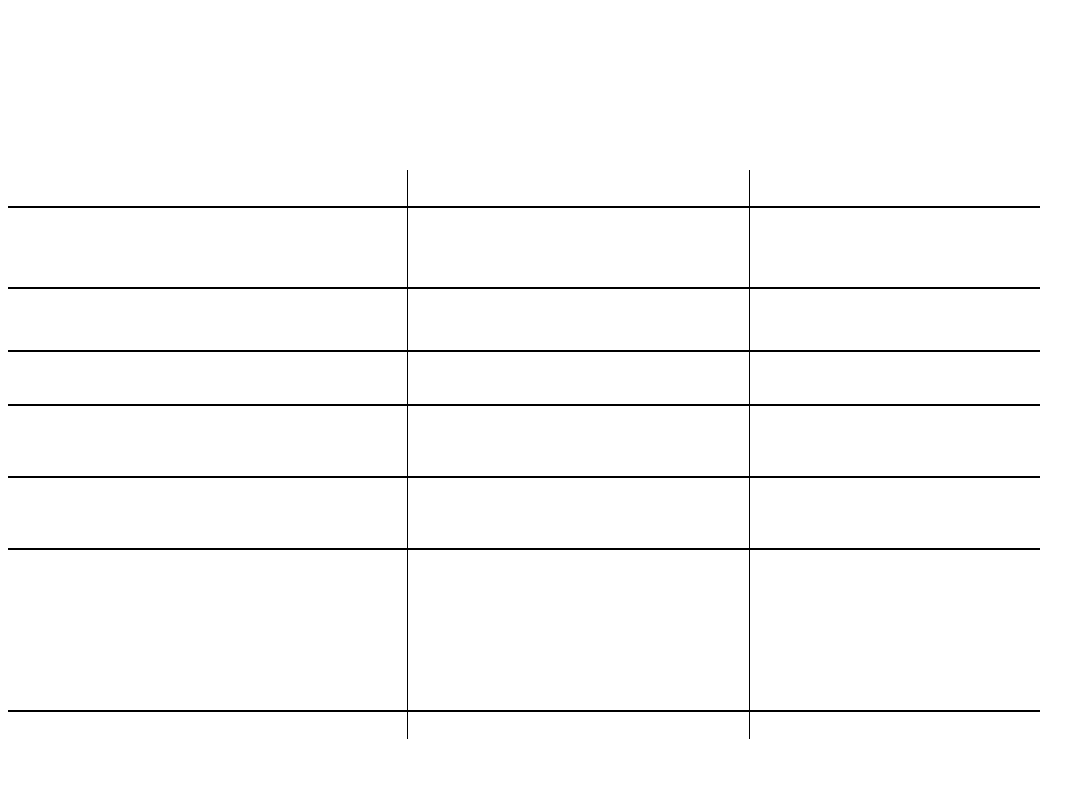
Leki zaburzające
jodochwytność
Typ leku
mechanizm działania
wymagany czas odstawienia
Tyreostatyki
zaburzają procesy jodowania
3-7 dni
(propylotiouracyl, karbimazol)
w tarczycy
Preparaty tarczycy
blokowanie wychwytu
2 (trójjodotyronina) –
4 (tyroksyna) tygodnie
Leki wykrztuśne, witaminy
Wysoka zawartość jodu, 1- 6 miesięcy
blokada kompetycyjna
Leki zawierające jod
kompetycyjna blokada
1- 6 miesięcy
(np. amiodaron)
wychwytu jodu
Środki jodowe stosowane zewnętrznie
kompetycyjne hamowanie 1 – 9 miesięcy
przez blokadę tarczycy
Środki kontrastowe
kompetycyjna blokada
Dożylne
wychwytu jodu
1- 2 miesiące
Doustne
6-9-12 miesięcy
Olejowe – bronchorafia
6-12 miesięcy
Mielografia
2-10 lat
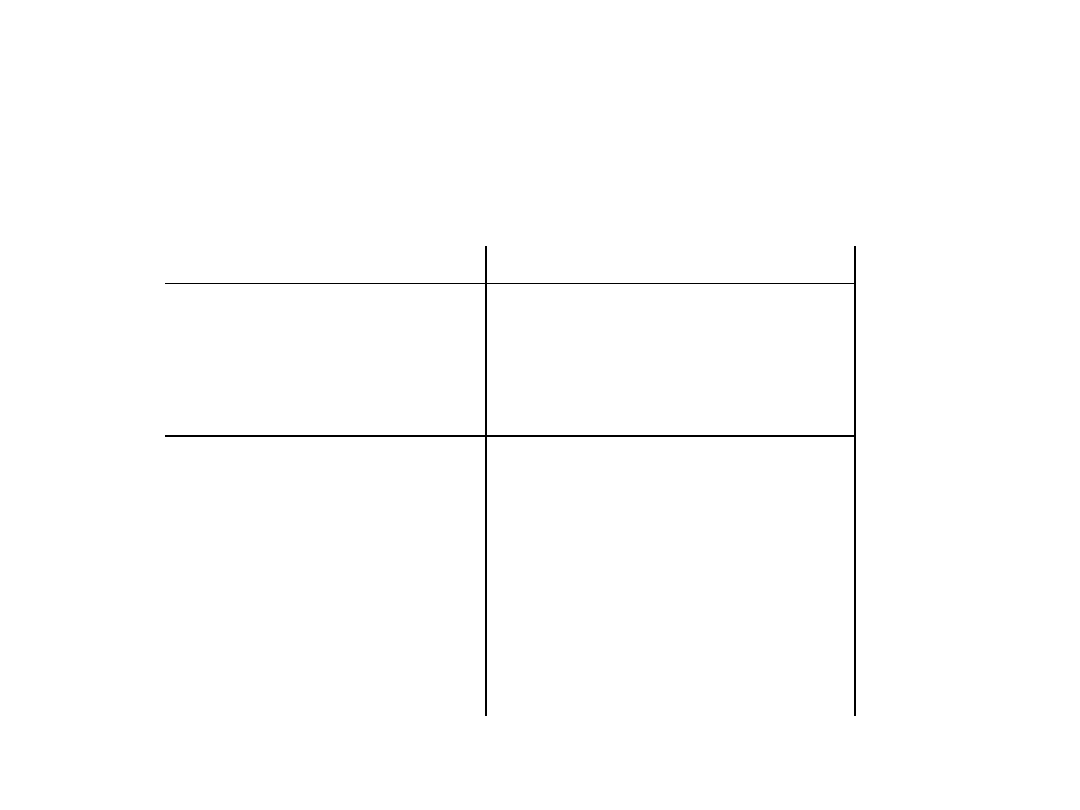
Leki zaburzające
jodochwytność
Typ leku
wymagany czas odstawienia
Fenylobutazon
1 – 2 tygodnie
Salicylany
1 tydzień
Steroidy
1 tydzień
Nitroprusydek sodu
1 tydzień
Beznodiazepiny
4 tygodnie
Inne leki:
Antykoagulanty
1 tydzień
Antyhistaminiki
1 tydzień
Leki przeciwrobacze
1 tydzień
Penicyliny
1 tydzień
Sulfonamidy
1 tydzień
Tolbutamid
1 tydzień
Tiopental
1 tydzień

PRZYTARCZYCE
– Scyntygrafia przytarczyc służy wykrywaniu obecności
gruczolaka przytarczyc. Typowym znacznikiem jest
MIBI znakowany Tc 99m. Kompleks ten wymywany
jest z gruczolaków przytarczyc wolniej niż z dobrze
unaczynionej tarczycy.
– Sposób badania:
• Po podaniu iv MIBI TC 99m i akwizycji po 15min. i 3
godzinach , nie zmieniając pozycji chorego podaje się Tc 99
i po 20 minutach rejestruje się obraz.
• Po 15 min. widoczna jest tarczyca i ew. słabo widoczne są
gruczolaki przytarczyc, po 3 godz. - ukazują się one jako
wyraźne ogniska silniejszego gromadzenia znacznika. Dla
ułatwienia uwidocznienia patologicznie zmienionych
przytarczyc wykonuje się scyntygrafię subtrakcyjną tj
porównanie wysycenia poszczególnych regionów obrazów
zarejestrowanych po podaniu Tc 99m i 99 m Tc - MIBI.

•
Uwaga:
– należy pamiętać o takim dobraniu pola widzenia aby
widoczna była nie tylko okolica tarczycy lecz również
śródpiersia (częsta ektopowa lokalizacja dla przytarczyc).
– projekcje nie tylko przednie i ukośne lecz także SPECT
•
Pierwotna nadczynność przytarczyc:
– Czułość scyntygrafii - 75-100%. W porównaniu z usg:
czułość - 93% vs 68%, swoistość - 93% vs 68%. Rzadko
wyniki fałszywie dodatnie - swoistość badania 95%. Na 5%
składają się:
• gruczolaki tarczycy
• raki sutka
• raki płuc
• raki wywodzące się z tkanek głowy i szyi
– Uwidocznienie się gruczolaka zależy od:
• rozmiarów
• ilorazu wychwytu radioznacznika w obrębie gruczolaka do
wychwytu w tkankach otaczających
• umiejscowienia (trudniej gdy zlokalizowane są w tylnej części
śródpiersia lub gdy są przesłonięte przez kości bądź naczynia

– Uwaga:
• Dla diagnostyki zawsze powinny być wykonane dwa badania
wizualizacyjne w tym na pewno scyntygrafia i usg (o wysokiej
rozdzielczości) lub MRI (gdy istnieje podejrzenie gruczolaków w
śródpiersiu)
– Wtórna nadczynność przytarczyc:
• Wykonywanie scyntygrafii przytarczycy może być niemiarodajne,
czułość zarówno dla usg jak i dla scyntygrafii 50%.
– Uwaga:
• W związku z tym, że wyszkolony chirurg podczas operacji potrafi
ustalić położenie zmienionych patologicznie gruczołów (gruczolak
czy rozrost) dąży się do tego, żeby metody wizualizacyjne
wykonywać u chorych, którzy mają być poddani reoperacji z
powodu nawrotu lub utrzymywania się nadczynności przytarczyc
pomimo przeprowadzonego leczenia chirurgicznego lub u chorych
w złym stanie ogólnym. Wykonywanie badań wizualizacyjnych
przed pierwszą operacją jest wciąż przyjęte i wykonuje się je
z powodu:
– skrócenia czasu operacji
– zmniejszenia rozległości zabiegu
– zmniejszenia prawdopodobieństwa reoperacji

RDZEŃ NADNERCZY
• Scyntygrafia rdzenia nadnerczy wykonywana jest za pomocą MIBG
znakowanej 131 I lub 123 I. MIBG jest fizjologicznym analogiem
noradrenaliny i guanetydyny, gromadzi się w pęcherzykach
chromofilnych, nie jest metabolizowany przez MAO czy COMT.
Mechanizm gromadzenia się w nadnerczach to najprawdopodobniej -
bierna dyfuzja do wnętrza komórki oraz mechanizm związany z
działaniem pompy sodowej. Może być blokowany przez pochodne
rezerpiny i trójcykliczne leki antydepresyjne. Konieczne jest przed
badaniem odstawienie następujących leków: labetalolu, rezerpiny,
trójcyklicznych leków antydepresyjnych, sympatykomimetyków.
Prawidłowo MIBG może gromadzić się w wątrobie i śledzionie (szczyt
po 24 godz.), nerkach (po 24 godz. radioaktywność znad nerek jest
śladowa), śliniankach, sercu, jelitach.
• Sposób badania:
– Obrazuje się po 24 i 48 godz. od podania i.v.
– Obraz scyntygraficzny:
• ocenia się jedynie ogniska wysokiego wychwytu znacznika, które może
występować w:
– hiperplazji rdzenia nadnerczy
– guzie chromochłonnym
– neuroblastoma
– gangliocytoma

OBRAZOWANIE I LECZENIE
Z UŻYCIEM MIBG
– meta-jodobenzylguanidyna
• Analog noradrenaliny znakowany 123 lub
131 – I stosowany jest do obrazowania
guzów pochodzenia neuroektodermalnego:
– Neuroblastoma
– Pheochromocytoma
– Paraganglioma
– Rak rdzeniasty tarczycy
– Karcinoidy
• oraz przerzuty tych guzów wychwytujące MIBG

• Po podaniu dożylnym 131-I MIBG wybiórczo
gromadzi się w guzach pochodzących z
tkanki neuroektodrmalnej
• Wychwyt – to transport bierny i aktywny
• 123- I w porównaniu do 131 –I
– Wyższa dawka (do 5 x)
– Szybciej możliwa wizualizacja (1-2 dni vs 2-3 dni)
– Lepsza jakość obrazów
– Droższa terapia

MIBG jest wychwytywany fizjologicznie
również przez:
– wątrobę,
– śledzionę
– mięsień sercowy (szczególnie wysoki wychwyt u
dzieci <1 roku życia)
– ślinianki
– prawidłowe nadnercza
• A także:
– mięśnie szkieletowe
– śluzówkę nosa
– płuca
– układ moczowy
– jelita
– pęcherz moczowy
– tarczycę
– Wychwyt ten odzwierciedla bogate unerwienie adrenergiczne
lub/i wydzielanie katecholamin

• Brak wychwytu MIBG
– Kościec
• Kończyny na scyntygrafii powinny wykazywać niewielką
aktywność związaną z mięśniami, kości winny być widoczne jako
obszary fotopeniczne
• Wychwyt MIBG w tkankach miękkich:
– Guzy pierwotne
– Przerzuty:
• Węzły chłonne
• Wątroba
• Kości
• Szpik kostny
• Intensywność wychwytu podobna w przypadku
łagodnych i złośliwych guzów (także dojrzałość
guzów nie ma znaczenia)
• Zwiększenie wychwytu w kościach może być
związane z przerzutami w kości lub/i infiltracji
szpiku

Wyniki fałszywie ujemne
• Przyczyny anatomiczne:
– Guzy leżące blisko tkanek miękkich
fizjologicznie gromadzących MIBG
– Brak wychwytu albo niski wychwyt w
guzie
z wysoką heterogenicznością,
martwicą, mała objętość guza, brak
wychwytu z powodu stosowania leków

KORA NADNERCZY
• Uwaga:
– badania kory nadnerczy wykonywane są
obecnie rzadko z powodu:
– wykorzystania dokładniejszych metod
wizualizacyjnych (TK, MRI)
– wysokiego narażenia pacjenta na promieniowanie
– Wskazaniami do wykonania scyntygrafii
kory nadnerczy były/są zespół Cushinga i
pierwotny hiperaldosteronizm.
Scyntygrafia wykonywana jest za pomocą:
pochodnych cholesterolu znakowanych 131
I (jodo - metyl - norcholesterol). Związki te
wychwytywane są przez wątrobę i
nadnercza.

• Zespół Cushinga:
– Sposób badania
• Obrazuje się po 7 dniach od podania iv (wcześniej
może być obecna aktywność znad wątroby)
• Objawy scyntygraficzne:
– jednostronne uwidocznienie się nadnercza lub
asymetria:
» gruczolak
» rak wysoko zróżnicowany
» przerzut do nadnercza
» stan po operacyjnym usunięciu nadnercza
– obustronne gromadzenie
» obustronny przerost kory
– brak gromadzenia radiofarmacutyku
» rak nadnercza
» leczenie kortykosteroidami
» hiperlipidemia

Hiperaldosteronizm
pierwotny:
• Sposób badania:
– Badanie wykonuje się po zahamowaniu
wychwytu radioznacznika przez prawidłową
tkankę nadnerczy (deksametazon 3 razy
dziennie 2 mg 2 dni przed i 7 dni po podaniu
radioznacznika). Akwizycje przeprowadza się
do 5 dnia po iniekcji i.v. radioznacznika.
– uwidocznienie się nadnerczy do 5 dnia
• obustronne - hiperplazja idiopatyczna
• jednostronne - gruczolak
– uwidocznienie się nadnerczy powyżej 5 dnia
• gruczolakowaty przerost warstwy kłębkowatej
kory nadnerczy

Wyspiaki trzustki
– W guzach hormonalnie czynnych (np. insulinoma,
carcinoid, gastrinoma, glucagonoma, niektóre
gruczolaki przysadki (nie - produkujące prolaktynę
i ACTH), rak rdzeniasty tarczycy) występują
receptory somatostatyny. Uwidocznienie takich
guzów jest możliwe przy zastosowaniu analogu
somatostatyny. Ponieważ okres półtrwania
naturalnej somatostatyny jest krótki (3 minuty),
opracowano ośmio - aminokwasowy analog
somatostatyny - oktreotyd, który stosuje się w
kompleksie z DTPA znakowanym 111 In. Badanie
to w diagnostyce rakowiaka posiada bardzo wysoką
czułość - 90 % (TK - 50%).
– Sposób badania:
• Akwizycję przeprowadza się po 24 i 48 godz. od
podania iv

Blokowanie tarczycy przy
wykonywaniu innych
badań
– W związku ze stosowaniem izotopów technetu i
jodu, pierwiastków gromadzących się m.in. w
tarczycy, gruczołach ślinowych, splocie
naczyniówkowym komór mózgu, błonie
śluzowej żołądka pojawił się problem czy
blokować ww struktury w przypadku
wykonywania scyntygrafii innych narządów.
Blokowanie ma na celu
• uzyskanie wyższej jakości wyników badań,
• uzyskanie rzetelnej informacji o czynności
danego narządu
• ochronę przed napromieniowaniem narządów nie
podlegających badaniu.

Blokowanie tarczycy przy
wykonywaniu innych
badań
• Proponowane preparaty do blokowania:
– płyn Lugola - metoda tania, stosowana od dawna. 1
kropla = 7-8 mg jodu, p.o., 1dzień przed badaniem 3x3
krople, a w dniu badania - 3 krople przed wstrzyknięciem
lub podaniem p.o. Blokowanie tarczycy utrzymuje się
dłużej niż 72 godziny.
– nadchloran potasowy - metoda nowsza, nieco droższa,
p.o., (krople) 6 mg / kg masy ciała 30-40 minut przed
podaniem radiofarmaceutyku i.v. lub p.o. Blokowanie
tarczycy trwa krócej niż 72 godziny.
• Blokowanie tarczycy należy bezwzględnie wykonać
przed scyntygrafią rdzenia i kory nadnerczy.

Blokowanie tarczycy
• Wychwyt wolnego jodu przez tarczycę jest
blokowany poprzez zastosowanie doustnego
podania jodku potasu (170 mg) 24 godz.
przed planowaną terapią MIBG - 131-I i
do 10 dni po terapii
• Dzieci na dzień przed, dzień terapii i dzień
po:
– Noworodki 16 mg KJ dziennie
– Od 1m-ca - 3 lat
32 mg KJ dziennie
– Od 3-13 lat 56 mg KJ dziennie
– > 13 lat
130 mg KJ dziennie

Leczenie 131-I
łagodnych chorób tarczycy
• tyreotoksykoza,
hipertyreoza
skąpoobjawowa i
utajona
– choroba Gravesa
– wole wieloguzkowe
– ognisko autonomiczne
• eutyreoza
– wole rozlane
– wole wieloguzkowe
• bezwzględne
– ciąża
– okres karmienia piersią
• względne
– młody wiek
– duże wole
– orbitopatia
WSKAZANIA
WSKAZANIA
PRZECIWWSKAZANIA
PRZECIWWSKAZANIA

• Jod
– Jedyny znany izotop trwały – A = 127
– 20 sztucznych izotopów – od A =117-140
– Praktyczne znaczenie – I – 125, 131, 132
– Sposób otrzymywania
• mieszanina produktów rozszczepienia uranu i
plutonu
• akceleratory
• 123 - I
– emituje promieniowanie gamma
– nie emituje promieniowania beta
• 124 - I
– emituje beta plus
• 125 - I
– emituje promieniowanie gamma

•
131
I
– promieniowanie – fotony o energii 364 keV
– promieniowanie– elektrony o energii 606 keV
– fizyczny czas półtrwania 8,02 dnia
• W tarczycy – ok. 5-10 tygodni
- promieniowanie
- wolne rodniki – uszkodzenie DNA - śmierć komórki albo utrata wzrostu i podziału -
obliteracja błony wewnętrznej naczyń krwionośnych – atrofia narządu
- Otrzymywanie – napromienienie prętów uranowych w reaktorach
- Zastosowanie: w medycynie, nauce i przemyśle
- Badanie ekologiczne obiegu jodu i innych substancji znakowanej jodem
promieniotwórczym w przyrodzie (cykle pokarmowe organizmów żywych)
- Znacznik przebiegu procesów technologicznych, w przemyśle fotochemicznym,
spożywczym i farmaceutycznym

Biodystrybucja
• w organizmie człowieka jest 30-40 g
jodu,
– z tego 15-17 g w tarczycy
– dobowe zapotrzebowanie na jod - 50-200 g
(1-4 mikrog/kg ciała)
– spożycie < 10 g dziennie - zaburzenie
funkcji tarczycy

Biodystrybucja
• Wchłaniany szybko w górnym
odcinku przewodu pokarmowego
(90% w ciągu 60 minut)
• Ze krwi jest transportowany do
tarczycy
• W nerkach jest akumulowany

Leczenie nadczynności tarczycy
131-I
-
czy przygotować tyreostatykami ?
• ZA
-
możliwość
zaostrzenia
hipertyreozy po
131-I
• PRZECIW
– zmniejszenie skuteczności
131-I
– brak „przełomów”
– brak pogorszenia stanu
kardiologicznego
– odstawienie tyreostatyków
przyczyną wzrostu
poziomu HT
we krwi
Włączenie tyreostatyków przed
po podaniu I 131
- I-131 –
96% wyleczeń
- włączenie do 5-
7 dni po podaniu 131-I
- I-131 + M – 83 %
Metizolu zmniejsza
skuteczność
- I-131 + PP – 77%
- I-131 + C – 49%
- lit w przypadku bardzo
dużego wola,
- beta blokery

- po podaniu 131-I
15 - 35 %
- w trakcie leczenia tyreostatykami
10 - 15 %
- po tyreoidektomii subtotalnej
11 - 16 %
- po tyreoidektomii totalnej
0 - 6 %
pacjentów
Tallstedt 1994, Bartalena 1998, Pinchera 2000
- UWAGA –
- SN, wysokie ATPO, niski TRAK + podanie 131- I –
oftalmopatia !!
Progresja orbitopatii
a leczenie choroby Gravesa
• czas leczenia
– rozpoczęcie 0 - 21 dni po RJ
– zakończenie ?
• dawki wstępne: 0,4 - 0,5 mg / kg mc
Glikokortykoidy

-
wielkość dawki zależy od przepisów obowiązujących w danym Państwie
do 185 MBq (5 mCi) Holandia, Austria, Szwajcaria
do 370 MBq (10 mCi) Anglia
do 1110 MBq (30 mCi) USA
• dawki stałe
– 111-185 MBq (3 - 5 mCi)
dawka Ci/g tkanki
– dawka lecznicza = Ci/g tkanki x m x 100/ U
24
• dawka pochłonięta
• dawka pochłonięta - modyfikacja
M Bq =
D x m x 25
T
eff
x U
24
Ch. Gravesa – 80 - 150
mikroCi/g
Wole wieloguzkowe – 100-
150 mikroC/g
Ognisko – 150 mikroCi/g
mCi =
m x 10
U
24
Obliczanie dawki 131-I

Wyższe dawki stosujemy:
• U dzieci
• U mężczyzn
• Przy drugiej dawce
• Po przygotowywaniu pacjenta
tyreostatykami

Skuteczność leczenia
• ZALEŻY OD DAWKI POCHŁONIĘTEJ
– masa tarczycy
– jodochwytność
– obrót jodu w tarczycy
– promienioczułość
•
ZALEŻY OD DOSTĘPNOŚCI 131-I

Wskazania dla pacjenta przed i po
podaniu 131-I
• wykluczyć ciążę !
– po podaniu 131-I
• nie zachodzić w ciążę 3 - 6 miesięcy,
• mężczyźni nie starać się o potomstwo do 4 miesięcy
– karmienie piersią:
– Tc 99m – 12 godz.
– 123 - I – 2 dni
– 131-I – 3 tygodnie
• przed - 4 godziny na czczo,
po - 2 godziny nic nie jeść i nie pić

Wskazania dla pacjenta przed i po
podaniu 131-I
• unikać bliskich kontaktów
– nie karmić piersią
– troszczyć się o higienę osobistą (pot)
– pić duże ilości płynów
– nie przygotowywać samodzielnie
posiłków
– uwaga
• pamiętać o zaświadczeniu lekarskim przy
przekraczaniu granic Państwa

Monitorowanie pacjenta po
podaniu 131-I
• Wizyty u lekarza
– po 3 - 4 tygodniach, następne wg zaleceń
endokrynologa
• Badania
– po 3 - 4 tygodniach ocena czynności tarczycy
– po 3 - 4 miesiącach usg tarczycy
• Leczenie farmakologiczne
– tyreostatyki i LT 4 - zależnie od stanu pacjenta i funkcji
tarczycy (unikać bezpośrednio po podaniu 131-I
)
• Ewentualna następna dawka 131-I
– po około 6 miesiącach

NASTĘPSTWA LECZENIA 131-I
• WCZESNE
– podwyższenie stężenia HT
– przełom tarczycowy ?
– popromienne zapalenie tarczycy
– wymioty, nudności, jadłowstręt
• PÓŹNE
– nasilenie orbitopatii
– zapalenie ślinianek
– niedoczynność tarczycy
• NIEDOCZYNNOŚĆ TARCZYCY JEST
OCZEKIWANYM NASTĘPSTWEM
LECZENIA 131-I

Niedoczynność tarczycy po leczeniu
131-I
• wczesna
• późna
• KUMULUJE SIĘ
– po roku od podania 131-I
• hipotyreoza - 7 - 47,4 %
• wzrost od 2 - 5 roku o 4,8 %
• wzrost od 6 roku o 1 %
» Clarke 1991, Aizawa 1997,
Tarintharan 1997

KANCERO - i TERATOGENNOŚĆ
131-I
• brak wpływu na częstość występowania raków
tarczycy
– po 131-I - 0,15% (jak w całej populacji)
» Angusti 2000
• białaczki -
– bardzo rzadko, częściej po podaniu 131-I w
leczeniu raka tarczycy (800mCi - 1Ci)
» Laurenti 1998
• brak dowodów na zwiększenie częstości
występowania wad płodu
• zwiększona śmiertelność po podaniu 131-I (RR –
1,47) związana jest z objawami wcześniej trwającej
nadczynności, a nie bezpośrednio z leczeniem 131-I

WADY I ZALETY
• stosunkowo późno
stabilna eutyreoza
• zwiększenie
częstości
orbitopatii
• skuteczny i
bezpieczny
• komfort leczenia
• dobry efekt
• rzadkie nawroty
• niski koszt 131-I
• możliwość leczenia
chorych w złym
stanie ogólnym

Rak tarczycy

Rak tarczycy
- scyntygrafia całego ciała
(przerzuty)
- leczenie 131-I
• Nie:
– anaplastyczny, rdzeniasty, chłoniak, mięsak
• Tak:
– pęcherzykowaty i brodawkowaty (przerzuty)
• Kiedy:
– Po operacji
• Dawka:
– 60-150mCi
• Scyntygrafia tarczycy – 50 microCi

Paliatywne leczenie bólu
u pacjentów z przerzutami
do kości

Leczenie bólu związanego z
przerzutami:
• NLPZ
• narkotyki
• hormonoterapia
• chemioterapia
• naświetlanie zewnętrzne lokalne
• naświetlanie zewnętrzne połowy ciała
• terapia izotopowa (po raz pierwszy -
1941 r)

• Scyntygraficzne objawy obecności przerzutu
• podwyższone gromadzenie znacznika
• "superscan" - bardzo wysokie gromadzenie
znacznika w całym układzie kostnych, brak tła
(brak cienia nerek), typowe dla bardzo
zaawansowanych postaci przerzutowych (uwaga -
podobnie przy nadczynności przytarczyc)
• pojedyncze ognisko wzmożonego gromadzenia
radiofarmaceutyku - w 15-21% - zmiana
przerzutowa

idealny radiofarmaceutyk w
leczeniu paliatywnym
przerzutów do kości
• dawka pochłonięta przez przerzut wysoka
w porównaniu do tkanek zdrowych np
szpiku
• szybkie usuwanie z tkanek miękkich i
zdrowych kości
• niski koszt i łatwy proces produkcji
• łatwy w stosowaniu
• łatwy w transporcie
• energia max > 0.8 MeV i < 2.0 MeV

• Przeciwwskazania do leczenia izotopami:
– bezwzględne:
– ciąża i okres karmienia
• Względne:
– rozpoznane złamanie patologiczne
– ucisk na rdzeń kręgowy
– leukopenia poniżej 3000
– trombocytopenia < 60 000
– niewydolność nerek
– zupełny brak kontroli nad mikcją
– obecność przerzutów w wątrobie

Paliatywne leczenie bólu
• wskazania:
–
dolegliwości bóle spowodowane przerzutami do kośćca
w przebiegu nowotworów złośliwych: rak prostaty,
rak sutka, rak płuc, rak nerek, potwierdzone
scyntygraficznie i dające na scyntygramie obraz ognisk
"gorących" szczególnie u pacjentów, u których
dotychczasowe leczenie przeciwbólowe nie jest
wystarczająco skuteczne lub występuje zagrożenie
ucisku na rdzeń kręgowy i złamaniami patologicznymi
• w 50% przypadków powyższych nowotworów
mamy do czynienia z przerzutami do układu
kostnego

Paliatywne leczenie
przerzutów nowotworowych
do kości
• Kiedy:
– rozważenie włączenia środków
narkotycznych
– 3 - 4 tyg po zakończeniu radioterapii
• Podawanie:
– i.v.
– Możliwość > bólu w 2-3 dobie i < po 20
dniach
– Redukcja bólu do 60-80%
– Kolejna dawka > 3 m-cy

• Kwalifikacja:
– onkolog - urolog - chirurg - lekarz opieki paliatywnej
– pacjent z prognozowanym okresem przeżycia > 3 miesiące
– równolegle lekami przeciwbólowymi
• Kiedy:
– moment rozpoczęcia leczenia radioizotopami - konieczność przejścia na
środki narkotyczne
– 3-4 tygodnie po zakończeniu radioterapii
– 3-4 tygodnie po zakończeniu chemioterapii
• Jakie przerzuty:
– rodzaj przerzutu (osteoblastyczny)
– intensywność ognisk (im intensywniejsze, mniejsze ognisko, wiele ognisk)

• przed włączeniem leczenia:
– morfologia
– mocznik, kreatynina - (maksymalnie 2 tygodnie wcześniej)
– stężenie wapnia
– transaminazy
– fosfataza zasadowa
– scyntygrafia kośćca - (maksymalnie 4 tygodnie wcześniej)
– RTG kręgosłupa i/lub konsultacja neurologa
– należy wykluczyć ciążę

• INFORMACJA DLA PACJENTÓW:
– możliwość nasilenia się bólów
• 2-3 dzień po podaniu - do maksymalnie 20 dnia
– redukcja bólu - 60-80%, zniesienie bólu - 30%
– konieczne prowadzenie dzienniczka samooceny bólu
– przez tydzień - kontakt z wydalinami chorego - stosowanie rękawiczek
1 razowych
– pisemna informacja –
• o braku toksyczności dla rodziny,
• o możliwości podjęcia każdej pracy,
• o braku interakcji z lekami,
• o braku wpływu na wartości wyników badań dodatkowych

• kontrola leczenia:
– co 2 tygodnie przez 2 miesiące kontrole
lekarskie (z morfologią)
– po 3 miesiącach - kontrola bólu
• kolejna dawka:
– nie wcześniej niż 3 miesiące
– kwalifikacja taka sama
– niepowodzenie po 1 dawce możliwe, efekt
czasami dopiero po 2 dawce

• w 1939-45 - zaobserwowano zwiększoną retencję P w chorobach
hematologicznych, potem także w przerzutach
• w 1946 r. opublikowano zastosowanie 32P u 155 osób
• jedynie czerwienica prawdziwa - leczona 32P
• bardzo szybkie zmniejszenie dolegliwości bólowych (po 3-4 dniach) trwa do 6
miesięcy
• 67-82% odpowiedzi przy podanej aktywności i.v. 3-24 mCi w dawkach
podzielonych
• gromadzenie nie tylko w guzie lecz także w onerwiu nerwów unerwiających
okostną
• androgeny powodują o 5-20% wzrost gromadzenia związków fosforanowych w
kościach (próby podawania P32 z androgenami, lub po nagłym odstawieniu PTH)
• objaw uboczny :
– zahamowanie produkcji szpiku
• praktycznie stosujemy tylko w przerzutach nowotworu prostaty
fosfor 32

fosfor 32
• emisja promieniowania beta, energia max -1.17 MeV,
okres półtrwania - 14.3 dnia
• podawany jako ortofosforan
• biodystrybucja - cały organizm
• ma wpływ na funkcję nerwowomięśniową ,
hematopoezę, metabolizm kości
• 85% fosforu w organizmie to fosfor w kościach
• wiąże się jako P organiczny z macierzą
hydroksyapatytu i powoli ulega przemianom
• w tkankach miękkich i szpiku znajduje się wewnątrz
komórek (jądro, cytoplazma)
• wydalanie przez nerki
• nie ma bezpośredniej metody mierzącej wychwyt przez
przerzuty

Stront
Sr 89 (wodny roztwór chlorku strontu)
– analog wapnia
– pierwiastek otrzymywany w reaktorze
– T1/2 - 50.5 dnia (uwaga w kości zdrowej - 14 dni)
– promieniowanie beta - 0.8 cm
• UWAGA: leczenie to jest skuteczne przy przerzutach
osteoblastycznych - tj – rak prostaty, żołądka, mniej skuteczne
- gruczoł piersiowy, płuca, nerki, przełyk, trzustka, wątroba,
czerniak złośliwy, jelito grube
• UWAGA
– nie należy przyjmować wapnia, kalcytoniny i bisfosfonianów

stront 89
• emisja promieniowania beta, energia max -1.46 MeV,
• wydala się przez nerki
• wbudowuje się w macierz nieorganiczną szczególnie w miejsca przebudowy
metastatycznej, szczególnie w miejscach gdzie są osteoblasty
• dystrybucja strontu i 99mTc-MDP - taka sama
• pochłanianie szpik:przerzut = 1:10
• 1 raz zastosowanie w 1942 r.u pacjenta z rakiem prostaty
• 51-81% odpowiedzi na leczenie (w zależności od dawki)
• zmniejsza ból, podnosi jakość życia, wydłuża czas pojawienia się nowych
przerzutów
• obniża się PSA
• odpowiedź po 2 tygodniach i trwa 3-6 miesięcy
• 1/3 pacjentów - bez bólu
• trombocytopenia łagodna
– < 2% pacjentów ma < 50 tys. płytek
• leczenie strontem u osób bardzo cierpiących

• emisja promieniowania beta (1,7 mm), energia max -0.81 MeV,
• emisja promieniowania gamma, energia max - 103 keV (diagnostyka)
• pierwiastek reaktorowy
• sól sodowa radioaktywnego samaru z pochodną kwasu fosfonowego =
kompleks stabilny
• T1/2 - 46.3 godz
• wydala się przez nerki
• gromadzi się 5 x silniej w zmianie przerzutowej niż w zdrowej kości i 6
x silniej niż w tkance miękkiej (po 3 godzinach 2% tkankach miękkich)
• wyższa dawka - bardziej skuteczna (1mCi/kg a nie 0.5 mCi/kg)
• skuteczny też w nowotworach sutka, można podawać do 4 razy
• wychwyt w przerzutach, uszkodzeniach kości
• mielotosyczność zależy od dawki
– od przejściowej trombocytopenii do śmiertelnej
samar 153

ren 186
• Rn + etidronian
• emisja promieniowania beta, energia max -1.07 MeV,
• emisja promieniowania gamma
– Ale bardzo niska energia - brak możliwości obrazowania
• zwiększony wychwyt i zatrzymywanie w kościach
• po 96 godz. iv - 15% w kościach
• 43% wydalone z moczem
• 80% odpowiedzi po 2 tygodniach
• dawka 33 mCi
• w raku piersi i prostaty
• większa dawka powoduje trombocytopenię

•
70-90% przerzutów odpowiada na terapię
izotopową
•
stosowanie łącznie radioterapii i terapii
izotopowej zwiększa odpowiedź
•
najbardziej poznany - Sr
•
Warunki podania:
•
Sm Rn - hospitalizacja 24 godz (1 noc w szpitalu)
•
Sr P - nie wymagają hospitalizacji

• POWIKŁANIA
• mielotoksyczność izotopu
• leukocyty - trombocyty
• O >4 tys,
150-400 tys
• I 3.0-3.9 tys
71-150 tys
• II 2.0-2.9 tys
50-70.9 tys
• III 1.0-1.9 tys
25-49.9 tys
• IV <1.0 tys <25 tys

• mielotoksyczność
• promieniowanie oddziałujące na
szpik kostny
– szpik kostny – niewielkie
– pogranicze kości i jamy szpikowej
– tkanka kostna
– inne tkanki sąsiadujące

I i II o
III i IV o
czas trwania
szczyt występowania
fosfor 32
37-43 %
12-37%
8-24 tyg
4 tydzień
stront 89
12-20 %
5%
4-12 tyg
4-6 tyg
samar 153 88 %
3-8 %
3-8 tyg
3-4
tyg

• ZJAWISKO "FLARE"
– przejściowe, przemijające wzmożenie dolegliwości bólowych,
występujące bezpośrednio po podaniu radioizotopu.
– przyczyny:
• reakcja zapalna ? zwiększanie ciśnienia wewnątrz ogniska
przerzutowego
– częstość
• fosfor 32
13 %
• stront 89
23%
• samar 153 7.5-11 %
• DIC
- rozsiane wykrzepianie wewnątrznaczyniowe
• nefrotoksyczność:
– leczenie radioizotopami jest przeciwwskazane przy
niewydolności nerek i wodonerczu

Leczenie z użyciem 131-
MIBG

Leczenie 131 – I
meta-
jodobenzylguanidyną
• Wskazania:
– Guzy wychwytujące 131-I MIBG
• Nieoperacyjne lub złośliwe przypadki
– Pheochromocytoma
– Paraganglioma
– Rakowiaki
– Rak rdzeniasty tarczycy
– III lub IV stopień neuroblastoma

Przeciwwskazania do
terapii
• Bezwzględne
– Ciąża
– Karmienie piersią
– Przewidywany okres przeżycia < 1 m-c
– Mielosupresja:
• Hb < 9 g%
• Leukocytoza < 4 tys.
• Płytki < 100 tys.
– Szybko postępujące upośledzenie funkcji nerek < 30 ml/min
• Względne
– Ryzyko medyczne wynikające z izolacji po podaniu
radiofarmaceutyku
– Nietrzymanie moczu

Przygotowanie pacjenta
• Potwierdzenie obecności nieoperacyjnego
guza neuroendokrynnego poprzez
wykazanie go w scyntygrafii z 131-I
MIBG, TK lub MRI oraz przy użyciu
badań biochemicznych
• Odstawienie przed planowanym
leczeniem na ok. 1-2 tygodnie leków
konkurujących w wychwycie lub
gromadzeniu 131-I MIBG

• Leki konkurujące
– Labetalol
– Rezerpina
– Blokery kanału
wapniowego
• werapamil
– Trójcykliczne
antydepresyjne
• Amitryptylina
• Imipramina
– Sympatykomimetyki
• Efedryna
– Kokaina
• Leki konkurujące
(potencjalnie)
– Blokery adrenergiczne
• Bretylium
• Guanetydyna
– Sympatykomimetyki
• Amfetamina
• Dopamina
• Izoprenalina
• terbutalina
– Fenotiazyny
• Chlorpromazyna
• Prometazyna
– Butyrofenony
• Droperidol
• haloperidol
– Tioxantyny

Blokowanie tarczycy
• Wychwyt wolnego jodu przez tarczycę jest
blokowany poprzez zastosowanie doustnego
podania jodku potasu (170 mg) 24 godz. przed
planowaną terapią MIBG i do 10 dni po terapii
• Dzieci na dzień przed, dzień terapii i dzień po:
–
Noworodki 16 mg KJ dziennie
–
Od 1m-ca - 3 lat
32 mg KJ dziennie
–
Od 3-13 lat 56 mg KJ dziennie
–
> 13 lat
130 mg KJ dziennie

Leczenie 131-I MIBG
• Podanie dożylne
• Wskazane podanie profilaktyczne leków
przeciwwymiotnych (w dniu podania oraz do
72 godz. po leczeniu)
• Dawka podana – 100-300 mCi
– Niższa – u pacjentów z upośledzoną funkcją nerek
– Mielosupresją
• Następna dawka 131-I MIBG w zależności od
ilości płytek krwi
– U dzieci - nie wcześniej niż po 4 tygodniach
– U dorosłych – nie wcześniej niż po 6 tygodniach

Po leczeniu
• Bezpośrednio po podaniu – pić duże ilości
płynów
• Do 3-4 dni po zabiegu powinno się
utrzymywać cewnik u pacjentów z
nietrzymaniem moczu i możliwie często
opróżniać zbiornik
• Do 5 dni po leczeniu możliwe wydalanie
radiofarmaceutyku z moczem
• Przez 4 miesiące po podaniu leku– nie
zachodzić w ciążę

Objawy uboczne
• Wczesne:
– Okresowe nudności i wymioty mogą się pojawić
podczas pierwszych 2 dni po leczeniu
– Przejściowa mielosupresja pojawia się 4-6 tygodni po
leczeniu
• Częściej występują u dzieci z neuroblastomą po chemioterapii
jako izolowana trombocytopenia
– Upośledzenie funkcji nerek (szczególnie u pacjentów
wcześniej leczonych cisplatyną lub ifosfamidem)
– Rzadko u pacjentów dorosłych z pheochromocytomą lub
paragangliomą, a u dzieci z neuroblastomą pojawia się
kryza nadciśnieniowa wywołana przez wyrzut
katecholamin wymagająca leczenia alfa-blokerami
– U pacjentów z rakowiakiem mogą pojawić się uderzenia
gorąca (wyrzut serotoniny)

Objawy uboczne
• Późne:
– Niedoczynność tarczycy (po
niewystarczającej blokadzie tarczycy)
– Trwała trombocytopenia,
mielosupresja
– Białaczki (do tej pory nigdy nie
zaobserwowano lecz nie można
wykluczyć)

Po leczeniu dziecka
• Po leczeniu dziecka dorosły pozostaje z nim w
izolacji. Powinien zachować odstęp tak daleki
jak to tylko możliwe, unikać spożywania
pokarmów i picia płynów w pokoju
• Ewentualne narażenie na zewnętrzne
promieniowanie winno być monitorowane
stale przez indywidualną dozymetrię a
wewnętrzne poprzez pomiary próbki moczu w
liczniku gamma

Leczenie z użyciem
fosforu 32

Leczenie 32 P
• Leczenie opornych na standardową terapię
(upusty krwi, chemioterapia) zespołów
mieloproliferacyjnych
– Czerwienica prawdziwa
– Samoistna nadpłytkowość
• Terapia sugerowana u pacjentów > 70 roku
życia

Przeciwwskazania
• Bezwzględne
:
– Ciąża,
– Karmienie piersią
• Względne
:
– Terapia nie polecana dla kobiet w wieku reprodukcyjnym
– Dla czerwienicy
• Leukocytoza - < 2tys
• Szybko pogarszająca się funkcja nerek
– Dla nadpłytkowość
• Leukocytoza - < 2tys
• Hemoglobina - < 9 g%
• Szybko pogarszająca się funkcja nerek

Terapia
• Przygotowanie
:
– Pacjenci z czerwienicą powinni być po
upustach krwi tak aby hematokryt
zawierał się między 42-47%,
chemioterapia powinna zakończyć się
w ciągu 1 tygodnia po podaniu 32 P
• Podanie dożylne ortofosforanu
fosforu:
– Maksymalna aktywność – 7 mCi

• 32 P
– Pierwiastek generatorowy
– Emitujący jedynie promieniowanie
beta
– Okres półtrwania – 14,3 dni
– Długość promieniowania w tkankach
3-8 mm

Objawy uboczne
• Wczesne
:
– Leukopenia, trombocytopenia
• Późne
:
– Czerwienica związana jest ze
zwiększonym występowaniem
białaczki, częstość wzrasta po
stosowaniu 32 P (2-15% w ciągu 10 lat
– jest podobna jak po chemioterapii)

Radiosynowektomia

Radiosynowektomia
• Podanie dostawowe pierwiastków
promieniotwórczych w celu leczenia przeciwbólowego
w przypadkach opornych na typową terapię
– Reumatoidalne zapalenie stawów
– Choroby stawów charakteryzujące się zapaleniem maziówki,
jej pogrubieniem lub wysiękiem
– Zmiany stawowe w przebiegu hemofilii
– Choroba Behcet’a
• Stosowane pierwiastki
– 90 Y - cytrynian
– 186 Re – siarczek
– 169 Er – cytrynian

Przeciwwskazania
• Bezwzględne
–
Ciąża
–
Karmienie piersią
–
Lokalna infekcja w okolicy stawu
–
Pęknięta cysta Backera
• Względne
–
U osób <20 roku życia stosować tylko wtedy gdy
efekty lecznicze przewyższą potencjalne ryzyko
–
Znaczna niestabilność stawu z destrukcją kości
–
Znaczące uszkodzenie chrząstki wewnątrz stawu

Wskazania
• Kiedy nieskuteczna okaże się terapia
dostawowa glikokortykosteroidami
długodziałającymi
• Kiedy ból utrudnia w znaczący
sposób lub uniemożliwia codzienną
aktywność lub wymaga stałego
przyjmowania leków
przeciwbólowych

Badania dodatkowe
• Wymagane:
– Rtg stawów
• Dodatkowe:
– Scyntygrafia (np. 3 fazowa kości)
– Usg – w celu oceny struktury stawu,
wykluczenia pękniętej cyty Backera
– MRI

Kiedy stosować
• Po artroskopii lub operacji
– 2 - 6 tygodni
• Po punkcji stawu
– 2 tygodnie
• Następna radiosynowektomia
– po 6 miesiącach (jeśli wykonane 2 nie
przynoszą skutku – nie powtarzać)

Informacje dla pacjenta
• 60-80% pacjentów odpowiada na leczenie
• Poprawa następuje od 14 – do 28 dni po zabiegu
• Możliwe krótkotrwałe pogorszenie objawów
związanych z zapaleniem błony maziowej po zabiegu
• Brak możliwości poprawy w innych stawach niż
poddanych synowektomii (chyba, że stosowane są
również glikokortykosteroidy)
• Możliwe powikłania:
– Ryzyko związane z punkcją stawu: miejscowe wylewy,
infekcje
– Teoretyczne ryzyko związane z ekspozycją na
promieniowanie (nekroza, karcinogenność – rzadko)
– Gorączka, alergia

Informacje dla pacjenta – po
zabiegu
• 48 godz. po zabiegu – unieruchomienie
• Do 3-4 dni po zabiegu powinno się
utrzymywać cewnik u pacjentów z
nietrzymaniem moczu i możliwie często
opróżniać zbiornik
• Do 1 tygodnia po zabiegu – możliwość
wydalania radiofarmaceutyku z moczem
• Do 4 miesięcy po zabiegu – unikanie
zajścia w ciążę

• 90 Y (długość promieni – 3,6 mm)
– Tylko stawy kolanowe, aktywność 5-6 mCi
• 186 Re (długość promieni – 1,1 mm)
– Stawy biodrowe, ramieniowy, łokciowy,
nadgarstkowy, skokowy
– Objętość 1 – 3 ml
– Aktywność – 1-5 mCi, na jeden zabieg nie więcej
niż 10 mCi
• 169 Er (długość promieni – 0,3 mm)
– Stawy śródręcznopaliczkowe,
śródstopnopaliczkowe, międzypaliczkowe
– Objętość 0,5 - 1 ml
– Aktywność – 0,3-1 mCi, na jeden zabieg nie
więcej niż 20 mCi

Po zabiegu
• Kontrola lekarska 6-8 tygodni po
zabiegu
• Potem co 3 –4 miesiące przez rok –
badanie kliniczne i usg

Terapia pierwotnego raka
wątroby

Terapia pierwotnego raka
wątroby
• Terapia nieoperacyjnego,
pierwotnego raka wątroby
potwierdzonego histologicznie
• Dotętnicze podanie 131-I Lipidol
– Lipidol naturalnie zawierający jod
etynylo-ester kwasu tłuszczowego
pochodzącego z ziaren maku

• Po dotętniczym podaniu 131-I Lipidol gromadzi się
w guzie i wątrobie (podawanie odbywa się podczas
konwencjonalnej arteriografii wątrobowej)
• Po 24 godz. od iniekcji
– 75-90% znacznika znajduje się w wątrobie,
– 10-25% w płucach
– iloraz wychwytu guz/wątroba = 2,3/12
• Recyrkulacja nie występuje
• Okres półtrwania radioznacznika guz/wątroba =
5,5/3,5 dnia
• Wydalanie
– z moczem 30-50% w ciągu 7 dni,
– ze stolcem 3% w ciągu 5 dni
• Działanie polega na wywołaniu niedokrwienia z
chemoembolizacją

Przeciwwskazania
• Bezwzględne
– Ciąża
– Karmienie piersią
– Przewidywany okres przeżycia < 1 m-c
– Encefalopatia wątrobowa
– Uczulenie na kontrasty
• Względne
– Zaburzenia krzepliwości
– Ostra bądź przewlekła niewydolność nerek –
klirens kreatyniny < 30 ml/min

• Standardowa podana dawka 131-I Lipodolu – 60 mCi
• Objawy uboczne
– Wczesne:
• Łagodna gorączka (29%)
• Ból w miejsce podania (12,5%)
• Zaburzenia w oddychaniu (3%)
• Ostre zapalenie płuc (0,5%)
– Późne:
• Odwracalna leukopenia (7%)
• Wskazane jest wykonanie scyntygrafii całego ciała 1
tydzień po podaniu celem potwierdzenia dystrybucji
131-I Lipidolu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
Wyszukiwarka
Podobne podstrony:
05 Dawki stosowane w medycynie nuklearnej
AOS AOS załącznik nr 2 cz 7 medycyny nuklearnej 29 08 09podpis
MEDYCYNA NUKLEARNA 2005, medycyna, medycyna nuklearna
ORP bezpieczenstwo pacjenta w rentgentodiagnostyce i medycynie nuklearnej
Medycyna nuklearna (1)
11 Terapeutyczna medycyna nuklearnaid 12638
TEST Z MEDYCYNY NUKLEARNEJ
Scyntygrafia statyczna nerek, MEDYCYNA VI rok, Medycyna Nuklearna
MEDYCYNA-NUKLEARNA-gield-a, medycyna UMed Łódź, 5 rok, medycyna nuklearna, giełdy
Medycyna Nuklearna id 292418 Nieznany
ORP ochrona radiologiczna w medycynie nuklearnej
Leczenie radioizotopami-DRUK, MEDYCYNA VI rok, Medycyna Nuklearna
BIOCHEMICZNE METODY RADIOIMMUNOLOGICZNE, MEDYCYNA VI rok, Medycyna Nuklearna, Medycyna nuklearna, nu
scyntygrafia płuc, MEDYCYNA VI rok, Medycyna Nuklearna
radioizotopy, MEDYCYNA VI rok, Medycyna Nuklearna
Emitery promieniowania gamma, medycyna, medycyna nuklearna
więcej podobnych podstron