

Zn
Cynk
Nazwa angielska
Zinc
Nazwa łacińska
Zincum
Grupa
Okres
Liczba atomowa
Liczba masowa
Stan skupienia
(20°C,1atm.)
II B
cynkowc
e
4
30
65.39
ciało stałe
Konfiguracja
elektronowa :
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10

30
Zn : K
2
L
8
M
18
N
2
30
Zn : 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2

Cynk jest srebrnoszarym, kowalnym,
łatwo topliwym metalem. Jest aktywny
chemicznie. Wykazuje właściwości
diamagnetyczne.
Cynk występuje w przyrodzie tylko w
postaci związków. Do najważniejszych
minerałów cynku należy blenda cynkowa
ZnS oraz galman zawierający głównie
ZnCO
3
. Minerały te są podstawowymi
surowcami do produkcji cynku.

Liczba elektronów: 30
Liczba neutronów: 35
Liczba protonów: 30
Elektroujemność (Allred-Rochow, Pauling): 1.66,
1.65
Stopień utlenienia: +2
Przewodność elektryczna: 164.5*105 1/( *cm)
Gęstość (293 K): 7.13 g/cm3
Temperatura topnienia: 420°C, 693 K
Temperatura wrzenia: 907°C, 1180 K
Ciepło topnienia: 7.28 kJ/mol
Ciepło parowania: 115.3 kJ/mol
Przewodność cieplna: 116 W/cm*K

Cynk jest często występującym
pierwiastkiem w przyrodzie.
Stanowi 0,007% skorupy
ziemskiej, zajmuje bowiem 22
miejsce wśród wszystkich
pierwiastków pod względem
rozpowszechnienia. Nie
występuje w stanie wolnym -
głównie związany jest w postaci
siarczków i węglanów.
Największe złoża cynku
występują w Stanach
Zjednoczonych, Kanadzie,
Meksyku, Australii i w Polsce
( Zagłębie Kruszcowe
obejmujące rejon pomiędzy
Chrzanowem i Olkuszem, a
Bytomiem).

Cynkowce na II stopniu utlenienia tworzą
wiele związków kompleksowych z jonami
cyjankowymi, halogenkowymi, z
amoniakiem i aminami.
Tworzą one kompleksy tetraedryczne ,
wykorzystując puste orbitale ns i np swoich
dwudodatnich jonów. Jon cynku ma liczbę
koordynacyjną cztery i tworzy kompleksy,
w których cztery atomy lub grupy atomów
z nim związane rozmieszczone są w
narożach czworościanu.

[Zn(OH)
4
]
2-
Zn(NH
3
)
4
]
2+
[Zn(CN)
4
]
2-


W 1934 roku wykazano, że cynk jest
pierwiastkiem niezbędnym do normalnego
wzrostu i rozwoju ssaków. W organizmie
człowieka znajduje się 2-4 g cynku, a więc
mniej niż żelaza. Dzienne zapotrzebowanie na
ten pierwiastek u dorosłych wynosi 10-15 mg.
Zmienia się ono w zależności od wieku i wynosi
3-5 mg u niemowląt, 10 mg u dzieci.
Cynk do organizmu dostarczany jest głównie
z pożywieniem pochodzenia:
zwierzęcego – mięso, jaja, wątroba, ryby,
ostrygi
roślinnego – nasiona dyni, słonecznika, kiełki
pszenicy i otręby pszenne, cebula, czosnek.
Jest gromadzony głównie w:
-
skórze,
-
kościach
-
mięśniach.
Duże ilości tego pierwiastka
znajdują się w:
-
wątrobie,
-
trzustce,
-
nerkach,
-
śledzionie.

Wchłanianie cynku następuje w
jelicie cienkim, głównie w
dwunastnicy. Jego przyswajalność
wynosi 20-40% i jest większa z
pokarmów pochodzenia
zwierzęcego.
Po spełnieniu funkcji biologicznych
cynk jest wydalany z organizmu
przez przewód pokarmowy i nerki.

Uczestniczy w przemianach metabolicznych
-
lipidów,
-
białek,
-
węglowodanów.
Jest niezbędny do prawidłowego funkcjonowania
układu:
-
oddechowego
-
rozrodczego.
Spełnia ochronną rolę w przypadkach zatruć:
-
ołowiem,
-
kadmem,
-
uczestniczy w eliminacji wolnych rodników
ponadtlenkowych (hamuje utlenianie
nienasyconych kwasów tłuszczowych).
-
zapewnia prawidłowe funkcjonowanie
skóry i błon śluzowych.

Cynk pełni podstawową rolę w wielu procesach
biologicznych, m.in.:
– bierze udział w metabolizmie kwasów nukleinowych, w
biosyntezie RNA i DNA oraz biosyntezie białek,
– spełnia ważną rolę w ekspresji genów i ma wpływ na
strukturę
i funkcjonowanie błon komórkowych,
– wykazuje działanie przeciwutleniające i hamuje utlenianie
nienasyconych kwasów tłuszczowych,
– bierze udział w magazynowaniu insuliny w trzustce i jej
uwalnianiu,
– spełnia znaczącą rolę w procesach odpornościowych
wpływając na układ immunologiczny

– jest niezbędny do utrzymywania
prawidłowego stężenia witaminy
A w osoczu, prawidłowego
funkcjonowania skóry i błon
śluzowych,
– bierze udział w utrzymywaniu
równowagi jonowej w organizmie,
takich pierwiastków śladowych,
jak: selen, miedź, mangan,
magnez,
– jako antagonista kadmu i ołowiu
działa odtruwająco na te metale
ciężkie,
-wchodząc w skład dysmutazy
nadtlenkowej(Zn-SOD),
uczestniczy w eliminacji wolnych
rodników ponadtlenkowych

Zadaniem cynku w
cząsteczce enzymu
może być:
-
udział w stabilizacji
przestrzennej enzymu,
-
bezpośredni udział w
katalizie enzymatycznej
oraz aktywacja
enzymu, który w
przypadku braku metali
wykazuje znacznie
obniżoną aktywność.

Cynk spełnia ważną rolę jako kwas Lewisa w
wielu metaloenzymach, ponieważ:
– jest jonem o konfiguracji d10 i dlatego nie
ulega wpływom
pola ligandów, które może determinować
określoną liczbę
koordynacyjną i geometrię kompleksu,
– procesy wymiany ligandów przy cynku są
szybkie (substraty
i produkty mogą być szybko wprowadzane
i usuwane),
– przy małych wartościach pH nie ulega
hydrolizie z utworzeniem
hydroksokompleksów,
– w warunkach biologicznych nie wykazuje
właściwości redoks

Poprzez swój udział w strukturach i aktywacji
wielu
enzymów cynk jest stymulatorem syntezy białek.
Dostępnymi dla cynku miejscami wiązania
białek są:
- wiązanie peptydowe,
- grupa –NH
2
azotu końcowego aminokwasu,
- grupa COO
–
węgla końcowego aminokwasu
- grupy funkcyjne w łańcuchach bocznych reszt
aminokwasowych, takich jak: histydyna (His),
cysteina (Cys), tyrozyna (Tyr), kwas
glutaminowy (Glu), kwas asparaginowy (Asp)

Wchodzi w skład lub jest aktywatorem około
80 cynkoenzymów, takich jak:
- dehydrogenaza alkoholowa,
- dehydrogenaza mleczanowa,
- dehydrogenaza jabłczanowa,
- dehydrogenaza glutationowa,
- dehydrogenaza aldehydu 3-fosforoglicerynowego,
- anhydraza węglanowa,
- fosfataza zasadowa,
- karboksypeptydaza,
- polimeraza RNA,
- polimerazaDNA,
- transkarbamylaza asparginianowa,

Bierze udział w aktywacji
takich enzymów jak:
- aldolaza,
- enolaza,
- cellulaza,
- karnozydaza,
- lecytynaza,
- arginaza,
- dezaminaza histydyny,
- dipeptydaza (glicylo-
glicynowa, glicylo-
leucynowa)


Karboksypeptaza A, zawierająca cynk(II), była
pierwszym metaloenzymem, w którym określono
miejsce
wiązania metalu.
Różnice między cynkoenzymami, a kompleksem
enzym-
Me
2+
ilustrują różnice w stałych dysocjacji.
Dla karboksypeptydazy zawierającej trwale
związany
cynk, stała jest równa 3,2×10*
10
, zaś dla
kompleksu
enolaza-Zn
2+
wynosi 2×10
*5
.
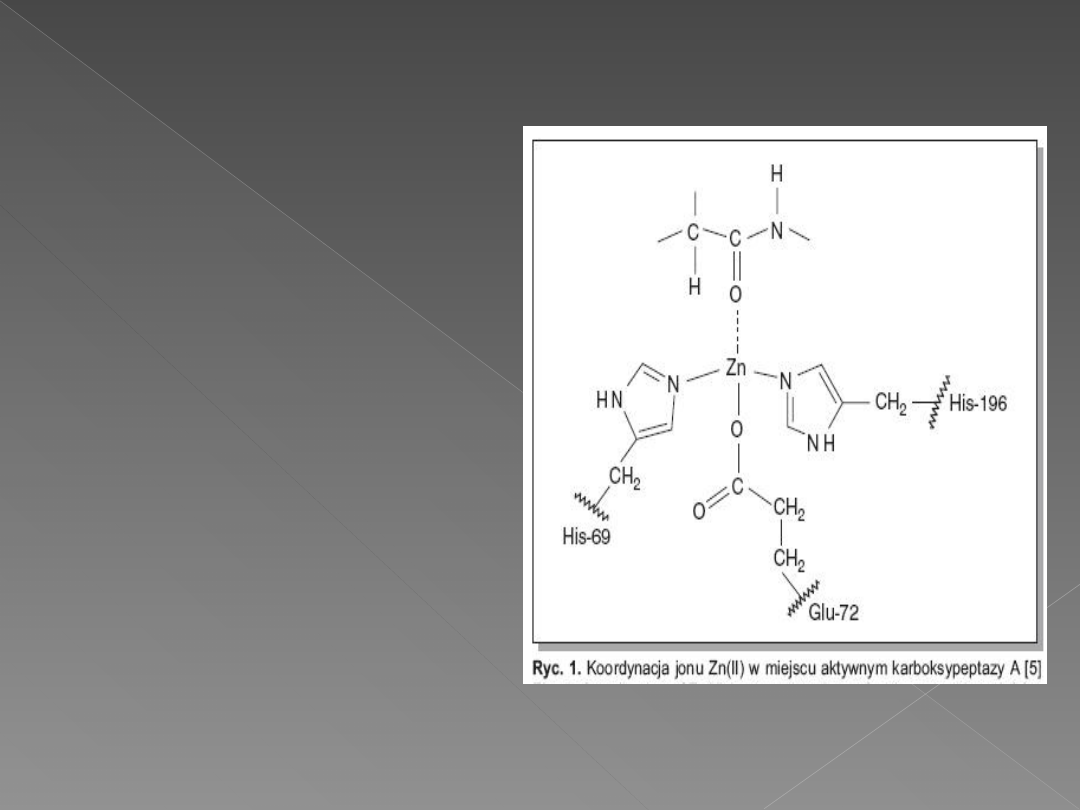
Jak wynika z ryciny,
jon cynku(II) jest
skoordynowany z
dwoma imidazolowymi
łańcuchami histydyny
oraz z dwukleszczową
grupą
karboksylanową
kwasu glutaminowego.
Piąte miejsce w sferze
koordynacyjnej
kompleksu zajmuje
cząsteczka wody.

Karboksypeptydaza A katalizuje hydrolizę
trzy- i czteropeptydów.
Jon cynku(II) gromadzi w tej reakcji
reaktywne grupy (grupę karboksylową
oraz reszty aminokwasowe) uczestniczące
w rozerwaniu wiązania peptydowego.
Przyroda wytworzyła więc wydajny układ
chemiczny ułatwiający przebieg
katalitycznej hydrolizy wiązań
peptydowych przy obojętnym pH.

Anhydraza węglanowa
katalizuje odwracalną
przemianę kwasu węglowego w
tlenek węgla(IV) i wodę.
Występuje u ssaków w:
-
erytrocytach (uczestnicząc w
transporcie CO2 z tkanek do
płuc),
-
w komórkach kanalików
nerkowych (gdzie ma wpływ
na wymianę jonową),
-
w komórkach żołądka (bierze
udział w powstawaniu kwasu
solnego),
-
w tkance mięśniowej.

-
anhydraza węglanowa była jedną z pierwszych
biocząsteczek, w której odkryto cynk.
-
w biokompleksie tym, jon cynku(II) jest
skoordynowany z trzema imidazolowymi łańcuchami
bocznymi histydyny (His-94 i His-96, His-119) poprzez
atomy azotu.
-
dalsze miejsce koordynacyjne jest zajęte przez
cząsteczkę wody lub jon hydroksylowy OH– (zależnie
od pH).
-
całkowity ładunek biokompleksu pozostałe
niezmienny i wynosi +2, gdyż wszystkie cząsteczki
zajmujące miejsca koordynacyjne w biokompleksie są
obojętne.

Enzym ten katalizuje odwracalną
reakcję hydratacji dwutlenku węgla
CO
2
:
CO
2
+ H
2
O -> HCO
3-
+ H
+
(1)
reakcję hydratacji aldehydów
CH
3
CHO + H
2
O-> CH
3
-CH(OH)
2
(2)
jak również reakcje hydrolizy
różnych estrów.
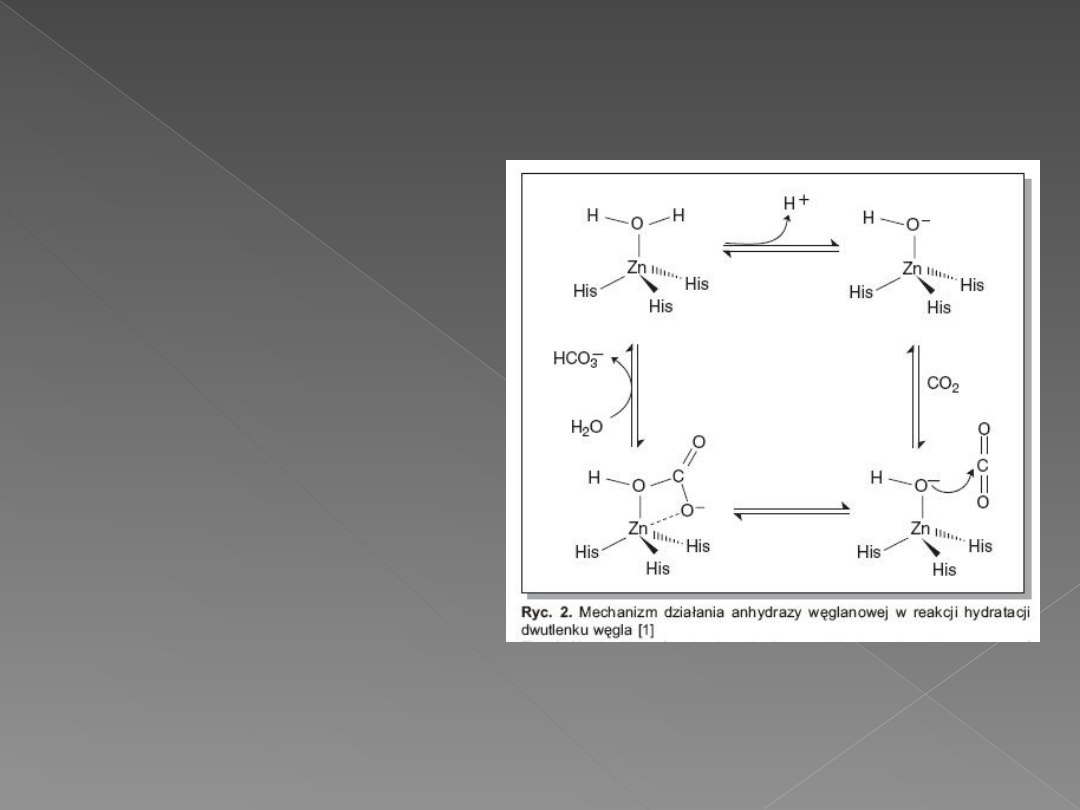
Cynk ułatwia
uwolnienie protonu
H
+
z cząsteczki wody
i utworzenie jonu
hydroksylowego OH
–
,
który reaguje z CO2,
przekształcając go w
jon
wodorowęglanowy
HCO
3-
. Następnie jest
uwolnienie jonu
wodorowęglanowego
i związanie kolejnej
cząsteczki wody oraz
regeneracja miejsca
aktywnego enzymu.

Jednym z najlepiej poznanych
enzymów cynku jest
dehydrogenaza alkoholowa.
Składa się ona z 2 podjednostek,
z których każda zawiera dwa jony
cynku. Jeden z jonów pełni
funkcję katalityczną, a drugi
strukturalną. Jon pełniący funkcję
katalityczną, skompleksowany
przez grupy tiolowe dwóch reszt
cysteinianowych i imidazolowy
azot histydyny odpowiada za
reakcję przemiany etanolu w
acetaldehyd.

Dehydrogenaza alkoholowa (EC
1.1.1.1) – enzym z grupy
oksydoreduktaz przyspieszający
przekształcanie się aldehydu octowego
w etanol lub odwrotnie. Może także
katalizować podobne przemiany innych
alkoholi i odpowiadających im
aldehydów i ketonów.
Enzym ten odgrywa podstawową rolę
w fermentacji alkoholowej, która jest
formą oddychania beztlenowego, a
także w detoksykacji alkoholu.

Enzym ten usuwa rodniki ponadtlenkowe,
katalizując przekształcenie dwóch rodników w
nadtlenek wodoru i cząsteczkę tlenu:
2O
2
.–
+ 2H
+
- > H
2
O
2
+ O
2
Powstający w reakcji potencjalnie szkodliwy
nadtlenek wodoru jest usuwany przez enzym
katalazę – złożony z wielu podjednostek
zawierających w swych miejscach aktywnych
grupy hemowe .
2H
2
O
2
-> 2H
2
O + O
2

-
dysmutaza ponadtlenkowa (SOD) występuje we
wszystkich tkankach metabolizujących tlen,
-
jest metaloproteiną zawierającą w swych centrach
aktywnych jony metali (Fe, Cu, Zn, Mn).
-
w komórkach ludzkich znajdują się trzy formy SOD:
•
cynkowo-miedziowa (CuZnSOD) w cytozolu i
przestrzeni
międzybłonowej mitochondriów,
•
manganowa (MnSOD) prawie wyłącznie w
mitochondriach
•
dysmutaza pozakomórkowa (ECSOD).
Wszystkie izoenzymy SOD u ludzi są kodowane przez
geny jądrowe, syntetyzowane w cytoplazmie i
transportowane do odpowiednich kompartmentów
komórkowych.

BUDOWA (Cu-Zn (SOD) :
dysmutaza ponadtlenkowa Cu-Zn (SOD)
jest dimerem dwóch identycznych
podjednostek, z których jedna zawiera
jony cynku(II) skoordynowane z trzema
resztami histydyny i jedną resztą
asparaginową, druga – jony miedzi (I,II)
skoordynowane z czterema resztami
histydyny.

Dysmutaza
ponadtlenkowa jest
kluczowym enzymem
bariery
antyoksydacyjnej
organizmu. Liczne
badania dowiodły
udziału reaktywnych
form tlenu w procesie
nowotworzenia, co
sprawia, że dysmutaza
ponadtlenkowa może
odgrywać ważną rolę w
powstawaniu
nowotworów.

W ostatnich latach cynk uznawano za
pierwiastek o działaniu przeciwutleniającym,
gdyż:
– zmniejsza tworzenie rodników OH i O
2
spowodowane przez niektóre metale
przejściowe, m.in. Fe i Cu (Zn konkuruje z już
wymienionymi metalami prooksydacyjnymi),
– tworzy chelaty z grupami sulfhydrylowymi,
przez co ochrania je przed procesami
prooksydacyjnymi, wywołując zmiany
przestrzenne w podjednostkach
enzymatycznych tzn. redukuje ich
reaktywność


Reguluje ciśnienie krwi,
Reguluje rytm pracy serca,
Wpływa na funkcje wydzielnicze skóry,
Reguluje poziom cholesterolu we krwi,
Bierze udział we wzroście i przemianach kośćca w wieku
starszym,
Przyspiesza gojenie ran zewnętrznych i wrzodów przewodu
pokarmowego,
Utrzymuje odporność skóry na infekcje,
Uczestniczy w detoksykacji alkoholu w wątrobie i dlatego u
alkoholików stwierdza się niski poziom cynku w organizmie,
Poprawia sprawność intelektualną a w wieku starszym
zapobiega rozwojowi demencji starczej,
Zwiększa sprawność układu odpornościowego uczestnicząc
w powstawaniu limfocytów T, oraz wykazuje działanie
antywirusowe,

Odpowiednia ilość cynku jest niezbędna do prawidłowego
wytworzenia się narządów płodu w okresie ciąży,
Wpływa na rozwój narządów płciowych w okresie
dojrzewania,
Wspomagać leczenie reumatyzmu, artretyzmu i prostaty

Ogólne osłabienie,
Niedokrwistość,
Wymioty,
Podrażnienie przewodu pokarmowego ,
Zaburzenia w układzie krążenia ,
Zmniejszenie odporności immunologicznej ,
Obniżenie poziom cholesterolu HDL ,
Ograniczenie wchłanianie miedzi i żelaza

Niedorozwój narządów u płodu,
Niedorozwój narządów płciowych w okresie
dojrzewania,
Dysfunkcja receptorów smakowych i węchowych,
Przedłużony czas gojenia się ran,
Zwiększona podatność na stres,
Wypadanie włosów, łamliwość paznokci, rozstępy na
skórze,
Popękana skóra w kącikach ust,
Zaburzenie potencji oraz u kobiet miesiączkowania,
Kurza ślepota,
Brak apetytu,
Depresja
Drżenie kończyn,
Objawy starzenia się,
Zaburzenie wzrostu i karłowatość,
Suchość oczu,
Infekcje gardła,
Biegunki

1. Berg J.M., Tymoczko J.L., Stryer L.: Biochemia.
Wyd. Nauk. PWN. Warszawa, 2005.
2. Bielański A. : Podstawy chemii nieorganicznej
t.2.Wyd. Nauk. PWN. Warszawa 2002.
3. Murray R.K., Granner D.K., Mayes P.A.,
Rodwell V.W.: Biochemia Harpera,
Wyd. Lekarskie. PZWL. Warszawa 1998.
4. Internet


Emilia Sadowska
Daria Nurska
Karla Joppek
Marta Oczachowska
Paulina Nietyksza
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
BILANS ENERGETYCZNY ORGANIZMU CZŁOWIEKA, Farmacja
ORGANIZM CZŁOWIEKA W LICZBACH, Sprawdziany i Odpowiedzi gimnazjum, Sprawdziany z odpowiedziami z bio
Znaczenie mięsa dla organizmu człowieka 4), Technologia żywności i żywienia człowieka, Gastronomia
Organizm człowieka nie może funkcjonować?z witamin
Wpływ stresu na organizm człowieka
Wpływ ruchu na organizm człowieka
Karta pracy Organizm człowieka jako funkcjonalna?łość
Fizjologia organizmu czlowieka, zak, BHP, Szkoła, Ergonomia
Wpływ masażu na organizm człowieka
7 Patogeny i ich wpływ na organizm człowieka
oddzialywanie pradu na organizm czlowieka, Uprawnienia dla elektryka E SEP, 1kV
05 Charakteryzowanie funkcji narządów organizmu człowieka 2
ORGANIZM CZŁOWIEKA
Wpływ promieniowania elektromagnetycznego na organizm człowieka
Źródła kadmu oraz jego działanie na organizm człowieka
Wpływ używek na organizm człowieka
Alkohol etylowy a organizm człowieka2
więcej podobnych podstron