Spektroskopia molekularna
Wykład 7
Spektroskopia
oscylacyjna w
podczerwieni- widma
IR
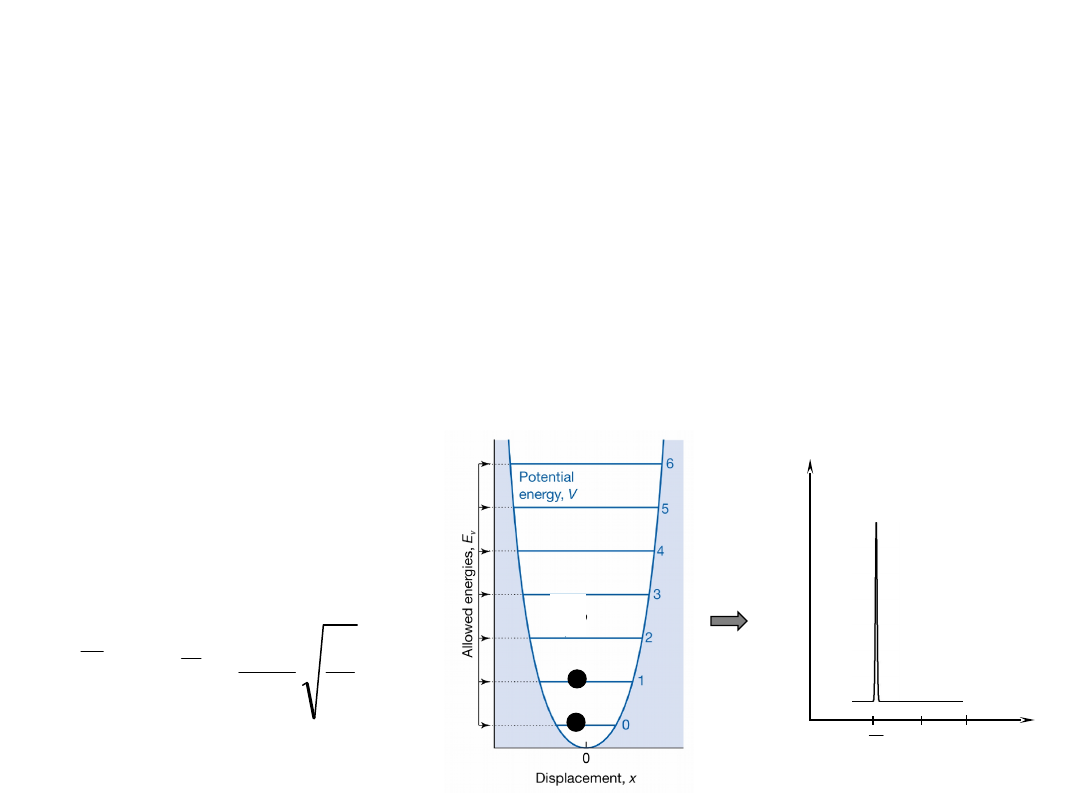
Widmo IR jest
zdominowane
przez przejścia z
podstawowego poziomu
oscylacyjnego na
pierwszy
poziom wzbudzony.
Zgodnie z regułą wyboru dla oscylatora harmonicznego:
1
v
)
0
1
(
Zgodnie z rozkładem Boltzmanna w temperaturze pokojowej
(kT=207 cm
-1
) większość cząsteczek przebywa na
podstawowym poziomie oscylacyjnym (v=0).
wavenumber (cm
-1
)
A
b
so
rb
e
d
In
te
n
si
ty
k
c
E
2
1
0
1
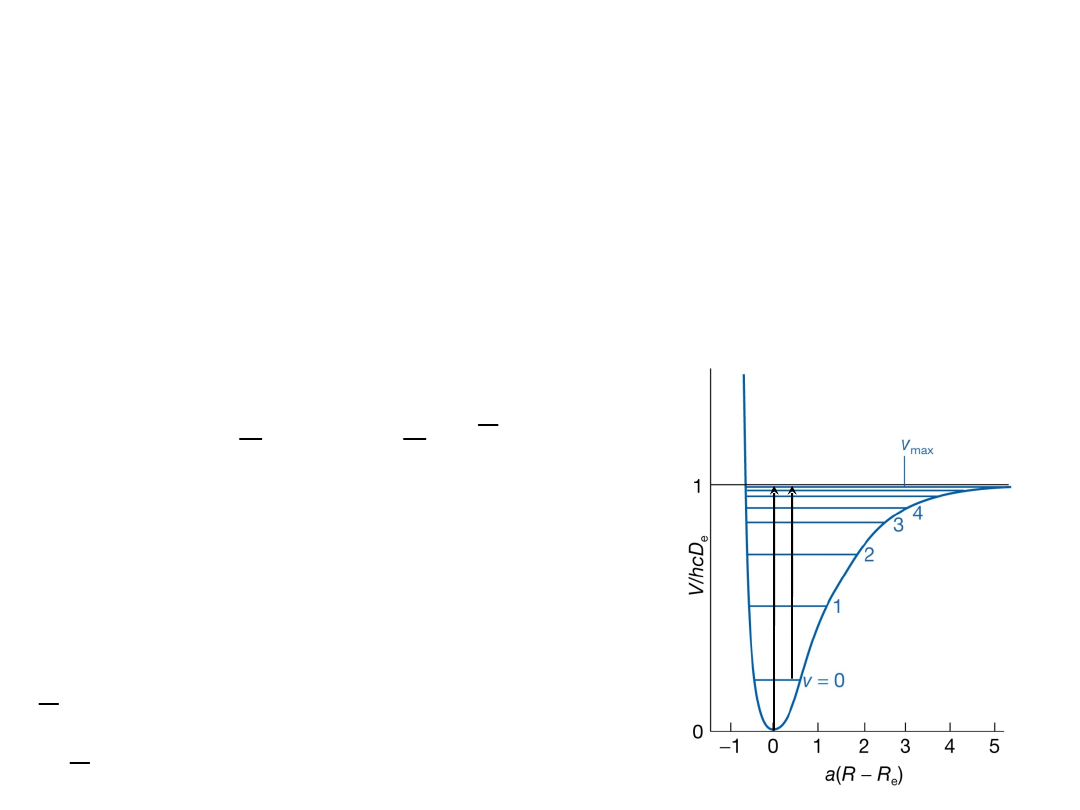
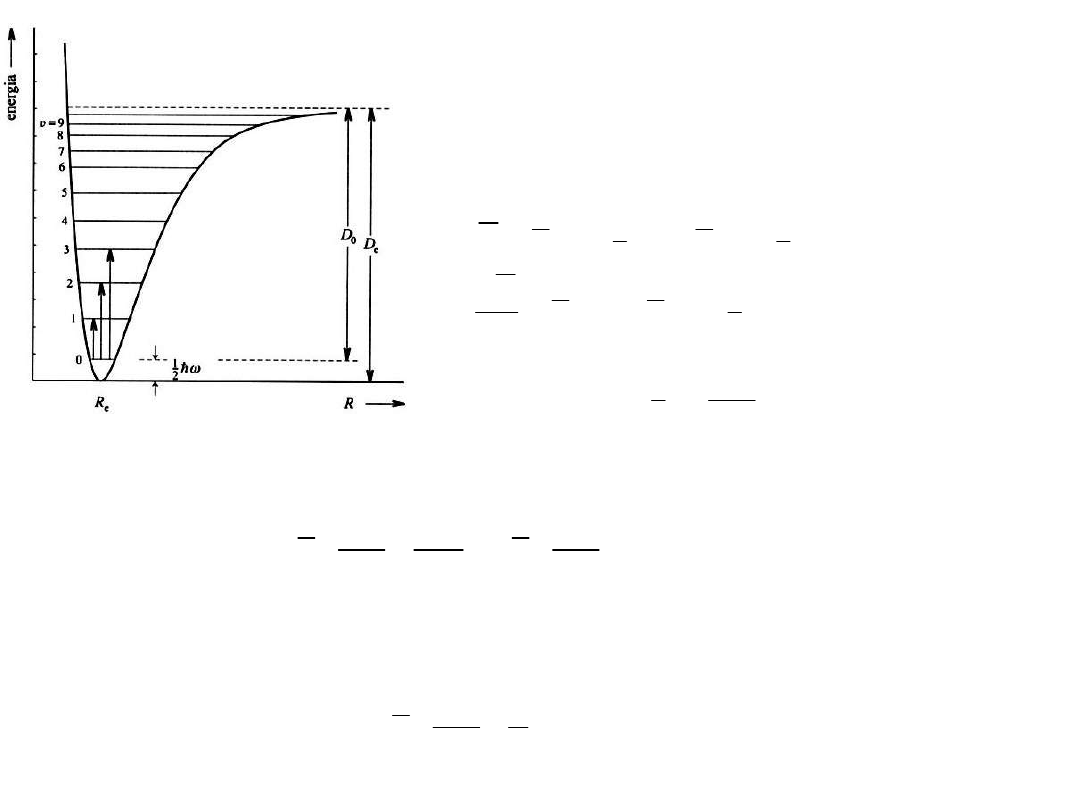
Widmo IR oscylatora harmonicznego
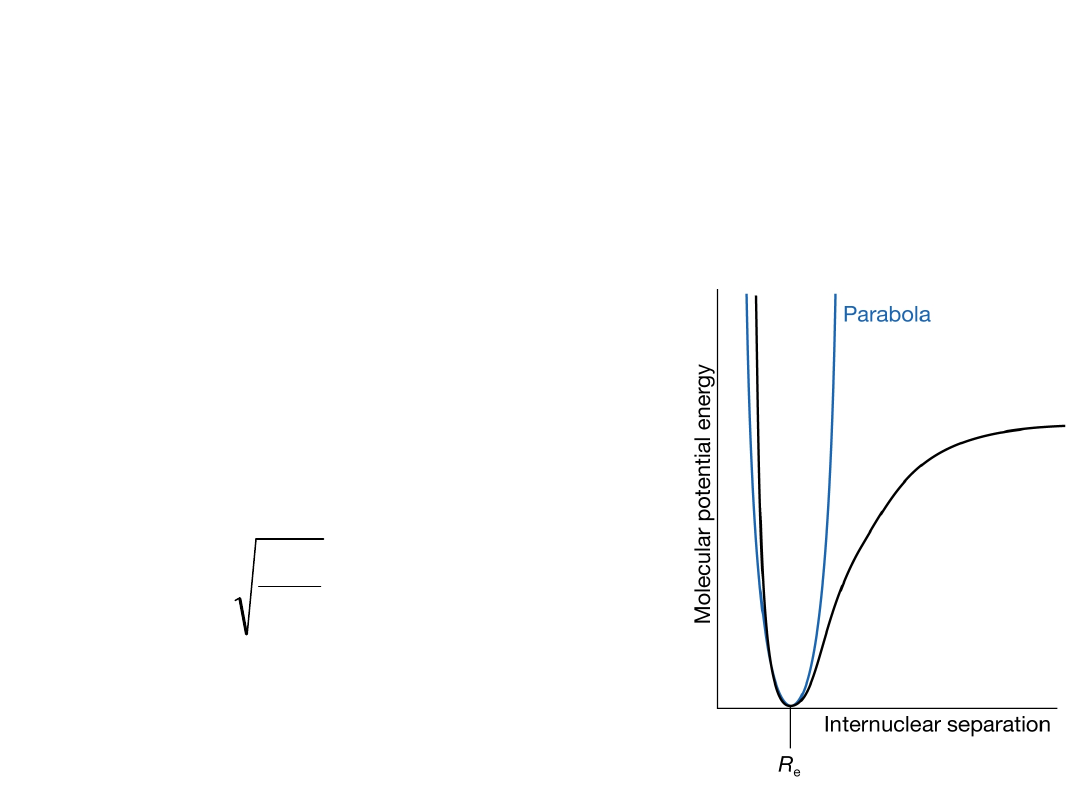
Dla większych wychyleń
międzyatomowy potencjał V jest
lepiej opisany potencjałem
Morse’a (anharmoniczność):
Oscylator
an
harmoniczny
Oscylator harmoniczny jest dobry przybliżeniem
tylko dla małych odchyleń z położenia równowagi
(drgania o małej amplitudzie).
e
e
R
R
a
e
D
a
e
D
R
V
e
2
2
1
)
(
2
)
(
D
e
– głębokość krzywej
a – szerokość krzywej
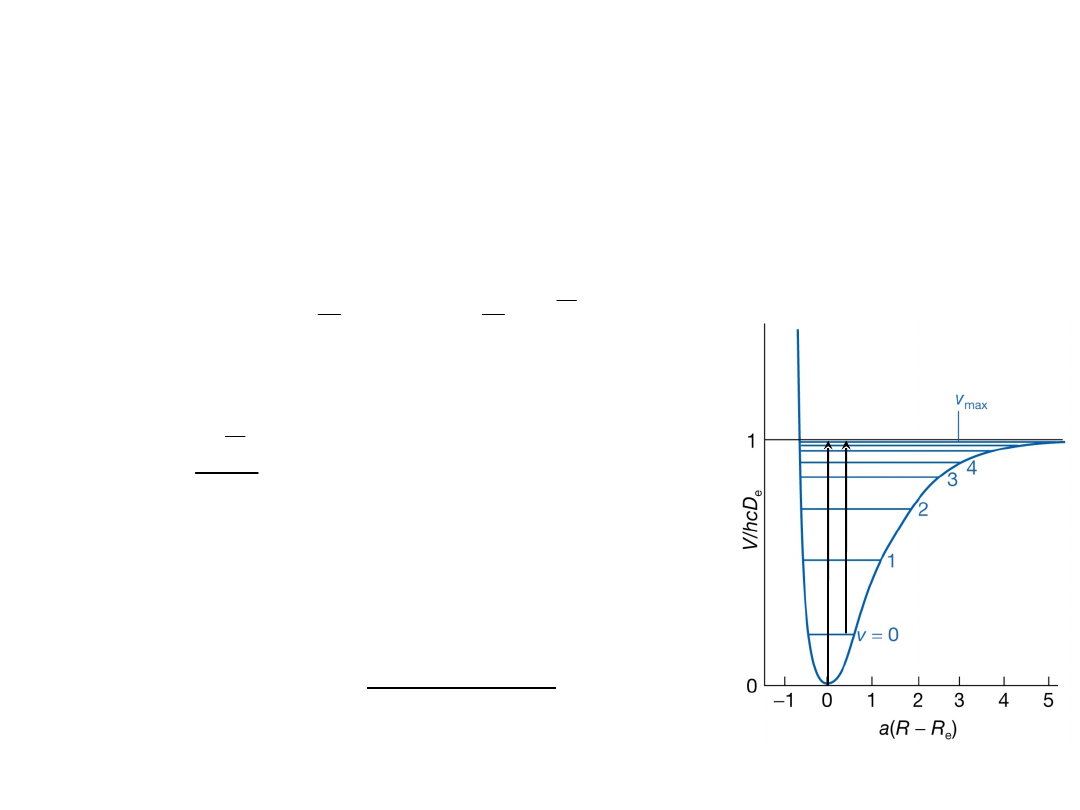
Poziomy energii nie są już równo
odległe. Ponadto liczba poziomów
oscylacyjnych jest skończona: dla
energii większych niż E
v
max
następuje
dysocjacja wiązania.
Oscylator
an
harmoniczny
e
e
e
e
e
D
x
x
hc
E
4
v
,...,
2
,
1
,
0
v
)
2
1
v
(
)
2
1
v
(
max
2
v
Kiedy potencjał oscylacji jest opisany krzywą Morse’a
dozwolone poziomy energii oscylacyjnej dane są
wzorem:
D
e
D
o
Oscylator
an
harmoniczny
Zadanie:
Cząsteczka
1
H
35
Cl jest opisana potencjałem Morse’a.
Przyjmując, że energia wiązania D
e
nie zmienia się
po deuterowaniu obliczyć energię dysocjacji D
0
dla
1
H
35
Cl i
2
H
35
Cl.
J
10
602177
.
1
eV
1
s
m
10
9979
.
2
s
J
10
62608
.
6
19
1
8
1
34
c
h
1
1
cm
05
.
52
cm
7
.
2989
eV
33
.
5
e
e
e
e
x
D
D
e
D
o
0
0
2
v
)
2
1
v
(
)
2
1
v
(
E
D
D
x
hc
E
e
e
e
Dane:
Oscylator
an
harmoniczny
Zadanie:
Rozwiązanie
eV
15
.
5
J
10
2452
.
8
J
10
5396
.
8
eV
33
.
5
J
10
9436
.
2
4
1
2
1
01741
.
0
05
.
52
19
0
0
19
20
0
E
D
D
D
x
hc
E
x
e
e
e
e
e
e
1
2
1
cm
3
.
2144
2
1
2
2
1
cm
7
.
2989
2
1
1
2
2
1
1
1
1
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
HCl
k
c
c
k
k
c
eV
20
.
5
J
10
3284
.
8
J
10
1111
.
2
4
1
2
1
19
0
0
20
0
2
E
D
D
x
hc
E
e
HCl
e
stała anharmoniczności obu
cząsteczek
energia drgań zerowych
1
H
35
Cl
energia wiązania obu cząsteczek
energia dysocjacji
1
H
35
Cl
częstość drgań
1
H
35
Cl
stała siłowa obu cząsteczek
częstość drgań
2
H
35
Cl
energia drgań zerowych
2
H
35
Cl
energia dysocjacji
2
H
35
Cl
Wniosek:
Energia dysocjacji D
0
jest różna
dla cząsteczek zawierających
różne izotopy.
Natomiast przyjmujemy, że
energia wiązania D
e
jest taka
sama dla obu cząsteczek
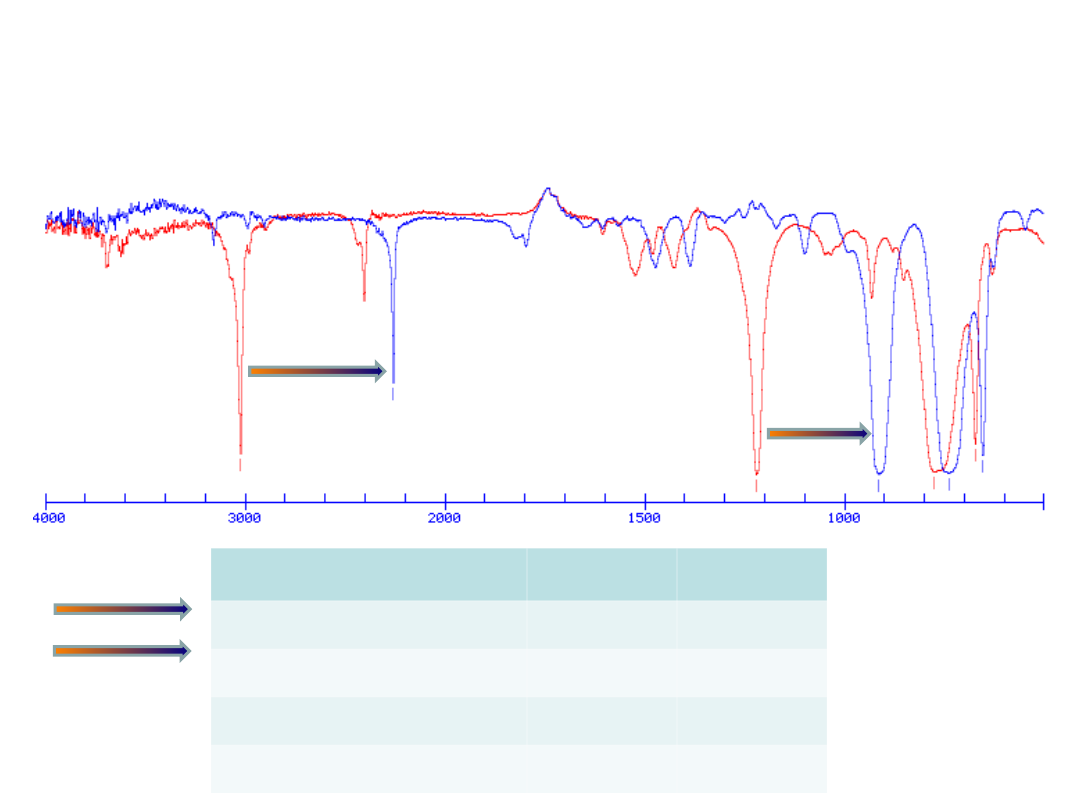
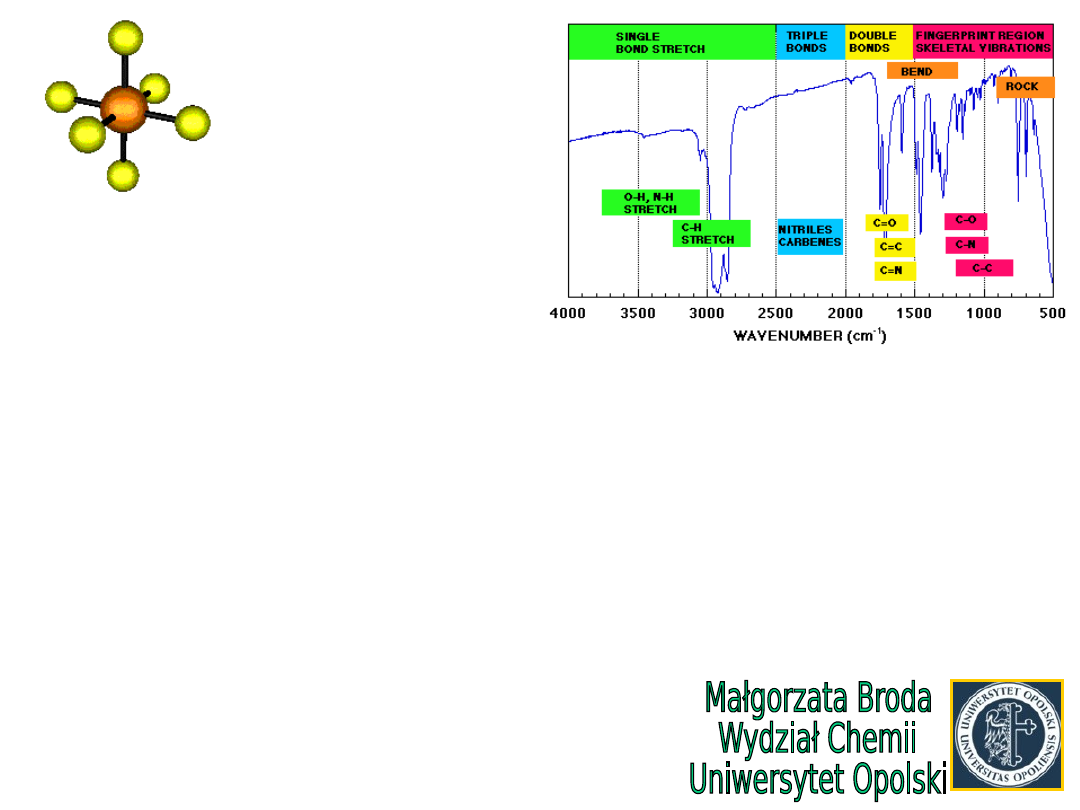
Widma IR
chloroformu
i
deuterochloroformu
Przesunięcie pasma
na
skutek zastąpienia H
atomem D (2x masa)
Rodzaj drgania
CHCl
3
CDCl
3
C-H rozciągające
3020
2256
C-H zginające
1219
912
C-Cl rozciągające
773
737
C-Cl zginające
671
652
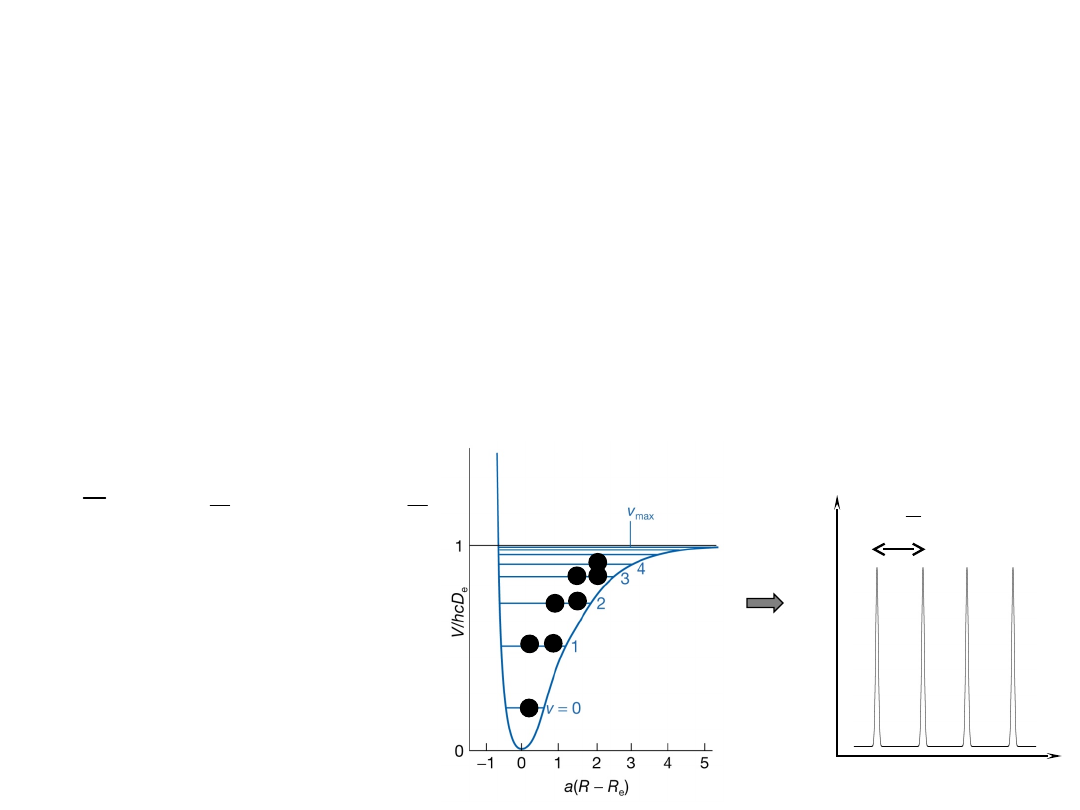
Widmo IR oscylatora
an
harmonicznego
- pasma gorące
Jeżeli cząsteczka znajduje się na wzbudzonych
poziomach oscylacyjnych, mogą być zaobserwowane
sygnały emisyjne pochodzące od przejść innych niż
1←0. W przybliżeniu harmonicznym sygnały powinny
pojawiać się przy tej samej częstości. W
rzeczywistości, obserwujemy je w nieco
innych pozycjach ze względu na anharmoniczność
drgań.
e
e
e
x
E
)
1
v
(
2
v
1
v
wavenumb
er
E
m
it
te
d
I
n
te
n
si
ty
e
e
x
2
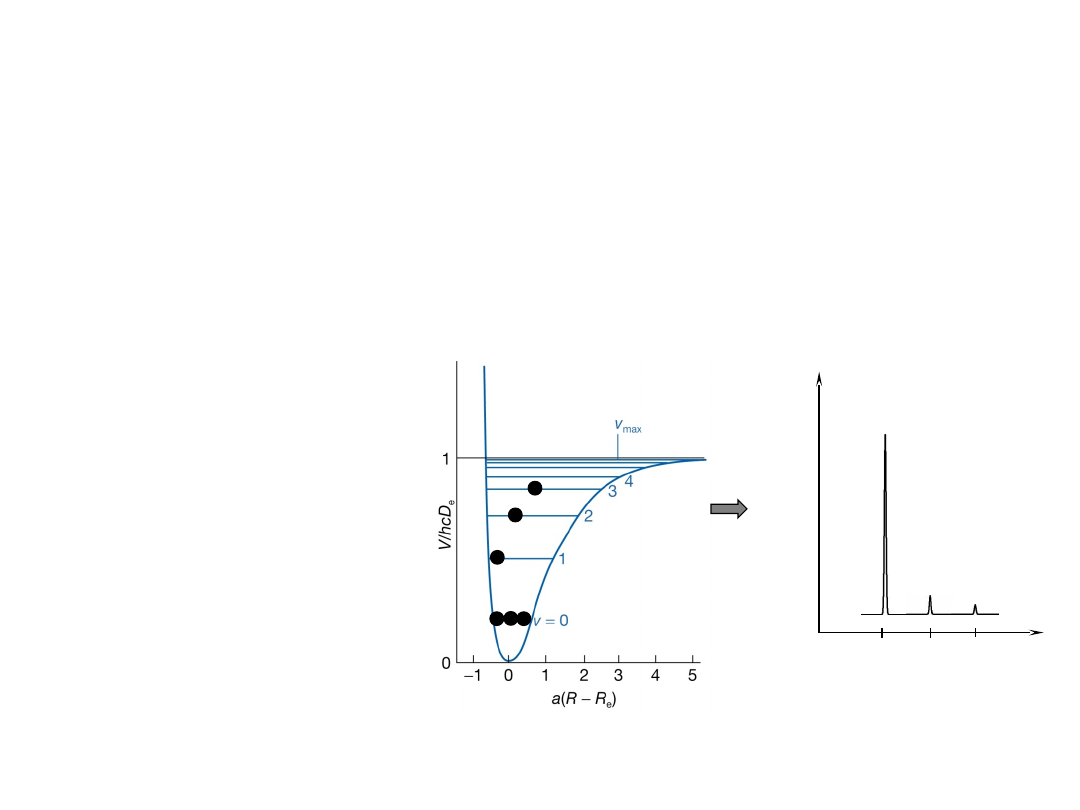
Eksperymentalnym
potwierdzeniem jest
obecność słabych
nadtonów w widmie
absorpcyjnym,
odpowiadającym
przejściom
2←0
,
3←0
, …itd.
Widmo IR oscylatora
an
harmonicznego
- nadtony
Reguła wyboru wynika z przybliżenia
harmonicznego.
Gdy weźmiemy pod uwagę anharmoniczność reguła
wyboru
nie jest ściśle zachowana i wszystkie
wartości są dozwolone.
1
v
wavenumber (cm
-1
)
A
b
so
rb
e
d
In
te
n
si
ty
~
1
v
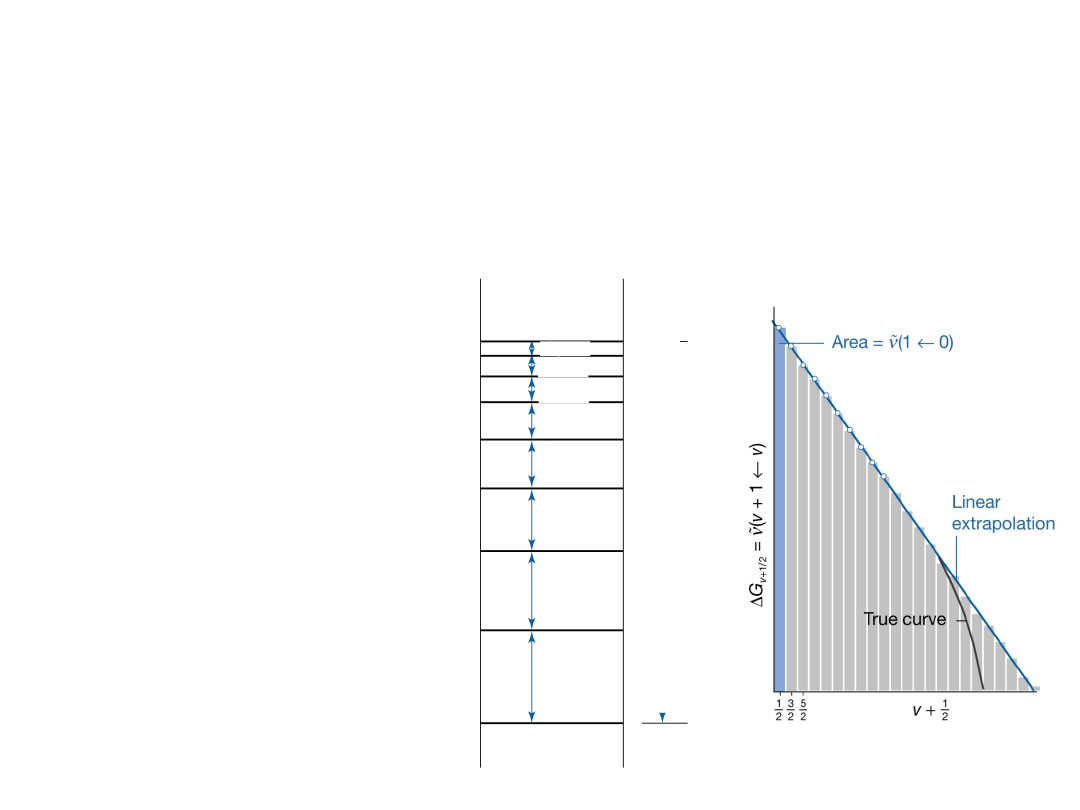
Z widma IR można wyznaczyć
energię dysocjacji D
0
Dlatego, jeżeli kilka
przejść oscylacyjnych
jest znanych energia
dysocjacji może być
oszacowana na
podstawie np. tzw.
diagramów Birge-
Sponera.
Suma energii wszystkich przejść oscylacyjnych
dwuatomowej cząsteczki odpowiada energii dysocjacji
D
0
:
)
v
(
)
1
v
(
...
1/2
v
v
1/2
v
2
/
3
2
/
1
G
G
G
G
G
G
D
o
G
1/2
G
3/2
G
5/2
G
7/2
G
9/2
G
11/2
G
13/2
G
15/2
D
0
G
3
/2
G
3
/2
G
5
/2
G
7
/2
G
9
/2
G
1
1
/2
G
1
3
/2
G
1
5
/2
Z widma IR można wyznaczyć
energię dysocjacji D
0
W miarę wzrostu liczby kwantowej v, różnice
pomiędzy poziomami oscylacyjnymi dążą do
zera.
0
)
v
(
2
v
)
v
(
)
v
(
2
1
2
2
1
2
1
e
e
e
e
e
e
x
d
E
d
x
E
Stąd:
e
x
2
1
)
v
(
2
1
max
Odpowiadająca liczbie kwantowej v
max
energia to energia wiązania
D
e
:
e
e
e
e
e
e
e
x
x
x
x
D
4
1
4
2
1
2
A energia dysocjacji D
0
wynosi:
2
1
4
1
0
0
e
e
e
x
E
D
D

Z widma IR można wyznaczyć
energię dysocjacji D
0
x
e
e
[cm
-1
]
k
[N m
-1
]
D
o
[
kJ mol
-1
]
D
o
[kJ mol
-1
]
HI
0,017
2
2308
312
388
295
HBr
0,017
1
2649
409
448
363
HCl
0,017
4
2991
513
497
428
HF
0,021
8
4138
960
543
564
NO
0,007
3
1904
1597
769
630
CO
0,006
1
2170
1905
1052
1072
Obliczone z x
e
i
e
Bardziej dokładne wartości uzyskane z
widm UV
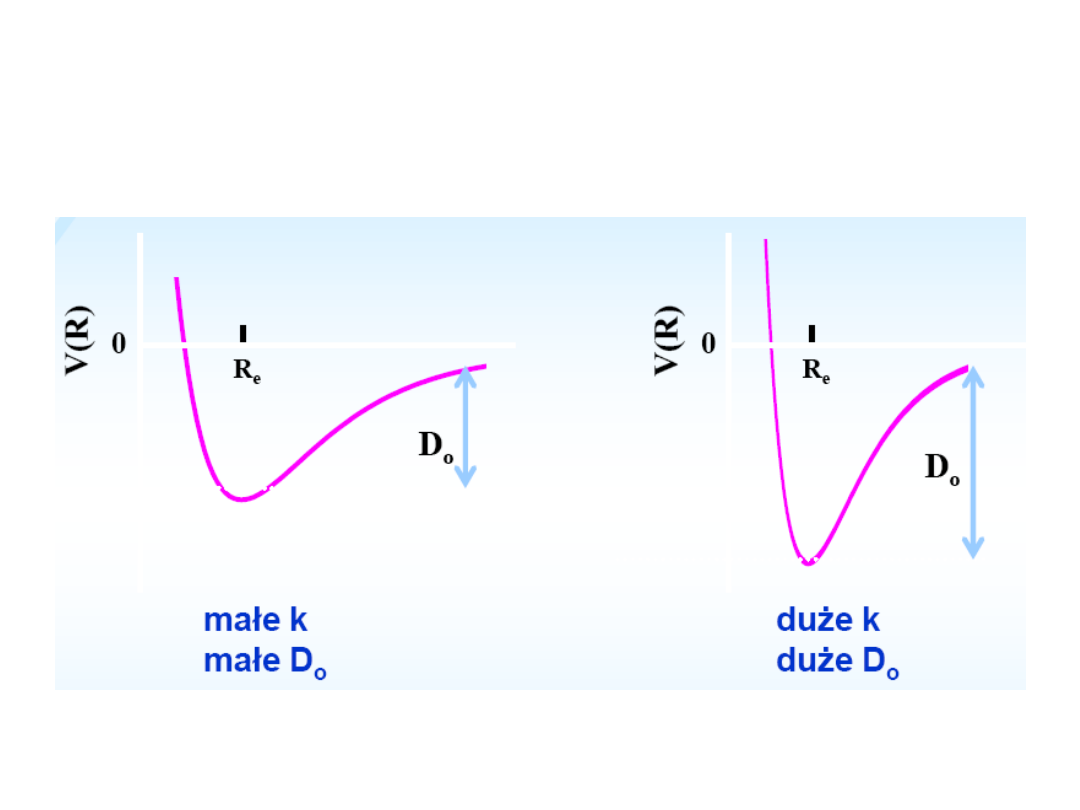
Zależność pomiędzy k i
energią dysocjacji D
0
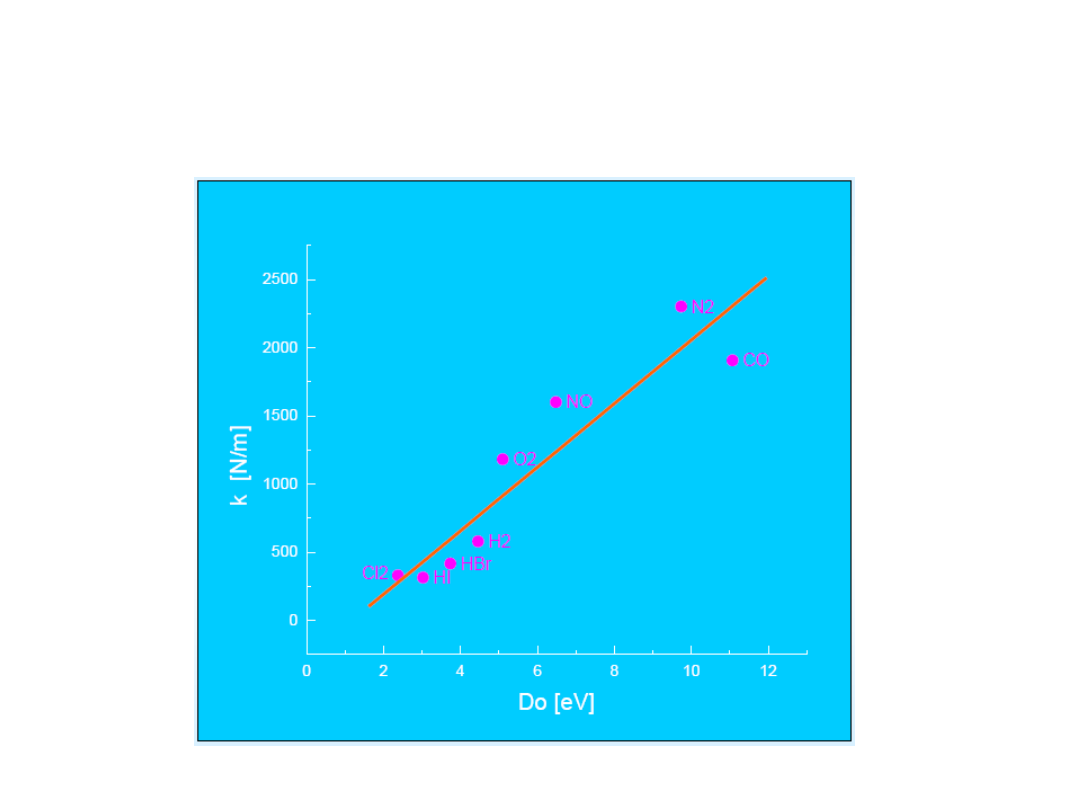
Zależność pomiędzy k i
energią dysocjacji D
0
Zależność pomiędzy stałą siłową (k) i mocą wiązania (Do) jest w
przybliżeniu liniowa
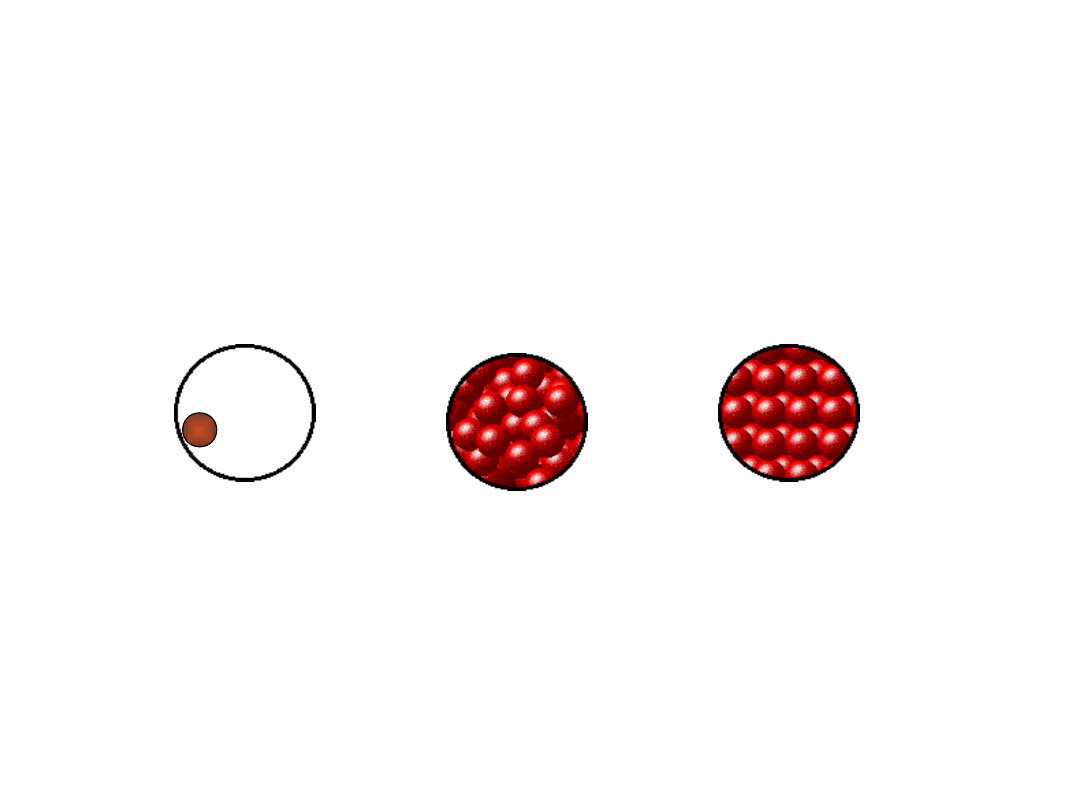
Spektroskopia w fazie
skondensowanej
Cząsteczki w fazie skondensowanej (ciecze/ciała stałe) są w
ciągłym kontakcie ze swoim otoczeniem co oznacza, że nie
mogą swobodnie rotować. Dlatego w wyrażeniu na energię
oscylacyjno-rotacyjną pomijamy składnik rotacyjny
.
Pomimo zahamowanej rotacji w fazach skondensowanych widma
oscylacyjne pokazują strukturę oscylacyjną. Otoczenie może
tylko zakłócać poziomy oscylacyjne ale nie może całkowicie
hamować oscylacji.
gaz
ciało stałe
ciecz

Spektroskopia w fazie
skondensowanej
Zanik struktury rotacyjnej w widmach oscylacyjnych i poszerzenie
pasm
można tłumaczyć na dwa sposoby:
Poszerzenie pasm wynikające z zasady nieoznaczoności –
cząsteczki próbują rotować, ale zderzenia z sąsiadami przerywa
ruch obrotowy a więc czas życia na dowolnym poziomie J’’ jest
bardzo krótki. Zgodnie z zasadą nieoznaczoności Heissenberga
odległości pomiędzy poziomami rozszerzają się
E
/ czas życia
Otoczenie zakłóca poziomy oscylacyjne – cząsteczki danego
rodzaju mają nieco różne lokalne otoczenie więc absorbują przy
nieco innych częstościach – uśrednienie w próbce
makroskopowej powoduje że pasma są poszerzone
Wniosek:
Widma IR faz skondensowanych nie wykazują struktury
rotacyjnej ale poszerzenie pasm wynikające z indywidualnych
przejść oscylacyjnych
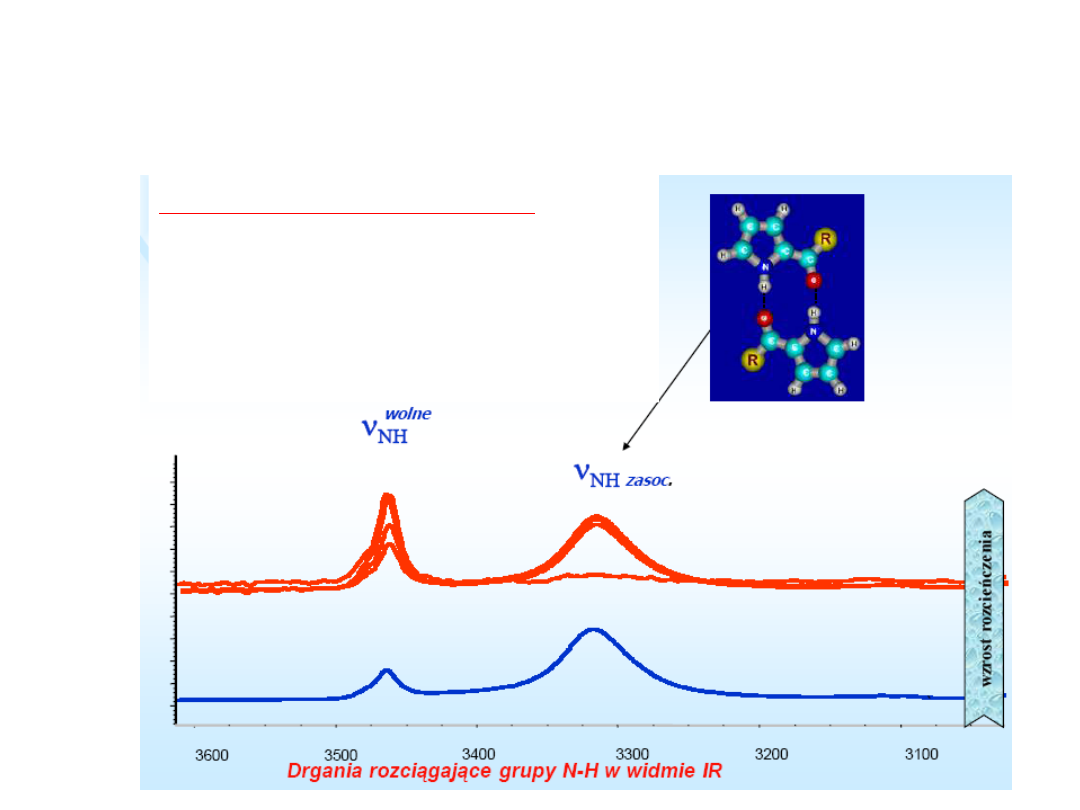
Wiązania wodorowe
międzycząsteczkowe w IR
Zmniejszanie stężenia
powoduje szybsze zmniejszanie
się pasma pochodzącego od
asocjatów (dimerów) niż pasma
pochodzącego od drgań grupy
N-H w monomerze.
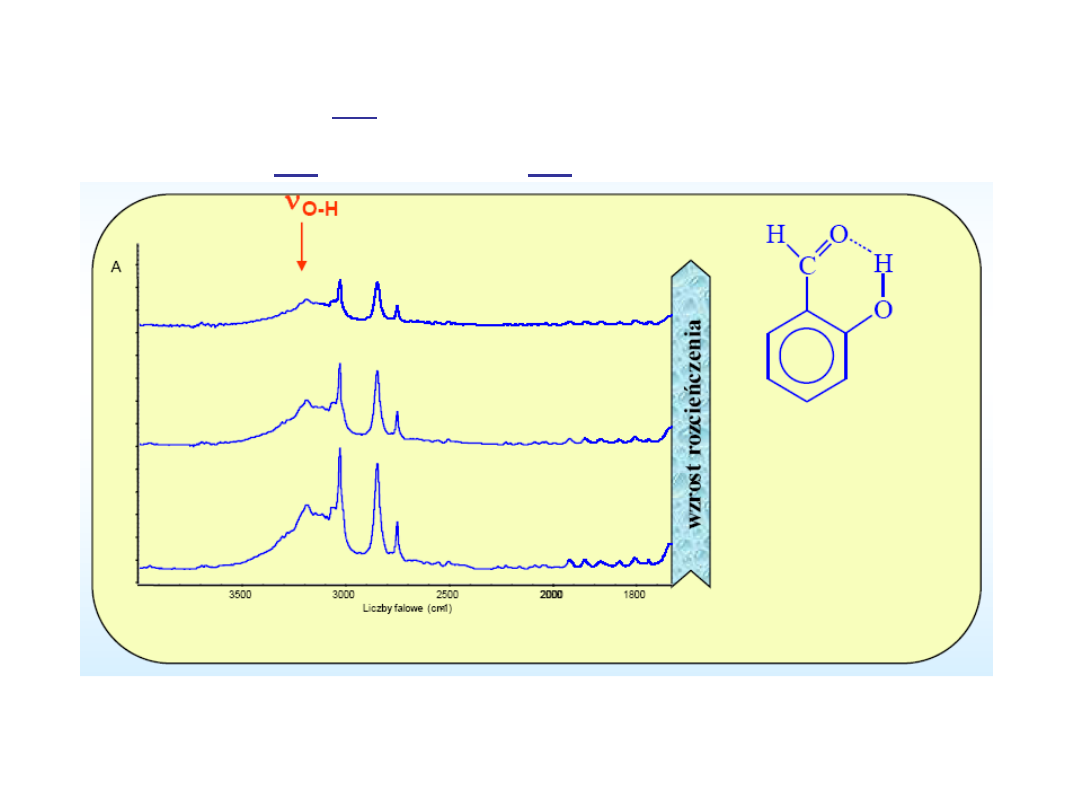
Jeżeli grupa OH tworzy wiązanie wodorowe
wewnątrz cząsteczki to pasmo
s
(OH) nie zmienia
położenia po rozcieńczeniu
Zmiany w widmie oscylacyjnym
WWW – wewnątrzcząsteczkowe
wiązanie wodorowe
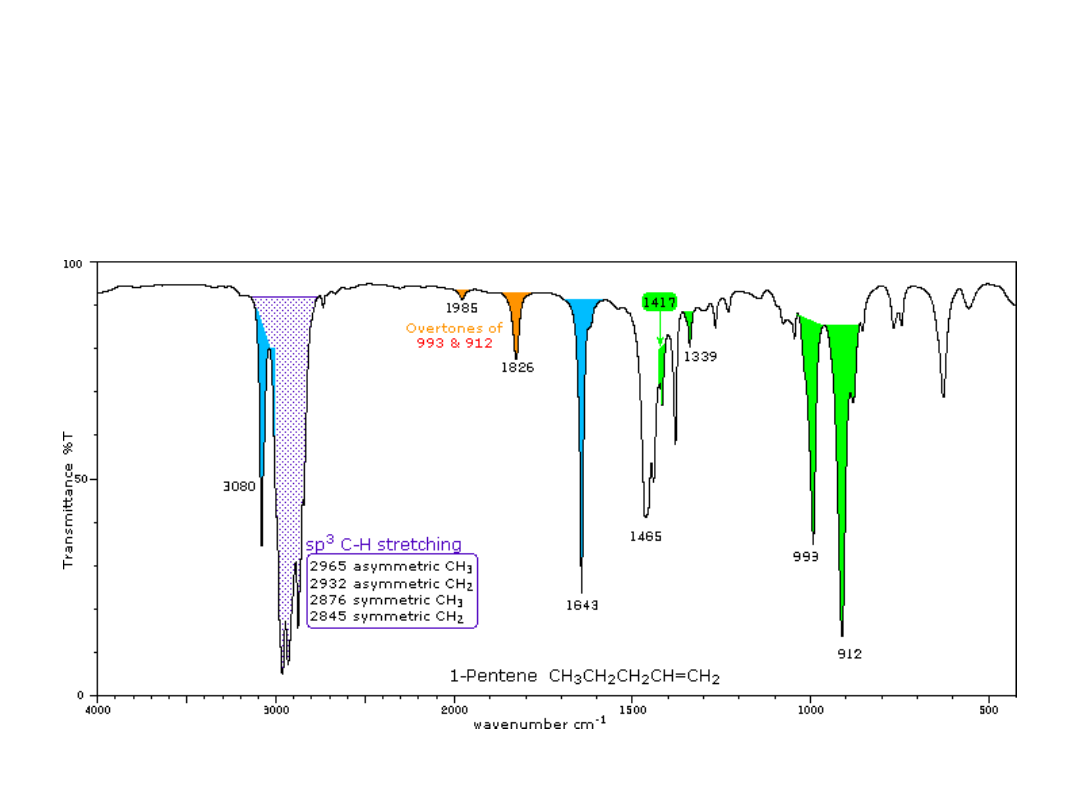
Pasma drgań rozciągających są
niebieskie
,
Pasma drgań zginających są
zielone
.
Nadtony są
pomarańczowe
.
Granica na 3000 cm
-1
pomiędzy drganiami rozciągającymi sp
2
i sp
3
C-H jest widoczna.
Widma alkenów
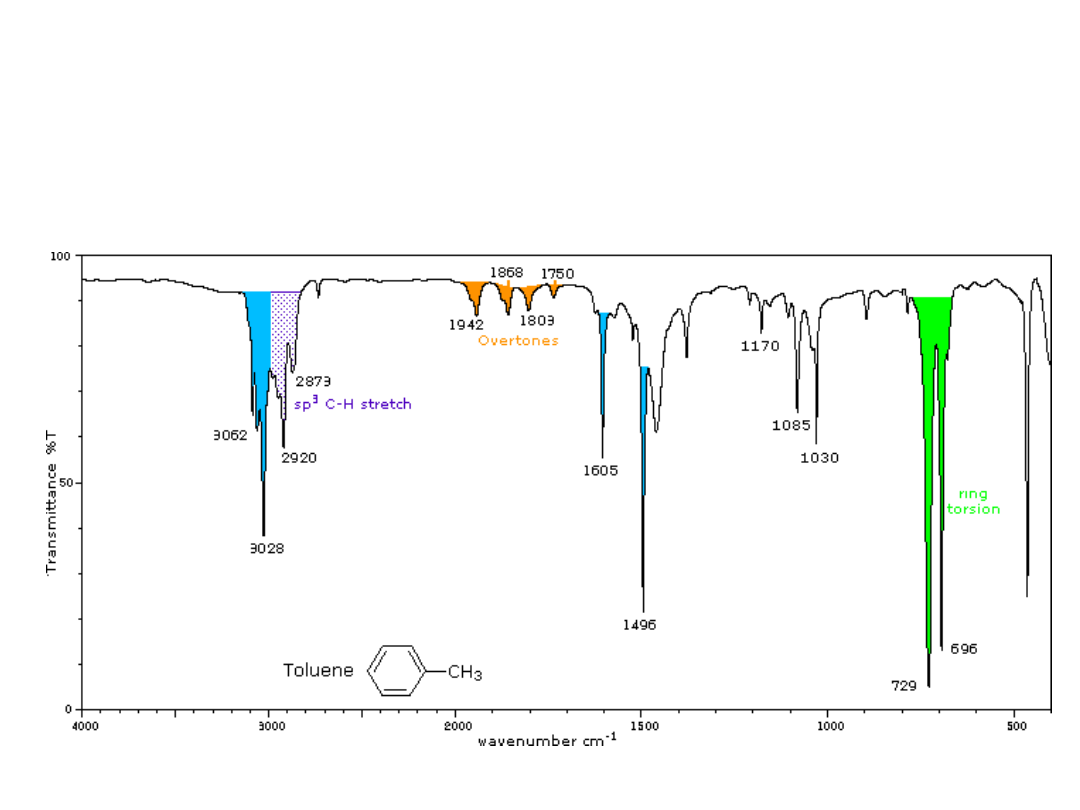
Drgania zginające C-H w płaszczyźnie (950 –1250);
Nadtony i pasma kombinacyjne (1600-2000)
Wąskie, słabe pasma– podstawiony benzen
Widma związków
aromatycznych
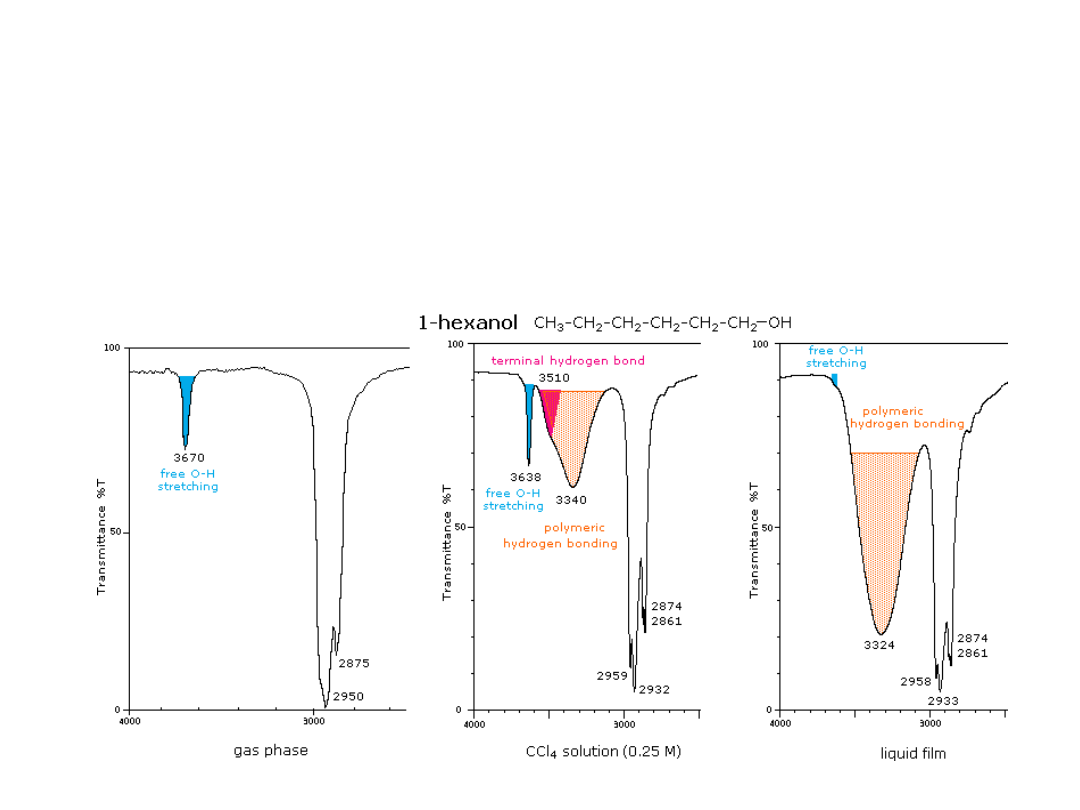
Pasma drgań O-H i N-H w zakresie 3400-3100 cm
-1
silne i szerokie (z
powodu wiązania wodorowego)
Wąskie pasmo wolnej grupy O-H występuje około 3600
cm-1 w:
- bardzo rozcieńczonych roztworach
- w widmach mierzonych w fazie gazowej
Widma alkoholi i fenoli
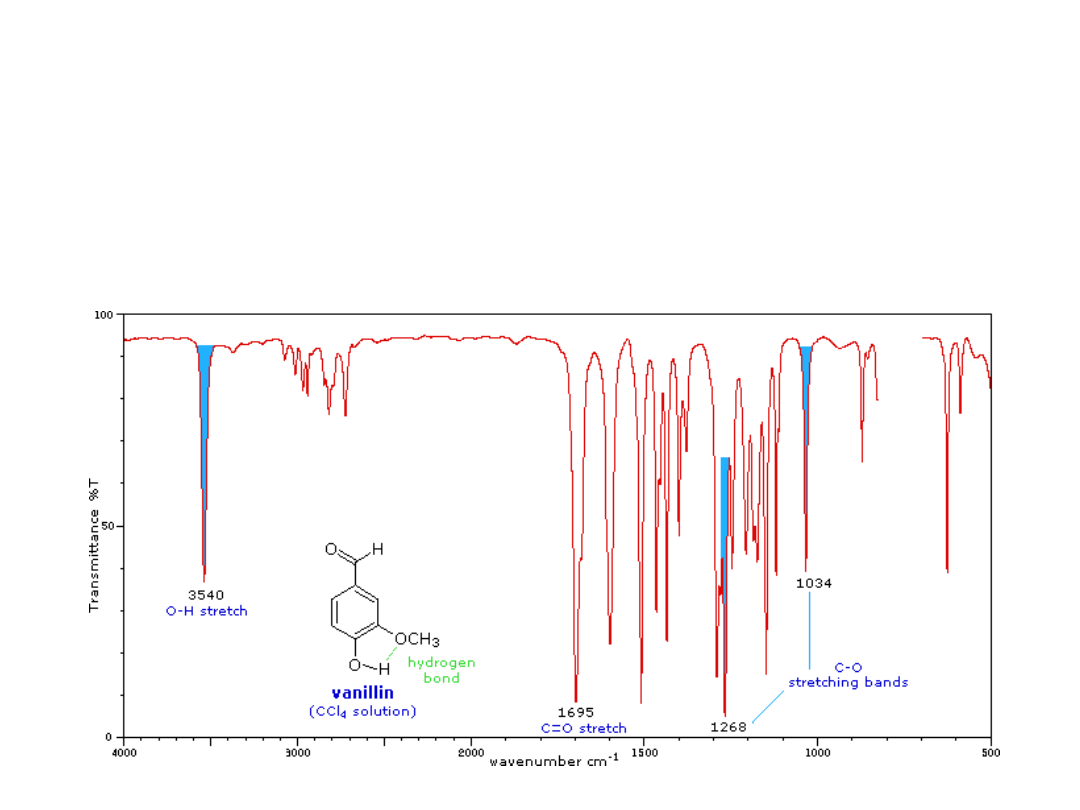
W przypadku wewnątrzcząsteczkowego wiązania
wodorowego
–
występuje pasmo grupy O-H o zwiększonej
intensywności
w zakresie od 3500 do 3600 cm
-1
.
Widma alkoholi i fenoli
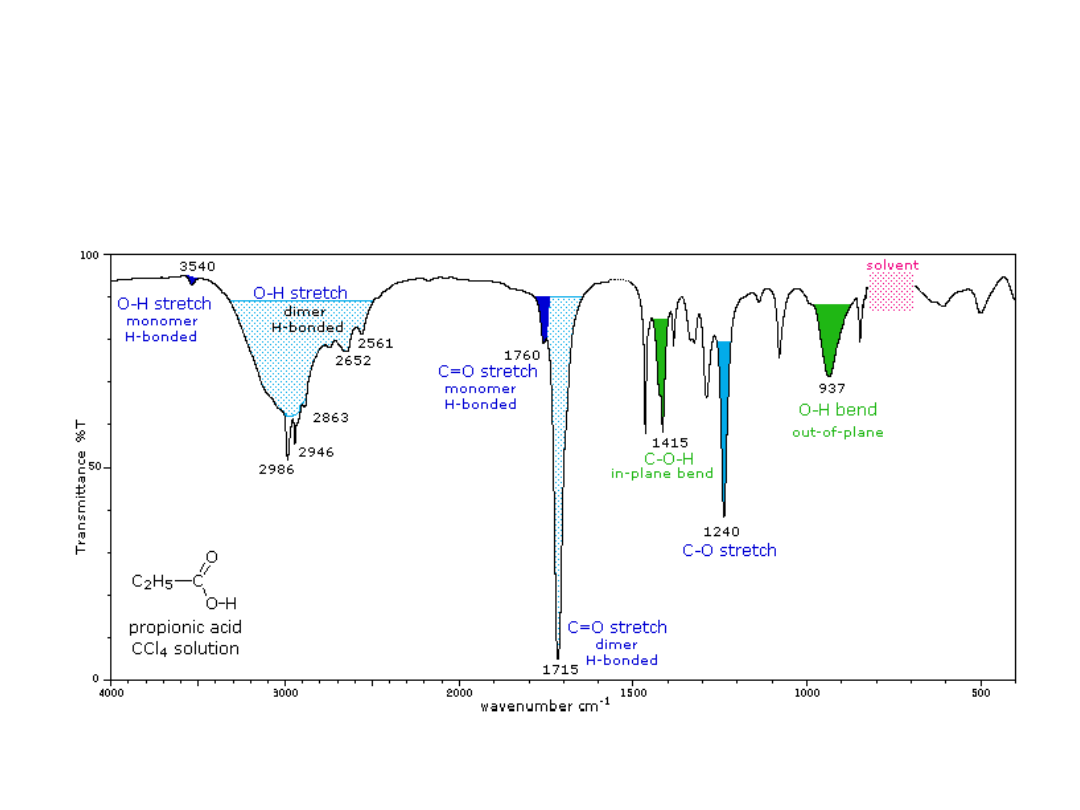
Pasmo drgania rozciągającego grupy C=O jest zwykle bardzo
intensywne z powodu dużej polarności tej grupy.
Widma kwasów karboksylowych

Korelacja pomiędzy częstością A-
H)
a innymi wielkościami opisującymi
wiązanie wodorowe
1937 Budger i Bauer
A-H) vs E
HB
1952 Rundle
A-H) vs r
A…B
1967 Ratajczak
A-H) vs r
A…B
1969 Bellamy i Pace
AH
vs r
AH
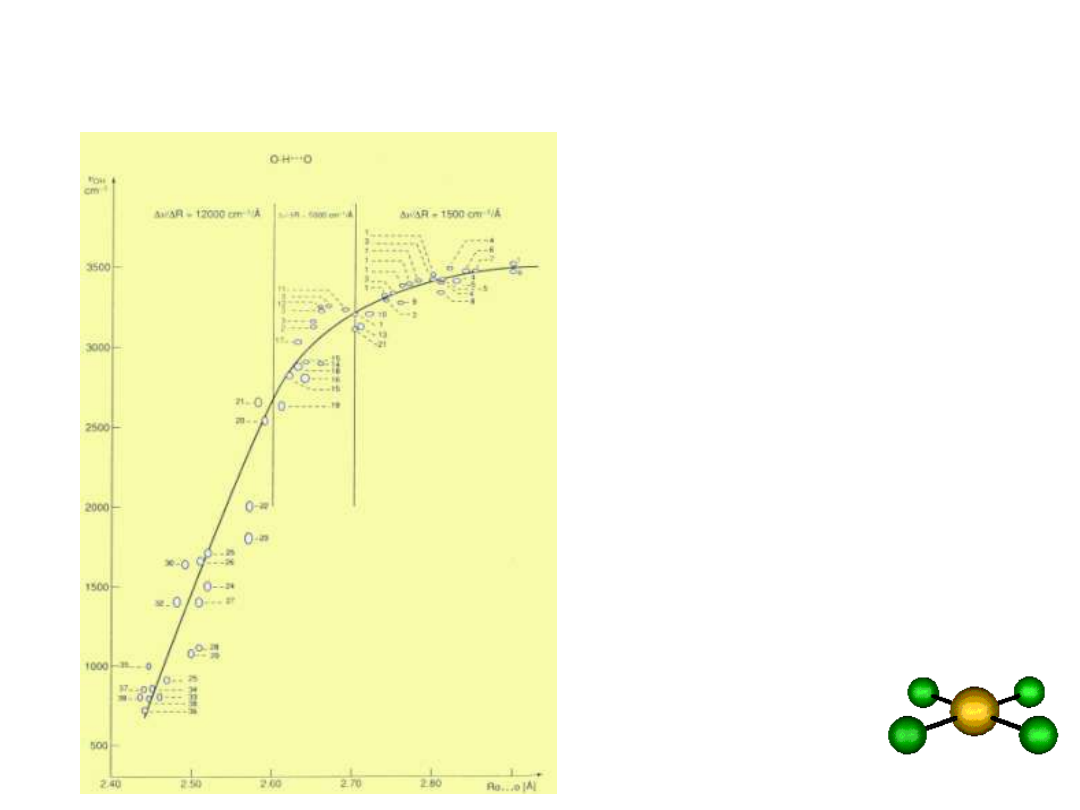
Korelacja OH) vs
R
O…O
wiązanie
wodorowe
silne średnie słabe
Novak; Structure and Bonding 18,
177, 1974
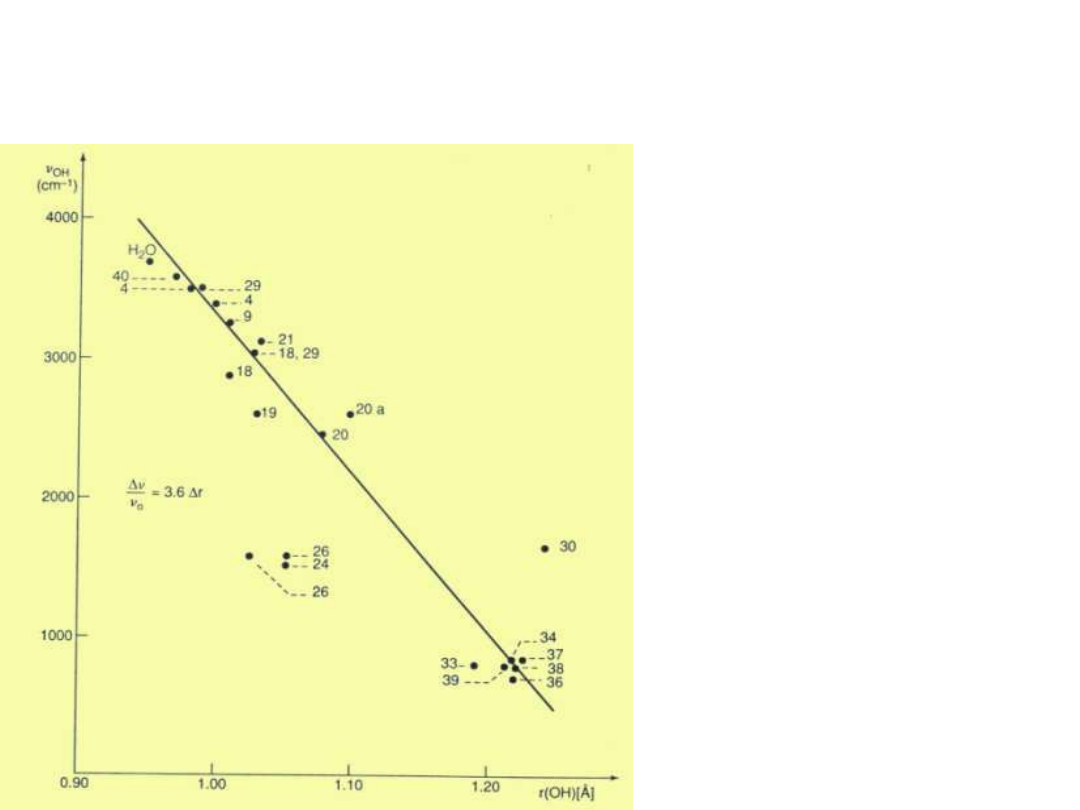
Zależność (O-H) vs r
O-H
Novak; Structure and
Bonding
18, 177, 1974
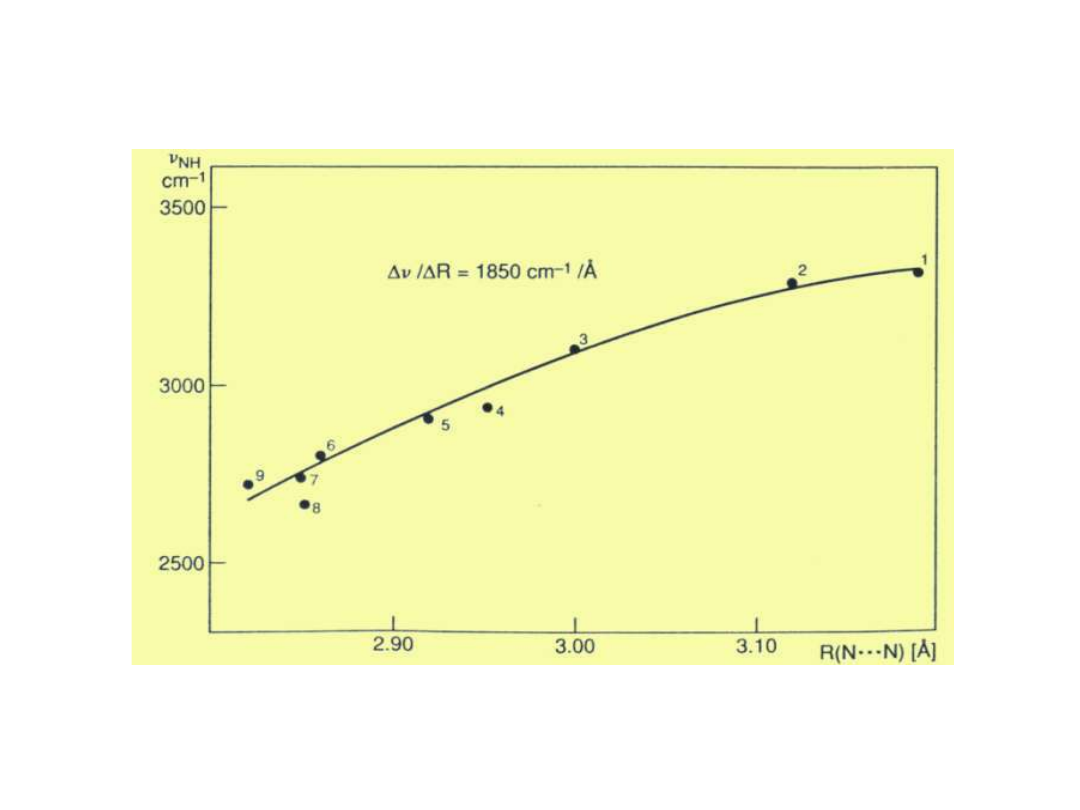
Zależność (N-H) vs R
N-(H)…N
Novak; Structure and Bonding 18,
177, 1974

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
IR Lecture1
Ir 1 (R 1) 127 142 Rozdział 09
IR and philosophy of history
iR Shell 3 9 User Guide
Ir 1 (R 1) 001 002 Okładka
Sprawko IR
Ir 1 (R 1) 197 198 Zalacznik 5 Nieznany
ET IR EZ PE 0607Zs1
IR 06 E Organizacja Ruchu Zasady stosowania sygnalizacji świetlnej 2009 [tryb zgodności]
IR(95) 1927 pl
af-wyk7, FIR UE Katowice, SEMESTR V, Analiza finansowa
Uczeń zdolny różni się od innych dzieci, Ir Ist. Pedagogika Resocjalizacja
fp-wyk7, UE Katowice FiR, finanse publiczne
IR(61) 1167 pl
instrukcja-porowatości metodą wagową , Ir. ETI MU, Mechanika środowiska
sprawozdanie organiczna nmr, ms, ir
więcej podobnych podstron