

Stany skupienia materii są efektem
oddziaływań międzycząsteczkowych
.
Tradycyjnie wyróżnia się trzy stany
skupienia według nomenklatury z XVII w. :
W czasach współczesnych dodano
czwarty stan:
gaz zjonizowany (plazma)
.

Lotny stan materii
Gaz
– stan skupienia materii, w
którym ciało fizyczne łatwo zmienia
kształt i zajmuje całą dostępną mu
przestrzeń.
Właściwości te wynikają z
własności cząsteczek, które w fazie
gazowej mają pełną swobodę ruchu.
Oddziaływania międzycząsteczkowe są
tak małe, że energia ruchu cząsteczek
umożliwia im dowolnie oddalenie się.

Lotny stan materii
Modelu gazu 3D w
którym cząsteczki
odziaływują ze sobą
tylko zderzeniami
idealnie
sprężystymi.

Równanie Clapeyrona
- równanie stanu gazu doskonałego
- równanie stanu opisujące związek pomiędzy
temperaturą, ciśnieniem i objętością gazu
doskonałego.
Sformułowane zostało w 1834 roku
przez Benoîta Clapeyrona.
Prawo to można wyrazić wzorem:
pV=nRT
p – ciśnienie,
V – objętość,
n – liczba moli gazu,
T – temperatura(bezwzględna), T [K] = t [°C] + 273,15
R – uniwersalna stała gazowa

Gaz doskonały
Ruch
cząsteczek w
modelu gazu
doskonałego.

Ciekły stan materii
Ciecz – stan skupienia materii, w
którym ciało fizyczne trudno
zmienia objętość, a łatwo zmienia kształt.

Ciekły stan materii
Istnienie cieczy ogranicza od strony niskich
temperatur
temperatura krzepnięcia…

Ciekły stan materii
…a od wysokich – temperatura wrzenia.

Własności cieczy:
lepkość,
gęstość,
napięcie powierzchniowe,
przewodność elektrolityczna,
duża rozszerzalność temperaturowa,
cząsteczki cieczy są ze sobą słabiej
powiązanie niż w ciałach stałych, ale
mocniej niż w gazach.

Stały stan materii
- ciało ma
stały kształt
(nie zmienia
go bez działania zewnętrznej siły
deformującej), podobnie zachowuje
się jej objętość.
Cząsteczki budujące ciało stałe są
mocno zbite i wykonują tylko
znikome ruchy. Przykład: kamień, lód,
węgiel, plastik, drewno.

Podział ciał stałych ze
względu na strukturę:

Ciała bezpostaciowe
(amorficzne)
nie wykazują
żadnych regularnych
płaszczyzn
ograniczających, nie
można w nich ustalić
prawidłowego
położenia cząstek.
Przykłady: szkło,
żywice, proszki.

Kryształy (monokryształy)
-
cząsteczki, atomy lub jony
nie mają pełnej swobody
przemieszczania się
w objętości ciała i zajmują
ściśle określone miejsca
w sieci przestrzennej –
mogą jedynie drgać
wokół położenia
równowagi.

Właściwości ciał
amorficznych:
w niektórych ciałach proces
krystalizacji w ogóle nie zachodzi,
np.:wosk, smoła,
w większości są to ciała izotropowe,
mogą być przezroczyste (szkło),
często traktuje się je z punktu
widzenia chemii fizycznej jako ciecze,
które w niskiej temperaturze uzyskały
lepkość tak dużą, że zatraciły płynność.

Właściwości kryształów:
anizotropia własności chemicznych i
fizycznych,
właściwości półprzewodnikowe
(krzem, german),
wysoka wytrzymałość mechaniczna,
wysoka temperatura wrzenia,
Ciepło właściwe rośnie w kolejności:
Metale
(miedź, stal) <
Ceramiki
(SiO2,Al2O3) <
Polimery
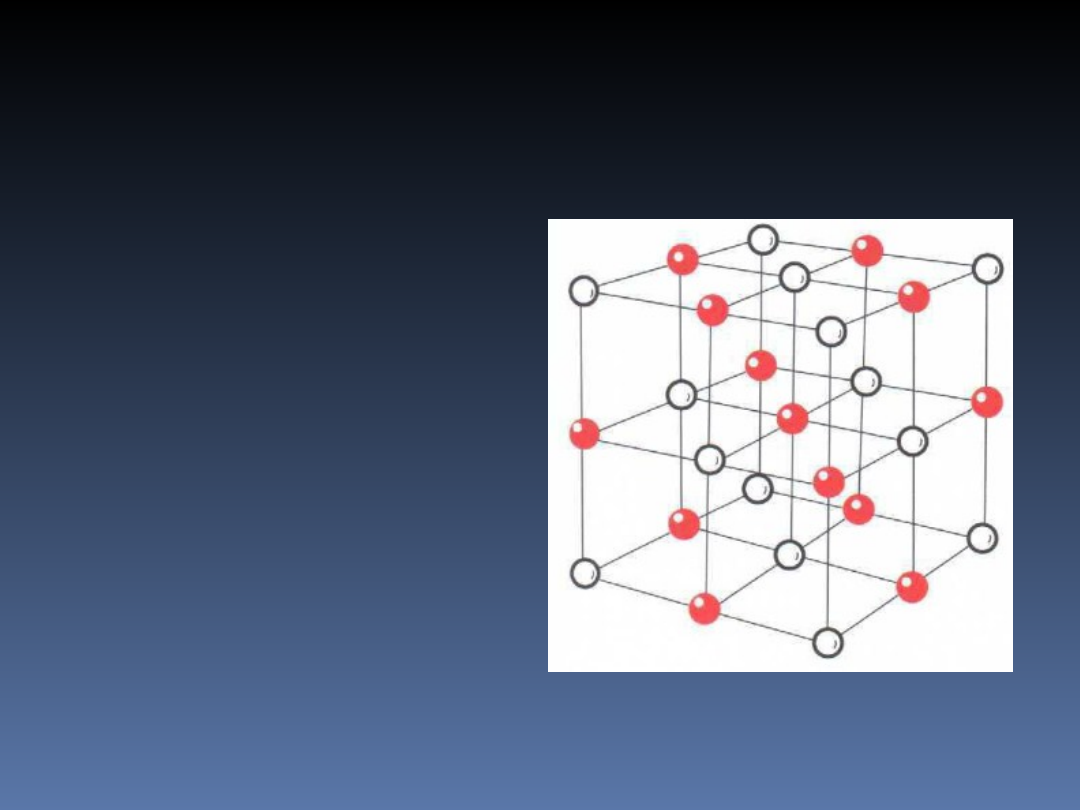
Stały stan materii
Ciało stałe
wyróżnia się
uporządkowanym
układem atomów
(cząsteczek), które
tworzą stałą
strukturę zwaną
siecią
krystaliczną.
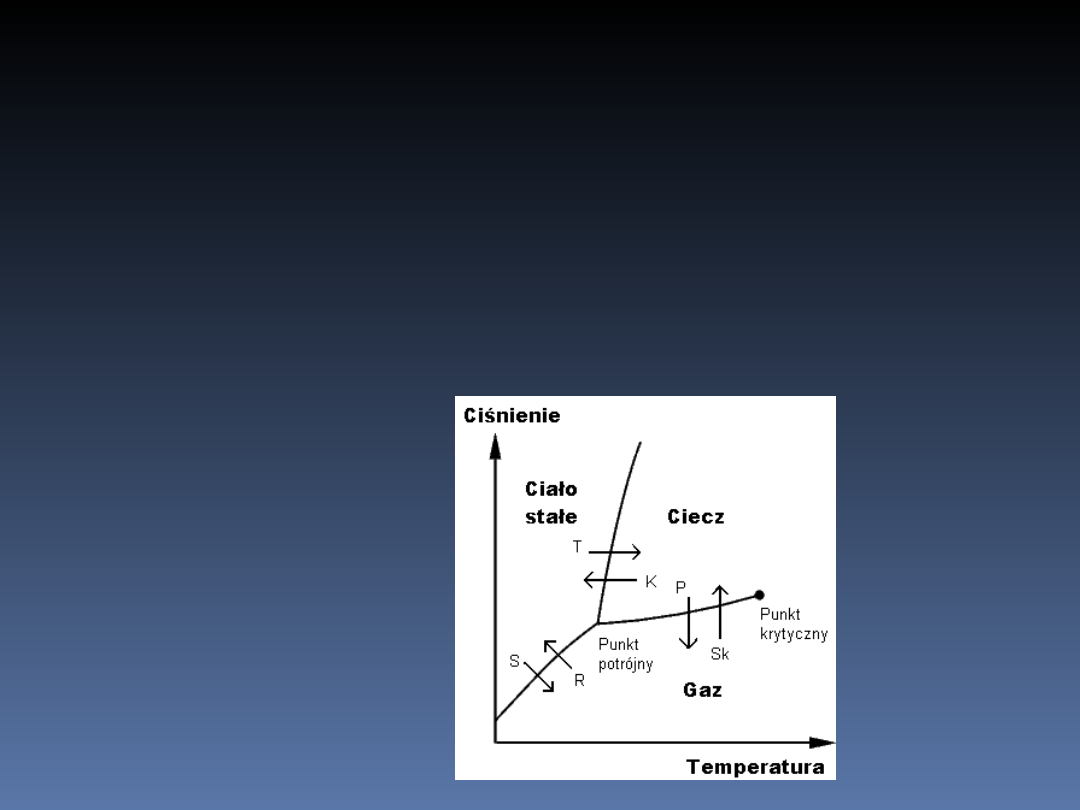
Przemiany międzyfazowe
W przypadku substancji składających się z
jednego rodzaju atomów lub cząsteczek,
które tak jak woda posiadają tylko trzy fazy
– krystaliczną, ciekłą i gazową, wykres
przemian międzyfazowych przybiera
postać:
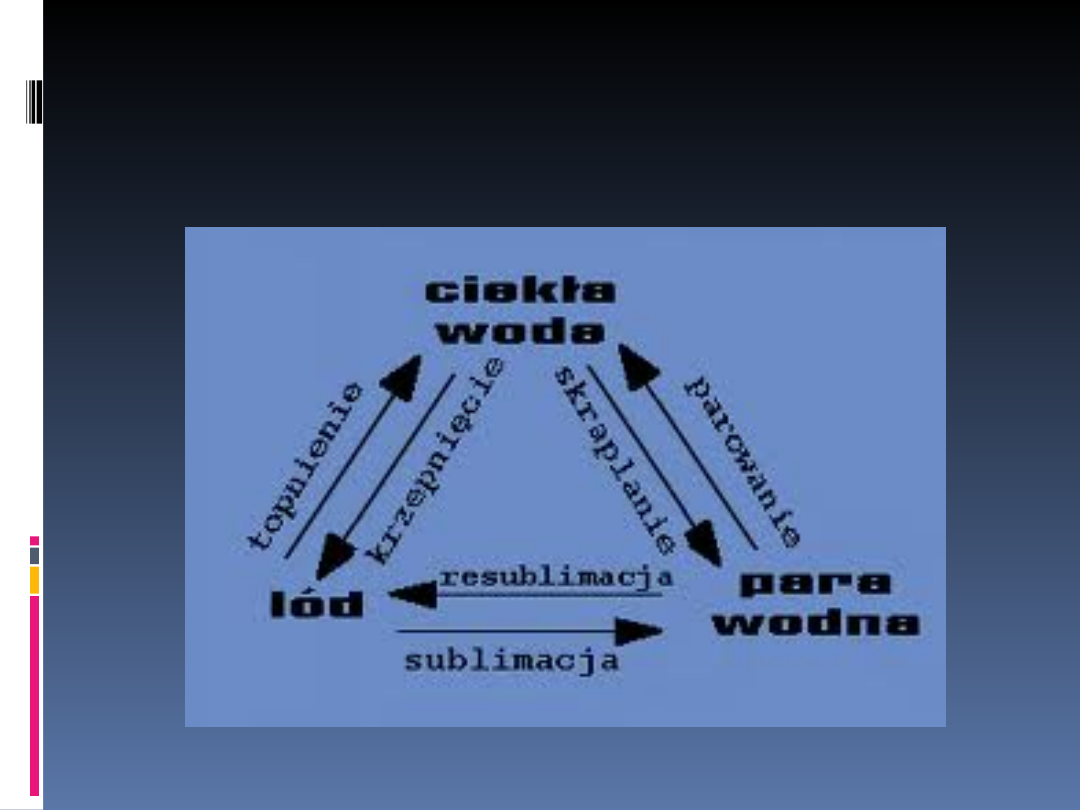
Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia

Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
a)
topnienie
-
przemiana
fazowa,
polegająca na
przejściu
substancji ze
stanu stałego w
stan ciekły.

Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
b)
krzepnięcie
- proces
przechodzenia ciała ze stanu ciekłego w
stan stały.

Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
c)
parowanie
- proces przechodzenia z
fazy ciekłej danej substancji w fazę
gazową (parę) zachodzący z reguły na
powierzchni cieczy

Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
d)
skraplanie (kondesacja)
- to
zjawisko zmiany stanu skupienia, przejścia
substancji z fazy gazowej w fazę ciekłą.
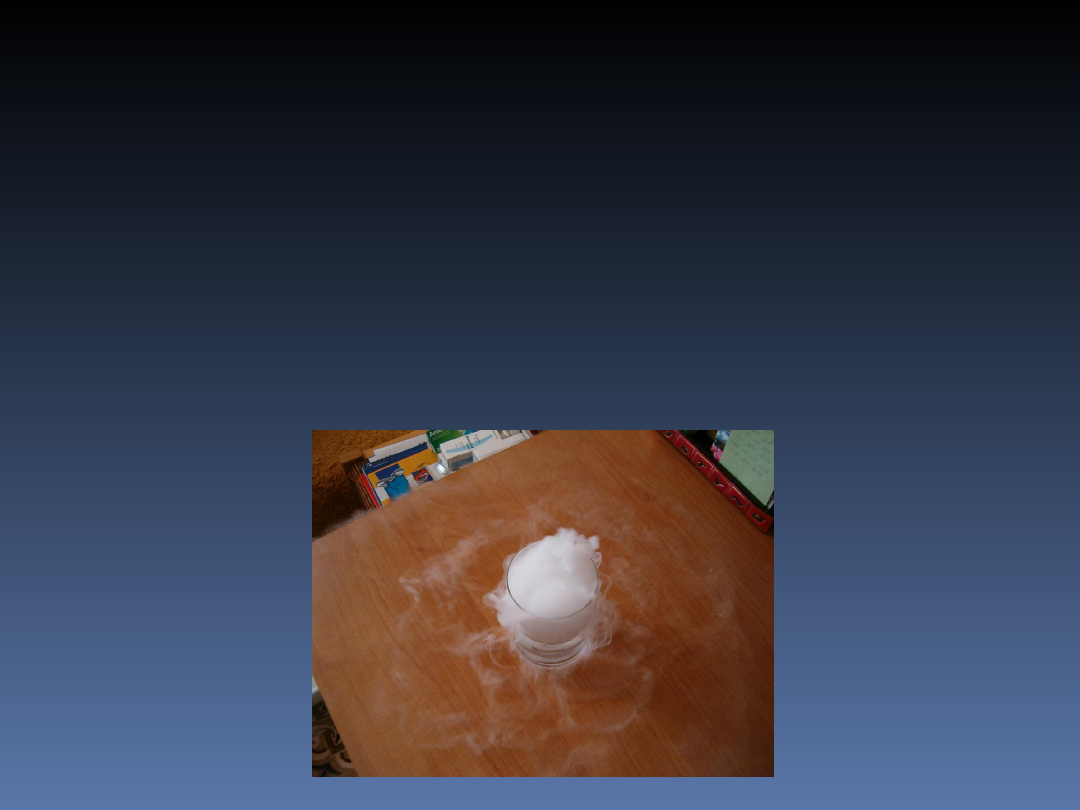
Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
e)
sublimacja
- to proces przejścia
substancji ze stanu stałego w stan gazowy
z pominięciem stanu ciekłego.
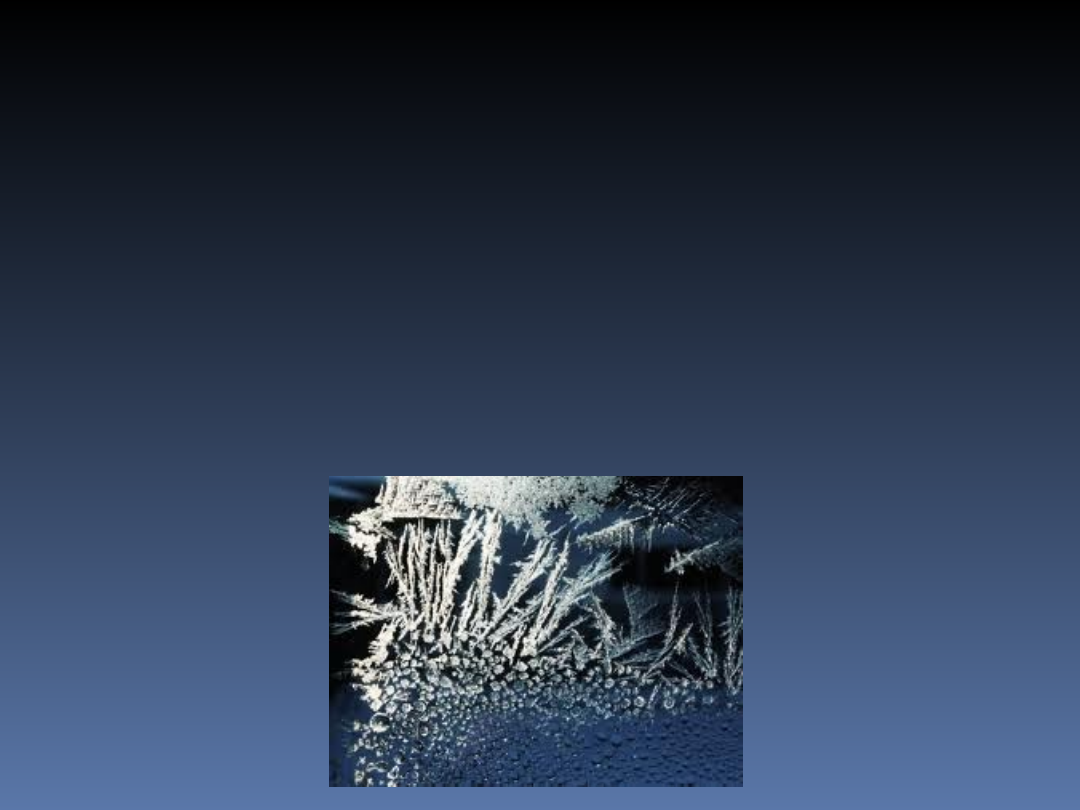
Zmiany cieplne zachodzące
miedzy trzema stanami
skupienia
f)
resublimacja -
bezpośrednie
przechodzenie substancji z fazy gazowej
(pary) w fazę stałą (przejście
fazowe).Resublimacja jest procesem
odwrotnym do sublimacji

Polimery
– substancje chemiczne o bardzo
dużej masie cząsteczkowej,
które składają się z wielokrotnie
powtórzonych jednostek
zwanych merami.
Polimery naturalne
są jednym z
podstawowych
budulców organizmów żywych.
Polimery syntetyczne
są podstawowym
budulcem tworzyw sztucznych
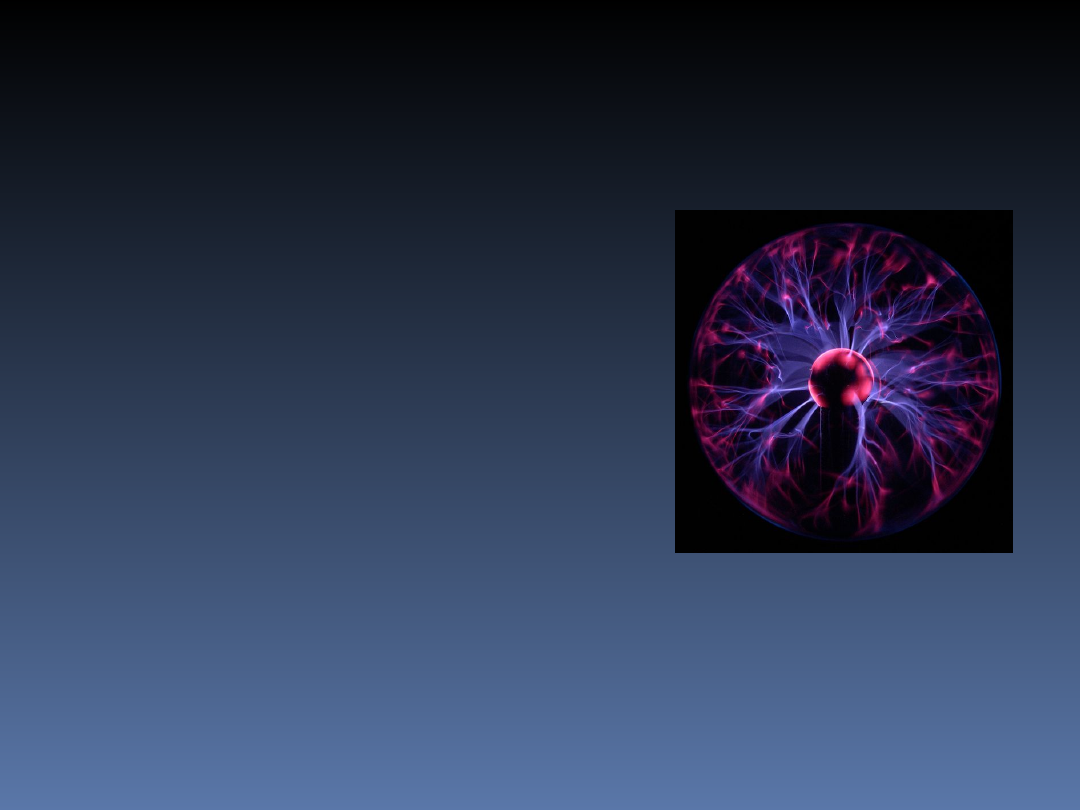
Plazma
Plazmę można rozpatrywać
jednocześnie jako ośrodek
ciągły (podobny do
własności cieczy) oraz jako
ośrodek składający się z
dużych zbiorów
pojedynczych cząstek
(podobnie jak gaz).
Nie jest to więc ani ciecz
ani gaz i plazmę traktujemy
jako
czwarty stan skupienia
materii
.

Plazma
Na skutek termicznych ruchów jonów,
elektronów, atomów lub cząsteczek w
plazmie występują chaotyczne, chwilowe
niejednorodności przestrzennego
rozmieszczenia ładunków.
Te niejednorodności wywołują w plazmie
szereg specyficznych zjawisk, dlatego
plazmę nazywamy
quasi-obojętny
elektrycznie
.

Plazma
Każda substancja w
odpowiednio
wysokiej
temperaturze może
przejść w stan
plazmy w wyniku
termicznej jonizacji.
Plazma powstaje w
czasie
wyładowania
atmosferycznego.

Plazma
W bardzo wysokich
temperaturach
(powyżej miliona
Kelwinów) materia
jest już całkowicie
zjonizowana i taki
stan materii
występuje w
jądrze
Słońca
i innych
gwiazd. Plazmą jest
również
obszar
międzygwiezdny
.
Plazma
W warunkach ziemskich plazma
występuje rzadko. Można ją spotkać w:

Bibliografia:
Materiałoznawstwo, Stanisław
Rudnik;
Chemia ogólna, Loretta Jones,
Peter Atkin;
Fizyka. Repetytorium, Andrzej
Persona.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
Właściwości fizyczne materiałów budowlanych
SERCE2, Wychowanie Fizyczne (materiały i notatki)), Anatomia
2 koło, Geodezja, Geodezja fizyczna, materiały
Antropologia - Zestawy Egzaminacyjne 1, Wychowanie Fizyczne (materiały i notatki)), Antropologia
Anatomia - Układ pokarmowy, Wychowanie Fizyczne (materiały i notatki)), Anatomia
Stany fizyczne polimerów
Cechy fizyczne materia é w CZ 1
1 Stany skupienia materii Zdefiniować pojęcie płynu
SEJSMIKA I MET BADANIA NIECIĄGŁOŚCI, Geodezja, Geodezja fizyczna, materiały
Projekt nr 2-m.zabawowa, Wychowanie Fizyczne (materiały i notatki)), Metodyka wychowania fizycznego,
Anatomia - Czynności mięśni, Wychowanie Fizyczne (materiały i notatki)), Anatomia
Układ pokarmowy, Wychowanie Fizyczne (materiały i notatki)), Anatomia
Wlasc fizyczne1 1, Materiały Budowlane
Cechy fizyczne materialow id 10 Nieznany
METODY MONITORINGU OBIEKTOW INZYNIERSKICH NA TERANACH AKTYWNYCH SEJSMICZNIE, Geodezja, Geodezja fizy
Anatomia - Rdzeń Przedłużony, Wychowanie Fizyczne (materiały i notatki)), Anatomia
Pytania z fizycznej, Materiały
Właściwości fizyczne materiałów budowlanych
więcej podobnych podstron