wd_2
1
Wykład 2
Peptydy i białka:
klasyfikacja, budowa,
funkcje.
wd_2
2
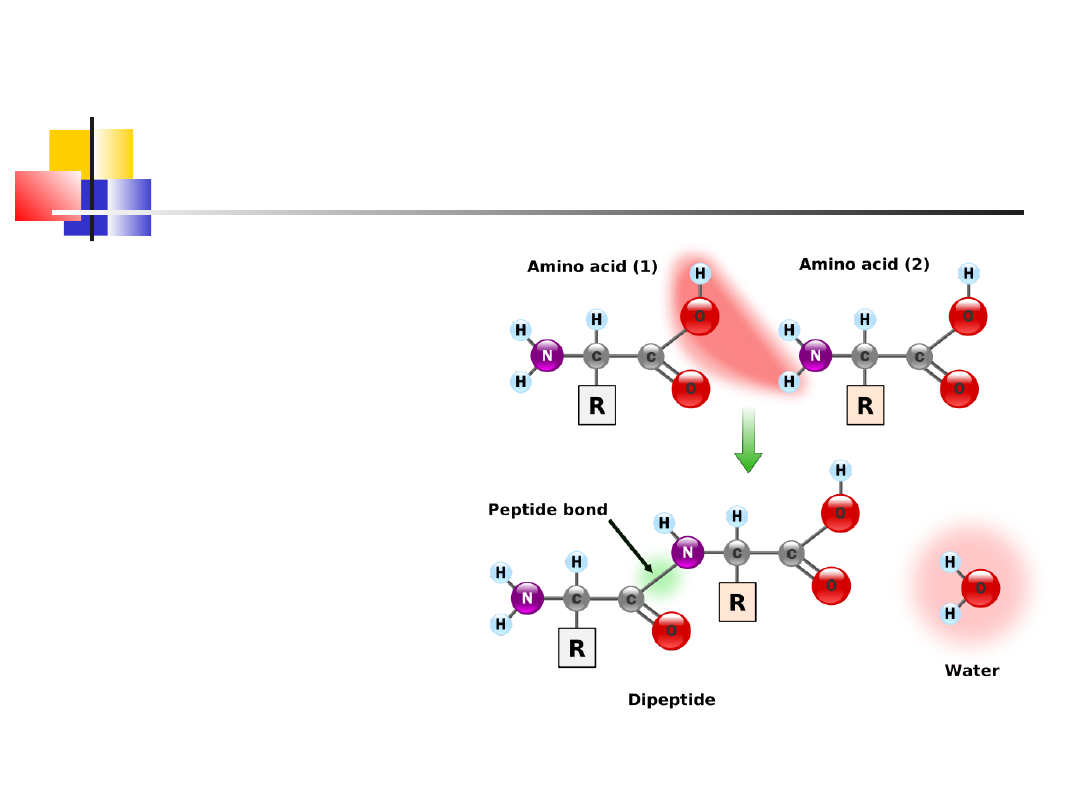
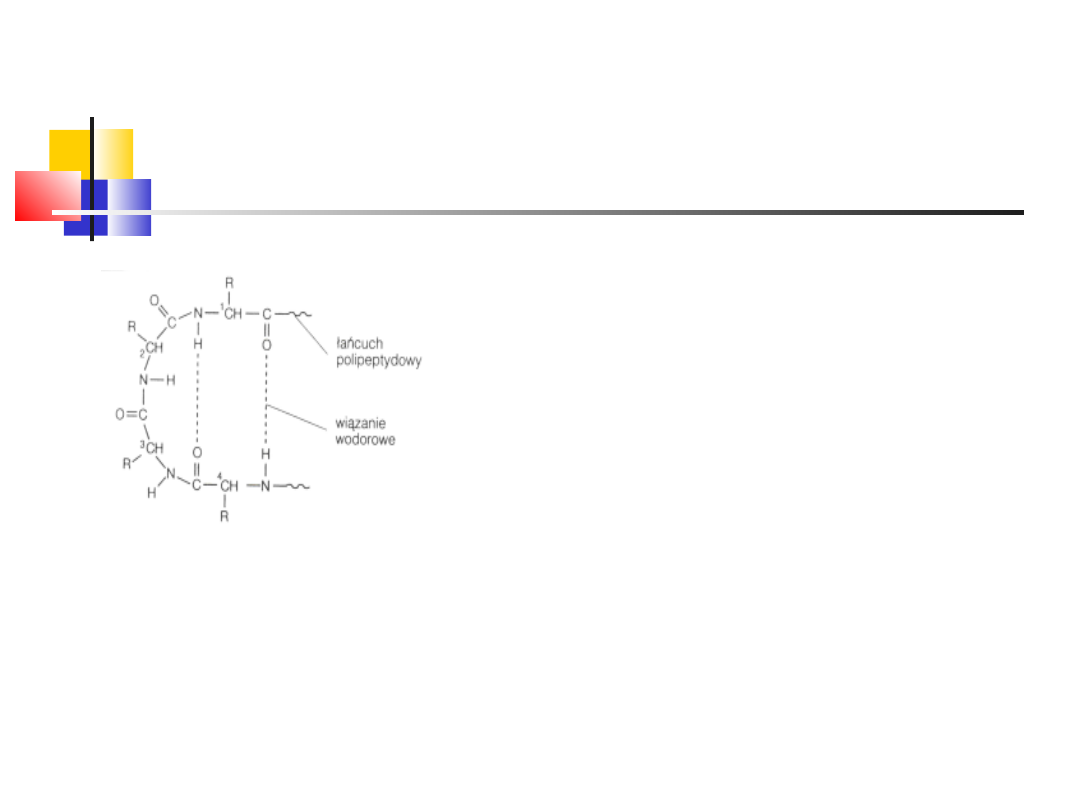
Wiązanie peptydowe
Wiązanie peptydowe
(amidowe), powstaje
na drodze
kondensacji grupy
-aminowej i -
karboksylowej
2
aminokwasów
–
powstaje dipetyd i
H
2
O
wd_2
3
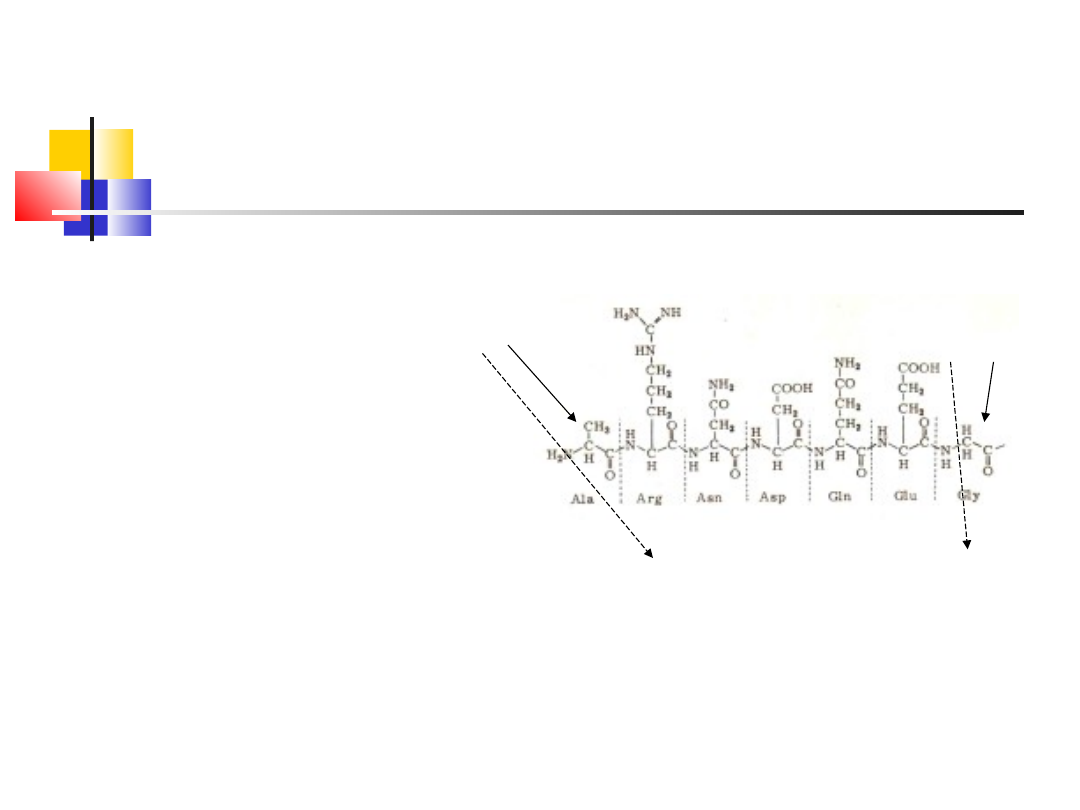
Sekwencja aminokwasów
N-koniec
Sekwencja: Ala-Arg-Asn-Asp-Gln-Glu-Gly
C-koniec
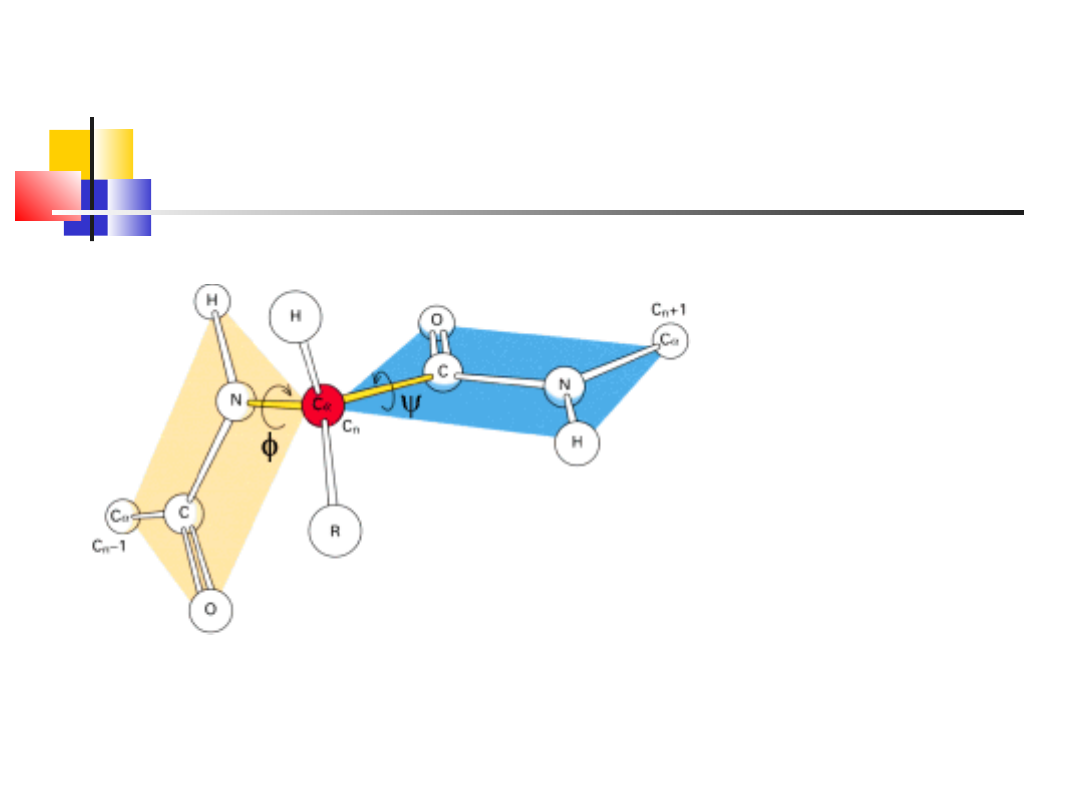
Wiązanie peptydowe jest
płaskie, ma charakter wiązania
podwójnego – nie ulega rotacji
Wiązania z udziałem C<a>
mogą ulegać rotacji(psi, phi),
umozliwiając zwijanie się białek
na rózne sposoby
Nie wszystkie wartości kątów
psi, phi są dozwolone –
występują zwady przestrzenne
Powstanie wiązania
peptydowego wymaga
dostarczenia energii. Wiele
aminokwasów tworzy łańcuch
peptydowy, kolejność
aminokwasów to sekwencja
aminokwasów, poczynając od
aminokwasu z wolną grupą
<a>-aminową – N-koniec
peptydu.
wd_2
4
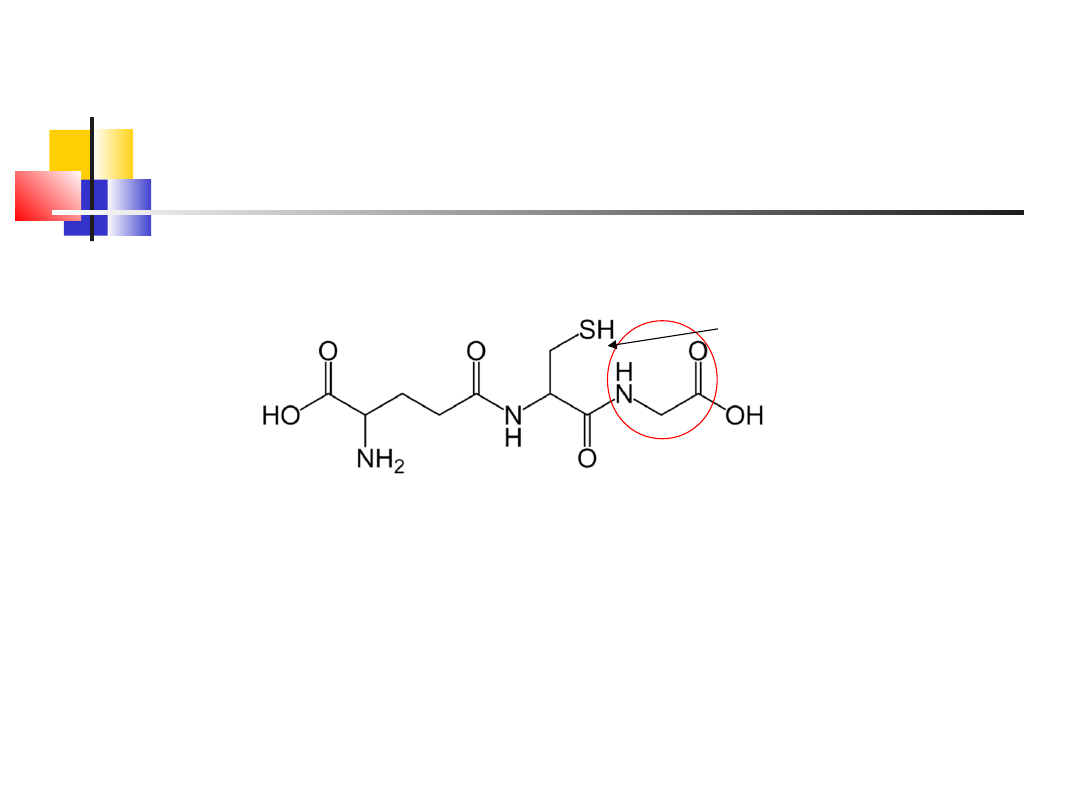
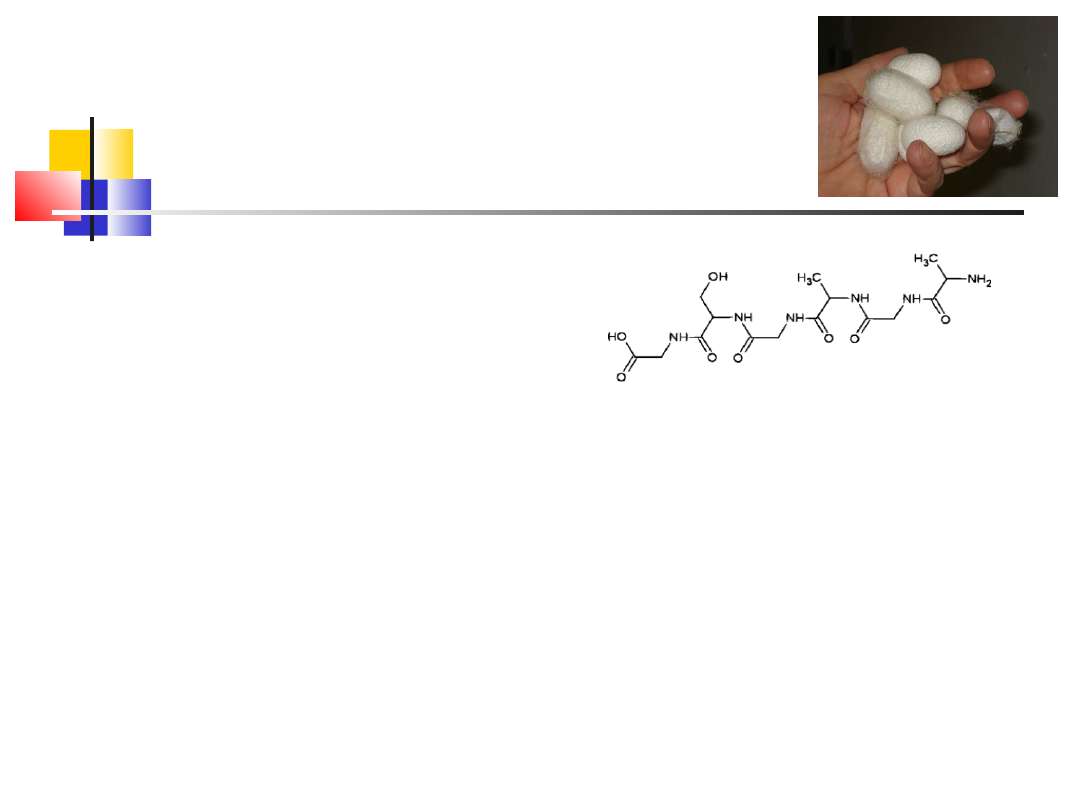
Przykłady
oligopeptydów
glutation
- tripeptyd - pełni funkcje przy regulacji
potencjału redox w komórce, usuwa szkodliwe nadtlenki
(reakcja)
Glutation GSH:
Reakcja:
2GSH + ROOH→ GSSG +H
2
O + ROH
Glu
Cys
Gly
w. peptydowe
wd_2
5
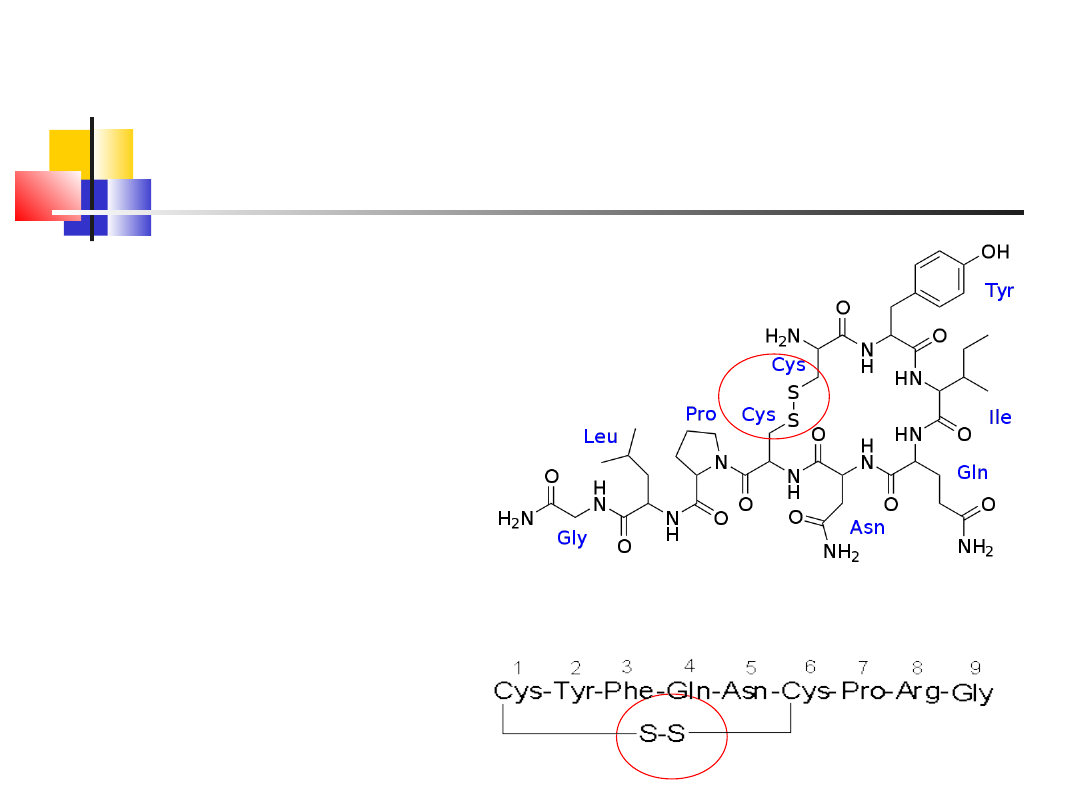
Hormony peptydowe
wazopresyna
oksytocyna
Oksytocyna – hormon
cykliczny z 9 aa –
dzięki mostkowi -S-S-
reguluje skurcze
macicy i gruczołów
mlekowych
Wazopresyna – hormon
cykliczny z 9 aa –
dzieki mostkowi -S-S-
stymuluje i reguluje
resorbcję wody w
nerkach
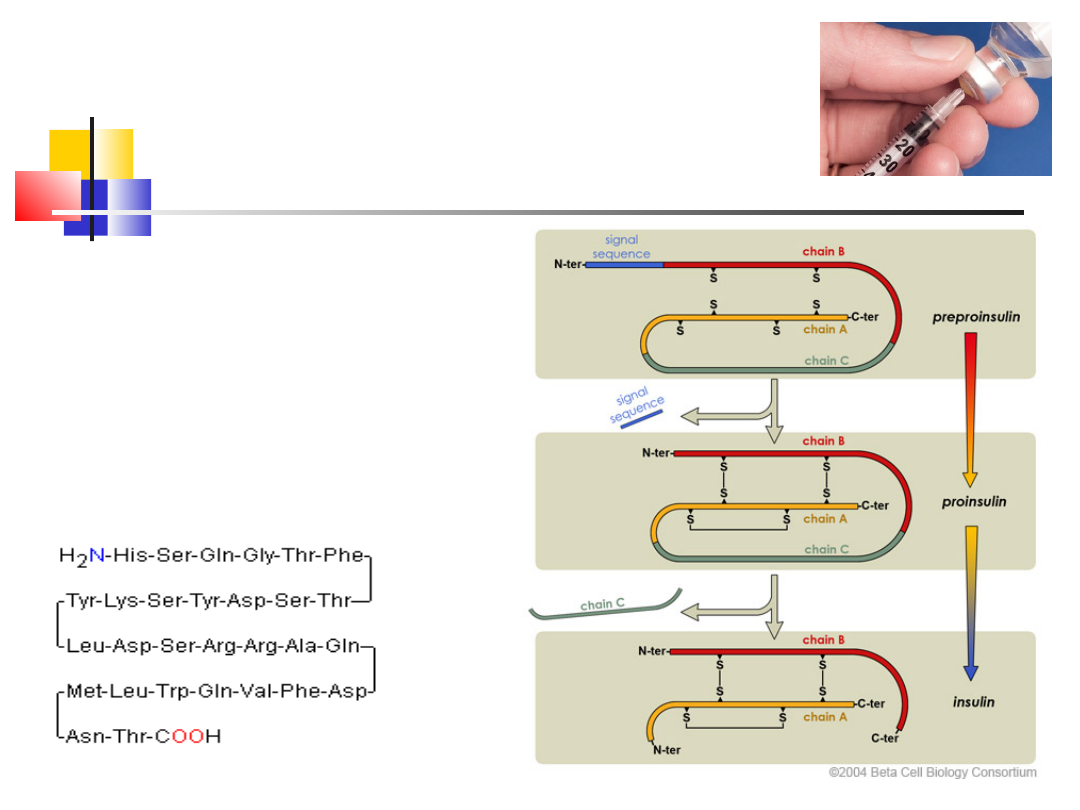
Hormony peptydowe cd.
35 aa
Insulina – hormon
regulujący poziom cukru
we krwi, (HI – 51 reszt AA)
Glukagon – (29 AA)
hormon mający działanie
przeciwstawne do insuliny
wd_2
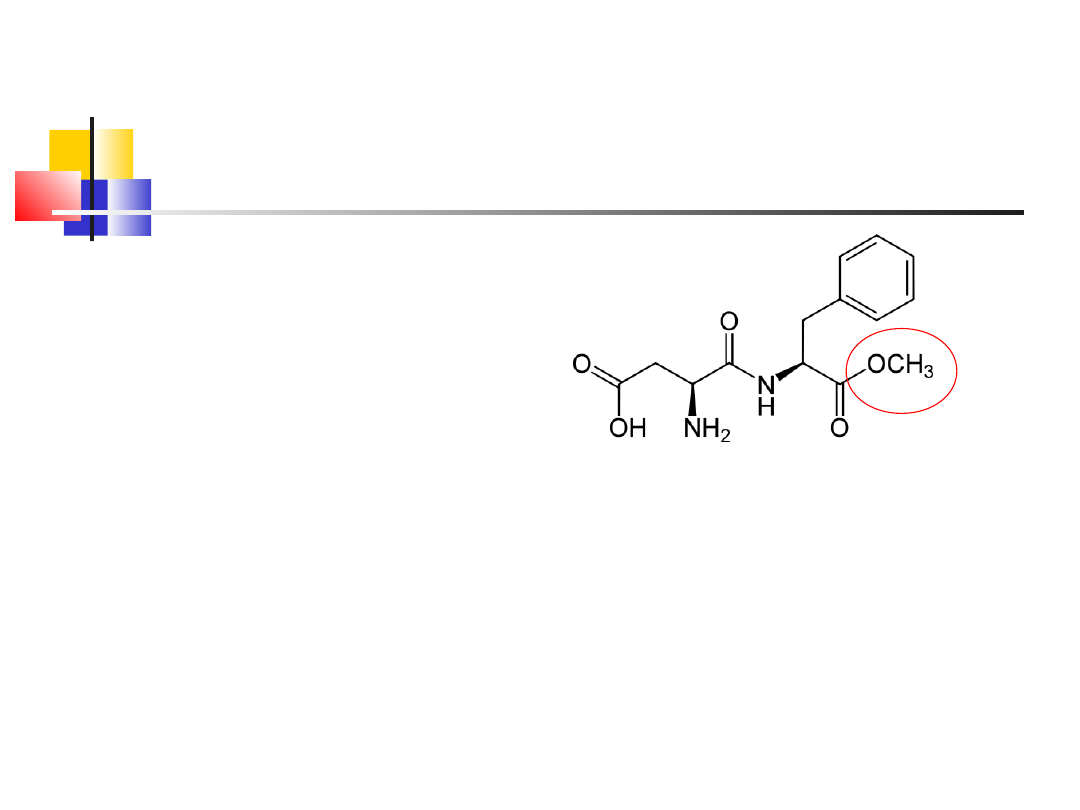
7
E951
aspartam
Asp
Phe
Aspartam (E951) – słodki
peptyd (ester metylowy
dipeptydu), zastąpił
sacharynę w słodzikach –
200x słodszy niż sacharoza –
napoje gazowane
"dietetyczne" znanych firm,
wędliny, mięsa
Stosowany przez diabetyków
Po rozkładzie powstaje
alkohol metylowy i
fenyloalanina (niewskazana
dla chorych na
fenyloketonurię)
wd_2
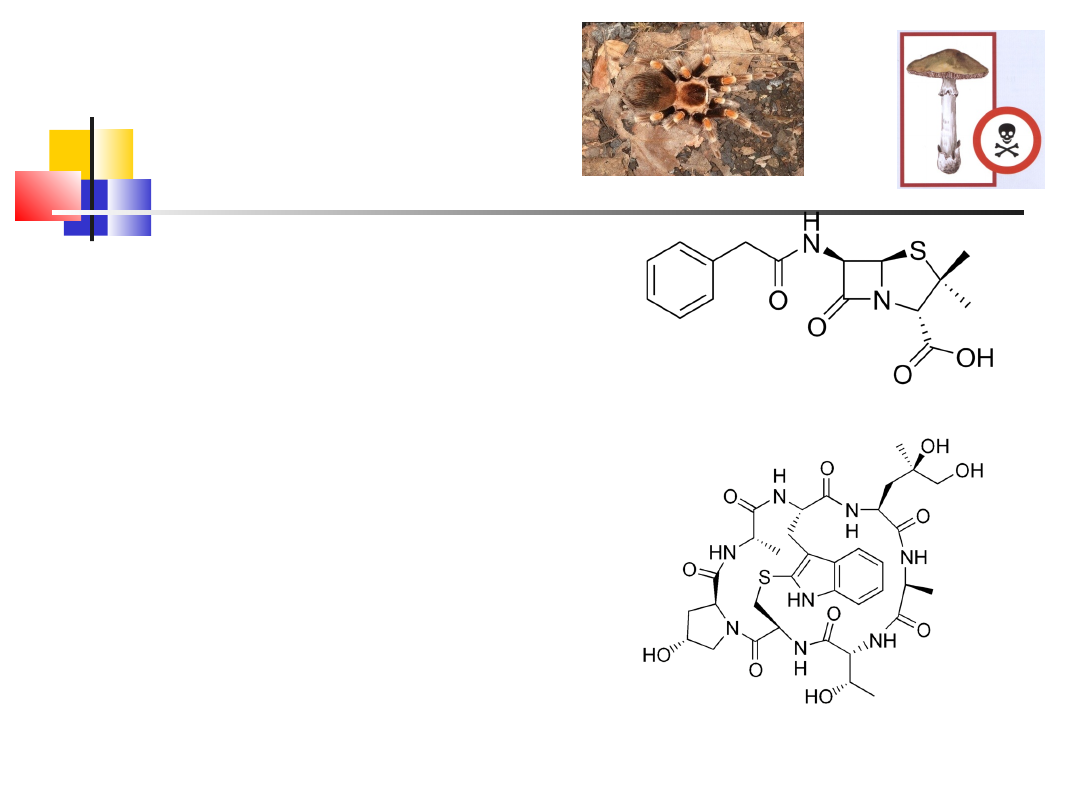
8
Inne peptydy
falloidyna
Penicylina G
-penicyliny – antybiotyki peptydowe
– hamują syntezę ściany
komórkowej bakterii (np. Penicylina
G – benzylopenicylina)
-fallotoksyny i amatotoksyny –
mikotoksyny z muchomora
sromotnikowego
-argiopinis, argiotoksyna, klawamina
– toksyny jadu tarantuli
Toksyny dzięki odmiennej strukturze
niż peptydy białkowe, nie są łatwo
trawione w organizmie, poza tym
wykazują specyficzne działanie
wd_2
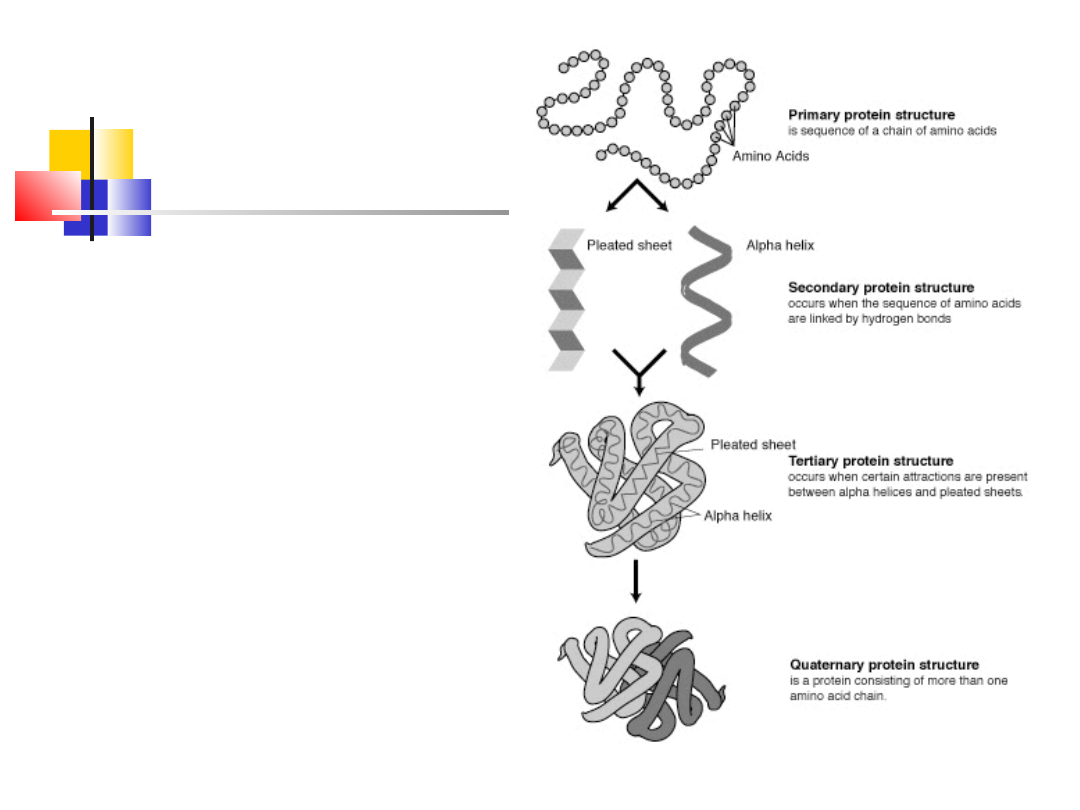
9
Struktury
białka
Białko to polipeptyd
złożony z co najmniej
100 reszt
aminokwasowych
przyjmujących
określoną konformację
przestrzenną, jego
masa cząsteczkowa
zwykle przekracza
10000 Da
wd_2
10
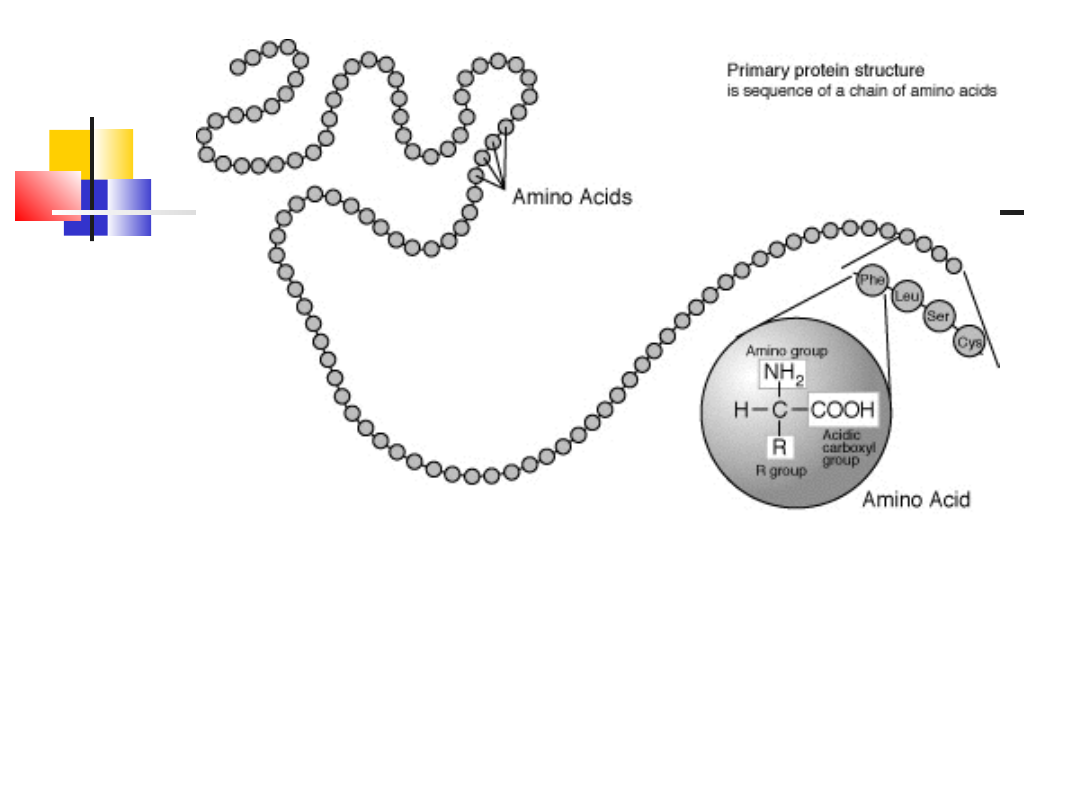
Struktura I-rzędowa:
Struktura
pierwszorzędowa :
zapisana w genach,
zwana również
strukturą pierwotną –
jest określona przez
sekwencją (kolejność)
aminokwasów w
łańcuchu białkowym –
powstaje na
rybosomach w
procesie translacji,
utrzymywana przez
silne wiązanie
kowalencyjne –
wiązanie peptydowe
wd_2
11
Struktur
a
I-
rzędowa
Struktura pierwszorzędowa : zapisana w genach, zwana również strukturą
pierwotną – jest określona przez sekwencją (kolejność) aminokwasów w
łańcuchu białkowym – powstaje na rybosomach w procesie translacji,
utrzymywana przez silne wiązanie kowalencyjne – wiązanie peptydowe
wd_2
12
Struktura I-rzędowa
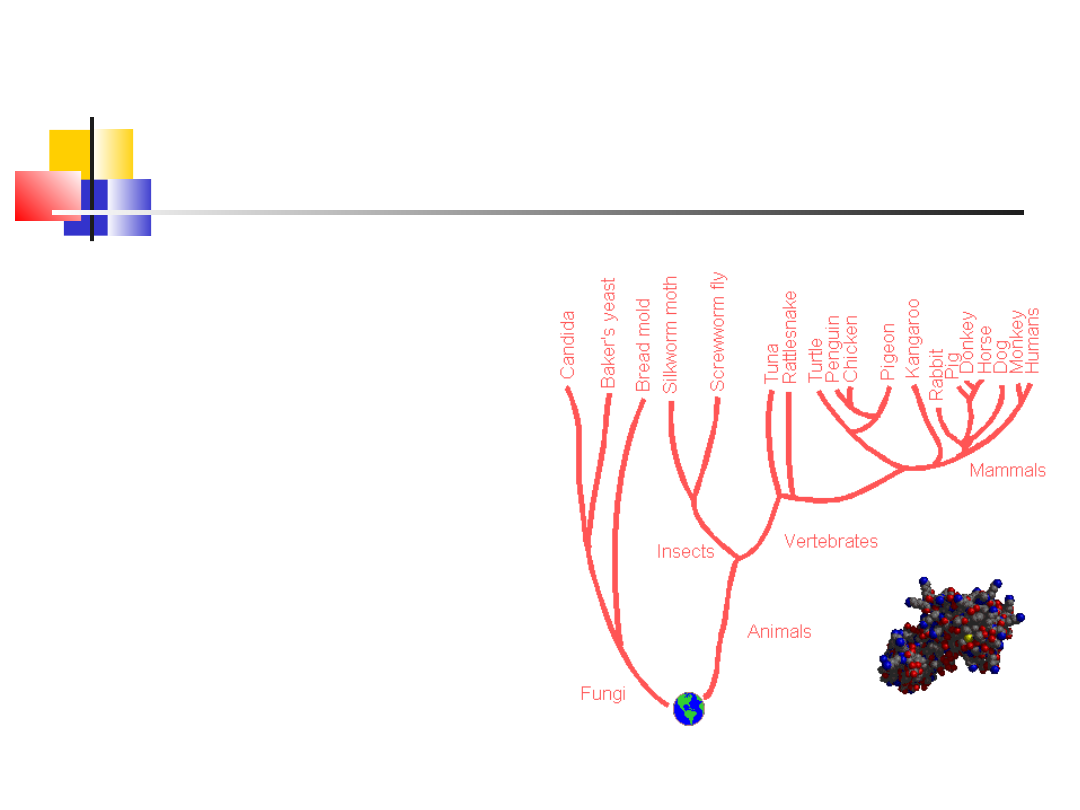
Często białka o podobnej funkcji, nawet
u róznych organizmów, mają identyczną
sekwencją aminokwasową, np: enzymy
proteolityczne:
-chymotrypsyna
-trypsyna
-elastaza
-trombina
posiadają powtarzającą się sekwencję
aminokwasów: -Gly-Asp-Ser-Gly-
Na podstawie różnic w sekwencji
pierwszorzędowej można wykonać
drzewo filogenetyczne i określić stopień
pokrewieństwa organizmów. (Cytochrom
C)
Skład aminokwasowy wybranych białek

wd_2
13
Struktura drugorzędowa białka
Rodzaje:
-helisa
Harmonijka
Struktura spinki do
włosów
Struktura drugorzędowa
białka
są to lokalne struktury
powstające w wyniku
tworzenia się wiązań
wodorowych pomiędzy
tlenem grupy -C=O a
wodorem grupy -NH dwóch
niezbyt odległych od siebie
w łańcuchu w obrębie tego
samego łańcucha
polipeptydowego
wd_2
14
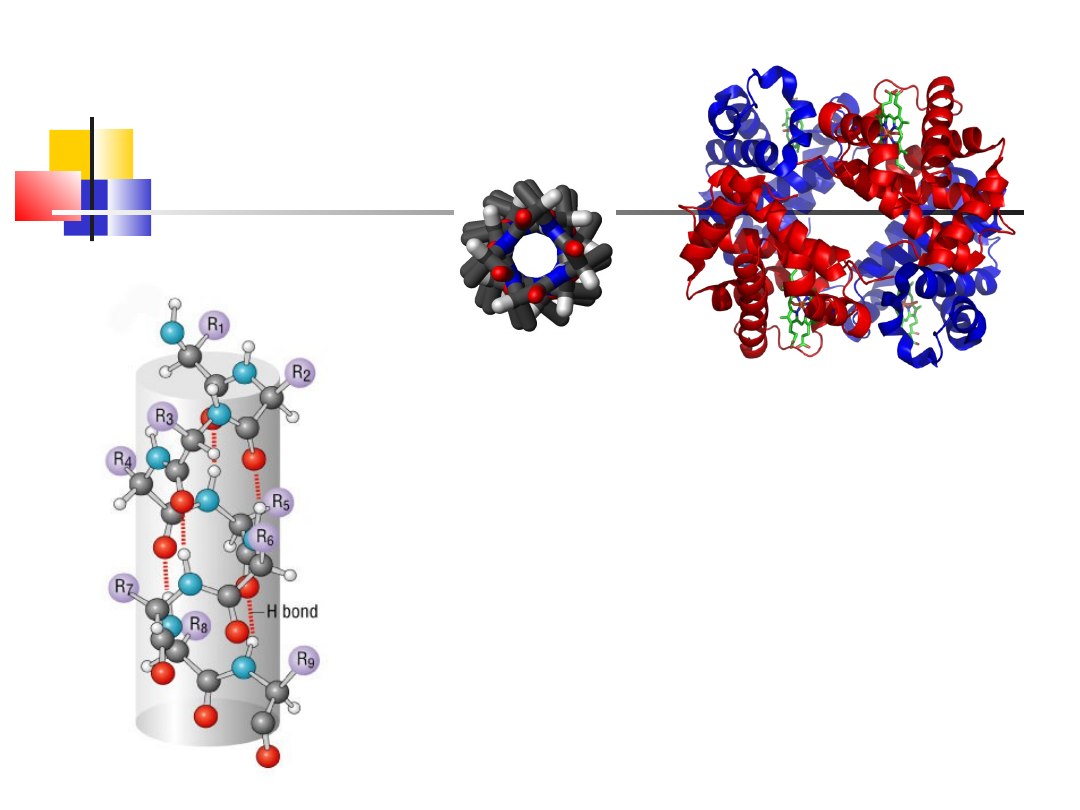
Struktura
II-rzędowa
-helisa
hemoglobina
Pełny skręt 3,6 reszt aa
Utrzymywana dzięki w. wodorowym
- helisa jest prawoskrętna
(lewoskrętna helisa występuje
bardzo rzadko w związku z występowaniem zwad przestrzennych,
przy skręcaniu się wiązać psi, phi)
wd_2
15
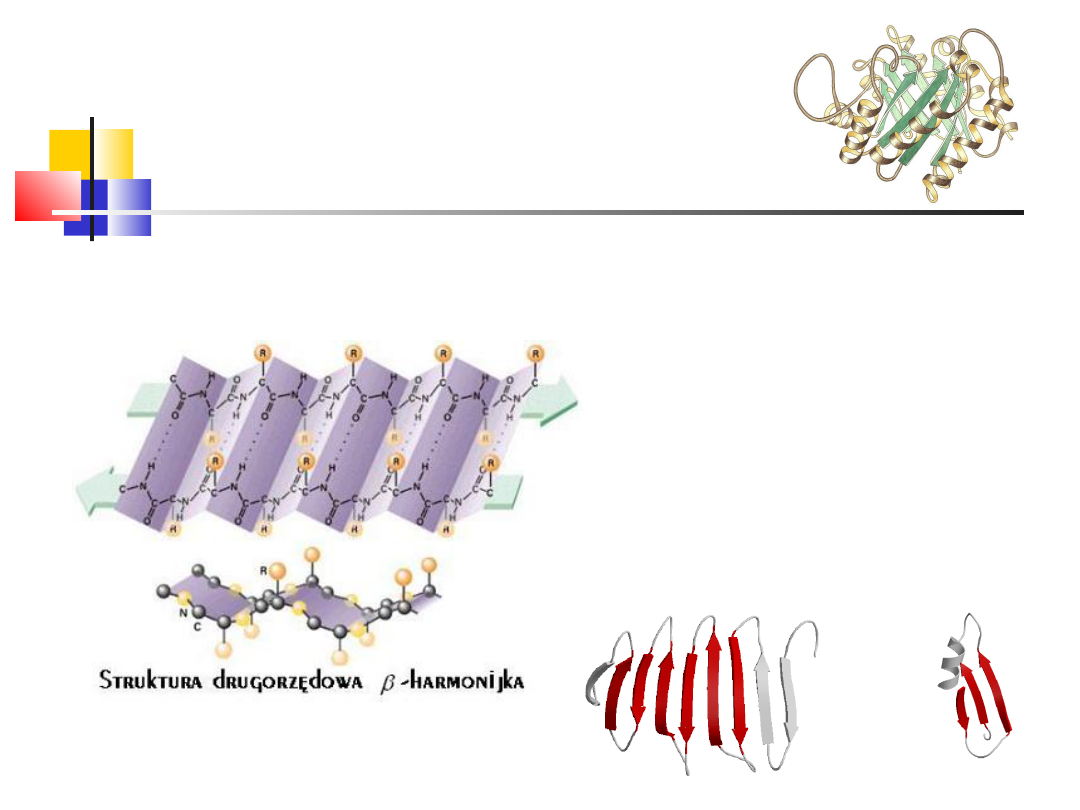
Struktura II-
rzędowa
harmonijka - "pofałdowanej kartki"
Utrzymywana dzięki w.
wodorowym
antyrównoległa
równoległa
Izomeraza triozofosforanowa
wd_2
16
zwrot pętla Ω - zakręty
łańcucha,
Struktura II-
rzędowa
Zwrot <b>
spowodowany jest
często obecnością
Pro, Gly, Asn
Zwroty <b>
występują na
powierzchni białek z
innymi białkami lub
ligandami
wd_2
17
Przykłady białek
z II-rzędowa strukturą
Fragment fibroiny
gly ser gly ala gly
ala
Białka włókniste (fibrylarne):
Fibroina 40% Gly, 26% Ala, 12%
Ser, antyrównoległe harmonijki
<b> - ułożone jedna nad drugą –
tworzą włókna – pajęczyna, jedwab
Keratyna (włosy, paznokcie, pióra)
– helisa <a>, pary helis oplatają
sie wokół siebie
helisę <a> keratyny można
mechanicznie rozciągnąć do
harmonijki <b>
mostki disulfidowe utrzymują
charakterystyczną strukturę (14%
Cys we włosie ludzkim)
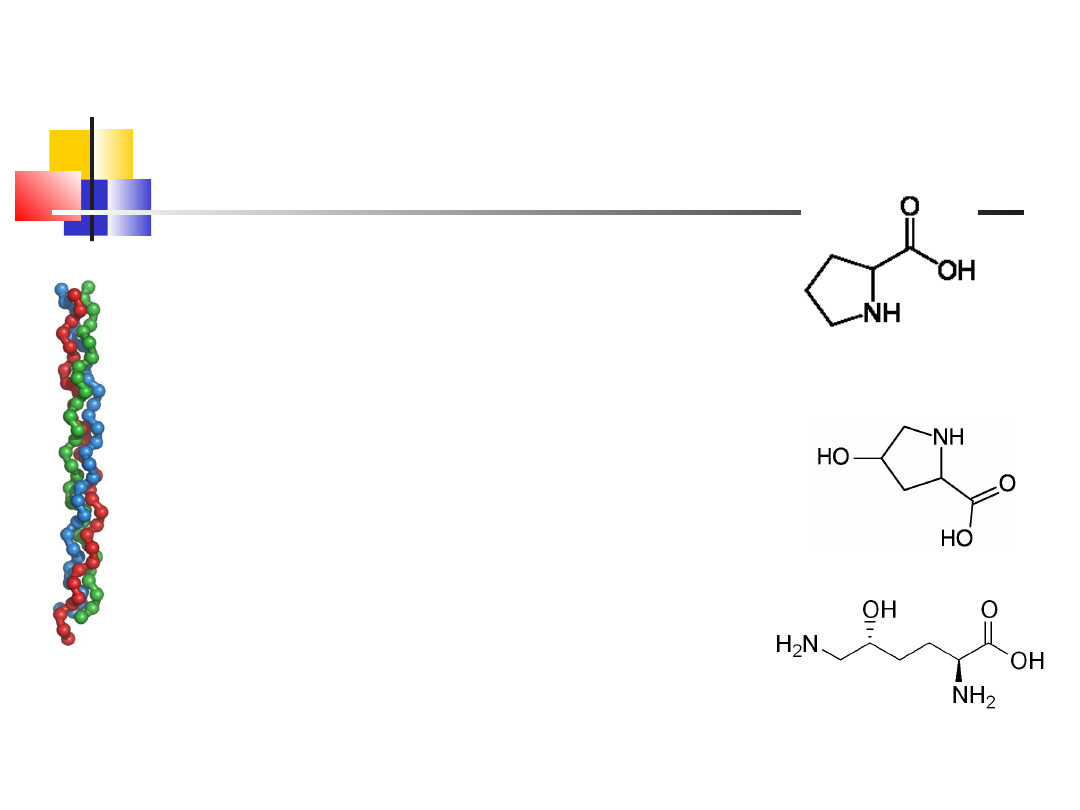
wd_2
18
Przykłady białek z II-rzędowa
strukturą
4-hydroksyprolina
prolina
5-hydroksylizyna
Trwała ondulacja: rozrywanie -S-S- i formowanie
nowych, nienaturalnych wiązań disiarczkowych
kreayna słabo rozpuszcza się w roztworach
wodnych
Kolagen – (gr. Kolla – klej) główny element
struktury kości, ścięgien, wiązadeł, skóry i naczyń
krwionośnych, składa się głównie z powtarzających
się sekwencji Gly-Pro-Y i Gly-X-Hyp gdzie X i Y to
reszty dowolnych aa, Hyp – hydroksyprolina (w
kolagenie skóry: Gly 33%, Pro 13%, Hyl 0,6%)
dodatkowe grupy -OH stabilizują kolagen
(mozliwość wytworzenia dodatkowego wiązania
wodorowego)
Hydroksylacja aminokwasów następuje po
translacji białka
Budowa: 3 lewoskrętne helisy (1 skręt 3,3 reszty
aa), tworzące prawoskrętną superhelisę ("lina
okrętowa")
wd_2
19
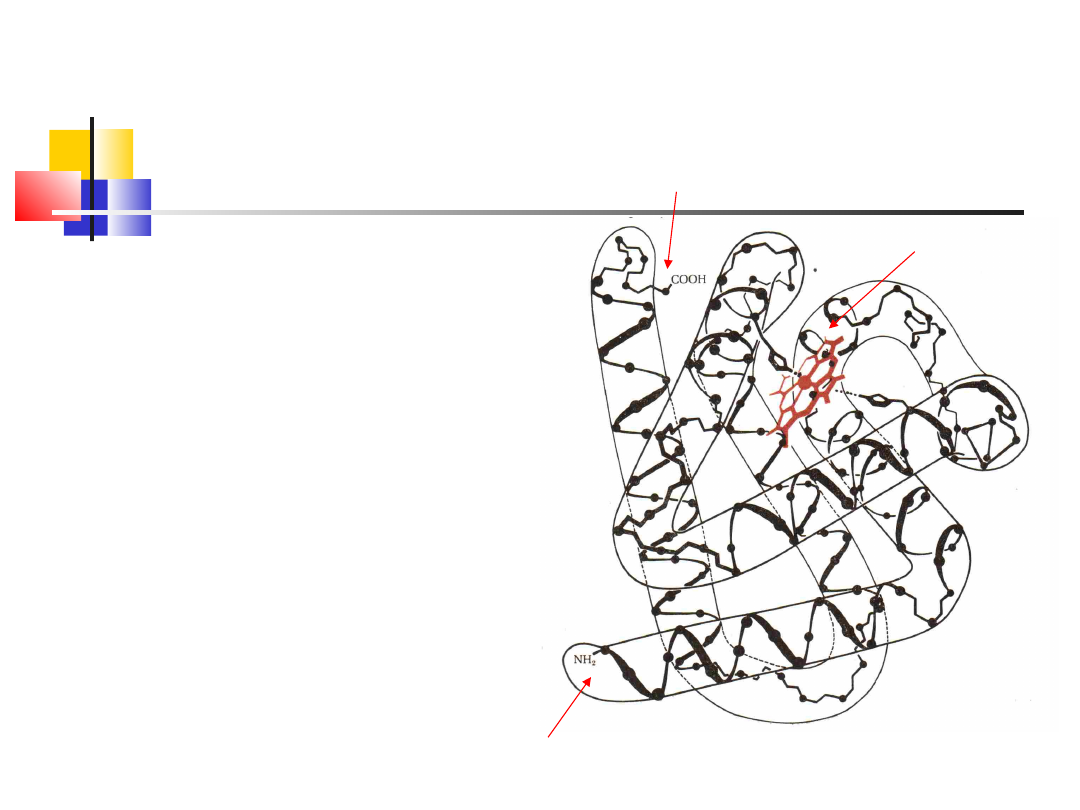
Struktura trzeciorzędowa białka
– białka globularne
mioglobina
C-koniec
N-koniec
Hem
Wzajemne położenie elementów
struktury drugorzędowej
stabilizowane przez oddziaływania
hydrofobowe reszt
aminokwasowych, tworzenie
mostków dwusiarczkowych -S-S-,
powstających pomiędzy dwiema
resztami cysteiny w łańcuchu,
wiązania wodorowe, siły van der
Waalsa między łańcuchami
alifatycznymi reszt
aminokwasowych i oddziaływania
elektrostatyczne między
przeciwstawnie naładowanymi
grupami.
wd_2
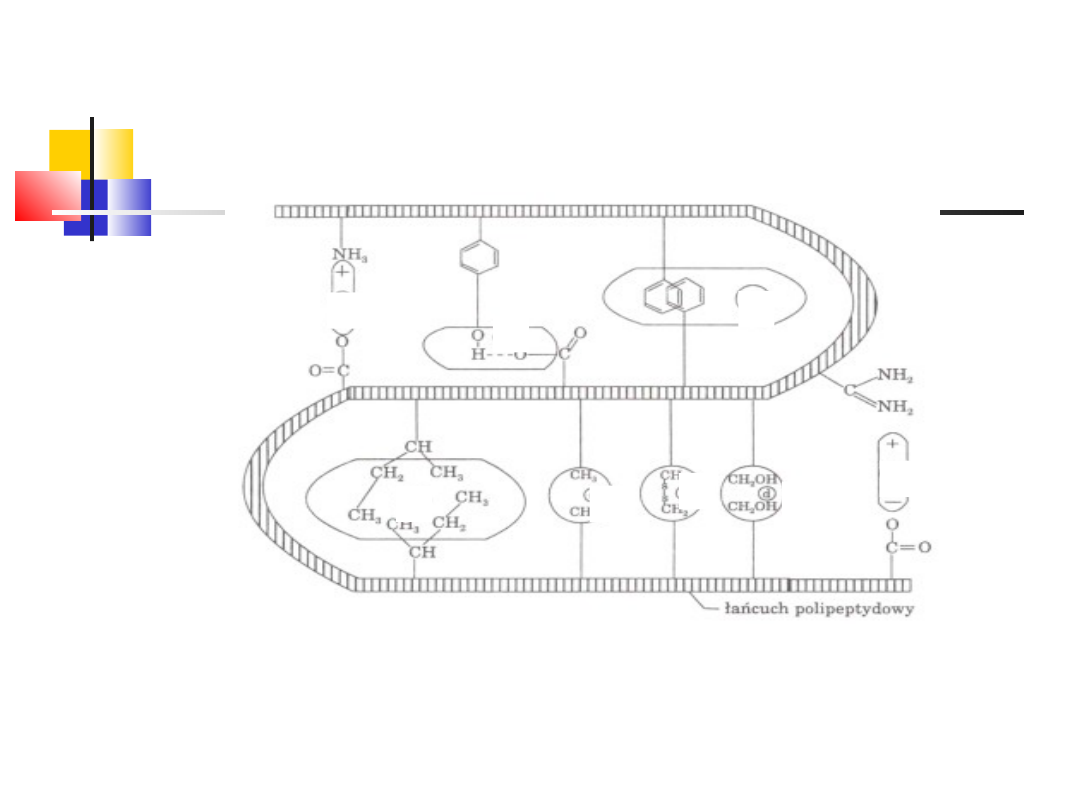
20
Przykłady wiązań
utrzymujących,
III rzędową strukturę białek
1 – wiazanie jonowe
2 – wiązanie wodorowe
3 – oddziałaywanie hydrofobowe
4 – mostek disiarczkowy
5 – wiązanie elektrostatyczne – dipol-dipol
1
2
3
3
3
1
4
5

wd_2
21
białka globularne
Anhydraza węglanowa
Białka globularne są często
symetryczne, mają rózne masy
cząsteczkowe, pełnią 'aktywną'
rolę w organizmie w
przeciwieństwie do białek
fibrylarnych – rola strukturalna
-enzymy (np: anhydraza,
węglanowa)
-białka transportujące
-receptorowe
-regulatorowe
Struktura określona dzięki NMR,
rentgenografii, a na podstawie
'rozwiązanych' struktuch
metodami bioinformatycznymi
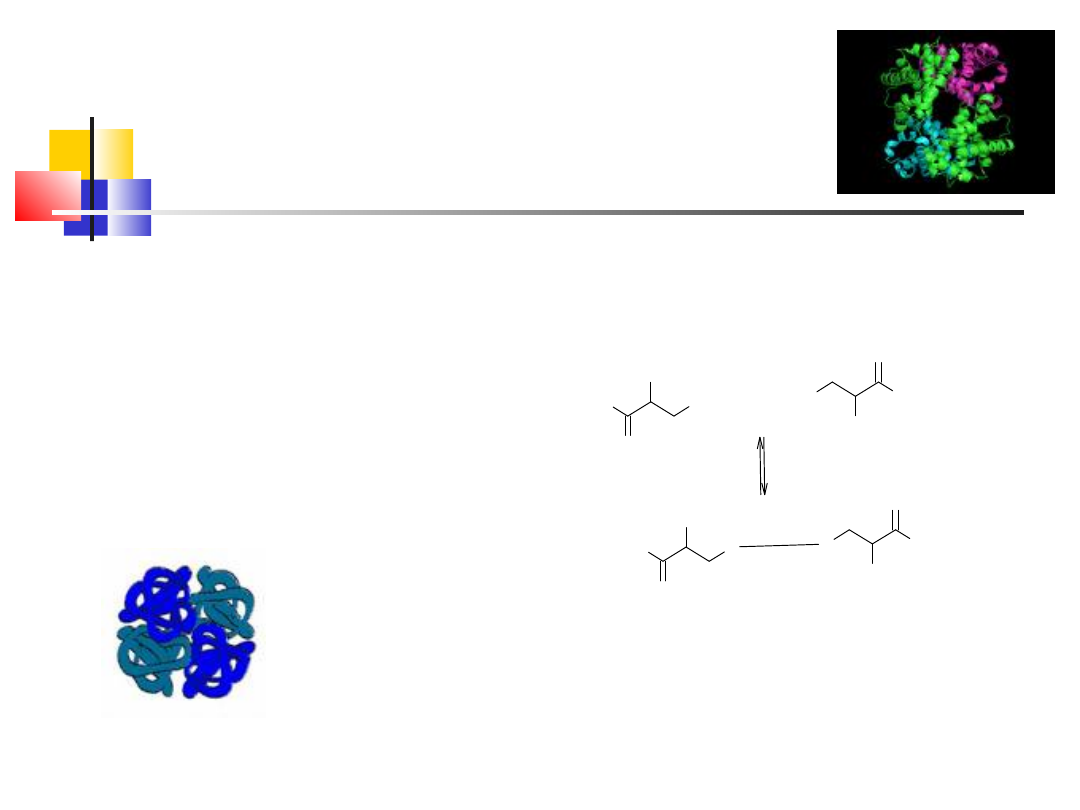
wd_2
22
Struktura IV rzędowa
O
NH
2
S
H
OH
O
NH
2
S
O
H
O
NH
2
S
OH
O
NH
2
SH
O
H
+ 2 H
+
+2 e
-
cysteina
cysteina
cystyna
utlenienie/redukcja
Tworzenie się mostków dwusiarczkowych
miedzy 2 resztami cysteiny w reakcji
utlenienia
dotyczy białek posiadających więcej niż 1
łańcuch polipeptydowy, opisuje ilość i
wzajemne ułożenie podjednostek
cząsteczkowych (pojedynczych łańcuchów)
białek, utrzymywana jest przez wiązania
dwusiarczkowe, siły elektrostatyczne, wiązania
wodorowe i oddziaływania hydrofobowe
Podobieństwo struktury czwartorzędwoej
lizozymu z jaja kurzego i ludzkiej <a>-
laktoglobuliny
W komórkach po syntezie peptydów
rozpoczyna się proces fałdowania białek
jak ten proces przebiega zależy od składu
aminokwasowego białek oraz obecn ości białek
pomocniczych – białek chaperonowych
białka przyjmuja konformację aktywną, która
umożliwia im spełneinie określonych funkcj

wd_2
23
Choroba Alzheimera
Postępująca, degeneracyjna choroba ośrodkowego układu
nerwowego, charakteryzująca się występowaniem
otepienia. Często u osób powyżej 65 roku zycia. Dochodzi
do zaniku kory mózgowej
Podobny mechanizm: choroba Parkinsona i chorba
"wściekłych krów"
na poziomie mikroskopowym stwierdza się występowanie
blaszek amyloidowych zbudowanych z beta-amyloidu
(zwanych też blaszkami starczymi lub płytkami starczymi),
które odkładają się w ścianach naczyń krwionośnych.
Obserwuje się także nadmierną agregację białka tau
wewnątrz komórek nerwowych mózgu, w postaci splątków
neurofibrylarnych (NFT)
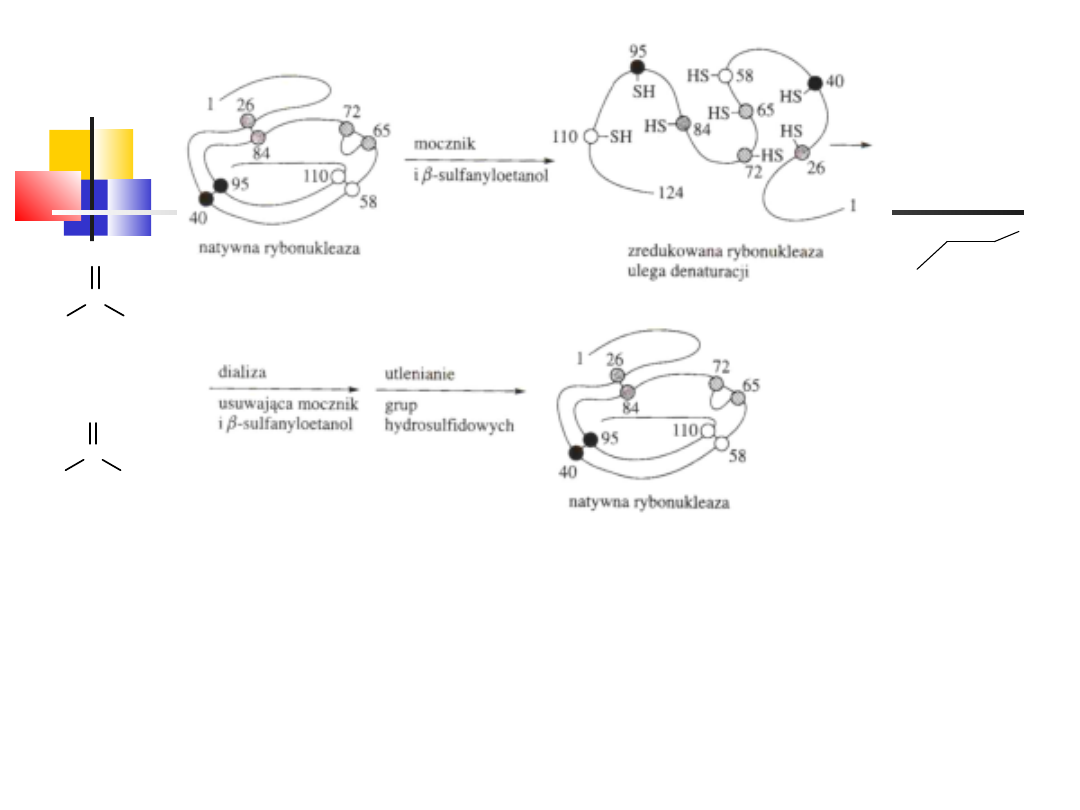
wd_2
24
C
O
NH
2
N
H
2
mocznik
C
NH
NH
2
N
H
2
2
+
Cl
-
chlorek guanidyny
OH
S
H
-merkaptoetanol
(-sulfanyloetanol)
Denaturacja i renaturacja rybonukleazy,
Doświadczenie Anfinsena, Nobel 1972
Denaturacja białka – zjawisko praktycznie nieodwracalne, powodujące dużą zmianę
konformacji cząsteczki białka z równoczesną utratą jej biologicznej aktywności,
zachodzi pod wypływem wysokiej temperatury, mocnych kwasów (<3,0) i zasad
(>9,0), 8M mocznika, 6M chlorku guanidyny, detergentów, niektórych związków
aromatycznych, wysokiego stężenia jonów metali, promieniowania UV lub
rentgenowskie

wd_2
25
Denaturacja – znaczenie
-powoduje zmianę pI (punktu izoelektrycznego) i obniża
rozpuszczalność białka
-w komórce białka zdenaturowane są szybko rozpoznawane
i trawione (synteza i degradacja białek reguluje ich
stężenie w komórce)
-Obserwacja denaturacji:
-pomiar dyspersji kąta skręcania światła spolaryzowanego
-dichroizm kołowy
-pomiar widm absorpcyjnych
-chemiczna ocena dostępności okreslonych grup
funkcyjnych
-wykorzystywana jest w procesie obróbki produktów
żywnościowych, w celu inaktywacji enzymów, talaizujących
niepożądane reakcje, no: powodujących ciemnienie
owoców i warzyw – oksydaza o-difenolowa, mieknienie
kwaszonych ogórków – enzymy pektynolityczne, hydroliza
tioglikozydów nasion rzapaku – tioglukozydaza.

wd_2
26
Podział białek
Białka proste
w wyniku ich całkowitej hydrolizy
powstają tylko aminokwasy lub ich
pochodne, przyjmują postać globularną i
fibrylarną
Białka złożone
w wyniku ich całkowitej hydrolizy
powstają aminokwasy i inne niebiałkowe
związki
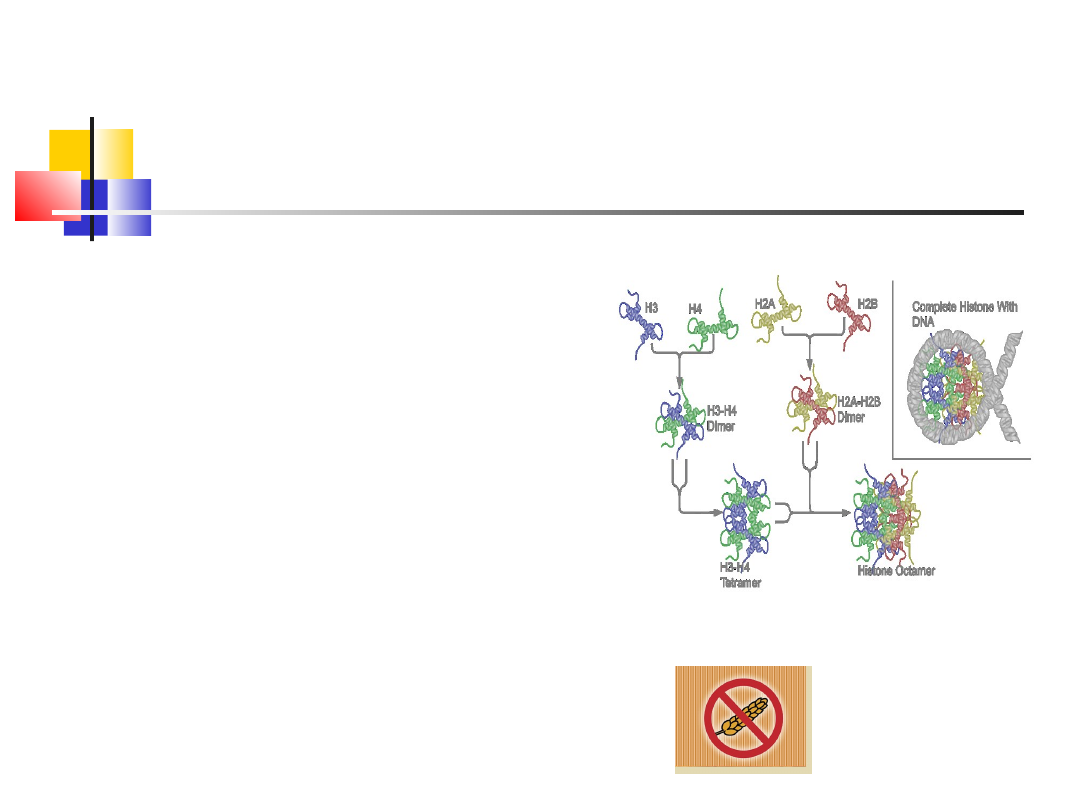
wd_2
27
Białka proste
Kompleks histonów z DNA
-albuminy – ważny składnik tkanek
stałych i płynów ustrojowych,
powszechnie występują w mleku,
jajach, nasionach niektórych zbóż,
ziemniakach 9szumowina na rosole)
-globuliny – dobrze rozpuszczalne w
roztworach soli fizjologicznych, mleka
(laktoglobuliny), ziemniaka –
tuberyna, enzymy proteolityczne,
lipazy
Białka włókienkowe:
-fibrynogen – białko włókienkowe
występuje w osoczu krwi
-fibroina – główny składnik
naturalnego jedwabiu
-keratyna – włosy, kopyta
kolagen – źle rozpuszczają się w
zimnej wodzie, po zagotowaniu
tworzą żelatynę
-elastyna – białko włókienkowe,
składnik ścięgien, wiązadeł i ścian
naczyń krwionośnych

wd_2
28
Białka: kalsyfikacja, budowa, funkcje
miozyna i katyna – stanowią 30-40% tkanki mięśniowej, białka włókienkowe umozliwiają
kurczenie się mięśni – molekularny motor
miozyna jest heksamere, składa się z 2 łańcuchów ciężkich, skręconych wokół siebie, z
głowami o charakterze globularnym – M. cz. ok. 220 kDa, na tych łańcuchach znajduje
się miejsce wiązania i hydrolizy ATP (domena NTPazy) oraz domena wiążąca aktynę,
przy każdej 'głowie' znajduje się po 2 łańcuchy niskocząsteczkowe (18-25 kDa), jeden z
nich pełni funkcję regulatorową, a drugi nazywa jest 'niezbędnym" (ang. Essential)
miozyna wraz z kinezyną oraz białkiem G tworzy filamenty grube

wd_2
29
Aktyna – występuje w 2 formach monomerycznej = 1 polipeptyd – G – aktyna
M. cz. 42 kDa, składa się z 4 domen, jest jednym z najliczniej występujacych
białek w komórkach eukariotycznych (do 10% wszystkich białek) oraz
polimerycznej F-aktyny.
Aktyna razm z kompleksem troponiny i tropomiozyny tworzy filamenty
cienkie.
Skurcz mięśnia wymaga hydrolizy ATP i polega na ślizganiu się filamentów
cienkich (kompleks z aktyną) wzdłuż filamentów grubych (kompleks z
miozyną).
Skurcz mięśnia wymaga hydroliz filamentów cienkich (kompleks z miozyną)
Histony zawierają dużo aminokwasów zasadowych (Arg, Liz, His) są dobrze
rozpuszczalne w wodzie, blokują i stabilizują cząsteczki DNA w komórkach
eukariotycznych.
Prolaminy w zależności od gatunku: gliadyny (pszenica), hordeiny (jęczmień),
zeiny (kukurydza), kafiryny (sorgo), aweniny (owies) i gluteina oba białka
występują w części bielma ziarniaków i są substancjami zapasowymi,
zawierają mało Lys, a dużo Asp i Glukationu
składnik glutenu – nietolerancja glutenu – choroba: celiakia
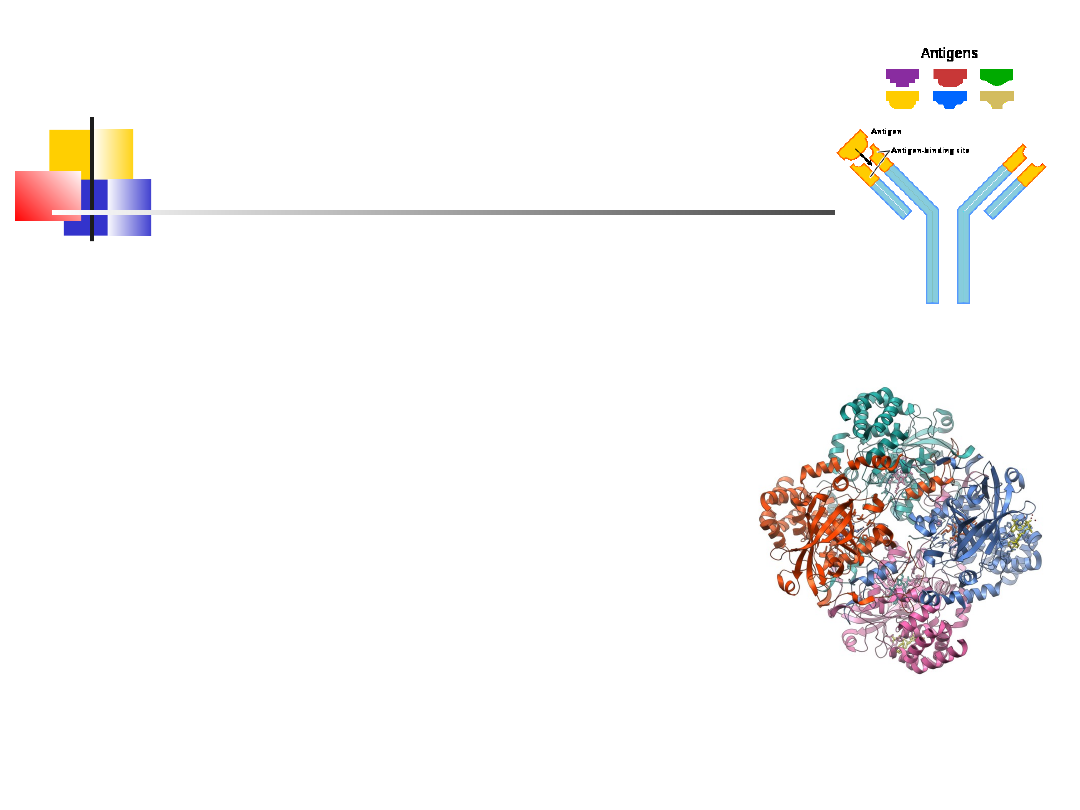
wd_2
30
Białka złożone
katalaza
Schemat budowy
przeciwciała
Chromoproteiny, zawierające substancję barwną (hem
– hemoproteiny) skompleksowaną z częścią białkową –
hemoglobina – tetrameryczne białko odpowiedzialne za
transport tlenu we krwi, mioglobina – magazynuje tlen
w mięśniach, cytochrom c – przenosielektrony w
łańcuchu oddechowym, katalaza – enzym rozkładający
H2O2
Glikoproteiny, zawierają kowalencyjnie związane
oligosacharydy (np. Glukoamylazy, pektyny, białka
błony komórkowej, mucyna,
immunoglobuliny/antygeny)
Głównym zadaniem immunoglobulin są: wiązanie
antygenu, a więc neutralizacja patogenów, toksyn,
adhezyn bakteryjnych
ułatwianie usuwania antygenów na drodze fagocytozy
powoduje równiez pobudzenie odpowiedzi
odpornościowej
wd_2
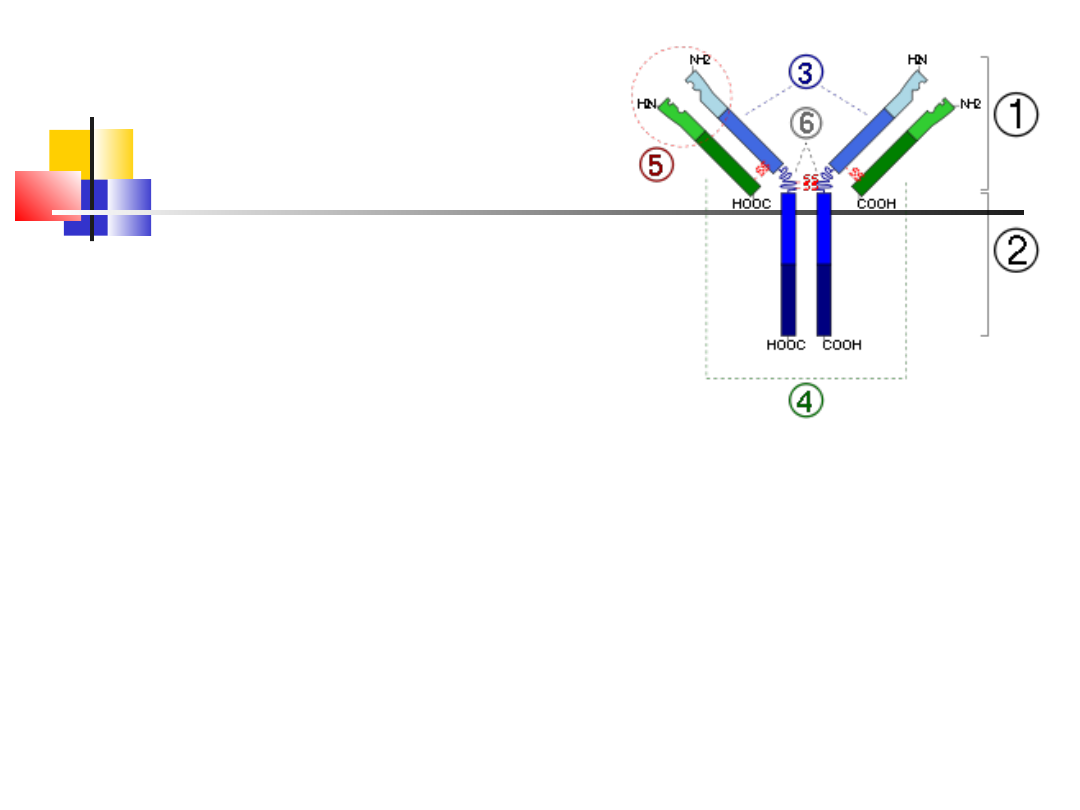
31
Schemat budowy
immunoglobuliny
1. Fragment wiążący antygen
2. Fragment krystalizujący
3. Łańcuch ciężki (definiuje
grupę przeciwciała: IgA,
IgD, IgE, IgG, IgM )
4. Łańcuch lekki (lambda - λ
lub kappa κ).
5. Miejsce wiązania antygenu
6. Regiony zawiasowe
-S-S- mostki disiarczkowe

wd_2
32
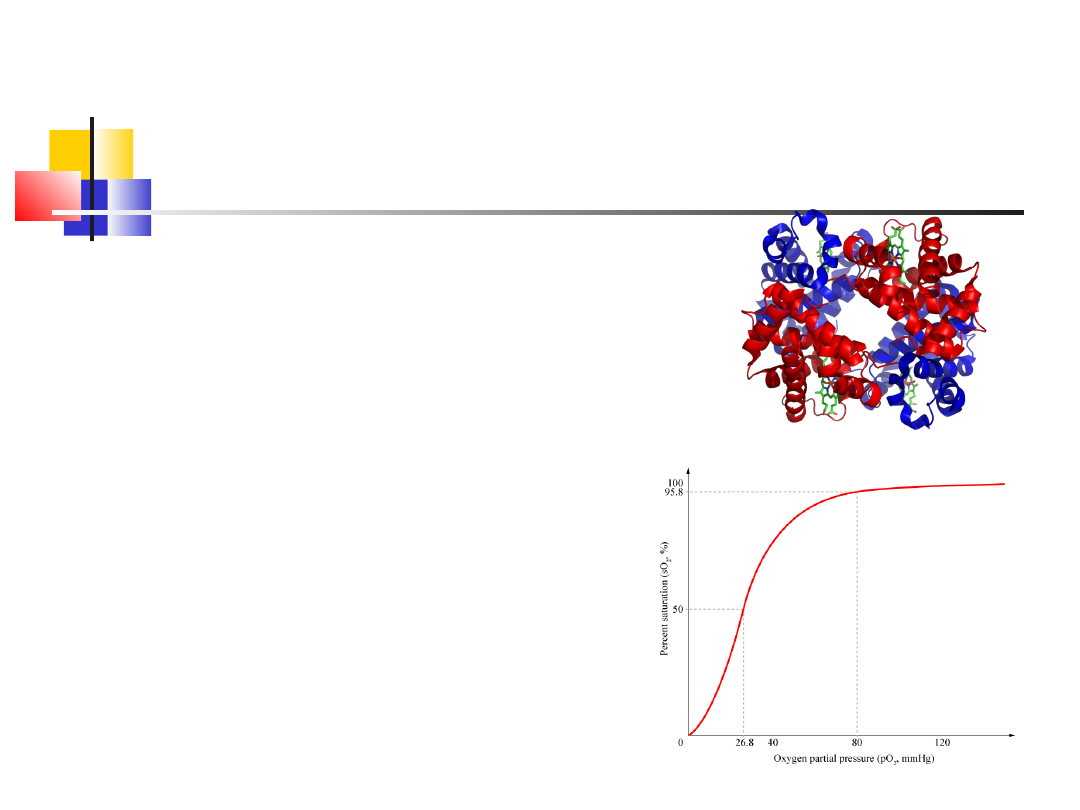
Hemoglobina
Białko złożone o strukturze czwartorzędowej
Ludzka hemoglobina jest tetramerem zbudowanym z dwóch par białkowych
podjednostek (2<a>, 2<b>):
podjednostki nie są związane kowalencyjnie; każda podjednostka zawiera
łańcuch polipeptydowy i jako grupę prosteryczną (niebiałkową) – hem
(czerwony kolor krwi):
Grupa hemowa składa sie z: centralnie położonego atomu żelaza, 4
pierścieni pirolowych, połączonych mostkami metonowymi.
Dodatkowo do tertrapirolowego pierścienia przyłączone są: 4 grupy
metylowe, 2 winylowe i 2 łańcuchy boczne propionianu.
Budowa hemu typu a występuje w cytochromie a i w chlorofilach (w
chlorofilach zamiast Fe jest Mg), chrakterystyczne jest wystepowanie
hydrofobowego łańcucha (Fitol – chlorofile), grupy aldehydowej zamiast
metylowej.
Budowa hemu typu b występuije w mioglobinie i hemoglobinie, hem jest
związany z łańcuchem polipeptydowym wiązaniem koordynacyjnym poprzez
resztę histydyny z jonem Fe
Budowa hemu typu c występuje w cytochromie c, charakterystyczne tu jest
związanie hemu poprzez resztę cysteiny hemu z apoenzymem wiązaniem
kowalencyjnym.
wd_2
33
Kooperacyjne wiązanie tlenu
przez hemoglobinę
Wiązanie tlenu w hemoglobinie
Jedna cząsteczka hemoglobiny może przyłączyć do 4
cząsteczek tlenu
Przyłączenie 1 cz. O2, powoduje korzystne zmiany
konformacyjne ułatwiające przyłączenie kolejnych cz.
O2.
Zalety posiadania struktury czwartorzędowej
tworzenie dużej cząsteczki (o dużej masie
cząsteczkowej) białka z niedużych monomerów (np.
Aktyna) – duża cząsteczka białka nie musi być
syntetyzowana cała i jej synteza może łatwo "zmieścić
się" w komórce
ewentualne błędy w biosyntezie peptydów są
minimalizowane i szybko naprawiane – sekwencje
kodujące są krótkie (tylko dla poszczególnych
monomerów)
oddziaływania pomiędzy podjednostkami umozliwiają
powstanie między nimi zależności/regulacji (np.
Wymuszenie konformacji w hemoglobinie – szybsze
wiązanie tlenu) – część podjednostek może być
regulatorowa, a część posiadać inne funkcje.

wd_2
34
Anemia sierpowata – pierwsza
"molekularna" choroba
-opisana po raz pierwszy w 1910 r.
-1949 – Linus Pauling wykazał, że hemoglobina osób
chorych ma inny ładunek elektryczny niż u osób zdrowych
-1957 – Vernon Ingram odkrył mutację punktową w <b>-
łańcuchu hemoglobiny kwas glutaminowy (HbA1) w pozycji
6 jest zastąpiony waliną (u osób chorych HbS)
-wymiana aminokwasów powoduje agregację deoksy-HbS z
innymi cząsteczkami deoksy-HbS i jej precypitację w
czerwonych krwinkach nadając im charakterystyczny
kształt.
-osoby heterozygotyczne nie chorują na malarię, dlatego na
anemię sierpowatą
wd_2
35
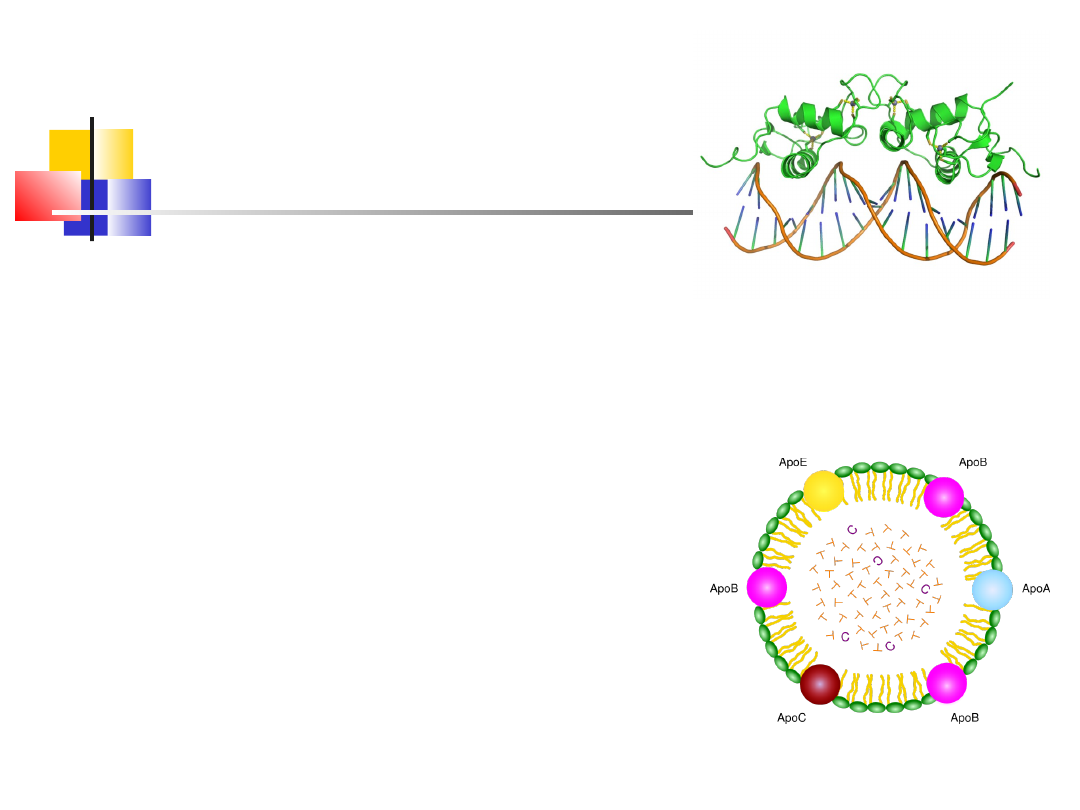
Białka złożone cd
chylomikron
Domena receptorowa
wiążąca DNA
Nukleoproteiny: np. Histony połączone głównie
wiązaniami jonowymi z kwasami nukleinowymi, budują
chromatynę jądrową i rybosomy, jak równiez wirusy
(np. Białko Cro)
Lipoproteiny zawierają tłuszcze, kwasy tłuszczowe,
fosfolipidy lub steroidy, wchodzą w skład błon
komórkowych, pełni też funkcje transportujące lipidy w
osoczu krwi (chylomikron)
Metaloproteiny – zawierają koordynacyjnie związane
jony metali, np: ferrytyna (magazynuje do 20% Fe)
proteazy cynkowe (Zn), = metaloproteazy, hydrolizują
białka i peptydy
Dehydrogenaza alkoholowa (Zn) – katalizuje reakcję
fermentacji alkoholowej
nitrogenaza (Mo i Fe) uczestniczy w procesie wiązania
azotu
plastocyjanina zawiera jon Cu, oksydaza
cytochromowa (Cu i Fe) oba białka uczestniczą w
transporcie elektronów u autotrofów

wd_2
36
Kazeina - fosfoproteina

wd_2
37
Fosfoproteiny zawierają estrowo związaną grupę
ortofosforanową (1-10% P) z resztami seryny lub/i treoniny,
np: kazeina mleka, witelina, fosfityna żółtka jaja
Kazeina – białko występujące w mleku w postaci koloidalnego
roztworu soli wapniowej, tworzącej mcelle śr. 20-300 nm w
jej skład wchodzi białko proste (20 różnych białek), kwas
fosforowy, sacharydy
Zakwaszanie mleka do pH=4,5 powoduje w temp. Pokojowej
wytrącanie się wolnej kazeiny – proces odwracalny, po
podniesieniu pH do ok. 6,7 do wytrącania kazeiny stosowany
jest kwas cytrynowy lub siarczan amonu.
Naturalnie wytraca się pod wpływem kwasu mlekowego –
kwaśne mleko zawiera śladowe ilości laktozy, utlenianej do
kwasu kwasu mlekowego przez bakterie kazeinę wytrąca się
także podpuszczka, wtedy zawiera więcej wapnia niż
wytrącona kwasem, a w serwatce jest laktoza, ważne dla
osób z problemami w trawieniu galaktozy.
wd_2
Podział białek według wartości
odżywczej
Pełnowartościowe – zapewniają prawidłowy wzrost i
rozwój organizmu, zawierają AA egzogenne w ilościach
zbliżonych do zapotrzebowania: białka jaj, mleka i
przetworów, tkanki mięsniowej; ssaków, ptaków, ryb,
skorupiaków, białko soi i orzeszków ziemnych
Częściowo pelnowartościowe – wystarczają do
podtrzymania życia, ale nie zapewniają prawidłowego
rozwoju i wzrostu, zawierają wszystkie AA egzogenne,
ale przynajmniej 1 wystepuje w ilościach
niewystarczających: białko zbóż (Lys), białko ryżu (Lys,
Thr), białko kukurydzy (Trp, Lys)
Niepełnowartościowe – białka przyswajalne, ale nie
wystarczające do podtrzymania życia, nie zawierają
jednego lub więcej AA egzogennych: żelatyna (brak Trp,
Cys, niedobór Met, Ile, Val, Tyr)
Bezwartościowe – nieprzyswajalne: białko włosów,
paznokci, rogów
wd_2
39
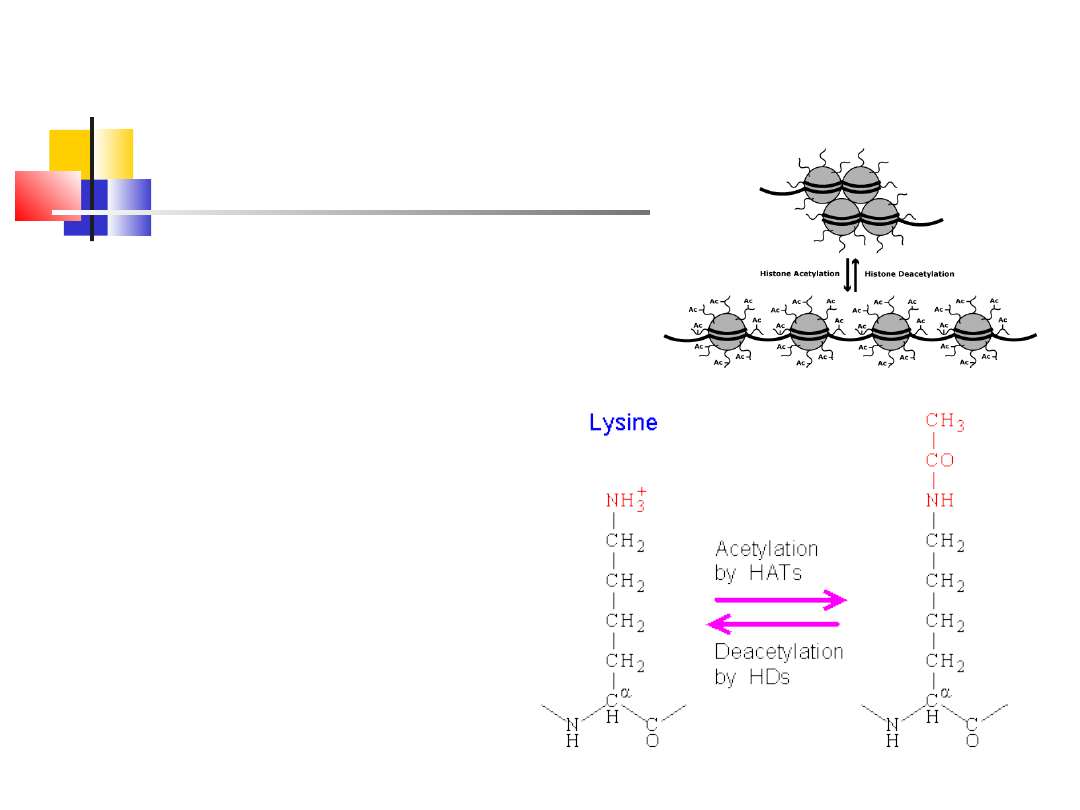
Modyfikacje białek (właściwych
reszt aminokwasowych)
Acetyna N-końca liozyny bialek histonowych
obniża ich powinowactwo do DNA, umożliwiając
dostęp polimerazie RNA i czynnikom
transkrypcyjnym łatwiejszy dostęp do miejsc
promotorowych
hydroksylacja proliny/lizyny – stabilizuje nowo
zsyntetyzowany kolagen, wymagana jest tu
obecność witaminy C
Przy niedoborach – szkorbut: samoistne
krwawienia (niedobór kolagenu w ścianach
naczyń krwionośnych) bóle, mięśni, stawów i
kości, patologivczne złamania, zapalny przerost
dziąseł, chwianie się i wypadanie zębów, słabe
gojenie ran
Fosforylacja hydroksylowych grup seryny,
Glikolizacja – przenbieda w aparacie Golgiego,
zwiększa hydrofilność białek, jest istotną
potranslacyjną modyfikacją białka, polega na
przyłączeniu reszty cukrowej głównie: mannozy,
fruktozy, galaktozy lub N-acetyloglukozoaminy
N-glikolizaja przez resztę Asn
O-glikolizacja poprzez reszty: Ser i Thr
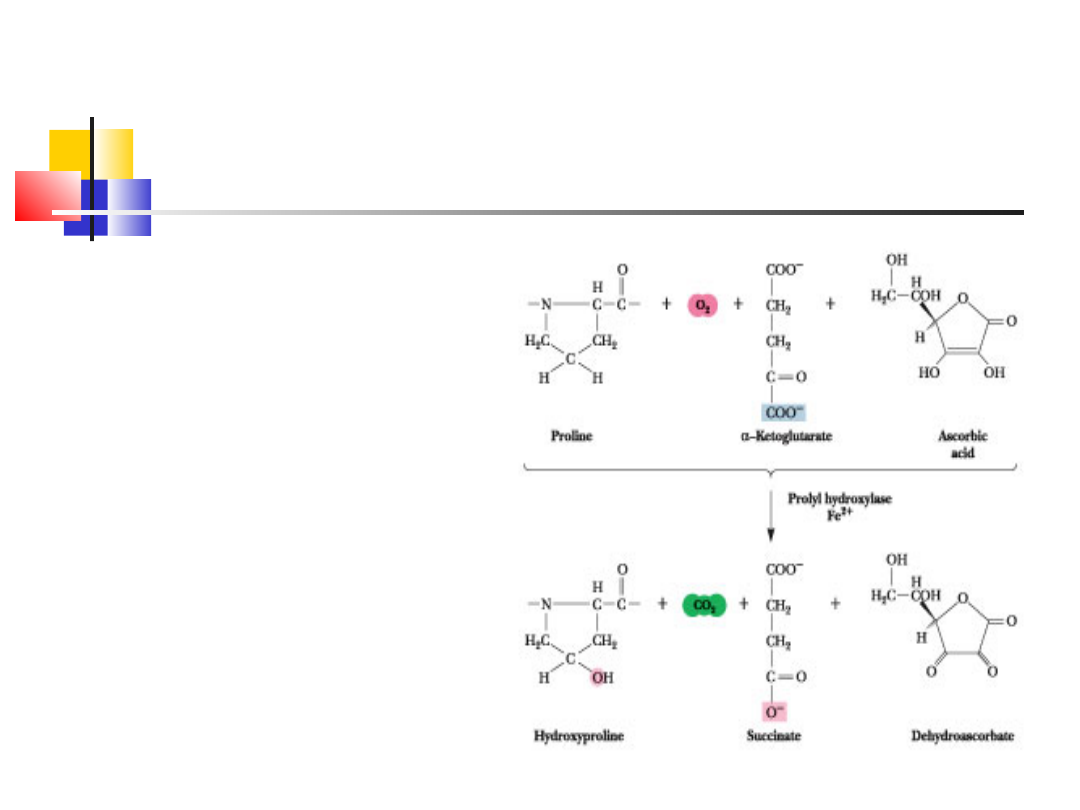
wd_2
40
Modyfikacje białek (właściwych
reszt aminokwasowych) cd
Przyłączenie reszty kwasu
tłuszczowego do grupy
<a>-aminowej lub
tiolowej cysteiny zwiększy
hydrofobowość białka
Proteoliza – enzymy
trawienne, proces
krzepnięcia krwi,
powstawanie katywnej
insuliny – proces
nieodwracalny
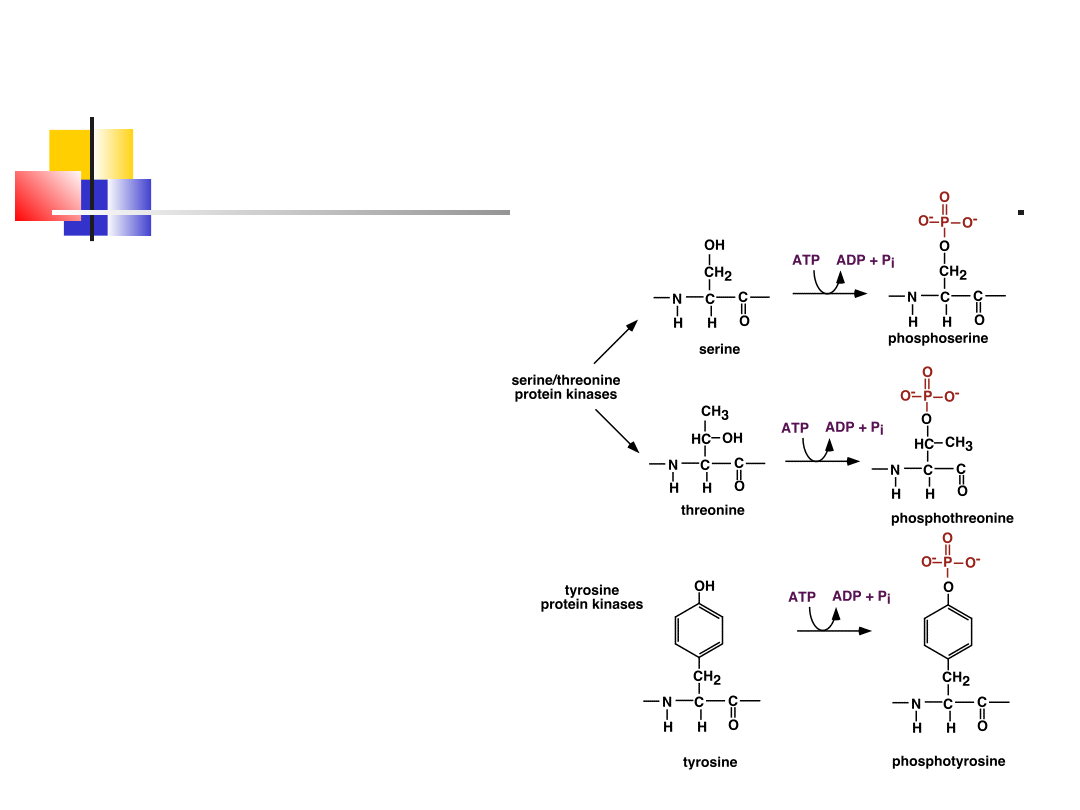
wd_2
41
Modyfikacje białek (właściwych
reszt aminokwasowych) cd
Przemiany białek w trakcje przechowywania i
przetwarzania żywnośći
Ogrzewanie:
-denaturacja cieplna (gotowanie pasteryzacja,
sterylizacja, pieczenie, smazenie)
-zmiany enzymatyczne – często inaktywacja enzymów
endogennych
-zmiany właściwości reologicznych i uwodnienia
-zmiany barwy (pieczenie, sterylizacja – reakcja
aminowych białek i aldehydowych lub efekt utlenienie
lipidów), zmiany chromoprotein mięśni i krwi, reakcje z
H2S uwalnianym z AA siarkowych
-powstawanie sieci – reakcja Maillarda oraz reakcja
transamidacji
Efekt:
-lepsze: smak, barwa i zapach, często lepsza
strawność i właściwości reologiczne
-inaktywacja endogennych enzymów, inhibitorów i
toksyn bakteryjnych
-usieciowienie obniża podatność na proteolizę –
trawienie
-zmodyfikowane AA nie są trawione: szczególnie
wrażliwe: cysteina, lizyna, metionina, tryptofan,
arginina, leucyna
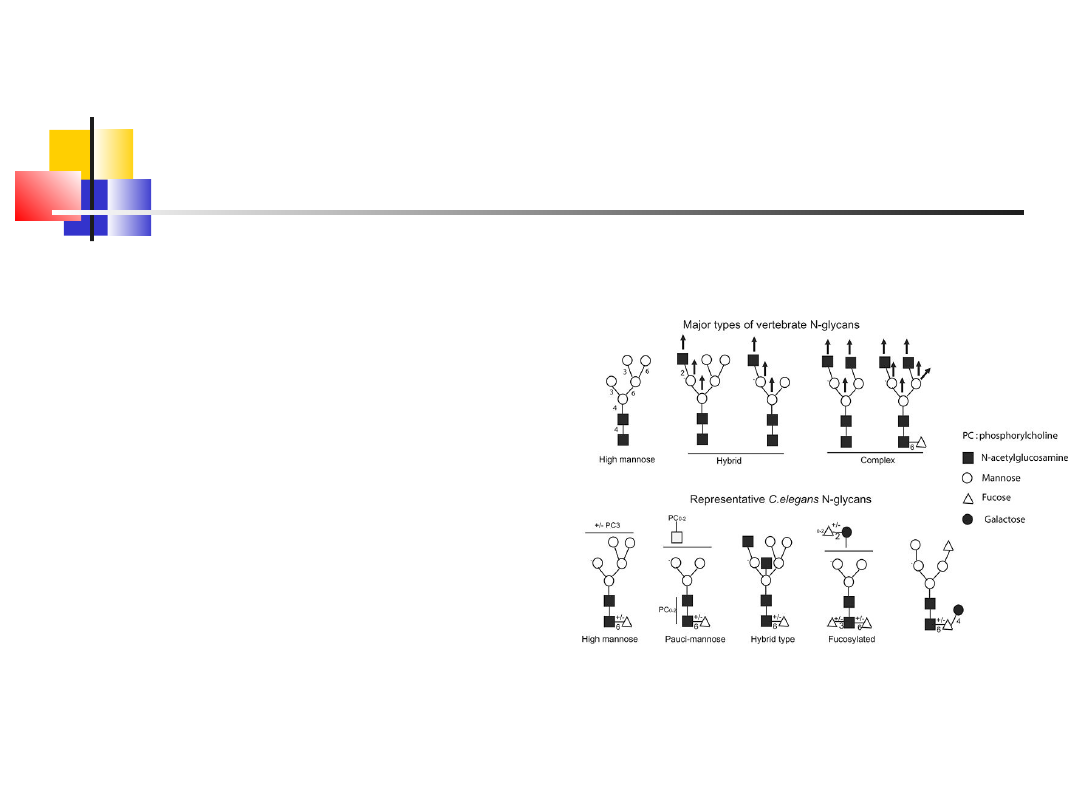
wd_2
42
Modyfikacje białek (właściwych
reszt aminokwasowych) cd
Enzymatyczne modyfikowanie bialek w
produkcji żywności
Enzymatyczna hydroliza białek (produkcja
serów, dojrzewanie mięsa, wytwarzanie piwa,
pieczywa)– endogenne proteazy lub preparaty
enzymów proteolitycznych – produkt:
hydrolizaty i aminokwasy – odpowiednio
zbilansowa uzupełniają dietę np: sportowców
Wytwarzanie lastein – polipeptydy o M. cz. ok.
3 kDa i pożądanym składzie AA, stosuje się
endopeptydazy, np: pepsynę lub papainę i
egzopeptydazy, np: pronazę lub dodatek do
hydrolizatorów białkowych określonych
aminokwasów i reakcję transpeptydacji (np:
pozbycie się fenyloalaniny – preparat buałkowy
dla osób chorych na fenyloketonurię)

wd_2
43
Funkcje białek
Kataliza enzymatyczna – enzymy np: rybonukleaza A, lizozym, chymotrypsyna,
karboksypeptydaza A
Transport i magazynowanie – hemoglobina, transferyna, albuminy, kazeina,
gliadyna, zeina, tuberyna
Odpowiedzialne za uporządkowany ruch – składnik mięśni: miozyna i aktyna
Fnkcje mechanizczno – strukturalne: bolagen, białka fibrylarne, keratyny
Ochronna immunologiczna – swoiste przeciwciała, interferony, białka chroniące
przed zamarzaniem
Wytwarzanie i przekazywanie impulsów nerwowych – rodopsyna, białko
receptorowe cAMP
Inne funkcje:
-białka trujące – toksyny błonicy – blokuje syntezę białek na rybosomach
-białka słodkie – taumatyna, monelina (2000 x słodsza niż cukier), mogą zastąpić
cukier w diecie
wd_2
44
Oczyszczanie białek –
wydzielenie z mieszaniny dla ich
lepszej charakterystyki
Przyłączenie białka do anionitu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
w2 zyw diet WZORY
Psycholgia wychowawcza W2
SP dzienni w2
w2 klasy(1)
W2 Chemiczne skladniki komorki
rodzaje diet
OK W2 System informacyjny i informatyczny
W2 6
Algebra w2
W2 Uproszczone formy rachunkowości
W2 i W3
ulog w2
UC W2
w2 podsumowanie
więcej podobnych podstron