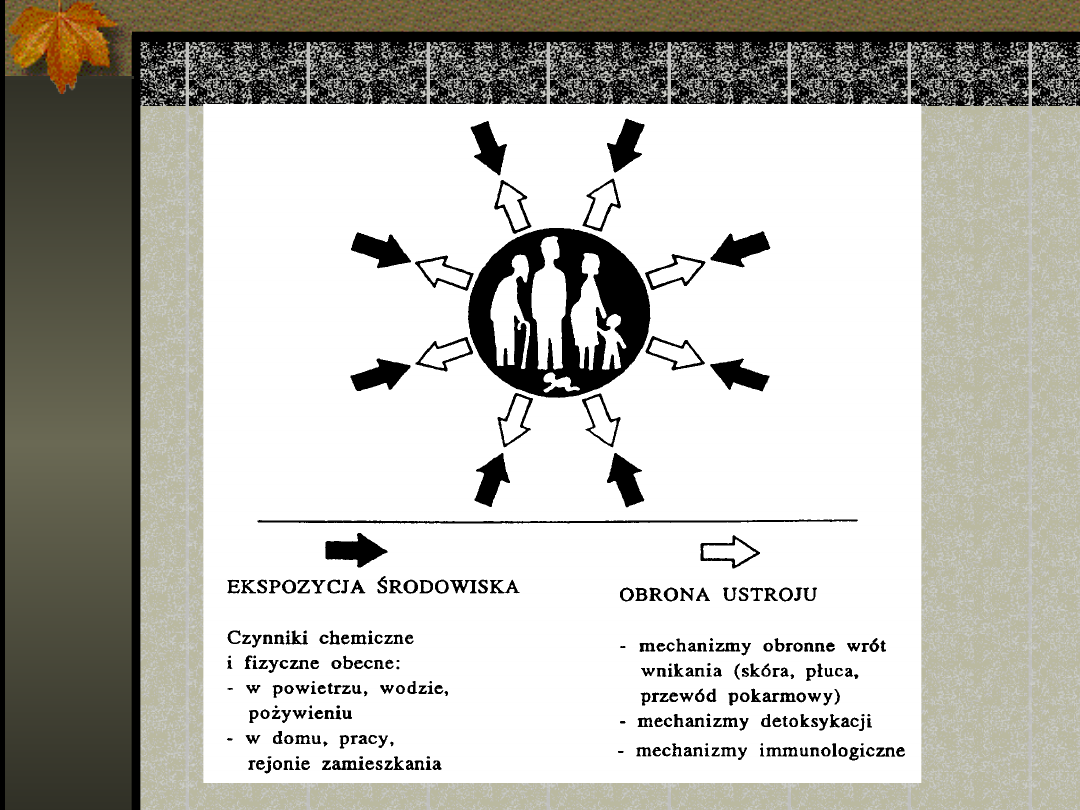

LOSY KSENOBIOTYKÓW
W ORGANIZMIE
Ksenobiotyk - greckie słowo xenos - oznacza
obcy.
Ksenobiotykiem jest każda substancja nie
będąca naturalnym składnikiem żywego
organizmu:
substancja egzogenna
materiał antropogenny o strukturze nie
występującej w przyrodzie,
do których organizmy nie przystosowały się na
drodze wcześniejszej ewolucji.

Główne grupy substancji obcych dla człowieka to:
- leki,
- pestycydy,
- niektóre substancje celowo dodane do żywności,
- zanieczyszczenia środowiska zewnętrznego.
pochodzenia zawodowego i komunalnego,
wewnątrzdomowe i zewnątrzdomowe
pochodzenia chemicznego i organicznego.

Metabolizm
ksenobiotyków w
organizmie obejmuje:
wchłanianie (absorbcja)
rozmieszczenie (dystrybucja)
przemiany biochemiczne
( biotransformacja)
wydalanie

DROGI WCHŁANIANIA
Egzogenne substancje toksyczne
wchłaniane są do organizmu
trzema głównymi drogami:
drogi oddechowe
skóra
układ pokarmowy

METABOLIZM
SUBSTANCJI
CHEMICZNYCH
Substancje chemiczne do tkanek i narządów dostają się po
przeniknięciu przez błony biologiczne na zasadzie transportu:
- biernego
- nośnikowego
- aktywnego
Zostają wówczas pokonane bariery nabłonkowe poszczególnych
układów oraz błony białkowo-lipidowe oddzielające różne tkanki
od płynów ustrojowych.
Związki silnie polarne np. kwasy sulfonowe lub aminy
czwartorzędowe, czy też substancje bardzo lotne np. eter etylowy
NIE ULEGAJĄ PRZEMIANOM METABOLICZNYM
w ustroju człowieka.
Wydalane są w swej pierwotnej formie.

Większość ksenobiotyków ulega
BIOTRANSFORMACJI
Wydalane są z ustroju w postaci metabolitów.
1. Metabolity są mniej toksyczne w stosunku do substratu,
lub wręcz stają się nietoksyczne –
DETOKSYKACJA
2. Metabolity te mogą stawać się bardziej toksyczne niż
dostarczony do organizmu substrat.
W związku z tym na określenie przemian wewnątrzustrojowych
ksenobiotyków używany jest termin “biotransformacja”.

Celem biotransformacji ksenobiotyków jest zwiększenie ich
rozpuszczalności w wodzie (czyli zwiększenie ich polarności)
dzięki czemu ułatwione jest ich wydalanie z ustroju.
Bardzo silnie hydrofobowe ksenobiotyki mogłyby przebywać
w tkance tłuszczowej niezmiernie długo.
* Monitoring środowiskowy - pomiar stężeń czynników
szkodliwych w środowisku, mający na celu ocenę wielkości
narażenia oraz ryzyka wystąpienia skutków zdrowotnych, przy
przyjęciu za podstawę odpowiednich danych interpretacyjnych.
** Monitoring biologiczny - systematyczny pomiar stężeń
substancji toksycznych lub ich metabolitów w tkankach,
wydzielinach lub wydalinach, oddzielnie lub łącznie, mający
na celu ocenę wielkości narażenia oraz ryzyka dla zdrowia,
przy przyjęciu za podstawę oceny odpowiednich danych
interpretacyjnych.

FAZA PIERWSZA
1. hydroksylacja - podstawienie grupy hydroksylowej do łańcuchów
bocznych węglowodorów aromatycznych i barbituranów
2. epoksydacja - przyłączenie do podwójnego wiązania atomu tlenu z
utworzeniem pierścienia trójczłonowego: (wielopierścieniowe
węglowodory aromatyczne) metabolity
epoksydowe mogą
wykazywać działanie mutagenne i rakotwórcze
3. oksydatywna dezaminacja - utlenienie amin endogennych (aminy
katecholowe, poliaminy, histamina) -> do ketonów pod wpływem
oksydazy aminowej w obecności NADPH i tlenu cząsteczkowego
4. desulfurylacja - podstawienie tlenu w miejsce siarki (insektycydy
fosfororganiczne, tiobarbiturany) -> ulegają biotransformacji do
metabolitów z reguły bardziej toksycznych
5. redukcja związków nitrowych - odpowiednie reduktazy w
warunkach beztlenowych
przekształcają aromatyczne związki
nitrowe i azozwiązki (nitrobenzen, chloramfenikol) do amin
pierwszorzędowych.

FAZA DRUGA
Glukuronidacja – reszta glukuronidowa z kwasu UDP-glukuronowego przy
udziale enzymów -transferaz glukuronylowych - ulega związaniu przez tlen,
azot lub grupę siarkową z substancjami, które posiadają grupy wodorotlenowe,
karboksylowe, aminowe i sulfhydrolowe.
Wiele związków np. fenole, sterole, alanina, kwas benzoesowy wydalane są
pod postacią glukuronidów.
Sprzęganie z siarką i siarczanami (sulfatacja)
- fenole, alkohole pierwszo-i drugorzędowe, aminozwiązki alifatyczne i
aromatyczne po reakcji sprzęgania z siarczanem przechodzą w estry siarkowe,
cyjanowodór i cyjanki przechodzą w rodanki (izotiocyjaniany), niektóre metale
przechodzą w siarczki.
Sprzęganie z glutationem
Sprzęganie substratu z aktywną grupą glutationu (reszta sulfhydrylowa SH
cysteiny). Koniugaty glutationowe ulegają dalszym przemianom: odszczepienie
grupy glutamylowej i glicynowej, przyłączenie grupy aminowej.
Metylowanie i acetylowanie - reakcje te mają dużą rolę w przemianach
endogennych np. adrenalina jest metylowana do noradrenaliny, natomiast w
metabolizowaniu obcych związków organicznych zachodzą rzadziej.

RODZAJE TOKSYCZNOŚCI
ZWIĄZANE Z PRZEMIANĄ
KSENOBIOTYKÓW
1. Cytotoksyczność ksenobiotyków
Reaktywne postaci ksenobiotyków łączą się kowalencyjnym
wiązaniem z makrocząsteczkami komórkowymi doprowadzając do
uszkodzenia komórki.
2. Wpływ na strukturę białek i antygenowość
Sam ksenobiotyk może nie stymulować powstawania przeciwciał,
natomiast po połączeniu z białkami może działać jak hapten. Może
dojść wówczas do immunologicznego uszkodzenia komórki.
1. Działanie mutagenne i udział w kancerogenezie chemicznej
Niektóre związki chemiczne w swojej pierwotnej postaci nie powinny
wywoływać żadnych zmian w materiale genetycznym, a nabierają
takich właściwości dopiero w organiźmie człowieka. Najbardziej
znanym przykładem jest benzo(a)piren. Substancją rakotwórczą
staje się dopiero po aktywacji przez monooksygenazy siateczki
śródplazmatycznej
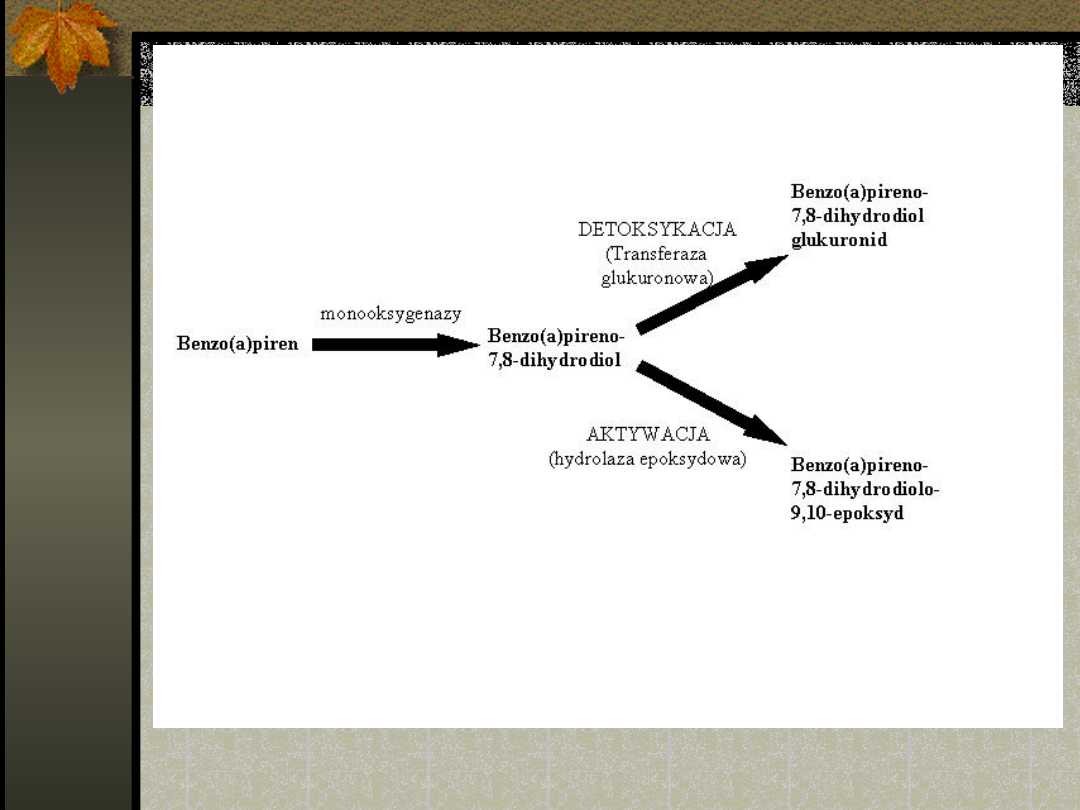

Udowodnienie związku przyczynowo-skutkowego
pomiędzy:
- oddziaływaniem środowiska zewnętrznego
- odpowiedzią ustroju w postaci rozwoju
konkretnej jednostki chorobowej
może nastręczać dużo trudności.
Etiologia wielu chorób ma bowiem
wieloczynnikowe podłoże:
- czynniki genetyczne
- czynniki wynikające z nieprawidłowego
stylu życia
- czynniki środowiskowe.
W udowodnieniu znaczenia czynników
środowiskowych pomocne mogą być biomarkery.

BIOMARKERY
Do oceny efektów działania substancji
chemicznych na organizm oraz określenia
interakcji między układem biologicznym a
zagrożeniem środowiskowym (chemicznym,
fizycznym i biologicznym) służą biomarkery.
Biomarker –wskaźnik procesów zachodzących w
organiźmie, pozwalający na ocenę wielkości
narażenia na czynniki chemiczne i efektów
działania w postaci skutków zdrowotnych, jakie
te czynniki powoduję w eksponowanym
organiźmie.

Najczęściej wyróżnia się trzy klasy biomarkerów:
- biomarkery ekspozycji:
egzogenne substancje lub ich metabolity,
a także produkty interakcji między czynnikiem chemicznym
(ksenobiotykiem) i docelowymi cząsteczkami lub
komórkami;
są one obecne i mierzone w wewnętrznych przedziałach
organizmu
biomarkery skutków (efektu) –
mierzalne biochemiczne, fizjologiczne, behawioralne i inne
zmiany zachodzące wewnątrz organizmu,
które mogą być rozpoznane jako łączące się z:
- już obecnymi,
-mogącymi się pojawić zaburzeniami zdrowia
biomarkery wrażliwości –
wskaźniki wrodzonej lub nabytej zdolności organizmu do
odpowiedzi wywołanej ekspozycją na specyficzny
ksenobiotyk
Część
związków
chemicznych
o
charakterze
ksenobiotyków po dostaniu się do organizmu może ulegać:
1. bioakumulacji.
2. biotransformacji.

BIOMARKERY EKSPOZYCJI.
Biomonitoring pomocny w określeniu interakcji
pomiędzy organizmem człowieka a zagrożeniem
środowiskowym:
Ekspozycja
Biomarkery ekspozycji
Arsen (As)
arsen w moczu, włosach, paznokciach
kwas monometyloarsenowy + kwas dimetyloarsenowy
Kadm (Cd)
kadm w moczu, beta 2 - mikroglobulina w moczu
Ołów (Pb)
ołów we krwi i w moczu ,
protoporfiryna erytrocytarna, cynkoporfiryna erytrocytarna we
krwi,
kwas delta-aminolewulinowy i koproporfiryny w moczu
Rtęć (Hg)
rtęć w moczu
Chrom (Cr)
chrom w moczu
Benzen
benzen we krwi, fenol w moczu
Dwusiarczek węgla
kwas 4-tio-4-tiazolidyno karbonylowy w moczu
Fenol
fenol w moczu
Ksyleny
kwasy metylohipurowe w moczu
Nitrobenzen
nitrofenol w moczu i w osoczu , MetHb we krwi
Styren
kwas migdałowy oraz kwas fenyloglioksalowy
w moczu
Toulen
kwas hipurowy w moczu, toulen we krwi

O toksyczności stwierdzanej w
wewnętrznych przedziałach organizmu
danej substancji chemicznej -
traktowanej jako biomarker ekspozycji -
mówimy wówczas, gdy występuje ona w
stężeniu przekraczającym DSB.
DSB - najwyższe dopuszczalne
stężenie biologiczne ( dla dawki
pochłoniętej ) związków szkodliwych
lub ich metabolitów w płynach
ustrojowych ( przede wszystkim we
krwi i w moczu) oraz w tkankach.

BIOMARKERY SKUTKÓW
( EFEKTU)
Preferowane są biomarkery, które łączą się z mechanizmami
toksycznymi i określają ilościowo zależność dawka -
odpowiedź.
Trudności interpretacyjne wiążą się jednak z faktem, że:
* obserwuje się dużą zmienność wewnątrzosobniczą w
odpowiedzi na takie same dawki substancji chemicznych
* niektóre biomarkery są niespecyficzne lub niedostatecznie
specyficzne i określają więcej niż jedno uszkodzenie
narządowe lub proces chorobowy.
Dlatego wprowadzono dodatkowe pojęcie
-biomarker funkcji danego narządu.
Sposób postępowania diagnostycznego w aspekcie przyczynowo-
skutkowym zostanie podany na przykładzie biomarkerów
funkcji płuc.

Biomarkery funkcji
płuc
zwiększona liczba neutrofilów w BALF (bronchoalveolar lavage
fluid) - reakcja zapalna w regionie oskrzelowo-pęcherzykowym
zwiększone stężenie białka w BALF - zwiększenie
przepuszczalności bariery pęcherzykowo-włośniczkowej
beta -glukoronidaza - marker nasilonej fagocytozy
zwiększony poziom wydzielanego przez makrofagi płucne
nowotworowego czynnika martwicyTNF (tumor necrosis
factor) - procesy zwłóknienia w płucach
obniżony poziom glutationu - biomarker stresu oksydacyjnego
Narażenie środowiskowe na tlenki azotu i ozon może
doprowadzać do:
upośledzenia antyoksydacyjnych mechanizmów obronnych
poprzez zaburzenie równowagi oksydacyjno-antyoksydacyjnej,
indukować stany zapalne doprowadzając do przewlekłej
obturacyjnej choroby płuc.

Zakładając, że diagnozujemy np. spawacza, który w
środowisku pracy narażony był zarówno na tlenki azotu jak
i ozon w stężeniu przekraczającym NDS, to aby
wnioskować że:
• narażenie to było przyczyną toczącego się stanu
zapalnego należałoby uzyskać zwiększoną liczbę
neutrofilów w BALF.
W przypadku, gdyby uzyskano prawidłowe stężenie
glutationu w surowicy krwi można by wnioskować , że nie
nastąpiło upośledzenie funkcji antyoksydacyjnych.
Biomarkerami przekształcania się komórek prawidłowych
w komórki nowotworowe, wraz z ich wzrostem ,
prowadzącym do nowotworu , mogą być:
• alkilowane puryny
• addukty alfatoksyn z guaniną
• addukty cis-platyny
• addukty tyminoglikolu
• N-nitrozo-prolina w moczu jako marker endogennych N-
nitrozozwiązków

BIOMARKERY
WRAŻLIWOŚCI
Wrażliwość osobnicza na ksenobiotyki uzależniona jest
od szeregu czynników; najważniejsze z nich to:
czynniki genetyczne. wiek, ogólny stan zdrowia,
stan
odżywienia,
styl
życia
->
palenie
papierosów, używki.
Biomarkery wrażliwości identyfikują tych osobników w
populacji, którzy mają genetyczną lub nabytą
odmienność we wrażliwości na skutki spowodowane
ekspozycją na substancje chemiczne. Wiadomo
bowiem, że jeśli np. eksponowana jest grupa
osobników na działanie substancji rakotwórczej, to z
całą pewnością nie dojdzie do rozwoju choroby
nowotworowej u wszystkich robotników, ale u części
z nich czynnik ten może być przyczyną choroby.

Biomarkery wrażliwości na czynniki środowiskowe i
genetyczne
---------------------------------------------------------------------------------------------------
--
Biomarker
Czynnik
Choroba
wrażliwości
środowiskowy
---------------------------------------------------------------------------------------------------
--Indukowalność hydroksylazy WWA
rak płuca
węglowodorów
---------------------------------------------------------------------------------------------------
--
Alfa 1-antytrypsyna
dym tytoniowy rozedma
płuc
---------------------------------------------------------------------------------------------------
--
Indukcja cytochromu P-450IIE1
spoż. alkoholu rak o
różnej
lokalizacji
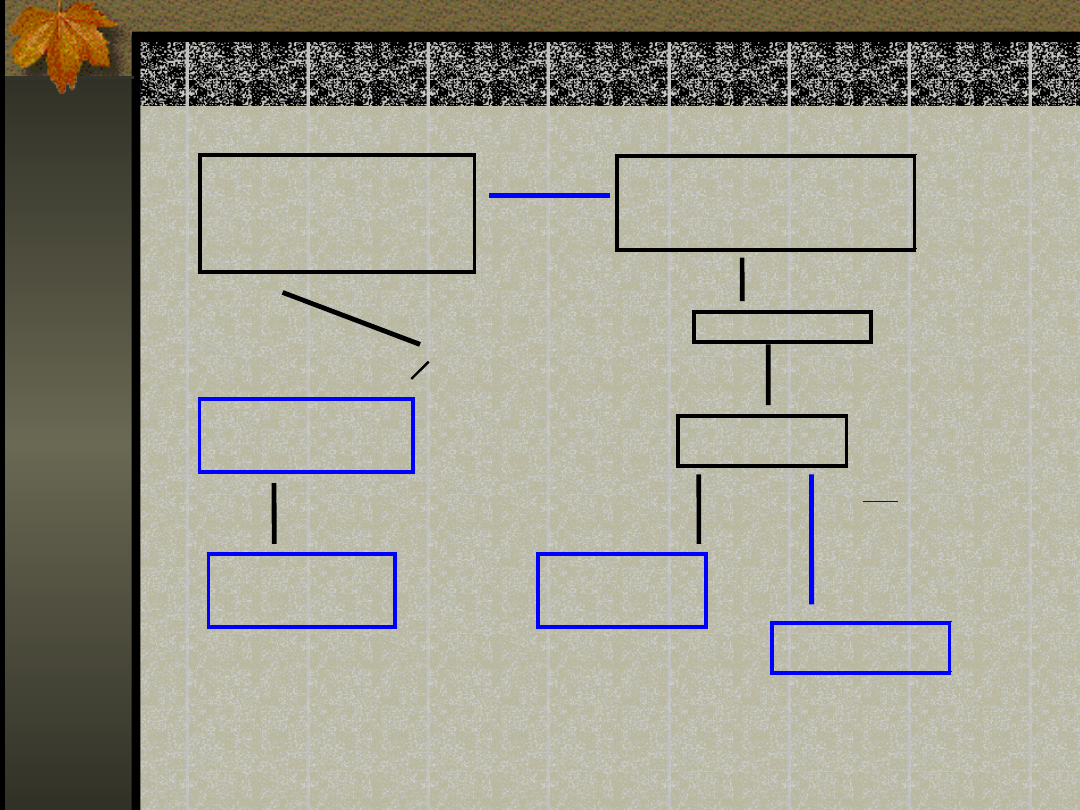
Dym tytoniowy
(wolne rodniki tlenowe )
rodnik hydroksylowy
nadtlenek wodoru
anion ponadtlenkowy
Oksydanty z zanieczyszczeń
przemysłowych i
motoryzacyjnych
NO
2
, O
3
skupienie
pęcherzykowych
makrofagów płucnych
1
antytropsyna
E L A S T A Z A
neutrofilowa
R o z e d m a
międzyzrazikowa
czynniki
chemotaktyczne
neurofitów
Leukocyty
wielojądrzaste
obojętnochłonne
metionina 358
utleniona
1
antytrypsyna
unieczynniona
utrata zdolności
unieczynniania elastazy
uwolnienie
przyciąganie
uwalniają
trawi:
* kolagen
* elastynę
* fibronektynę
tkanki śródmiąż. płuc
hamuje
( 394 reszty aminokwasowe )
unieczynnia elastazę przez
nieodwracalne wiązanie
z metioniną - 358

ODPOWIEDŹ USTROJU NA
EKSPOZYCJĘ ŚRODOWISKOWĄ I
ZAWODOWĄ
1.Sposób określania związku przyczynowo-
skutkowego między ekspozycją zawodową
a odpowiedzią organizmu człowieka
omówiony zostanie na przykładzie
narażenia na rtęć (I),
2.Określanie
związku
przyczynowo-
skutkowego
w
ekspozycji
zarówno
komunalnej
jak
i
zawodowej
na
przykładzie narażenia na ołów (II)

I.
Narażenie na rtęć metaliczną i jej pary ma miejsce przy
obsłudze różnego rodzaju aparatury pomiarowej
wypełnionej rtęcią i przy czyszczeniu rtęci.
Do ostrego zatrucia dochodzi w przypadku rtęci rozlanej w
pomieszczeniach nieodpowiednio przystosowanych.
Przewlekła ekspozycja prowadząca do zatrucie
przewlekłego najczęściej ma miejsce w przemyśle
chemicznym (elektroliza), w przemyśle elektro-chemicznym
(lampy rtęciowe, prostowniki ).
Rtęć do organizmu dostaje się głównie poprzez układ
oddechowy.
Na poziomie komórkowym jej toksyczność przejawia się
uszkodzeniem błon komórkowych (powinowactwo do grup
sulfhydrylowych białek).
Rtęć przenika przez barierę krew-mózg. W obrazie
klinicznym przeważają objawy uszkodzenia układu
nerwowego. W początkowym okresie rozwija się zespól
rzekomonerwicowy, potem nerwica rtęciowa.
Zmiany w obwodowym układzie nerwowym mają charakter
polineuropatii. Najwięcej rtęci gromadzi się w nerkach,
mimo to objawy uszkodzenia nerek obserwuje się rzadko.

Początkowa odpowiedź organizmu na działanie rtęci jest
niespecyficzna.
Aby etiologię zespołu rzekomonerwicowego powiązać z
ekspozycją na rtęć należy stwierdzić w pomiarach
środowiskowych stężenie rtęci przekraczające NDS.
NDS dla rtęci podawane jest jako suma rtęci i związków
nieorganicznych i wynosi 50 μg/m
3
, a NDS chwilowe 150 μg/ m
3
.
Biomarkerem ekspozycji na rtęć jest obecność rtęci w moczu.
DSB wynosi 50ug/l (0,25 μmol/l ) i w przypadku zatrucia rtęcią
DSB powinno być przekroczone.
Przy ewentualnym uszkodzeniu nerek powinny być stwierdzane
biomarkery funkcji tego narządu.
W zależności od lokalizacji uszkodzenia biomarkery są różne.
Jako biomarker uszkodzenia kłębków nerkowych uznawane są
kreatynina i beta 2-mikroglobulina w surowicy krwi oraz białka o
ciężarze cząsteczkowym > 400000 w moczu.
Przy uszkodzeniu kanalików nerkowych stwierdzane są
antygeny kanalikowe (BB50, BBA, HF5) oraz enzymy w moczu
(N-acetylo-beta-D-glukozoamidaza i B-galaktozydaza.
Kalikrenina w moczu i glikoproteina Thamm-Horfsfalla
świadczyć mogą o uszkodzeniu pętli Henlego i kanalika
dystalnego.

II.
Ekspozycja na ołów może być rozpatrywana w
podwójnym aspekcie:
narażenie w środowisku bytowania człowieka
narażenie w środowisku pracy
Źródłem zanieczyszczenia środowiska naturalnego
ołowiem może być:
sąsiedztwo przemysłu,
-spaliny benzyny etylizowanej
-ołowiane instalacje wodociągowe.
Od 1998 roku:
D
24
-2 μg/m
3
,
D
30
- 5 μg/m
3
,
D
A
-0,5 μg/m
3
.

Obserwowany jest spadek stężenia ołowiu np.
w Krakowie w 94 stężenie średnioroczne w powietrzu
atmosferycznym wynosiło 0,15 μg/m
3
-D
A
0,2 μg/m
3
,
w 98r stężenie ołowiu wynosiło 0,109 -D
A
-0,5 μg/m
3
.
Narażenie zawodowe ma miejsce głównie w hutach cynku i ołowiu
podczas przeróbki i wytapiania z rud, ale także w przemyśle
kaflarskim i ceramicznym oraz przy wyrobie szkła kryształowego,
przy wyrobie i remontach akumulatorów oraz w składnicach
złomu .
NDS dla ołowiu wynosi 50 μg/m
3
Ołów do ustroju wprowadzany jest z powietrzem atmosferycznym,
wodą i pokarmami.
Zatrucie ołowiem objawia się przede wszystkim uszkodzeniem:
układu krwiotwórczego (dochodzi do hamowania syntezy
hemoglobiny i skrócenia czasu przeżycia krwinek czerwonych)
układu nerwowego(polineuropatia i encephalopatia).

Znaczne zwiększenie stężenia ołowiu we krwi może prowadzić do
powstania ostrych objawów pod postacią kolki ołowiczej. Wczesny
okres zatrucia ołowiem przebiega bezobjawowo.
Objawy ołowicy są niespecyficzne .
W rozpoznaniu różnicowym należy pamiętać o tym, że:
- niedokrwistość oraz choroby ośrodkowego i obwodowego układu
nerwowego mogą mieć etiologię niezależną od ołowicy,
- kolkę ołowiową należy różnicować z kolką nerkową, żółciową,
zapaleniem trzustki, czy jelit.
Dlatego niezmiernie ważne jest oznaczenie biomarkerów
ekspozycji na ołów.
Nie mniej jednak również biomarkery mogą być niespecyficzne
lub niedostatecznie specyficzne.
Np. związane z ekspozycją na ołów zahamowanie aktywności
enzymów biosyntezy hemu znajduje odzwierciedlenie we wzroście
poziomu wolnej protoporfiryny erytrocytarnej.
Jednak poziom wolnej protoporfiryny erytrocytarnej wzrasta
również w stanach niedoboru żelaza.
Dlatego stosuje się kompleksowe oszacowanie.

W praktyce klinicznej oznaczane jest:
•- stężenie ołowiu we krwi
•- stężenie kwasu delta –aminolewulinowego w moczu.
DSB dla ołowiu we krwi wynosi 600 μg/l (2,28 μmol/l), a u
kobiet w wieku rozrodczym 300 μg/l (1,44 μmol/l).
DSB dla kwasu delta–aminolewulinowego (wg metody
Grabskiego) wynosi 17mg/l (129,6umol/l), a dla
protoporfiryny w krwinkach czerwonych - 10ug/gHb (1400
ug/l krwi).
Górne granice stężeń tych biomarkerów dla populacji
nienarażonej zawodowo są oczywiście niższe.
Ołów we krwi: 200 μg/l (0,97 μmol/l) ,
kwas delta –aminolewulinowy: 10mg/l (76,3umol/l),
protoporfiryna w erytrocytach- 2,5 ug/gHb (350 ug/l)

Wrażliwość osobnicza na ekspozycję
środowiskową uzależniona jest od całego szeregu
czynników.
Oprócz czynników genetycznych dużą rolę
odgrywa ogólny stan zdrowia, stan odżywienia
oraz styl życia.
Natomiast jako biomarker wrażliwości uważane
mogą być niedobory IgA.
Powyższy sposób diagnozowania schorzeń o
etiologii środowiskowej odgrywa rolę przede
wszystkim w początkowym okresie jeszcze przed
ujawnieniem się typowych objawów klinicznych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
biotransformacja ksenobiotyków, toksykologia II rok SUM
toksyczność ksenobiotyków, toksykologia
Większość ksenobiotyków wchłania się w sposób bierny, Toksykologia2
toksykologia 4
Analiza toksykologiczna
Toksykologia sądowo lekarska
TOKSYKOLOGIA 8
5 Toksykokinetyka i toksykodynamika
Poradnik Toksykologia
salicylany, V ROK, TOKSYKOLOGIA, notatki, kolos 1
Mechanizmy absorpcji trucizn, TOKSYKOLOGIA, Toksykologia
Kw szczawiowy, WNOŻCiK wieczorowe, semestr V, toksykologia
TOXYKIwieczorowi, toksykologia żywności SGGW
więcej podobnych podstron