
Korozja metali i stopów

Definicja zjawiska korozji:
Korozją - oddziaływanie fizykochemiczne i
elektrolityczne między materiałem metalowym a
otaczającym środowiskiem, w wyniku którego
następuje uszkodzenie korozyjne powodujące
zmniejszenie własności metalu.
Ze względu na typ reakcji powodujących niszczenie
metalu i stopów istnieje korozja :
- elektrochemiczna
- chemiczna

Skutki korozji
Korozja powoduje znaczne obniżenie własności
mechanicznych i użytkowych maszyn, urządzeń i
elementów, np. kotłów parowych, konstrukcji mostów,
łopatek turbin, instalacji chemicznych, zbiorników,
rurociągów, samochodów, istotnie zmniejszając
bezpieczeństwo ich stosowania. Dotyczy to ok. 30%
ogólnej liczby produktów z metali i ich stopów.

Straty ekonomiczne
bezpośrednie
Straty bezpośrednie są związane z
koniecznością:
• dokonywania wymiany uszkodzonych
konstrukcji maszyn i urządzeń,
• stosowania pokryć antykorozyjnych,
• osuszania magazynów etc

Straty ekonomiczne bezpośrednie
c.d.
Straty bezpośrednie powstają również w
procesie wytwarzania:
• np. 7- 10% produkcji stali ulega
zniszczeniu podczas obróbki cieplnej,
plastycznej wskutek tworzenia się
zgorzeliny

Straty ekonomiczne pośrednie
Straty pośrednie są związane:
• z przerwami w eksploatacji urządzeń w
celu naprawy lub wymiany
• ze stratami materiałów np. w wyniku
przecieków olejów, gazów, wody
• zmniejszeniem wydajności np.
wymienników ciepła
• ze stratami energetycznymi
• ze stratami pracy ludzkiej
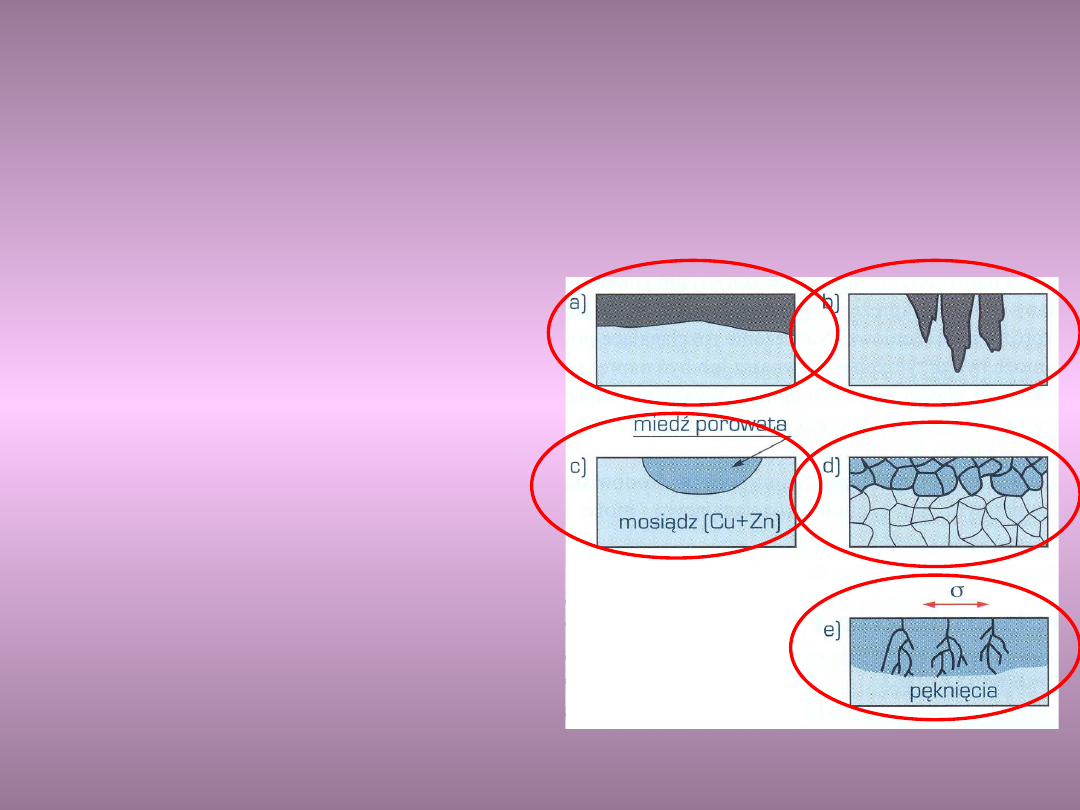
Odmiany uszkodzeń korozyjnych
Ze względu na wygląd zewnętrzny i zmiany
własności fizycznych wyróżnić można kilka
zasadniczych odmian korozji:
a) korozja równomierna
b)korozja wżerowa
c) korozja selektywna
d)korozja międzykrystaliczna
e) pękanie korozyjne

Korozja
równomierna
Korozja równomierna polega na jednostajnym na
całej powierzchni niszczeniu metalu w miarę upływu
czasu
• Szybkość korozji v
KR
jest podawana w mm/rok lub w
mg/dm2 x doba
• Metale o v
KR
< 0,15 mm/r są stosowane na
odpowiedzialne elementy narażone na trudne
warunki pracy jak: gniazda zaworów, wirniki pomp.
• Metale o v
KR
> 0,15 mm/r nie mogą być stosowane
na odpowiedzialne elementy narażone na trudne
warunki pracy jak: gniazda zaworów, wirniki pomp.

Korozja wżerowa
Korozja wżerowa charakteryzuje się nie
równomiernym niszczeniu metalu w miarę
upływu czasu.
• Stosunek największej głębokości wżerów
do głębokości średniej, wynikającej z
ubytku masy próbki, nosi nazwę
współczynnika korozji wżerowej WKW
• Dla korozji równomiernej Wkw = 1

Korozja
selektywna
Korozja selektywna polega na niszczeniu jednej
lub kilku faz ze znacznie większą szybkością
od szybkości uszkadzania osnowy stopu
W wyniku tego porowata pozostałość
zachowuje swój pierwotny kształt, obniżeniu
ulega wytrzymałość materiału
Korozja selektywna występuje m.in. w stopach
metali szlachetnych, np. Au-Ag i Au-Cu
Przykładem jest odcynkowanie mosiądzów
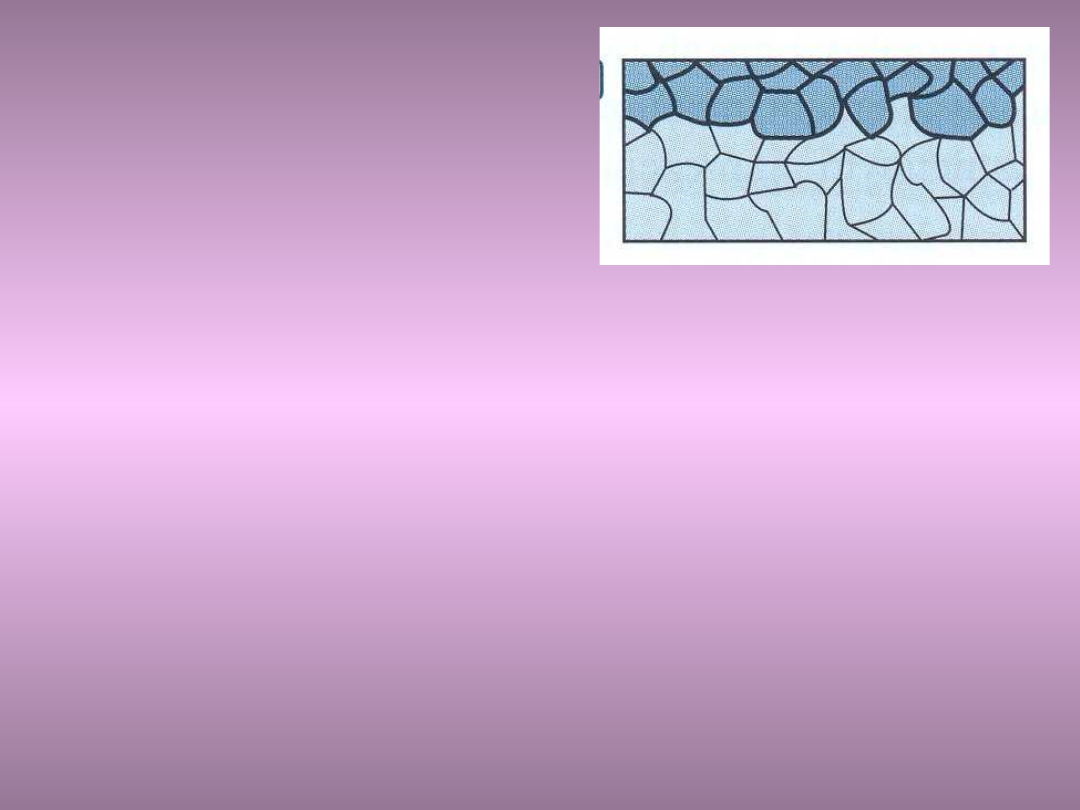
Korozja
międzykrystaliczna
Korozja międzykrystaliczna przebiega głównie na
granicach ziarn metali i stopów, postępując z
bardzo dużą szybkością i sięgając na dużą
głębokość
Korozja międzykrystaliczna powoduje często
katastrofalne zniszczenia w wyniku znacznego
zmniejszenia wytrzymałości i ciągliwości
metalu, bez wyraźnie widocznych zewnętrznie
objawów
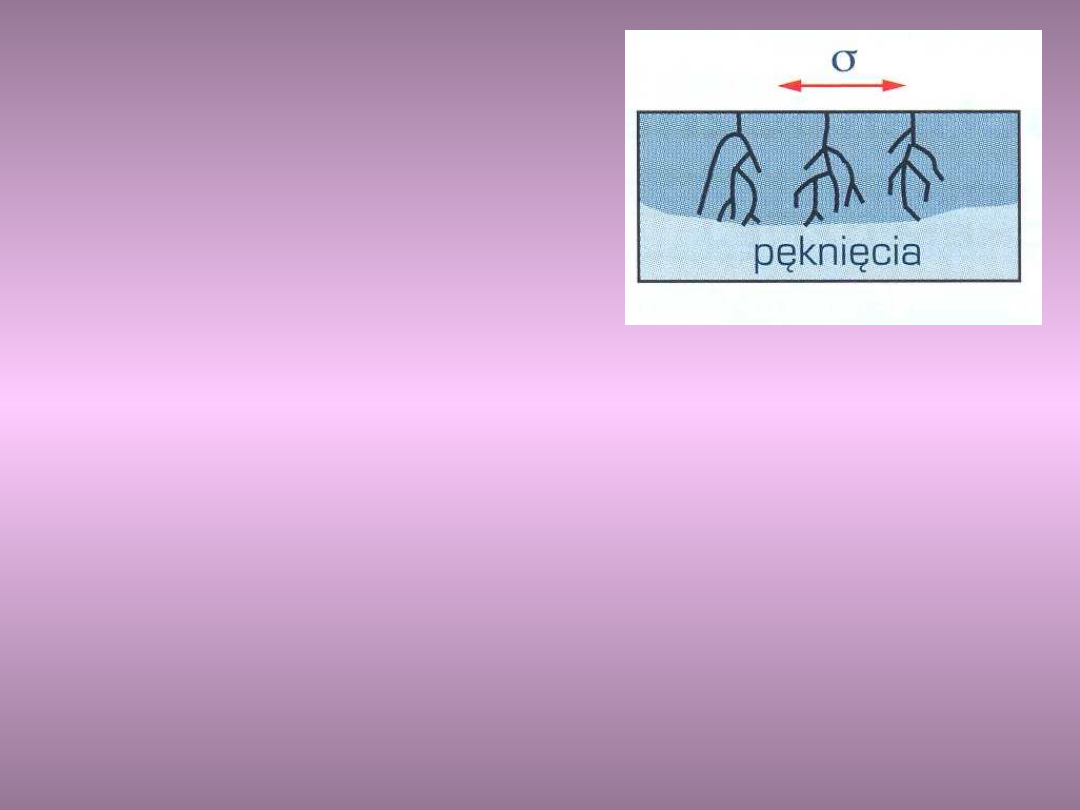
Korozja
naprężeniowa i
zmęczeniowa
Pękanie korozyjne jest powodowane
jednoczesnym działaniem środowiska
korozyjnego i naprężeń rozciągających stałych
lub zmiennych
Naprężenie rozciągające może być wywołane np.
obróbką plastyczną, cieplną lub spawaniem
Naprężenie powodujące pęknięcia w wyniku
korozji naprężeniowej są znacznie mniejsze od
granicy plastyczności i wytrzymałości metali i
stopów

Korozja elektrochemiczna
Procesy korozji najczęściej mają charakter
elektrochemiczny.
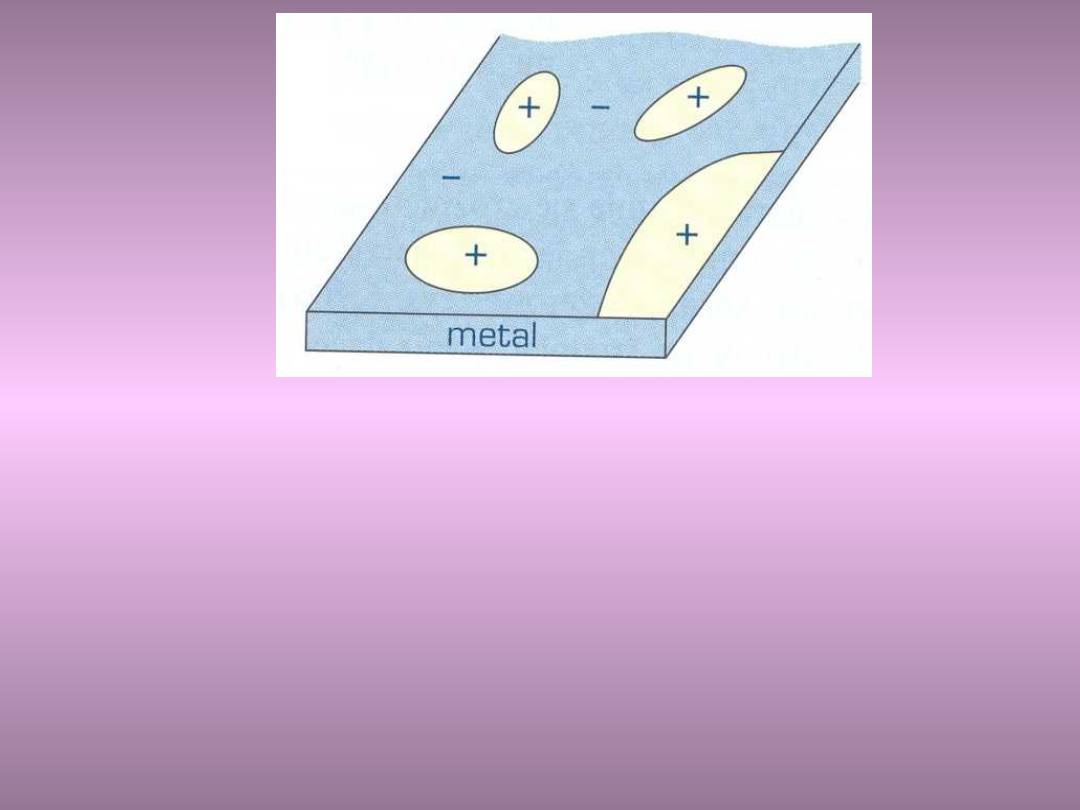
Powierzchnia każdego metalu lub stopu stanowi
zbiór elektrod dodatnich i ujemnych, pomiędzy
którymi występuje różnica potencjałów
Gdy na metal działa elektrolit (kwas, woda, wodne
roztwory soli), tworzą się lokalne mikroogniwa i
lokalny przepływ prądu elektrycznego
Towarzyszą temu reakcje redukcji i utleniania
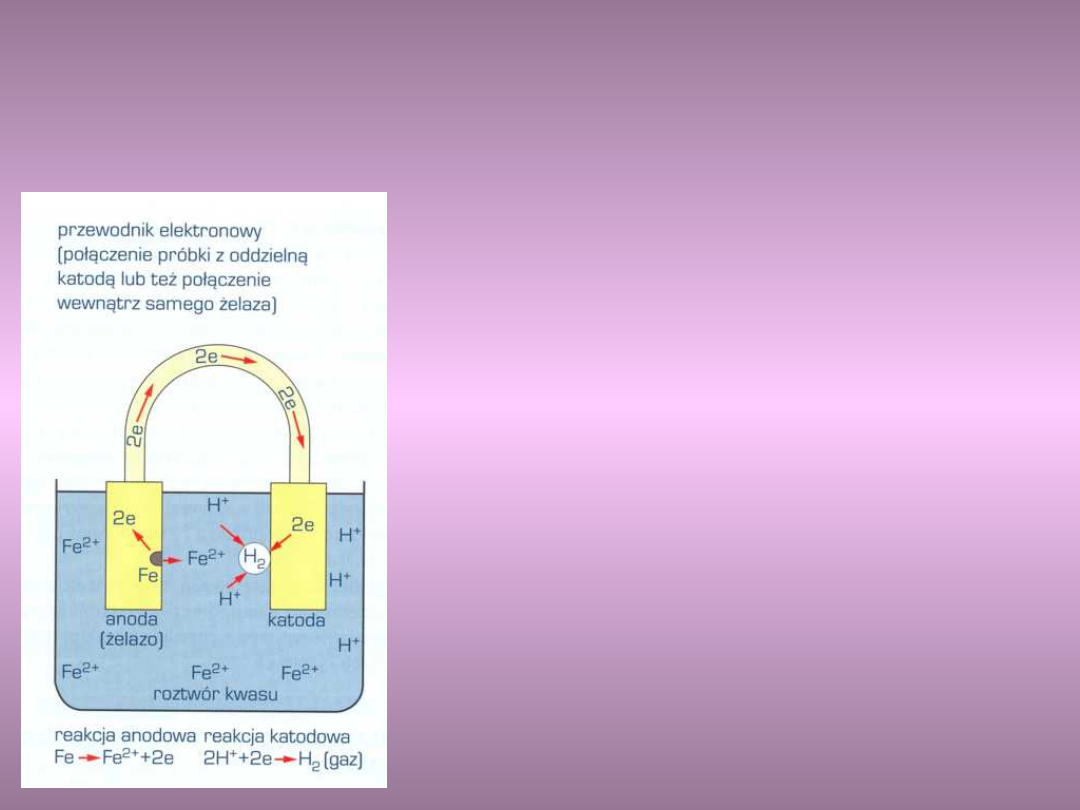
Schemat procesów zachodzących na
dwu elektrodach w czasie korozji żelaza
w roztworze kwasu
Reakcja redukcji zachodzi na
elektrodzie zwanej katodą. Polega
na przepływie elektronów,
anionów np. Cl
-,
OH
-
, do anody.
Reakcja utleniania zachodzi na
anodzie. Polega na przepływie
kationów, np. H
+
, Fe
2+
, z anody do
katody.
Korozja następuje tylko na
anodach mikroogniw, gdzie zwykle
tworzą się sole, lub wodorotlenki.

Czynniki decydujące o przebiegu
korozji elektrochemicznej
Skłonność metalu lub stopu do korozji
elektrochemicznej wzrasta wraz ze zwiększeniem siły
elektromotorycznej ogniw korozyjnych.
Metale uporządkowano w tak zwanym szeregu
napięciowym według malejących standardowych
potencjałów utleniających, tj. potencjałów równowagi
danego metalu z jego jonami o jednostkowej
aktywności.
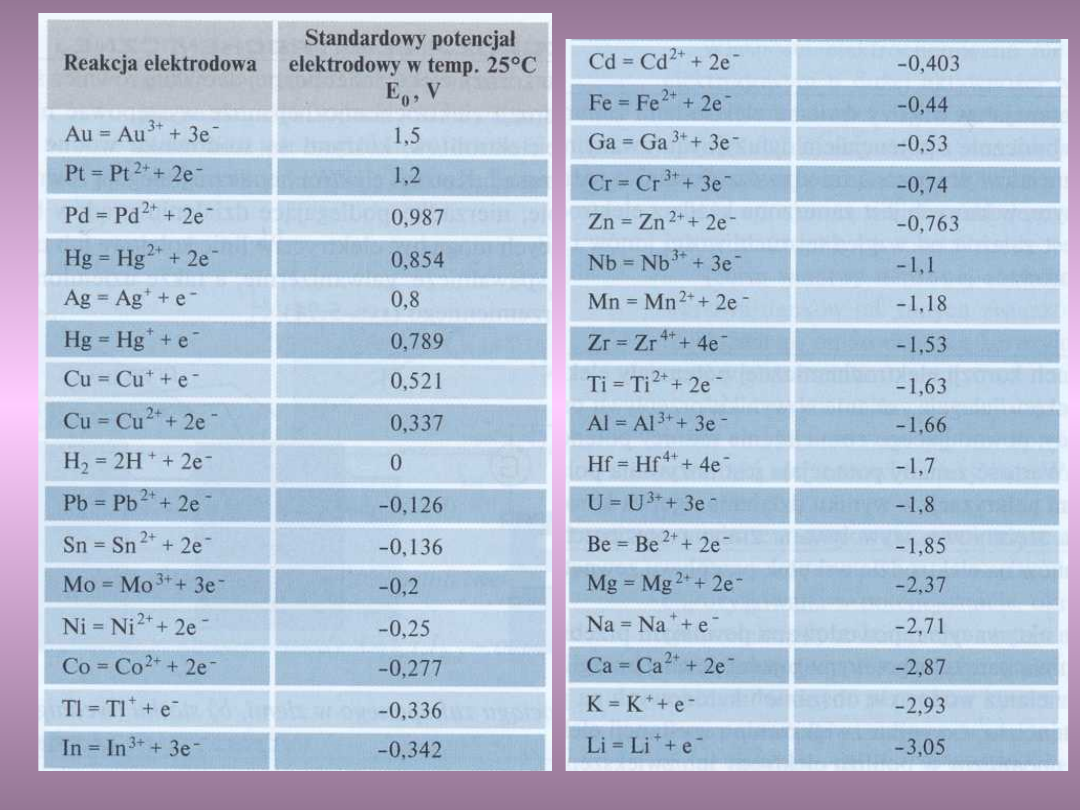
Szereg napięciowy metali

Szereg napięciowy metali c.d.
Spośród metali tworzących ogniwo korozyjne anodę
stanowi metal o wyższym standardowym potencjale
utleniającym, wykazującym większą aktywność, a
zatem większą podatność na korozję.
Np. żelazo w roztworze wodnym jonów Fe
2+
o
aktywności równej jedności pozostaje w równowadze
przy potencjale 0,440 V.

Środowiska sprzyjające korozji
elektrochemicznej
O przebiegu korozji elektrochemicznej decyduje
również środowisko korozyjne.
Mechanizm korozji elektrochemicznej występuje w
środowisku wodnym, wodnych roztworach kwasów,
soli i zasad.
Korozji elektrochemicznej ulegają również metale i
stopy zakopane w ziemi i podlegającymi działaniu
prądów błądzących.
Źródłami prądów błądzących są elektryczne linie
kolejowe, tramwajowe, elektryczne urządzenia
spawalnicze, galwanizernie, uziemione linie
wysokiego napięcia.
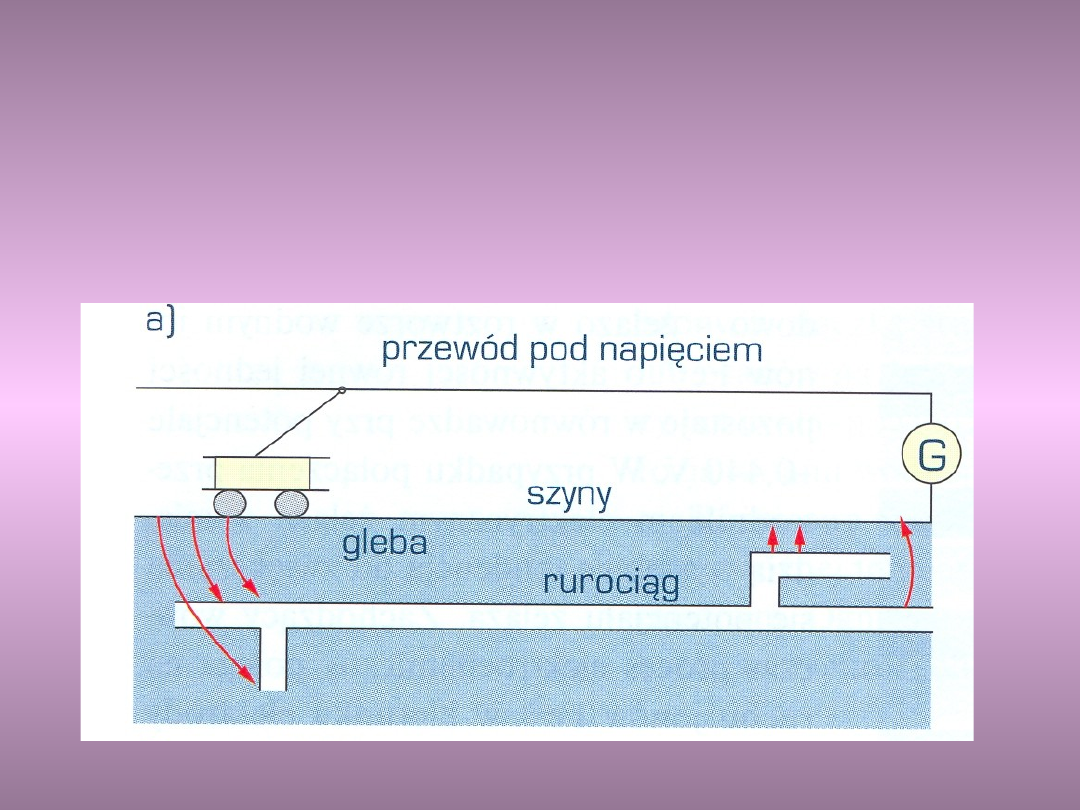
Korozja w wyniku prądów
błądzących
a) rurociągu zakopanego w
ziemi
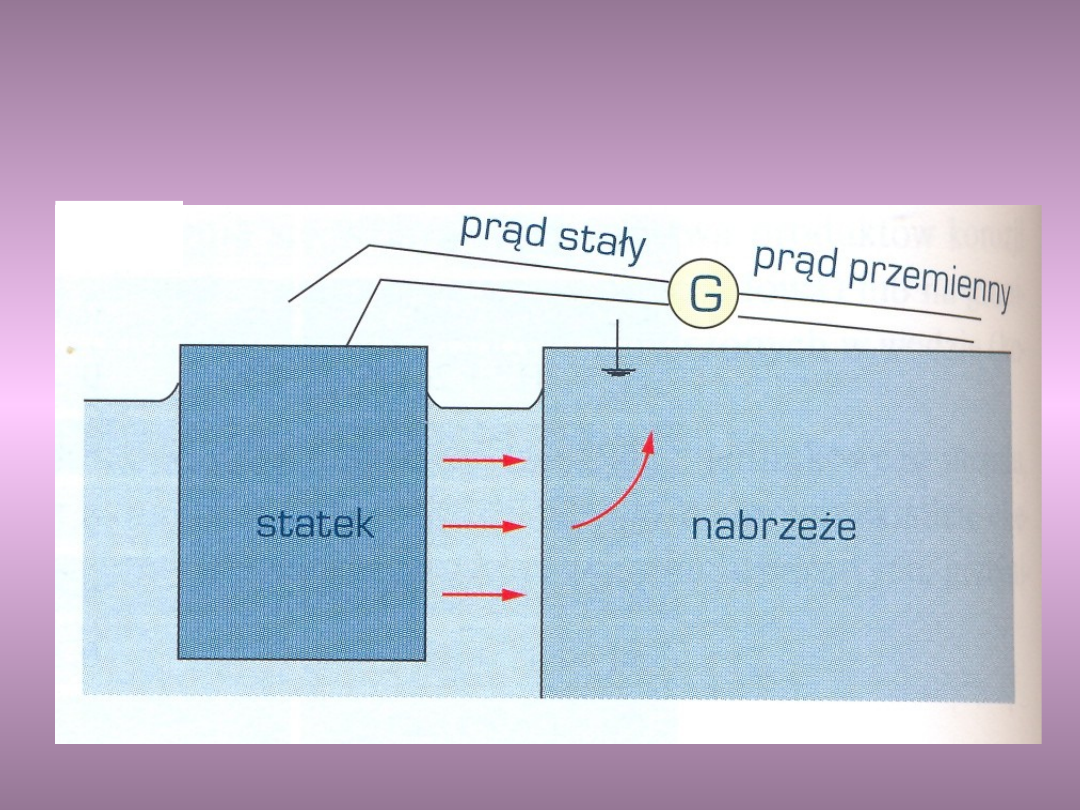
Korozja statku w wyniku prądów
błądzących

Pasywacja metali
Własności elektrochemiczne metalu cechującego się
dodatnim potencjałem utleniającym o dużej
aktywności w szeregu napięciowym lub stopu
złożonego z takich metali niekiedy odpowiadają
analogicznym własnościom metali szlachetnych. Stan
taki jest nazywany pasywnym.
Do metali tych należą chrom, nikiel, molibden, a
stopami pasywnymi są np. stale odporne korozję i
monel (70% Ni i 30% Cu).

Teorie pasywacji metali
Teoria warstwy tlenkowej zakłada, że o
pasywności metali decyduje szczelna warstwa
tlenków lub innych związków, tworząca się na
powierzchni metalu i oddzielająca go od środowiska
korozyjnego, uniemożliwiającego dyfuzję produktów
korozji w głąb metalu.
Adsorpcyjna teoria pasywacji zakłada, że metal
pasywny jest pokryty zaadsorbowaną chemicznie
warstwą, np. tlenu, podwyższającą napięcie
anodowe. Warstwa taka nie stanowi bariery
uniemożliwiającej dyfuzję.

Wykresy PKR
Rodzaj związków elektrochemicznych, które
mogą się tworzyć w wyniku korozji elektrochemicznej
w różnych warunkach, umożliwiając m.in. pasywacje
metali, podają wykresy PKR zależności reakcji
korozyjnych R od potencjału P i kwasowości K
elektrolitu pH.

Korozja gazowa
Istota i skutki korozji gazowej
Korozja gazowa w środowisku zawierającym tlen lub
powietrze, azot, siarkę i jej związki, spaliny i pary jest
najczęstszym przykładem korozji chemicznej
polegającej na niszczeniu metali i stopów w wyniku
reakcji korozji chemicznych.
Korozja gazowa przynosi dotkliwe straty w
przemysłach chemicznym, energetycznym, w
transporcie samochodowym i lotniczym – wszędzie
tam, gdzie elementy konstrukcyjne narażone są na
działanie gorących par i gazów.
Korozja gazowa powoduje straty w procesach
wytwarzania metali, głównie wskutek tworzenia
zgorzeliny podczas obróbki plastycznej i cieplnej
metali i stopów, zwłaszcza stali.

Reakcja chemiczna utleniania
Podstawowym typem reakcji powodującej korozję
gazową (głównie podczas obróbki plastycznej i
cieplnej) jest reakcja utleniania
M +
1
/
2
X
2
MX
gdzie:
M – metal
X
2
– utleniacz, np. O
2
, S
2
, N
2

Szybkość utleniania metali i
stopów
Szybkość elementarnych procesów cząstkowych
reakcji utleniania metali i stopów zależy od
temperatury i ciśnienia.
W wysokiej temperaturze reakcje chemiczne
przebiegają szybciej niż dyfuzja jonów metalu lub
utleniacza przez warstwę zgorzeliny.
Z tego powodu dyfuzja określa szybkość reakcji
sumarycznej.
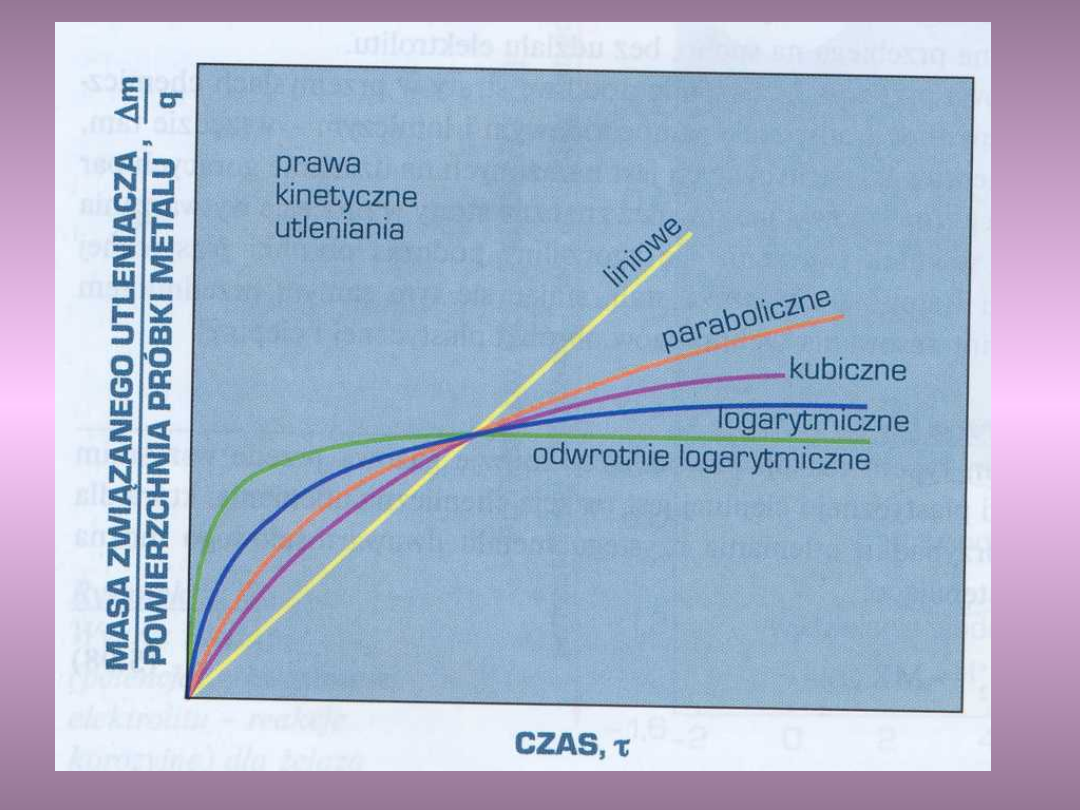
Schemat praw kinetycznych
utleniania metali

Produkty korozji gazowej
Produkty reakcji utleniania metalu zwykle występują
w stanie stałym, rzadko w stanie ciekłym lub
gazowym.
Warstwy stałego produktu reakcji utleniania w
zależności od grubości są nazywane:
Zgorzelinami, jeśli ich grubość jest większa od 10
um.
Warstwami nalotowymi – grubość mniejsza od 10
um.

Typ zgorzeliny tworzącej się w
temperaturze 1000
o
C na żelazie w
zależności od rodzaju atmosfery
utleniającej
Ośrodek
Ciśnienie
Zgorzelina zwarta
Mieszanina
CO-CO
2
pO
2
< od prężności
rozkładowej Fe
3
O
4
Jednofazowa
FeO
Para wodna pO
2
< od preżności
rozkładowej Fe
2
O
3
ale > od pr Fe
3
O
4
Jednofazowa
FeO
Powietrze
pO
2
> od preżności
rozkładowej Fe
2
O
3
Trójfazowa
FeO, Fe
3
O
4
, Fe
2
O
3
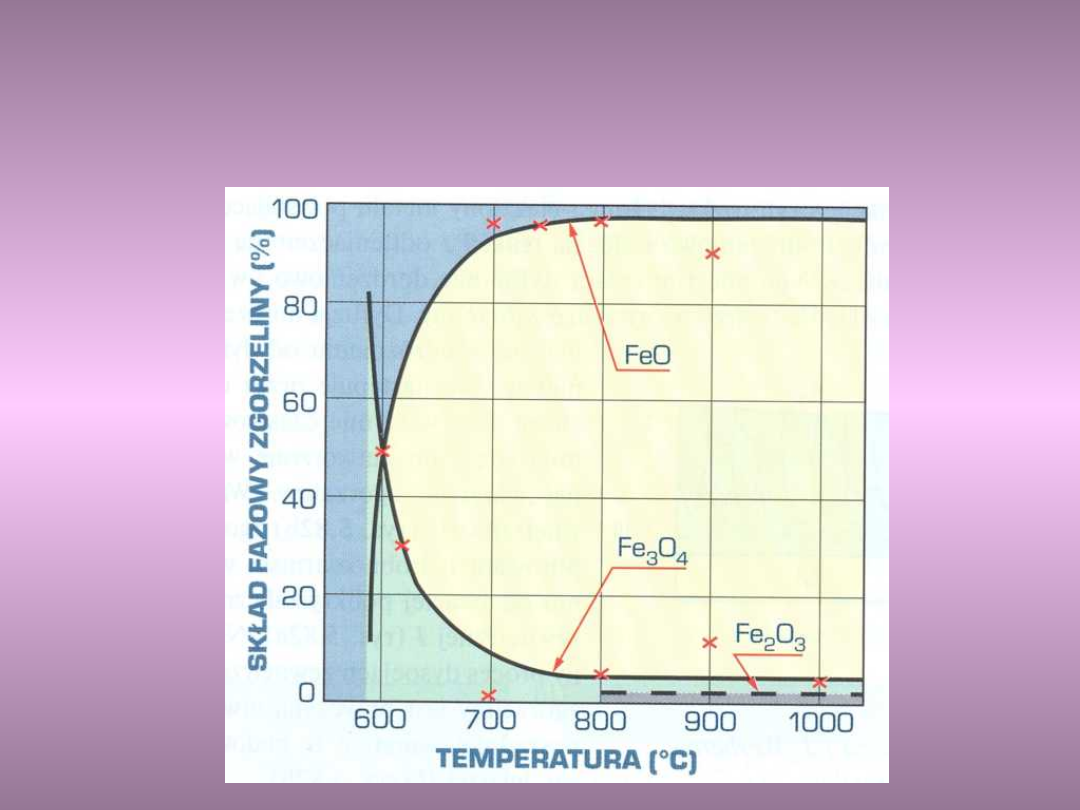
Wpływ temperatury na skład
fazowy zgorzeliny na żelazie

Czynniki wpływające na korozję
gazową
• Skład chemiczny atmosfery
korozyjnej
• Temperatura
• Rodzaj metalu
• Skład chemiczny stopu

Nowe terminy
• Korozja, jej odmiany i mechanizmy:
• Korozja elektrochemiczna, chemiczna,
równomierna, wżerowa, selektywna, gazowa

Pytania
• Na czym polega korozja? (Definicja korozji)
• Jakie są skutki korozji? (Odmiany zniszczeń
korozyjnych)
• Jak przebiega korozja elektrochemiczna?
(Mechanizm)
• Czynniki decydujące o przebiegu korozji
elektrochemicznej
• Jak przebiega korozja gazowa?
• Jakie są mechanizmy powstawania zgorzelin na
czystych metalach i ich stopach?

Ochrona przed korozją
Znajomość mechanizmów korozji oraz środowisk
korozyjnych, w których maszyny pracują umożliwia
zastosowanie odpowiednich i najskuteczniejszych
środków zabezpieczających przed korozją. Są to:
• Dobór składu chemicznego stopów
• Ochrona katodowa
• Ochrona protektorowa
• Ochrona anodowa
• Stosowanie inhibitorów
• Powłoki i warstwy ochronne
• Ograniczenie oddziaływania środowiska korozyjnego

Zasady doboru składu chemicznego
stopów w celu zwiększenia odporności
na korozję elektrochemiczną
• Podatność metali i stopów na korozję
elektrochemiczną zależy od składu chemicznego i
struktury fazowej stopu. Odpowiedni dobór składu
chemicznego powoduje przesunięcie standardowego
potencjału elektrodowego stopu do wartości
dodatnich, zapewniając wysoką odporność na korozję.
Działanie takie wywołuje chrom w stali o zaw. 13%.
• Wysoką odporność na korozję elektrochemiczną
wykazują stopy lub metale jednofazowe, gdyż nie
występują na ich powierzchni mikroogniwa między
dwiema fazami. Dążenie do uzyskania struktury
jednofazowej stanowi jedną z zasad doboru składu
chemicznego stali i stopów odpornych na korozję
elektrochemiczną.

Zasady doboru składu chemicznego
stopów w celu zwiększenia odporności
na korozję gazową
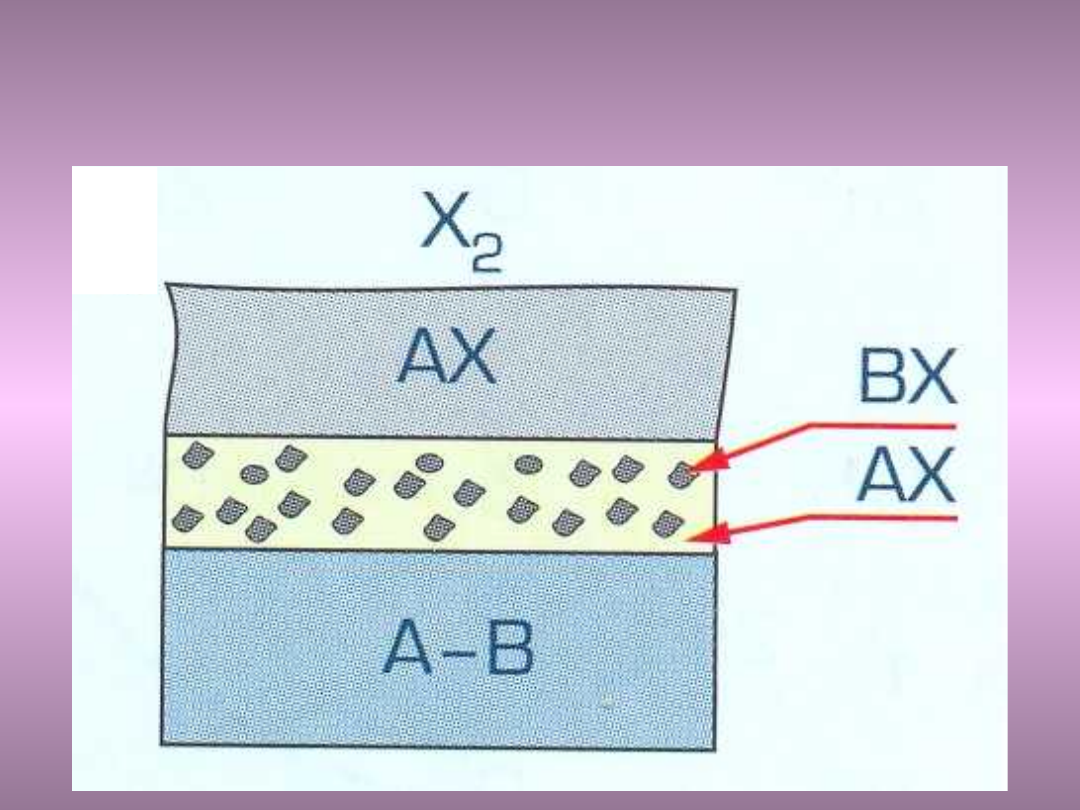
• Skład chemiczny stali i jego zdolność do tworzenia
zgorzeliny stanowiącej jednocześnie rolę warstwy
ochronnej, należy do najistotniejszych czynników
decydujących o przebiegu korozji gazowej.
• Dobre własności ochronne wykazuje zgorzelina w
postaci ciągłej warstwy jednofazowej związku – np.
BX utworzona na powierzchni przez dodatek
stopowy o znacznym powinowactwie chemicznym z
utleniaczem. Dodatkami takimi są: Zn, Al., Si, Cr, Be
i Mg.
• Istotne jest przy tym, by związek ten ściśle przylegał
do rdzenia metalicznego i nie tworzył niskotopliwych
eutektyk.
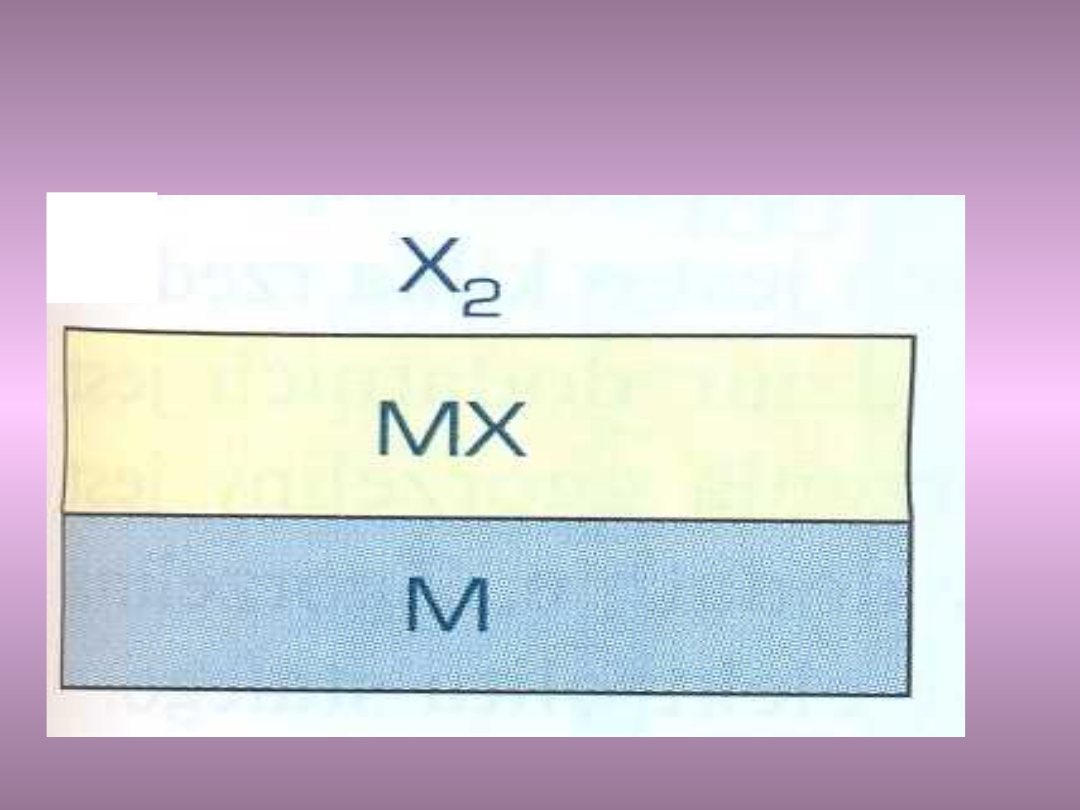
Przykłady: zgorzelina jednofazowa
zwarta – dobre własności
antykorozyjne
Al
2
O
3
, Cr
2
O
3
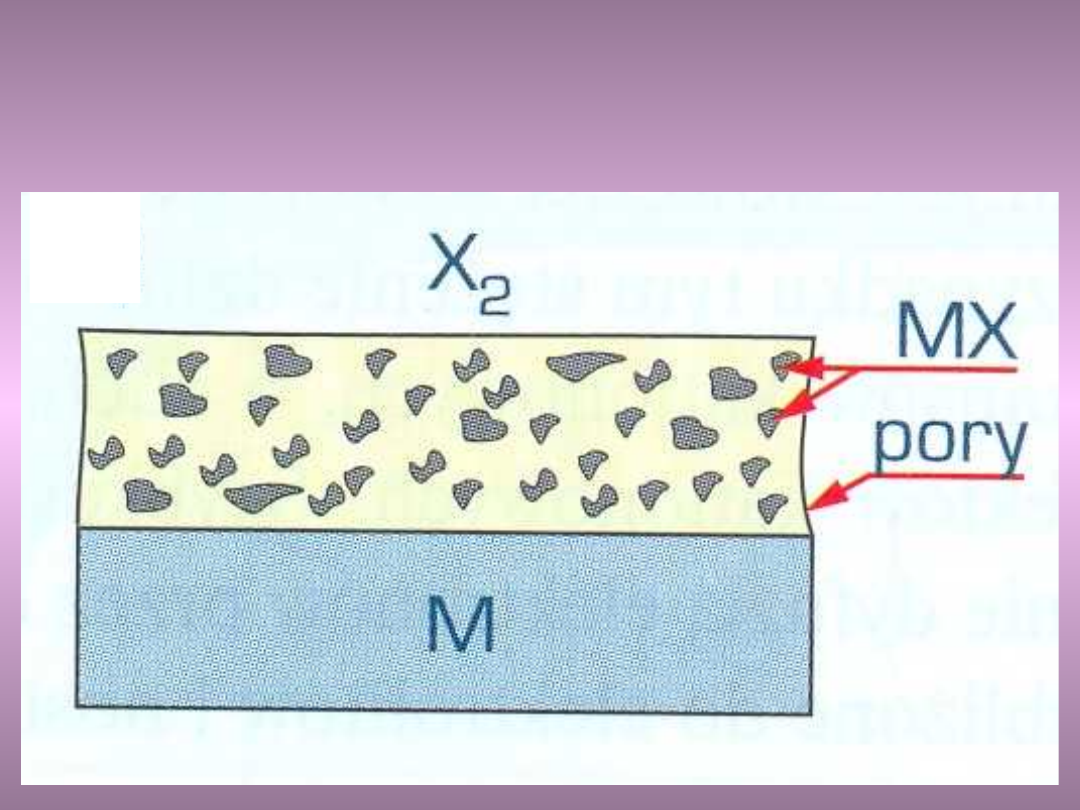
Przykłady: zgorzelina
jednofazowa porowata – złe
własności antykorozyjne
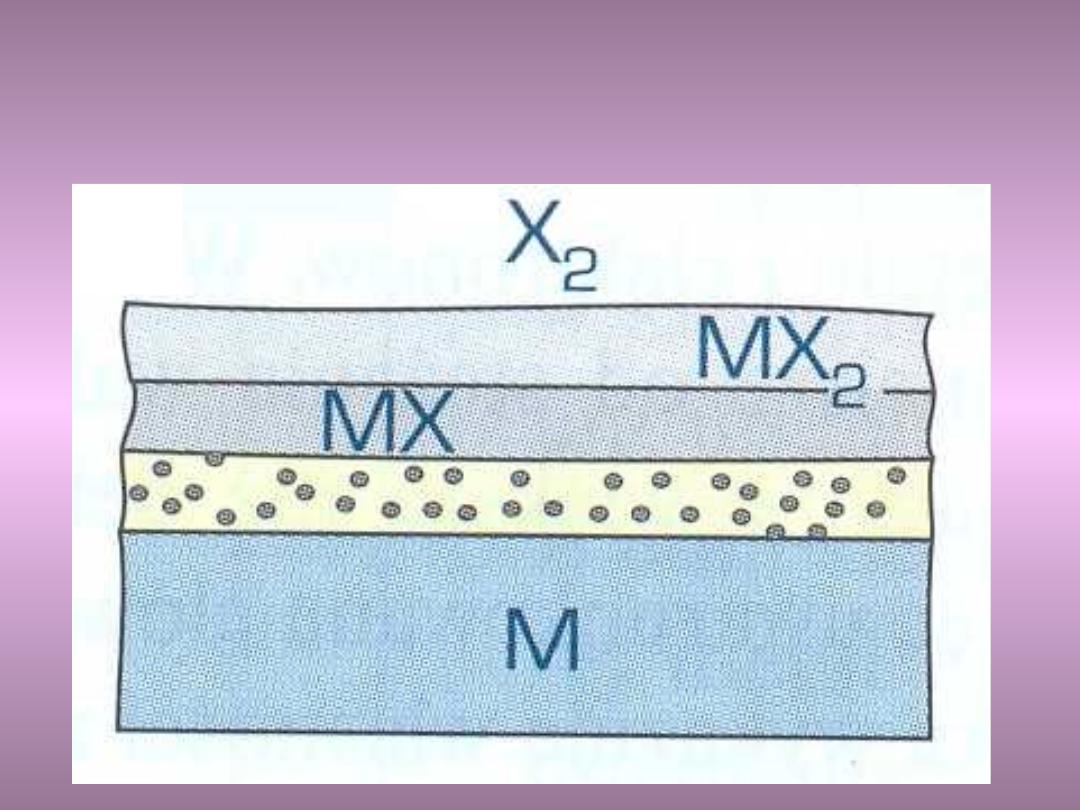
Przykłady: Zgorzelina
dwufazowa zwarta – złe
własności antykorozyjne
Dwufazowa ze strefą utleniania
wewnętrznego – polepsza
żaroodporność

Dodatki stopowe przyśpieszające
korozję
• Przykładem jest węgiel (podstawowy składnik
stopowy) decyduje o własnościach mechanicznych
stali.
• Selektywne utlenianie węgla powoduje odwęglenie,
natomiast przewaga utleniania żelaza – na
dodatkowe nawęglenie stali.
• W obydwu przypadkach powoduje to zmianę składu
fazowego, własności fizycznych i mechanicznych
oraz wielokrotnie przyśpieszone zużycie korozyjne.

Ochrona katodowa
Metodą tą można chronić:
• Stale, miedź, ołów, mosiądze pracujące w
roztworach wodnych lub glebie.
• Metale i stopy pasywne takie jak aluminium lub
stal odporna na korozję
• Stale niskowęglowe, magnez
• Metale i stopy ulegające korozji naprężeniowej i
zmęczeniowej
• Stale kwasoodporne i duraluminium uegające
korozji międzykrystalicznej

Ochrona katodowa
• Ochrona katodowa polega na polaryzacji
zewnętrznym prądem metalu, na powierzchni którego
występują lokalne ogniwa korozji elektrochemicznej.
• Prąd ze źródła prądu stałego płynie przez elektrodę
odniesienia (anodę) z dowolnego metalu i elektrolit
do metalu korodującego, a następnie do źródła prądu.
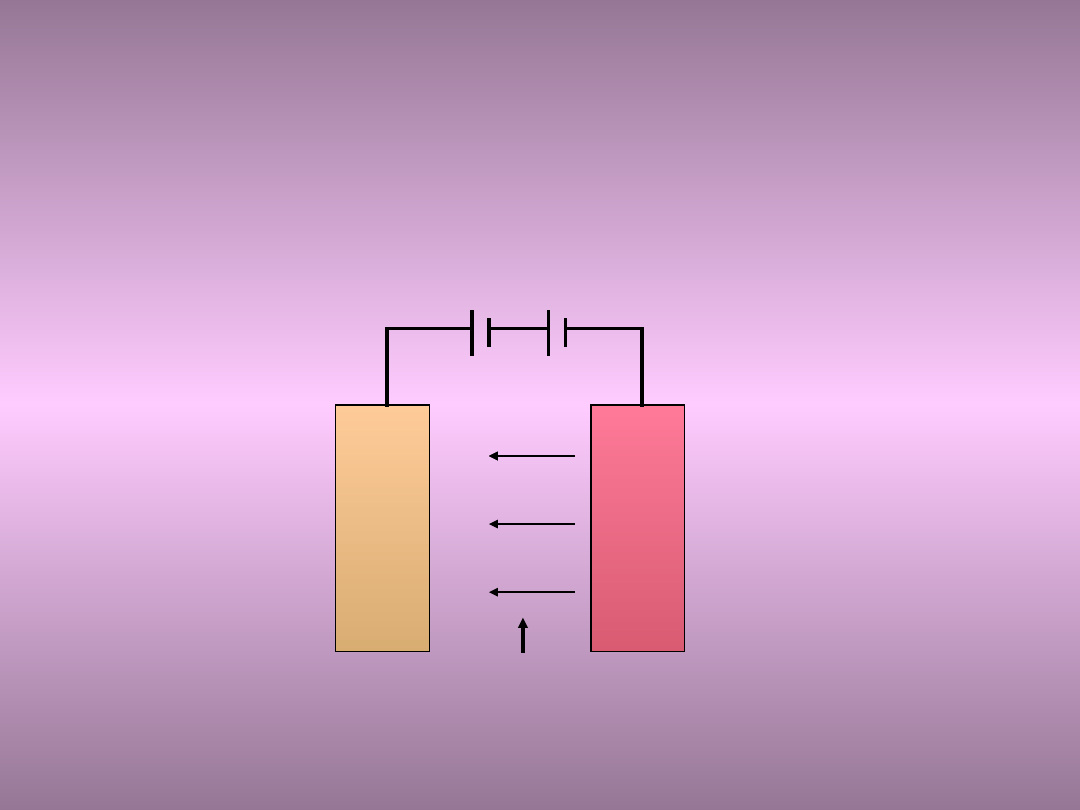
Schemat układu elektrycznego
+
-
+
+
metal
korodując
y
elektroda
odniesieni
a
Z
elektrolit

Ochrona katodowa
• W wyniku polaryzacji elektrody katodowe
występujące na powierzchni metalu korodującego
osiągają potencjał anody ogniwa otwartego.
• Następuje zatem wyrównanie potencjału na całej
powierzchni metalu i nie występuje przepływ
prądu korozyjnego, a zatem nie występuje
korozja.
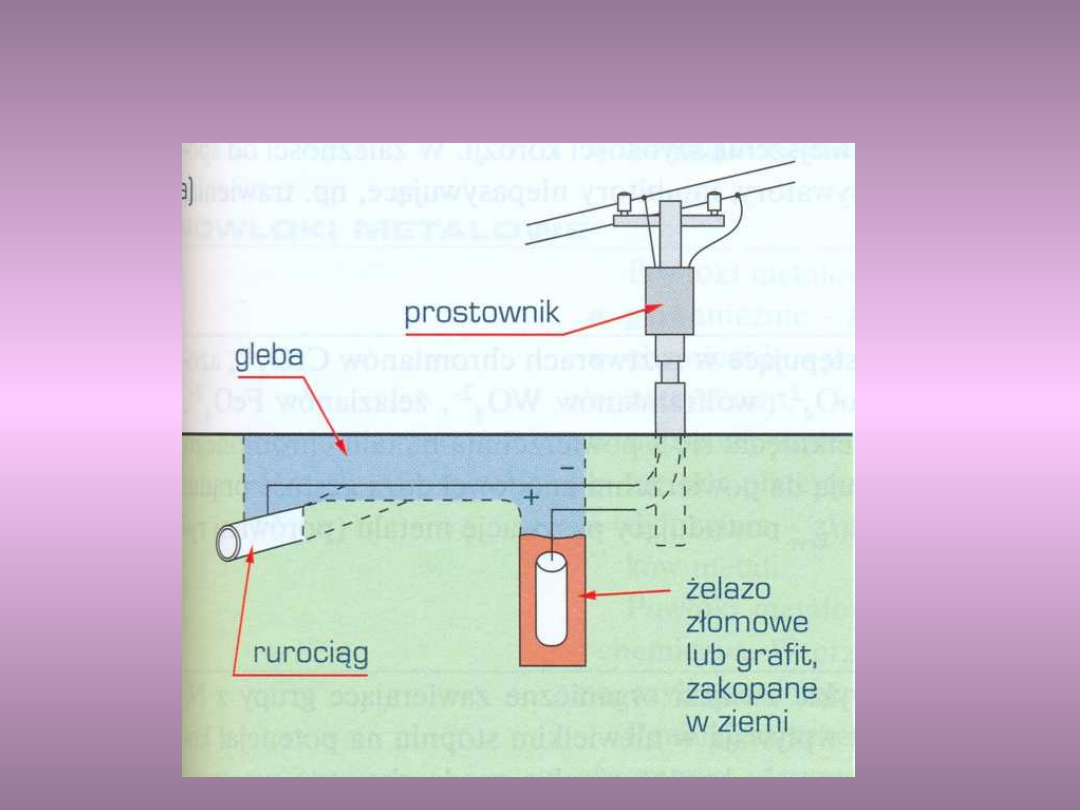
Ochrona katodowa – rurociąg w
ziemi

Inne środki ochrony przed
korozją
• Inhibitory
• Pasywatory
• Środki konserwacyjne
• Powłoki w warstwy ochronne
• Powłoki metalowe
• Powłoki nieorganiczne
• Powłoki organiczne
• Inne sposoby zapobiegania korozji

Inhibitory
• Inhibitorem jest nazywana substancja
chemiczna, która po dodaniu do
środowiska korozyjnego wpływa na
zmniejszenie szybkości korozji.
• W zależności od sposobu działania
rozróżnia się: pasywatory, inhibitory
niepasywujące, np. trawienia oraz
inhibitory lotne.

Pasywatory
• Pasywatorami są np. jony występujące w
roztworach chromianów CrO
42-
, azotynów
NO
2-
, molibdenianów MoO
42-
, wolframianów
WO
42-
, lub nadtechnetanów TeO
42-
.
• Po zetknięciu się z powierzchnią metalu
chronionego przed korozją pasywatory
wywołują na powierzchni anodowej prąd
większy od prądu I
kryt
powodujący
pasywację metalu

Środki konserwacyjne
• Należą do nich oleje, smary lub woski z
odpowiednimi dodatkami organicznymi,
stosowane jako środki do zabezpieczenia
przed korozją elementów stalowych w
czasie transportu i magazynowania.
• Związki te adsorbowane są na powierzchni
i tworzą cienką warstwę zabezpieczającą.

Powłoki metalowe
• Galwaniczne – z wodnych roztworów lub soli
• Chemiczne – w wyniku reakcji wymiany
• Natryskowo
• Naparowywaniem w próżni
• Dyfuzyjne
• Powłoki szlachetne np. niklowe, srebrne,
miedziowe, ołowiowe, chromowe (mają wyższy
standardowy potencjał elektrodowy od metalu
podłoża)

Powłoki protektorowe
• Powłoki protektorowe, np. na stali –
cynkowe, kadmowe, aluminiowe lub
cynowe.
• Warunkiem skuteczności powłoki jest
trwały styk
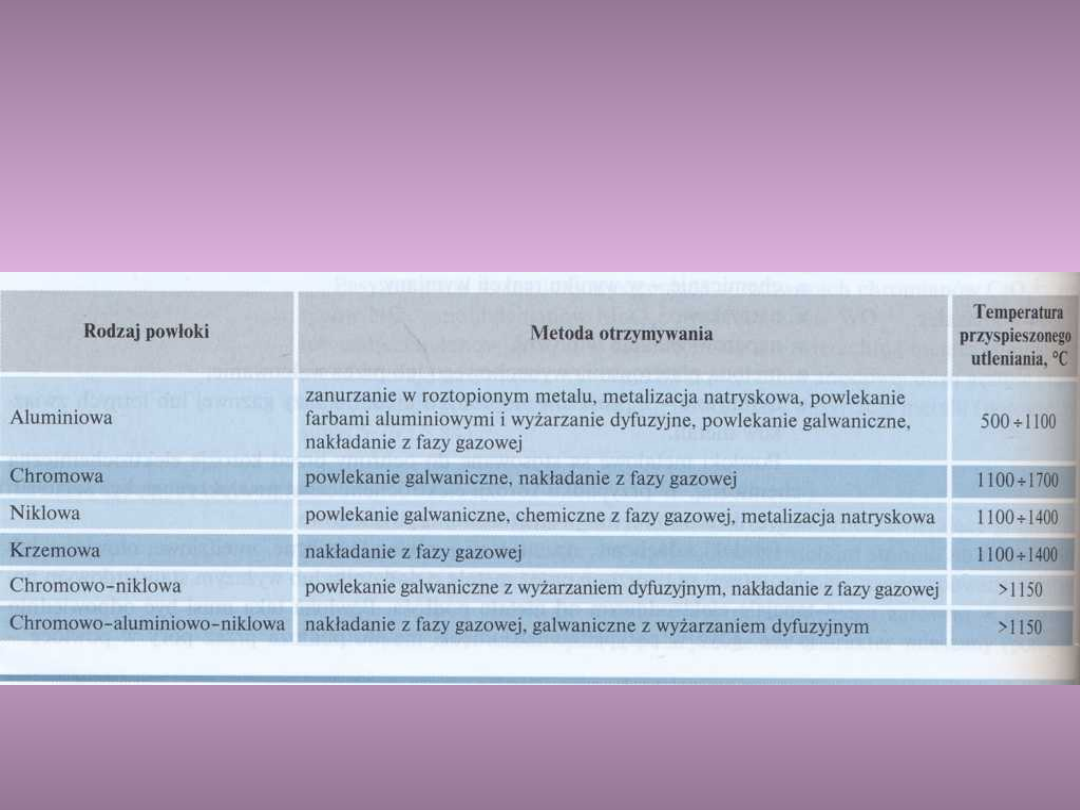
Przykłady powłok odpornych na
utlenianie w wysokiej
temperaturze (5.9)

Powłoki nieorganiczne
• Najczęściej są to powłoki ceramiczne, np. z emalii
szklanych. Całkowicie nie przepuszczają wody i
tlenu.
• Chronią metale, stal a także wolfram, molibden i
tytan do temperatury 750
o
C.
• Stosuje się m.in. Do ochrony elementów
wylotowych silników lotniczych, a także w
naczyniach kuchennych.
• Warstwy fosforanowane – nakłada się na nie farby
malarskie itd.

Powłoki organiczne
• Są to powłoki malarskie, stanowiące mieszaninę
nierozpuszczalnych pigmentów w nośniku
organicznym lub wodzie
• Nośniki olejowe w zetknięciu z olejem
polimeryzują, żywice syntetyczne polimeryzują
lub wysychają przez odparowanie tworząc na
powierzchni cieniutką warstwę zapobiegającą
korozji.

Nowe terminy
• Ochrona przed korozją: ochrona –
katodowa, protektorowa, anodowa;
• Inhibitory – trawienia, lotne;
• Pasywatory
• Powłoki ochronne – metalowe,
organiczne, nieorganiczne

Pytania i zadania
Jakie s a zasady doboru składu chemicznego stopów
odpornych na korozję?
Na czym polega katodowa i protektorowa ochrona
przed korozją?
Na czym polega anodowa ochrona przed korozją?
Na czym polega działanie ochronne inhibitorów
dodawanych do środowisk korozyjnych?
Jakie są rodzaje powłok ochronnych stosowanych w celu
zapobieżenia korozji? Na czym polega ich działanie?
Narysuj schematy ochrony katodowej i protektorowej
rurociągów zakopanych w ziemi.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
Wyszukiwarka
Podobne podstrony:
14 Korozja metali i stopów
14 Korozja metali i stopów
15 - Korozja metali i ich stopów, Korozja metali i ich stopów
Korozja metali i ich stopów(1), Studia, Stomatologia Łódź, Rok II, Materiałoznawstwo
Korozja metali, Energetyka, Chemia
Inhibitory korozji metali
Badania makro i mikrostruktury metali i stopów, WIP zarządzanie i inżynieria produkcji, sesja 1, Mat
16 Korozja metali i innych materiałów
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
,chemia L,korozja metali
KOROZJA METALI
doświadczenie 3 korozja metali
korozja metali I wykres
,systemy oczyszczania wody, Korozja metali
Ćwiczenie 4 Właściwości magnetyczne metali i stopów
więcej podobnych podstron