
KOROZJA METALI

Rodzaje korozji metali
P.Łukowski, 2
Korozja biologiczna – metale są odporne na czynniki
biologiczne.
Korozja fizyczna – czynniki mechaniczne i termiczne.
Korozja chemiczna – może mieć charakter chemiczny lub
elektrochemiczny.
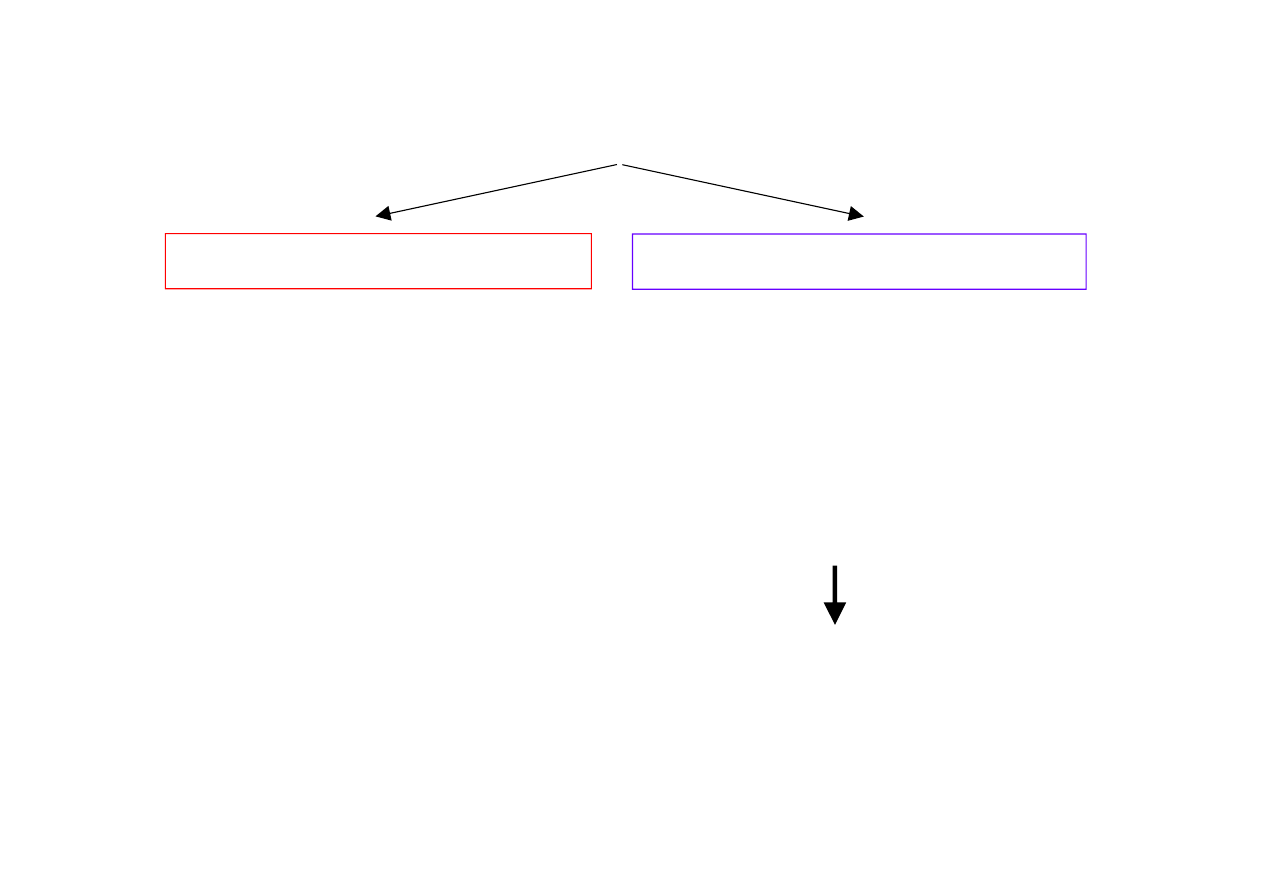
Korozja spowodowana czynnikami chemicznymi
CHEMICZNA
ELEKTROCHEMICZNA
Zachodzą reakcje
chemiczne, w trakcie
których nie następuje
przepływ prądu
elektrycznego.
Powstaje ogniwo
korozyjne i następuje
przepływ prądu
(przenikanie elektronów
przez granicę faz metal
– elektrolit).
Obecność elektrolitu jest
warunkiem koniecznym,
ale niewystarczającym (!)
korozji elektrochemicznej
P.Łukowski, 3

Korozja chemiczna
P.Łukowski, 4
Pod wpływem kwasów następuje roztwarzanie metalu:
Fe + 2HCl → FeCl
2
+ H
2
↑
Pod działaniem tlenu z atmosfery, w obecności wody,
następuje bezpośrednie utlenianie z utworzeniem
mieszaniny tlenków i wodorotlenków żelaza (rdzy):
3Fe + O
2
+ 2H
2
O → Fe
2
O⋅H
2
O + Fe(OH)
2

Fe + 2Cl– → FeCl
2
+ 2e–
Korozja chemiczna
Chlorki powodują korozję wżerową metalu:
P.Łukowski, 5
P.Łukowski, 6
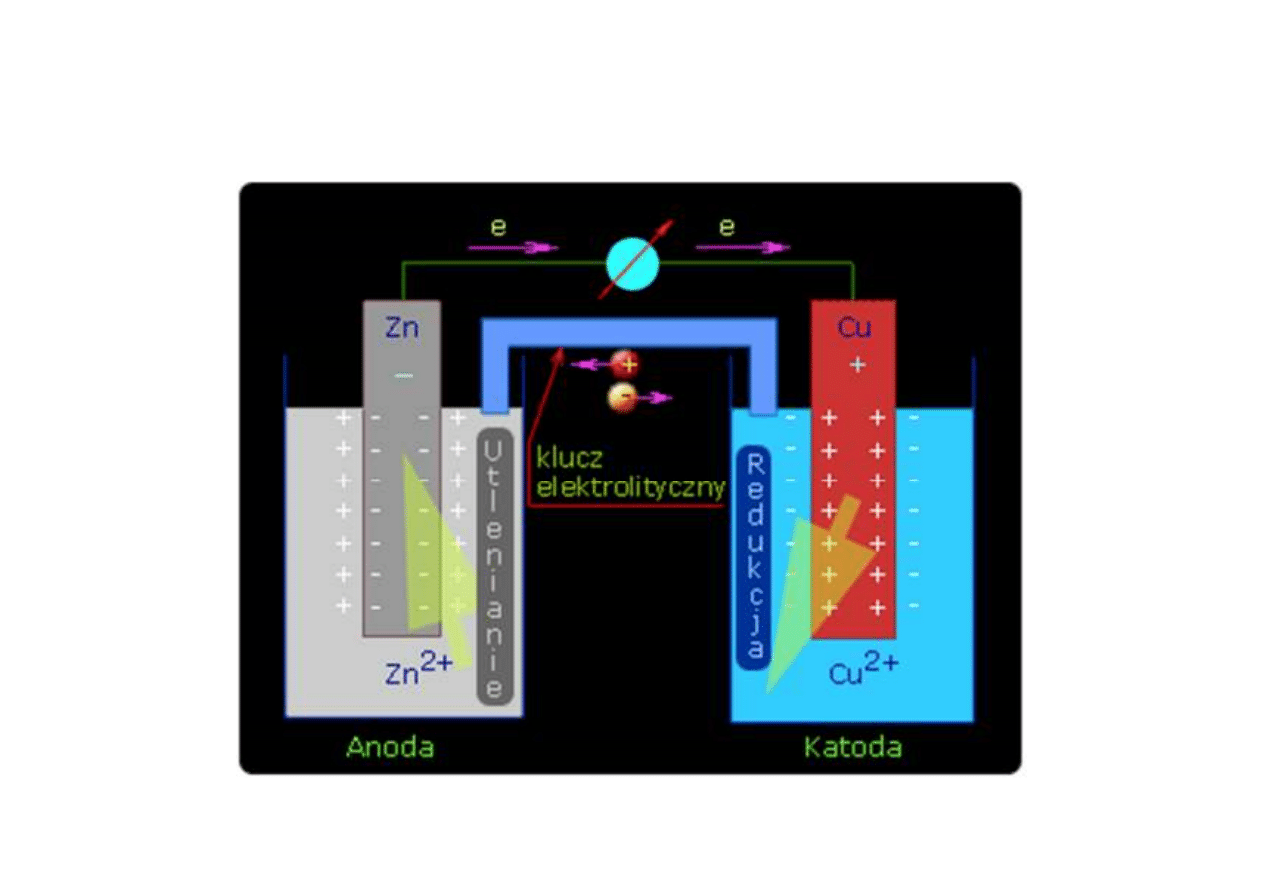
Obszar anodowy
(o niższym potencjale
elektrochemicznym)
Obszar katodowy
(o wyższym potencjale
elektrochemicznym)
Me
2e
–
2e
–
2H
+
H
2
½O
2
+ H
2
O
2OH
–
redukcja ≡
depolaryzacja
wodorowa
Me
2+
redukcja ≡
depolaryzacja
tlenowa
METAL
ELEKTROLIT
Korozja elektrochemiczna
utlenianie
P.Łukowski, 7
Ogniwo stykowe (Daniella)
P.Łukowski, 9
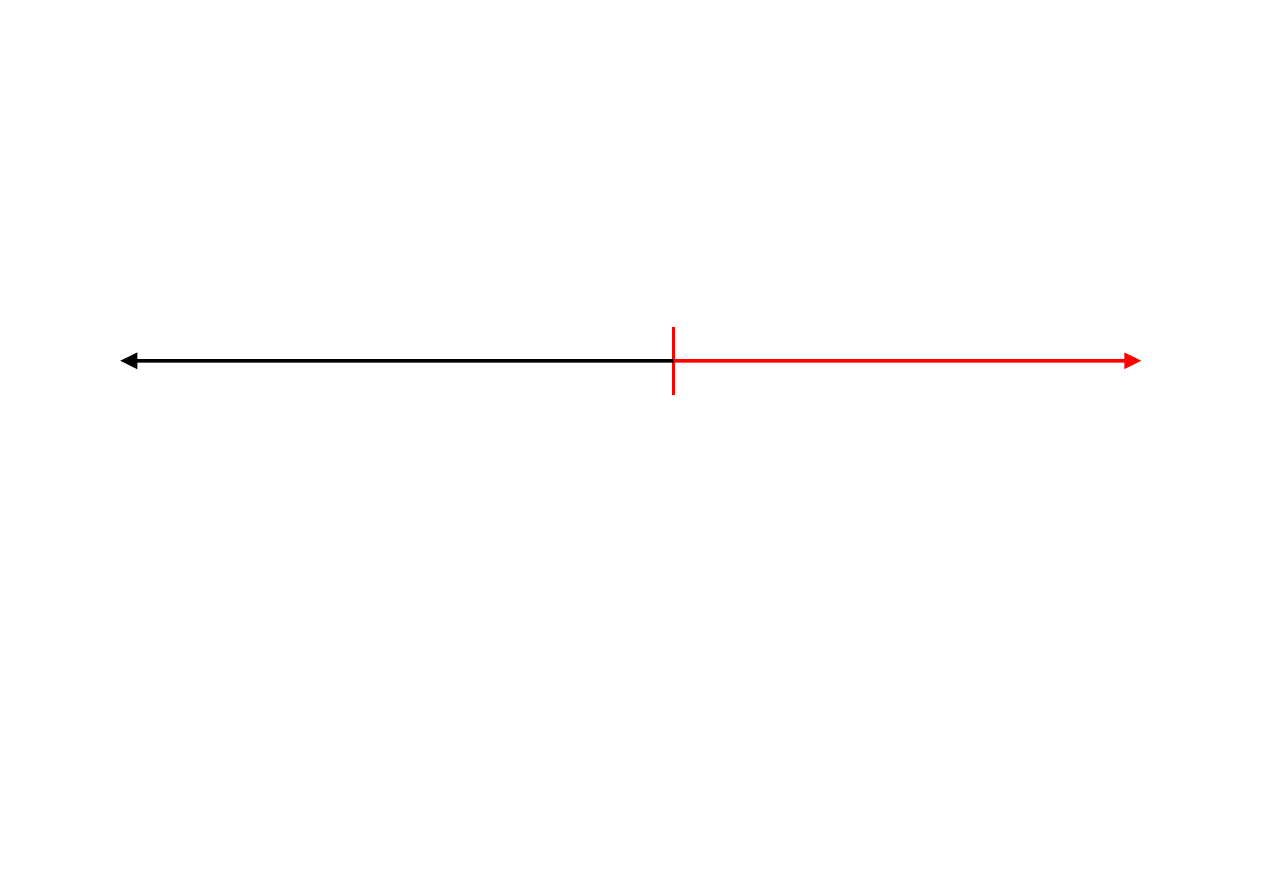
Szereg napięciowy metali
Metal o niższym (bardziej ujemnym) potencjale staje
się anodą i ulega korozji.
→
→
→
→ Zn →
→
→
→ Cr →
→
→
→ Fe →
→
→
→ Ni →
→
→
→ Sn →
→
→
→ H →
→
→
→
Cu
→
→
→
→
Ag
→
→
→
→
Au
→
→
→
→
Pt
→
→
→
→
–
0
+
metale szlachetne
metale nieszlachetne
P.Łukowski, 10
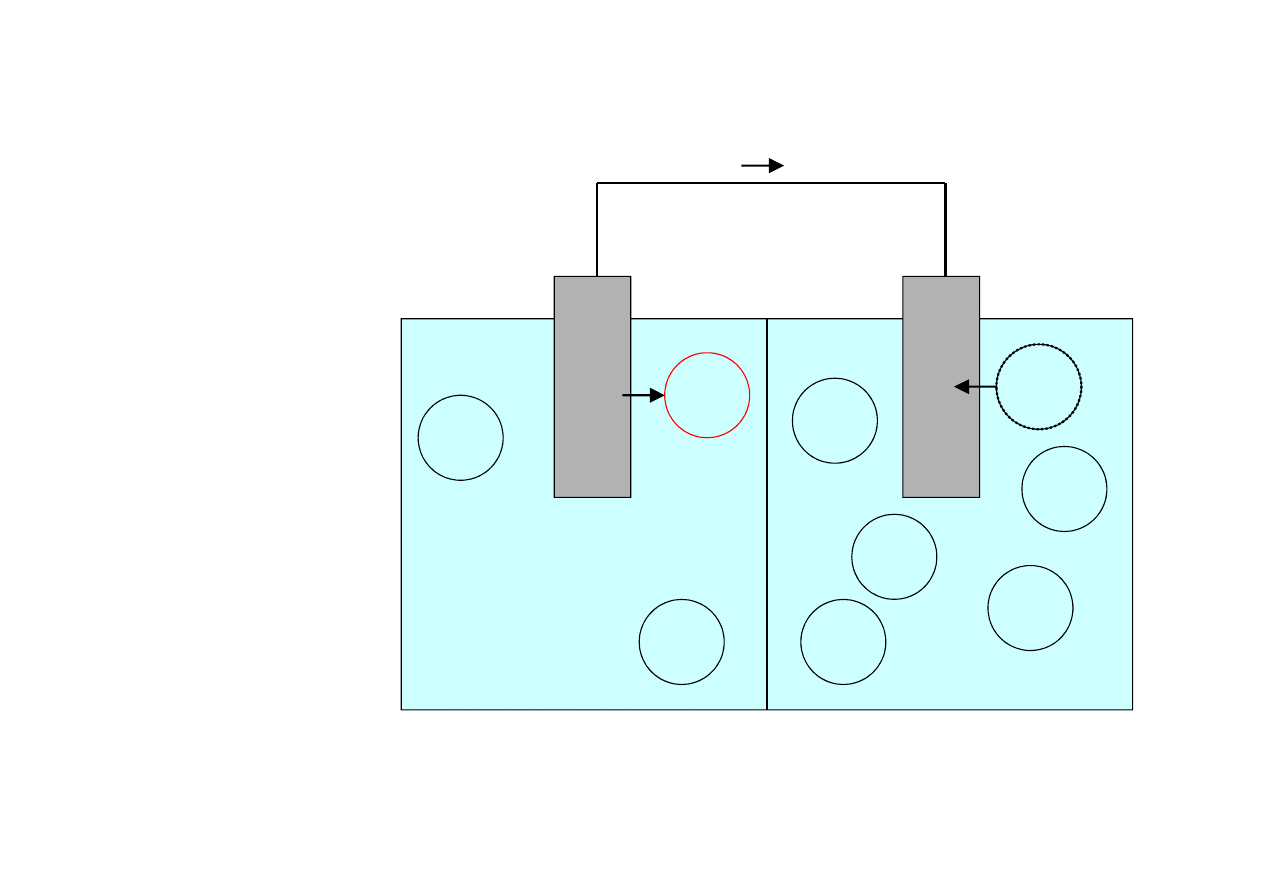
Układ dąży do
wyrównania
stężeń przez
produkcję
jonów w części
o mniejszym
stężeniu ⇒ ta
część metalu
staje się anodą
i ulega korozji
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
Fe
Fe
2+
e
–
Ogniwo stężeniowe
P.Łukowski, 11
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
2+
Fe
Fe
Fe
2+
Fe
2+
e
–
Ogniwo stężeniowe
W trakcie działania
Stan równowagi

P.Łukowski, 12
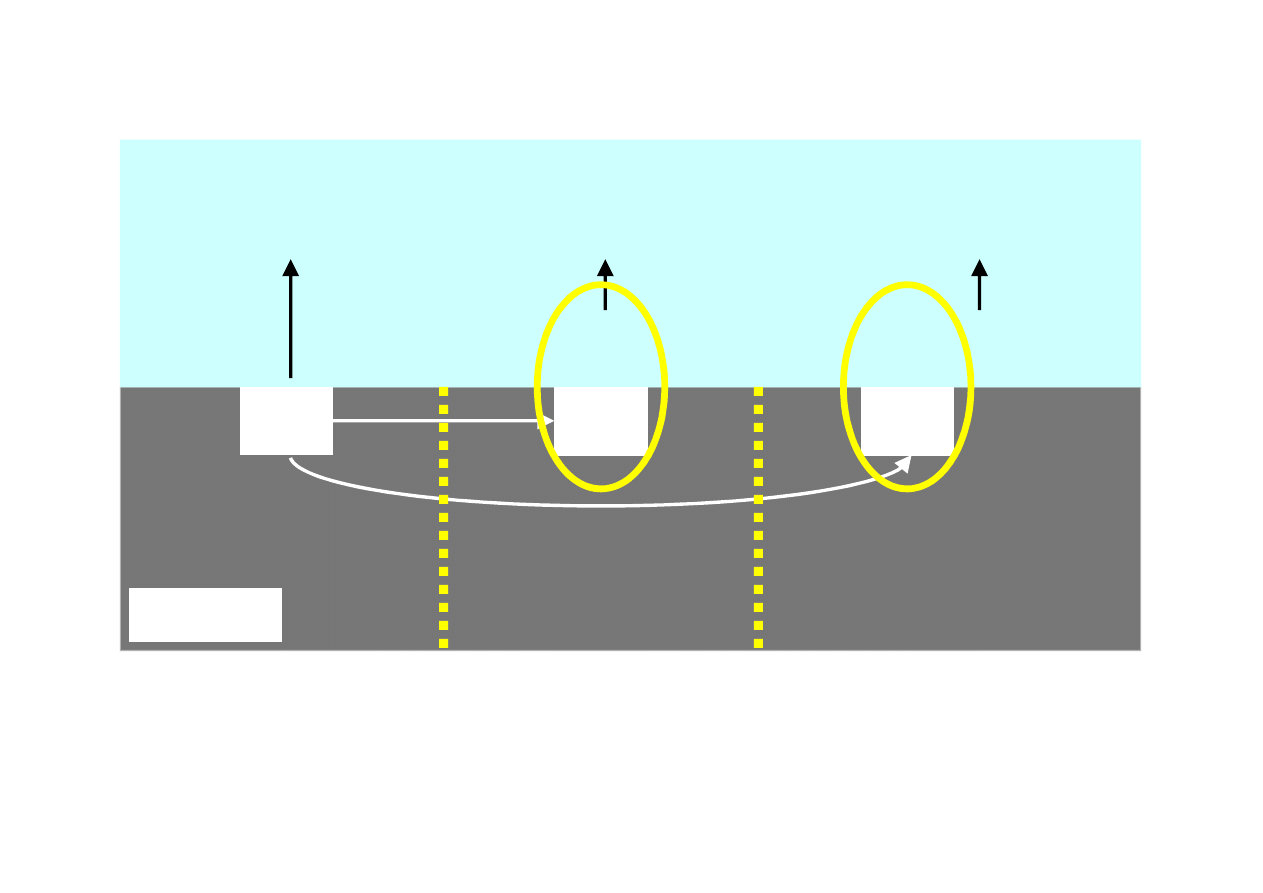
swobodny
dostęp
tlenu
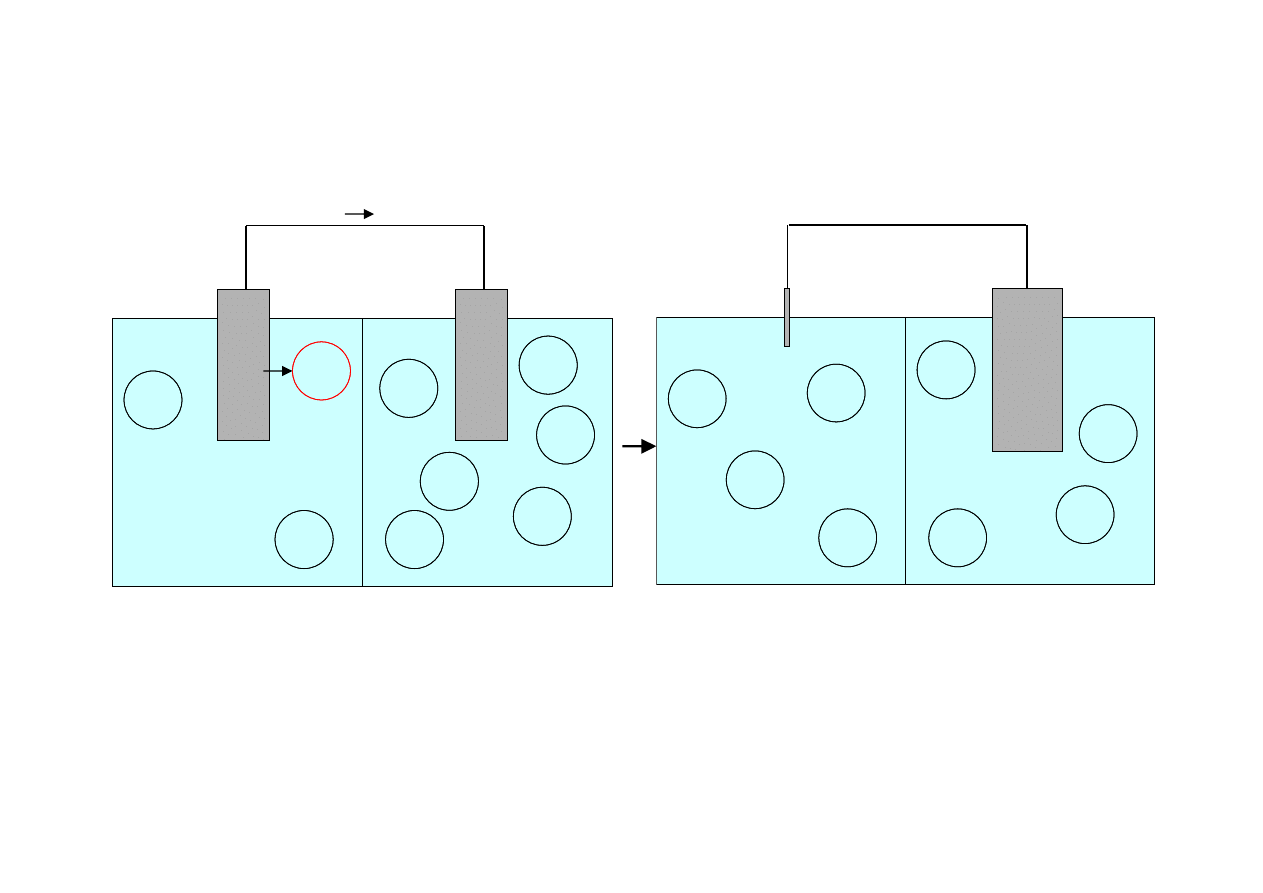
Ogniwo stężeniowe – przykład
strefa
katodowa
strefa
anodowa
ograniczony
dostęp tlenu

P.Łukowski, 13
Ogniwo naprężeniowe
W wyniku naprężeń mechanicznych powierzchnia metalu
staje się niejednorodna ⇒ powstają miejsca o wyższej
energii ⇒ jony z tych miejsc łatwiej przechodzą do roztworu
niż z powierzchni niezdefektowanej ⇒ obszar powierzchni
poddany naprężeniom stanowi anodę, zaś powierzchnia
niezedefektowana stanowi obszar katodowy.
P.Łukowski, 14
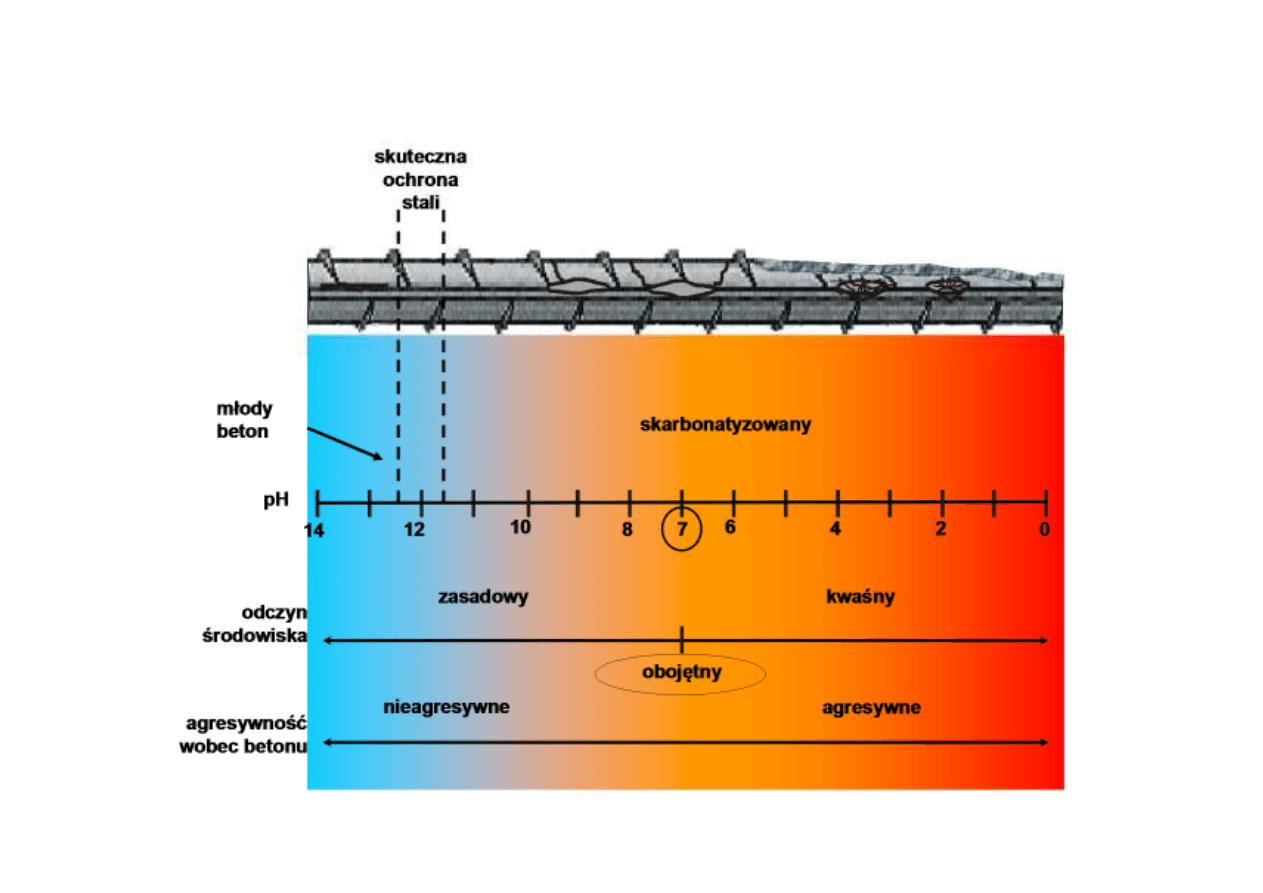
Korozja stali zbrojeniowej w betonie

W wyniku karbonatyzacji:
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
obniża się pH betonu ⇒ warstewka pasywna na stali zostaje
zniszczona ⇒ zaczyna się korozja stali zbrojeniowej:
Fe + 2Cl
–
→ FeCl
2
+ e
–
3Fe + O
2
+ 2H
2
O → Fe
2
O⋅H
2
O + Fe(OH)
2
Zobojętnienie betonu i korozja stali zbrojeniowej
P.Łukowski, 15
F
e
F
e
O
F
e
3
O
4
F
e
2
O
3
F
e
(O
H
)
2
F
e
(O
H
)
3
F
e
(O
H
)
3
3
H
2
O
0
1
2
3
4
5
6
7
W
z
g
lę
d
n
a
o
b
ję
to
ś
ć
m
o
lo
w
a
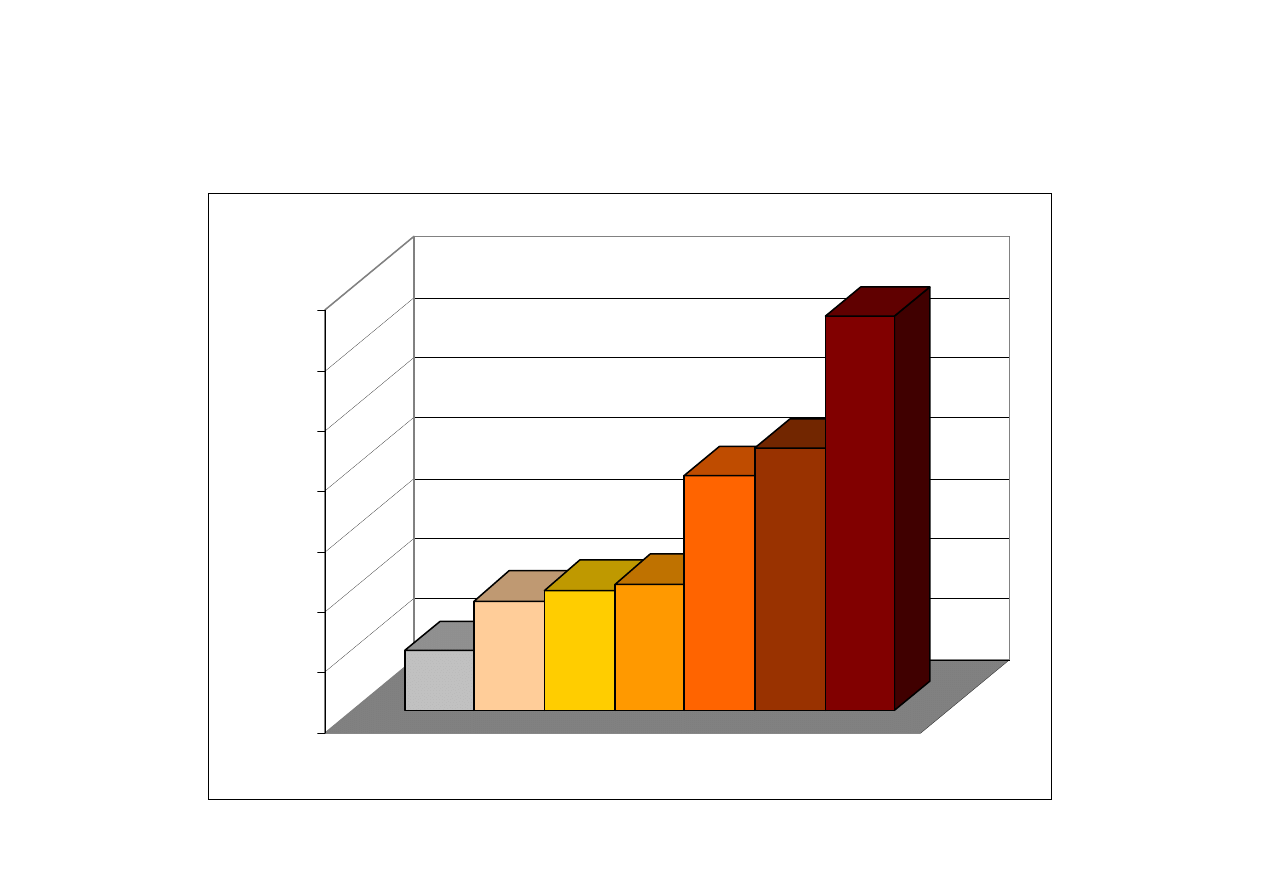
Względna objętość produktów utleniania żelaza
P.Łukowski, 16
1
2
3
4
4
CO Cl O
H O
2
2
,
, ,
2
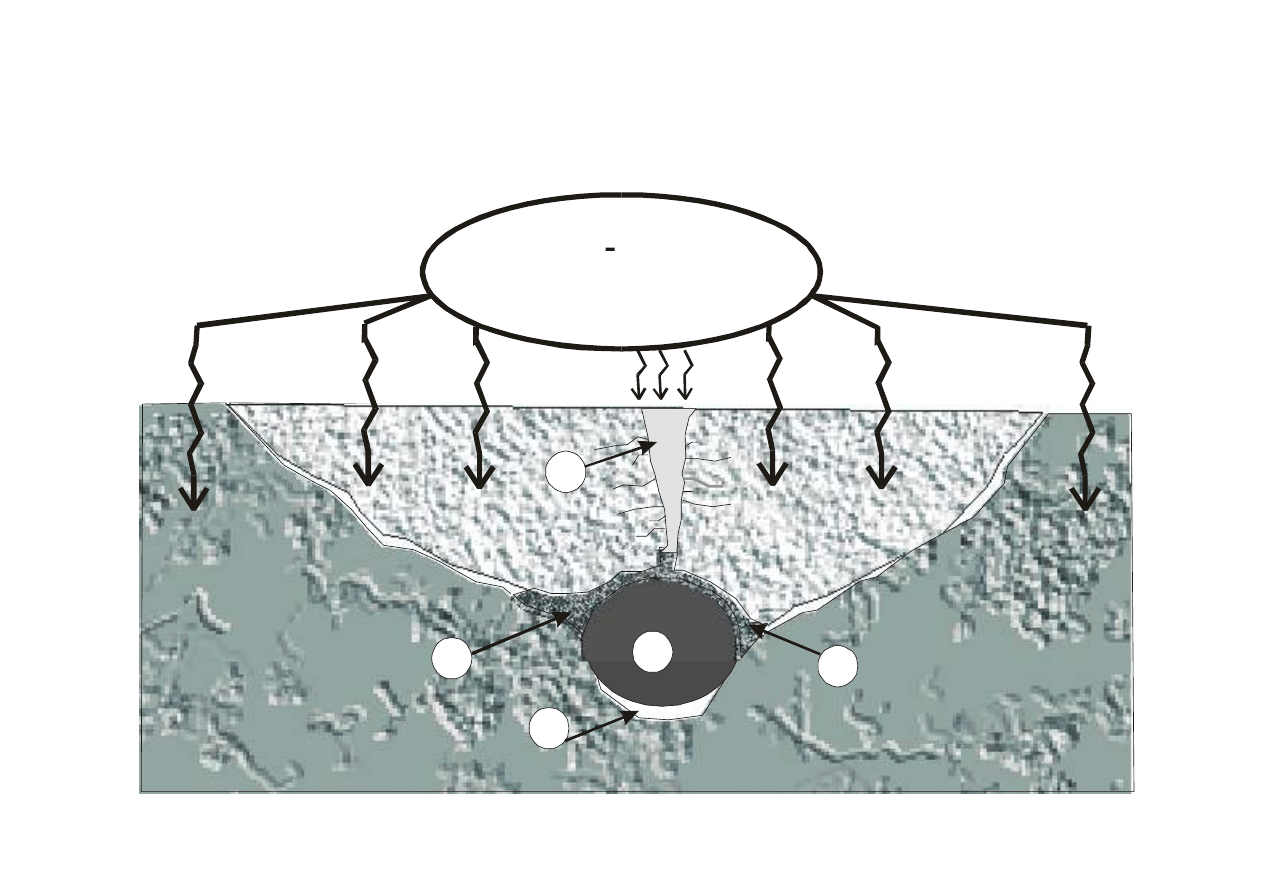
Zniszczenie żelbetu
P.Łukowski, 17
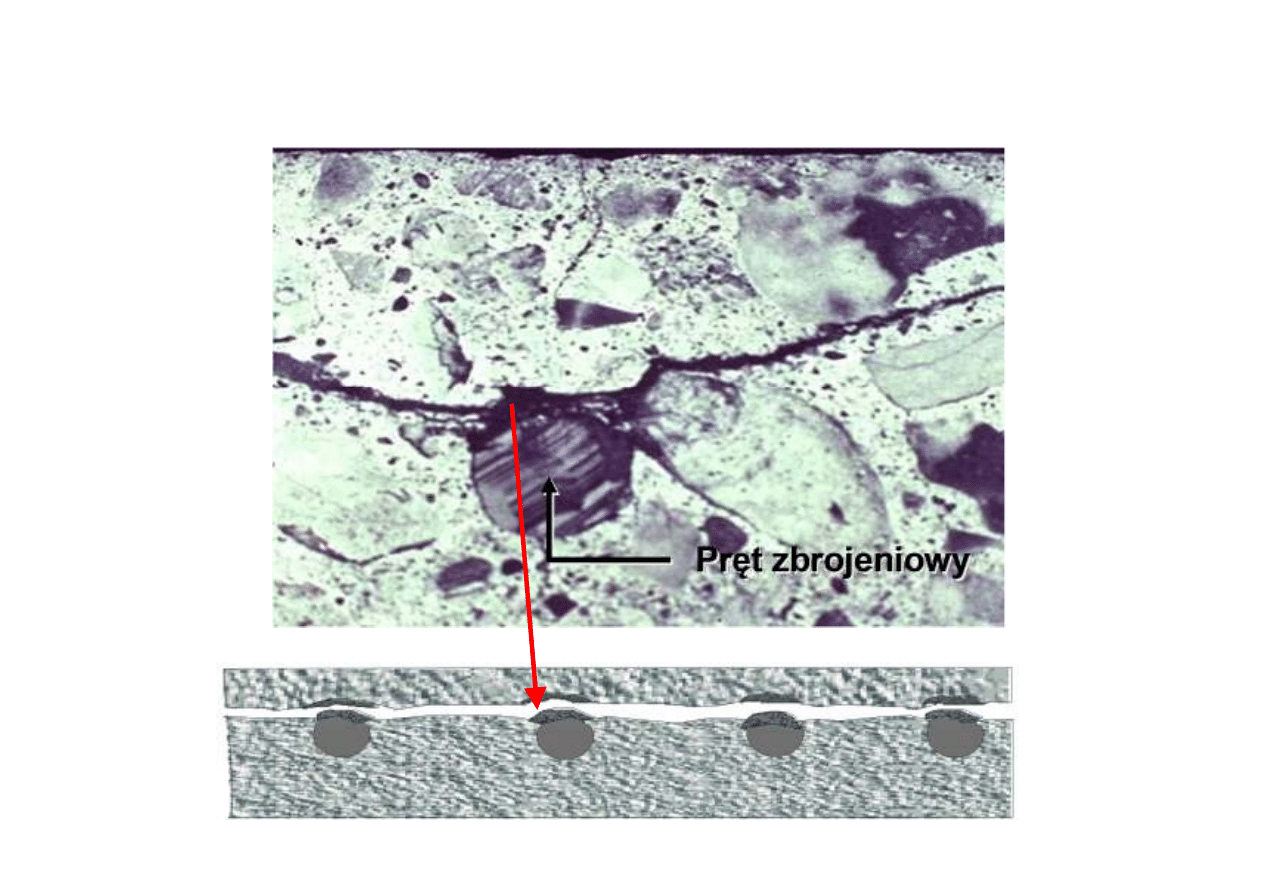
Zniszczenie żelbetu
P.Łukowski, 18
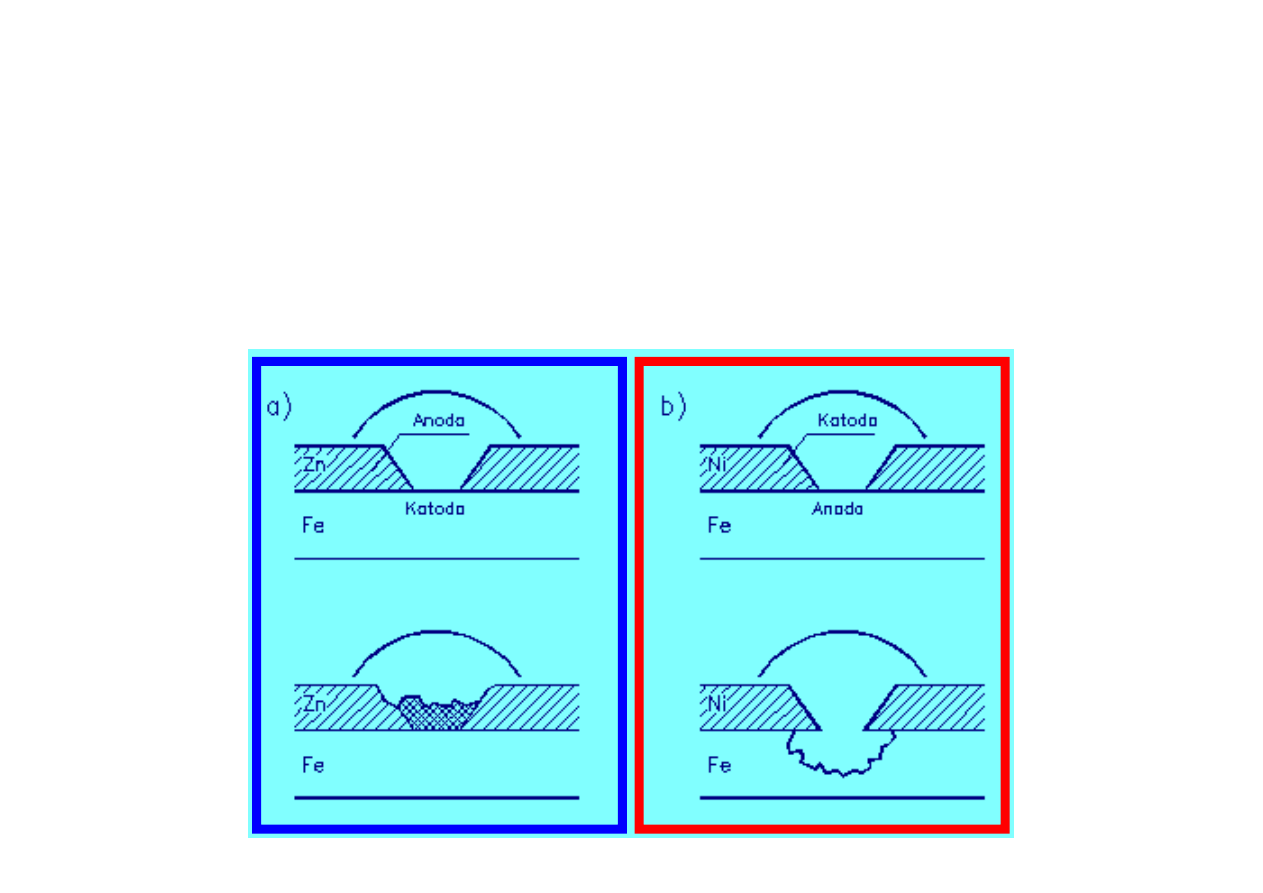
Ochrona metali przed korozją
P.Łukowski, 20
Elektrochemiczna: stworzenie takiego układu, w którym
metal chroniony po powstaniu ogniwa korozyjnego jest
katodą i nie ulega korozji (ochrona protektorowa).
Przykład: cynkowanie blachy stalowej

P.Łukowski, 21
Ochrona metali przed korozją
Chemiczna: wprowadzenie do układu inhibitorów korozji,
czyli substancji, które zatrzymują lub znacznie zwalniają
procesy korozyjne.
Przykład: jodek potasu, sole cyny, arsenu i niklu.
Mechaniczna: pokrycie powierzchni metalu warstwą
odcinającą dostęp szkodliwych substancji, np. elektrolitu.
Przykład: farby, emalie, powłoki z tworzyw sztucznych lub
metali ⇒ możliwość dodatkowej ochrony elektrochemicznej
– protektorowej.

wykwity
przyczyny:
sole
rozpuszczalne
zawarte w
materiale lub
podciągane
kapilarnie z
zewnątrz
odpryski, spęcznienia
przyczyny: siarczany,
zanieczyszczenia organiczne
rysy, złuszczenia
przyczyny: węglany,
siarczany, korozja mrozowa
Korozja ceramiki budowlanej
P.Łukowski, 22

Ochrona ceramiki budowlanej przed korozją
• staranny dobór surowców
• impregnacja
• powłoki ochronne (tynki, farby)
P.Łukowski, 23

Korozja drewna
Podstawowym zagrożeniem dla drewna jest
korozja
biologiczna
, tzn. powodowana przez organizmy żywe:
- bakterie,
- grzyby,
- owady:
kołatek, spuszczel, tykotek
zgnilizna
próchnica
P.Łukowski, 24

Korozja drewna
zgnilizna
owady
P.Łukowski, 25

Sposoby zabezpieczania i konserwacji drewna
- Suszenie
- Powlekanie
- Impregnacja: nasycanie drewna środkami zabezpieczającymi
przed szkodliwym działaniem grzybów (fungicydy), owadów
(insektycydy), ognia i wody.
P.Łukowski, 26
Wyszukiwarka
Podobne podstrony:
Korozja metali i ich stopów(1), Studia, Stomatologia Łódź, Rok II, Materiałoznawstwo
korozja metali i, I semstr moje materiały, chemia materialow budowlanych, laborki
Korozja metali II oksydowanie, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, Laborator
14 Korozja metali i stopów
Korozja metali, Energetyka, Chemia
Inhibitory korozji metali
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
,chemia L,korozja metali
KOROZJA METALI
doświadczenie 3 korozja metali
korozja metali I wykres
,systemy oczyszczania wody, Korozja metali
ćw8 - Badanie stali odpornych na korozję, Wstępy na materiałoznawstwo
14a Korozja metali i stopów (PPTminimizer)
więcej podobnych podstron