
WYKŁAD 11
1
PODSTAWY CHEMII
PODSTAWY CHEMII
Dwuatomowe cząsteczki homojądrowe
Dwuatomowe cząsteczki homojądrowe
ORBITALE MOLEKULARNE
ORBITALE MOLEKULARNE

WYKŁAD 11
2
PODSTAWY CHEMII
PODSTAWY CHEMII
KOMBINACJA LINIOWA ORBITALI ATOMOWYCH
KOMBINACJA LINIOWA ORBITALI ATOMOWYCH
(LCAO)
(LCAO)
WYKŁAD 11
3
PODSTAWY CHEMII
PODSTAWY CHEMII
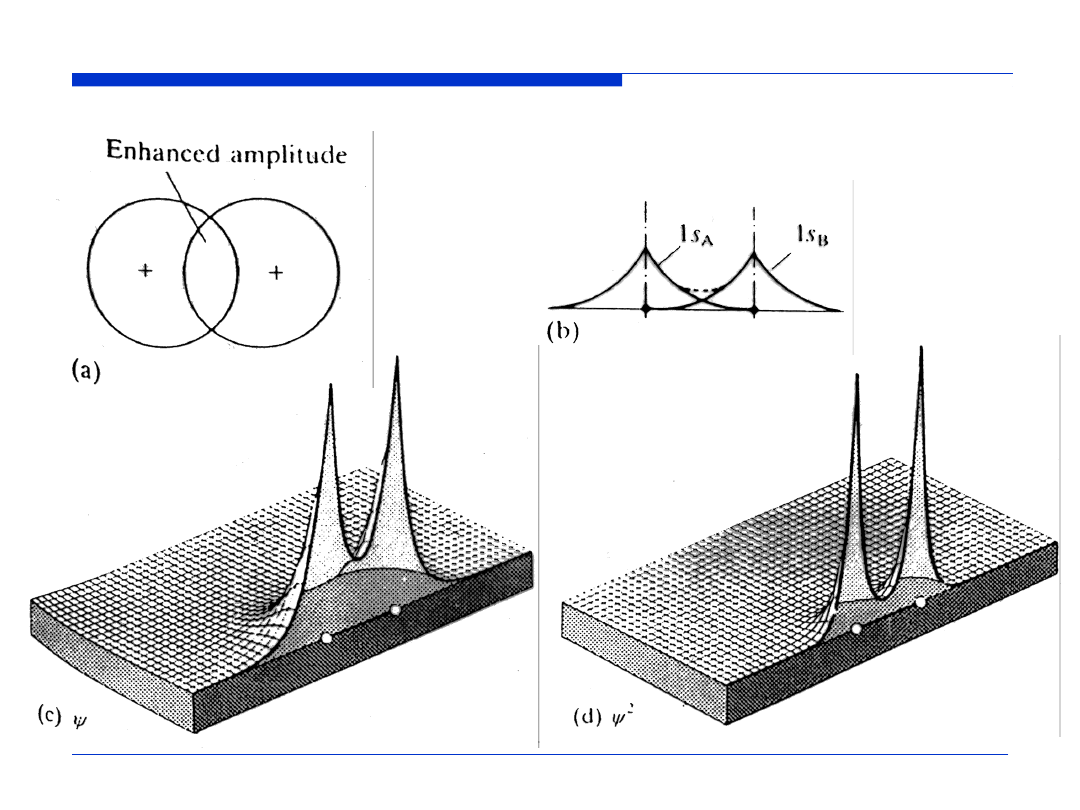
zwiększona wartość
zwiększona wartość
funkcji falowej
funkcji falowej
Orbital wiążący
Orbital wiążący
WYKŁAD 11
4
PODSTAWY CHEMII
PODSTAWY CHEMII
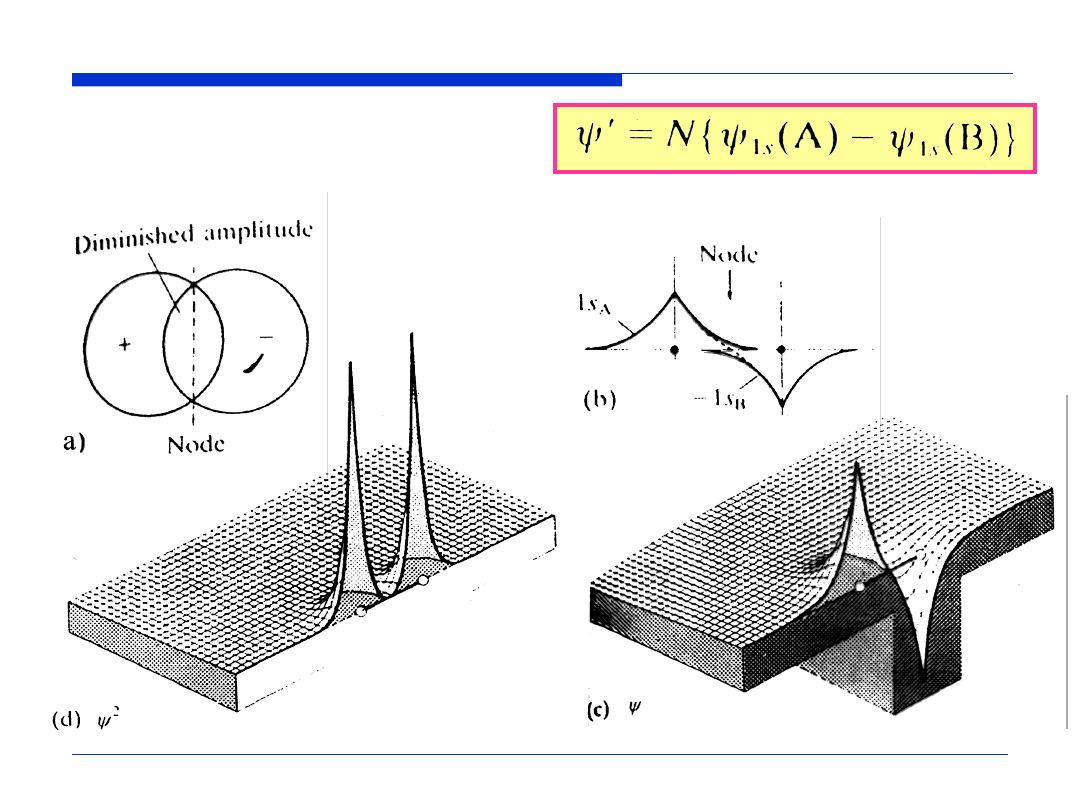
zmniejszona wartość
zmniejszona wartość
funkcji falowej
funkcji falowej
powierzchnia
powierzchnia
węzłowa
węzłowa
Orbital antywiążący
Orbital antywiążący
powierzchnia
powierzchnia
węzłowa
węzłowa
WYKŁAD 11
5
PODSTAWY CHEMII
PODSTAWY CHEMII
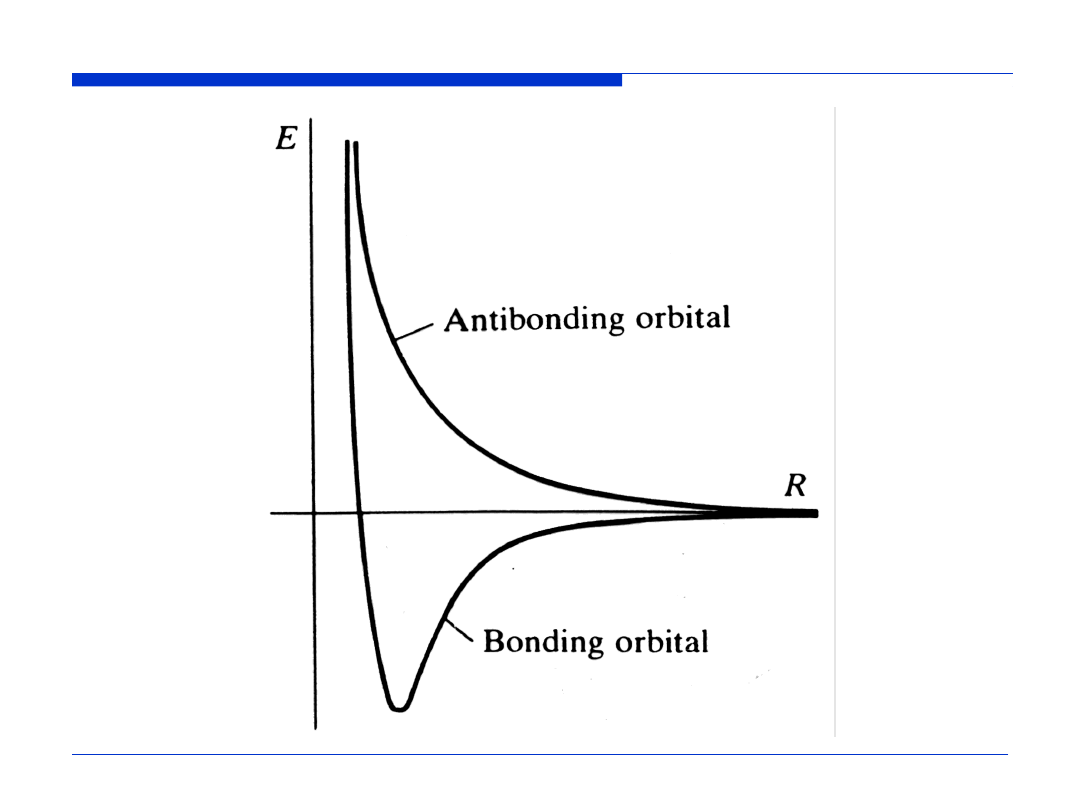
orbital antywiążący
orbital antywiążący
orbital wiążący
orbital wiążący
WYKŁAD 11
6
PODSTAWY CHEMII
PODSTAWY CHEMII
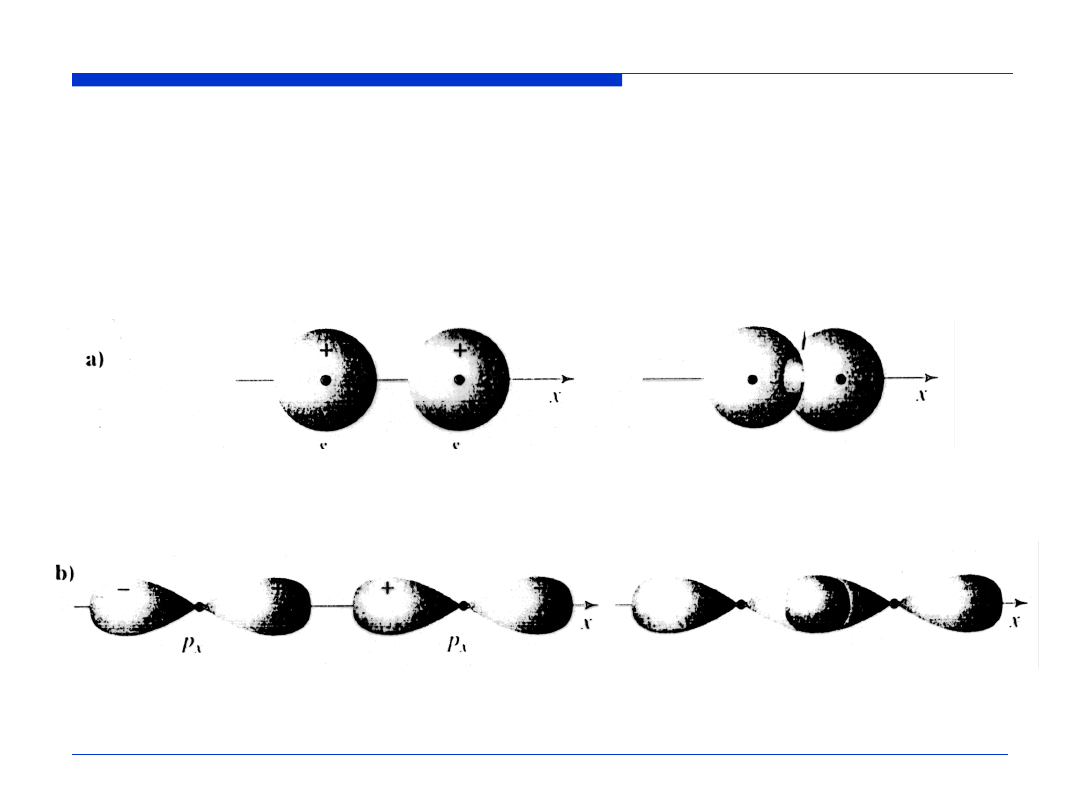
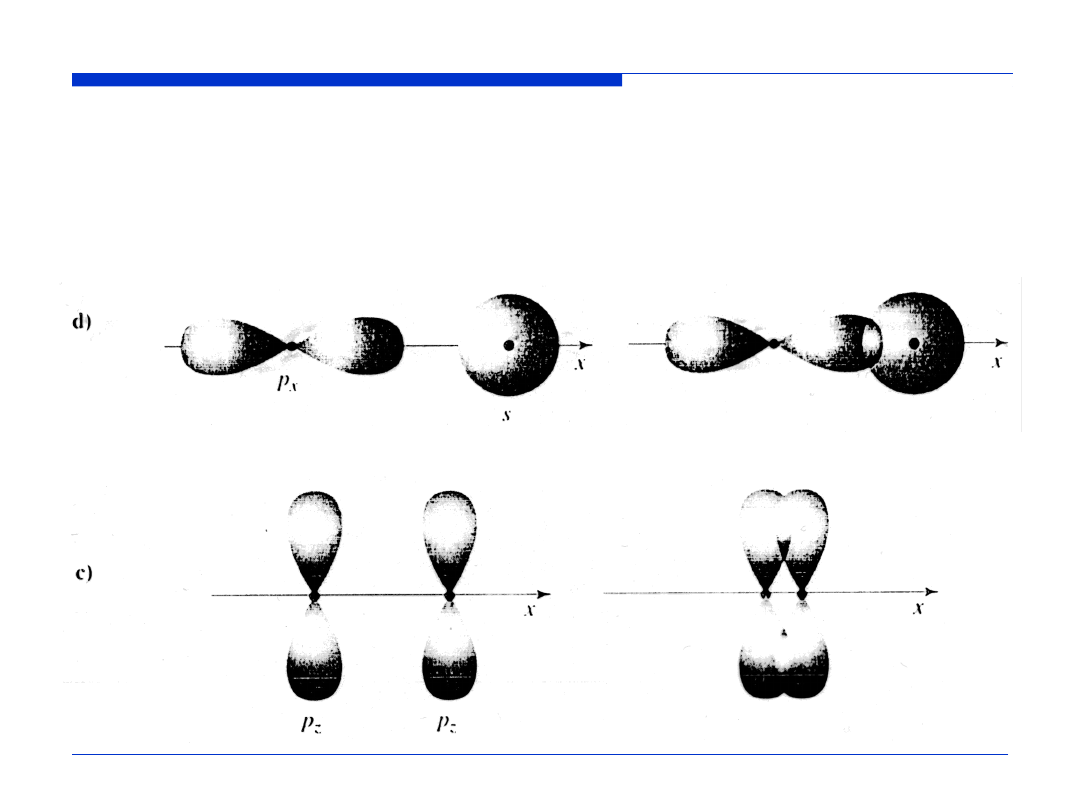
Schematy nakładania się orbitali. Uproszczone wykresy kwadratu
Schematy nakładania się orbitali. Uproszczone wykresy kwadratu
części kątowej orbitali |Y(
części kątowej orbitali |Y(
θ
θ
,
,
φ
φ
)|
)|
2
2
WYKŁAD 11
7
PODSTAWY CHEMII
PODSTAWY CHEMII
Schematy nakładania się orbitali. Uproszczone wykresy kwadratu
Schematy nakładania się orbitali. Uproszczone wykresy kwadratu
części kątowej orbitali |Y(
części kątowej orbitali |Y(
θ
θ
,
,
φ
φ
)|
)|
2
2
WYKŁAD 11
8
PODSTAWY CHEMII
PODSTAWY CHEMII
orbitale atomowe
orbitale atomowe
orbitale molekularne
orbitale molekularne
symbol orbitalu
symbol orbitalu
molekularnego
molekularnego
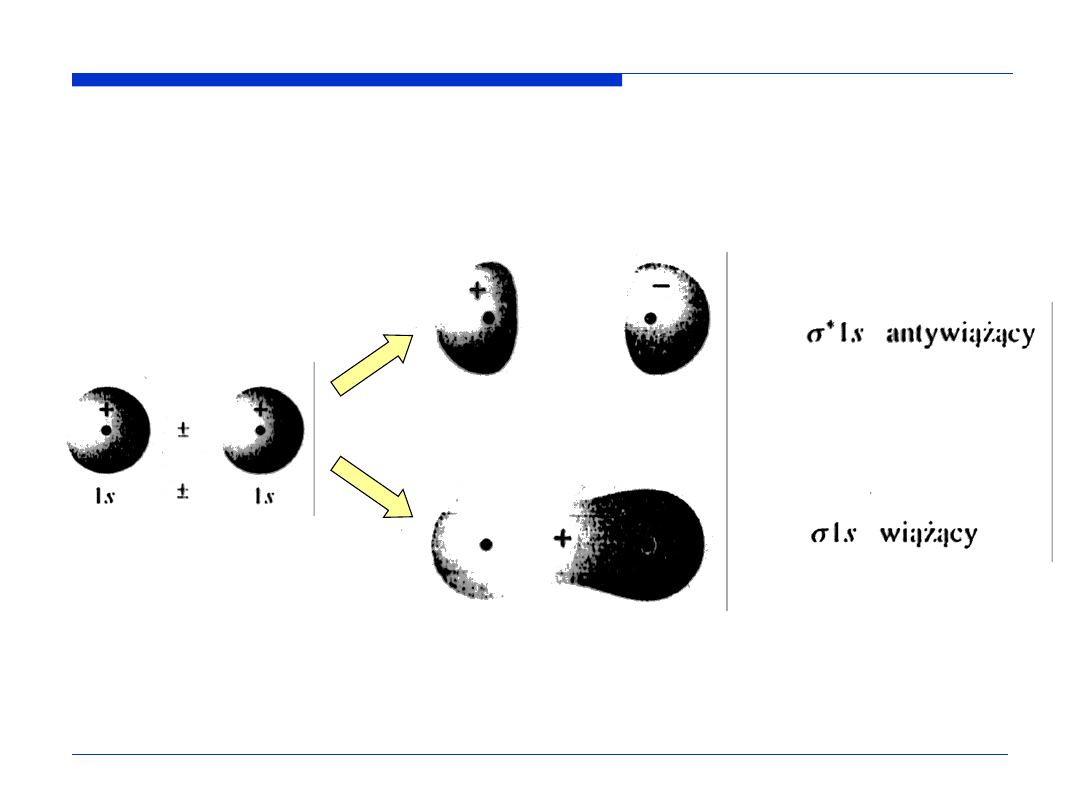
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
WYKŁAD 11
9
PODSTAWY CHEMII
PODSTAWY CHEMII
orbitale atomowe
orbitale atomowe
orbitale molekularne
orbitale molekularne
symbol orbitalu
symbol orbitalu
molekularnego
molekularnego
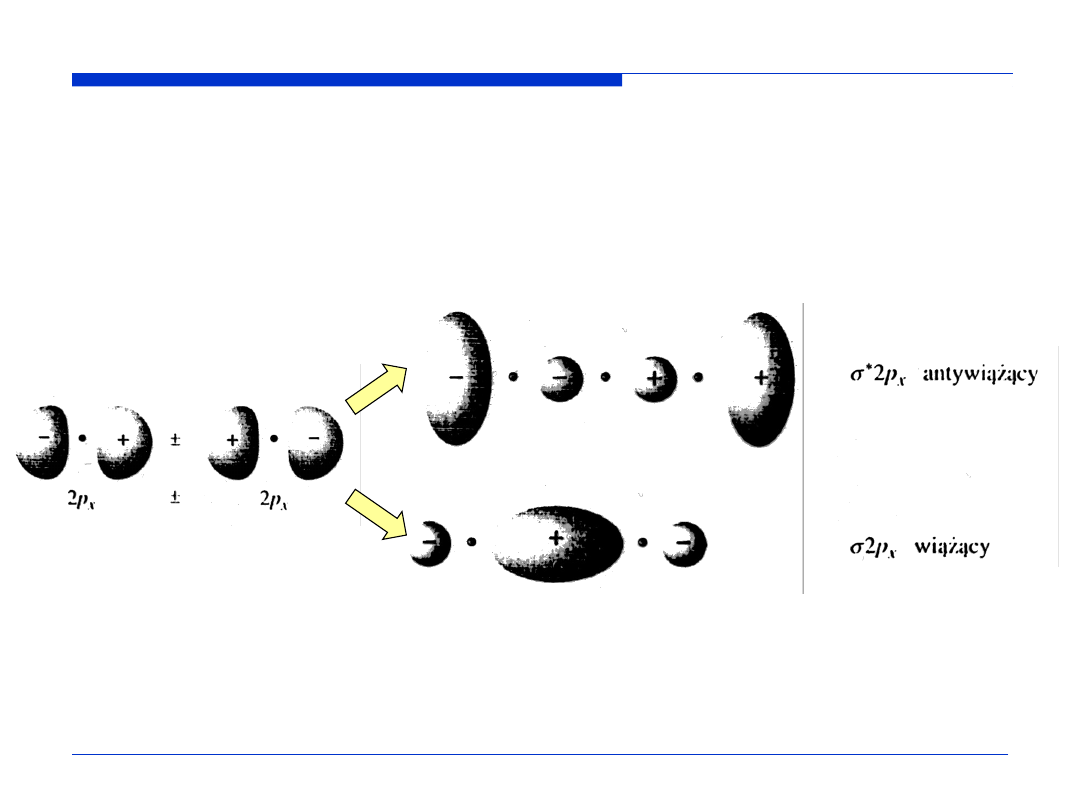
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
WYKŁAD 11
10
PODSTAWY CHEMII
PODSTAWY CHEMII
orbitale atomowe
orbitale atomowe
orbitale molekularne
orbitale molekularne
symbol orbitalu
symbol orbitalu
molekularnego
molekularnego
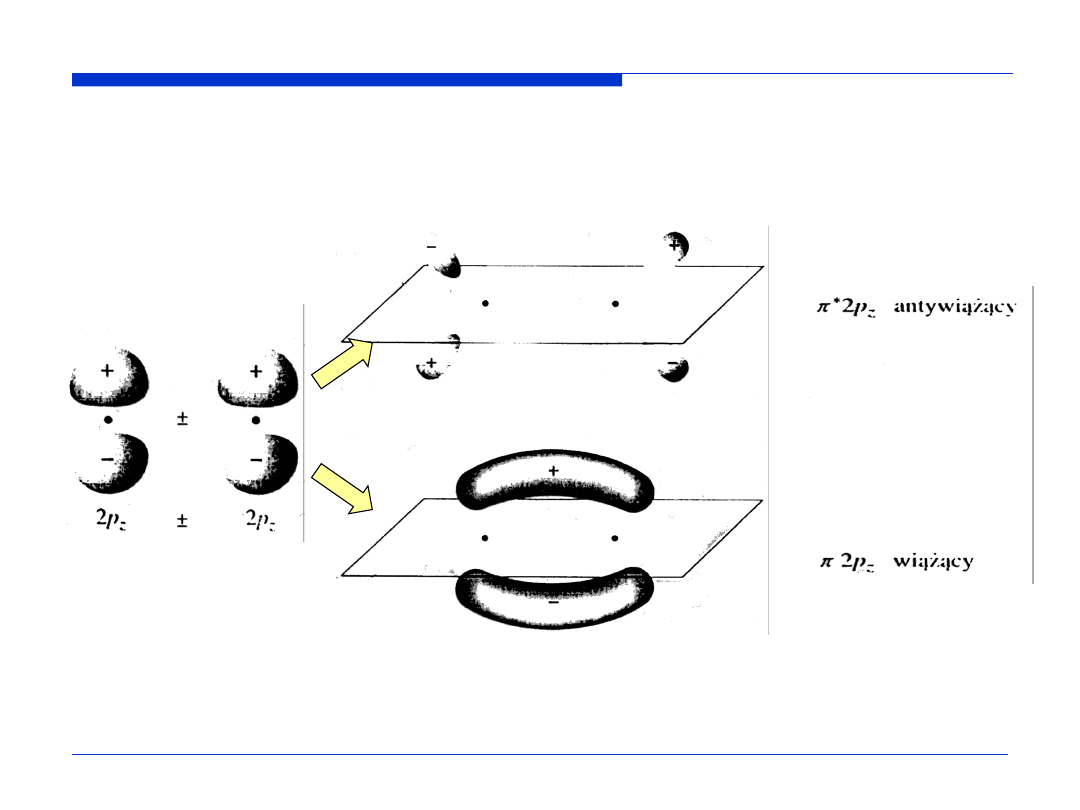
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
WYKŁAD 11
11
PODSTAWY CHEMII
PODSTAWY CHEMII
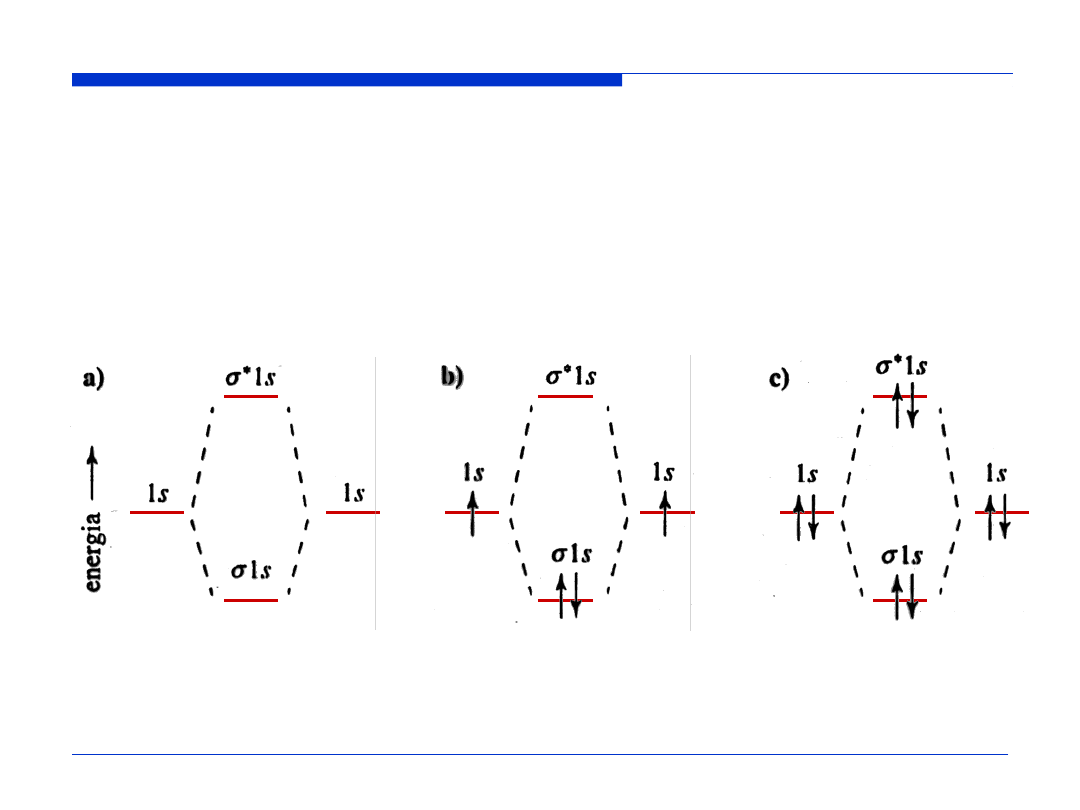
Orbitale cząsteczkowe
Orbitale cząsteczkowe
stanowiące kombinację
stanowiące kombinację
liniową orbitali
liniową orbitali
atomowych 1s
atomowych 1s
Konfiguracja
Konfiguracja
elektronowa
elektronowa
cząsteczki H
cząsteczki H
2
2
Konfiguracja
Konfiguracja
elektronowa
elektronowa
hipotetycznej
hipotetycznej
cząsteczki He
cząsteczki He
2
2
WYKŁAD 11
12
PODSTAWY CHEMII
PODSTAWY CHEMII
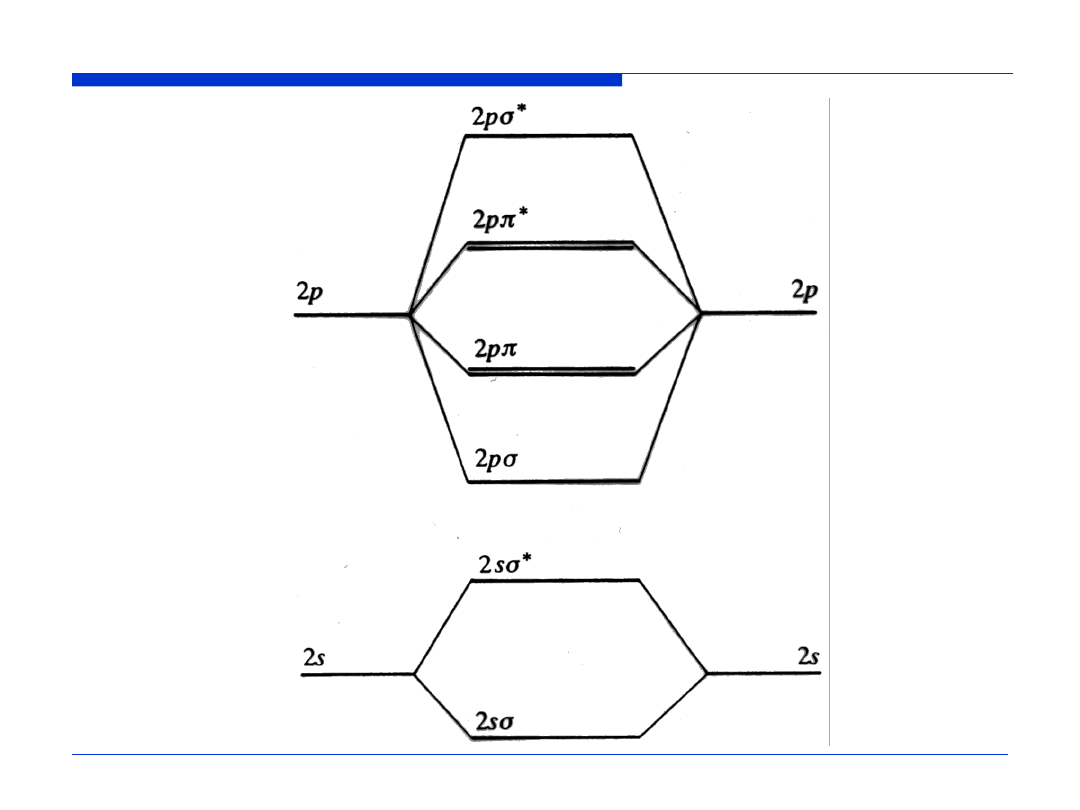
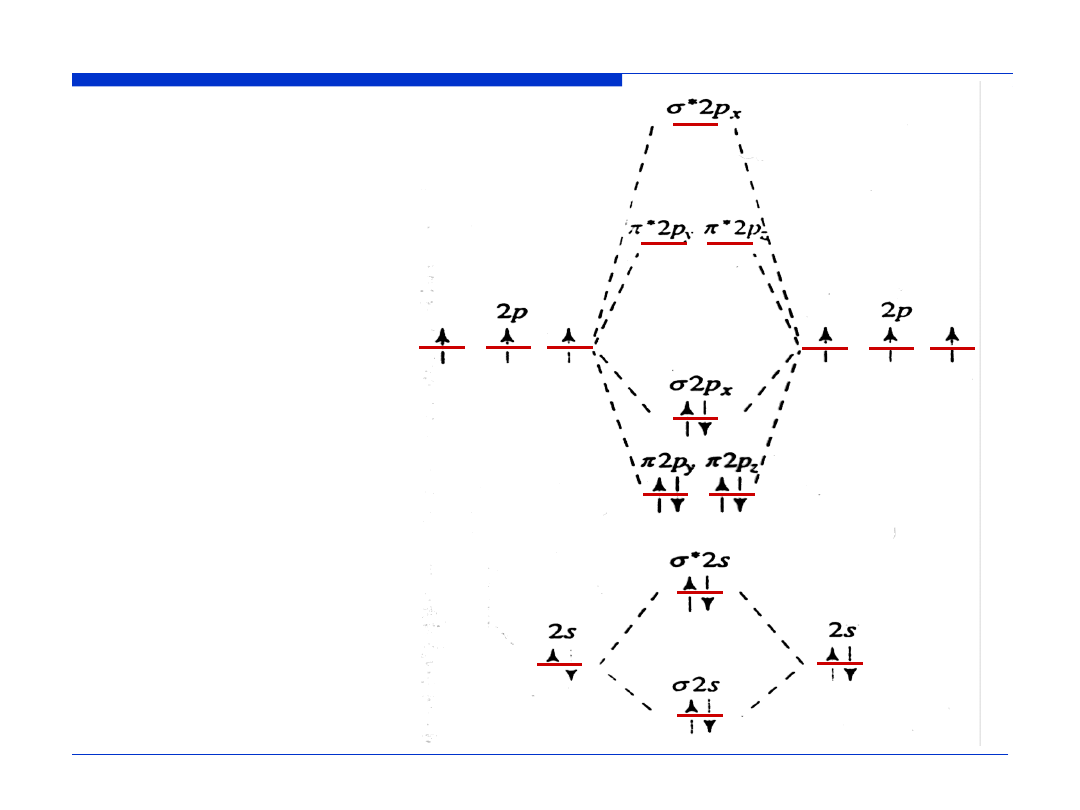
σ
σ
*
*
2s
2s
σ
σ
2s
2s
π
π
2p
2p
σ
σ
2p
2p
π
π
*
*
2p
2p
σ
σ
*
*
2p
2p
WYKŁAD 11
13
PODSTAWY CHEMII
PODSTAWY CHEMII
σ
σ
*
*
2s
2s
σ
σ
2s
2s
π
π
2p
2p
σ
σ
2p
2p
π
π
*
*
2p
2p
σ
σ
*
*
2p
2p
WYKŁAD 11
14
PODSTAWY CHEMII
PODSTAWY CHEMII
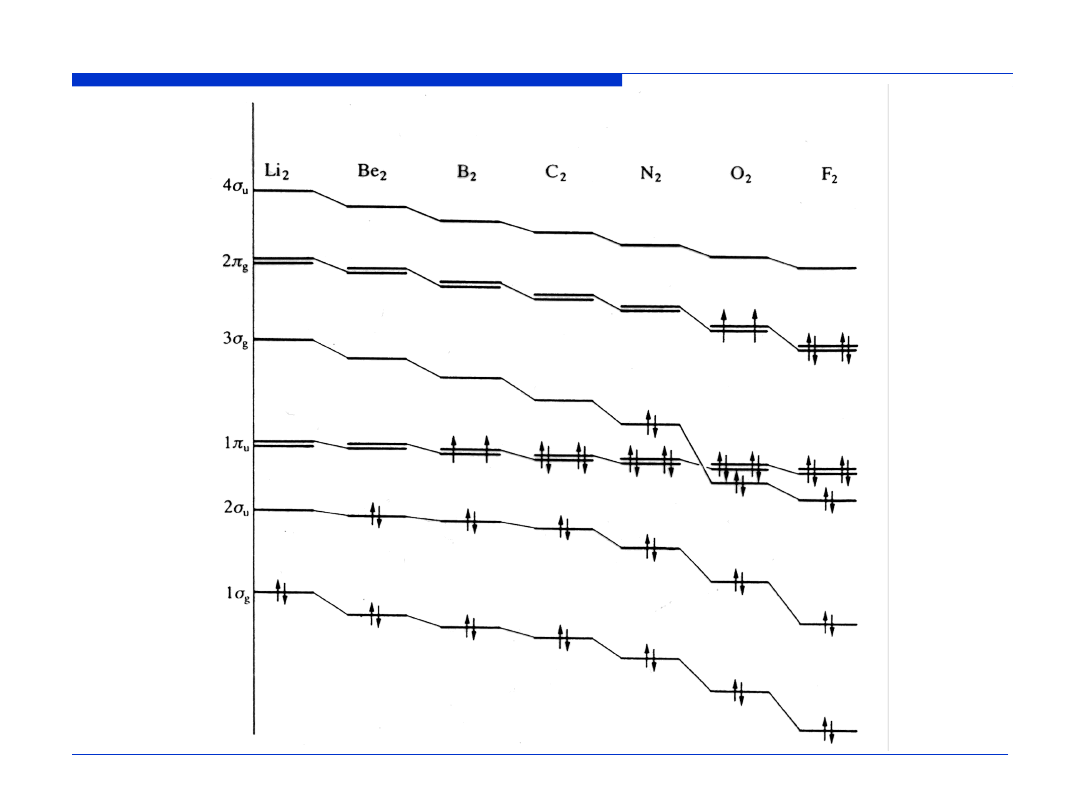
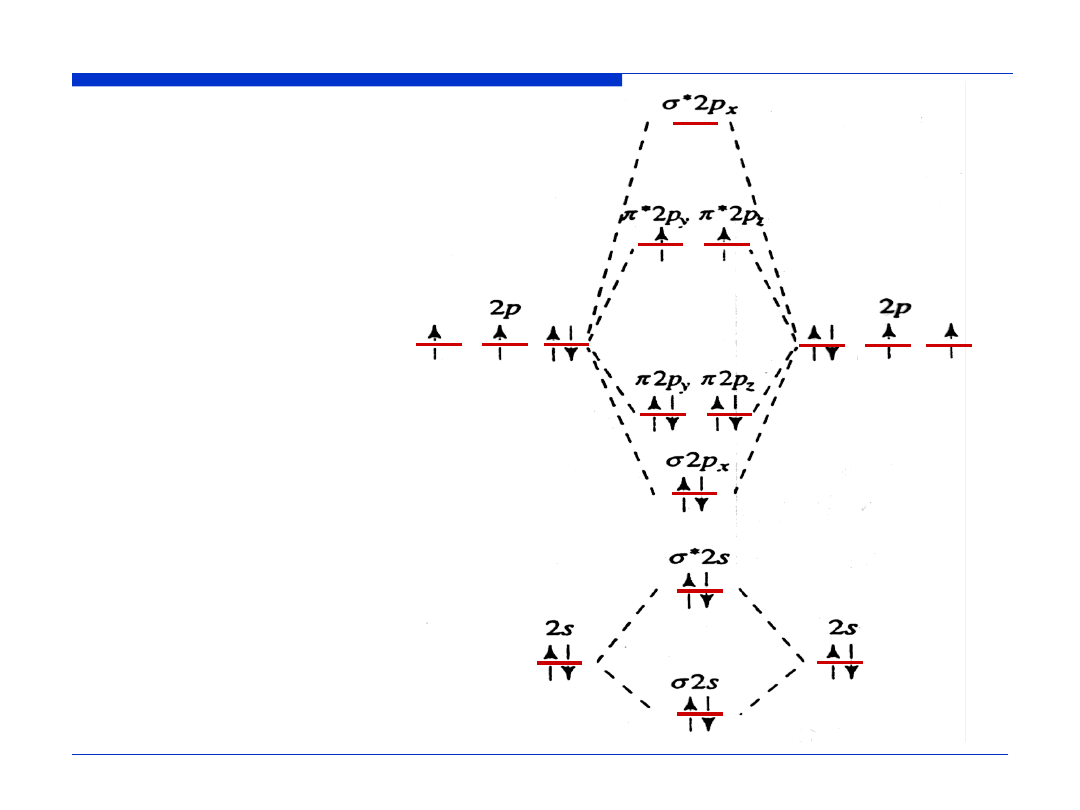
Orbitale molekularne N
Orbitale molekularne N
2
2
Rząd wiązania =
Rząd wiązania =
½
½
(liczba elektronów wiążących
(liczba elektronów wiążących
–
–
liczba elektronów antywiążących)
liczba elektronów antywiążących)
RW =
RW =
½
½
(LEW – LEA)
(LEW – LEA)
RW (N
RW (N
2
2
) =
) =
½
½
(8 – 2) = 3
(8 – 2) = 3
Konfiguracja elektronowa N
Konfiguracja elektronowa N
2
2
KK (
KK (
σ
σ
2s)
2s)
2
2
(
(
σ
σ
*
*
2s)
2s)
2
2
(
(
π
π
2p
2p
x
x
)
)
2
2
(
(
π
π
2p
2p
y
y
)
)
2
2
(
(
σ
σ
2p
2p
z
z
)
)
2
2
WYKŁAD 11
15
PODSTAWY CHEMII
PODSTAWY CHEMII
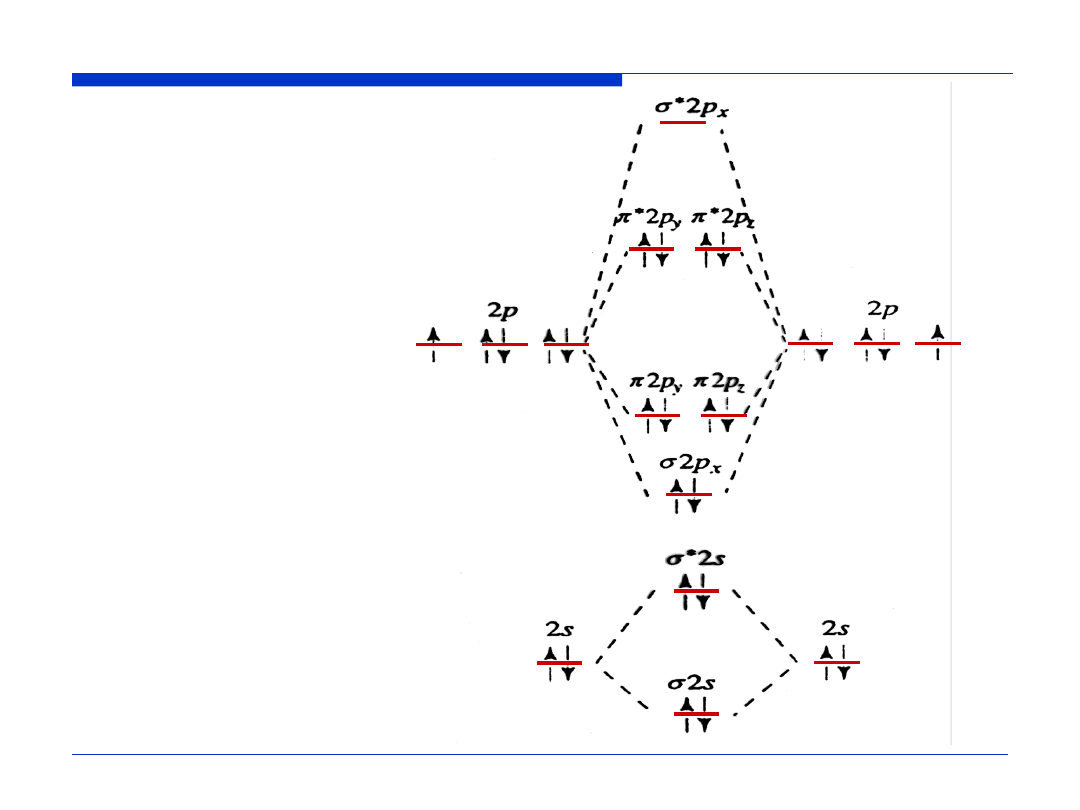
Orbitale molekularne O
Orbitale molekularne O
2
2
RW =
RW =
½
½
(LEW – LEA)
(LEW – LEA)
RW (O
RW (O
2
2
) =
) =
½
½
(8 – 4) = 2
(8 – 4) = 2
Konfiguracja elektronowa O
Konfiguracja elektronowa O
2
2
KK (
KK (
σ
σ
2s)
2s)
2
2
(
(
σ
σ
*
*
2s)
2s)
2
2
(
(
π
π
2p
2p
x
x
)
)
2
2
(
(
π
π
2p
2p
y
y
)
)
2
2
(
(
σ
σ
2p
2p
z
z
)
)
2
2
(
(
π
π
*
*
2p
2p
x
x
)
)
1
1
(
(
π
π
*
*
2p
2p
y
y
)
)
1
1
WYKŁAD 11
16
PODSTAWY CHEMII
PODSTAWY CHEMII
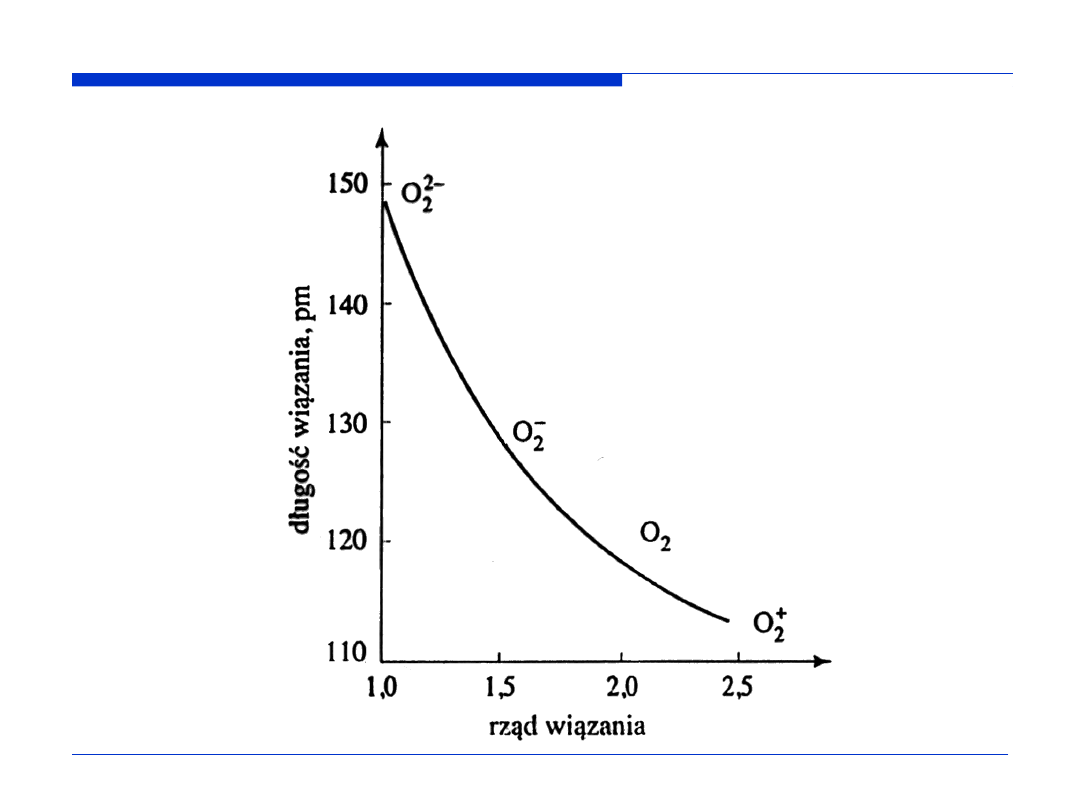
Orbitale molekularne F
Orbitale molekularne F
2
2
RW =
RW =
½
½
(LEW – LEA)
(LEW – LEA)
RW (F
RW (F
2
2
) =
) =
½
½
(8 – 6) = 1
(8 – 6) = 1
Konfiguracja elektronowa F
Konfiguracja elektronowa F
2
2
KK (
KK (
σ
σ
2s)
2s)
2
2
(
(
σ
σ
*
*
2s)
2s)
2
2
(
(
π
π
2p
2p
x
x
)
)
2
2
(
(
π
π
2p
2p
y
y
)
)
2
2
(
(
σ
σ
2p
2p
z
z
)
)
2
2
(
(
π
π
*
*
2p
2p
x
x
)
)
2
2
(
(
π
π
*
*
2p
2p
y
y
)
)
2
2
WYKŁAD 11
17
PODSTAWY CHEMII
PODSTAWY CHEMII

WYKŁAD 11
18
PODSTAWY CHEMII
PODSTAWY CHEMII
Dwuatomowe cząsteczki heterojądrowe
Dwuatomowe cząsteczki heterojądrowe
ORBITALE MOLEKULARNE
ORBITALE MOLEKULARNE

WYKŁAD 11
19
PODSTAWY CHEMII
PODSTAWY CHEMII
CZĄSTECZKI HETEROJĄDROWE
CZĄSTECZKI HETEROJĄDROWE
B
A
c
c
B
A
c
c
Różnice energii jonizacji atomów
Różnice energii jonizacji atomów
I
I
A
A
< I
< I
B
B
WYKŁAD 11
20
PODSTAWY CHEMII
PODSTAWY CHEMII
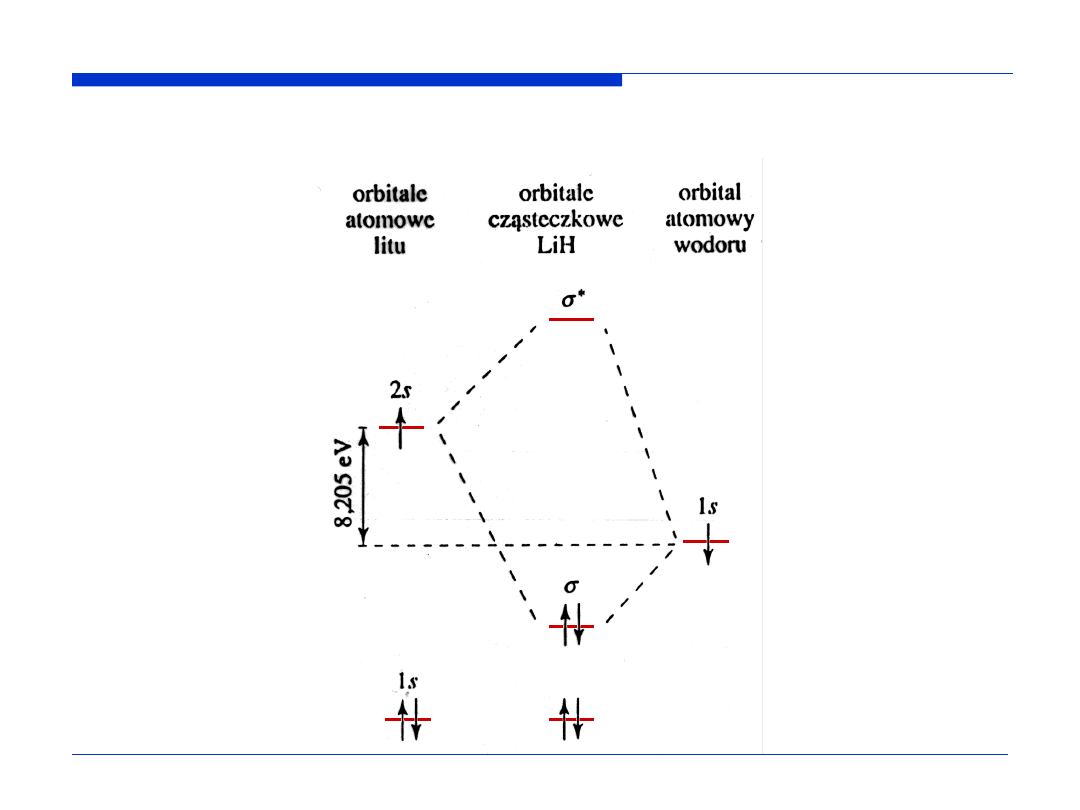
Schemat orbitali molekularnych cząsteczki LiH
Schemat orbitali molekularnych cząsteczki LiH
WYKŁAD 11
21
PODSTAWY CHEMII
PODSTAWY CHEMII
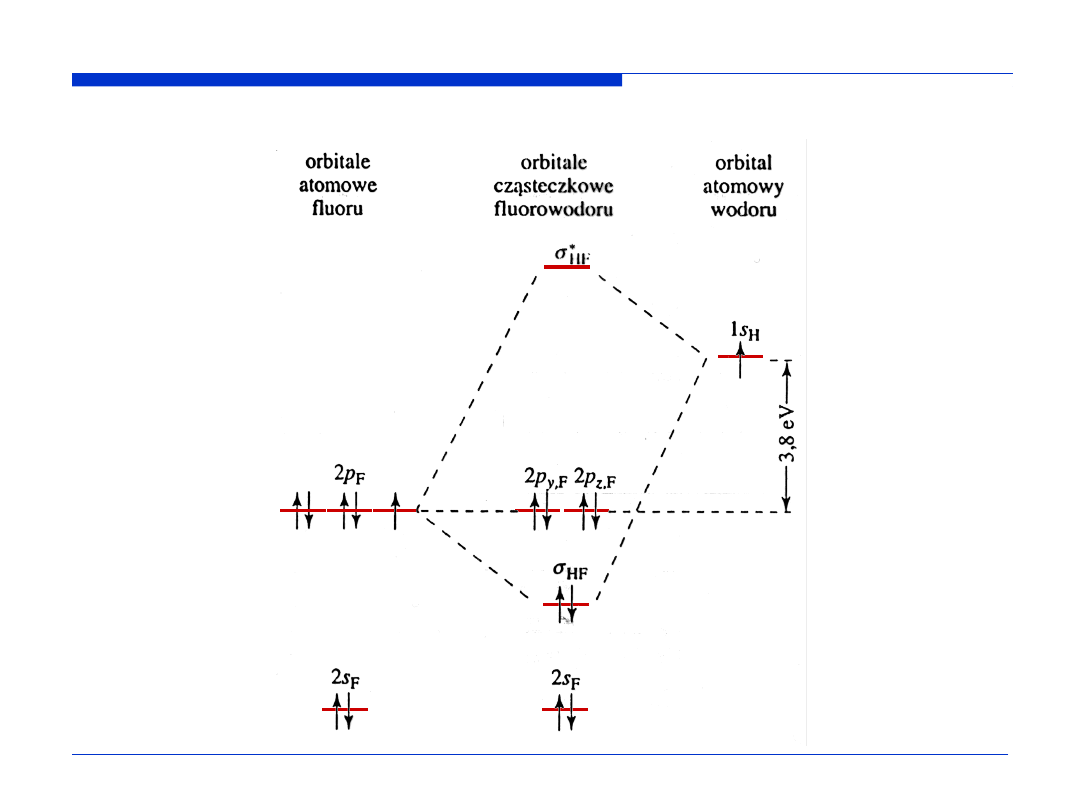
Schemat orbitali molekularnych cząsteczki HF
Schemat orbitali molekularnych cząsteczki HF
WYKŁAD 11
22
PODSTAWY CHEMII
PODSTAWY CHEMII
PRZYBLIŻONE KRYTERIUM DOŚWIADCZALNE
PRZYBLIŻONE KRYTERIUM DOŚWIADCZALNE
Przesunięcie ładunku – moment dipolowy
Przesunięcie ładunku – moment dipolowy
l
-e
-e
+e
+e
l
-
-
+
+
e
e
.
.
l
l
=
=
.
.
l
l
WYKŁAD 11
23
PODSTAWY CHEMII
PODSTAWY CHEMII
ELEKTROUJEMNOŚĆ według Paulinga
ELEKTROUJEMNOŚĆ według Paulinga
Energie jonizacji cząsteczek dwuatomowych
Energie jonizacji cząsteczek dwuatomowych
D
D
A-A
A-A
D
D
B-B
B-B
D
D
A-B
A-B
Im bardziej kowalencyjne
Im bardziej kowalencyjne
tym bardziej średnia geometryczna
tym bardziej średnia geometryczna
BB
AA
AB
x
D
D
D
0
lim
1
1018
.
0
mol
kJ
D
D
D
x
x
x
BB
AA
AB
B
A

WYKŁAD 11
24
PODSTAWY CHEMII
PODSTAWY CHEMII
WYKŁAD 11
25
PODSTAWY CHEMII
PODSTAWY CHEMII
ELEKTROUJEMNOŚĆ według Allred i Rochow
ELEKTROUJEMNOŚĆ według Allred i Rochow
Wykorzystanie koncepcji Slatera
Wykorzystanie koncepcji Slatera
744
.
0
359
.
0
2
r
S
Z
x
Z-S
- efektywna liczba atomowa
- efektywna liczba atomowa
r
- promień atomowy [
- promień atomowy [
Å
Å
]
]
% charakter jonowy = 16|x
% charakter jonowy = 16|x
A
A
-x
-x
B
B
| + 3.5|x
| + 3.5|x
A
A
-x
-x
B
B
|
|
2
2
WYKŁAD 11
26
PODSTAWY CHEMII
PODSTAWY CHEMII
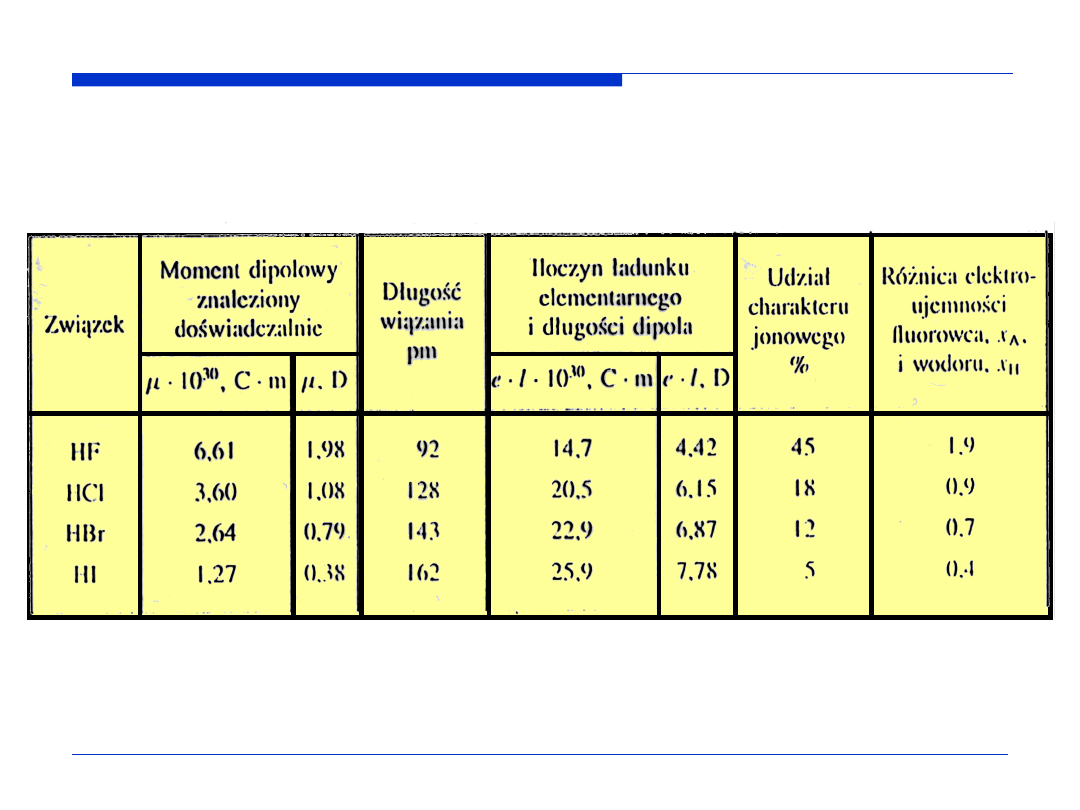
Momenty dipolowe fluorowców
Momenty dipolowe fluorowców
WYKŁAD 11
27
PODSTAWY CHEMII
PODSTAWY CHEMII
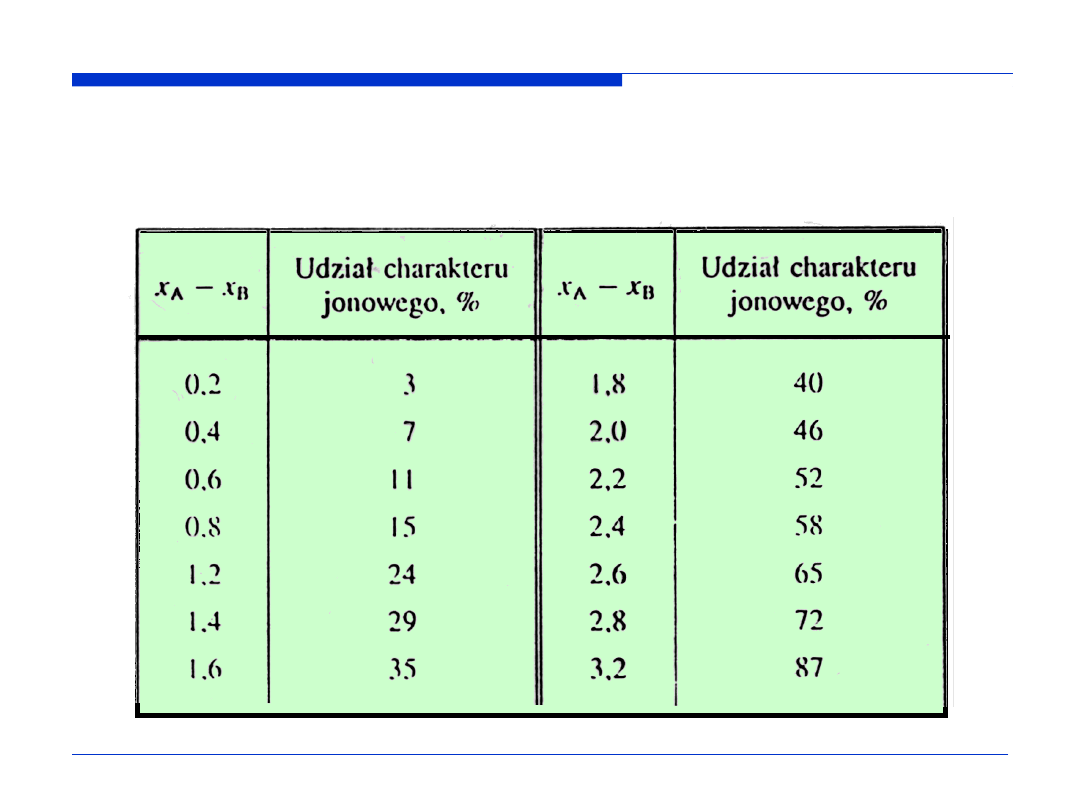
Zależność pomiędzy udziałem charakteru jonowego w wiązaniu a
Zależność pomiędzy udziałem charakteru jonowego w wiązaniu a
różnicą elektoujemności x
różnicą elektoujemności x
A
A
-x
-x
B
B

WYKŁAD 11
28
PODSTAWY CHEMII
PODSTAWY CHEMII
HYBRYDYZACJA ORBITALI
HYBRYDYZACJA ORBITALI
WYKŁAD 11
29
PODSTAWY CHEMII
PODSTAWY CHEMII
Symetria CH
Symetria CH
4
4
nie jest zgodna
nie jest zgodna
z symetrią orbitali opisujących
z symetrią orbitali opisujących
elektrony walencyjne atomu C
elektrony walencyjne atomu C
[C]: [He]2s
[C]: [He]2s
2
2
2p
2p
2
2
Struktura przestrzenna cząsteczki CH
Struktura przestrzenna cząsteczki CH
4
4

WYKŁAD 11
30
PODSTAWY CHEMII
PODSTAWY CHEMII
Hybrydyzacja sp
Hybrydyzacja sp
3
3
Hybrydyzacja
Hybrydyzacja
Utworzenie nowego zespołu orbitali atomowych
Utworzenie nowego zespołu orbitali atomowych
poprzez wymieszanie (czyli kombinację liniową)
poprzez wymieszanie (czyli kombinację liniową)
orbitali z powłoki walencyjnej
orbitali z powłoki walencyjnej
t
t
1
1
=
=
½
½
(2
(2
s C
s C
+ 2p
+ 2p
x C
x C
+ 2p
+ 2p
y C
y C
+ 2p
+ 2p
z C
z C
)
)
t
t
2
2
=
=
½
½
(2
(2
s C
s C
+ 2p
+ 2p
x C
x C
- 2p
- 2p
y C
y C
- 2p
- 2p
z C
z C
)
)
t
t
3
3
=
=
½
½
(2
(2
s C
s C
- 2p
- 2p
x C
x C
+ 2p
+ 2p
y C
y C
- 2p
- 2p
z C
z C
)
)
t
t
4
4
=
=
½
½
(2
(2
s C
s C
- 2p
- 2p
x C
x C
- 2p
- 2p
y C
y C
+ 2p
+ 2p
z C
z C
)
)

WYKŁAD 11
31
PODSTAWY CHEMII
PODSTAWY CHEMII
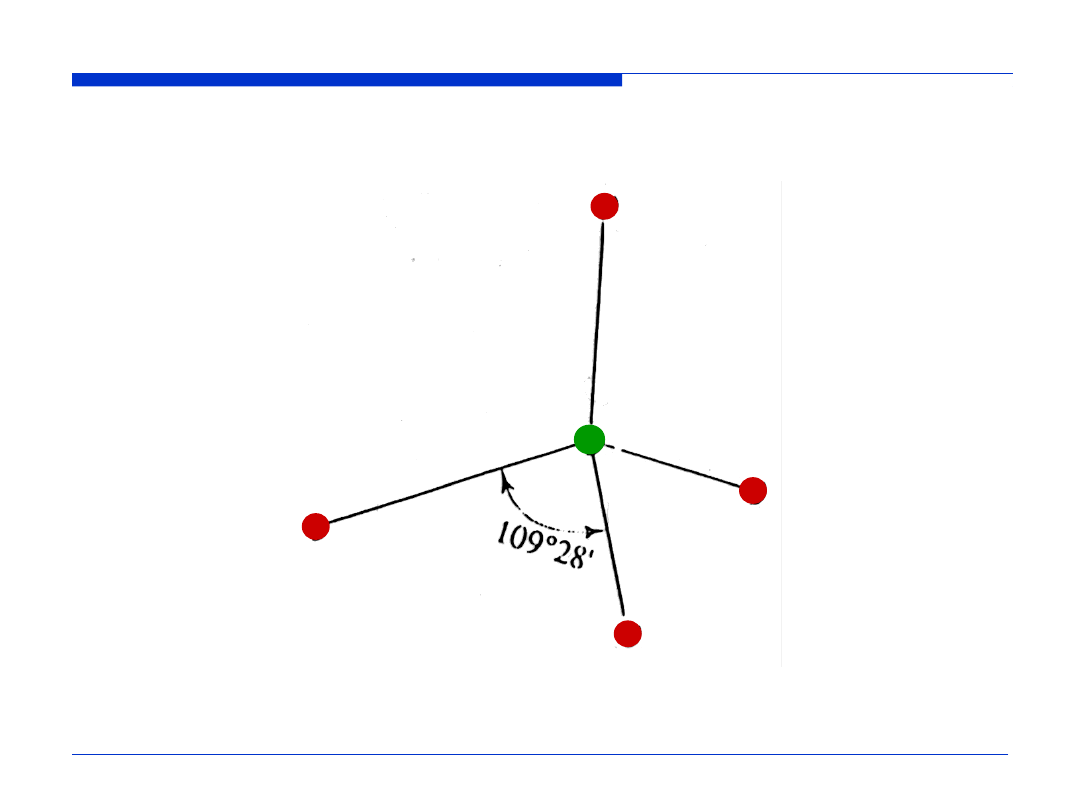
Przestrzenne rozmieszczenie orbitali zhybrydyzowanych.
Przestrzenne rozmieszczenie orbitali zhybrydyzowanych.
Hybrydyzacja sp
Hybrydyzacja sp
3
3
WYKŁAD 11
32
PODSTAWY CHEMII
PODSTAWY CHEMII
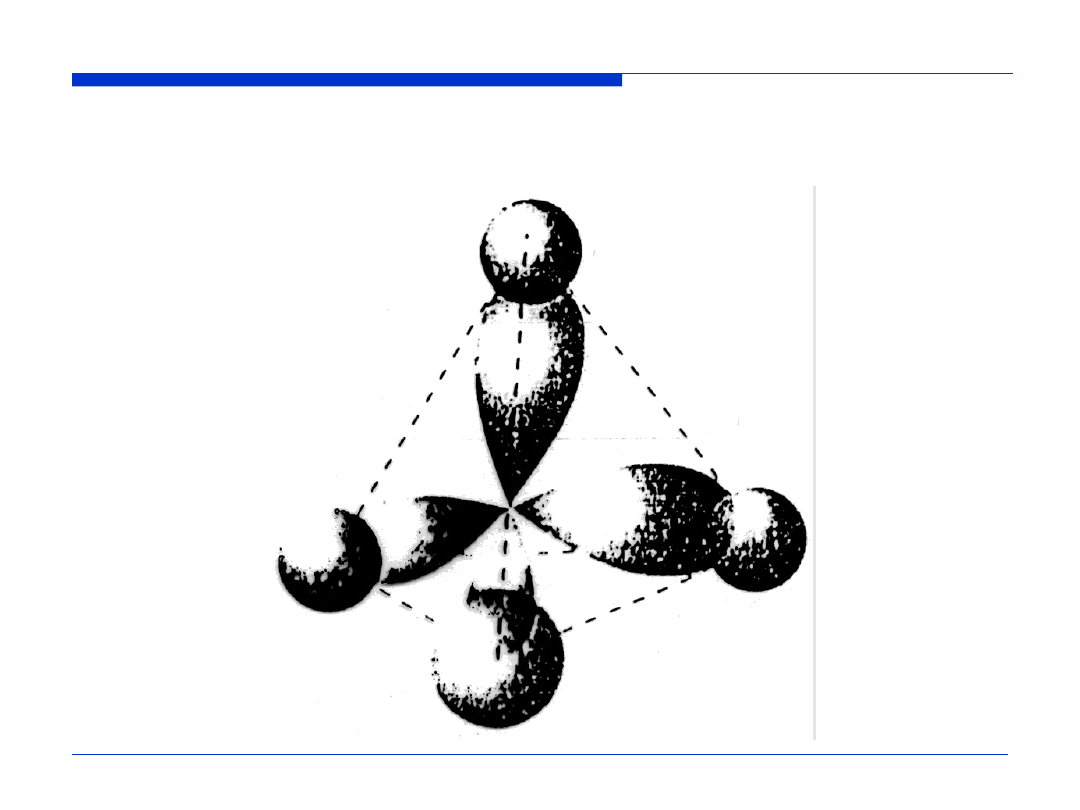
Nakładanie się zhybrydyzowanych orbitali atomu węgla z orbitalami
Nakładanie się zhybrydyzowanych orbitali atomu węgla z orbitalami
1s
1s
czterech atomów wodoru w cząsteczce metanu
czterech atomów wodoru w cząsteczce metanu
WYKŁAD 11
33
PODSTAWY CHEMII
PODSTAWY CHEMII
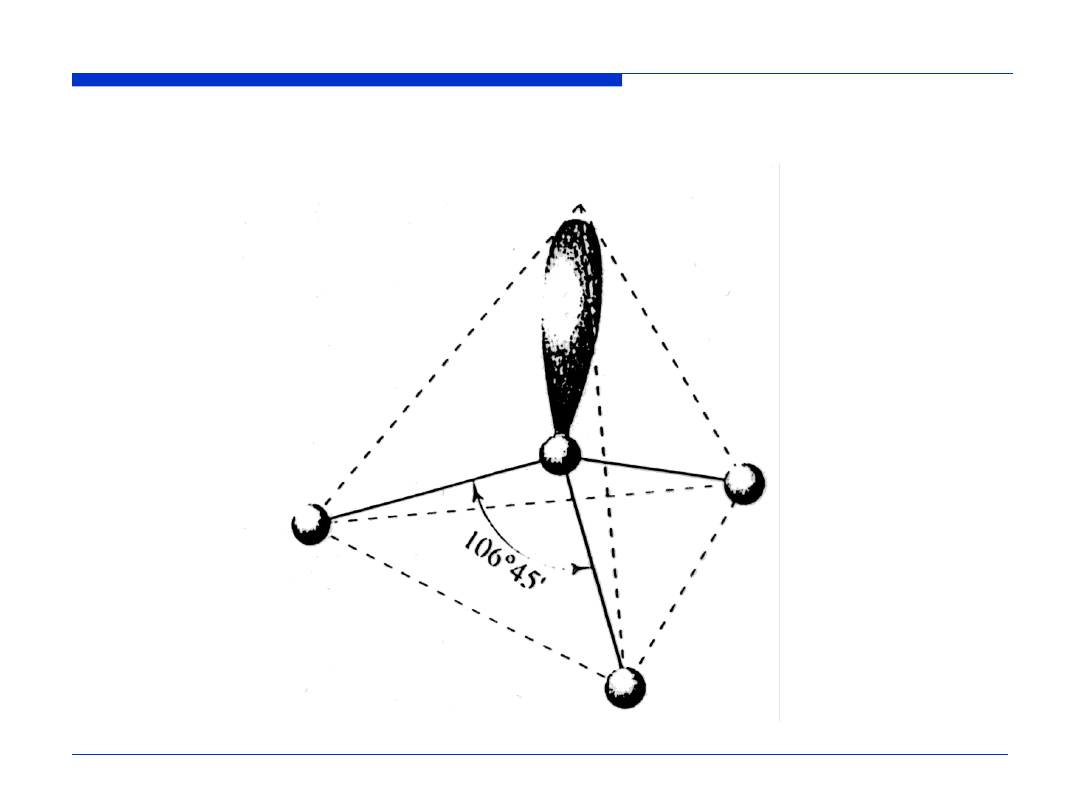
Przestrzenne rozmieszczenie wiązań i wolnej pary elektronowej
Przestrzenne rozmieszczenie wiązań i wolnej pary elektronowej
w cząstecze NH
w cząstecze NH
3
3
WYKŁAD 11
34
PODSTAWY CHEMII
PODSTAWY CHEMII
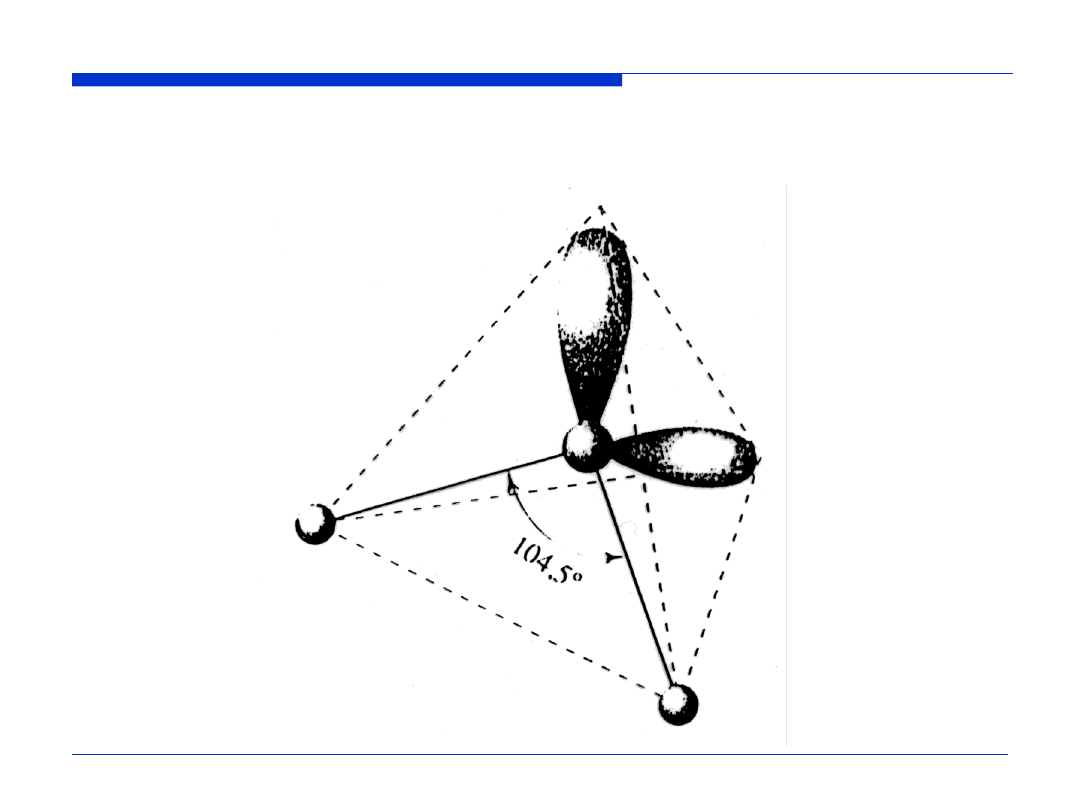
Przestrzenne rozmieszczenie wiązań i wolnych par elektronowych
Przestrzenne rozmieszczenie wiązań i wolnych par elektronowych
w cząstecze H
w cząstecze H
2
2
O
O
WYKŁAD 11
35
PODSTAWY CHEMII
PODSTAWY CHEMII
STRUKTURA ELEKTRONOWA CZĄSTECZKI NH
STRUKTURA ELEKTRONOWA CZĄSTECZKI NH
3
3
i jej właściwości
i jej właściwości
N: He, 2s
N: He, 2s
2
2
p
p
3
3
sp
sp
3
3
He, t
He, t
1
1
1
1
, t
, t
2
2
1
1
, t
, t
3
3
1
1
, t
, t
4
4
2
2
5e = 5e
5e = 5e
(1+3)
(1+3)
= 4t
= 4t
Elektroujemność:
Elektroujemność:
N = 3.07
N = 3.07
H = 2.20
H = 2.20
= 0.87
= 0.87
= 1.48D
= 1.48D
Rozpuszczalnik elektrolitów
Rozpuszczalnik elektrolitów
- słabe kwasy
- słabe kwasy
- słabe zasady
- słabe zasady

WYKŁAD 11
36
PODSTAWY CHEMII
PODSTAWY CHEMII
STRUKTURA ELEKTRONOWA CZĄSTECZKI H
STRUKTURA ELEKTRONOWA CZĄSTECZKI H
2
2
O
O
O: He, 2s
O: He, 2s
2
2
p
p
4
4
sp
sp
3
3
He, t
He, t
1
1
1
1
, t
, t
2
2
1
1
, t
, t
3
3
2
2
, t
, t
4
4
2
2
6e = 6e
6e = 6e
(1+3)
(1+3)
= 4t
= 4t
Elektroujemność:
Elektroujemność:
O = 3.50
O = 3.50
H = 2.20
H = 2.20
= 1.30
= 1.30
= 1.86D
= 1.86D
Rozpuszczalnik elektrolitów
Rozpuszczalnik elektrolitów
H
H
2
2
O + H
O + H
2
2
O = H
O = H
3
3
O
O
+
+
+ OH
+ OH
-
-
Akwakompleksy
Akwakompleksy
[Al(H
[Al(H
2
2
O)
O)
6
6
]
]
3+
3+
WYKŁAD 11
37
PODSTAWY CHEMII
PODSTAWY CHEMII
HYBRYDYZACJA sp
HYBRYDYZACJA sp
2
2
Przestrzenne rozmieszczenie wiązań w cząsteczce C
Przestrzenne rozmieszczenie wiązań w cząsteczce C
2
2
H
H
4
4
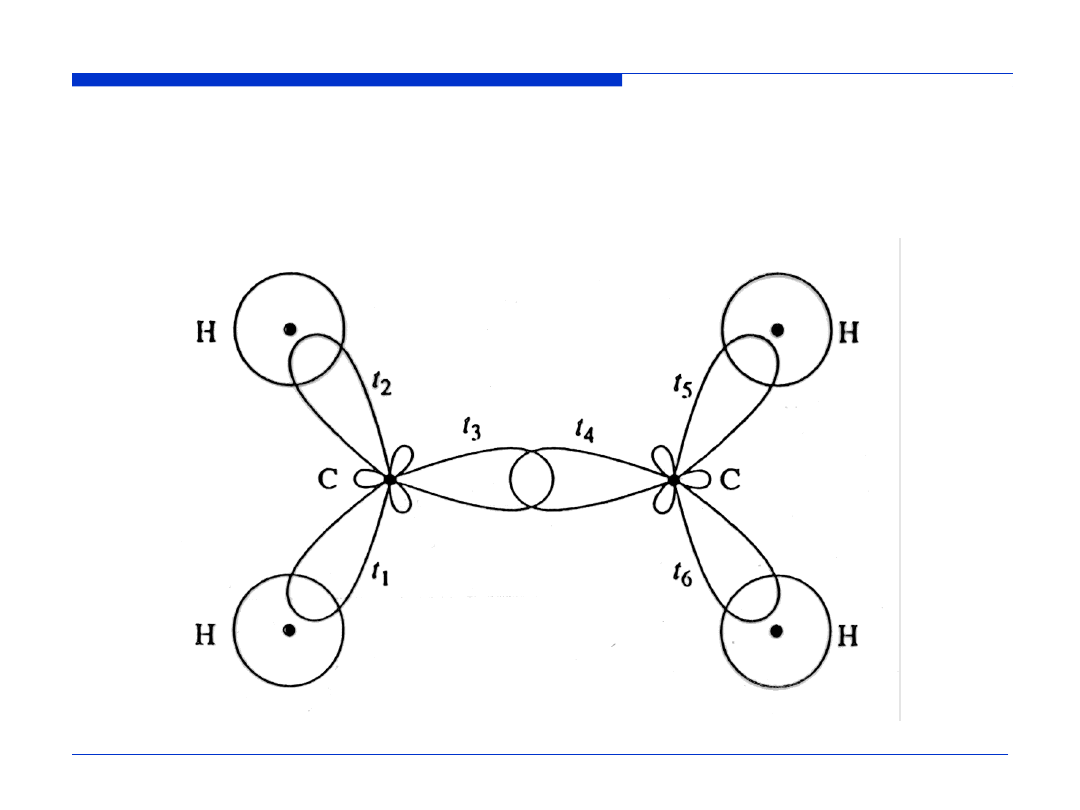
WYKŁAD 11
38
PODSTAWY CHEMII
PODSTAWY CHEMII
Nakładanie się zhybrydyzowanych orbitali atomów węgla
Nakładanie się zhybrydyzowanych orbitali atomów węgla
(hybrydyzacja sp
(hybrydyzacja sp
2
2
) i orbitali
) i orbitali
1s
1s
czterech atomów wodoru
czterech atomów wodoru
w cząsteczce C
w cząsteczce C
2
2
H
H
4
4
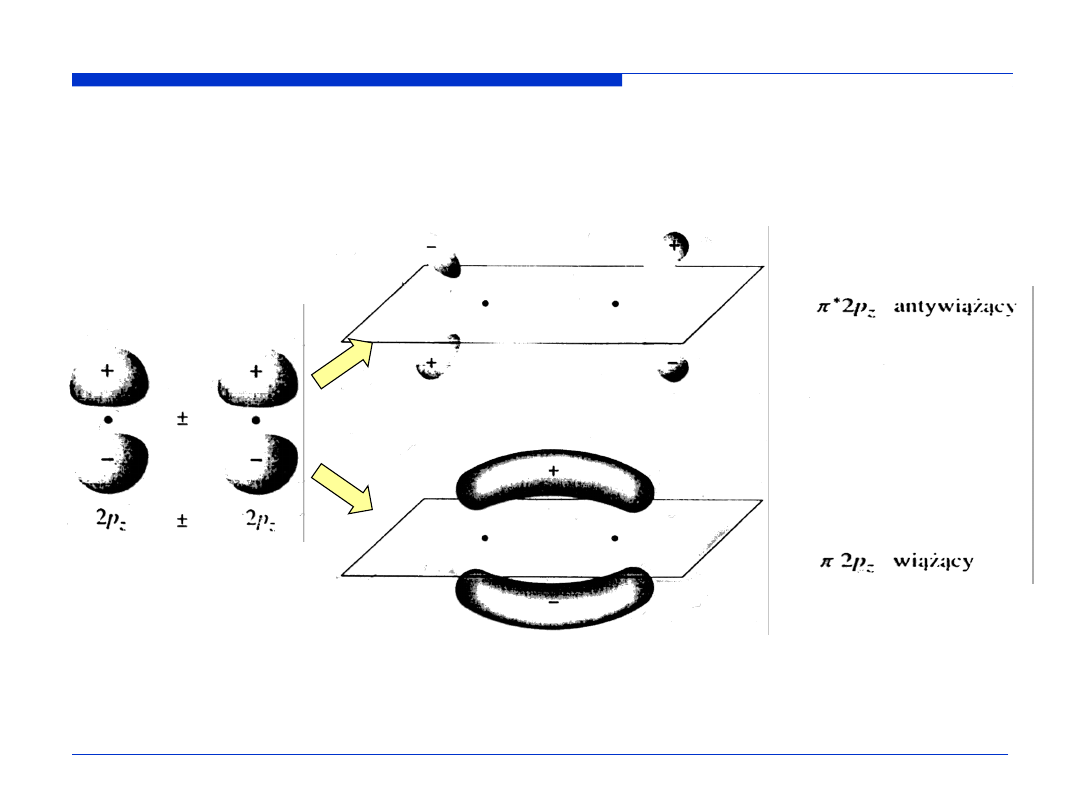
WYKŁAD 11
39
PODSTAWY CHEMII
PODSTAWY CHEMII
orbitale atomowe
orbitale atomowe
orbitale molekularne
orbitale molekularne
symbol orbitalu
symbol orbitalu
molekularnego
molekularnego
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
Kontury orbitali molekularnych – powierzchnie ograniczające przestrzeń, w
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
której prawdopodobieństwo napotkania elektronu wynosi 0,9.
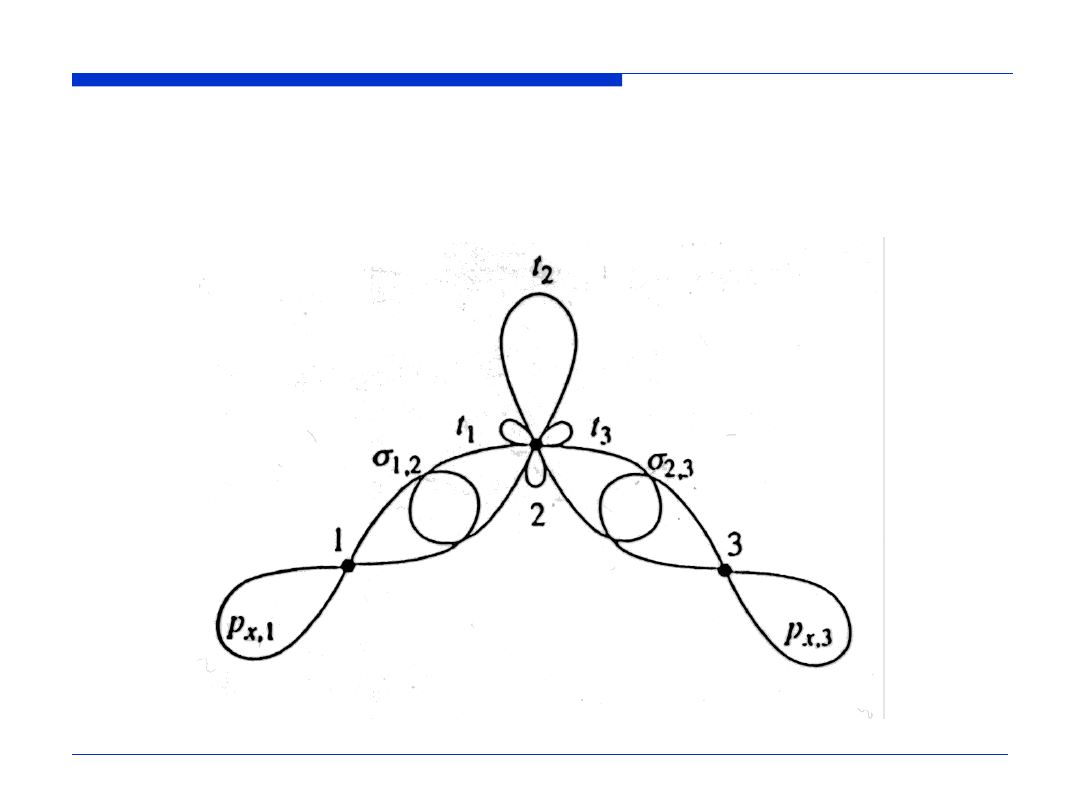
WYKŁAD 11
40
PODSTAWY CHEMII
PODSTAWY CHEMII
Nakładanie się zhybrydyzowanych orbitali (hybrydyzacja sp
Nakładanie się zhybrydyzowanych orbitali (hybrydyzacja sp
2
2
)
)
centralnego atomu tlenu z orbitalami
centralnego atomu tlenu z orbitalami
2p
2p
skrajnych atomów tlenu
skrajnych atomów tlenu
w cząsteczce O
w cząsteczce O
3
3
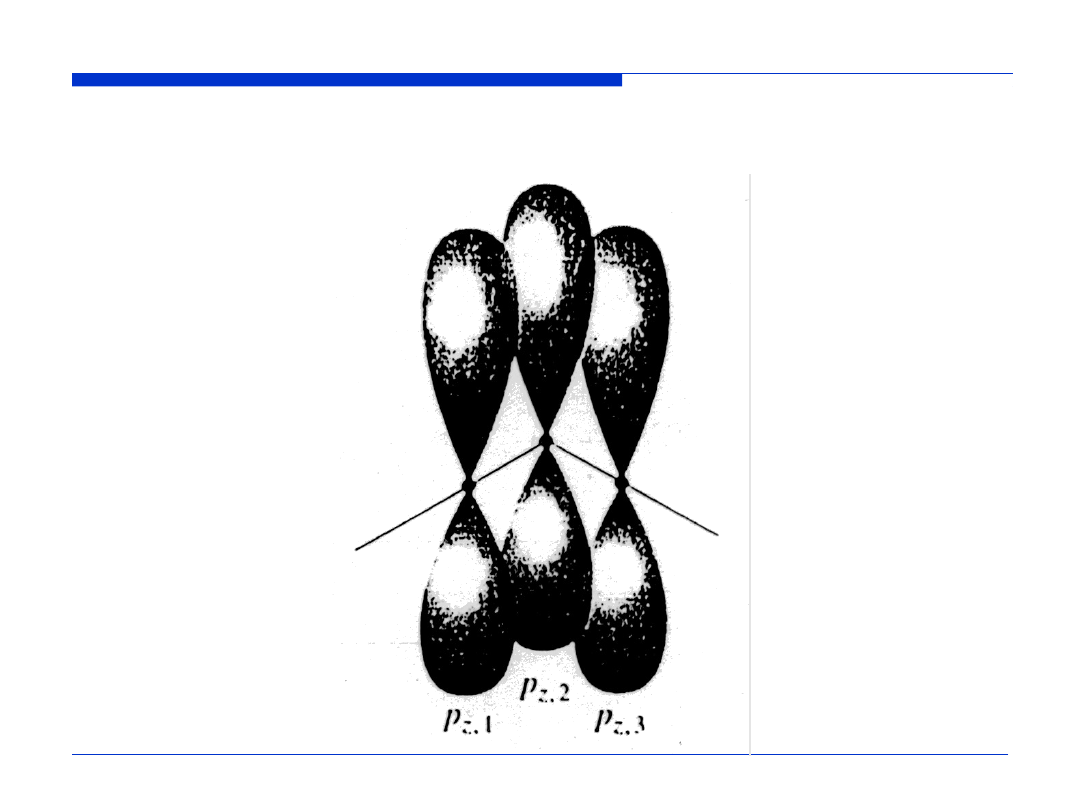
WYKŁAD 11
41
PODSTAWY CHEMII
PODSTAWY CHEMII
Nakładanie się orbitali
Nakładanie się orbitali
2p
2p
z
z
atomów tlenu w cząsteczce O
atomów tlenu w cząsteczce O
3
3
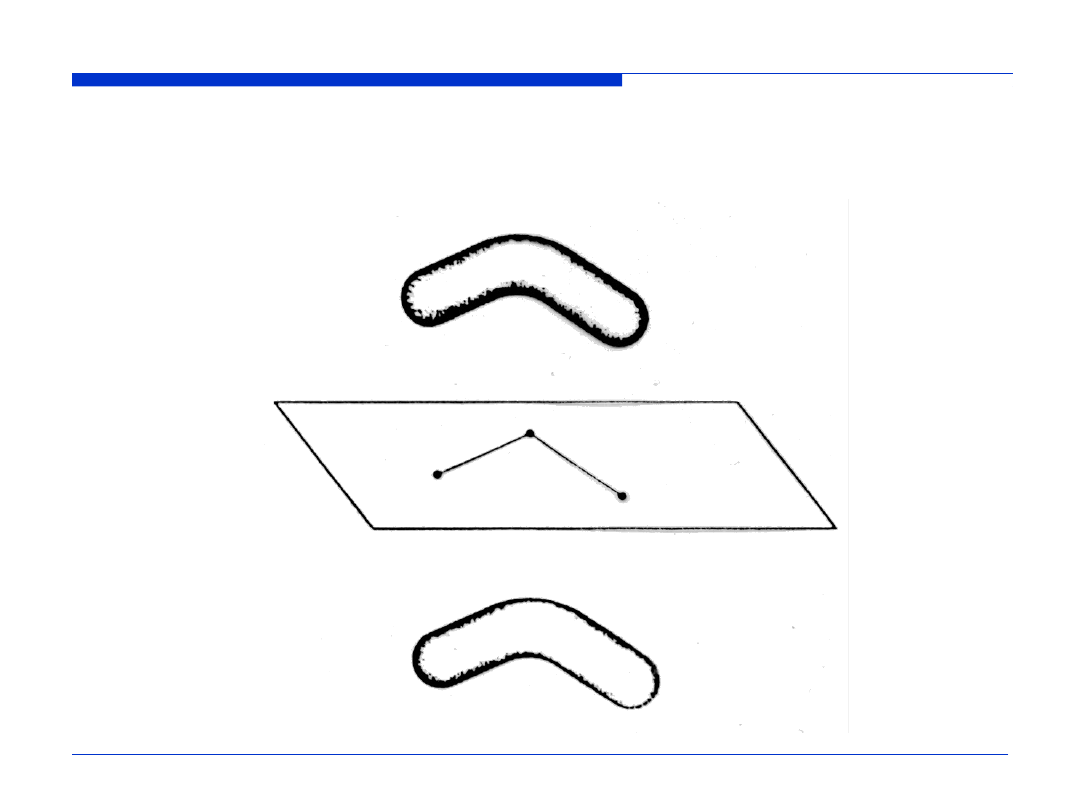
WYKŁAD 11
42
PODSTAWY CHEMII
PODSTAWY CHEMII
Kontury zdelokalizowanego orbitalu wiążącego
Kontury zdelokalizowanego orbitalu wiążącego
del
del
w cząsteczce ozonu
w cząsteczce ozonu
WYKŁAD 11
43
PODSTAWY CHEMII
PODSTAWY CHEMII
O
O
3
3
KKK (2s
KKK (2s
1
1
)
)
2
2
(2s
(2s
3
3
)
)
2
2
(2p
(2p
y,1
y,1
)
)
2
2
t
t
2
2
2
2
(s
(s
1,2
1,2
)
)
2
2
(s
(s
2,3
2,3
)
)
2
2
(p
(p
del
del
)
)
2
2
(p
(p
0
0
del
del
)
)
2
2
5
,
1
2
1
2
0
6
RW
RW=
RW=
Liczba wiązań
Liczba wiązań
1
1
Wiążące - Antywiążące
Wiążące - Antywiążące
2
2
.
.
OZON: O
OZON: O
3
3
BENZEN: C
BENZEN: C
6
6
H
H
6
6
H
H
H
H
H
H
H
H
H
H
H
H
6 x K
6 x K
6 x (s
6 x (s
C-H
C-H
)
)
2
2
6 x (s
6 x (s
C-C
C-C
)
)
2
2
3 x (p
3 x (p
C-C
C-C
)
)
2
2
1
6
1
2
0
12
RW
5
,
1
6
1
2
0
18
RW

WYKŁAD 11
44
PODSTAWY CHEMII
PODSTAWY CHEMII
Nakładanie się orbitali
Nakładanie się orbitali
2p
2p
y
y
oraz orbitali
oraz orbitali
2p
2p
z
z
atomów węgla
atomów węgla
w cząsteczce C
w cząsteczce C
2
2
H
H
2
2
WYKŁAD 11
45
PODSTAWY CHEMII
PODSTAWY CHEMII
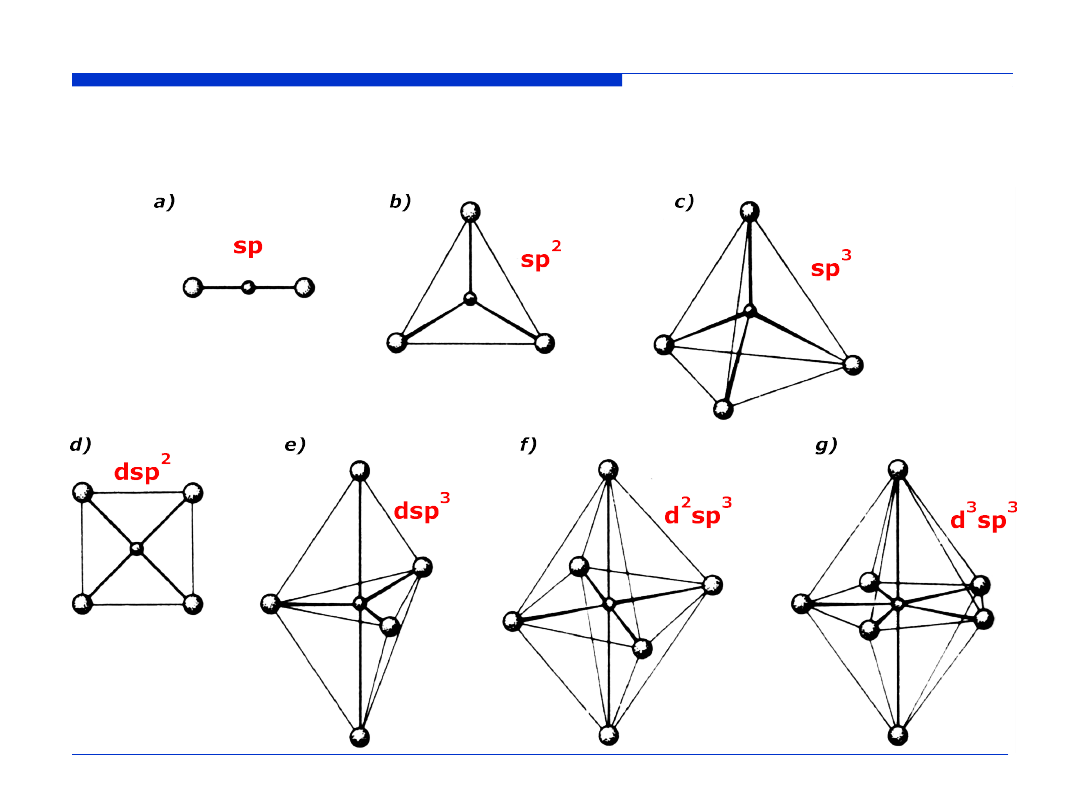
Przestrzenne rozmieszczenie wiązań chemicznych tworzonych
Przestrzenne rozmieszczenie wiązań chemicznych tworzonych
przez orbitale zhybrydyzowane
przez orbitale zhybrydyzowane
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
ja mialam jeszcze do obliczenia rzedowosc czasteczce tlenu i tych jonow tlenu i narysowac orbitale
a07 fizyka czasteczkowa wstep (11 16) 4OIIVPDYM7EPESXKM (2)
0203 11 03 2009, wykład nr 3 , Białka powierzchni komórkowej Cząsteczki adhezyjne
C5 (X7) B1KT0102P0 11 13 03 2014 Modyfikacja Dodatek do paliwa a filtr cząstek stałych
Zarz[1] finan przeds 11 analiza wskaz
11 Siłowniki
11 BIOCHEMIA horyzontalny transfer genów
PKM NOWY W T II 11
wyklad 11
R1 11
CALC1 L 11 12 Differenial Equations
Prezentacje, Spostrzeganie ludzi 27 11
więcej podobnych podstron