
Proteoliza
ATP-zależna i
ATP-
niezależna
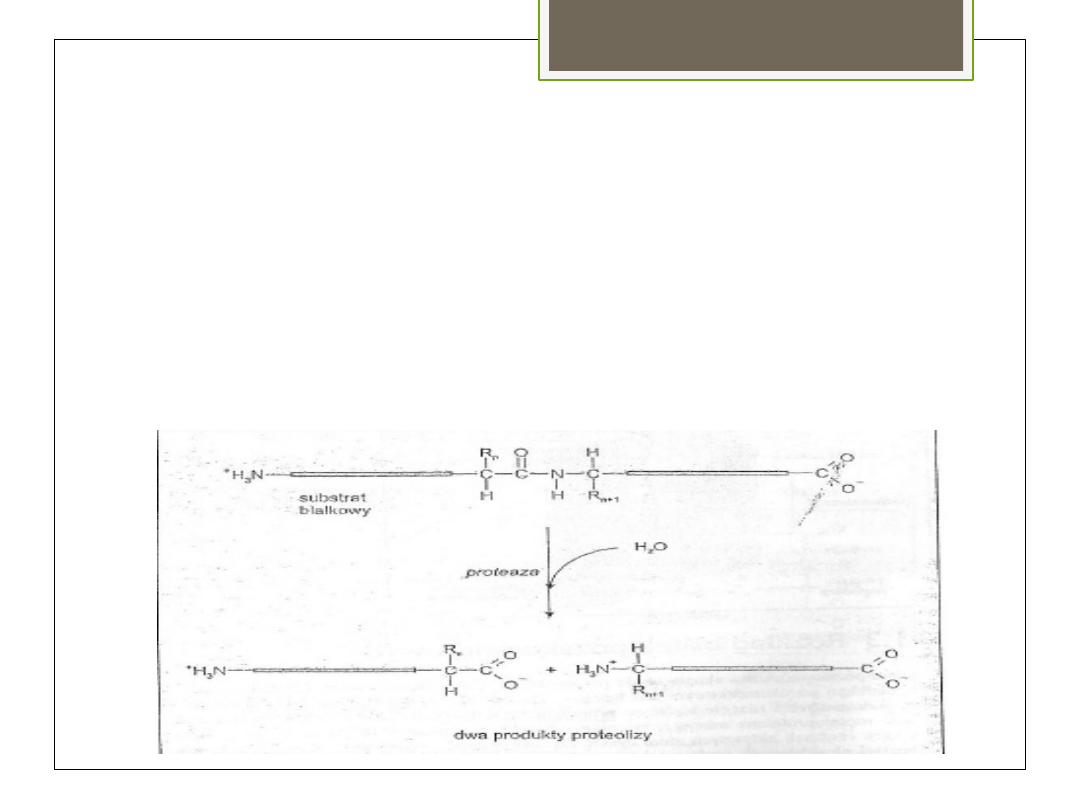
Proteoliza
hydrolityczny rozkład wiązania
peptydowego. Prowadzi do rozpadu białek
na peptydy i aminokwasy. Katalizowana
poprzez proteazy (peptydazy)

Peptydazy:
Egzopeptydazy:
Aminopeptydazy
Karboksypeptydazy
•
Karboksypeptydaza A
•
Karboksypeptydaza B
Endopeptydazy
Pepsyna
Trypsyna
Chymotrypsyna
Elastaza
Wewnątrzkomórkowa
degradacja białek
Szlak ATP-
niezależny
(lizosomalny)
Szlak ATP- zależny
(proteosomalny)

Szlak ATP- niezależny
Zachodzi w lizosomach przy udziale
katepsyn
Proteazy lizosomalne
Optymalne pH – ok. 5
Degradacja białek:
Pozakomórkowych
Związanych z błoną kom.
Długożyjących białek
wewnątrzkomórkowych
Nie wymaga ubikwitynacji

Degradacja peptydów krwi
(np. hormonów) w
wątrobie:
Sygnałem do degradacji jest utrata
reszty kwasu sjalowego
z nieredukującego końca
łańcucha oligosacharydowego
glikoproteiny
Receptor asjaloglikoproteinowy
rozpoznaje glikoproteinę i internalizuje ją
do wnętrza hepatocytu
Cząsteczka ulega degradacji w lizosomie

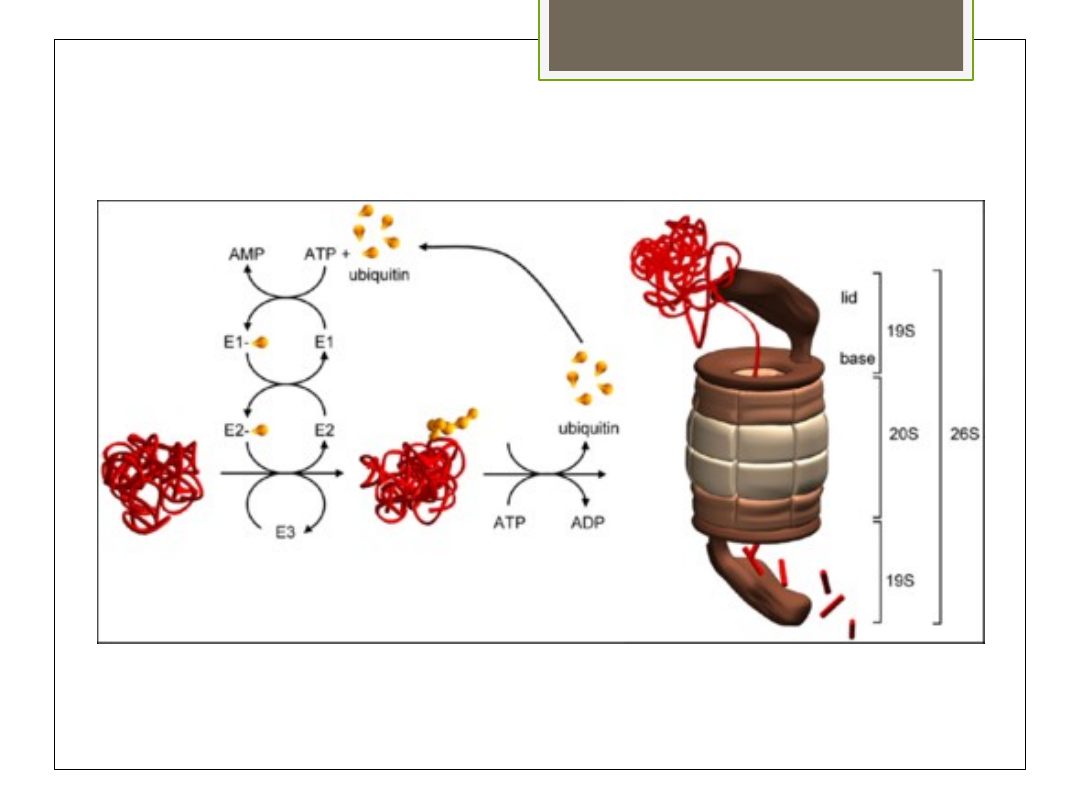
Szlak ATP- zależny
Zachodzi w cytozolu z udziałem
ubikwityny i ATP
Degradacja białek:
Nieprawidłowych
Krótko żyjących
Znaczone ubikwityną białka ulegają
degradacji w proteasomie

Przebieg:
Ubikwityna ulega aktywacji i przyłącza
się do białka w reakcji wymagającej ATP
Powstaje niepeptydowe wiązanie między
glicyną C-końca ubikwityny a grupą ε-
aminową lizyny degradowanego białka
Do 1 substratu przyłącza się kilka
cząsteczek ubikwityny

Reakcję białka w
ubikwityną:
Przyspiesza:
N-końcowa reszta
kw.
Asparaginowego
N- końcowa reszta
argininy
Hamuje:
N-końcowa reszta
metioniny
N- końcowa reszta
seryny

Czas połowicznego
rozpadu białka:
Określa jego podatność na degradację
Dla białek wątroby: 0,5-150h
Dla enzymów metabolizmu
podstawowego: >100h
Dla enzymów regulatorowych: 0,5-2h
Sekwencje PEST, czyli regiony bogate w
prolinę (P), glutaminian (E), serynę (S) i
treoninę (T) odpowiadają za szybką
degradację niektórych białek

Literatura:
Biochemia Harpera ilustrowana, Robert
K.Murray, wyd. Lekarskie PZWL
Biochemia, E. Bańskowski, wyd.
MedPharm Polska
Document Outline
Wyszukiwarka
Podobne podstrony:
Proteoliza ATP zależna i ATP niezależna
Mowa zależna i mowa niezależna strona bierna
Biochemia, ATP
05 BIOCHEMIA Zw wysokoenergetyczne ATP
atp 2003 07 78
Synteza ATP w organizmie, Weterynaria Lublin, Weterynaria 1, Biochemia, Biochemia
zmienna zalezna i niezalezna id Nieznany
mikrobiologia zdj 6 b, ATP produkowany podczas utleniania jednej cząsteczki glukozy w warunkach tlen
Extracellular NAD and ATP Partners in immune
Biochemia, ATP(1)
atp 2003 05 109
ATP umowa atp id 627904 Nieznany (2)
ATP, GTP
148 Omow w jaki sposob dochodzi do syntezy ATP komorkowego lancuchu utleniania komorkowego
Cz 3, Zmienne zależne i niezależne występują w modelu Keynesa
ATP
Odnawianie zapasów ATP
ATP
8 Alfabetyczny spis znaków stosowanych w ATP 45
więcej podobnych podstron