
ANALIZA
POZOSTAŁOŚCI
ŚRODKÓW OCHRONY ROŚLIN
W MIODZIE PRZY UŻYCIU
METODY QUECHERS
MARTA
KOPEĆ
OŚ I SUM
ŚRODKI OCHRONY ROŚLIN
• Definicja:
„substancje lub ich mieszaniny oraz żywe organizmy,
przeznaczone do
ochrony roślin uprawnych
przed
organizmami szkodliwymi, niszczenia niepożądanych
roślin, regulowania wzrostu, rozwoju i innych procesów
biologicznych w roślinach uprawnych oraz do poprawy
właściwości lub skuteczności tych substancji.”
• Stosowane w rolnictwie mogą być przyczyną masowych
zatruć pszczół, ale również przedostawać się i kumulować
w produktach pszczelich, np. miodzie.
• Towary spożywcze muszą być kontrolowane, pod kątem
występowania substancji niedozwolonych w żywności oraz
przestrzegania najwyższych dopuszczalnych poziomów
pozostałości (NDP)
(Rozporządzenie (we) nr 396/2005 Parlamentu
Europejskiego i Rady z dnia 23 lutego 2005 r. w sprawie najwyższych
dopuszczalnych poziomów pozostałości pestycydów w żywności i paszy
pochodzenia roślinnego i zwierzęcego oraz na ich powierzchni.)
PODZIAŁ ZE WG. NA BUDOWĘ
CHEMICZNĄ
PESTYCYDY
Nieorganic
zne
Organiczne
Insektycyd
y arsenowe
Insektycyd
y
fluorkowe
Herbicydy
nieorganiczne
Fungicydy
nieorganicz
ne
Węglowodory
chlorowane
Pochodne
kw.
fosforowyc
h
Karbaminian
y
Pochodne
triazyny
Ditiokarbaminian
y
Pochodne kw.
fenoksyoctowego
Pochodne
mocznika
Syntetyc
zne
pyretroid
y
Dinitrofeno
le
związki
bispirydylow
e
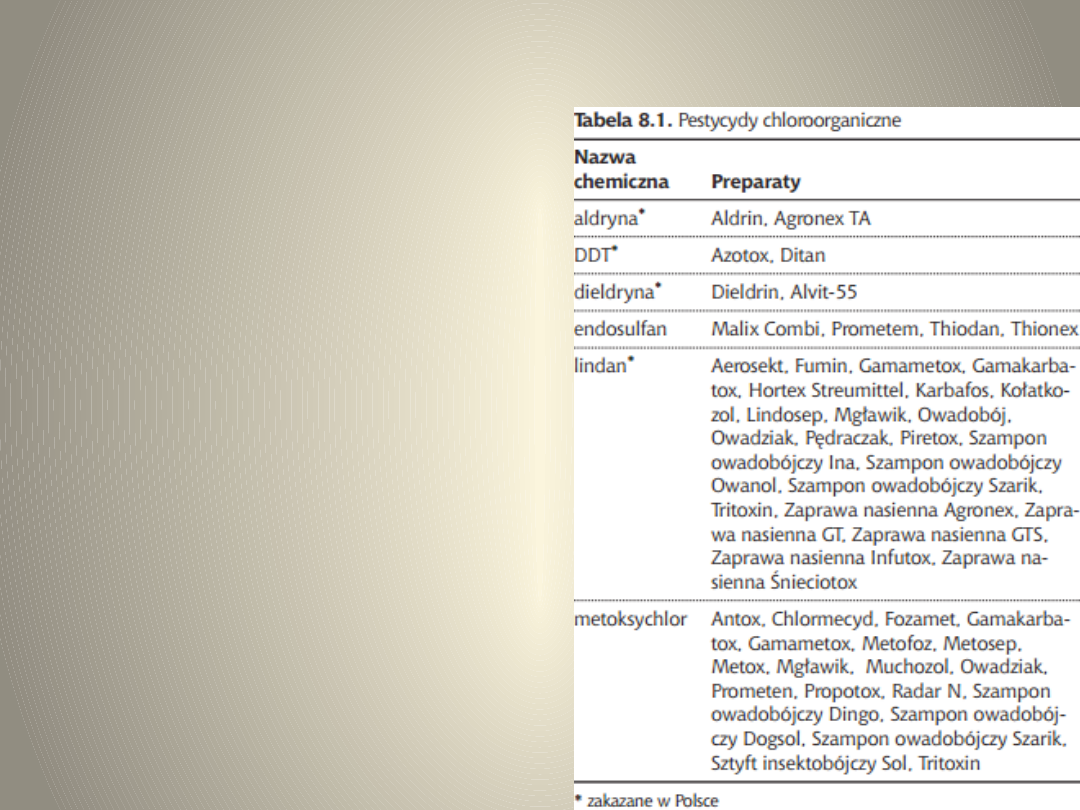
PESTYCYDY
CHLOROORGANICZNE
• Pochodne chlorowcowe
kilkupierścieniowych
cykloparafin oraz połączeń
szeregu dienowego
terpenów, benzenu itp.;
• Posiadają wspólne cechy,
do których można zaliczyć:
dobra rozpuszczalność w
lipidach
zdolność odkładania się
w tkankach organizmów
żywych.

PESTYCYDY
FOSFOROORGANICZNE
•
występują w formie
krystalicznej lub są oleistymi
cieczami, o ostrym,
nieprzyjemnym zapachu
• hamują aktywności enzymów
regulujących funkcjonowanie
układu nerwowego- głównie
acetylocholinesterazy
• nie wykazują dużej trwałości
oraz tendencji do
kumulowania się w
organizmach i środowisku
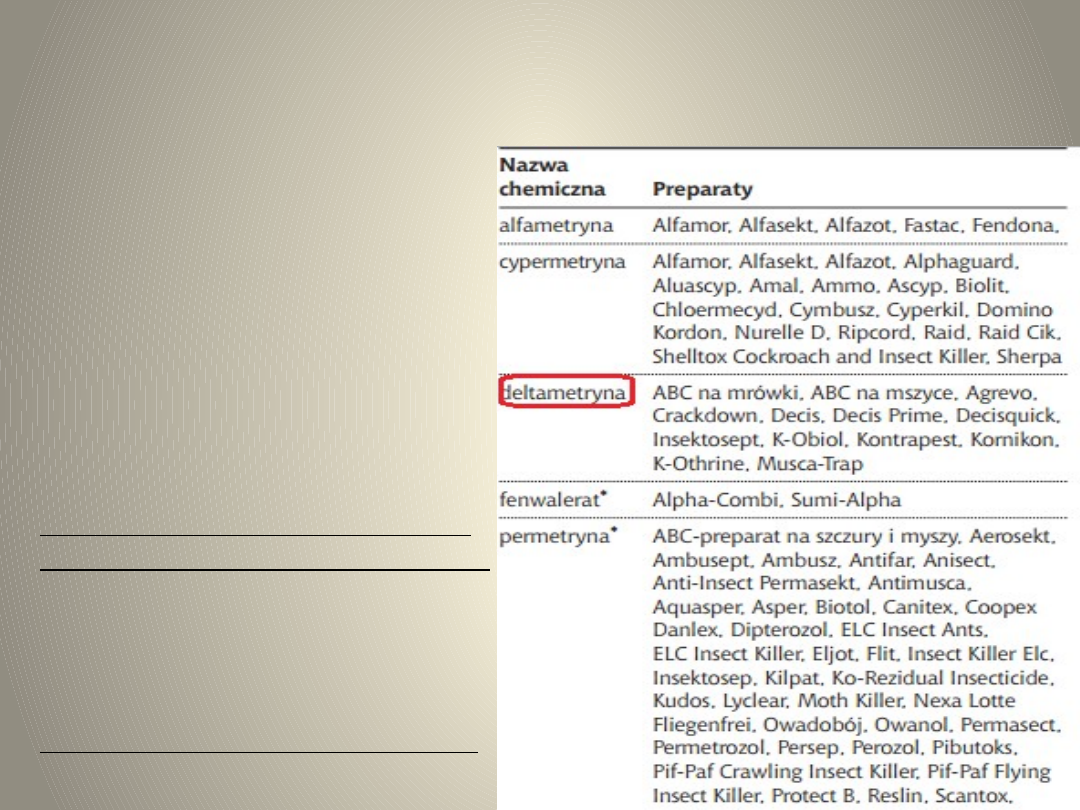
Tab. 2 Związki fosforoorganiczne
PYRETROIDY
• Estry kwasu chryzantemowego
lub halogenowych analogów
tego kwasu i alkoholi pierwszo-
lub drugorzędowych,
zawierających w cząsteczce
przynajmniej jedno wiązanie
podwójne.
• Działają na centralny i
obwodowy układ nerwowy-
blokują kanały przewodnictwa
jonowego w błonach neuronów.
• Podnoszą uwalnianie
noradrenaliny, dopaminy.
• Działają wyłącznie kontaktowo.
Tab.3 Pyretroidy

METODA QuEChERS
(Quick Easy Cheap Effective
Rugged and Safe)
• Pozwala na oznaczenie pozostałości ś.o.r.
przy minimalnej liczbie etapów pracy
laboratoryjnej i niewielkim zużyciu
odczynników oraz szkła laboratoryjnego.
• Polega na ekstrakcji i podziale w układzie
ciecz-ciecz składników próbki z użyciem
acetonitrylu, a następnie oczyszczeniu
ekstraktu z wykorzystaniem metody
dyspersyjnej ekstrakcji do fazy stałej
(SPE – Solid Phase Extraction)

CEL BADAŃ
• Sprawdzenie przydatności metody
QuEChERS (Quick Easy Cheap
Effective Rugged and Safe) w
połączeniu z chromatografią gazową
z detekcją wychwytu elektronów oraz
termojonową w badaniach
pozostałości pestycydów w miodzie.

BADANIA
1. Materiały i metody
• miód pochodzący z pasieki położonej na czystych ekologicznie terenach
Pogórza Dynowskiego- wstępnie poddany analizie pod kątem wykluczenia
obecności wytypowanych do badań pestycydów;
• Do badań wybrano 19 insektycydów z różnych grup chemicznych:
chloroogranicznej, fosforoorganicznej oraz pyretroidów;
• Pozostałości pestycydów oznaczano na dwóch poziomach wzbogacenia:
0,003–0,02 i 0,11–0,24 mg/kg (6 powtórzeń)
• Zastosowano kolumny używane do oczyszczania owoców i warzyw o
niskiej zawartości tłuszczu, wosku i pigmentów;
• Próbki przygotowano zgodnie z polską normą PN-EN 15662:2008
2. Etapy analizy
I. Przygotowanie próbek (końcowy etap- zmiana rozpuszczalnika z
acetonitrylu na eter naftowy).
II. Oznaczanie na chromatografie gazowym Agilent 7890
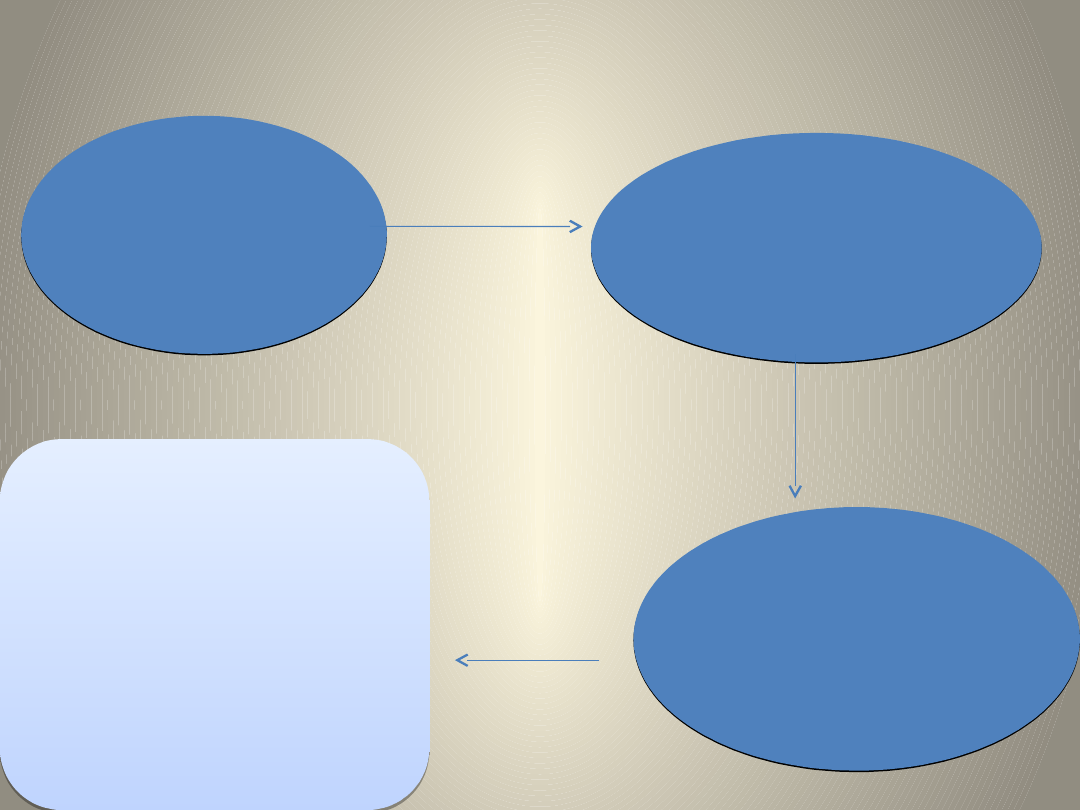
I. PRZYGOTOWANIE PRÓBEK
5 g miodu + 5ml
wody +
mieszanina
wzorców
ekstrakcja
acetonitrylem
+ mieszanina soli: 4 g
MgSO
4
, 1 g
NaCl, 1 g cytrynianu
trisodu i 0,5 g
seskwiwodnego
wodorocytrynianu disodu.
Wstrząsanie,
wirowanie
6 ml warstwy
acetonitrylowej
przeniesiono do probówki
zawierajacej: 150 mg PSA
(primary secondary
amine) i 900 mg Na
2
SO
4
•pobrano 2 ml ekstraktu,
•przeniesiono do szklanej
probówki,
• odparowano do sucha
• suchą pozostałość
rozpuszczono w 1 ml
(dla niższego poziomu
wzbogacenia) lub 2 ml
(dla wyższego poziomu
wzbogacenia) eteru
naftowego.
•pobrano 2 ml ekstraktu,
•przeniesiono do szklanej
probówki,
• odparowano do sucha
• suchą pozostałość
rozpuszczono w 1 ml
(dla niższego poziomu
wzbogacenia) lub 2 ml
(dla wyższego poziomu
wzbogacenia) eteru
naftowego.
Wstrząsanie,
odwirowywan
ie

II. OZNACZANIE NA
CHROMATOGRAFIE GAZOWYM
Chromatograf wyposażony
był w detektory:
1. wychwytu elektronów
(EC)- czuły na
zanieczyszczenia
zawierające pierwiastki o
dużej elektroujemności;
2. azotowo- fosforowy
(NP)- ma wysoką czułość
w stosunku do związków
azotu i fosforu.
Ryc.1 Chromatograf Gazowy
Agilent 7890A
WARUNKI ANALIZY
INSTRUMENTALNEJ
1. Przepływy gazów:
• gaz nośny azot –4,4 ml/min;
• detektor NP: wodór – 3,0 ml/min, powietrze – 60 ml/min,
gaz dodatkowy (azot) –10 ml/min;
• detektor EC: gaz dodatkowy (azot) – 30 ml/min.
2. Temperatura:
• detektora NP: 300°C,
• detektora EC: 260°C;
• komory nastrzykowej: 250°C.
Badane związki były identyfikowane na podstawie
czasów retencji.
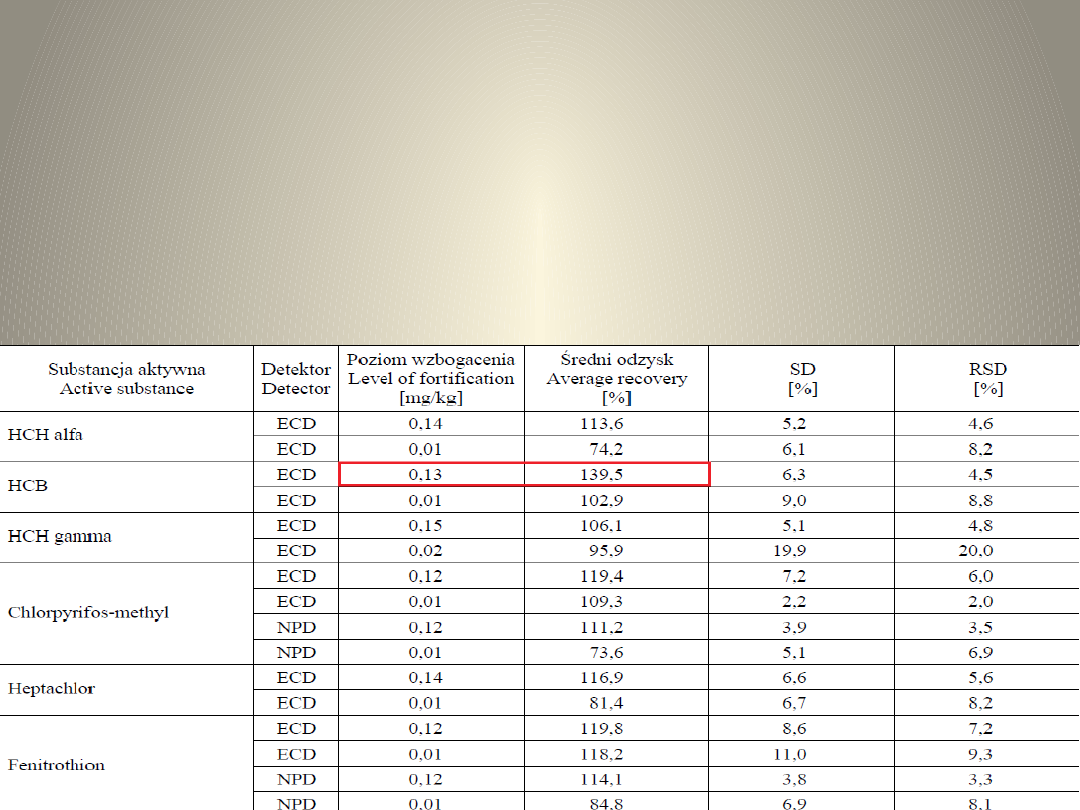
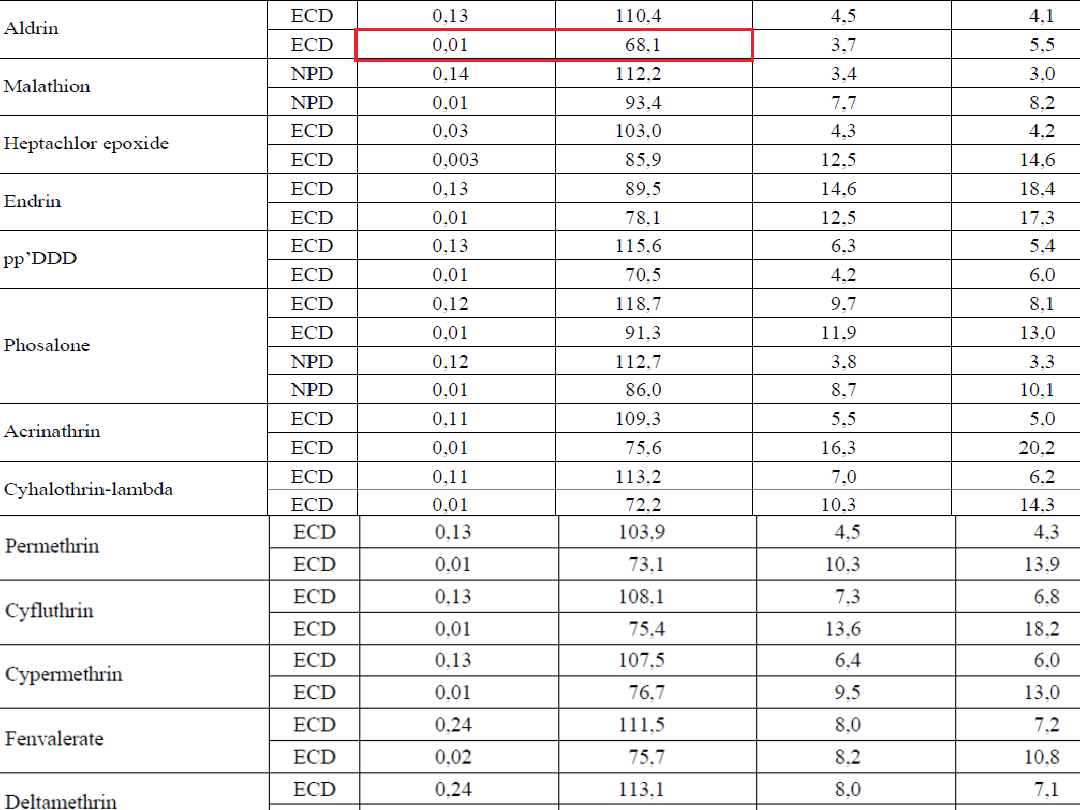
WYNIKI
• Wg. europejskiego przewodnika
SANCO, średni odzysk pestycydów-
70–120%, a powtarzalność ≤ 20%
Tab.1. Odzyski otrzymane przy użyciu metody
QuEChERS.

PODSUMOWANIE
• Wykorzystana metoda pozwala oznaczyć
pozostałości wielu pestycydów w jednym
procesie analitycznym.
• Umożliwia skrócenie czasu przygotowania
próbki oraz przebadania większej ich liczby.
• W celu osiągnięcia niższych granic
oznaczalności konieczne byłoby
zastosowanie chromatografii gazowej w
połączeniu ze spektrometrią masową MS-
MS.

BIBLIOGRAFIA
• Artykuł :„Wykorzystanie metody QuEChERS
w analizie pozostałości środków ochrony
roślin w miodzie”; autorzy: M. Grzegorzak,
E. Szpyrka, M. Słowik‐Borowiec, A.Kurdziel,
A.Matyaszek, J.Rupar
•
http://www.pzwl.pl/PDF/977_375.pdf
•
http://www.rybynapolskimrynku.pl/2010/1
0/pestycydy-chloro-organiczne-%CF%83hch
-hcb-%CF%83ddt/
•
http://www.pedagogiczna.edu.pl/warsztat/
2006/3-4/060315.htm
•
http://ec.europa.eu/food/food/biosafety/hy
gienelegislation/guidance_doc_haccp_pl.pdf
Document Outline
- Slide 1
- ŚRODKI OCHRONY ROŚLIN
- PODZIAŁ ZE WG. NA BUDOWĘ CHEMICZNĄ
- PESTYCYDY CHLOROORGANICZNE
- PESTYCYDY FOSFOROORGANICZNE
- PYRETROIDY
- METODA QuEChERS (Quick Easy Cheap Effective Rugged and Safe)
- CEL BADAŃ
- BADANIA
- I. PRZYGOTOWANIE PRÓBEK
- II. OZNACZANIE NA CHROMATOGRAFIE GAZOWYM
- WARUNKI ANALIZY INSTRUMENTALNEJ
- WYNIKI
- Slide 14
- PODSUMOWANIE
- BIBLIOGRAFIA
Wyszukiwarka
Podobne podstrony:
instrukcja bhp przy obsludze opryskiwacza chemicznych srodkow ochrony roslin
BHP magazyn nawozów środków ochrony roślin, instrukcje BHP
zużycie środków ochrony roślin
Magazynowanie środków ochrony roślin
Rejestr środków ochrony roslin
instrukcja bhp przy uzytkowaniu srodkow ochrony indywidualnej oraz obuwia i odziezy roboczej
TECHNIKA OCHRONY ROŚLIN
metody2, Ogrodnictwo UP Lbn, Ochrona roślin. Metody i środki
Bezkolizyjność stosowania środków ochrony indywidualnej
Chemiczne środki ochrony roślin, Ogrodnictwo UP Wrocław, semestr V, Ochrona roślin - środki ochrony
Fungicydy miedzowe, rolnicze, Środki Ochrony Roślin, fungicydy
TOR cw2 - dr Pusz, metody i srodki ochrony roślin, pusz
więcej podobnych podstron