
Różnice między hyrolazami
i hydroksylazami oraz
oksydazami i
oksygenazami.
Michał Butenko
Gr. 5
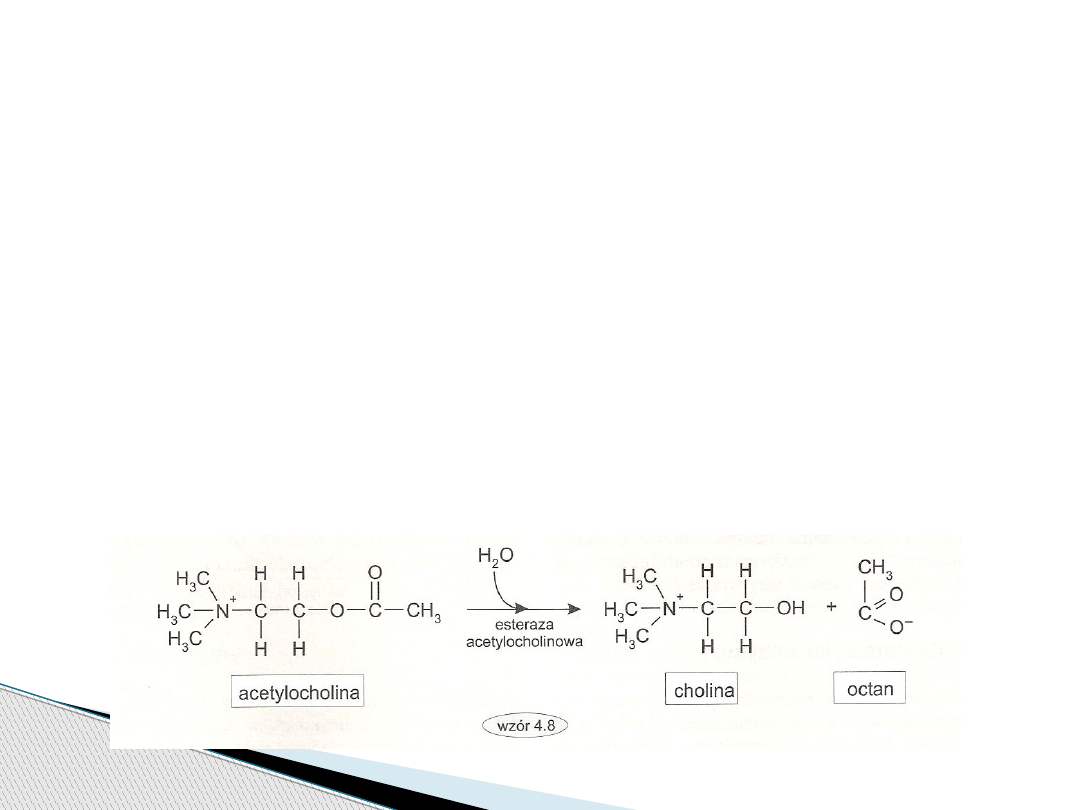
Klasa enzymów katalizująca hydrolizę wiązań:
estrowych, eterowych, peptydowych,
glikozylowych, wiązań C-N różnych od
peptydowych, bezwodników kwasowych, wiązania
C-C, wiązania P-N, halogenków. Reakcja hydrolizy
tych wiązań polega na przeniesieniu grup
funkcyjnych i cząsteczki donora do cząsteczki
akceptora, którym jest woda.
Hydrolazy

Wyróżniamy:
EC 3 HYDROLAZY
EC 3.1. Esterazy - Działają na wiązania estrowe
EC 3.2. Glukozylazy - Hydrolizują związki glikozydowe
EC 3.3. Hydrolazy działające na wiązania eterowe
EC 3.4. Peptydazy - działają na wiązania peptydowe
EC 3.5. Hydrolazy działające na wiązanie C-N, ale różniące się
od peptydowych
EC 3.6. Enzymy działające na bezwodniki kwasowe
EC 3.7. Hydrolazy działające na wiązanie C-C
EC 3.8. Enzymy działające na wiązanie halogenkowe
(halogenkowo-alkilowe)
EC 3.9. Hydrolazy działające na wiązanie P-N
EC 3.10. Enzymy działające na wiązanie S-N
EC 3.11. Hydrolazy działające na wiązanie C-P
EC 3.12. Enzymy działające na wiązanie S-S
EC 3.13. Hydrolazy działające na wiązanie C-S
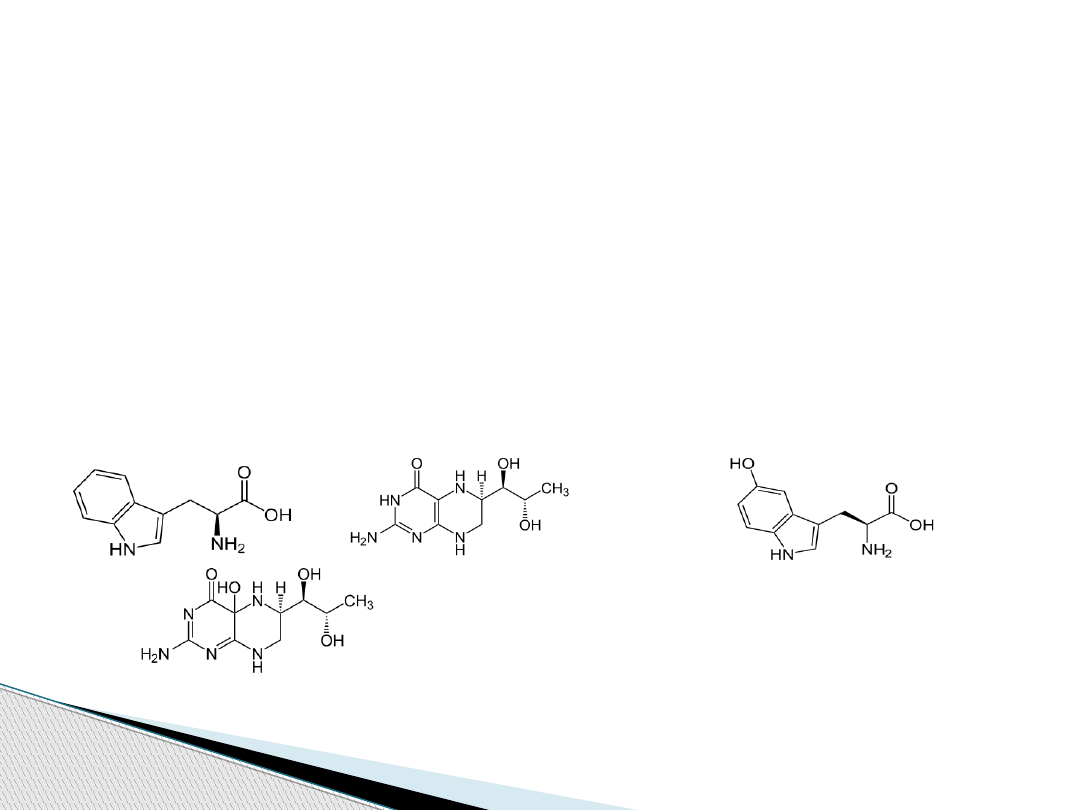
Są to oksydazy o funkcji mieszanej
monooksygenazy. Katalizują przyłączenie do
substratu grupy hydroksylowej –OH.
Katalizują reakcje utleniania i redukcji.
L-tryptofan + tetrahydrobiopteryna + O
2
⇌ 5-Hydroksytryptofan + Hydroksytetrahydrobiopteryna
+ + O
2
⇌ +
+
Hydroksylazy

Enzymy z klasy oksydoreduktaz. Tlen
cząsteczkowy zostaje zaktywowany przez
przeniesienie na niego elektronów, przez co
może się on łączyć z protonami tworząc
cząsteczkę wody, rzadziej nadtlenku wodoru
(oksydazy flawinowe).
(1)
C
6
H
12
O
6
+ O
2
+ H
2
O → C
6
H
12
O
7
+ H
2
O
2
(2)
H
2
O
2
+ 2 I
−
+ 2 H
+
→ I
2
+ 2 H
2
O
Oksydazy

Wyróżnia się:
oksydazy pierwszego zespołu - produktem
jest woda (np. oksydaza cytochromowa
posiada grupę prostetyczną w postaci
dwóch grup hemowych)
oksydazy drugiego zespołu - produktem jest
nadtlenek wodoru (np. oksydaza
ksantynowa - posiada koenzym w formie
FAD lub FMN)
oksydaza monoaminowa (MAO)
oksydaza diaminowa (DAO)

Katalizują reakcje włączania tlenu
cząsteczkowego do jednego substratu,
którym jest związek organiczny.
Oksygenaza hemowa HO-1:
Hem b + 3O
2
+ 3½NADPH + 3½H
+
+ 7e
-
→
biliwerdyna + Fe
2+
+ CO + 3½NADP
+
+
3H
2
O
Oksygenazy

Wyróżnia się oksygenazy właściwe, tj.:
dioksygenazy-włączają dwa atomy tlenu do
substratu;
◦
dioksygenazy wymagające udziału NAD(P)H,
katalizujące reakcje hydroksylacji substratu;
◦
dioksygenazy nie wymagające udziału NAD(P)H,
katalizujące rozerwanie pierścienia;
monooksygenazy-katalizują włączenie
jednego atomu tlenu do hydroksylowanego
substratu, podczas gdy drugi atom tlenu
wiązany jest w cząsteczkę wody z udziałem
NAD(P)H, np. 3-monooksygenaza
kinureninowa.
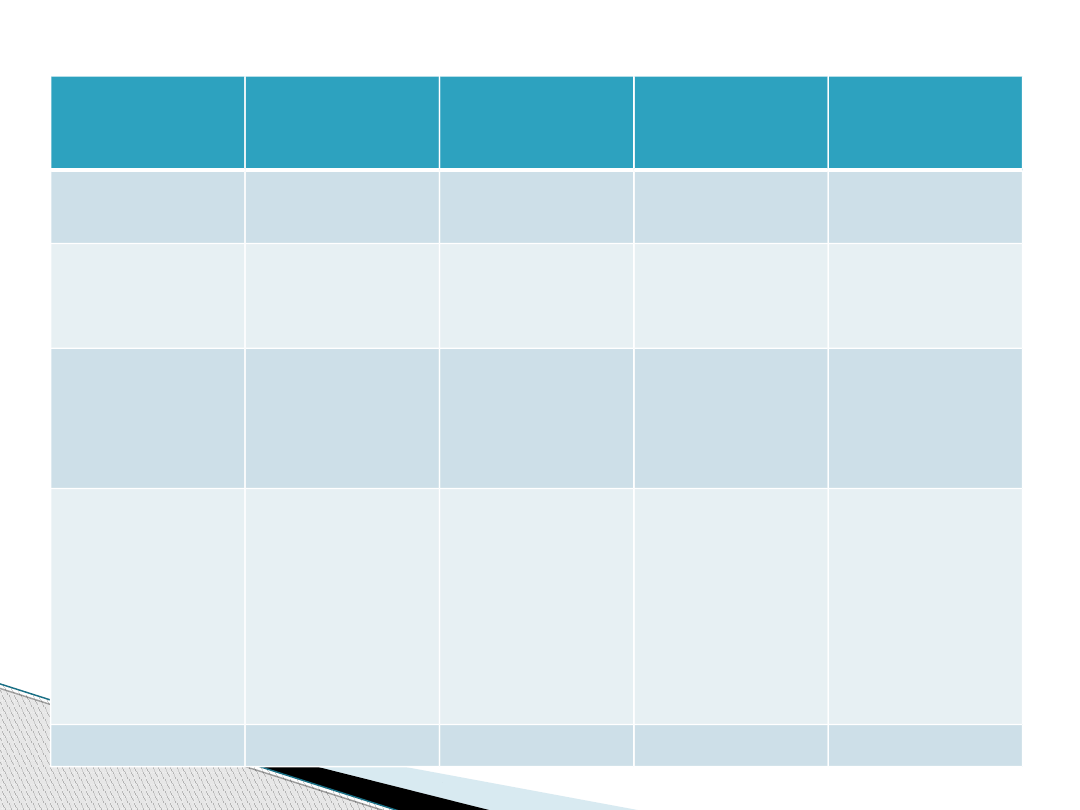
Cecha
porównawcz
a
Hydrolazy
Hydroksylaz
y
Oksydazy
Oksygenaz
y
Klasa
enzymów
EC 3
EC 1
EC 1
EC 1
Typ
katalizowan
ej reakcji
Hydroliza
Utlenianie i
redukcja
Utlenianie i
redukcja
Utlenianie i
redukcja
Substrat
Rozpada się
pod
wpływem
H
2
O
Równoczesne
utlenienie
dwóch
odrębnych
substratów
Redukcja
substratu
Związek
organiczny
reagujący z
O
2
Produkty
Powstałe po
rozpadzie
substratu
Jeden atom
tlenu włączony
do substratu, a
drugi z
atomami
wodoru
drugiego
substratu
tworzy H
2
O
H
2
O lub H
2
O
2
Utleniony
związek
organiczny
Koenzymy
Brak
Obecne
Obecne
Obecne

Koniec
Document Outline
Wyszukiwarka
Podobne podstrony:
Różnice między hydrolazą, a hydroksylazą
Roznice miedzy?daniami PISA, PIRLS ORAZ TIMSS
24 RÓŻNICE MIĘDZY KOBIETĄ A MĘŻCZYZNĄ
różnice między public relations a reklamą (2 str), Marketing
48 Na czym polega różnica między zmiennymi Lagrangea i zmiennymi Eulera
2 Różnice między odruchem warunkowym i bezwarunkowym
Różnice między dominatem a pryncypatem
Różnica między folią wstępnego krycia a wiatroizolacj
Dodatek F Różnice między C a C++
Roznica miedzy erytrocytem a epikulocytem
Różnica między naukami przyrodniczymi a humanistycznymi
RÓŻNICA MIĘDZY CYTAT A CYTOWANIE
różnice między eubacteria i eucarya, Studia, V rok, V rok, IX semestr, Biologia molekularna
różnice między podstawowymi kategoriami produktu i hodu n, Ekonomia, ekonomia
Różnice między temperamentem a osobowością, PSYCHOLOGIA, Psychologia socjologia
06d.Różnice między prewencją i promocją, Zdrowie publiczne, W. Leśnikowska - Ścigalska - ĆWICZENIA I
public relations, różnice między public relations a reklamą (2 str), Katarzyna Radwańska Gr
Mechanika płynów - do egzaminu, 1) Różnice między zjawiskami podobnymi i analogicznymi
więcej podobnych podstron