Metabolizm lipidów cz.1
Katarzyna Wargacka

Spis treści
1.
Ketogeneza i metabolizm związków
ketonowych w warunkach prawidłowych
oraz w warunkach głodzenia.
2.
Czynniki regulujące ketogenezę.
3.
Efekty energetyczne spalania związków
ketonowych, kwasów tłuszczowych i
triacylogliceroli
4.
Transport triacylogliceroli, kwasów
tłuszczowych i ciał ketonowych we krwi.

Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.
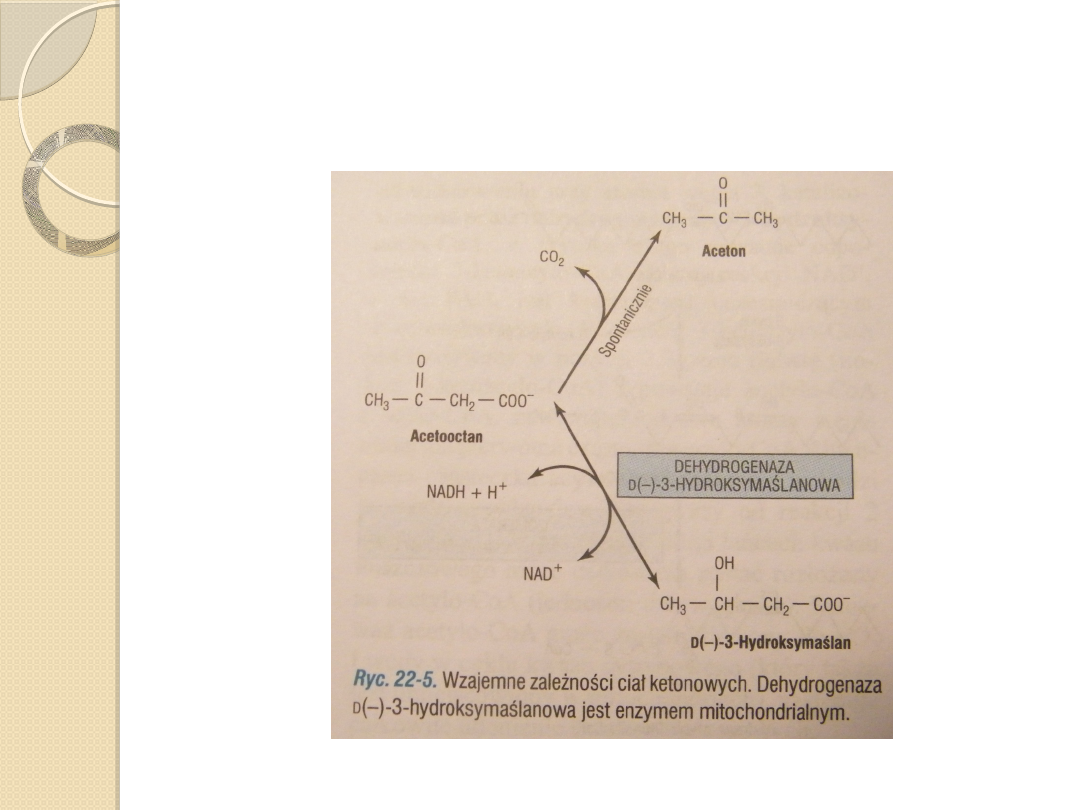
Ketogeneza zachodzi, gdy
intensywność utleniania kwasów
tłuszczowych w wątrobie jest duża.
◦
Wątroba wytwarza znaczne ilośći
acetooctanu i D(-)-3-
hudroksymaślanu. Acetooctan ulega
ciągłej, samoisntej dekarboksylacji do
acetonu.
◦
Te 3 substancje są znane pod nazwą
ciała ketonowe.
Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.
Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.

Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.
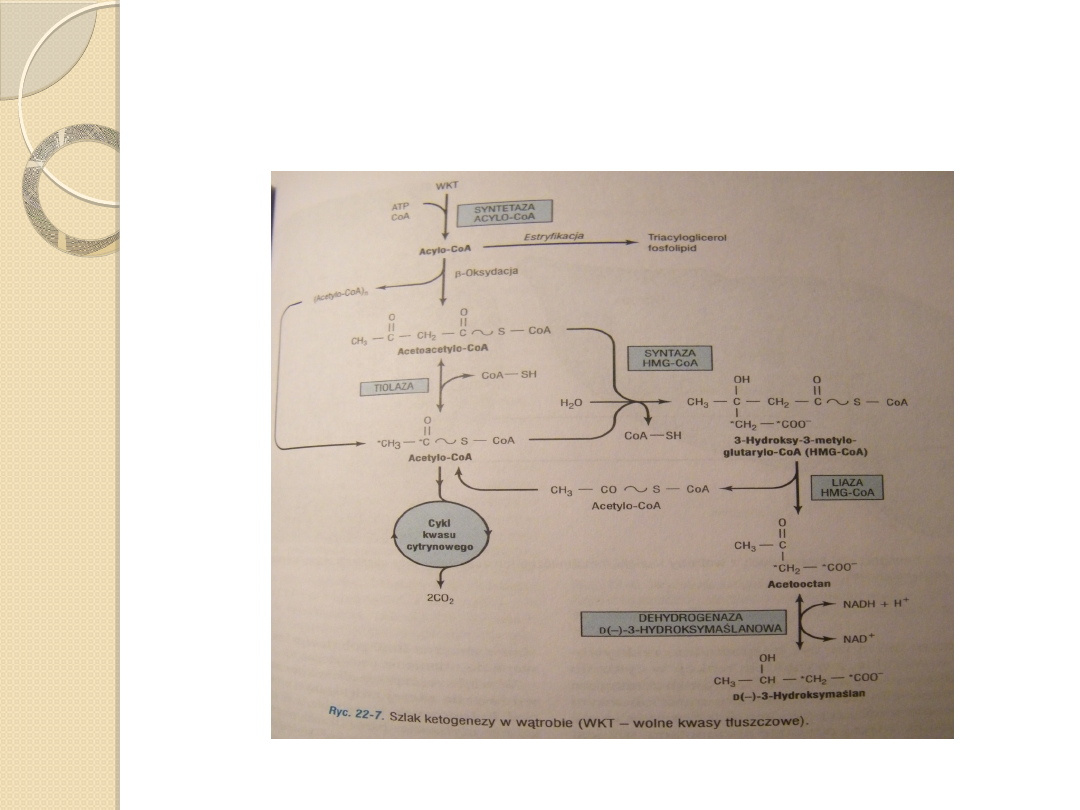
Acetoacetylo-CoA jest materiałem wyjściowym dla ketogenezy,
powstaje on z:
◦
2 cząsteczek acetylo-CoA wytwarzanych podczas beta –
oksydacji katalizowanych przez tiolazę,
◦
Końcwych 4 atomów węgla kwasu tłuszcowego w czasie beta-
oksydacji.
Kondensacja z kolejną cząsteczką acetylo-CoA i powstanie 3-
hydroksy-3-metyloglutarylo-CoA (HMG-CoA) katalizowana przez
syntazę 3-hydroksy-3-metyloglutarylo-CoA .
Enzym liaza 3-hydroksy-3-metyloglutarylo-CoA katalizuje
odszczepienie acetylo-CoA od HMG-CoA , pozostawiając wolny
acetooctan.
Obydwa enzymy muszą być obecne w mitochondriach, aby
ketogeneza mogła zachodzić. Jest to możliwe jedynie w wątrobie i
nabłonku żołądka żwacza.
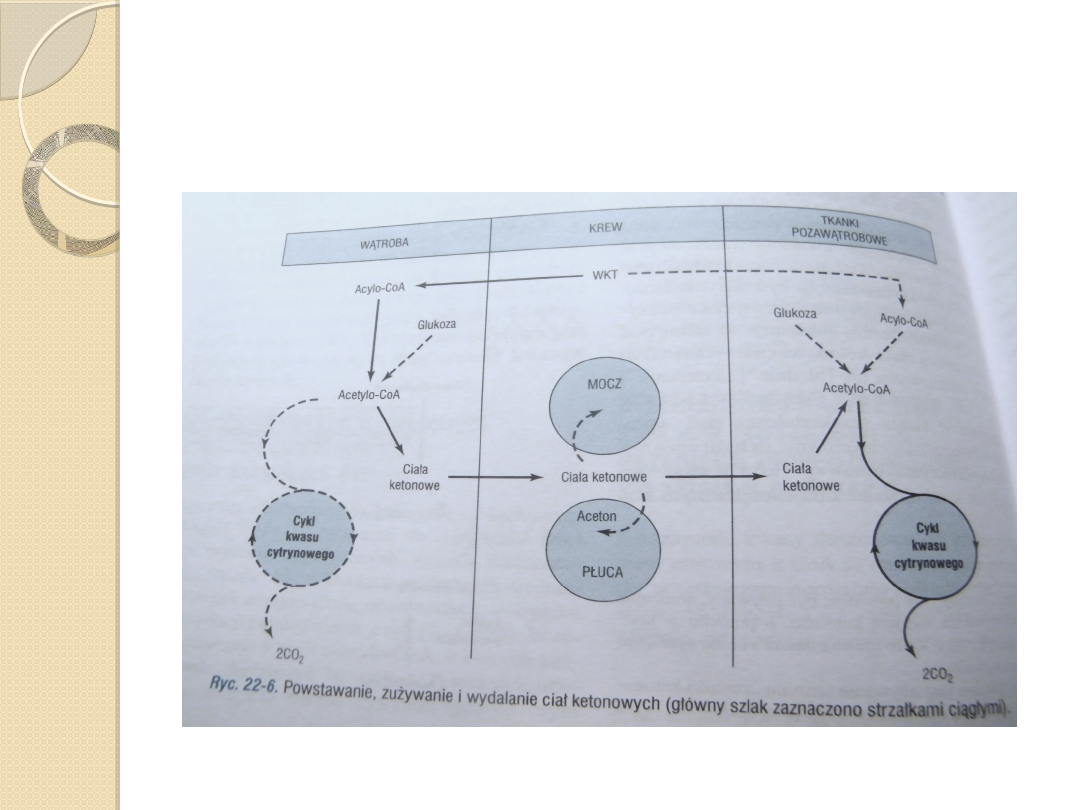
Ciałem ketonowym ilościowo dominującym we krwi i moczu w
stanie ketonemii jest D(-)-3-hydroksymaślan.
Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.

Czynniki regulujące ketogenezę.
Ketogeneza jest regulowana na 3
głównych etapach:
1.
Kontroli uwalnia wolnych kwasów
tłuszczowych z adipocytów,
2.
Aktywności palmitoilotransferazy karnitynowej
I w wątrobie, która warunkuje proporcję
dopływających wolnych kwasów tłuszczowych,
przeznaczonych do utleniania, a nie do
estryfikacji,
3.
Rozdziału acetylo-CoA między szlak
ketogenezy a cykl kwasu cytrynowego.
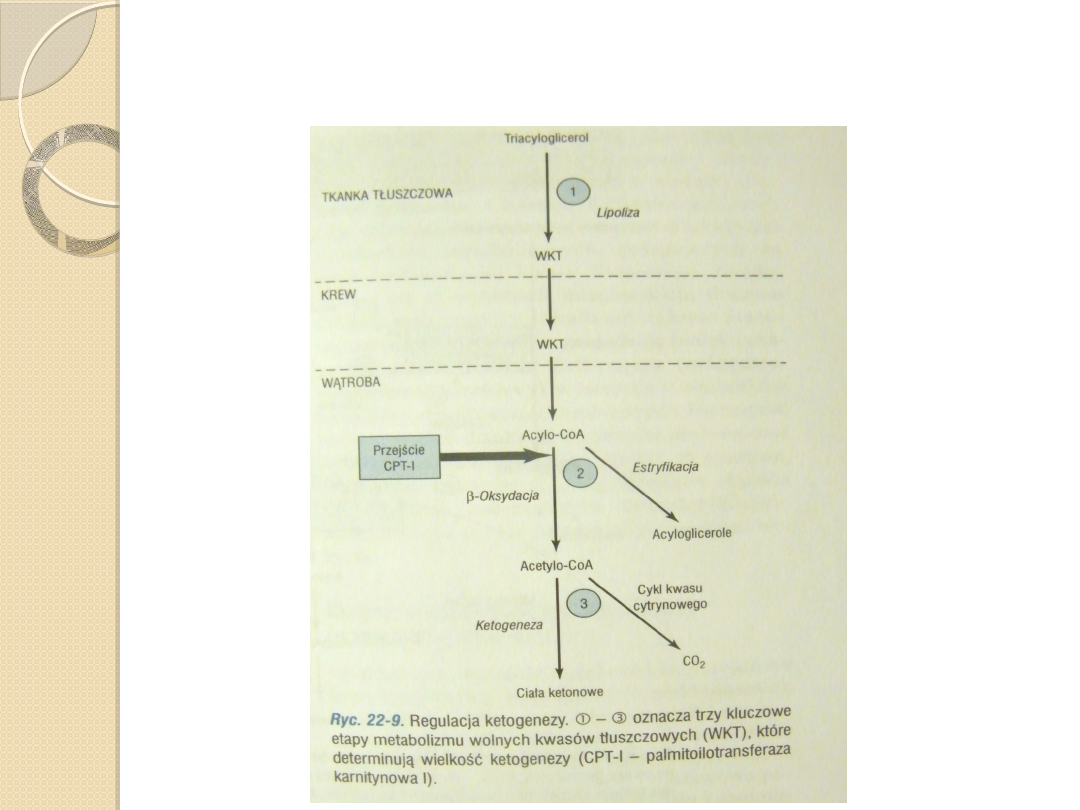
Czynniki regulujące ketogenezę.

Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.
Głodowanie
◦
U niektórych ludzi, którzy spożywają w ciągu doby
mniej aniżeli 500 kalorii przez wiele dni może
wystąpić umiarkowana kwasica ketonowa.
◦
Jakkolwiek zdrowe osoby mogą być zdolne do
adaptacji przedłużonego głodu, poprzez zwiększenie
przemian powstających ciał ketonowych przez
mięśnie i mózg oraz dzięki zdolności wydalania
anionów amonowych przez nerki.
◦
Stężenie ciał ketonowych w surowicy krwi wynosi od
0,5 do 2,0 mmol/l.
◦
Po 30 dniach głodu stwierdzono, że ciała ketonowe
dostarczają 60 % energii do ośrodkowego układu
nerwowego.
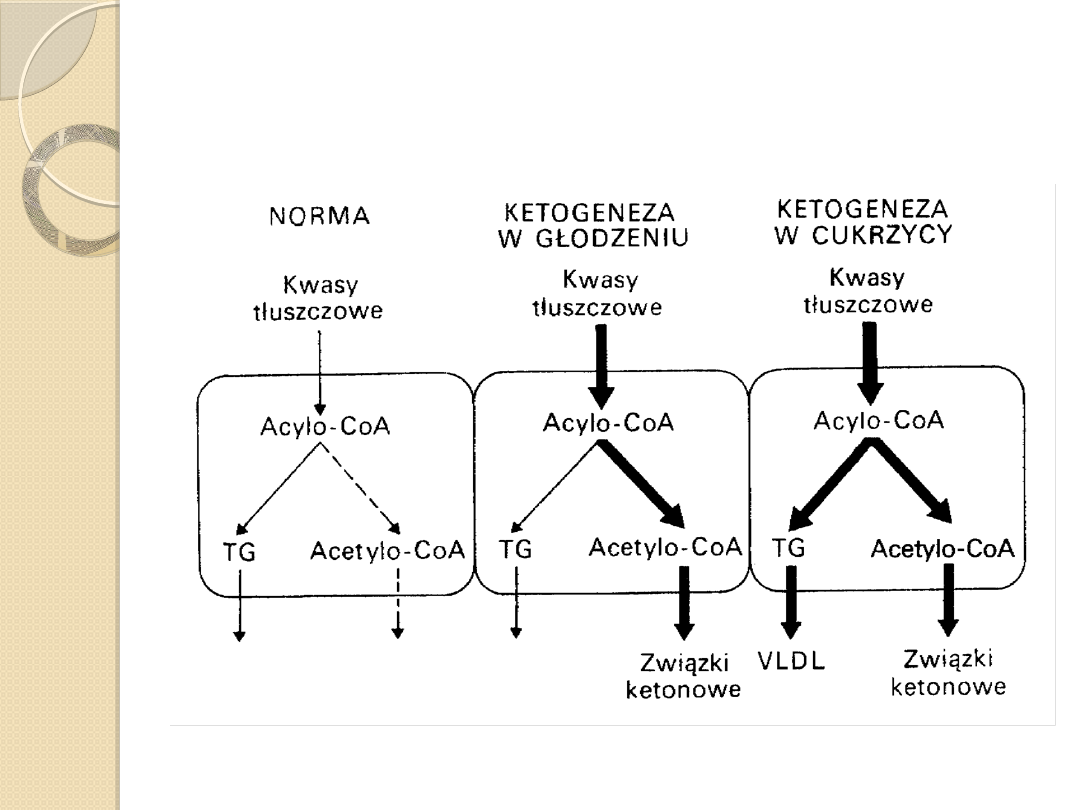
Ketogeneza i metabolizm związków ketonowych w
warunkach prawidłowych oraz w warunkach głodzenia.

Efekty energetyczne spalania związków ketonowych,
kwasów tłuszczowych i triacylogliceroli
Podstawowym substancją paliwową o charakterze tłuszczowym są triglicerydy.
Składają się one z glicerolu oraz 3 cząsteczek kwasów tłuszczowych. Spalanie
tłuszczów to przede wszystkim zachodząca w mitochondriach -oksydacja kwasów
tłuszczowych.
W pierwszym etapie cząsteczka ta jest rozkładana na glicerol oraz kwasy tłuszczowe.
Glicerol następnie wchodzi w szlak glikolizy, kwasy tłuszczowe natomiast podlegają
cięciu w procesie beta-oksydacji na kawałki dwuwęglowe, czyli acetylo-CoA, co ma
miejsce w mitochondriach. Acetylo-CoA jest następnie spalany w cyklu Krebsa.
Pierwszy etap spalania cząsteczki triglicerydu zachodzi w większości o dziwo w tkance
tłuszczowej. Dotyczy to zarówno triglicerydów krążących we krwi, jak i tych
uwalnianych z tkanki tłuszczowej. Polega on na rozkładzie cząsteczki na glicerol i 3
kwasy tłuszczowe. Kwasy tłuszczowe dostają się do krwi, skąd są pobierane przez
tkanki celem spalenia.
Zakładając, że cząsteczka glicerolu zostałaby całkowicie spalona, podsumowanie
wszystkich pośrednich reakcji (zamiana na pirogronian, acetylo-CoA i spalenie w cyklu
Krebsa) będzie wyglądać następująco:
C
3
H
8
O
3
(glicerol) + 3½ O
2
+ 22 P + 22 ADP 3 CO
2
+ 4 H
2
O + 22 ATP
W przeliczeniu na gramy natomiast – ze 100g glicerolu uzyskać można ok. 24
mole ATP. Jest to wartość porównywalna z glukozą (21 moli/100g).

Efekty energetyczne spalania związków ketonowych,
kwasów tłuszczowych i triacylogliceroli
Zaktywowany kwas tłuszczowy, czyli acylo-CoA jest już w mitochondrium. Tutaj następuje jego
ostateczne spalanie. Ogólnie, w procesie spalania wyróżnić można 2 etapy. Pierwszy – to
cięcie kwasu tłuszczowego na fragmenty dwuwęglowe, czyli cząsteczki acetylo-CoA. Drugi – to
spalanie acetylo-CoA w cyklu Krebsa.
Cięcie na fragmenty dwuwęglowe polega na kolejnym odłączaniu od końca karboksylowego
cząsteczek acetylo-CoA.
W jednym etapie odłączania acetylo-CoA uzyskujemy więc 1 FADH
2
oraz 1 NADH
2
. Ponieważ
utlenienie FADH
2
daje 2 cząsteczki ATP, a NADH
2
– 3 ATP, utlenienie tego wodoru daje łącznie
5 cząsteczek ATP.
Przeprowadźmy teraz obliczenia bilansu energetycznego spalania 1 cząsteczki kwasu
palmitynowego, podstawowego – 16-węglowego kwasu tłuszczowego.
◦
Zostaje wykonanych 7 cięć, w wyniku których powstaje 8 cząsteczek acetylo-CoA.
◦
Każde cięcie dostarcza 5 ATP, a każdy acetylo-CoA daje w cyklu Krebsa 12 ATP. Odjąć trzeba jeszcze 2
cząsteczki zużyte na pierwszą reakcję aktywacji kwasu tłuszczowego.
◦
Ostateczny bilans więc to 75 + 812 – 2 = 129 cząsteczek ATP. W przeliczeniu na gramy, ze 100g
kwasu palmitynowego można uzyskać 50.4 mole ATP. Jest to wartość ok. 2.5x większa niż dla
glukozy.
W przypadku nienasyconych kwasów tłuszczowych istnieją specjalne mechanizmy, które
umożliwiają ominięcie podwójnego wiązania w trakcie cięcia na acetylo-CoA. Aby nie wdawać
się w nadmierne szczegóły, wystarczy powiedzieć, że każde podwójne wiązanie w cząsteczce
kwasu tłuszczowego to 3 cząsteczki ATP mniej w łącznym bilansie. Wiązania podwójne nie
obniżają więc znacząco kaloryczności tłuszczów.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
Najważniejsze związki tłuszczowe, które są
transportowane przez krew to trójglicerydy,
fosfolipidy, cholesterol wolny, cholesterol
zestryfikowany oraz wolne kwasy
tłuszczowe. Związki te nie są rozpuszczalne w
wodzie, dlatego transportowane są w postaci
maluteńkich kropelek tłuszczu, w połączeniu ze
specjalnymi białkami transportującymi. Białka te
nazywamy apolipoproteinami.
W zależności od rodzaju białka transportującego i
składu lipidów wyróżniamy kilka frakcji
lipidowych we krwi. Są to chylomikrony, VLDL,
LDL, HDL, IDL i remnanty chylomikronów.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
Chylomikrony
Jest to frakcja, która powstaje w jelicie. Podstawowym białkiem nośnikowym
tej frakcji jest apolipoproteina o nazwie apoB-48. Są to największe cząstki
spośród wszystkich wymienionych frakcji.Jej główna funkcja to transport
paliwa czyli trójglicerydów z jelita do tkanek obwodowych.
Składają się one też prawie wyłącznie z triglicerydów. Proces tworzenia się
takiej cząstki jest dość długi, gdyż spożyty tłuszcz musi zostać najpierw
rozłożony w jelicie do glicerolu i kwasów tłuszczowych, przetransportowany
do komórki śródbłonka jelitowego, w nim z powrotem złożony jest trigliceryd,
cząsteczki triglicerydu zostają spakowane do cząstki chylomikronu, ta
następnie jest wydalona na zewnątrz komórki.
Chylomikrony dostają się do krwi przez przewód chłonny, czyli z
pominięciem wątroby. Czas życia takiej cząstki jest bardzo krótki, bo ok.
½–1 godziny. W tym czasie przekazuje ona paliwo do tkanek organizmu. Gdy
większość zapasu triglicerydu zostanie już przekazana do tkanek, cząstka
chylomikronu zmniejsza swój rozmiar ponad 2–krotnie (czyli objętość
zmniejsza 8–krotnie) i nazywa się wtedy remnantem chylomikronu.
Remnanty chylomikronów są w całości wychwytywane przez wątrobę, gdzie
pozostałe ilości trójglicerydów, fosfolipidów i cholesterolu są rozpakowywane.
Ich dalszy los zależy od potrzeb organizmu.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
VLDL
Ta frakcja jest wytwarzana przez wątrobę i jest analogiczna do
chylomikronów powstających w jelicie. Transportuje ona
triglicerydy i cholesterol z wątroby do tkanek obwodowych.
Podstawowym białkiem nośnikowym jest apoB-100. Triglicerydy,
które są transportowane przez tę frakcję pochodzą w dużej
mierze ze zjedzonych białek i węglowodanów, które wątroba
przerabia na triglicerydy. Część składu pochodzi jednak też z
tego, co zostało wchłonięte do wątroby z innych cząstek
lipidowych (remnanty chylomikronów, LDL).
Rozmiar cząstki to 30–90nm - w zależności od ilości
zapakowanych triglicerydów. Zapakowanych jest tu też trochę
cholesterolu i fosfolipidów, które mają być przetransportowane
do tkanek. Po przetransportowaniu triglicerydów do tkanek
cząstka ta zamienia się na IDL, ta następnie po odłączeniu
apolipoprotein apoC i apoE zamienia się w LDL.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
LDL
LDL jest cząstką, która powstała z VLDL. Średnica tej cząstki to ok. 20-
25nm. Zawiera w sobie ok.: 20% białka, 50% cholesterolu, 20%
fosfolipidów, 10% triglicerydów. LDL, jako pozostałość po transporcie
triglicerydów z wątroby do tkanek jest usuwana z krwi. Średni czas
półtrwania we krwi wynosi ok. 2 dni. W ok. 70% cząstki te są usuwane
przez wątrobę, a w ok. 30% przez tkanki pozawątrobowe. Podział ten jest
do pewnego stopnia zmienny w zależności od potrzeb organizmu.
Owe 30% to forma dostarczania do komórek pozawątrobowych
fosfolipidów i cholesterolu, które są dostępne w organizmie i nie ma
potrzeby syntetyzowania ich na miejscu. Synteza cholesterolu, jest
procesem dość energożernym, stąd organizm gospodaruje nim w sposób
jak najbardziej oszczędny. Odkładanie go w ścianach tętnic można w
pewnym sensie traktować również przez pryzmat oszczędzania go „na
czarną godzinę”, tak by w razie głodu było go skąd czerpać.
Organizm może się oczyścić z miażdżycy. Wymaga to jednak z reguły
zdecydowanej zmiany dotychczasowych nawyków żywieniowych, w
szczególności ograniczenia węglowodanów, uzupełnienia niedoboru
minerałów, antyoksydantów i nienasyconych kwasów tłuszczowych.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
HDL
Jest to frakcja, która jest produkowana przez wątrobę i jelito. Jej główną
lipoproteiną jest apoA-I. Spełnia ona dwa główne zadania.
Pierwsze to transport cholesterolu z tkanek obwodowych i innych frakcji
lipidowych osocza (VLDL, chylomikrony), do wątroby. Jest to jakby taki woreczek,
który po wyprodukowaniu jest pusty, następnie krąży po organizmie i zbiera
cholesterol, po napełnieniu się wyrzuca ten cholesterol do komórek wątrobowych
i wraca pusty do obiegu. W końcu jest usuwany w całości przez wątrobę.
Druga ważna rola tych cząstek to przechowywanie zapasu apolipoprotein apoA,
apoC i apoE. Są to pomocnicze białka odgrywające ważną rolę w procesach
przekazywania triglicerydów i fosfolipidów do tkanek, przenoszenia cholesterolu,
oraz wychwytywania poszczególnych frakcji przez wątrobę. Jest ich kilka
podtypów.
Chylomikrony i VLDL wyprodukowane w jelitach i wątrobie nie posiadają na swej
powierzchni wszystkich tych białek. Są one przenoszone z HDL dopiero po
przedostaniu się do krwi. Białka te są przenoszone z powrotem na HDL z
remnantów chylomikronów i LDL przed ich usunięciem z krwi przez wątrobę.
Zważywszy, że frakcja ta przechowuje ważne dla procesów transportu lipidów
apolipoproteiny, jej wysoki poziom jest korzystny dla organizmu, gdyż umożliwia
sprawne procesy transportu lipidów w innych frakcjach. Nic dziwnego, że jest
ona ujemnie skorelowana z miażdżycą.

Transport triacylogliceroli, kwasów tłuszczowych i ciał
ketonowych we krwi.
Wolne kwasy tłuszczowe
Mówiąc o transporcie tłuszczów we krwi nie można pominąć roli
wolnych kwasów tłuszczowych (WKT). Dotychczas w uproszczeniu
pisałam, że triglicerydy z chylomikronów i VLDL są transportowane
do tkanek obwodowych.
W rzeczywistości wygląda to tak, że na zewnętrznych
powierzchniach komórek większości tkanek obwodowych znajdują
się cząsteczki enzymu lipazy lipoproteinowej. Jest to białko, do
którego przyłączają się cząstki chylomikronów i VLDL. W trakcie
takiego przyłączenia dochodzi do rozłożenia zawartych w tych
cząstkach triglicerydów na glicerol i wolne kwasy tłuszczowe.
Glicerol dostaje się do krwi, a następnie wnika do komórek, które
posiadają enzym kinazę glicerolowi umożliwiającą mu wejście w
szlak glikolizy.
Kwasy tłuszczowe w większości są od razu transportowane do
wnętrza komórki, część jednak pozostaje we krwi i dociera do
innych tkanek, które zużytkowują je jako paliwo. We krwi
transportowane są przez albuminę.

Document Outline
- Slide 1
- Spis treści
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Czynniki regulujące ketogenezę.
- Czynniki regulujące ketogenezę.
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
METABOLIZM LIPIDOW cz II RM
METABOLIZM LIPIDÓW cz I wykład RM
METABOLIZM LIPIDÓW cz I RM
Metabolizm lipidów (1)
IV metabolizm lipidow i sterydow
METABOLIZM LIPIDOW
Metabolizm lipidów 3
Metabolizm lipidów
Metabolizm lipidów w komórkach nowotworowych
Metabolizm lipidów
metabolizm lipidów
Metabolizm lipidów (1)
Wykład 9 Oznaczenia lipidów cz 2
Wykład 8 Oznaczenia lipidów cz 1
więcej podobnych podstron