
BIAŁKA UCZESTNICZĄCE W
SKURCZU MIĘŚNI
Tomasz Mulewski
DO BIAŁEK BIORĄCYCH UDZIAŁ W
SKURCZU MIĘŚNI NALEŻĄ:
Miozyna
Aktyna
Tropomiozyna
Troponina
Dystrofina
α-aktynina
Tytyna
Nebulina
Desmina
Kalcyneuryna
Kalponina

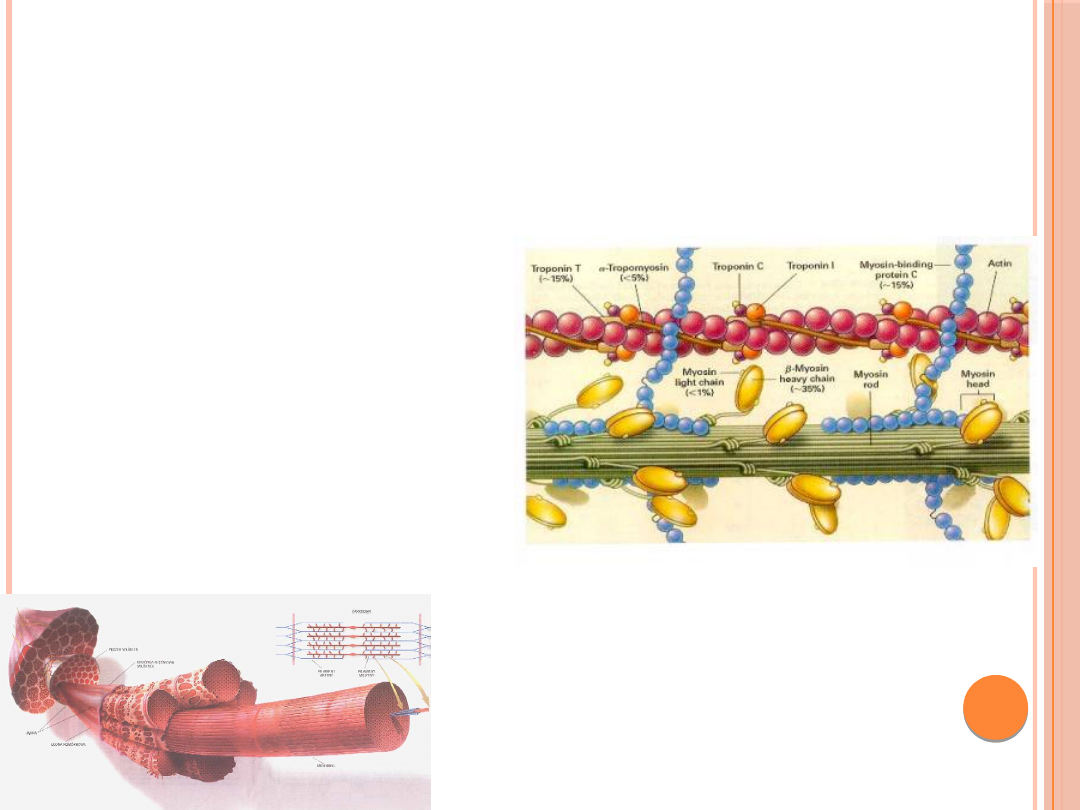
MIOZYNA
Miozyna to białko o masie 480kDa. Składa się z
dwóch łańcuchów ciężkich i dwóch par łańcuchów
lekkich. N-końcowe części ciężkich łańcuchów
zwinięte są w globularne „główki”, a u ich
podstawy zlokalizowane są po dwa lekkie
łańcuchy. Lekkie łańcuchy różnią się między sobą,
jeden z nich jest nazywamy łańcuchem
podstawowym, a drugi regulatorowym. Ciężkie
łańcuchy owijają się wokół siebie, tworząc długą
superhelisę. Dzięki pałeczkom cząsteczki miozyny
mogą agregować, tworząc grube filamenty.
To właśnie za pomocą główek następuje
wiązanie i hydroliza ATP, oraz wiązanie głównego
białka cienkich filamentów - aktyny.

W Globularnej głowie miozyny znajdują się
dwa miejsca aktywne: jedno słuzy do
enzymatycznego rozpadu ATP i w pobliżu
niego drugie którym cząsteczka miozyny
zaczepia się o aktynę. Te dwa miejsca
aktywne nie są identyczne.
Tworzy filament gruby
Stanowi 55% bialek mięśnia
Enzym ATP-aza
ATP ADP + energia
Reakcja katalizowana jest przez miozynę
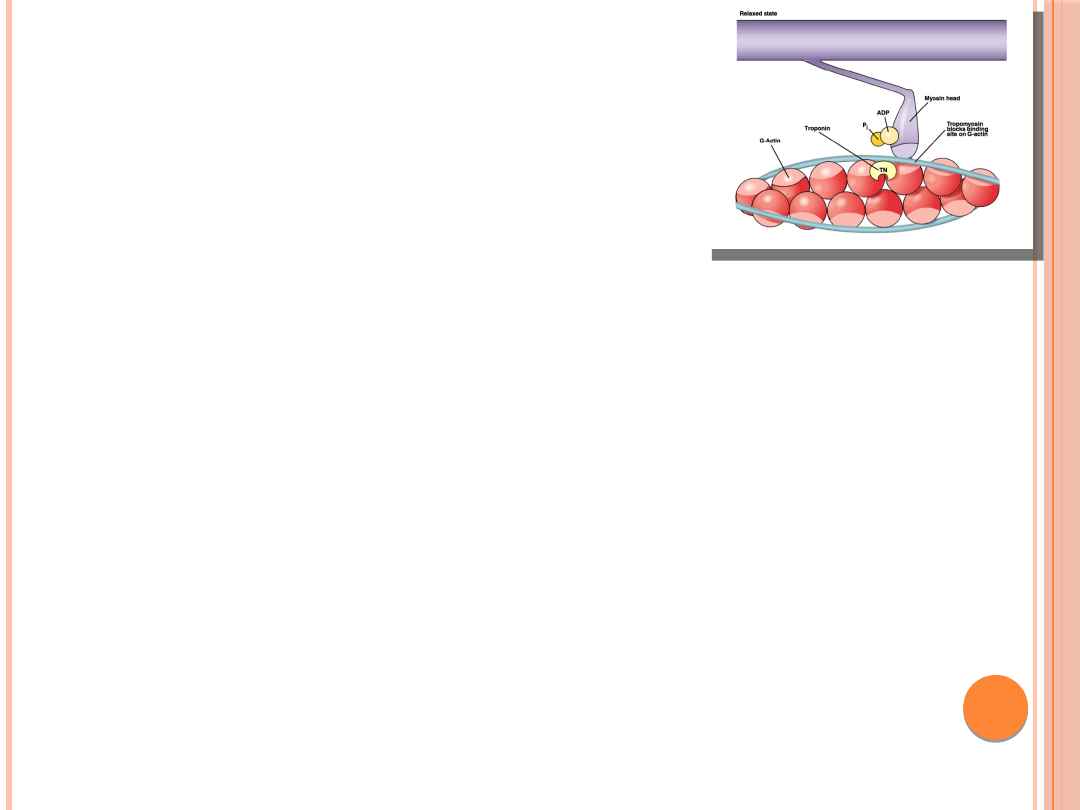
MECHANIZM GENERACJI
SIŁY W KOMÓRCE
MIĘŚNIOWEJ
Cykliczne zmiany konformacji
mostków równocześnie z etapami hydrolizy
ATP
1-wiązanie ATP przez miozynę- odłączenie
główek od filamentu aktynowego
2-hydroliza nukleotydu-zmiana kąta
nachylenia główki wobec długiej osi
filamentu
3-przyłączenie główek do aktyny- uwolnienie
ortofosforanu i ADP
4-powrót główek połączonych z aktyną do
poprzedniego stanu-zmiana kąta nachylenia
główek-przesunięcie filamentu aktynowego
przez główkę miozyny

Łańcuch ciężki pod wpływem enzymów
proteolitycznych dzieli się na dwie
podjednostki:
Meromiozynę lekką (wydłużona cz. Cząsteczki)
Meromiozynę ciężką (złożona z głowy oraz nitkowatej
podjednostki, której podłożem jest aktyna)
-Podjednostka S1
-Podjednostka S2

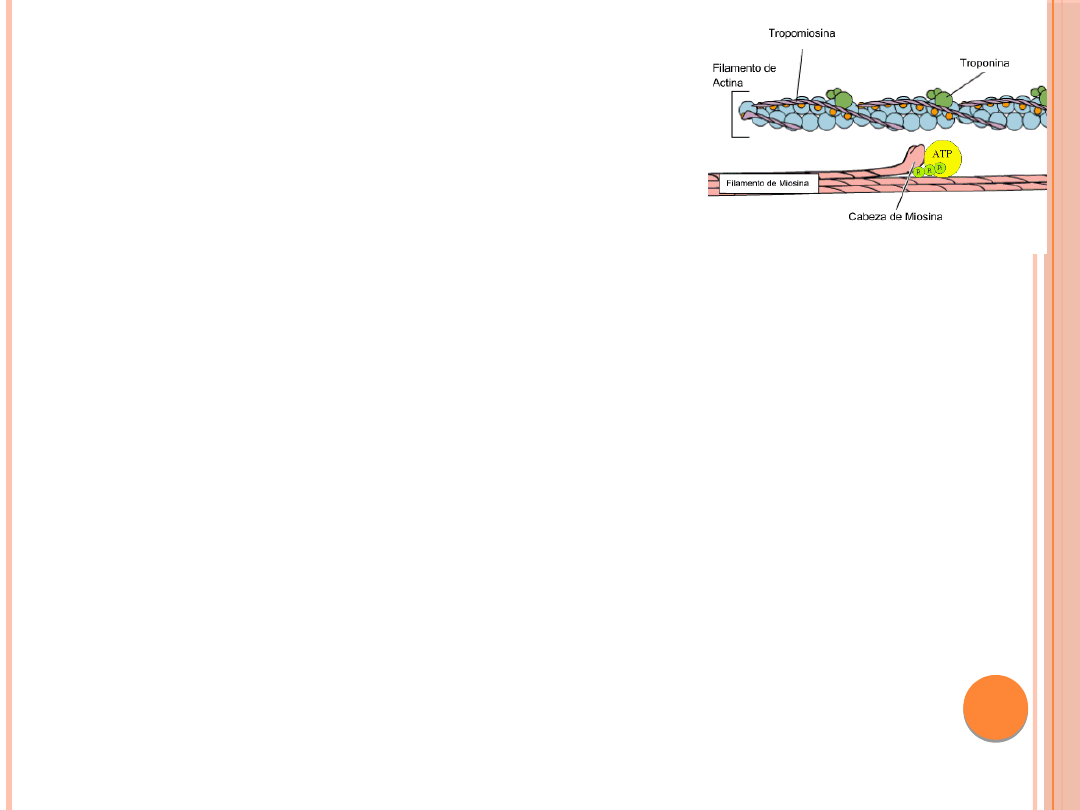
AKTYNA
Aktyna – jest to białko kurczliwe mięśni,
wchodzące w skład filamentów cienkich,
stanowiące 25% masy białek mięśnia.
Występuje w dwóch formach - globularnej
(zbliżonej do kulistego) jako aktyna G i
fibrylarnej (włókienkowej) jako aktyna F.
Cienki filament zawiera 1 cząsteczkę
tropomiozyny i 1 troponiny na każde 7
monomerów aktyny

Aktyna G jest ATPazą
enzym i składa się z dwóch części, między
którymi znajduje się szczelina wiążąca ATP (lub
ADP). ATP jest źródłem energii a reagując z
aktyną i miozyną powoduje skurcz mięśni Jest
monomeryczna i sferyczna zbudowana z
pojedynczego łańcucha polipeptydowego. Znane
są cztery odmiany aktyny G o stopniowo
zmniejszającym się ładunku ujemnym cząsteczki
α (w mięśniach szkieletowych i sercu) β i ζ
(mięśnie gładkie i komórki nie mięśniowe) i δ u
Acanthamoeba castellanii. Aktyna F tworzy nici o
średnicy 6-7 nm i jest głównym składnikiem
filamentów cienkich.

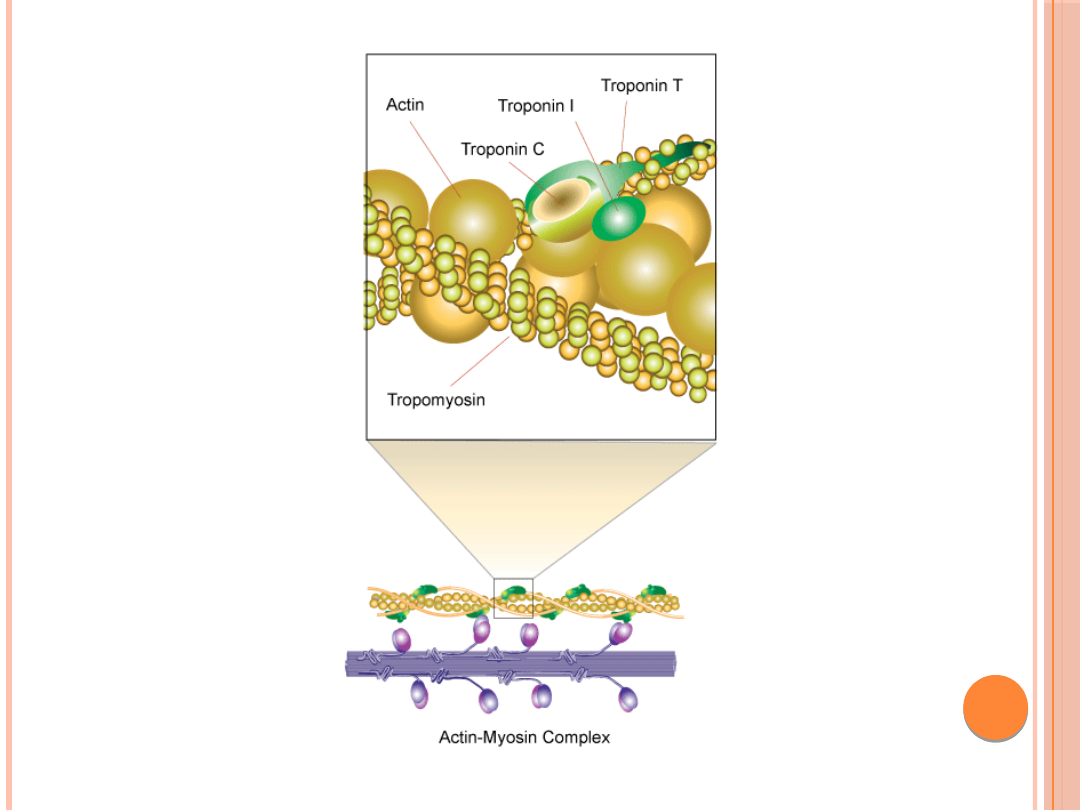
TROPOMIOZYNA
Tropomiozyna występuje we wszystkich
rodzajach mięśni jak również towarzyszy
aktynie w komórkach niemięśniowych.
Cząsteczka Tropomiozyny zbudowana jest
z dwóch łańcuchów polipeptydowych (284
aminokwasów) o strukturze alfa-helisy
skręconych w superhelisę. W mięśniach
poprzecznie prążkowanych występują dwie
izoformy alfa i beta, które tworzą homo(np.
alfa-alfa) i heterodimery. Proporcje izoform
zależą od rodzaju mięśnia .

Zawiera 7 grup Ala powodujących lokalne
zaburzenia symetrii klasycznej superhelisy i
jej nieznaczne odkształcenie – 7
potencjalnych miejsc wiązania aktyny. Udział
każdego z tych miejsc nie jest równocenny.
Cząsteczki Tm tworzą liniowe polimery dzięki
wiązaniom pomiędzy końcami N i C.

TROPONINA
Troponina jest kompleksem trzech
białek z których każde pełni specyficzną
rolę w regulacji skurczu mięśnia .
Troponina I hamuje ATPazę
aktomiozynową, troponina C wiąże jony
wapnia Ca
2+
, natomiast troponina T
łączy wszystkie składniki z
Tropomiozyną.
TROPONINA I
Cząsteczka zawiera 181 aminokwasów i
wiąże się bezpośrednio z aktyną.
W nieobecności innych składników
regulujących cząsteczka TnI związana z
aktyną hamuje aktywność ATP-azy
aktomiozynowej (in vitro).
TnI posiada 2 miejsca wiązania TnC.
Oprócz TnC i aktyny , TnI wiąże TnT.
Podstawowa rola TnI – utrzymywanie Tm na
powierzchni filamentu aktyny w tzw. „pozycji
blokującej” wiązanie główek miozyny w
nieobecności jonów Ca
2+
.

TROPONINA T
Największa podjednostka troponiny.
Podstawową funkcją jest wiązanie Tm
fragmentem N-końcowym TnT.
Innym fragmentem wiąże się z TnI.
TnT degraduje pod wpływem enzymów
tworząc 2 fragmenty: T1 i T2.
T2 tworzy trwały kompleks z TnI i TnC.
TROPONINA C
Odgrywa kluczową rolę w skurczu.
Posiada zdolność specyficznego wiązania
jonów wapnia.
W TnC występuje charakterystyczny motyw
helisa-pętla-helisa (EF-hand) – 2 motywy EF-
hand tworzą domenę strukturalną.
TnC zawiera 2 domeny:
C-końcowa – rola strukturalna
N-końcowa – odpowiada za regulację skurczu

Dystrofina - białko strukturalne komórki
mięśniowej łączące cytoszkielet (przez wiązanie się
z aktyną) z kompleksem glikoproteinowym
znajdującym się w błonie komórkowej (sarkolemie).
Obecność dystrofiny nie pozwala na rozpad tego
kompleksu, który stabilizuje błonę komórkową i
wpływa na jej przepuszczalność. Dystrofina składa
się z 3684 aminokwasów i ma masę 427 kDa.
Dystrofina kodowana jest przez położony na
chromosomie X największy ludzki gen ( 1,5%
długości chromosomu X, 0,1% ludzkiego genomu).
Składa się z 79 egzonów. Mutacje w tym genie
powodują dystrofię mięśniową Duchenne'a i
dystrofię mięśniową Beckera

α-aktynina- białko łączące kalcyneuryne z liniami Z
Tytyna -Konektyna (titina). Karboksylowy koniec jaj
łańcucha zakotwiczony jest w prążku M sarkomeru, a
koniec aminowy w prążku Z. Część łańcucha
przebiegająca w prążku A posiada okresowo
powtarzające się domeny wiążące się z meromiozyną.
Ta część łańcucha konektyny jest integralną częścią
grubej nitki miozyny stanowiąc dla niej matryce.
Część łańcucha przebiegająca przez prążek I leży
równolegle do nitek aktyny. W prążku I cząsteczki
tytyny przybierają kształt sprężyny i służa do
centrowania filamentów miozynowych w sarkomerze
oraz nadają mu sprężystość. Zostaje ściśnięta w
czasie skurczu i roprężona w czasie rozkurczu.

Nebulina- białko mięśniowe, ciągnące się od
linii Z, wzdłuż nitek aktyny, których
najprawdopodobniej określa długość. W
większej części jest ona zbudowana z
jednostek o 35 aminokwasach, które tworzą
domeny wiążące aktynę. Jest białkiem
fibrylarnym o długości równej dł. cienkiej
nitki sarkomeru, w którą jest wbudowana,
stanowiąc jej integralną część.
Utrzymuje ułożenie filamentów cienkich w
sarkomerze.

Desmina- położona wzdłuż nitek aktyny,
połączona jest z błoną plazmatyczną. Białko to
tworzy filamenty pośrednie typu III które łączą
ze sobą prążki Z sąsiednich miofibryli.
Kalcyneuryna- Jest to fosfataza regulowana
przez kalmodulinę. Odgrywa rolę w regulacji
liczby szybko i wolno kurczących się włókienek
mięśniowych. Białko tworzy heterodimery,
zbudowane z podjednostki katalitycznej
(kalcyneuryna A) i regulatorowej
(kalcyneuryna B). Podjednostka B
zawiera 4 miejsca wiążące jony
wapnia.

KALPONINA
Wykazuje właściwości podobne do kaldesmonu – wiąże aktynę,
tropomiozynę, kalmodulinę i miozynę.
Wykazuje zdolność oddziaływań z desminą, białkiem mięśniowych
filamentów pośrednich, obecnym w domenie cytoszkieletowej.
Wiązaniu takiemu towarzyszy tworzenie wiązek filamentów
desminowych.
Odziałuje również z mikrotubulami.
Brak ekspresji kalponiny powoduje znaczne obniżenie odporności
mechanicznej tkanek zawierających mięsnie gładkie, w tym
osłabia integralność ścian naczyń krwionośnych.
Zmiany stężenia jonów wapnia wpływają na zdolność kalponiny do
tworzenia wiązek filamentów aktynowych – przy wyższych
stężeniach zdolność ta jest znacznie osłabiona.

BIBLIOGRAFIA
Biochemia, Jeremy M. Berg, John L.
Tymoczko, Lubert Stryer, wydawnictwo
naukowe PWN Warszawa 2005
Biochemia Harpera, Franciszek Kokot,
Aleksander Koj, Andrzej Kozik, Tadeusz
Wilczok, Wydawnictwo lekarski PZWL
warszawa 2008
Fizjologia człowieka t.I, Stanisław Konturek,
Tomasz Brzozowski, Kraków 2003
Histologia , Wojciech Sawicki, Wydawnictwo
Lekarski PZWL, Warszawa 2003
Źródła internetowe
Document Outline
- Slide 1
- Do białek biorących udział w skurczu mięśni należą:
- Miozyna
- Slide 4
- Mechanizm generacji siły w komórce mięśniowej
- Slide 6
- aktyna
- Slide 8
- Tropomiozyna
- Slide 10
- Troponina
- Troponina I
- Troponina T
- Slide 14
- Troponina C
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- kalponina
- bibliografia
Wyszukiwarka
Podobne podstrony:
Białka biorące udział w skurczu mięśnia
1 Rodzaje pracy fizjologia skurczu mięśnia
Energetyka skurczu miesnia i wy Nieznany
Energetyka skurczu mięśnia plan prezentacji
Kości tworzą układ dźwigni poruszających się w następstwie skurczów mięśni szkieletowych
Regulacja siły skurczu mięśnia
bioenergetyka skurczu mięśnia
Potencjał spoczynkowy i czynnościowy nerwu, rejestracja skurczów mięśni szkieletowych po pobudzeniu
Mechanizm skurczu mięśnia szkieletowego
rodzaje skurczów mięśniowych, Anatomia i fizjologia, anatomia
skurcz miesni, Biologia maturalna
7 Leki zwiększające siłę skurczu mięśnia sercowego1, 4farmacja, III koło
FIZJOLOGIA MIĘŚNIA SERCOWEGO – AKTYWNOŚĆ SKURCZOWA MIĘŚNIA SERCOWEGO - instrukcja, Medycyna i Zdrowi
krótkie wykłady kraba seby z fizjologi Mięśnie, skurcz mięśnia
Prawa skurczu mięśnia elktrodiagnostyka
Fizjologia mięśni, skurcz mięśniowy
więcej podobnych podstron