
Udział hemoglobiny w
transporcie tlenu i dwutlenku
węgla, zmiany konformacyjne
cząsteczki hemoglobiny
towarzysze jej utlenowaniu

Z definicji wysyceniem cząstkowym
nazywa się stosunek liczby miejsc
zawierających związany tlen do pełnej
liczby możliwych miejsc wiązania.
Może wahać się od 0 do 1.
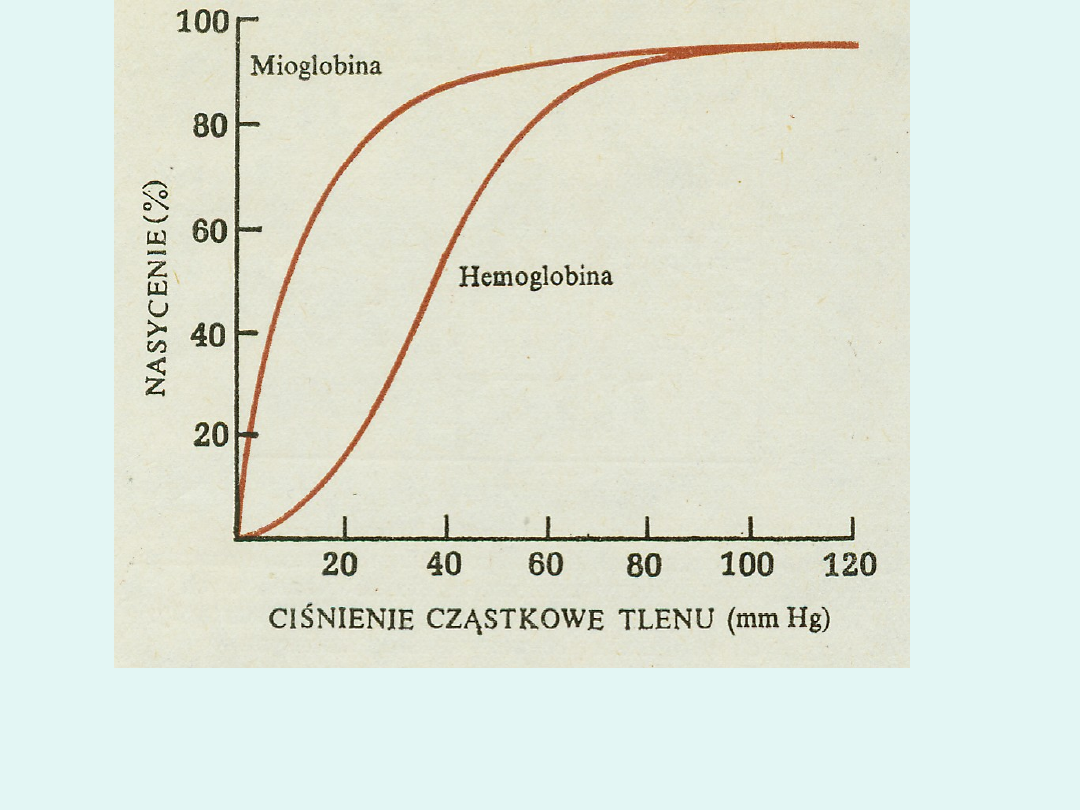
Wiązanie tlenu przez hemoglobinę oraz mioglobinę
. Krzywa uzyskana dla
hemoglobiny w erytrocytach kształtem przypomina literę „S”, co wskazuje,
że w każdej cząsteczce hemoglobiny znajdują się różne, ale oddziałujące na
siebie miejsca wiązania tlenu.

Związanie tlenu w jednym miejscu
cząsteczki hemoglobiny zwiększa
prawdopodobieństwo, że tlen zwiąże
się w pozostałych miejscach, dotąd
niezwiązanych.
I na odwrót, uwolnienie tlenu z
jednego hemu ułatwia uwolnienie
pozostałych cząsteczek tlenu.
Takie zachowanie białek wiążących
określane jest jako
kooperatywne
.

Jakie jest fizjologiczne znaczenie
kooperatywnego wiązania tlenu
przez hemoglobinę?
Hb w płucach
(
zajętych
98%
miejsc wiążących
)O
2
Hb w tkankach
(32%
miejsc
)
66% potencjalnych miejsc wiążących tlen bierze udział w transporcie tlenu
Mb w plucach (zajętych 98% miejsc wiążących) O
2
Mb w tkankach (91%
miejsc)
7% potencjalnych miejsc uczestniczyłoby w przenoszeniu tlenu
Białko niekooperatywne wykształcone na drodze ewolucji:
pO2=100 torów pO2=20 torów
63-25=38%
efektywność transportu Hb> białka>Mb
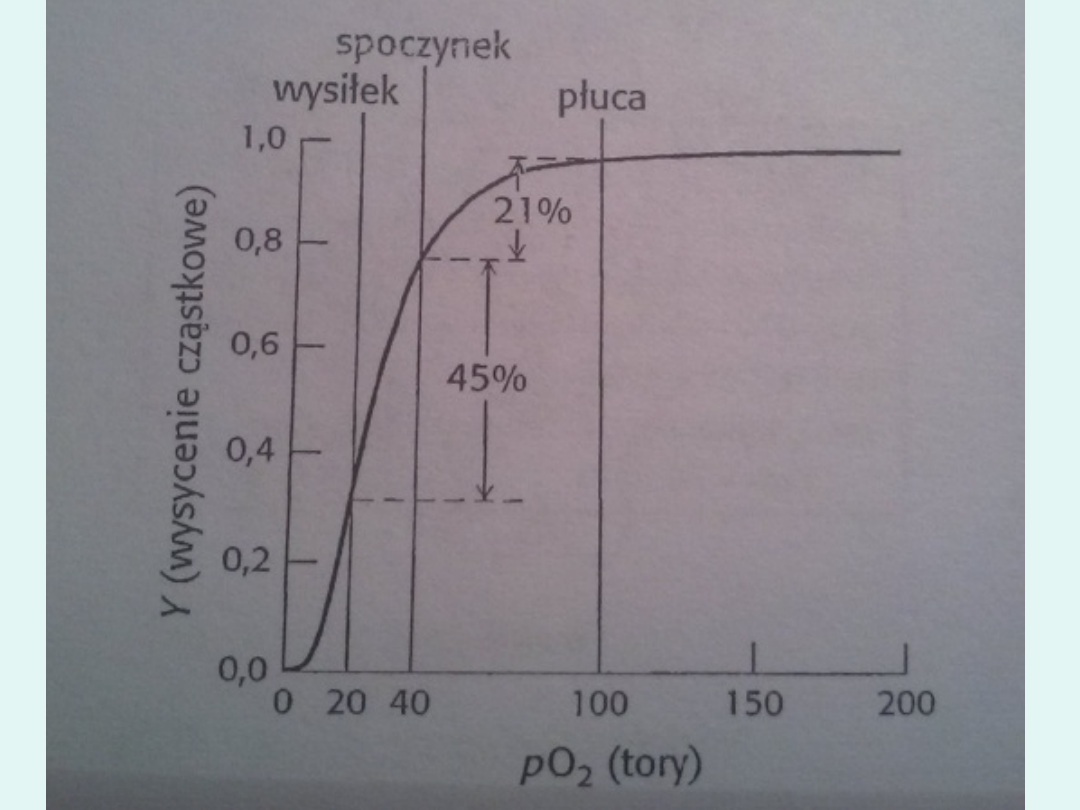
Rys 7.9 str 188

-stan T
(tense) „naprężony” – struktura
czwartorzędowa nieutlenowanej formy Hb (silne
oddziaływania między jednostkami)
-stan R
(relaxed) „rozluźniony” – forma w pełni
utlenowana
Podczas utlenowania jeden z dimerów αβ
przemieszcza się względem drugiego o 15 stopni.
Związanie tlenu w jednym miejscu hemoglobiny
zwiększa powinowactwo wiązania tlenu w innych
miejscach, uruchamiając przejście tetrameru ze
stanu T do stanu B.

Dwa modele graniczne
Model jednoprzejściowy
– model MWC
-cały układ może istnieć tylko w dwóch
formach: stanie T i stanie R
-związanie ligandów tylko przesuwa
równowagę między tymi dwoma
stanami
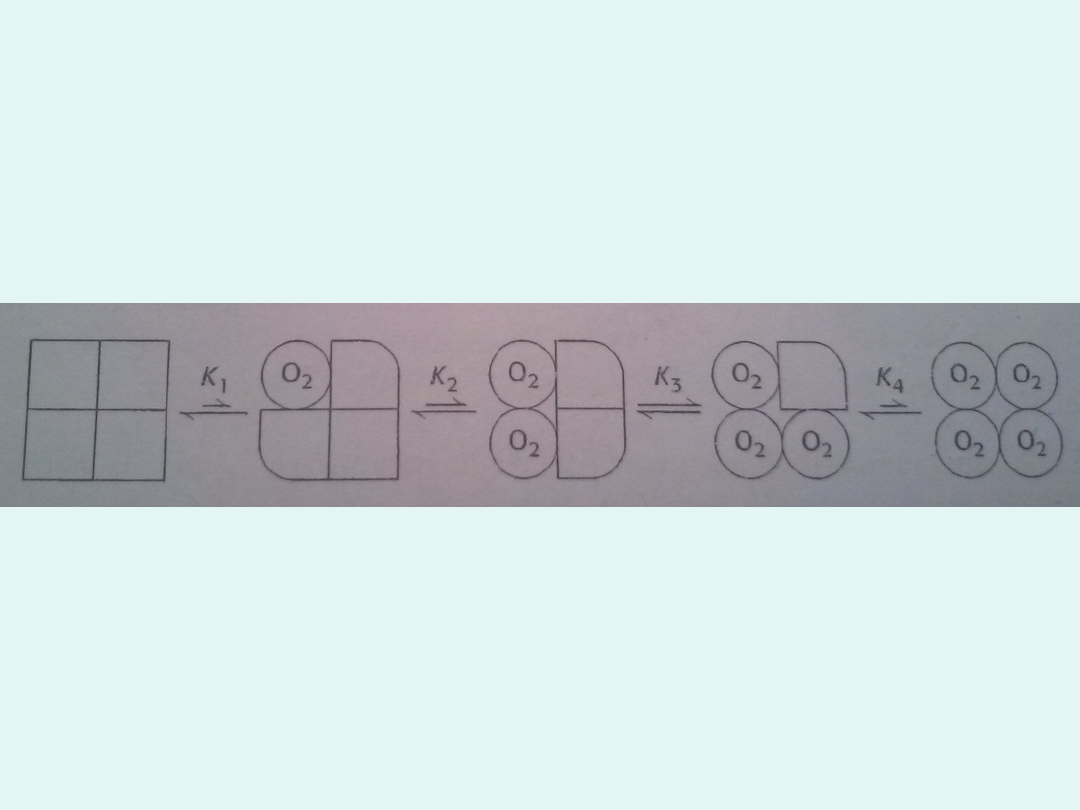
Model sekwencyjny
-związanie liganda do jednego miejsca w
układzie zwiększa powinowactwo związania w
miejscach sąsiednich bez uruchamiania
pełnego przekształcania stanu T w stan R
Oba modele obrazują wyidealizowane
przypadki graniczne, do których rzeczywiste
systemy mogą się zbliżać, ale które rzadko
osiągają.

Zmiany strukturalne w grupach hemowych
są przekazywane do strefy kontaktu między
dimerami α
1
β
1
-α
2
β
2
-związanie tlenu sprawia , że każdy atom Fe w Hb
przemieszcza się z zewnątrz do wnętrza pierścienia
porfirynowego
-wraz z jonem żelaza przemieszcza się reszta histydyny
-reszta histydyny jest częścią helisy α, która również
się przesuwa
-koniec karboksylowy tej helisy znajduje się w rejonie
kontaktu między dwoma dimerami αβ – zmiana jego
pozycji sprzyja przejściu z T do R.
Zmiany strukturalne w otoczeniu jonu żelaza w jednej
podjednostce są przekazywane bezpośrednio do innych
podjednostek.
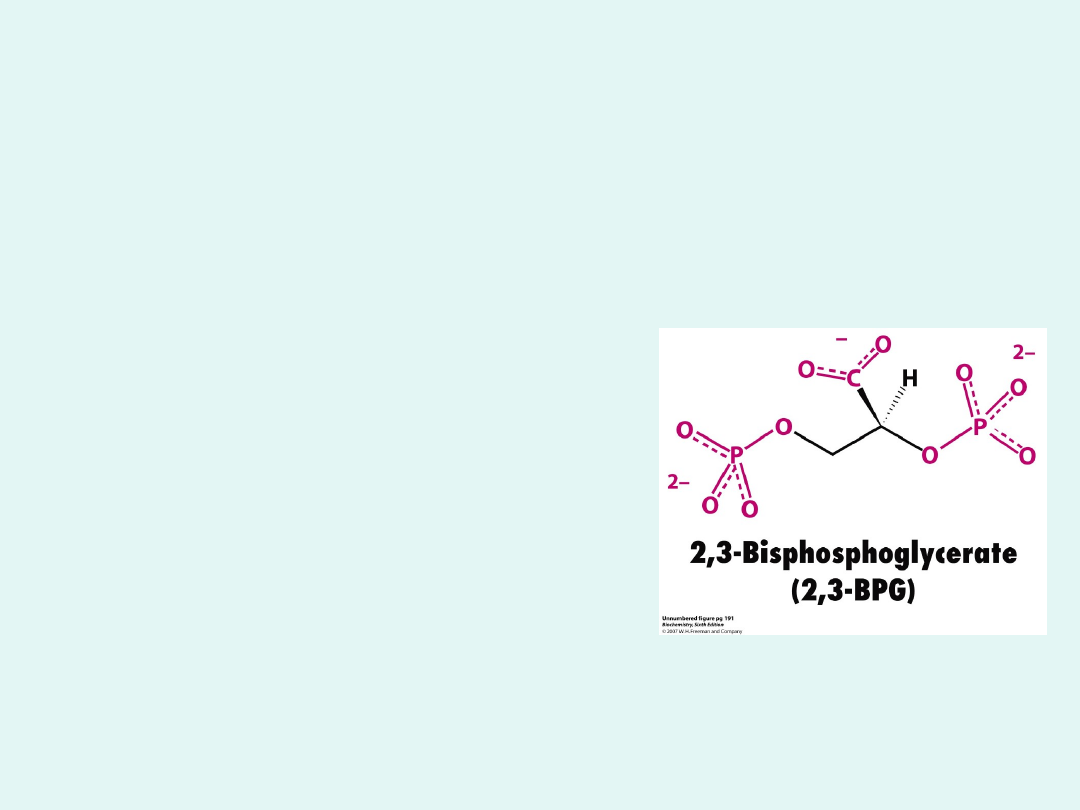
W erytrocytach 2,3-bisfosfoglicerynian jest
najważniejszym regulatorem
powinowactwa Hb do O
2
-występuje w erytrocytach w
stężeniu bliskim stężeniu Hb
-bez niego Hb uwalniałaby w
tkankach tylko 8% swojego
ładunku
-pojedyncza cząsteczka wiąże się
w centrum tetrameru Hb w
kieszeni obecnej tylko w formie T
-gdy Hb przechodzi z T R
kieszeń zapada się i 2,3-BPG jest
uwalniany

Warunkiem przejścia formy T w R jest
zerwanie wiązań między Hb a 2,3-BPG.
W obecności 2,3-BPG więcej miejsc
wiązania tlenu w tetramerze Hb musi
być zajętych, by zainicjować przejście
formy T w R.
W ten sposób Hb pozostaje w stanie T o
mniejszym powinowactwie tak długo,
dopóki nie wzrośnie stężenie tlenu

2,3-BPG w żaden sposób nie
przypomina tlenu jest więc określany
mianem
efektora allosterycznego
.
Regulacja działania przez cząsteczkę
niespokrewnioną strukturalnie z tlenem
jest możliwa dlatego, że efektor
allosteryczny wiąże się do miejsca
całkowicie odrębnego od miejsca
wiązania tlenu.

Konsekwencje fizjologiczne
występowania 2,3-BPG w Hb płodowej
-zastąpienie resztą seryny His143 w łańcuchu β ,
uczestniczącej w tworzeniu miejsca wiązania 2,3-BPG
-zmiana ta eliminuje z miejsca wiązania 2,3-BPG dwa
ładunki dodatnie (po jednym z każdego łańcucha) i
zmniejsza powinowactwo Hb płodowej do 2,3-BPG
-zatem powinowactwo Hb płodowej do tlenu jest
większe niż Hb matki, co pozwala skutecznie
przenosić tlen z erytrocytów matki do erytrocytów
płodu

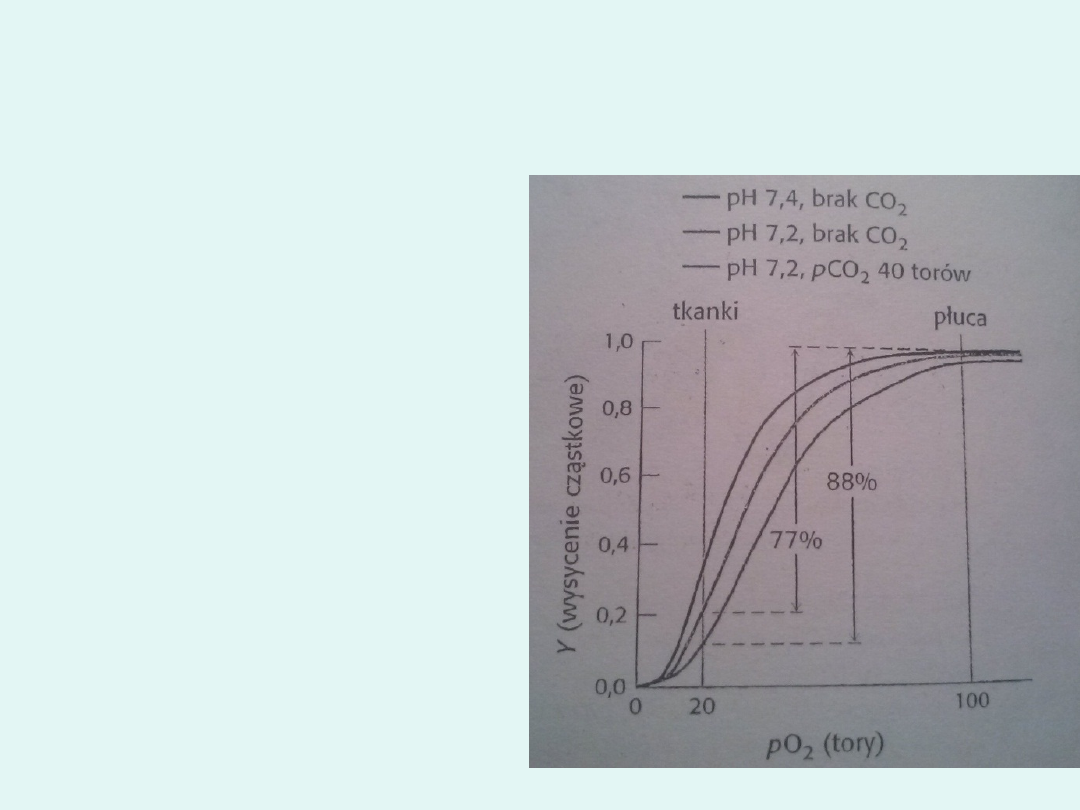
Efekt Bohra: protony i dwutlenek
węgla sprzyjają uwalnianiu tlenu
-CO
2
oraz H
+
są efektorami allosterycznymi Hb, które
wiążą się do miejsc w cząsteczce odrębnych od miejsc
wiązania tlenu
-powinowactwo Hb do tlenu zmniejsza się wraz z
obniżeniem pH poniżej 7,4 -np. transport z płuc, gdzie
pH wynosi 7,4, a ciśnienie cząstkowe tlenu – 100 torów,
do aktywnego mieśnia o pH 7,2 , i ciśnieniu
cząstkowym tlenu 20 torów, powoduje uwolnienie ilości
tlenu stanowiącej 77% całkowitej pojemności
przenośnikowej. Bez zmiany pH uwolnieniu uległoby
tylko 66% tlenu.

-w wywoływaniu pH biorą udział dwa zestawy grup
chemicznych: grupy α-aminowe z końca aminowego
łańcuchów α oraz reszty histydyny β146 i α122
-histydyna β146 jest resztą ulokowaną na końcu C łańcucha
β. W deoksyhemoglobinie wolna grupa karboksylowa His
146 tworzy wiązanie jonowe z resztą lizyny podjednostki α
wchodzącej w skład drugiego dimeru αβ. Oddziaływanie to
unieruchamia łańcuch boczny histydyny β146 w pozycji, w
której może on tworzyć wiązanie jonowe z ujemnie
naładowanym asparaginianem 94 w tym samym łańcuchu,
pod warunkiem, że grupa imidazolowa tej reszty histydyny
jest uprotonowana.
Inne reszty również tworzą wiązanie w formie T. Formowanie
tych wiązań jonowych stabilizuje stan T, zwiększając w ten
sposób skłonność hemoglobiny do uwalniania tlenu.

-CO
2
przenika przez błony komórkowe
erytrocytów do wnętrza komórek
2 mechanizmy stymulacji uwalniania tlenu
przez dwutlenek węgla:
1.przy wysokich stężeniach CO
2
dochodzi
do ↓ pH w erytrocytach
-CO
2
reaguje z wodą H
2
CO
3
– reakcję
przyspiesza anhydraza węglanowa
-po utworzeniu dysocjuje na jon
wodorowęglanowy co prowadzi do ↓ pH
-stabilizuje on stan T Hb zgodnie z
mechanizmem omówionych wcześniej
2.Zakłada się stymulację uwalniania tlenu
przez bezpośrednie oddziaływania chemiczne
między CO
2
i Hb
W obecności dwutlenku węgla
w stężeniu odpowiadającym
ciśnieniu cząstkowemu rzędu
40 torów w pH 7,2,
ilość uwalnianego tlenu sięga
90% maksymalnej zdolności
transportowej.
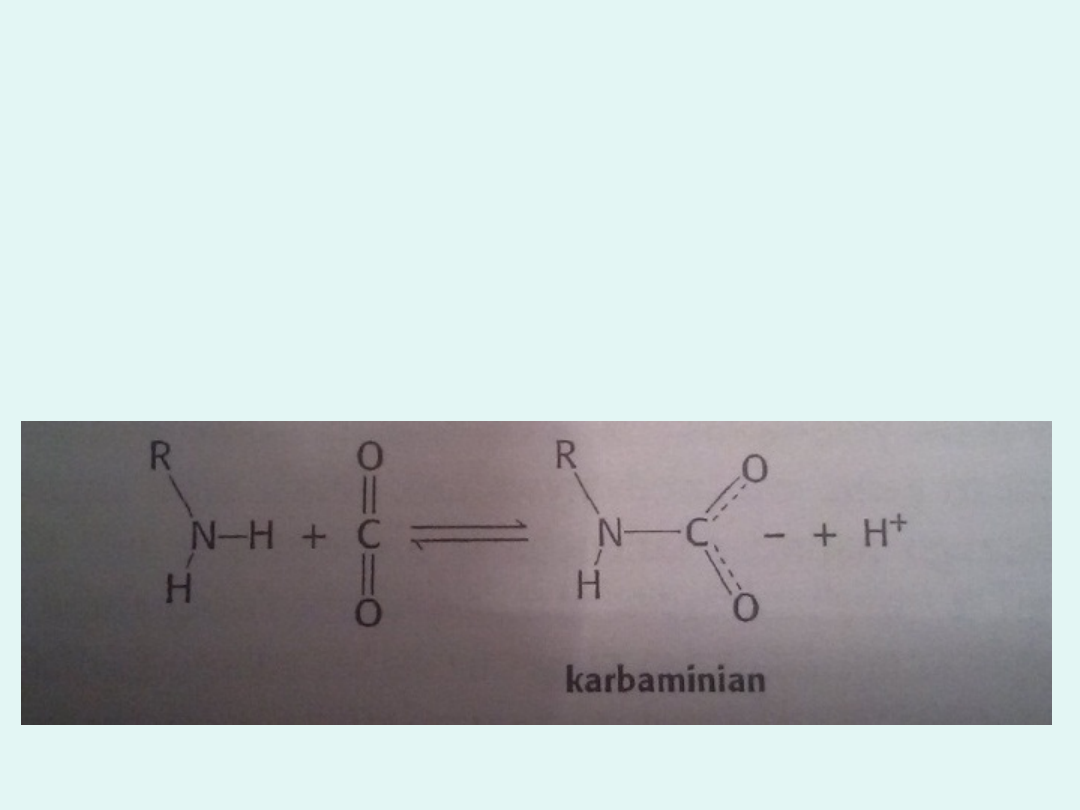
Dwutlenek węgla stabilizuje
deoksyhemoglobinę, reagując z
końcowymi grupami aminowymi, co
prowadzi do powstania grup
karbaminianowych, naładowanych
ujemnie w odróżnieniu od wolnych grup
aminowych, które są pozbawione
ładunku lub obdarzone ładunkiem
dodatnim.

Końce aminowe znajdują się w rejonie
kontaktu między dimerami αβ, gdzie
obdarzone ładunkiem ujemnym grupy
karbaminianowe uczestniczą w
tworzeniu wiązań jonowych, które
stabilizują stan T, sprzyjając
uwalnianiu tlenu. Proces ten jest
podstawą dodatkowego mechanizmu
transportu dwutlenku węgla przez
hemoglobinę, którego wydajność
sięga zaledwie 14% całkowitego
transportu tych cząsteczek.

-większość dwutlenku węgla jest
transportowana do płuc w formie HCO
3-
-HCO
3-
wymieniany jest na Cl
-
wzrasta
stężenie jonu w surowicy
-w płucach proces ulega odwróceniu
Zatem dwutlenek węgla, wytwarzany przez
tkanki aktywne metabolicznie, przyczynia
się do obniżenia pH w erytrocytach, a zatem
do uwalniania tlenu, i zostaje
przekształcony do formy, która może być
transportowana w surowicy i uwalniana w
płucach
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Transport tlenu i dwutlenku węgla przez krew, Fizjologia
Obieg tlenu i dwutlenku węgla w przyrodzie
Obieg tlenu i dwutlenku węgla w przyrodzie
OBIEG TLENU I DWUTLENKU WĘGLA W PRZYRODZIE
instrukcja bhp przy eksploatacji butli z medycznym dwutlenkiem wegla
tlenek wegla, dwutlenek wegla i?ekt cieprialniany
Modele struktur dwutlenku węgla i dwutlenku krzemu
TEORIA W-F, teoria, Skład chemiczny powietrza atmosferycznego: a)składniki stałe: azot(78%),tlen(21%
Zawartość ilościowego dwutlenku węgla
Biologia część V Transport tlenu w organiźmie
Ograniczanie emisji dwutlenku węgla w elektrowniach
1. Transport tlenu, II lek, Fizjologia, !Krew, III Transport gazów przez krew
ćw 1 ŚCIEKI Oznaczanie wolnego dwutlenku węgla w wodzie metodą miareczkową
agresywny dwutlenek wegla
Zatrucia dwutlenkiem wegla, PIERWSZA POMOC
więcej podobnych podstron