STRUKTURY BIAŁEK.
CHARAKTERYSTYCZN
E CECHY KOLAGENU
Joanna Kąciak
Agata Dutkiewicz

STRUKTURY BIAŁEK
struktura
pierwszorzędowa,
tj.
sekwencjonowanie
aminokwasów w łańcuch polipeptydowy, w strukturze
pierwszorzędowej występują tylko wiązania peptydowe
struktura drugorzędowa, tj. sposób zwinięcia krótkich, od 3
do 30 stykających się segmentów polipeptydowych w
geometrycznie uporządkowaną jednostkę
struktura trzeciorzędowa, tj. sposób ułożenia jednostek
mających strukturę drugorzędową w większe funkcjonalnie
segmenty, takie jak dojrzały polipeptyd lub jego składowe
domeny
struktura czwartorzędowa, tj. liczba i typy jednostek
polipeptydowych budujących białko oligomeryczne oraz ich
przestrzenne ułożenie

STRUKTURA PIERWSZORZĘDOWA
Pierwszy poziom organizacji, na którym można opisać
budowę białka. Opisuje liniowy układ aminokwasów w
łańcuchu polipeptydowym zgodny z kodem genetycznym.
Pierwszymi białkami, których poznano skład i sekwencję
aminokwasów, była insulina (51 aminokwasów) oraz
rybonukleaza (124 aminokwasy).

W strukturze pierwszorzędowej
zawarte są również położenia wiązań
kowalencyjnych. Są to głównie wiązania
dwusiarczkowe między resztami cysteiny
sąsiadującymi ze sobą w przestrzeni, ale
nie w sekwencji liniowej aminokwasów.
Owe wiązania poprzeczne między
odrębnymi łańcuchami polipeptydowymi
lub między częściami tego samego
łańcucha powstają na skutek utlenienia
grup SH w resztach cysteiny,
sąsiadujących ze sobą w przestrzeni.

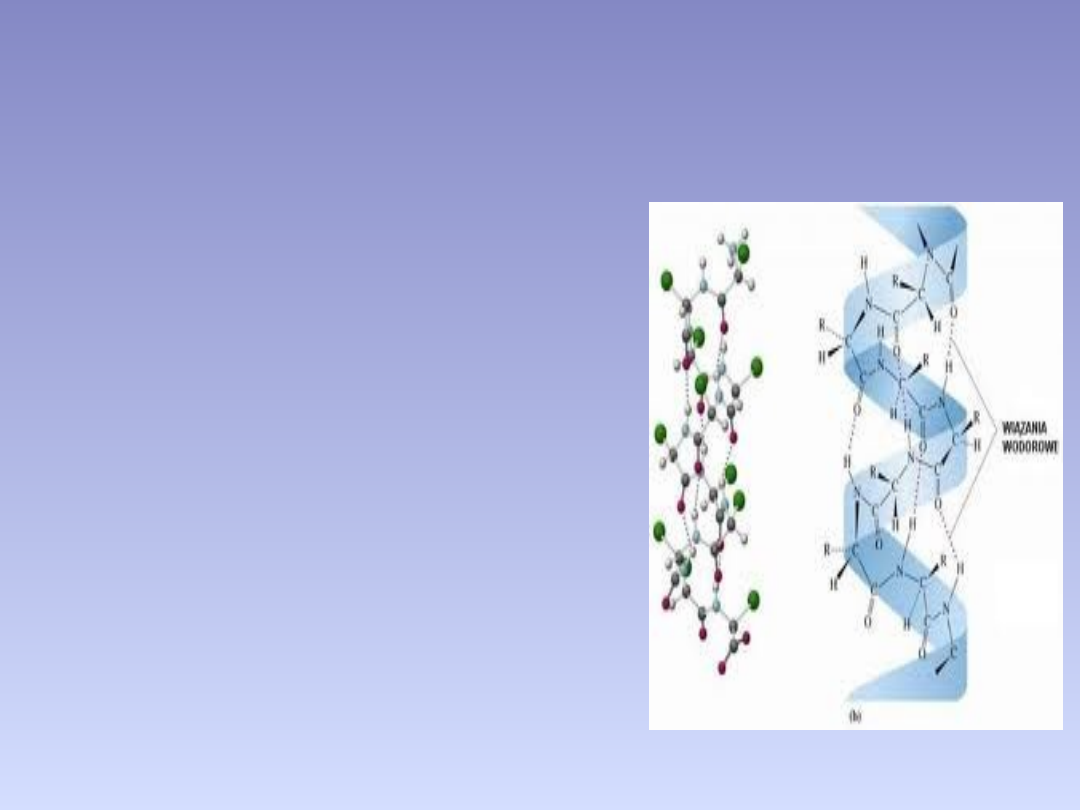
STRUKTURA DRUGORZĘDOWA
Struktura drugorzędowa białka – poziom organizacji, na
którym można opisać budowę białka. Określa się tu sposób
przestrzennego ułożenia łańcuchów polipeptydowych białek (lub
łańcuchów kwasów nukleinowych) na skutek powstawania
spontanicznych
układów
wewnątrzcząsteczkowych
wiązań
wodorowych przede wszystkim między tlenem grupy C=O, a
wodorem grupy -NH dwóch niezbyt odległych od siebie (3 – 5
reszt na jeden zwój heliksu) w łańcuchu wiązań peptydowych.
Na ogół łańcuchy polipeptydowe białek układają się w
kształt:
•helisy – helisy alfa
•pofałdowanej płaszczyzny – harmonijka beta
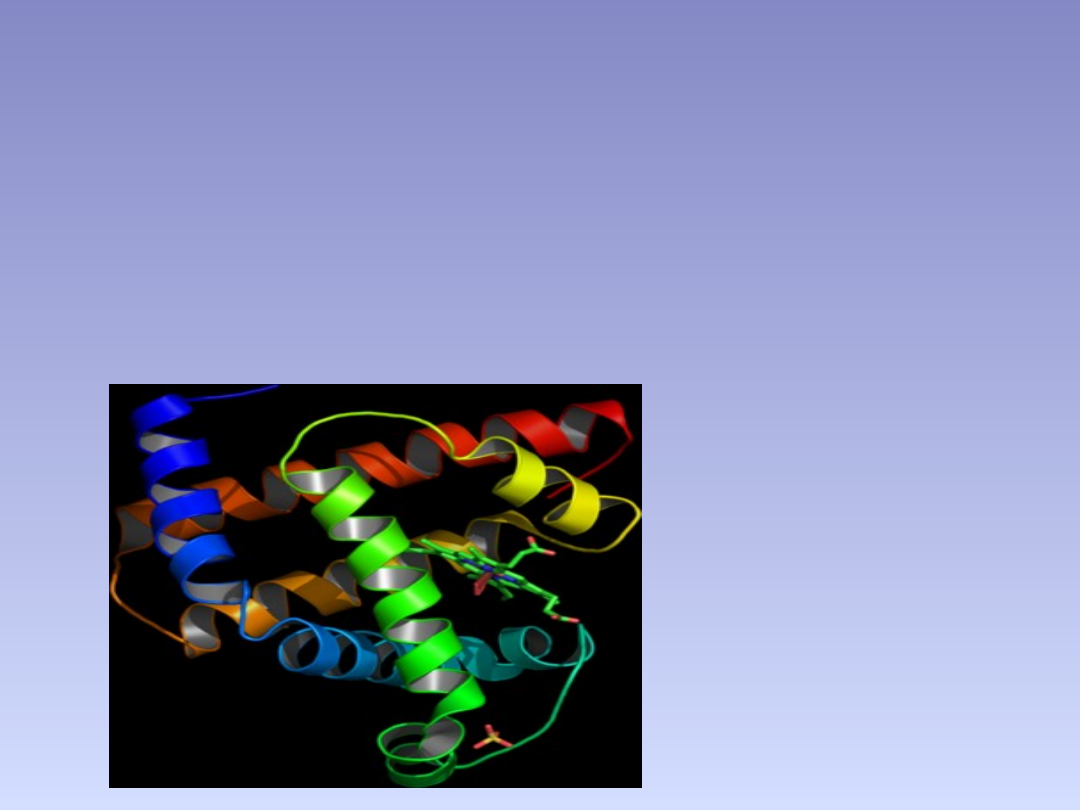
ALFA HELISA
• Struktura drudorzędowa białka (tak jak i
haronijka beta), stabilizowana przez
wiązania wodorowe.
• Kształtem
przypomina
cylinder,
tworzony przez ciasno, prawoskrętnie
skręconą sprężynę. Ściany cylindra
tworzy
łańcuch
polipeptydowy,
a
łańcuchy boczne (podstawniki) wystają
na zewnątrz. Co cztery aminokwasy w
łańcuchu polipeptydowym tworzone
jest wiązanie wodorowe pomiędzy
grupą
karboksylową
jednego
aminokwasu
a
grupą
aminową
drugiego. Skok helisy następuje co
0,54nm.
• Tego rodzaju α heliks przeważa np. w
hemoglobinie i mioglobinie.
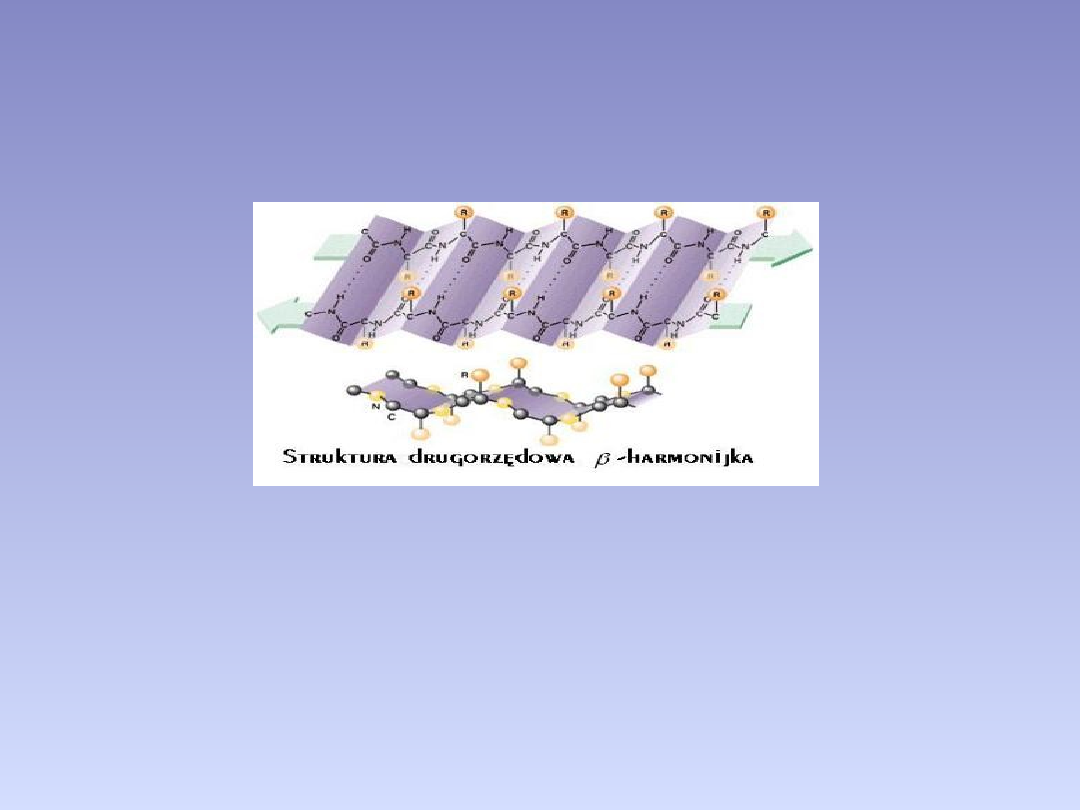
BETA HARMONIJKA
• Kształt harmonijki beta stabilizowany jest poprzez wiązania
wodorowe występujące pomiędzy sąsiednimi łańcuchami – beta
nićmi. Beta nić jest to prawie całkowicie rozciągnięty fragment
polipeptydu, zwykle o długości 5-10 aminokwasów.
• Występują harmonijki beta: równoległe, antyrównoległe i
mieszane. Struktury te (w odróżnieniu od alfa helisy zbudowanych
z jednej ciągłej sekwencji) składają się z oddzielnych fragmentów
łańcucha (nici beta) czasem znacznie od siebie oddalonych w
sensie struktury pierwszorzędowej.
Ten sposób przestrzennego ułożenia aminokwasów włańcuchu
polipeptydowym przypomina wyglądem kartkę papieru
pofałdowaną w harmonijkę.

STRUKTURA TRZECIORZĘDOWA
• Określa się tu wzajemny układ w przestrzeni
elementów struktury drugorzędowej, bez
uwzględniania zależności od sąsiednich cząsteczek.
Kształt, wielkość i właściwości danej podjednostki
decydują o aktywności biochemicznej, w tym o
działaniu enzymu.

Strukturę trzeciorzędową warunkują
różne wiązania chemiczne i
oddziaływania międzycząsteczkowe
• Wiązania dwusiarczkowe (mostki disulfidowe) – należą one do
najsilniejszych wiązań między resztami aminokwasów. Powstają w
wyniku odwodornienia grup tiolowych – SH dwóch cystein
znajdujących się w tym samym łańcuchu białkowym. Wiązania te
nadają trwałość strukturze trzeciorzędowej.
• Oddziaływania jonowe – mogą występować między grupami
aminowymi lub guanidynowymi łańcuchów bocznych aminokwasów
zasadowych, a grupami karboksylowymi aminokwasów kwaśnych
(Asp,Glu).
• Oddziaływania hydrofobowe – polega na odpychaniu cząsteczek wody.
• Oddziaływania van der Waalsa
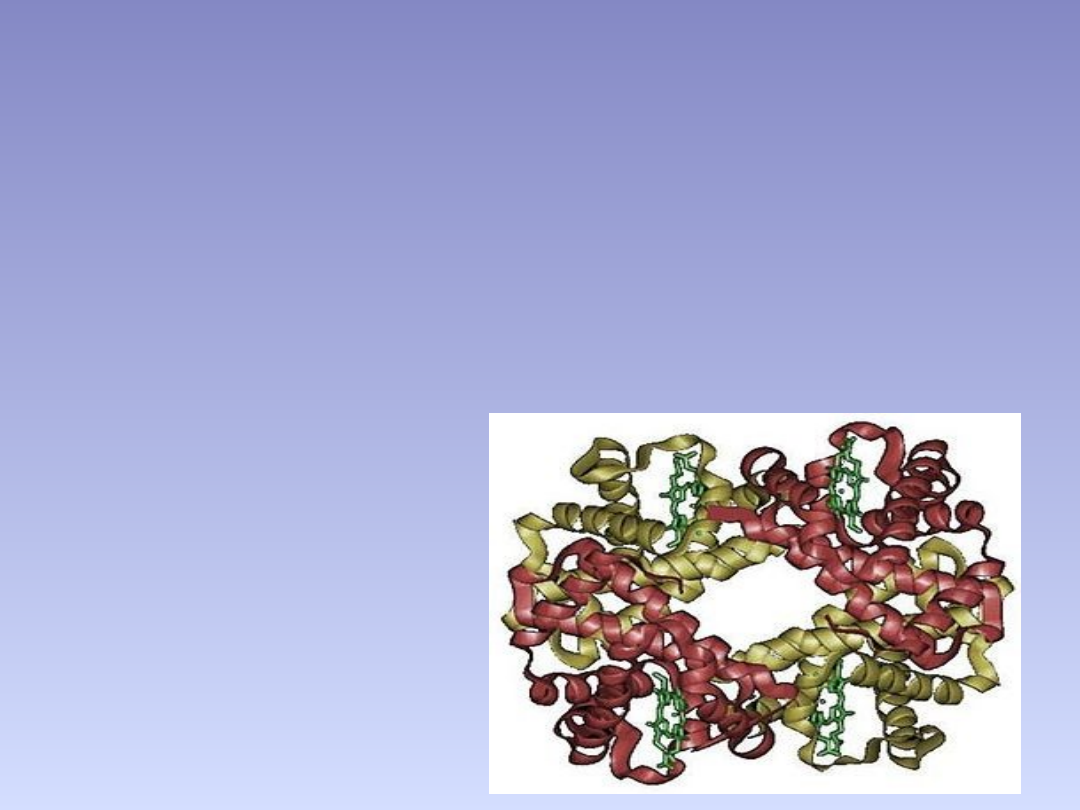
STRUKTURA CZWARTORZĘDOWA
• poziom organizacji na którym można opisać budowę białka.
Określa się tu wzajemny układ w przestrzeni oraz sposób
połączenia się:
• podjednostek, czyli osobnych łańcuchów polipeptydowych,
niepołączonych ze sobą kowalencyjnie lub
• Grup prostetycznych (w przypadku białek złożonych).
• przykładami białek składających się z kilku podjednostek są :
hemoglobina, polimeraza DNA , kanały jonowe ,
• wirus mozaiki tytoniowej ,
• dehydrogenaza białczanowa ,
• dehydrogenaza alkoholowa.
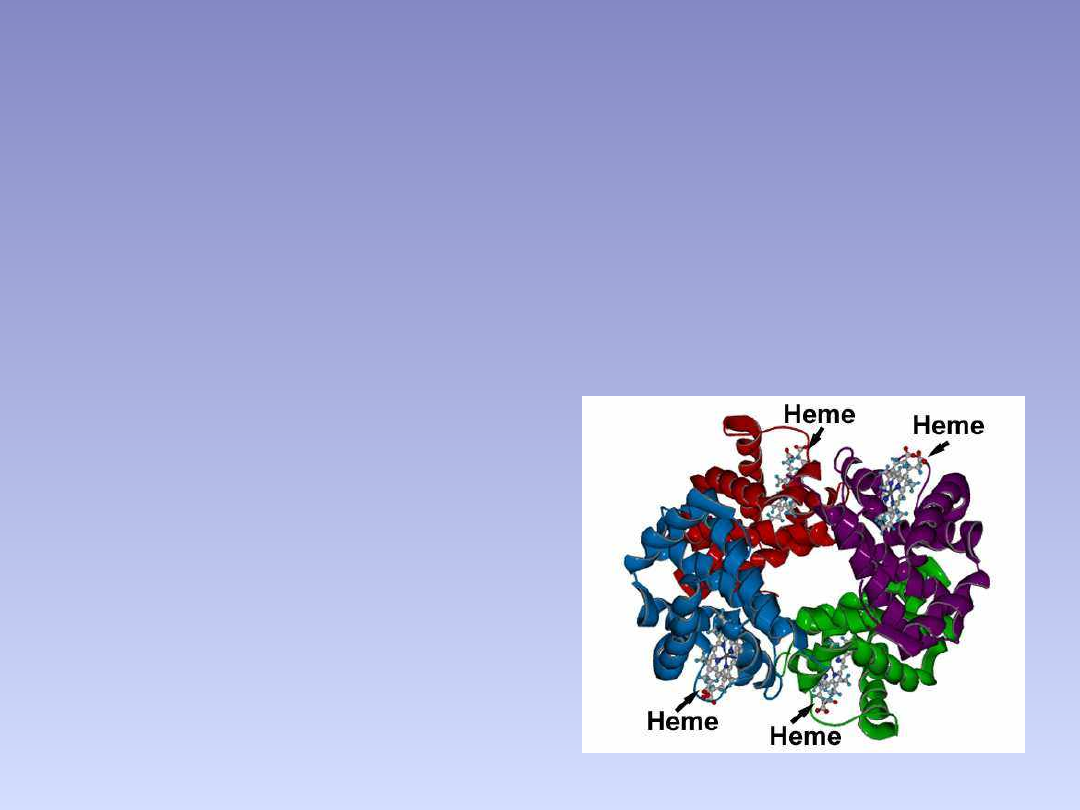
Oddziaływania
międzycząsteczkowe stabilizujące
strukturę czwartorzędową:
Oddziaływania jonowe – mogą występować między
grupami aminowymi lub guanidowymi łańcuchów bocznych
aminokwasów zasadowych, a grupami karboksylowymi
aminokwasów kwaśnych (Asp,Glu).
Oddzialywania
hydrofobowe – polegają
na odpychaniu cząsteczek
wody.
Oddzialywania van der
Waalsa
Wiązania wodorowe
KOLAGEN
Kolagen – główne białko tkanki łącznej .
Posiada ono bardzo wysoką odporność na
rozciąganie i stanowi główny składnik
ścięgien.
Jest odpowiedzialny za elastyczność skóry.
Ubytek kolagenu ze skóry powoduje
powstawanie zmarszczek, w trakcie jej
starzenia. Kolagen wypełnia także rogówkę
oka, gdzie występuje w formie krystalicznej.
Kolagen jest powszechnie stosowany w
kosmetykach, zwłaszcza w kremach i
maściach przeciwzmarszczkowych .
Stosuje się go też jako wypełniacz
w chirurgii kosmetycznej – np. do
wypełniania ust.
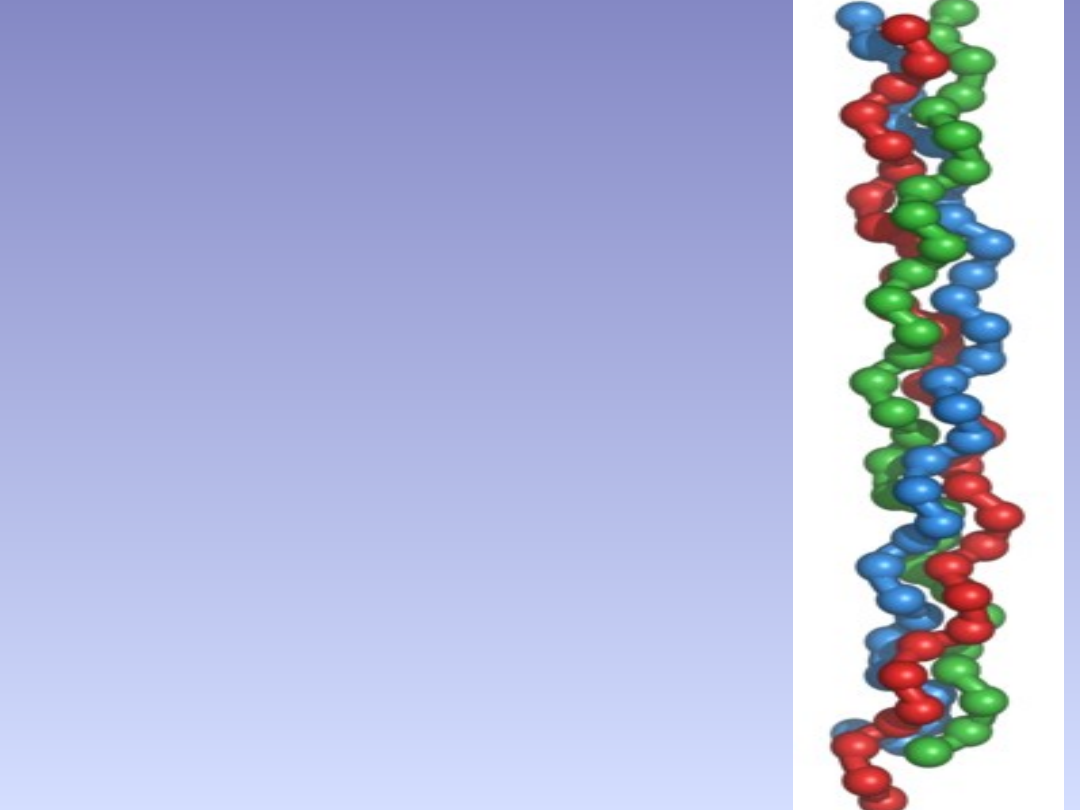
STRUKTURA KOLAGENU
• Kolagen ma nietypowy skład aminokwasów.
Zawiera duże ilości glicyny i proliny oraz dwa
aminokwasy nie pochodzące bezpośrednio z
translacji w rybosomach –hydroksyprolinę i
hydroksylizynę.
• Łańcuchy te składają się z regularnych triad
aminokwasów: Gly-X-Y , gdzie Gly – to glicyna a X i
Y to inne aminokwasy. Na ogół X to prolina zaś Y to
hydroksyprolina . Niewiele innych białek wykazuje
taką regularność. Regularność ta powoduje, że
łańcuchy α mają tendencję do przyjmowania ściśle
określonej konformacji , na skutek oddziaływań
między sobą. Trzy cząsteczki kolagenu skręcają się
spontanicznie
w
podjednostki
zwane
tropokolagenem . Tropokolagen ma strukturę
potrójnej, ściśle upakowanejhelisy , o skoku tylko
0,3 nm w porównaniu ze skokiem 0,36 nm,
typowym dla innych białek.
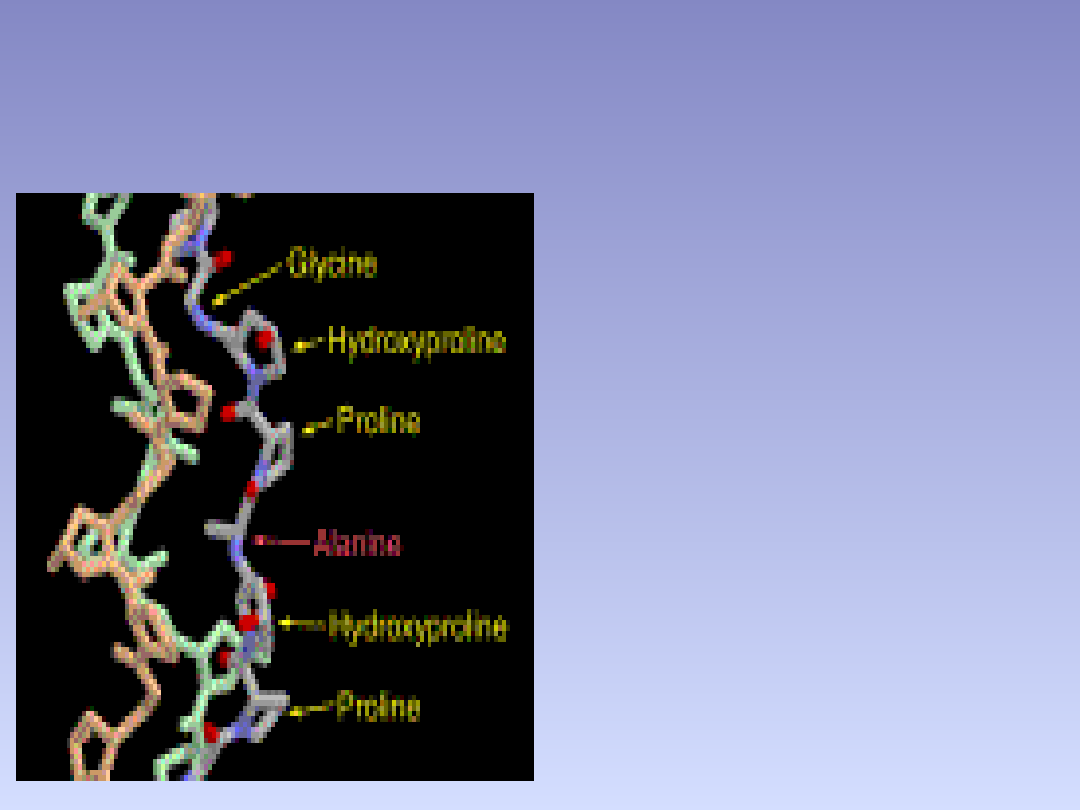
Wiązania kowalencyjne i wodorowe tworzone przez
hydroksylizynę i hydroksyprolinę odgrywają kluczową rolę w
stabilizowaniu helisy kolagenu, a także mają silny wpływ na
ostateczny kształt włókien zbudowanych z kolagenu.
Różnego
rodzaju
czynniki
np.
podwyższenie
temperatury,
zmiana
wartości
pH
czy
duża
dawka
promieniowania mogą doprowadzić do
zniszczenia
naturalnej
struktury
kolagenu, np. do jego denaturacji.
Polega ona na zmianach drugo- i
trzeciorzędowej struktury ich cząsteczki
bądź
zmianach
ich
struktury
nadcząsteczkowej przebiegających bez
rozrywania wiązań peptydowych, czyli z
zachowaniem
struktury
pierwszorzędowej białka. W przypadku
kolagenu denaturacja oznacza przejście
struktury helikalnej w statystyczny
kłębek. Temperatura denaturacji zależy
od zawartości wody w kolagenie i od
stopnia jego usieciowania.
Document Outline
- STRUKTURY BIAŁEK. CHARAKTERYSTYCZNE CECHY KOLAGENU
- STRUKTURY BIAŁEK
- STRUKTURA PIERWSZORZĘDOWA
- Slide 4
- STRUKTURA DRUGORZĘDOWA
- ALFA HELISA
- BETA HARMONIJKA
- STRUKTURA TRZECIORZĘDOWA
- Slide 9
- STRUKTURA CZWARTORZĘDOWA
- Slide 11
- KOLAGEN
- STRUKTURA KOLAGENU
- Slide 14
Wyszukiwarka
Podobne podstrony:
biochemia wiaz pept strukt bialek
biochemia wiaz pept strukt bialek
Struktury białek Denarutacja Białek 2
biologia, bialka, 1 I rzedna struktora bialek- peptydy w budowie jednej plaszczyzny
struktury białek
Przewidywanie struktury białek
1 Skład i struktura białek
Wielopoziomowa struktura białek
struktury białek
Struktura białek opracowane pytania
12 Struktura i funkcje białek
11. Struktura i funkcje białek, licencjat eksperyment
13 struktura i funkcje białek (2)
BIOCHEMIA struktura i funkcje bialek
3 Struktura przestrzenna białek
15 struktura i funkcje białek (4)
więcej podobnych podstron