Patrycja Zamojska, 2011
Temat: wiązania peptydowe i struktury białek
Białka należą do wielkocząsteczkowych związków zbudowanych z kilkuset
do kilku tysięcy aminokwasów wykazujących masę cząsteczkową powyżej 10 kDa.
W łańcuchu polipeptydowym aminokwasy połączone są wiązaniami peptydowymi
(zwanymi również amidowymi).
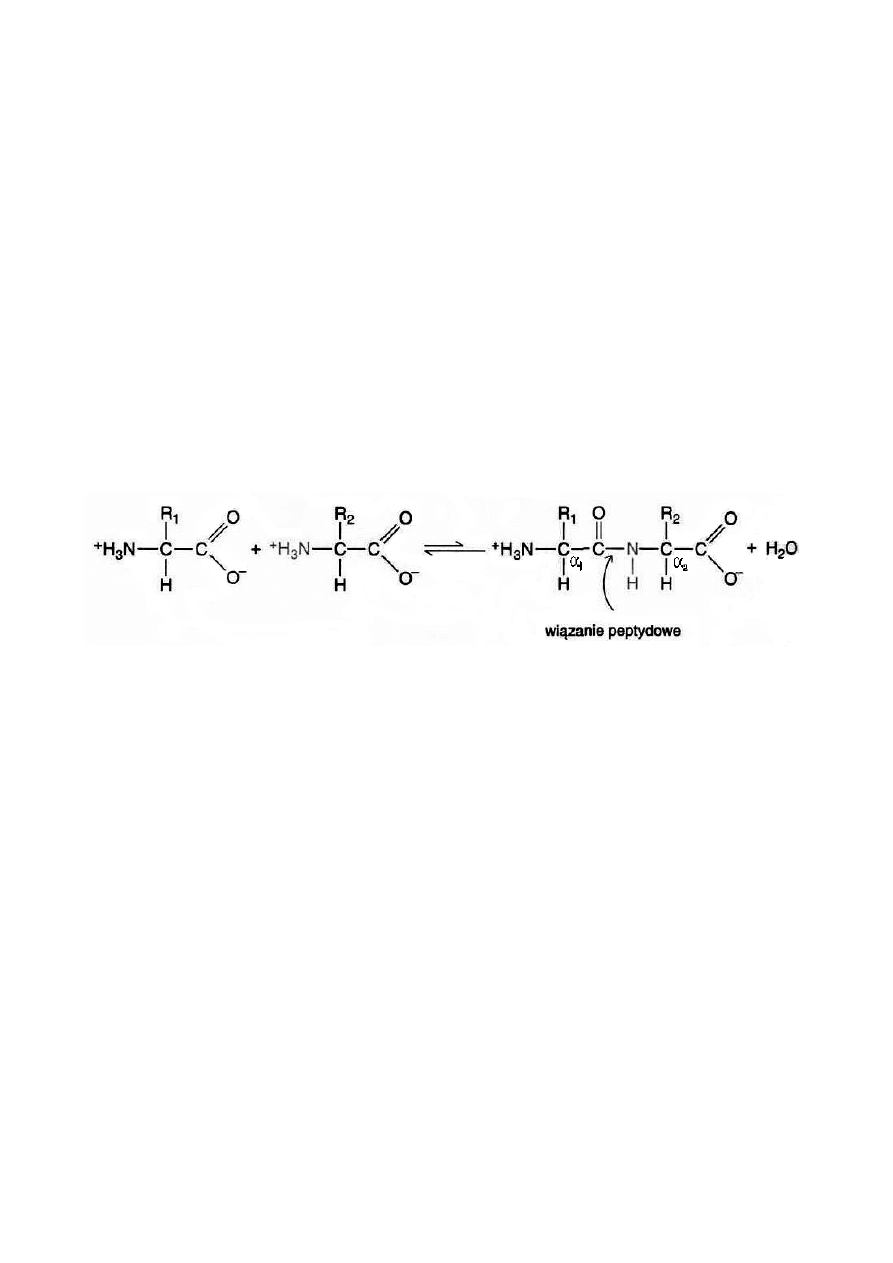
W tworzeniu wiązania peptydowego bierze udział azot grupy α-aminowej
jednego aminokwasu, który wiąże się z węglem grupy α-karboksylowej drugiego
aminokwasu. Powstanie dipeptydu z dwóch wolnych aminokwasów powoduje
uwolnienie wody. Przebieg reakcji ilustruje rysunek:
Wiązanie peptydowe jest sztywne, ma cechy wiązania podwójnego o konfiguracji
trans. Tlen grupy C=O i wodór grupy N-H są skierowane w przeciwne strony. Węgle
α, tlen grupy C=O i wodór grupy N-H tworzą jedną płaszczyznę. Sąsiednie wiązanie
C-C oraz N-C są wiązaniami pojedynczymi – zapewniają możliwość fałdowania
łańcucha polipetydowego.
Kaj Ulrik Linderstrom-Lang wprowadził pojęcie rzędowości struktury białek, dzięki
czemu złożoność struktury cząsteczek białkowych jest łatwiejsza do zrozumienia.
Wyróżnił on strukturę pierwszo-, drugo-, trzecio- i czwartorzędową.
Struktury przestrzenne utrzymywane są przez cząsteczki białkowe dzięki zdolności
tworzenia różnych wiązań – w obrębie cząsteczki bądź międzycząsteczkowych.
Podstawowym wiązaniem jest wiązanie peptydowe, jednak występują również:
•
wiązanie wodorowe (protonowe) – słabe wiązanie między dodatnio
naładowanym atomem wodoru a ujemnie naładowanym akceptorem (np.
tlen, azot). Ładunki atomów (dodatni bądź ujemny) powstaje na skutek
polaryzacji wiązań kowalencyjnych, w których te atomy biorą udział. Aby
mogło powstać wiązanie grupy wiążące się muszą być w odpowiednio
bliskiej odległości.

•
wiązania jonowe – występują między sąsiadującymi,
zdysocjonowanymi grupami np. między grupami karboksylowymi i
hydroksylowymi.
•
Siły van der Waalsa – występują między grupami atomów
jednakowego rodzaju np. między blisko położonymi grupami węglowodorów
różnych rodników (-R) aminokwasowych
Do struktur białek należą: pierwszorzędowa, drugorzędowa, trzeciorzędowa
oraz czwartorzędowa. Trzy ostatnie określane są jako konformacja białka.
STRUKTURA PIERWSZORZĘDOWA
Jest to sekwencja, czyli kolejność aminokwasów – połączonych liniowo - w
łańcuchu polipeptydowym. Aminokwasy wchodzące w skład białka połączone są
wiązaniami peptydowymi.
Istnieje możliwość dokładnego określenia kolejności występowania aminokwasów
w cząsteczce białka. Na przykład glukagon (hormon wydzielany przez trzustkę) jest
polipeptydem zbudowanym z 29 reszt aminokwasowych. Znajomość budowy
znajduje potwierdzenie w syntezie danego związku w warunkach laboratoryjnych.
STRUKTURA DRUGORZĘDOWA
Jest to sposób przestrzennego rozmieszczenia łańcucha polipeptydowego.
Wyróżnia się dwa rodzaje tej struktury: α- helisa i β-harmonijka.
Struktura α-helisy występuje w takich częściach łańcucha, w których układa się on
w regularne, helikalne skręty. Strukturę tę utrzymują wiązania wodorowe między
grupami -CO-NH- znajdującymi się w sąsiednich skrętach. Każdy z nich łączy tlen
obdarzony ładunkiem ujemnym z wodorem o ładunku dodatnim. Na jeden skręt
helisy przypada 3,6 reszt aminokwasowych – wszystkie uczestniczą w tworzeniu
wiążań wodorowych.
Struktura α-helisy jest podstawową jednostką budowy białek fibrylarnych, które
wchodzą w skład np. włosów i paznokci. Elastyczność tych białek jest zależna od
struktury helikalnej oraz obecności wiązań wodorowych. Przykładem może tu być

rozciąganie włosów na głowie – jest to możliwe do pewnego momentu, później
włosy wracają do poprzedniej długości. Wiąże się to z tym, że podczas rozciągania
włókiem fibryli ulegają rozerwaniu włókna wodorowe, które po ustaniu działania siły
odtwarzają się, a włókna ponownie skręcają.
W strukturze β-harmonijki (pofałdowanej kartki) wiązania wodorowe w białkach
powstają między różnymi łańcuchami polipeptydowymi lub różnymi fragmentami
jednego łańcucha, jeżeli wygiął się on w taki sposób, że te fragmenty ustawiły się
równolegle. Każdy łąńcuch jest rozwinięty i układa się zygzakowato, tworząc
pofałowaną struktur, która może się zginać lecz nie jest rozciągliwa.
Strukturę β-harmonijki ma na przykład fibroina – białko jedwabiu.
W jednym łańcuchu polipeptydowym mogą znajdować się odcinki o konformacji α-
helisy oraz β-harmonijki. Przykładem jest materiał budulcowy pajęczyny, który swą
elastyczność zawdzięcza białkom o strukturze α-helisy, a wytrzymałość białkom β-
harmonijki.
STRUKTURA TRZECIORZĘDOWA
Struktura trzeciorzędowa określa sposób wtórnego, trójwymiarowego pofałdowania
cząsteczki białka z zachowaniem wyżej opisanych elementów struktury
drugorzędowej. Struktura III-rzędowa jest wynikiem przyjęcia przez cząsteczkę
konformacji o najmniejszej swobodnej energii. Zachodzi stabilizacja pofałdowania
oraz zwijania się łacucha przez wytworzenie wielu dodatkowych wiązań.
Istnienie struktury trzeciorzędowej jest możliwe dzięki istnieniu wiązań, które
zespalają odległe od siebie liniowo reszty aminokwasów. Dzięki zagięciom
łańcucha białkowego jego fragmenty odległe od siebie o kilkanaście, a nawet
kilkadziesiąt reszt aminokwasowych stają się bliskie przestrzennie.
STRUKTURA CZWARTORZĘDOWA
Wiele aktywnych biologicznie białek składa się z dwóch lub większej ilości
łańcuchów polipeptydowych, połączonych specyficznym wzajemnym
oddziaływaniem.
Struktura czwartorzędowa jest wynikiem nałożenia się przestrzennych struktur
współdziałających łańcuchów polipeptydowych, każdego o własnej strukturze
pierwszo-, drugo- i trzeciorzędowej.

Te same oddziaływania, które warunkują strukturę drugo- i trzeciorzędową (tzn.
wiązania wodorowe, jonowe, oddziaływania hydrofobowe oraz mostki
dwusiarczkowe) przyczyniają się do struktury czwartorzędowej.
Hemoglobina, białko czerwonych krwinek odpowiedzialne za rozprowadzanie tlenu
po organizmie, jest przykładem białka globularnego o strukturze czwartorzędowej.
Hemoglobina jest zbudowana z 574 reszt aminokwasowych, które wchodzą w skład
czterech łańcuchów polipeptydowych. Dwa identyczne łańcuchy nazwano
łańcuchami alfa, a dwa pozostałe – łańcuchami beta.
Bibliografia:
•
„Biochemia” - Edward Bańkowski,
•
„Biochemia zwierząt” - Aleksandra Malinowska,
•
„Biochemia zwierząt” - Stanisław E. Karpiak
•
„Biochemia” - Lubert Stryer
•
„Biologia” - Eldra P. Solomon, Linda R. Berg, Diana W. Martin,
Wyszukiwarka
Podobne podstrony:
biochemia wiaz pept strukt bialek
Struktury białek Denarutacja Białek 2
biologia, bialka, 1 I rzedna struktora bialek- peptydy w budowie jednej plaszczyzny
struktury białek
Przewidywanie struktury białek
1 Skład i struktura białek
Wielopoziomowa struktura białek
(), biochemia L, sprawozdanie Amfoteryczny charakter białek i aminokwasów (ćw I)
struktury białek
Struktura białek opracowane pytania
STRUKTURY BIAŁEK
BIOCHEMIA struktura i funkcje bialek
Funkcje białek, Biochemia
więcej podobnych podstron