Skład i struktura białek
TWÓJ BIOTECHNOLOG
https://www.facebook.com/twoj.biotechnolog
1. Białka są liniowymi polimerami, zbudowanymi z monomerycznych jednostek, zwanych aminokwasami. Białka
spontanicznie zwijają się w struktury przestrzenne, które są zdeterminowane przez sekwencję
aminokwasową. Funkcja białka jest bezpośrednio zależna od jego struktury przestrzennej. Białka są
ucieleśnieniem przejścia jednowymiarowego świata sekwencji do trójwymiarowego świata cząsteczek o
rozmaitych właściwościach.
2. Białka zawierają szeroki zakres grup funkcyjnych (grupy alkoholowe, tiolowe, tioeterowe, estrowe,
karboksylowe, karboksyamidowe i różne grupy zasadowe). Większośd tych grup jest chemicznie aktywna i
odpowiedzialna za szeroki spektrum funkcji białek. Reaktywnośd chemiczna ma zasadnicze znaczenie dla
działania enzymów – białek, które katalizują specyficzne reakcje chemiczne w układach biologicznych.
3. Białka mogą oddziaływad ze sobą i z innymi biologicznymi makrocząsteczkami, tworząc złożone struktury.
Dzięki temu uzyskują właściwości, których nie mają poszczególne białka.
4. Niektóre białka mają sztywną strukturę (mogą stanowid elementy strukturalne cytoszkieletu), a inne
wykazują ograniczoną elastycznośd (mogą pełnid rolę zawiasów, sprężyn i dźwigni).
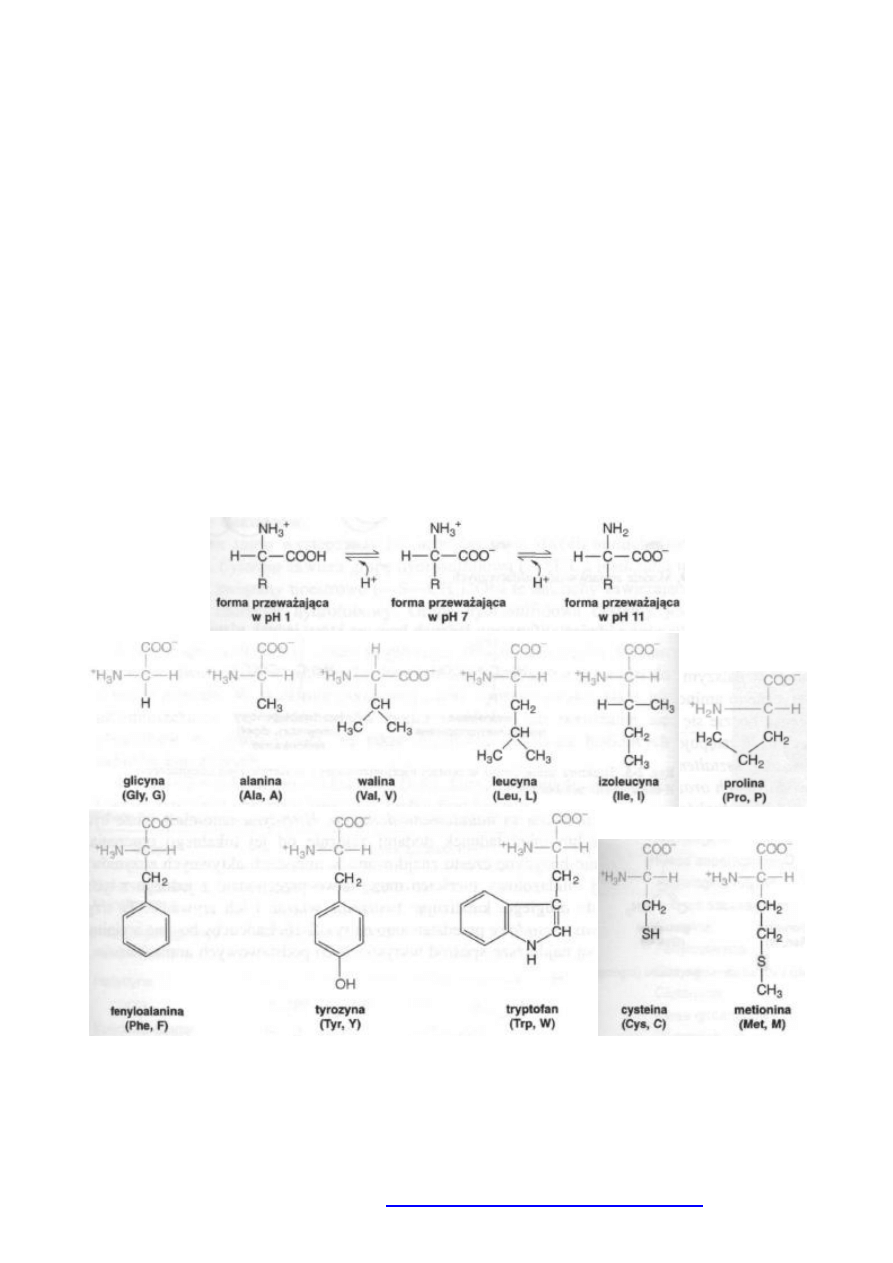
Aminokwasy są podstawowymi elementami białek. α-Aminokwas jest zbudowany z centralnie usytuowanego atomu
węgla α, połączonego z grupą aminową, karboksylową, atomem wodoru i wyróżniającą go grupą R (łaocuchem
bocznym). Białka są zbudowane wyłącznie z L-aminokwasów. W roztworze o pH obojętnym występują w formie
zjonizowanej jako jony obojnacze (dwubiegunowe).

Skład i struktura białek
TWÓJ BIOTECHNOLOG
https://www.facebook.com/twoj.biotechnolog
Łaocuchy boczne 7 aminokwasów łatwo ulegają zjonizowaniu. Mogą byd one zarówno donorami, jak i akceptorami
protonów, ułatwiając reakcje, a także tworząc wiązania jonowe.
Diagram Ramachandrana – ukazuje dozwolone kombinacje wartości kątów φ (kąt torsyjny wokół wiązania między
atomem azotu i węgla α) i ψ (kąt torsyjny wokół wiązania między atomem węgla α i węgla karbonylowego).
Wiele kombinacji jest niedozwolonych ze względu na steryczne zawady między atomami
Skład i struktura białek
TWÓJ BIOTECHNOLOG
https://www.facebook.com/twoj.biotechnolog
Motywy/struktury naddrugorzędowe – np. helisa-zwrot-helisa.
Domena – zwinięty łaocuch polipeptydowy, tworzący ściśle upakowany region; połączony elastycznymi odcinkami
łaocucha z innymi domenami (perły na sznurze).
Dimer – składa się z dwóch identycznych podjednostek.
Kłębek statystyczny – łaocuch polipeptydowy pozbawiony wiązao poprzecznych; enzym w tej formie traci aktywnośd
katalityczną. Białko po przejściu w formę kłębka jest zdenaturowane.
Molekularni opiekunowie (chaperones) – zapobiegają niedozwolonym oddziaływaniom prowadzącym do powstania
agregatów.
Priony – czynniki białkowe wywołujące choroby.
Formy amyloidowe – włókniste agregaty białkowe
NMR – magnetyczny rezonans jądrowy, nadaje się bardziej do badania materiału stałego niż rozpuszczonego.
Paradoks Levinthala – olbrzymia różnica między obliczonym czasem (potrzebnym do przybierania wszystkich
możliwych konformacji przez białko) a czasem rzeczywistym potrzebnym do prawidłowego zwinięcia się białka.
Białka mają zdolnośd do pełnienia licznych funkcji wyłącznie dzięki zestawowi 20 aminokwasów. Wiele białek
podlega jednak modyfikacji przez przyłączenie innych grup.
Grupy acetylowe – przyłączane do N kooca, co zwiększa odpornośd białek na degradację.
Grupy hydroksylowe – przyłączane do wielu reszt proliny, stabilizuje to nowe włókna kolagenu.
Grupa karboksylowa – nieodpowiednia karboksylacja γ-karboksyglutaminianu (białku będącym czynnikiem
krzepnięcia krwi) zachodzi przy niedoborze witaminy K, co może prowadzid do krwotoku.
Jednostki węglowodanowe – przyłączane do białek występujących na powierzchni komórek, np. do reszt
asparginowych.
Kwasy tłuszczowe – przyłączane do grupy α-aminowej lub tiolowej w cysteinie (charakter hydrofobowy).
Grupa fosforanowa – najczęściej przyczepiana do seryny, tyrozyny i treoniny.
Inne modyfikacje powstają w wyniku chemicznych rearanżacji łaocuchów bocznych, a czasami szkieletu
peptydowego.
GPF – białko zielonej fluorescencji; grupa powstała w wyniku rearanżacji i utlenienia sekwencji Ser-Tyr-Gly
znajdującej się w centrum białka.
Wiele białek ulega docięciu:
Enzymy trawienne są syntetyzowane w postaci nieaktywnych prekursorów; po uwolnieniu do jelita są
aktywowane przez rozcięcie specyficznego wiązania peptydowego.
W procesie krzepnięcia krwi rozcięcie wiązania peptydowego przekształca rozpuszczalny fibrynogen w
nierozpuszczalną fibrynę.
Pewne hormony powstają z rozcięcia jednego długiego prekursora białkowego.
Wyszukiwarka
Podobne podstrony:
POWOŁYWANIE RADY MINISTRÓW I JEJ SKŁAD I STRUKTURA, PRAWO OGÓLNE
biochemia wiaz pept strukt bialek
biochemia wiaz pept strukt bialek
Struktury białek Denarutacja Białek 2
biologia, bialka, 1 I rzedna struktora bialek- peptydy w budowie jednej plaszczyzny
struktury białek
Przewidywanie struktury białek
Wielopoziomowa struktura białek
struktury białek
Struktura białek opracowane pytania
STRUKTURY BIAŁEK
12 Struktura i funkcje białek
11. Struktura i funkcje białek, licencjat eksperyment
Elektroforeza białek w agarozie, skład jonowy białka, pI,?nsytometria
13 struktura i funkcje białek (2)
Atmosfera. Struktura i skład atmosfery., transport materiałów niebezpiecznych
więcej podobnych podstron