
Izomeria konfiguracyjna heteroatomów.
Przykłady chiralności w przyrodzie.

HETEROATOM ≠ H, C
HETEROATOM = S, N, F,
Si, P …
Izomeria konfiguracyjna
heteroatomów

Stereochemia
azotu
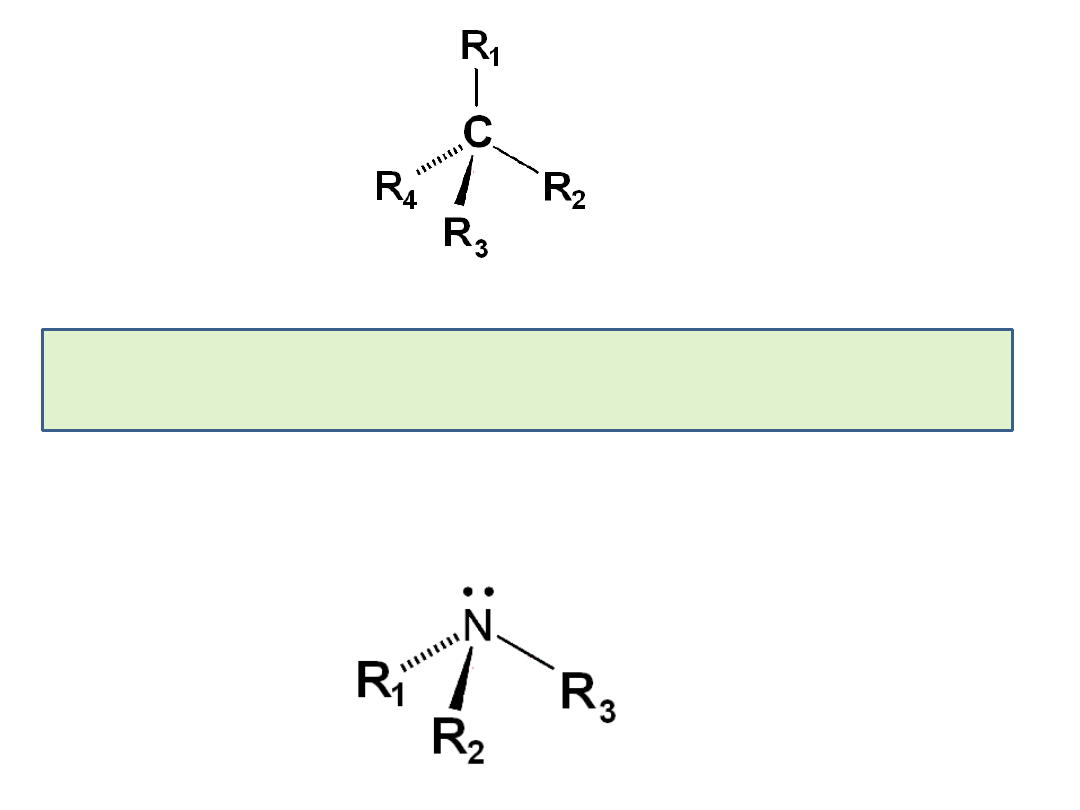
Czy trójwartościowy atom
azotu jest chiralny?
Czy związek taki jak
etylometyloamina istnieje
jako para enancjomerów?
INNE ATOMY O TETRAEDRYCZNEJ
HYBRYDYZACJI MOGĄ BYĆ RÓWNIEŻ
CENTRAMI STEREOGENICZNYMI!
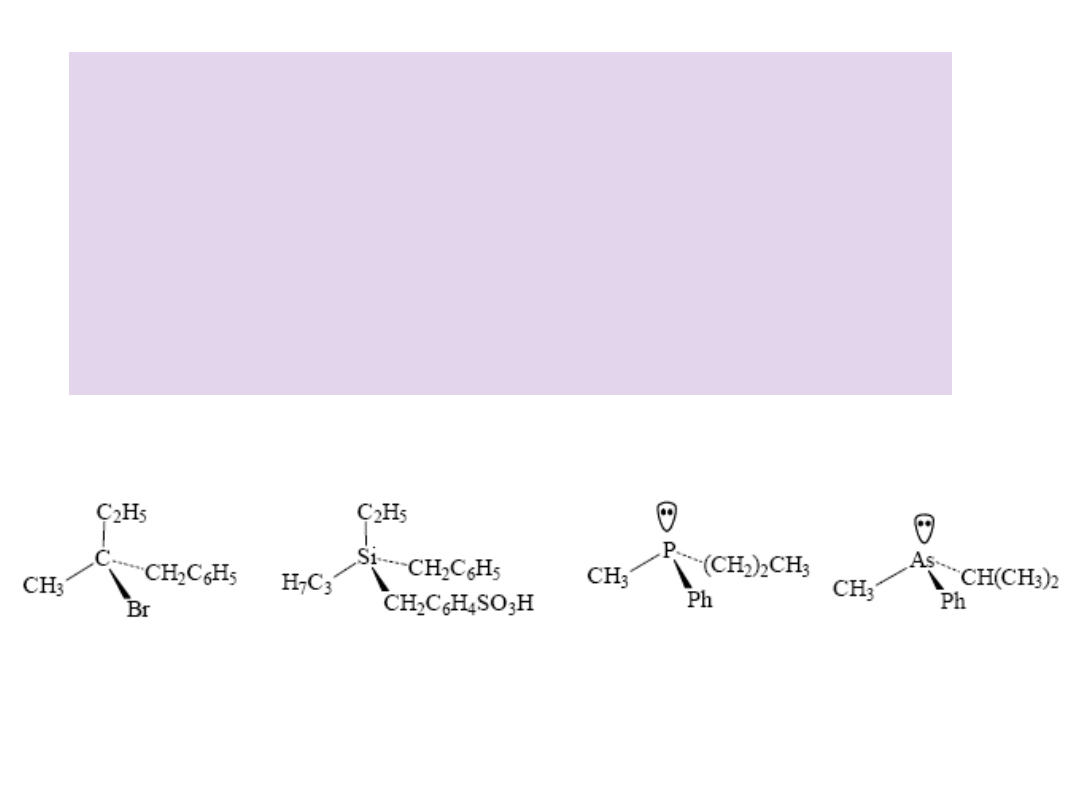
• Atomy IV grupy układu okresowego takie jak: krzem, german
• Atomy siarki: sulfotlenki, sole sulfoniowe, estry kwasów
sullfinowych
• Atomy azotu: sole ammoniowe, N-tlenki amin
• Atomy fosforu: fosfina, tlenek fosfiny, estry kwasów
fosfinowych
• Atomy arsenu: arsyna
Stereochemia azotu
aminy
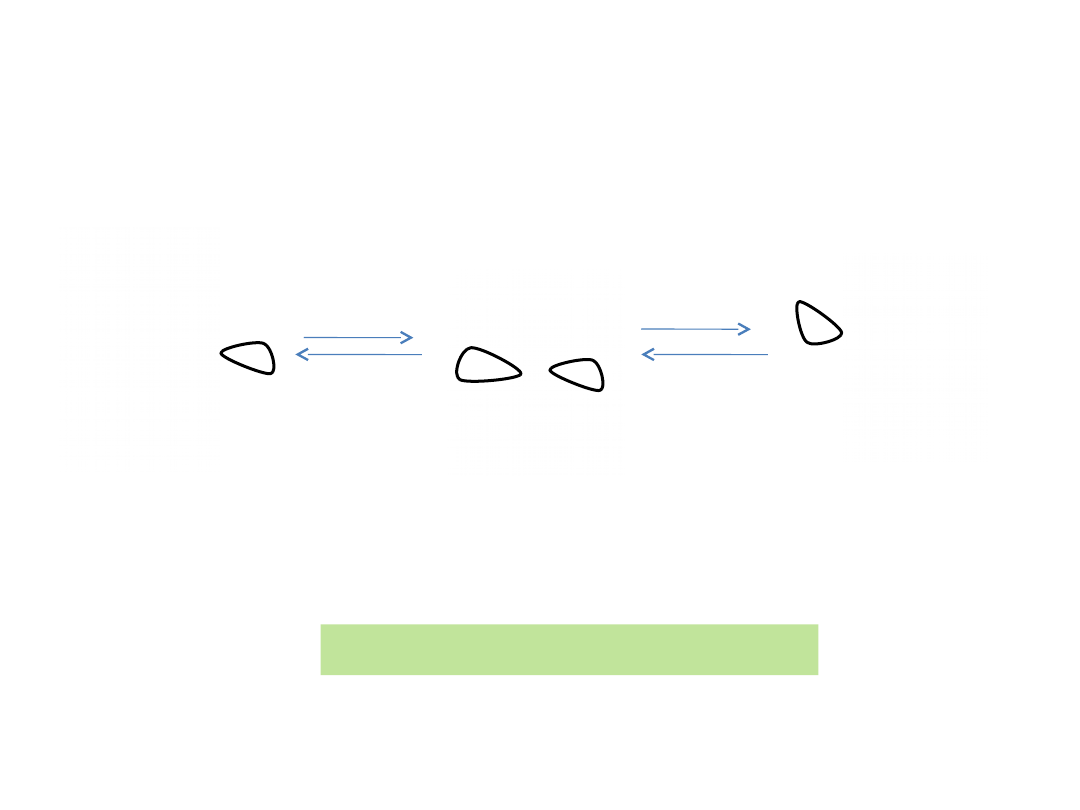
Inwersja konfiguracji chiralnej aminy
R
2
R
3
R
1
:
R
3
R
2
R
2
R
1
R
1
R
3
:
:
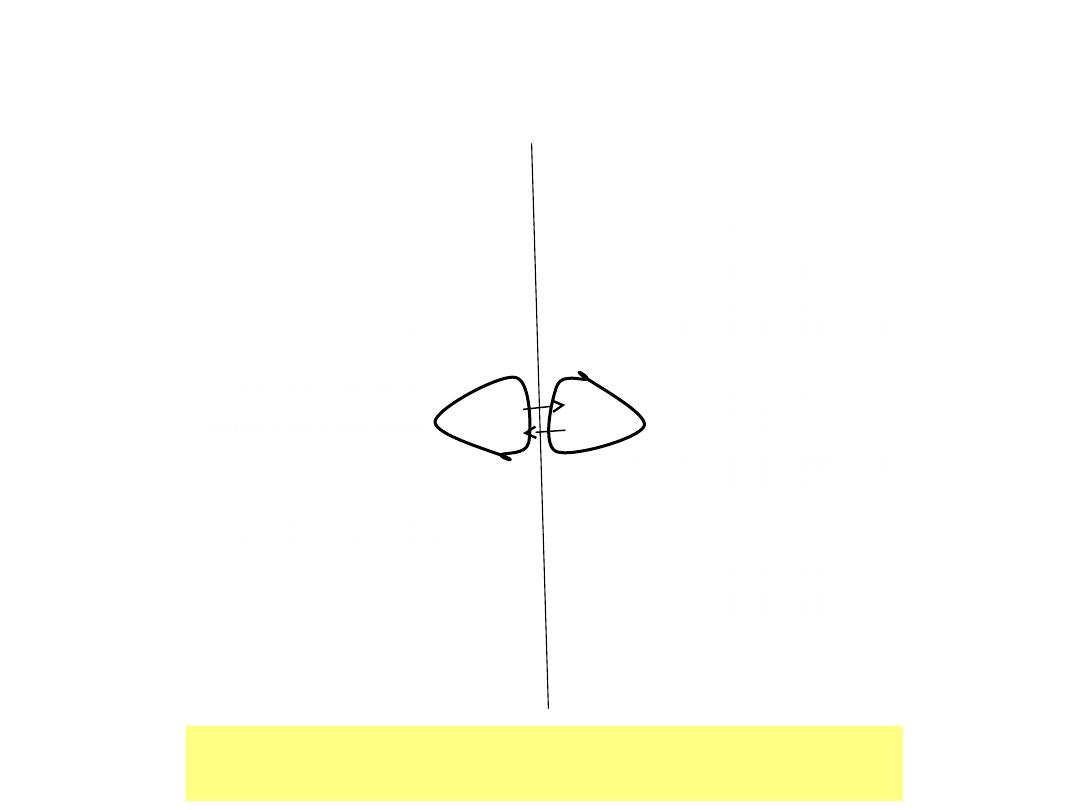
W temp. pokojowej zmiana konfiguracji – 10
10
razy
na sekundę
:
CH
3
C
H
2
H
3
C
CH
3
:
CH
3
C
H
2
szybko
Szybka inwersja podstawników
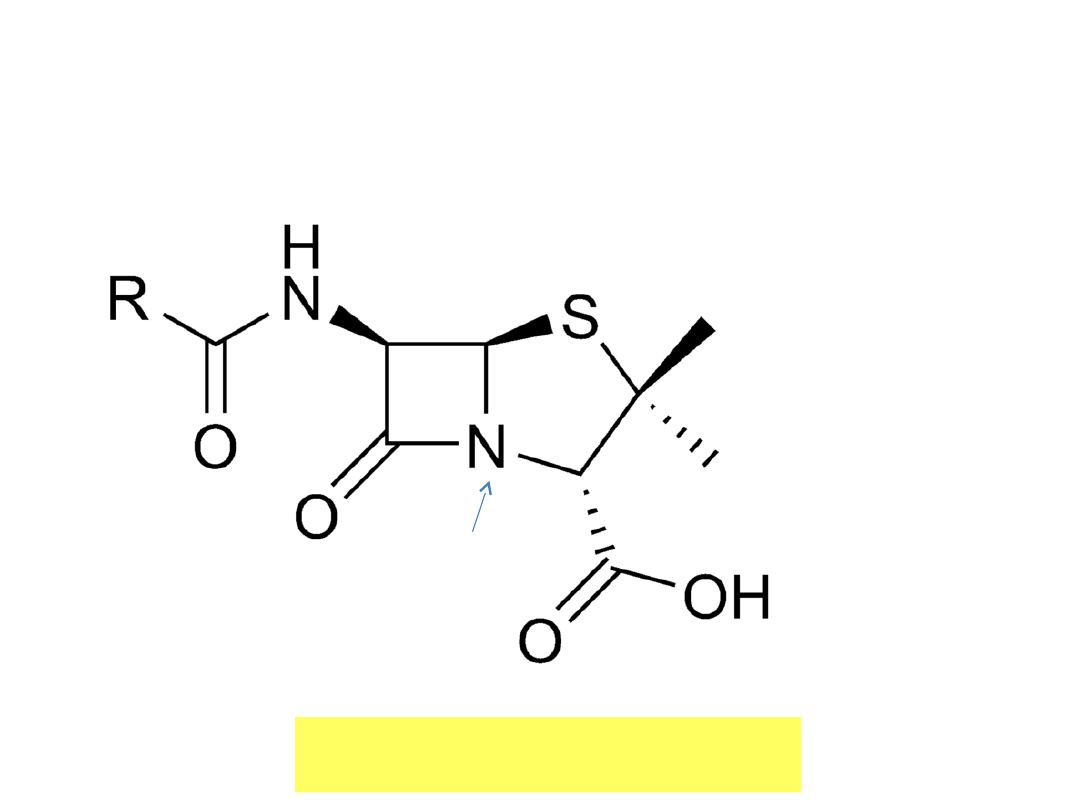
Struktura przestrzenna cząsteczki
penicyliny
Stereochemia azotu
brak zjawiska inwersji
Asymetrycznie
podstawiony,
piramidalny atom azotu
o ściśle określonej i nie
ulegającej zmianie
konfiguracji
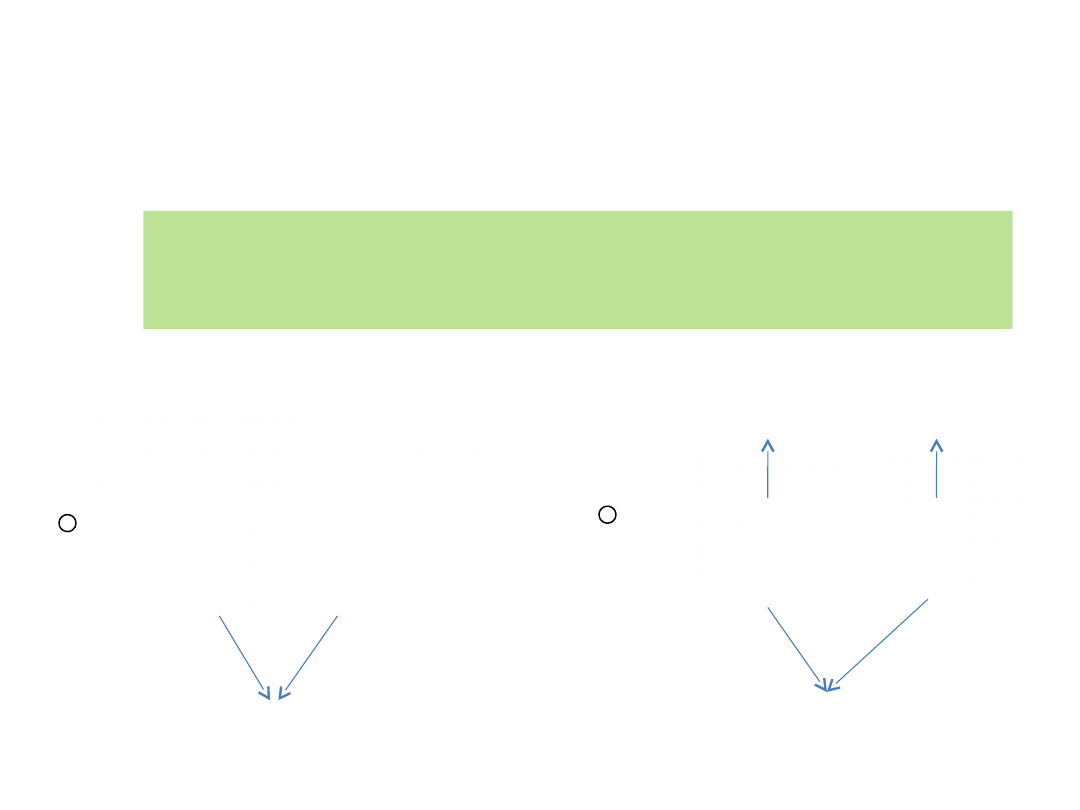
Stereochemia azotu
sole amoniowe
Konfiguracyjnie stabilne: chiralne czwartorzędowe
sole amoniowe
oraz asymetrycznie podstawione N-tlenki amin
trzeciorzędowych
X
-
X
-
Enancjomery
chiralnej soli
amoniowej
Enancjomery chiralnego
N-tlenku aminy
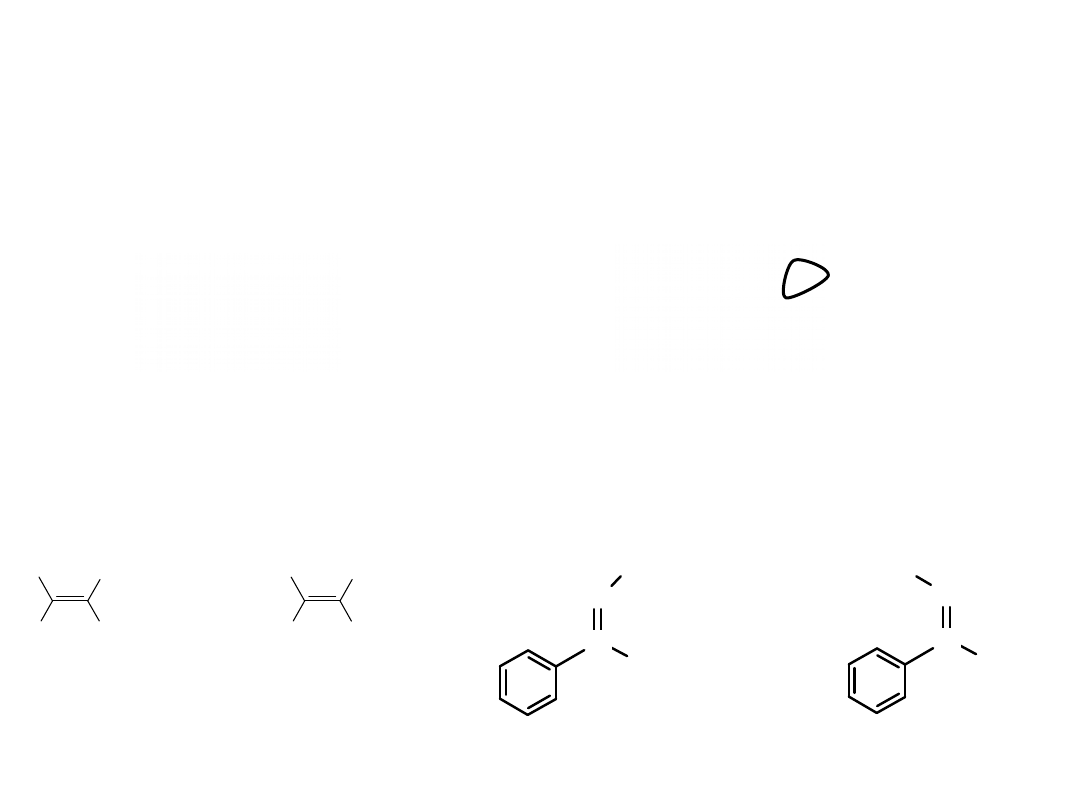
Stereochemia azotu
izmeria syn-anti
Cis -trans
Syn-anti
H
Cl
Cl
H
H
Cl
H
Cl
izomer cis
izomer trans
:
H
N
OH
H
N
O
H
.
.
..
C
C
syn
anti
Oksym benzaldehydu
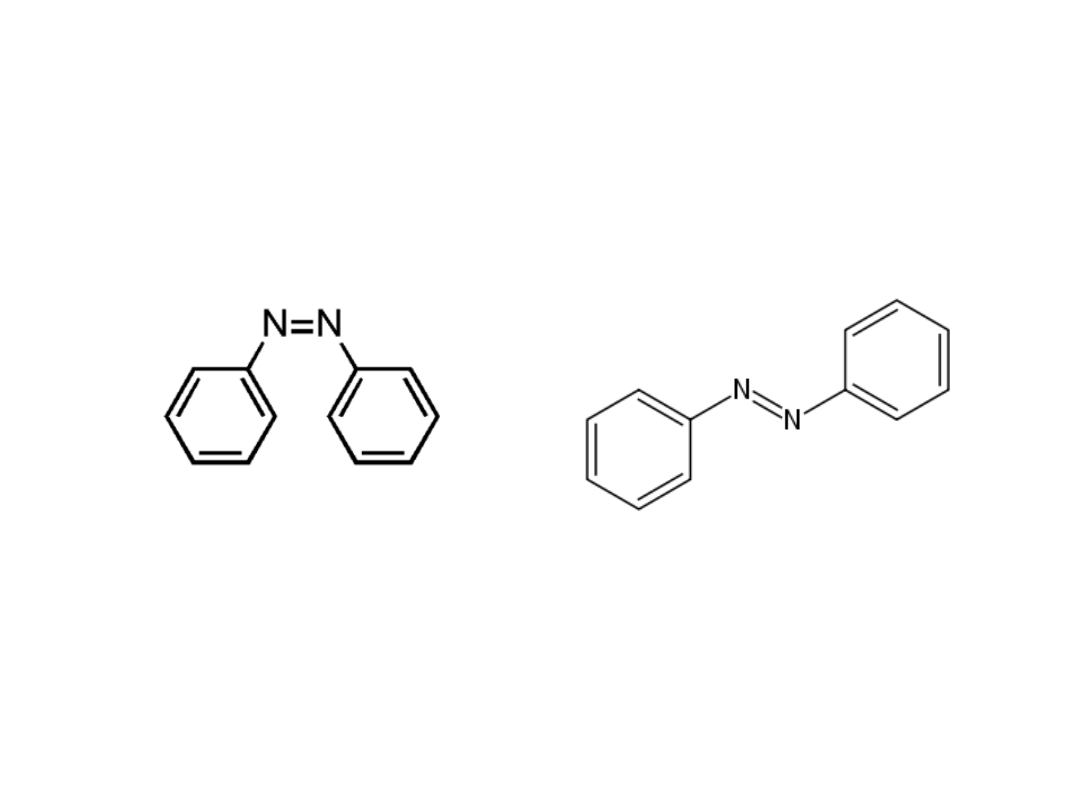
Stereoizomeria azotu
Wiązanie azot-azot
Syn-azobenzen
Anti-azobenzen
Stereochemia fosforu
Enancjomery chiralnej
fosfiny
:
:

:
Najmniej
ważny 4
(R)-
metylopropylofenylofosforan
CH
2
CH
2
CH
3
2
H
3
C
1
3
Stereochemia fosforu

Stereochemia związków fosforu
Chiralne tlenki fosfin i kwasów fosfinowych
Tlenek fosfiny
Ester kwasu
fosfinowego
Stereochemia związków siarki
Chiralne cząsteczki:
:
:
:
sulfotlenku
Soli sulfoniowej
Estru kwasu
sulfinowego
Sulfotlenek (S)-metylocysteiny
Dwa chiralne atomy
Cztery odmiany
izomeryczne
R-R
S-S
R-S
S-R

Określenie konfiguracji heteroatomu
System R, S
Reguła
pierwszeństwa
Konfiguracja R
Chiralność w przyrodzie
Laboratorium:
Przyroda:
Synteza związku
chiralnego
racemat
Rozdział enancjomerów
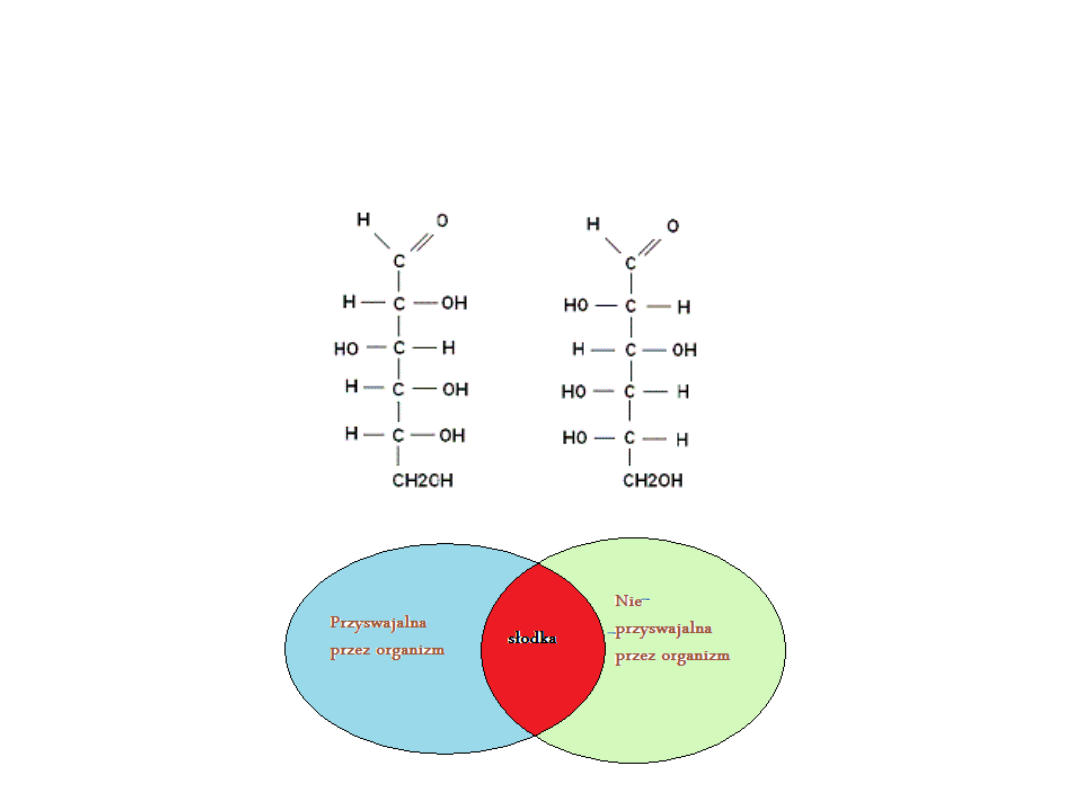
D-glukoza
L-alanina
Glukoza
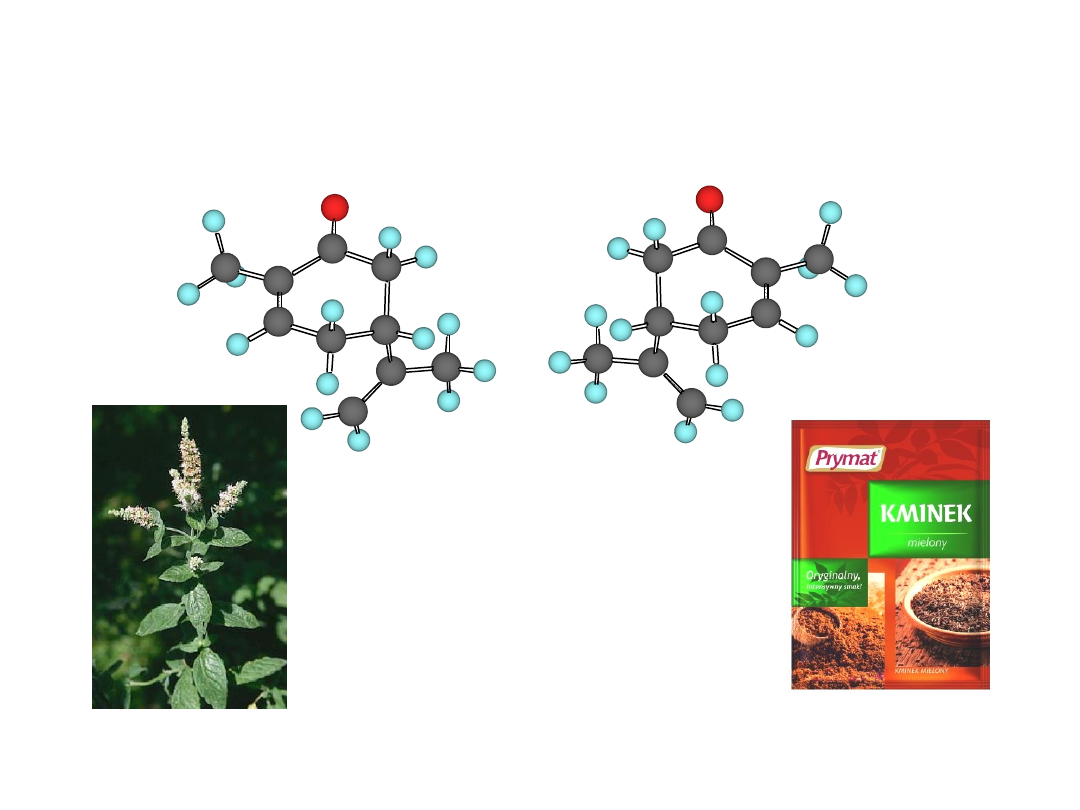
Karwon
(-)-(R)- karwon
(+)-(S)- karwon
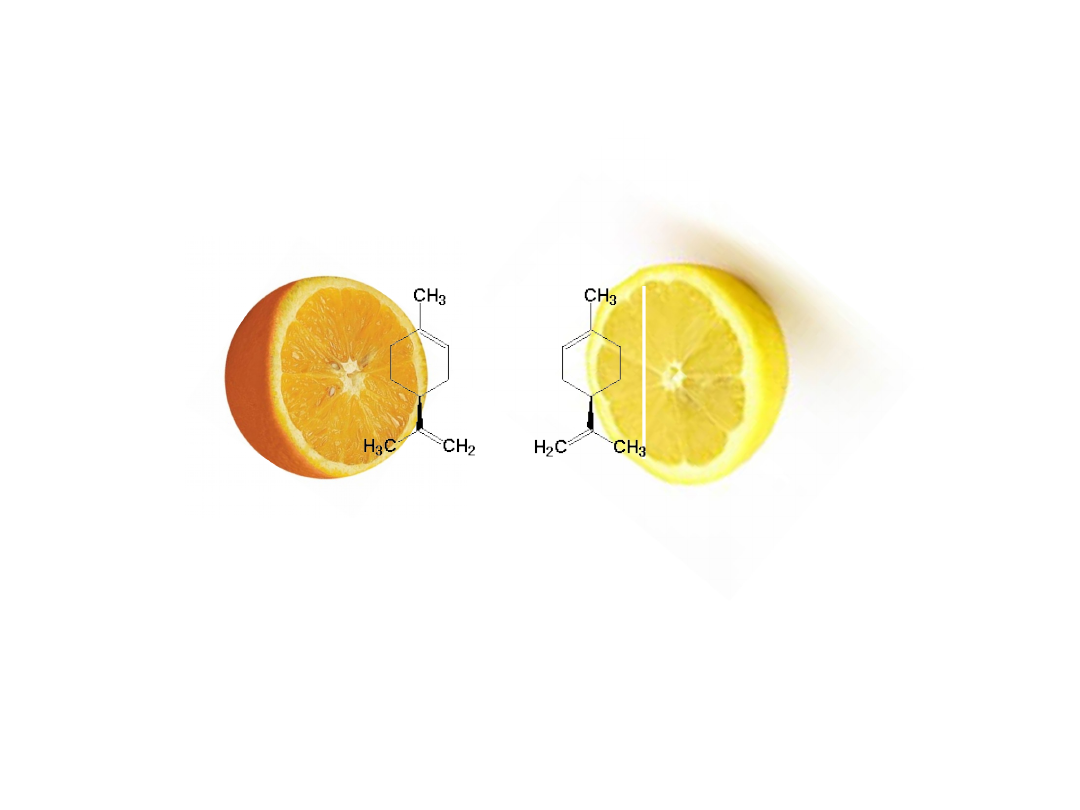
Limonen
(+)-limonen
(-)-limonen
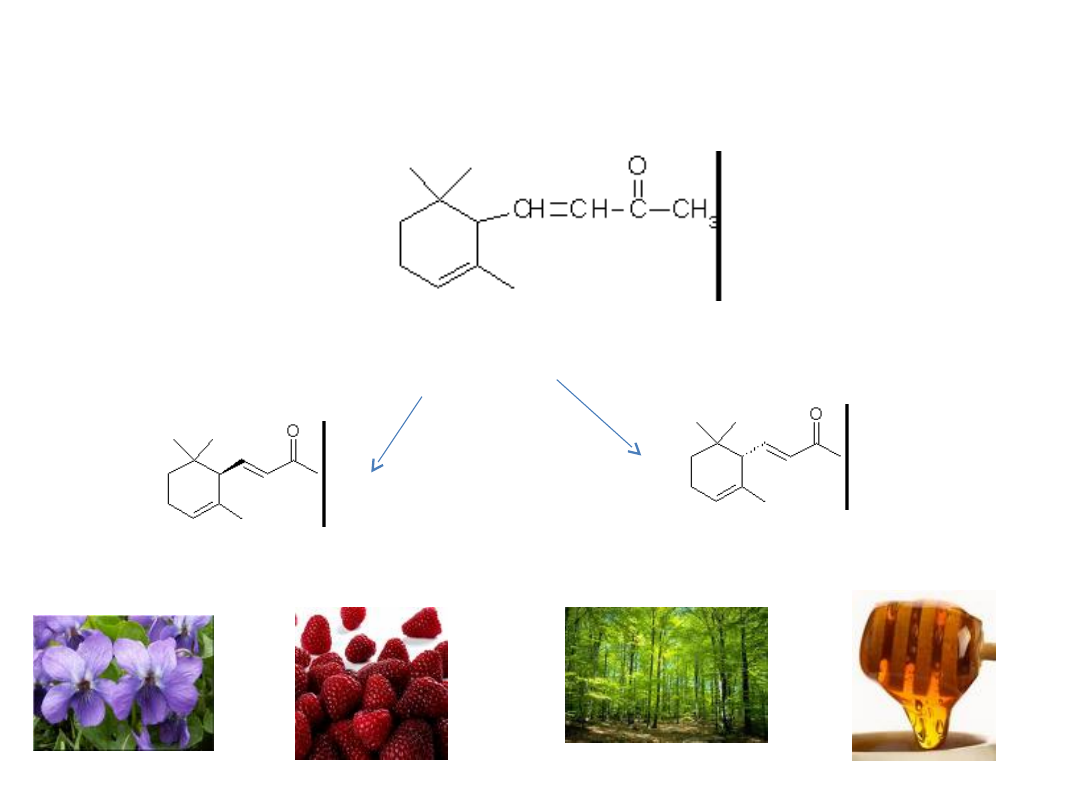
Jonony
α-jonon
R(+)-α-jonon
+
S(-)-α-jonon
+
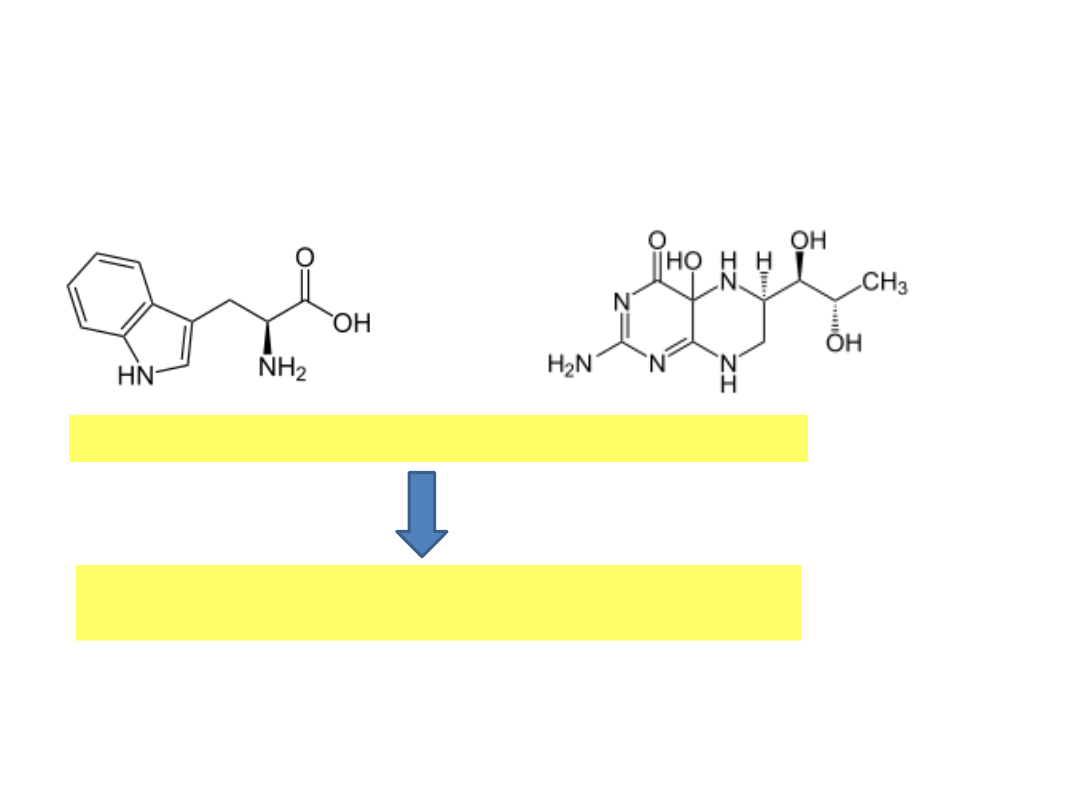
Tryptofan i fenyloalanina
L- tryptofan
L- fenyloanalina
GORZKIE
D- tryptofan
SŁODKIE
D-
fenyloalania
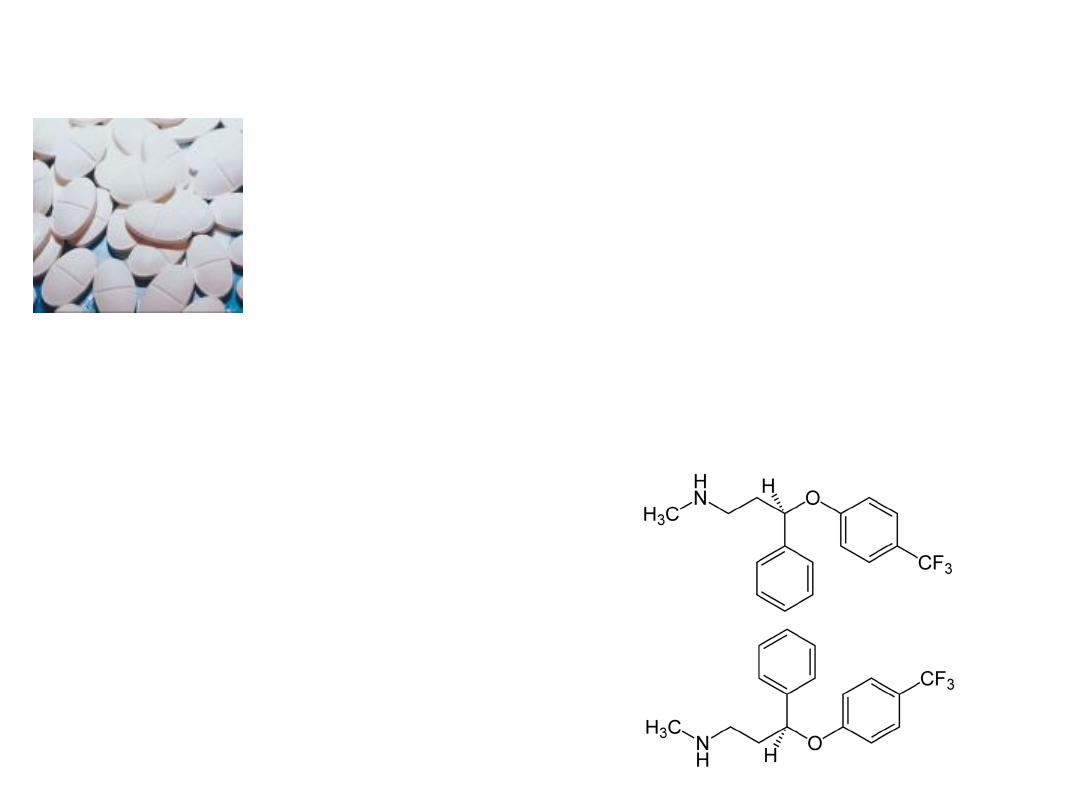
Fluoksetyna
•
• Mieszanina racemiczna – lek przeciw
depresji
• Enancjomer S- lek przeciw migrenie
Enancjomer
(R)
Enancjomer
(S)
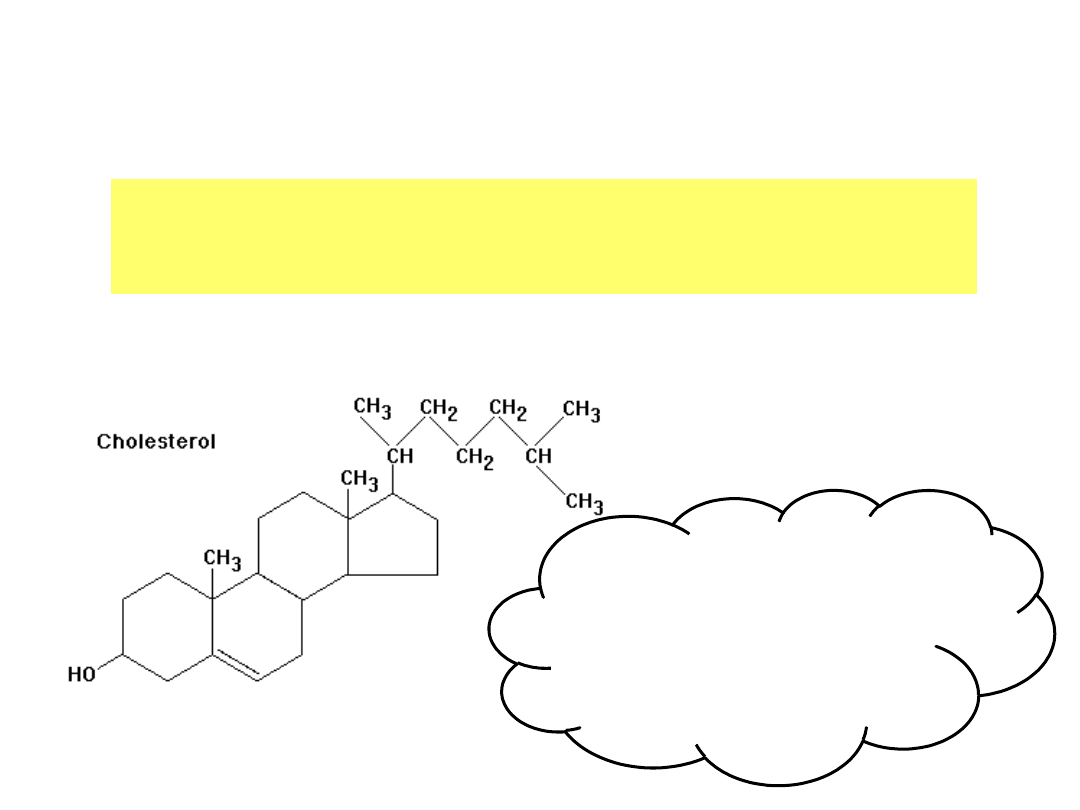
Cholesterol
Asymetryczna budowa niemal wszystkich
chemicznych składników żywej komórki.
Z 256 teoretycznie możliwych
izomerów konfiguracyjnych ,
żywe komórki syntetyzują i
wykorzystują tylko jeden.
Enzymy
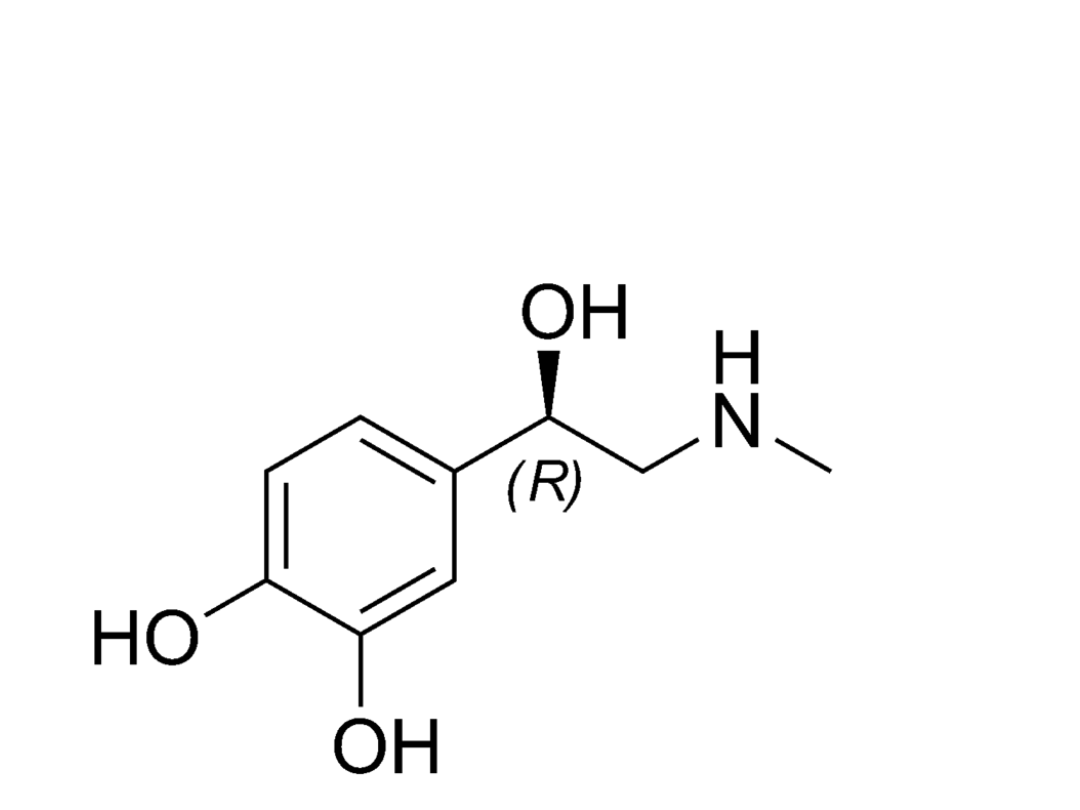
Hormony
(-)adrenalina działa o wiele silniej niż (+)adrenalina.
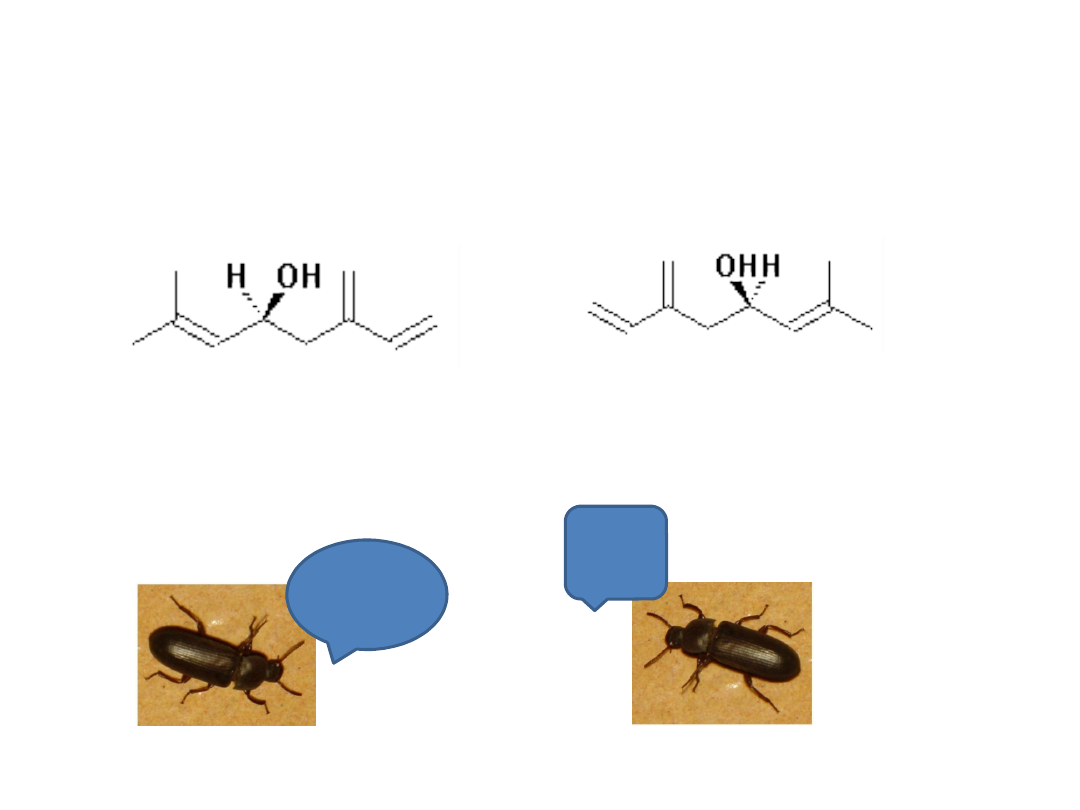
Feromony
(-) ipsendiol
(+) ipsendiol
Zgubiłem
się,
pomożes
z?
Ja nie
rozumieć,
Twojego
języka

Teorie na „lewoskrętność” przyrody
Oszczędność
Ostrożność
Stabilność
Przypadek
Ups!

Bibliografia
• W.M. Potapow ; tł. z ros. Zygmunt
Kałuski, Stereochemia, PWN,
Warszawa 1986.
• Ignacy Z. Siemon, Biostereochemia,
PWN Warszawa 1985
• John McMurry, Chemia organiczna,
2005 PWN W-wa
• Źródła internetowe
Document Outline
- Slide 1
- Izomeria konfiguracyjna heteroatomów
- Slide 3
- Slide 4
- Slide 5
- Stereochemia azotu aminy
- Slide 7
- Stereochemia azotu brak zjawiska inwersji
- Stereochemia azotu sole amoniowe
- Stereochemia azotu izmeria syn-anti
- Stereoizomeria azotu Wiązanie azot-azot
- Stereochemia fosforu
- Stereochemia fosforu
- Slide 14
- Stereochemia związków siarki
- Slide 16
- Określenie konfiguracji heteroatomu
- Chiralność w przyrodzie
- Glukoza
- Karwon
- Limonen
- Jonony
- Tryptofan i fenyloalanina
- Fluoksetyna
- Cholesterol
- Enzymy
- Hormony
- Feromony
- Teorie na „lewoskrętność” przyrody
- Bibliografia
Wyszukiwarka
Podobne podstrony:
Do prezentacji izomeria konfiguracyjna
Przykładowy sprawdzian z przyrody kl 4
konfiguracja eletronowa przykładowe zadania(1)
1 Klasyfikacja izomerów Izomeria konstytucyjna Izomeria konfiguracyjna i konformacyjna – zarys ogóln
konprzyrkl4[1], Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej
154 Podaj przyklady waznych wiazan wodorowych w przyrodzie
KONSPEKTi, Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej AR w
Przykłady pomysłów na działalność przyrodniczą, jakie nauczyciel może zrealizować na lekcjach z uczn
15[1], Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej AR w Lub
Izomeria rodzaje i przykłady
przyr1[1], Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej AR w
PROPONOWANE TREŚCI PRZYRODNICZO – EKOLOGICZNE i przykładowe scenariusze, nauczanie zintegrowane w kl
konspekt[1], Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej AR
nowy egzamin gimnazjalny p przyrodnicze 2012 przykładowy zestaw zadań
Identyfikacja leśnych siedlisk przyrodniczych NATURA 2000 na przykładzie Nadleśnictwa Oleśnica Śląsk
konprzyrkl4[1], Międzywydziałowe Studium Pedagogiczne Uniwersytetu Przyrodniczego w Lublinie dawniej
więcej podobnych podstron