
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Alicja Królak
Wykonywanie mikrobiologicznych badań żywności
321[09].Z4.04
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Teresa Kubiak – Zespół Szkół Ponadgimnazjalnych Nr 2 w Białymstoku
mgr inż. Aleksandra Ptak – Gagatek – Zespół Szkół Nr 1 w Wieluniu
Opracowanie redakcyjne:
Konsultacja:
mgr inż. Maria Majewska – Centrum Doradztwa Rolniczego w Brwinowie
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 321[09.Z4.04
„Wykonywanie mikrobiologicznych badań żywności”, zawartego w modułowym programie
nauczania dla zawodu technik technologii żywności.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Sprzęt i materiały do badań mikrobiologicznych
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
10
4.1.3. Ćwiczenia
10
4.1.4. Sprawdzian postępów
14
4.2. Wykonywanie oznaczeń bakteriologicznych w zakładach przetwórstwa
spożywczego
15
4.2.1. Materiał nauczania
15
4.2.2. Pytania sprawdzające
22
4.2.3. Ćwiczenia
22
4.2.4. Sprawdzian postępów
26
5. Sprawdzian osiągnięć
27
6. Literatura
31

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik
będzie
Ci
pomocny
w
przyswajaniu
wiedzy
dotyczącej
badań
mikrobiologicznych mających na celu wykrycie grup drobnoustrojów występujących
w badanym produkcie oraz określenie ich liczby w analizowanej próbce.
W poradniku zamieszczono:
−
wymagania wstępne, w których określono co powinieneś umieć przystępując do realizacji
tej jednostki modułowej,
−
cele kształcenia, które określają umiejętności jakie powinieneś opanować w wyniku
procesu kształcenia,
−
materiał nauczania, który pomoże Ci samodzielne przygotować się do wykonania ćwiczeń
i zaliczenia sprawdzianów. Wykorzystaj do poszerzenia wiedzy wskazaną literaturę oraz
inne źródła informacji. Obejmuje on również ćwiczenia zawierające polecenie, sposób
wykonania oraz wyposażenie stanowiska pracy.
−
sprawdzian postępów, który umożliwi Ci sprawdzenie poziomu wiedzy po wykonaniu
ćwiczeń,
−
wykaz literatury.
Sprawdzian osiągnięć opracowany jest w formie testu zawierającego:
−
instrukcję,
−
zestaw zadań testowych,
−
punktację zadań,
−
kartę odpowiedzi.
Bezpieczeństwo i higiena pracy
Przebywając w laboratorium analizy żywności musisz przestrzegać regulaminu pracowni,
przepisów bezpieczeństwa i higieny pracy oraz przepisów przeciwpożarowych. Przy
wykonywaniu ćwiczeń zachowaj ostrożność podczas ogrzewania roztworów. Postępuj
ostrożnie z roztworami kwasów i zasad szczególnie stężonych. Kwasy do pipety naciągaj za
pomocą pompki, a nie ustami.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
321[09].04
Analiza żywności w przetwórstwie spożywczym
321[09].04.01
Wykonywanie wagowej analizy żywności
321[09].04.02
Wykonywanie objętościowej analizy żywności
321[09].04.05
Wykonywanie towaroznawczych badań żywności
321[09].04.03
Wykonywanie
instrumentalnej analizy
żywności
321[09].04.04
Wykonywanie
mikrobiologicznych badań
żywności

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
korzystać z różnych źródeł informacji,
−
posługiwać się sprzętem laboratoryjnym,
−
korzystać z wag technicznych i analitycznych,
−
sączyć roztwory,
−
wskazywać zagrożenia związane z pracą w laboratorium oraz podczas wykonywania
ćwiczenia,
−
przeliczać stężenia,
−
interpretować wyniki badań laboratoryjnych,
−
stosować metody Dobrej Praktyki Laboratoryjnej,
−
korzystać z programów komputerowych,
−
korzystać z dokumentacji technicznej i technologicznej przy wykonywaniu badań
mikrobiologicznych,
−
ustalać punkty kontroli w procesach produkcji artykułów spożywczych poprzez
wykonywanie monitorujących analiz żywności,
−
zastosować zasady bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
określić niepożądane rodzaje drobnoustrojów w produktach spożywczych,
−
scharakteryzować czynniki i warunki przeciwdziałające rozwojowi szkodliwej mikroflory
w środkach spożywczych i przetwórniach surowców spożywczych,
−
określić wpływ zanieczyszczeń mikrobiologicznych żywności na zdrowie człowieka,
−
skorzystać z dokumentacji technicznej i technologicznej przy wykonywaniu badań
mikrobiologicznych żywności,
−
przygotować próbki do badań mikrobiologicznych,
−
wykonać badania mikrobiologiczne żywności,
−
wykonać badania mikrobiologiczne w zakładach przetwórstwa spożywczego,
−
zinterpretować wyniki badań mikrobiologicznych,
−
zarejestrować wyniki badań,
−
zastosować zasady Dobrej Praktyki Laboratoryjnej,
−
ustalić krytyczne punkty kontroli w procesach produkcji artykułów spożywczych poprzez
wykonywanie monitorujących analiz żywności (HACCP),
−
zastosować zasady bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
skorzystać z różnych źródeł informacji zawodowej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Sprzęt i materiały do badań mikrobiologicznych
4.1.1. Materiał nauczania
Szkło i sprzęt laboratoryjny
Sprzęt i materiały do badań powinny być czyste i wyjałowione. Szkło używane
w pracowniach mikrobiologicznych jeśli jest nowe należy przetrzymać je przez kilkanaście
minut w ok. 1-procentowym roztworze węglanu sodu w temperaturze ok. 50°C, a potem
umyć pod bieżącą ciepłą wodą. Na koniec należy umyć w zimnej wodzie destylowanej. Szkło
używane nie zawierające nie zawierające drobnoustrojów należy umyć w 2-procentowym
ciepłym roztworze mydła lub detergentu, następnie opłukać w zimnej wodzie destylowanej.
Naczynia zawierające hodowle mikroorganizmów należy moczyć w 10-procentowym
roztworze kwasu solnego lub w środkach odkażających w celu ich zabicia. Środkiem
odkażającym może być lizol. Naczynia można także wyjaławiać w temperaturze 121°C przez
30 minut potem, umyć w ciepłej wodzie bieżącej, a na koniec w zimnej destylowanej. Suszenie
szkła odbywa się na rozłożonych arkuszach czystego papieru lub bibuły filtracyjnej. Można
również suszyć je w suszarkach o temperaturze 40÷60°C. Wysuszone szkło poddaje się
wyjaławianiu. Kolby, butelki, probówki należy zatkać korkiem z waty. Do pipet należy włożyć
odpowiedniej wielkości tamponiki z waty. Pipety i probówki pakować należy po kilka sztuk
zawijając w papier. Butelki wyjaławiane są z korkami zakładając pomiędzy korki i szyjki paski
papieru. Same korki i szyjki również owijane są papierem i obwiązywane sznurkiem. Płytki
Petriego wyjaławiane są w specjalnie do tego celu przygotowanych metalowych puszkach,
owinięte także papierem jak inne szkło. Przygotowany sprzęt wyjaławiany jest przez 2 godziny
w suszarce o temperaturze 160°C lub w autoklawie przez 30 minut w temperaturze 121°C.
Naczynia szklane wstawiane do autoklawu owija się w pergamin. Sprzęt pomocniczy można
wyjaławiać przed użyciem zanurzając w 96-procentowym etanolu i opalenie w płomieniu
palnika gazowego.
Pożywki i podłoża hodowlane
Do hodowli drobnoustrojów oraz ich identyfikacji jakościowych lub ilościowych
stosowane są pożywki hodowlane. Pożywki są to roztwory wodne substancji odżywczych.
Podłoża hodowlane to pożywki zestalone agar-agarem lub żelatyną. Podobnie jak pożywki
służą do identyfikacji jakościowej oraz do ilościowego oznaczania drobnoustrojów. Dobór
pożywek i podłóż do hodowli drobnoustrojów jest zależny od właściwości fizycznych
i chemicznych środowiska. Powinny one spełniać określone wymagania w zakresie jakości,
mianowicie:
−
muszą zawierać wszystkie składniki pokarmowe w odpowiednich stężeniach niezbędnych
do optymalnego wzrostu drobnoustrojów,
−
wykazywać właściwy odczyn środowiska,
−
powinny być przejrzyste, ponieważ ułatwiona jest wówczas obserwacja wzrostu i liczenie
kolonii drobnoustrojów,
−
muszą być jałowe, nie zawierać żywych drobnoustrojów, ich form przetrwalnikujących ani
zarodników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Pożywki i podłoża mogą być ogólne i wybiórcze. Do najczęściej stosowanych ogólnych
pożywek w analizie mikrobiologicznej jest niechmielona brzeczka piwna oraz bulion czyli
wyciąg mięsny z dodatkiem peptonu i chlorku sodu doprowadzony do pH 7,8.
Brzeczka piwna stosowana jest do hodowli pleśni i drożdży, natomiast bulion do hodowli
bakterii. Pożywki hodowlane wybiórcze przygotowywane są z mleka odtłuszczonego, serwatki
lub hydrolizatów białkowych.
Przygotowanie pożywek i podłóż hodowlanych
Wyciąg mięsny otrzymywany jest z mięsa końskiego lub wołowego oczyszczonego ze
ścięgien i tłuszczu. Rozdrobnione mięso zalewa się wodą w stosunku 1: 2 i pozostawia
w lodówce na 12÷15 godzin. Po upływie tego czasu gotuje się całość przez 30 minut,
następnie sączy przez lnianą tkaninę. Otrzymany wyciąg rozlewa się do butelek i wyjaławia w
autoklawie przez 30 minut w temperaturze 121°C. Wyciąg można przechowywać w lodówce i
używać jako składnika pożywek i podłoży hodowlanych po uprzednim przesączeniu przez
sączek z waty.
Podłoże Endo:
bulion zwykły – 1000 cm
3
,
woda destylowana doprowadzona do pH 6,5 – 2000 cm
3
,
pepton,
chlorek sodu – 10 g,
agar – 60 g,
laktoza – 30 g,
fuksyna zasadowa roztwór alkoholowy 3% – 30 cm
3
,
siarczyn sodu, roztwór wodny 10% - 160 cm
3
,
wodorotlenek sodu, roztwór wodny 10% - do zobojętnienia.
Do zlewki o pojemności 4 dm
3
odmierzyć wodę destylowaną, dodać agar-agar i ogrzewać
w autoklawie do chwili upłynnienia. Dodać bulion mięsny, pepton, chlorek sodu i laktozę.
Mieszać do rozpuszczenia się składników. Doprowadzić pH do 7,8 dodając z biurety 10%
roztwór NaOH. Tak przygotowane podłoże rozlać do kolb stożkowych o pojemności 150 cm
3
każda i wyjaławiać 30 minut w temperaturze 117°C. Przed użyciem do badań podłoże należy
upłynnić ogrzewając kolby w kąpieli wodnej. Następnie dodaje się fuksyny zasadowej
(1÷1,5 cm
3
na każde 150 cm
3
płynu) oraz 10% roztwór siarczynu sodu do chwili zabarwienia
się podłoża na bladoróżowy kolor. Podłoże rozlewa się na płytki Petriego i przechowuje
w ciemnym miejscu do czasu prowadzenia badań mikrobiologicznych, nie dłużej jednak niż
dwa dni.
Pożywka Eijkmana:
woda destylowana – 1000cm
3
,
pepton – 10 g,
chlorek sodu – 5 g,
laktoza – 10 g,
purpura bromokrezolowa, 1% roztwór w 50% etanolu – 1cm
3
,
wodorotlenek sodu, roztwór wodny 10% - do zobojętnienia.
Odmierzyć wodę destylowaną do zlewki o pojemności 2 dm
3
, dodać pepton i chlorek
sodu, mieszać bagietką do rozpuszczenia składników. Doprowadzić roztwór do pH 6,8÷7,0
dodając z biurety 10% roztwór NaOH. Zawartość zlewki ogrzać do wrzenia i sączyć na
gorąco przez bibułę filtracyjną. Do przesączu dodać laktozę i wskaźnik. Pożywkę rozlać do

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
probówek z rurkami Durhama, zamknąć korkami z waty i wyjaławiać 30 minut w temperaturze
117°C.
Roztwór soli fizjologicznej:
woda destylowana – 1000 cm
3
,
chlorek sodu – 9 g,
Chlorek sodu rozpuszcza się w wodzie destylowanej, rozlewa roztwór do kolb stożkowych
i wyjaławia 10 minut w temperaturze 121°C.
Płyn Lugola:
woda destylowana – 300cm
3
,
jodek potasu – 2g,
jod – 1g.
Pobrać 20 cm
3
wody destylowanej do butelki z ciemnego szkła zamykanej doszlifowanym
korkiem, dodać jodek potasu, a po jego rozpuszczeniu jod. Całość mieszać do rozpuszczenia
jodu. Dodać pozostałą część wody destylowanej i wymieszać. Przechowywać do czasu badań
analitycznych.
Sporządzanie preparatów bakterioskopowych. Barwienie metodą Grama.
Charakter lub liczbę drobnoustrojów w badanym produkcie określa się za pomocą
preparatów mikroskopowych. Oglądane są one pod mikroskopem przy odpowiednio
dobranym powiększeniu.
Preparaty bakteriskopowe można wykonać np. z mięsa lub jego przetworów. Są to
preparaty odciskowe, które barwi się metodą Grama. Kolejność postępowania przy barwieniu
metodą Grama jest następująca:
−
przygotowanie preparatu odciskowego z mięsa chudego,
−
wysuszenie preparatu,
−
barwienie roztworem fioletu krystalicznego,
−
działanie na preparat płynem Lugola,
−
spłukiwanie preparatu 96% alkoholem etylowym do odbarwienia,
−
barwienie fuksyną fenolową,
−
spłukiwanie wodą destylowaną,
−
suszenie preparatu bibułą i obserwacja pod mikroskopem.
Barwienie preparatu metodą Grama umożliwia rozpoznanie charakteru występującej
mikroflory. Do bakterii Gram-dodatnich, które barwią się na fioletowo, należą między innymi
bakterie z rodziny Bacillaceae (rodzaje Bacillus – tlenowe laseczki przetrwalnikujące
i Clostridium – beztlenowe laseczki przetrwalnikujące, gronkowce chorobotwórcze oraz
bakterie fermentacji mlekowej). Natomiast do bakterii Gram-ujemnych, które barwią się na
czerwono, zalicza sięrodzinę Enterobacteraceae (są to pałeczki z grupy okrężnicy, z grupy
Salmonella i inne).
Płyn Ringera
woda destylowana – 1000cm
3
,
chlorek sodu – 9g,
chlorek potasu – 0,42g,
chlorek wapnia bezwodny – 0,24g,
wodorowęglan sodu – 0,20g,
Wodę destylowaną należy ogrzać do wrzenia, dodać pozostałe składniki, mieszać do
całkowitego rozpuszczenia. Płyn rozlać do kolb stożkowych i wyjaławiać przez 20 minut
w temperaturze 121°C.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Rys. 1. Cieplarka laboratoryjna CLN 53 [8]
Cieplarka posiada naturalny obieg powietrza i mikroprocesorowy sterownik temperatury
i czasu. Wnętrze i obudowa komory zbudowane są ze stali nierdzewnej.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie znasz metody badań mikrobiologicznych?
2. Jakich roztworów należy używać do mycia naczyń i sprzętu w laboratorium
mikrobiologicznym?
3. Jakie są warunki wyjaławiania sprzętu do badań mikrobiologicznych?
4. Jakie znasz rodzaje pożywek i podłóż hodowlanych?
5. Jak przygotować preparat bakterioskopowy?
4.1.3. Ćwiczenia
Ćwiczenie 1
Porównaj wyposażenie i urządzenia laboratorium szkolnego i zakładowego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wymienić sprzęt i szkło znajdujące się w laboratorium szkolnym,
2) wymienić sprzęt i szkło stosowane w laboratorium zakładowym,
3) porównać wyposażenie, urządzenia i sprzęt laboratoriów zakładowego i szkolnego,
4) wyciągnąć wnioski dotyczące różnicy w oznaczeniach wykonywanych w laboratorium
szkolnym i zakładowym.
Wyposażenie stanowiska pracy:
−
schemat, mikrobiologicznego laboratorium zakładowego,
−
foldery z urządzonymi laboratoriami zakładów przetwórstwa spożywczego,
−
zdjęcia, foldery mikrobiologicznego laboratorium analiz żywności Terenowej Stacji
Sanitarno- Epidemiologicznej ewentualnie spostrzeżenia z wycieczki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Ćwiczenie 2
Przygotuj sprzęt i szkło do badań mikrobiologicznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przetrzymać nowe szkło w 1- procentowym roztworze węglanu sodu w temperaturze
50°C,
2) umyć w bieżącej, ciepłej wodzie,
3) umyć w zimnej wodzie destylowanej,
4) odstawić do suszenia w powietrzu rozłożone na arkuszach czystego papieru lub bibuły
filtracyjnej lub suszyć w suszarkach o temperaturze 40÷60°C,
5) umyć szkło używane w 2-procentowym ciepłym roztworze mydła lub detergentu,
6) wypłukać w ciepłej wodzie bieżącej, a potem w zimnej destylowanej,
7) suszyć jak w punkcie 4,
8) namoczyć naczynia zawierające hodowle drobnoustrojów w 10-procentowym roztworze
kwasu siarkowego lub w środkach odkażających np. w 2-procentowym lizolu,
9) umyć w ciepłej bieżącej wodzie,
10) umyć w zimnej wodzie destylowanej,
11) suszyć jak podano w punkcie 4,
12) zatkać korkami z waty kolby, butelki, probówki, pipety,
13) zapakować w papier pipety i probówki (po kilka sztuk),
14) włożyć paski papieru pomiędzy korki i szyjki butelek z doszlifowanymi korkami,
15) owinąć korki i szyjki butelek papierem i obwiązać sznurkiem,
16) wyjaławiać sprzęt przez 2 godziny w suszarce o temperaturze 160°C lub 30 minut
w autoklawie o temperaturze 121°C,
17) zanurzyć sprzęt metalowy w 96-procentowym etanolu,
18) opalić w płomieniu palnika gazowego.
Wyposażenie stanowiska pracy:
−
sprzęt i szkło laboratoryjne,
−
roztwory do mycia: 1-procentowy roztwór węglanu sodu, 2-procentowy roztwór mydła,
−
woda destylowana,
−
lizol,
−
10%H
2
SO
4
,
−
wata,
−
papier,
−
bibuła,
−
palnik gazowy,
−
suszarki do wyjaławiania szkła laboratoryjnego
Ćwiczenie 3
Przygotuj 1500 cm
3
niechmielonej brzeczki piwnej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) wytarować garnek emaliowany z łopatką,
2) dodać 200 g słodu mielonego oraz 1,2 dm
3
wody wodociągowej,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
3) ustawić garnek z zawartością na trójnogu,
4) ogrzewać do temperatury 45°C utrzymując w tym stanie przez 30 minut,
5) ogrzewać garnek do temperatury 70°C (1°C na 1 minutę),
6) utrzymywaać temperaturę końcową przez 10 minut,
7) sprawdzić stopień scukrzenia przenosząc bagietką kroplę zacieru na bloczek gipsowy,
8) zadać kroplą płynu Lugola, (żółte zabarwienie świadczy o pełnym scukrzeniu, niebieskie
o niepełnym),
9) schłodzić po osiągnięciu pełnego scukrzenia,
10) uzupełnić wodą masę do 1800 g,
11) wymieszać, odsączyć przez lnianą tkaninę,
12) zebrać przesącz do kolby okrągłodennej o pojemności 1,5 dm
3,
13) wyjałowić w temperaturze 121° przez 30 minut,
14) schłodzić i sklarować utrwaloną brzeczkę pozostawiając na kilka godzin,
15) sprawdzić gęstość areometrem Ballinga,
16) doprowadzić stężenie do 10°Blg przez dodanie odpowiedniej ilości wody,
17) przesączyć brzeczkę przez sączek z bibuły filtracyjnej,
18) rozlewać do butelek o pojemności 250 cm
3
,
19) zamknąć butelki korkami z waty,
20) utrwalić brzeczkę temperaturze 117°C w czasie 30 minut.
Wyposażenie stanowiska pracy:
–
słód browarniany mielony – 200 g,
–
garnek emaliowany o pojemności 2 dm
3
,
–
łopatka drewniana,
–
trójnóg,
–
pinceta,
–
palnik gazowy,
–
termometr o zakresie temperatur 0÷150°C,
–
bagietka szklana,
–
bloczek gipsowy,
–
areometr Ballinga o zakresie 0 ÷25°Blg,
–
cylinder szklany o pojemności 250 cm
3
,
–
tkanina lniana,
–
sączek z bibuły filtracyjnej,
–
butelki o pojemności 250 cm
3
– 6 sztuk,
–
kolba okrągłodenna o pojemności 1,5 dm
3
,
–
autoklaw.
Ćwiczenie 4
Przygotuj bulion zwykły.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować wyciąg mięsny według niżej podanego przepisu,
a) rozdrobnić w maszynce do mięsa 1 kg mięsa wołowego lub końskiego,
b) przełożyć do garnka emaliowanego i zalać 2,2 dm
3
wody destylowanej,
c) wstawić do lodówki na 12÷15 godzin,
d) gotować następnego dnia 30 minut,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
e) przesączyć przez płótno,
f) rozlać do kolb lub butelek,
g) wyjaławiać przez 20 minut w temperaturze 121°C,
h) wyciąg przechowywać w chłodni, a przed użyciem, jako składnika podłoży
przesączyć przez watę,
2) przygotować bulion zwykły zgodnie z podanym niżej przepisem,
a) zmieszać 1000cm
3
wyciągu mięsnego z 10g peptonu i 5g chlorku sodu w garnku
emaliowanym,
b) doprowadzić odczyn do pH 7,8 za pomocą 10-procentowego NaOH,
c) ogrzewać 30 minut w temperaturze 121°C,
d) skorygować odczyn do pH 7,8,
e) przesączyć przez bibułę i rozlać do kolb lub probówek,
f) wyjaławiać w temperaturze 121°C przez 20 minut, pH 7,4÷ 7,6.
Wyposażenie stanowiska pracy:
−
mięso wołowe lub końskie 1 kg,
−
woda destylowana,
−
wyciąg mięsny,
−
pepton,
−
chlorek sodu,
−
garnek emaliowany,
−
butelki,
−
autoklaw.
Ćwiczenie 5
Przygotuj preparaty do badań mikroskopowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować preparat odciskowy z mięsa chudego (przeprowadź odtłuszczanie szkiełka
wyjętego z etanolu, wycierając go miękką ściereczką do sucha, a następnie przetrzeć
kawałkiem suchego mydła i ponownie wytrzeć ściereczką. Szkiełko przepalić w płomieniu
i odcisnąć na nim powierzchnię cięcia badanej próbki mięsa tak, aby otrzymany ślad był
wyraźny, cienki i bez wolnych przestrzeni),
2) wysuszyć przygotowany preparat,
3) utrwalić preparat,
4) barwić preparat roztworem fioletu krystalicznego,
5) działać na preparat płynem Lugola,
6) spłukać preparat 96-procentowym alkoholem etylowym, aż do odbarwienia,
7) barwić preparat fuksyną fenolową (rozcieńczoną dziesięciokrotnie),
8) spłukać wodą destylowaną,
9) osuszyć preparat bibułą i obserwować pod mikroskopem używając obiektywu
immersyjnego,
10) określić charakter mikroflory licząc w 40 polach widzenia ziarniaki, pałeczki Gram-
dodatnie oraz pałeczki Gram-ujemne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Wyposażenie stanowiska pracy:
−
mięso chude,
−
roztwór fioletu krystalicznego,
−
płyn Lugola,
−
alkohol etylowy,
−
fuksyna fenolowa,
−
bibuła,
−
szkiełko przedmiotowe,
−
mikroskop.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia pożywki i podłoża hodowlanego?
2) przygotować sprzęt i materiały do badań mikrobiologicznych?
3) przygotować podłoża i roztwory do badań bakteriologicznych?
4) dobrać pożywki i podłoża hodowlane zależnie od wymagań
drobnoustrojów?
5) wyjałowić szkło i sprzęt laboratoryjny?
6) przygotować płytki Petriego do posiewu?
7) przygotować probówki z rurkami Durhama do posiewu?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.2. Wykonywanie oznaczeń bakteriologicznych w zakładach
przetwórstwa spożywczego
4.2.1. Materiał nauczania
Zasady przygotowania próbek do badań i posiewów
Przygotowanie próbek do orientacyjnego określenia stopnia zakażenia polega na jałowym
podzieleniu próbki (ok. mięsa) wielkości 20 g w taki sposób, aby otrzymać jeden kawałek
wielkości 10 g (przeznaczony do posiewów na podłoże stałe), natomiast resztę należy
podzielić na kawałki ok. 1 g (przeznaczenie na podłoże płynne).
Przygotowanie próbek do badań ilościowych polega na wykonaniu rozcieńczeń.
Rozróżnia się dwa sposoby rozcieńczeń. Pierwszy sposób stosowany jest w przypadku
oznaczania ogólnej liczby drobnoustrojów w 1 g lub miana. Drugi sposób ma miejsce, gdy
celem badań jest określenie liczby drobnoustrojów na powierzchni 1 cm
2
lub miana z 1 cm
2
.
Oznaczanie ogólnej liczby drobnoustrojów
Produkty spożywcze, surowce roślinne i zwierzęce stanowią dobre źródło rozwoju
drobnoustrojów, które powodują niekorzystne zmiany sensoryczne, a także zmiany składu
chemicznego. Zachodzi konieczność dokonywania oceny żywności pod względem zakażenia
drobnoustrojami. Wynik oznaczania ogólnej liczby drobnoustrojów w surowcach pozwala na
określenie jakości higienicznej surowców, ich przydatności do przerobu, jakości i trwałości
otrzymanych z tych surowców produktów. W przypadku oznaczania ogólnej liczby
drobnoustrojów w wyrobach gotowych wynik pozwala dokonać oceny:
−
prawidłowości procesów technologicznych,
−
warunków higienicznych, w jakich odbywała się produkcja,
−
jakości i trwałości mikrobiologicznej ocenianych wyrobów.
Wymagania ilościowe podane są w normach jakościowych. Do oznaczania ogólnej liczby
drobnoustrojów stosowane są dwie metody:
−
metoda reduktazowa,
−
hodowlana metoda płytkowa.
Metoda reduktazowa należy do metod orientacyjnych i sprowadza się do określenia
stopnia zakażenia środowisk drobnoustrojami. Polega na obserwacji czasu odbarwiania się
barwników oksydoredukcyjnych (błękit metylenowy, rezazuryna) w badanych środowiskach,
po inkubacji w określonych warunkach temperatury.
Metodę reduktazową stosuje się do szybkiej oceny jakości bakteriologicznej mleka
surowego. Stwierdzono, że czas odbarwiania barwników oksydoredukcyjnych w mleku jest
tym krótszy, im więcej zawiera ono drobnoustrojów.
Drobnoustroje w wyniku procesu oddychania wydzielają wodór, który wiąże najpierw tlen
zawarty w mleku, a po wyczerpaniu się tlenu akceptorami wodoru są dodane barwniki
oksydoredukcyjne: błękit metylenowy lub rezazuryna. Barwniki redukując się przechodzą
w bezbarwne formy, czyli leuko.
Błękit metylenowy dodany do mleka barwi je na niebiesko. Po redukcji błękitu
metylenowego do formy leukozwiązku barwa znika. W próbie z rezazuryną bezpośrednio po
jej wymieszaniu z mlekiem barwa jest stalowoniebieska, następnie przechodzi w różową, a po
całkowitej redukcji rezazuryny następuje całkowicie odbarwia się. Czas odbarwiania
barwników w mleku waha się od kilku minut do kilku godzin w zależności od zakażenia
mleka. Im bardziej zakażone tym czas odbarwiania dłuższy.
Hodowlana metoda płytkowa sprowadza się do posiewu pewnych ilości środowisk
(surowca, produktu) do podłoża ogólnego w płytkach Petriego i policzenia kolonii wyrosłych
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
drobnoustrojów na zestalonym podłożu. Pod pojęciem kolonii drobnoustrojów rozumie się
zespół komórek widoczny makroskopowo, powstały z rozmnożenia jednej komórki na
podłożu stałym, w odizolowaniu od innych komórek.
Używaną do posiewu ilość surowca lub produktu uzależnia się od spodziewanej w nim
liczby drobnoustrojów. Zakłada się, że z jednej komórki wyrasta kolonia i że każda komórka
jest w stanie rozmnożyć się i utworzyć swoją kolonię. Nie zawsze założenia te są ścisłe.
Czasami poza pojedynczymi komórkami mogą występować zespoły komórek w postaci
gronek lub łańcuszków, które dają pojedyncze kolonie. Ponadto nie wszystkie komórki
rozwijają swoje kolonie ze względu na brak optymalnych warunków rozwoju. Metodę
płytkową uważa się za porównawczą. Określa ona liczbę żywych komórek w badanych
środowiskach, zdolnych do rozwoju na użytych podłożach i w danych warunkach hodowli.
W zależności od badanego środowiska stosuje się różne podłoża hodowlane. W celu uzyskania
porównywalnych wyników oznaczeń ogólnej liczby drobnoustrojów metodą płytkową należy
przestrzegać ściśle tego samego sposobu postępowania, w którym wyróżnia się podstawowe
etapy:
−
przygotowanie odpowiedniego rozcieńczenia badanego środowiska,
−
dokonanie posiewu,
−
hodowla drobnoustrojów,
−
liczenie kolonii i interpretacja wyników.
Surowce roślinne zawierają zwykle dużą liczbę drobnoustrojów, dlatego przed posiewem
na zestalone podłoże należy je rozcieńczyć jałowym roztworem soli fizjologicznej lub płynem
Ringera w odpowiednim stosunku, aby po inkubacji liczba kolonii wyrosłych na płytce
Petriego mieściła się w zakresie 30÷300. Rozcieńczenia wykonuje się w butelkach
o pojemności 200 cm
3
lub 20 cm
3
, do których pobiera się odpowiednio 90 lub 9 cm
3
rozcieńczalników, (sól fizjologiczna, płyn Ringera). Rozcieńczalnik może być wyjałowiony lub
można go wyjaławiać w butelkach w autoklawie. Z badanej próbki surowca należy pobrać
10cm
3
produktu lub odważyć 10 g i przenieść do butelki zawierającej 90 cm
3
rozcieńczalnika.
Zawartość butelki wymieszać dokładnie. W ten sposób otrzymuje się rozcieńczenie próbki
pierwotnej 1:10. Pobierając z tej próbki inną jałową pipetą 1 cm
3
i przenosząc do następnej
butelki zawierającej 9 cm
3
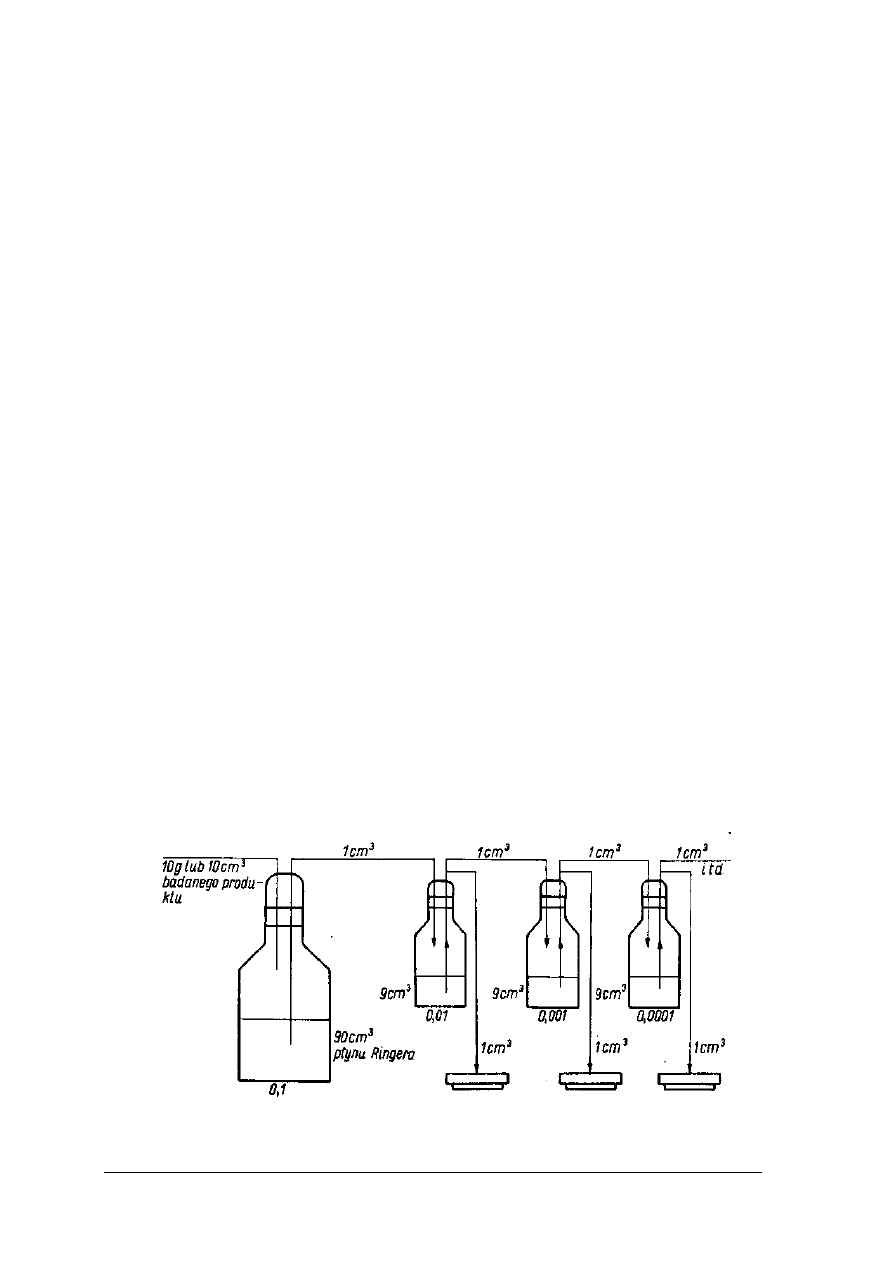
rozcieńczalnika uzyskuje się rozcieńczenie 1:100 itd. Schematycznie
sposób rozcieńczania przedstawia rysunek 1. Postępując analogicznie uzyskuje się żądane
rozcieńczenie próbki pierwotnej. Z ostatniego rozcieńczenia pobiera się 1 cm
3
do posiewu na
podłoże hodowlane w płytce Petriego.
Rys. 2. Schemat przygotowywania rozcieńczeń do posiewu [3, s. 406]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
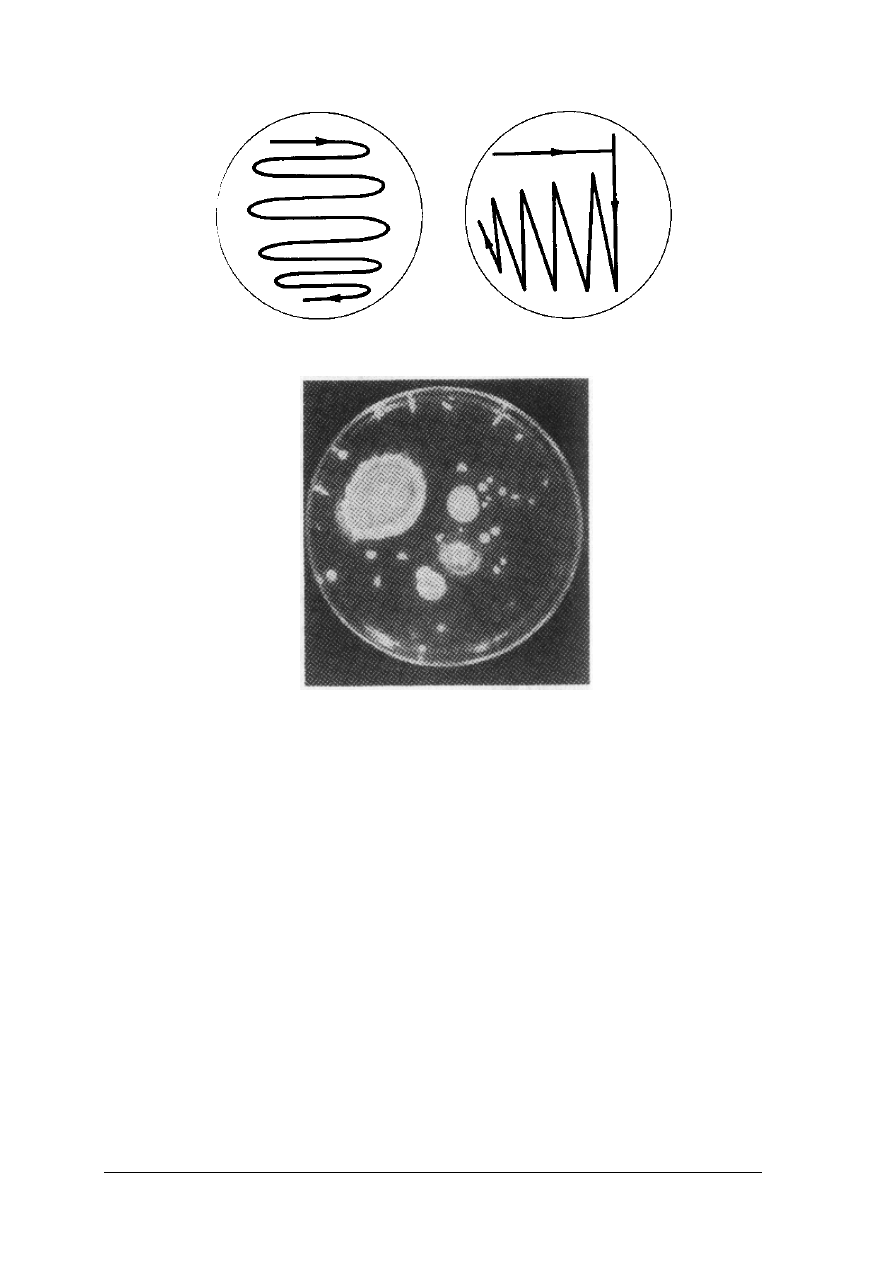
Rys.3. Przykłady posiewu rysowego [3, s. 104]
Rys. 4. Różne kształty kolonii drobnoustrojów [3, s. 99]
W celu wykonania posiewu należy pobrać pipetą 1 cm
3
płynu z odpowiedniego
rozcieńczenia, uchylić lekko wieczko płytki Petriego wprowadzić koniec pipety do środka
i wdmuchnąć delikatnie zawartość pipety nie dotykając dna płytki i unikając rozprysku płynu.
Następnie należy wlać podłoże hodowlane uprzednio upłynnione we wrzącej łaźni wodnej
i ochłodzone do temperatury 47÷50°C. Przed wylaniem podłoża na płytki Petriego naczynie
z pożywką otwiera się tuż przy płomieniu palnika gazowego, opala się brzegi i szyjkę,
a następnie wylewa płynne podłoże do płytki mieszając ruchem kołowym. Płytki pozostawia
się na ok. 15 minut na czas skrzepnięcia agaru, po czym odwraca do góry dnem w celu
zapobieżenia kondensacji pary wodnej na powierzchni podłoży. Płytki wstawia się do cieplarki,
układając jedną na drugiej, nie więcej niż 4 w jednym słupku. Jednocześnie wkłada się do
cieplarki dwie płytki kontrolne.
Hodowlę prowadzi się w temperaturze 28÷30°C przy swobodnym dostępie tlenu do
podłoża, gdyż najczęściej oznacza się liczbę drobnoustrojów tlenowych, mezofilnych. Czas
hodowli wynosi trzy doby, co zapewnia możliwość obserwacji kolonii wyrosłych gołym okiem.
Liczenie kolonii odbywa się przy wykorzystaniu płytek kontrolnych całkowicie wolnych
od drobnoustrojów. Do obliczeń pobiera się płytki z posiewami z dwu kolejnych rozcieńczeń,
z liczbą kolonii mieszczącą się w zakresie 10÷300, a policzone kolonie zaznacza się
dermatografem na zewnętrznej powierzchni denka płytki. Sumuje się liczby kolonii
z poszczególnych płytek dla tego samego rozcieńczenia i dzieli przez liczbę płytek uzyskując
średnią liczbę kolonii dla jednej płytki.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Liczbę mnoży się przez dzielnik krotności rozcieńczenia (10, 100, itd.) co daje liczbę
kolonii drobnoustrojów w 1cm
3
lub 1g badanego surowca lub produktu. Jeżeli wyniki
oznaczeń dla dwu kolejnych rozcieńczeń nie różnią się o więcej niż 10% jako ostateczny wynik
przyjmuje się wartość średniej arytmetycznej uzyskanych wyników. W innym przypadku za
podstawę przyjmuje się wyniki uzyskane przy zastosowaniu większego rozcieńczenia.
Kolonie wyrosłe w postaci smug przyjmuje się za kolonie pojedyncze. Jeśli kolonie
zajmują więcej niż połowę powierzchni podłoża płytki eliminuje się z oznaczeń, jako płytki
zalane.
Uzyskane wyniki ogólnej liczby drobnoustrojów w surowcach lub produktach przemysłu
spożywczego porównuje się z wymaganiami norm jakościowych. Zgodność uzyskiwanych
wyników z normami jest podstawą do uznania wyrobu za nadający się do spożycia. Po analizie
sensorycznej i składu chemicznego do zaliczenia wyrobu do odpowiedniej klasy jakości.
Oznaczanie miana coli w produktach spożywczych
W przemyśle spożywczym znajdują się bardzo dobre warunki do rozwoju bakterii coli
czyli pałeczki okrężnicy należącej do enterobakterii. Bakterie te występują w przewodzie
pokarmowym, a także w odchodach, skąd dostają się do wody. Obecność większej liczby
bakterii coli świadczy o niskim poziomie higieny produkcji w zakładach przetwórstwa
spożywczego. Dodatkowym źródłem zanieczyszczeń może być brak higieny osobistej
personelu zatrudnionego przy produkcji. W analizie mikrobiologicznej produktów
spożywczych oznacza się bakterie coli jako miano coli tj. najmniejszą ilość produktu
(w gramach lub cm
3
), w której stwierdza się jeszcze występowanie pałeczki okrężnicy. Do
oznaczeń stosuje się metodę hodowlaną w pożywce płynnej. Wykorzystuje się zdolność
bakterii coli do fermentacji laktozy z wytworzeniem gazów CO
2
i H
2
, które zbierają się
w zanurzonych w pożywce rurkach Durhama. Do oznaczania miana coli konieczne jest
dokonywanie posiewów z wielu rozcieńczeń badanego produktu do pożywki płynnej. Pożywki
poddaje się inkubacji w temperaturze 37°C przez 48 godzin, następnie prowadzi się
obserwację, czy w rurkach Durhama pojawia się gaz. Rozcieńczenia muszą być tak dobrane,
by co najmniej w jednej probówce z posiewem odpowiadającym największemu rozcieńczeniu
badanego produktu nie było już wzrostu bakterii Coli (brak gazu w rurce). W przeciwnym
wypadku wynik oznaczenia nie będzie ściśle określony. Największe rozcieńczenie przyjmuje
się za podstawę obliczeń miana coli, przy czym ilość gazu w rurce Durhama musi wynosić co
najmniej 10% objętości rurki.
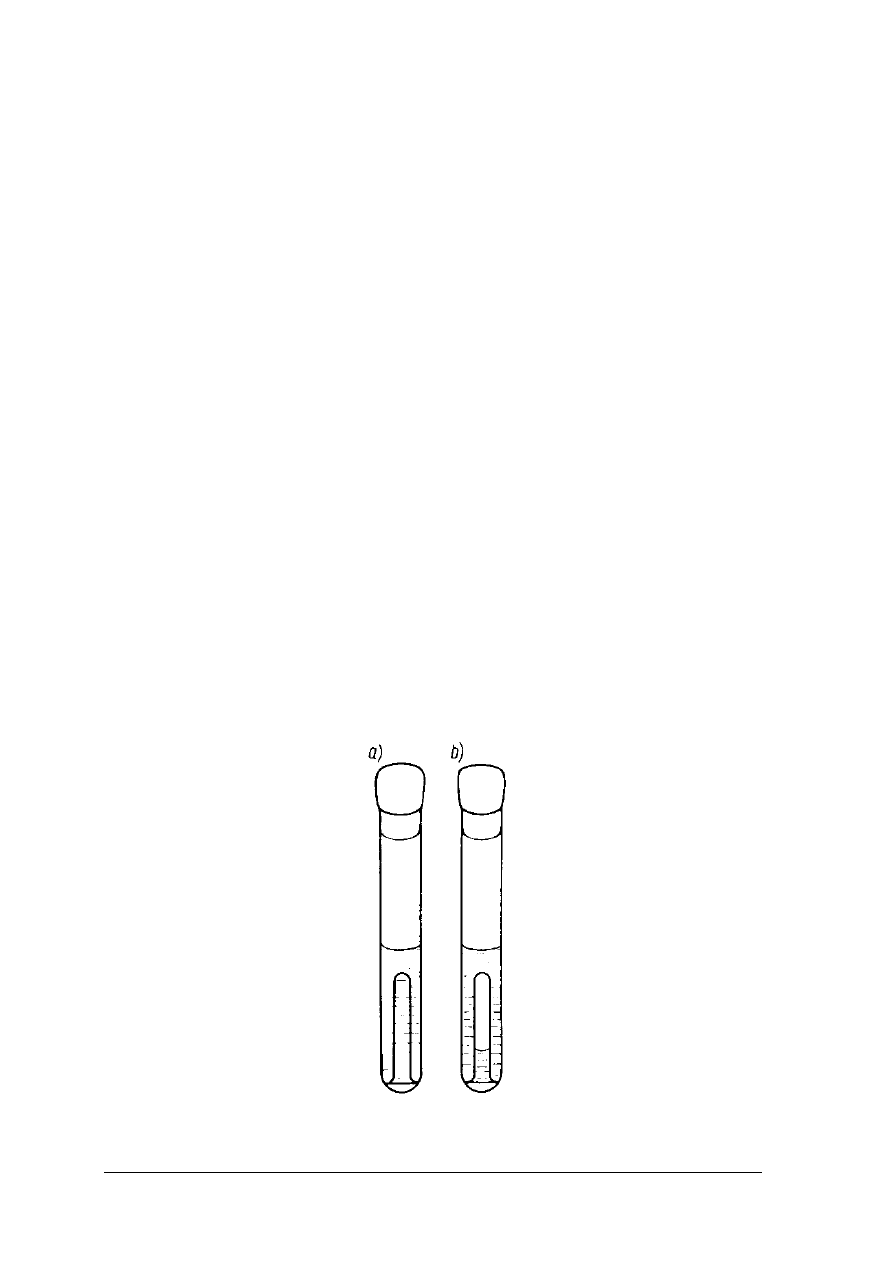
Rys. 5. Probówki z pożywką i rurkami Durhama [4, s. 409]
a) rurka Durhama wypełniona pożywką (bez gazu), b) rurka Durhama częściowo napełniona gazem
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Miano coli zapisuje się w postaci ułamka dziesiętnego, który oznacza ilość badanego
produktu wprowadzonego do probówki z pożywką. Jeśli na przykład gaz występuje w rurkach
Durhama w probówkach, do których posiano po 1 cm
3
z rozcieńczeń 10
-1
i 10
-3
, a przy
posianiu dalszych rozcieńczeń gaz już nie występuje wówczas miano coli wynosi 0,001.
Oznacza to, że w objętości 0,001 cm
3
próbki pierwotnej występowała co najmniej jedna
komórka bakterii coli. Gdy gaz był obecny we wszystkich próbkach z przygotowanych
rozcieńczeń badanego produktu wówczas podaje się słownie, że miano coli jest niższe od ok.
0,01; 0,001. Jeśli nie stwierdza się obecności coli w żadnym z rozcieńczeń należy podać, ze
miano coli jest wyższe od najmniejszego rozcieńczenia, ok. od 0,1 lub 0,001.
Rys.6. Anaerostat [3, s.107]
Zasady hodowli beztlenowców
Wyhodowanie beztlenowców wymaga usunięcia tlenu ze środowiska, gdyż przy dostępie
tlenu komórki wegetatywne beztlenowców szybko giną. Występuje kilka metod hodowli
bakterii beztlenowych, mianowicie:
−
hodowla na pożywce płynnej pod warstwą oleju parafinowego, przy czym do pożywki
dodaje się substancje pochłaniające tlen(np. kostki wątroby w podłożu Wrzoska),
−
hodowla w specjalnych aparatach aerostatach (rys. 6), z których usuwa się powietrze za
pomocą pompy próżniowej (po uprzednim umieszczeniu hodowli), a następnie wstawia się
je do cieplarki,
−
hodowla w wysokim słupku agaru lub żelatyny, na powierzchnię którego wprowadza się
dodatkowo warstwę agaru lub żelatyny, przez co zamyka się dostęp powietrza do podłoża,
−
hodowla w warunkach beztlenowych wywołanych usunięciem tlenu środkami
chemicznymi,
−
hodowla symbiotyczna beztlenowców z tlenowcami polegająca na tym, że na jednej
połowie płytki posiewa się bakterie tlenowe, a na drugiej beztlenowe. Płytkę z posiewami
zamyka się szklaną taflą, a brzegi oblepia plasteliną. Tlenowce w czasie wzrostu zużywają
tlen zawarty w podłożu i naczyniu, stwarzając w ten sposób odpowiednie warunki
rozwoju beztlenowców.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Oznaczanie obecności pałeczek duru i czerwonki
Badania obecności pałeczek duru i czerwonki wykonuje się w przypadku wystąpienia
zatruć pokarmowych lub podejrzenia o zakażenie produktów tymi bakteriami. W badaniach
wstępnych stosowane są:
−
dwa płynne podłoża namnażające: podłoże z czterotionianem sodu według Kauffmana
oraz podłoże z kwaśnym selenitem sodu (podłoże SF);
−
podłoża stałe wybiórczo-różnicujące: podłoże Mac Conkeya i podłoże „SS”.
W wymienionych badaniach należy posiać duże ilości badanego materiału (25g) w celu
zwiększenia możliwości wykrycia bakterii rodzaju Salmonella i Shiggella, ponieważ nie mają
one warunków do rozwoju w produktach spożywczych.
Podłoże z czterotionianem sodu według Kauffmana
−
Bulion o pH 7,4÷7,6
- 900,0 cm
3
−
Węglan wapnia
- 45,0 g
−
Jod w roztworze wodnym jodku potasu
- 20,0 cm
3
−
Tiosiarczan sodu (Na
2
S
2
O
3
· 5H
2
O)
- 100,0 cm
3
−
Zieleń brylantowa, roztwór 0.1%
- 10,0 cm
3
−
Żółć bydlęca
- 50,0 cm
3
Przygotowanie składników:
1. Węglan wapnia wyjałowić w kolbie poj. 2dm
3
w suszarce w temp. 160ºC w ciągu 60 min.
2. W 100 cm
3
wody destylowanej rozpuścić 25g jodku potasu, a następnie 20g jodu.
3. 50 g tiosiarczanu sodu rozpuścić w 100cm
3
wody destylowanej i wyjałowić w autoklawie
w temp.120ºC w ciągu 15 min.
4. Żółć bydlęcą przesączyć przez watę i wyjaławiać w autoklawie w temp.120ºC w ciągu
30 min.
Przygotowanie podłoża
Do kolby z węglanem wapnia dodać w sposób jałowy bulion, roztwór jodu, tiosiarczan sodu,
żółć i zieleń brylantową, dokładnie wymieszać i rozlać do kolb po 200 cm
3
. Wyjaławiać
dwukrotnie w parze bieżącej przez 20 minut.
Oczyszczanie ścieków
Ścieki są to odpływy powstające przy wykorzystywaniu wody w gospodarstwach
domowych, dla celów sanitarnych i przemysłowych, zawierające składniki charakterystyczne
dla środowiska, w którym użyto wodę. Rozróżnia się ścieki domowe lub bytowo-gospodarcze,
wody opadowe, ścieki poprodukcyjne, ścieki miejskie. Charakter i skład ścieków
przemysłowych jest różny i zmienny, zależny od rodzaju przemysłu, użytych surowców, metod
produkcji. Na ogół we wszystkich ściekach zawierających substancje organiczne znajdują się
bakterie i inne drobnoustroje. Liczba bakterii w ściekach zależy od wielu czynników np. od
rodzaju i stężenia ścieków, pH, stanu świeżości, temperatury itd. Jest ona zmienna i może się
wahać od kilkuset do wielu milionów komórek w 1 dm
3
ścieków.
Zdolność do samooczyszczania się wód naturalnego odbiornika ścieków jest ograniczona.
Nie chcąc doprowadzić przez przeciążenie odbiornika ściekami do zniszczenia jego wartości
użytkowych należy zawsze rozważyć i ustalić, czy dana ilość ścieków mieści się w granicach
dopuszczalnych procesami samooczyszczania się, Granice te ustalają odpowiednie przepisy
prawne. Biorąc pod uwagę specyficzne właściwości ścieków oraz obowiązujące przepisy,
w większości przypadków ścieki miejskie i przemysłowe wymagają oczyszczenia przed
odprowadzeniem ich do naturalnych odbiorników. Wybór metody oczyszczania ścieków zależy
od wielkości odbiornika oraz jakości i ilości ścieków. Metody mechaniczne pozwalają usunąć
ze ścieków substancje pływające zawieszone. Metodami fizyko-chemicznymi usuwa się ze
ścieków substancje koloidalne i zawiesinę nie opadającą. W metodach biologicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
drobnoustroje głównie bakterie rozkładają zawarte w ściekach substancje organiczne
rozpuszczone, koloidalne lub występujące w postaci drobnej zawiesiny. Całość procesów
oczyszczania rozdzielono umownie na 4 fazy zwane stopniami oczyszczania:
−
oczyszczanie I stopnia – wstępne (najczęściej fizyczne),
−
oczyszczanie II stopnia – biologiczne,
−
oczyszczanie III stopnia – doczyszczanie ścieków z usuwaniem substancji biogennych,
−
oczyszczanie IV stopnia – odnowa wody.
Oczyszczanie I stopnia oczyszczania mogą być niekiedy poprzedzane dodatkowym
napowietrzaniem w odrębnych komorach przed osadnikami wstępnymi. W ramach
oczyszczania I stopnia stosuje się proste operacje mechaniczne i procesy fizyczne: cedzenie,
sedymentacja, filtrowanie, przez które zmierza się do wydzielania większych ciał pływających i
wleczonych (skratki), cząstek ziarnistych o umownym zakresie 0,1 mm i większych (piasek),
zawiesin łatwo opadających (osady wstępne), olejów i tłuszczów podatnych na wydzielanie.
Oczyszczanie biologiczne przeprowadza się z reguły przy udziale przystosowanej do tego
biocenozy. Zanieczyszczenia te służą mikroorganizmom jako pokarm i jako budulec nowych
komórek. Dzięki tym procesom życiowym następuje rozkład, utlenianie i ubytek zawartych
w ściekach zanieczyszczeń – w tym zwłaszcza organicznych. Oczyszczone biologicznie
ścieki są mniej podatne na zagniwanie, a tym samym w mniejszym stopniu naruszają
równowagę tlenową wód płynących. Podstawową miarą efektywności pracy oczyszczalni
II stopnia jest zdolność obniżania ładunku zanieczyszczeń organicznych podatnych na rozkład i
wyrażonych przez ubytek BZT
5
. Umownie wyróżnia się niepełne biologiczne oczyszczanie,
gdy osiąga się 85% obniżenia BZT (biochemiczne zapotrzebowanie tlenu) i pełne, gdy osiąga
się efektywność powyżej 85% (zwykle 95%), a stężenie zawiesin nie przekracza 30 mg/dm
3
.
Dodatkowymi miernikami II stopnia oczyszczania są ubytki CHZT bakterii, a także usuwanie
zanieczyszczeń biogennych. Najbardziej rozpowszechniły się dwie formy oczyszczania
biologicznego:
−
z biocenozą osiadłą – złoża biologiczne,
−
z biocenozą pływającą – komory z osadem czynnym.
Mikroflora powietrza
Wyniki badań mikrobiologicznych wykazały, że powietrze zawiera różne ilości
drobnoustrojów. Mikroflora powietrza jest reprezentowana przez różne gatunki bakterii
i grzybów. Spotyka się bakterie dające kolonie różnej barwy (białe, żółte, pomarańczowe), jak
np. ziarniaki – Micrococcus, pakietowce – Sarcina, pałeczki z rodzaju Achromobacter,
laseczki, jak np. Bacillus subtilis i inne. Spośród drożdży spotyka się gatunki z rodzaju
Torulopsis i Rhodotorula. Występują też pleśnie z rodzaju Aspergillus, Penicillum, Rhizopus,
Mucor, Cladosporium, Dematitum i wielw innych. Wśród mikroflory powietrza mogą
znajdować się różne zarazki groźnych chorób zakaźnych dostających się do powietrza
z kurzem lub rozsiewane przez chorych. Jedną z podstaw oceny sanitarno-higienicznej
zakładów spożywczych jest stan ilościowy i jakościowy mikroflory powietrza. Drobnoustroje
dostają się z opadającym pyłem na produkty spożywcze, surowce roślinne lub zwierzęce –
zakażają je w stanie surowym lub w czasie produkcji. Produkty spożywcze oraz surowce
służące do ich wytwarzania są dobrym podłożem do rozwoju drobnoustrojów. Powodują
psucie się zarówno surowców, jak i półproduktów oraz gotowych wyrobów spożywczych
odpowiednio nie zabezpieczonych. Pył opada również na przedmioty, z którymi styka się
gotowy produkt lub surowiec. Dlatego utrzymanie powietrza w stanie optymalnej czystości
mikrobiologicznej ma specjalnie duże znaczenie we wszystkich zakładach przemysłu
spożywczego wytwarzających artykuły żywnościowe dla człowieka, jak również produkty
paszowe dla zwierząt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Do oczyszczania powietrza stosowane są specjalne filtry, przez które przepuszczane jest
powietrze. Zatrzymują one całkowicie pyły znajdujące się w powietrzu łącznie
z drobnoustrojami. Stosuje się także odkażanie powietrza promieniami ultrafioletowymi,
emitowanymi przez różne lampy rtęciowe.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Na czym polega próba reduktazowa oznaczania ogólnej liczby drobnoustrojów?
2. Jak oznaczyć ogólną liczbę drobnoustrojów hodowlaną metodą płytkową?
3. W jaki sposób dokonać rozcieńczenia badanych środowisk?
4. Jak wykonać posiew na płytkę Petriego?
5. Jak oznaczyć miano coli?
6. Jak zinterpretować wynik otrzymany przy oznaczaniu miana coli?
4.2.3. Ćwiczenia
Ćwiczenie 1
Oznacz ogólną liczbę drobnoustrojów tlenowych w mięsie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować szablony do badania stopnia zakażenia powierzchni,
2) wyciąć z blachy do wyrobu puszek okienko w kształcie kwadratu, prostokąta lub koła
o powierzchni 25 cm
2
,
3) pozostawić obramowanie dookoła okienka o szerokości 2 cm z rączką do trzymania
szablonu,
4) opiłować brzegi szablonu, wyjałowić przed użyciem w autoklawie w temperaturze nie
niższej niż 117°C przez 15 minut,
5) przyłożyć szablon do powierzchni badanej próbki,
6) uchwycić pincetą wyjałowiony tampon z gazy wielkości ok. 2 cm
2
,
7) zanurzyć tampon w jałowym płynie do rozcieńczeń,
8) wycisnąć płyn z tamponu przez przyciśnięcie go do wewnętrznej powierzchni kolby,
9) wykonać tamponem dokładny wymaz z całej powierzchni próbki znajdującej się
w okienku szablonu,
10) przenieść tampon do kolby i wstrząsać ok. 1000 razy,
11) wypłukać tampon, sporządzić rozcieńczenia,
12) umieścić kolby z agarem odżywczym w łaźni wodnej,
13) ogrzewać w temperaturze 100°C do całkowitego rozpłynnienia podłoża,
14) oziębić pożywkę do temperatury ok. 45°C,
15) przygotować odpowiednia liczbę płytek Petriego,
16) przeznaczyć po dwie płytki na każde rozcieńczenie,
17) zaznaczyć dermatografem na płytce rodzaj próbki, datę badania i wielkość rozcieńczenia
18) przenieść kolejno na płytki po 1 cm
3
z poszczególnych rozcieńczeń, używając do każdego
rozcieńczenia innej pipety,
19) wykonać po dwa równoległe posiewy z każdego rozcieńczenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
20) zalać posiewy ostudzonym podłożem agarowym, uchylając nieco pokrywkę i wylewając
na płytkę po ok. 10 cm
3
pożywki,
21) wymieszać ruchem kołowym płytkę i pozostawić do zastygnięcia,
22) wstawić płytki do góry dnem do cieplarki o temperaturze 30°C na 72 godziny,
23) policzyć wyrosłe kolonie po zakończeniu hodowli,
24) podać liczbę drobnoustrojów na powierzchni 1cm
2
produktu,
25) dokonać analizy i interpretacji wyników. Na przykład do obliczeń wybrano płytki
z posiewami z rozcieńczenia 1:100. Na jednej z nich wyrosło 43 kolonie, na drugiej – 47.
Średnia liczba kolonii na jednej płytce wynosiła 45. Zatem liczba kolonii na powierzchni 1
cm
2
produktu była: 45 · 100 = 4500, czyli 4,5 · 10
3
.
26) interpretacja wyników. Dokonać analizy uzyskanych wyników, wykorzystując informacje
z biologii i podane w materiale nauczania. Oceń przydatność technologiczną badanego
mięsa.
Wyposażenie stanowiska pracy:
−
taca z próbką,
−
szablon o powierzchni 25cm
2
,
−
tampon z gazy,
−
kolba o pojemności 250
÷
300cm
3
zawierająca 25cm
3
płynu do rozcieńczeń,
−
pinceta, probówki z 9cm
3
płynu do rozcieńczeń,
−
pipety poj.1 cm
3
(10 sztuk),
−
płytki Petriego (10 sztuk),
−
agar odżywczy (ok.100cm
3
),
−
cieplarka,
−
normy jakościowe.
Ćwiczenie 2
Oznacz miano coli w wodzie pitnej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przetrzeć kran tamponem z waty zwilżonym denaturatem i opalić w płomieniu,
2) otworzyć kran całkowicie i spuszczać wodę przez 10 minut,
3) pobrać 150cm
3
wody do butelki i przystąpić do dokonania posiewu,
4) posiewać do 10 probówek z podwójną pożywką Eijkmana jeśli z wody wodociągowej
korzysta ponad 50 tysięcy mieszkańców,
5) posiewać do 5 probówek z podwójną pożywką Eijkmana jeśli z wodociągu korzysta mniej
niż 50 tysięcy mieszkańców,
6) umieścić statyw z probówkami w liczbie 5 lub 10, do których posiano po 10 cm
3
badanej
wody w cieplarce temperaturze 37ºC na 48 godzin,
7) wyjąć statyw z probówkami i obserwować kolejno probówki na obecność gazu w rurkach
Durhama,
8) zinterpretować wyniki. Jeżeli nie stwierdza się obecności gazu (powyżej 10% objętości
rurki) w żadnej z probówek oznacza to, że miano coli jest niższe od 50 lub 100, co
jednocześnie dyskwalifikuje badaną wodę jako przydatną do spożycia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Wyposażenie stanowiska pracy:
−
pożywka Eijkmana (podwójna) w probówkach z rurkami Durhama,
−
jałowe szkło: butelka o pojemności 200 cm
3
,
−
pipeta o pojemności 10 cm
3
,
−
statyw do probówek,
−
wata,
−
denaturat,
−
cieplarka.
Ćwiczenie 3
Oznacz obecność pałeczek Salmonella w mięsie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować próbkę mięsa podejrzanego o zakażenie pierwotne,
2) opalić próbkę w płomieniu palnika i rozciąć jałowym nożem,
3) pobrać materiał z głębi próbki,
4) rozdrobnić próbkę za pomocą noża, albo maszynki do mięsa, z zachowaniem warunków
jałowości,
5) wprowadzić próbkę wielkości 25g pincetą do kolbki z podłożem czterotionianu sodu
według Kauffmana,
6) zanurzyć lub wymieszać z podłożem,
7) inkubować posiewy w temperaturze 37ºC przez trzy dni, wstrząsając co 24 godziny,
8) dokonać obserwacji,
9) zinterpretować wyniki. Posiew do podłoża z czterotionianem sodu jest namnażaniem
selektywnym. Wzrost wskazuje na prawdopodobieństwo zakażenia mięsa bakteriami
z grupy Salmonella.
Wyposażenie stanowiska pracy:
−
taca z próbką mięsa,
−
nóż,
−
maszynka do mięsa,
−
pinceta,
−
palnik,
−
kolbka z 200 cm
3
podłoża z czterotionianem sodu.
Ćwiczenie 4
Porównaj mikrobiologiczne metody oczyszczania ścieków w zakładach przetwórstwa
spożywczego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) pobrać próbki ścieków z zakładu przemysłu spożywczego,
2) porównać stan ogólny wód ściekowych z wymaganiami i warunkami dotyczącymi
odprowadzanych wód ściekowych (wykorzystać normy),
3) wskazać mikroorganizmy wykorzystywane do oczyszczania ścieków,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
4) porównać
metody
mikrobiologicznego
oczyszczania
ścieków
z
metodami
fizykochemicznymi,
5) zinterpretować przepisy dotyczące oczyszczania ścieków.
Wyposażenie stanowiska pracy:
–
próbki ścieków z zakładów przemysłowych.
–
tekst dotyczący biologicznych i fizykochemicznych metod oczyszczania ścieków,
–
normy dla wód ściekowych.
Ćwiczenie 5
Oznacz stopień zakażenia powietrza w zakładzie przetwórstwa spożywczego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przygotować dwie płytki Petriego z agarem odżywczym,
2) ustawić otwarte płytki w hali produkcyjnej zakładu przetwórczego na 5÷15 minut,
3) zamknąć płytki zaznaczając na wieczku miejsce pobrania próby i czas trwania posiewu,
4) wstawić płytki z posiewem (dnem do góry), do termostatu o stałej temperaturze 37°C na
48 godzin,
5) po okresie inkubacji wyjąć płytki z termostatu,
6) obliczać wyrosłe kolonie przy zamkniętych płytkach. Zakładając, że każda kolonia
rozwinęła się z pojedynczej komórki obliczyć liczbę drobnoustrojów x znajdujących się w
10dm
3
powietrza według wzoru:
k
b
a
x
⋅
⋅
=
100
gdzie:
a – średnia arytmetyczna z liczby kolonii wyrosłych na dwóch płytkach z tym samym
podłożem,
b – powierzchnia płytki w cm
2
(dla płytki o średnicy 10 cm powierzchnia wynosi 78,5 cm
2
),
k – współczynnik czasu ekspozycji płytki, dla 5 minut k=1; dla 10 minut k=2; dla 15 minut
k=3,
100 – przeliczenie płytki na 100 cm
2
,
100 – przeliczenie płytki na 100 dm
2
.
Powietrze można uznać za bardzo czyste jeśli liczba drobnoustrojów w 10dm
3
nie jest większa
niż 10. Zakażenie przekraczające 100 uważa się za bardzo duże.
7) zinterpretować wyniki.
Wyposażenie stanowiska pracy:
−
płytki Petriego,
−
agar,
−
woda destylowana,
−
termostat.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.2.4 Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia metoda reduktazowa, miano coli, metoda
płytkowa?
2) dokonać
rozcieńczeń
badanego
produktu
do
badań
mokrobiologicznych?
3) oznaczyć miano coli?
4) policzyć wyrośnięte kolonie na płytkach Petriego i zinterpretować wynik?
5) ustalić kolejność postępowania przy barwieniu preparatów metodą
Grama?
6) określić techniki mikroskopowania oraz zasady przygotowywania
preparatów?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań dotyczących mikrobiologicznych badań żywności.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi.
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8. Trudności mogą przysporzyć Ci zadania: 15-20, gdyż są one na poziomie trudniejszym niż
pozostałe.
9. Na rozwiązanie testu masz 45 min.
ZESTAW ZADAŃ TESTOWYCH
1. Próbki do badań mikrobiologicznych można przechowywać w temperaturach:
a) 0÷20°C.
b) 0÷15°C.
c) 0÷10°C.
d) 0÷5°C.
2. Pożywki hodowlane to roztwory wodne substancji odżywczych do:
a) badań wybiórczych.
b) utrwalania preparatów mikroskopowych.
c) hodowli drobnoustrojów.
d) barwienia preparatów.
3. Naczynia zawierające hodowle drobnoustrojów moczy się w 10% roztworze:
a) H
2
SO
4
lub 2% roztworze lizolu.
b) HCl lub 3% roztworze lizolu.
c) NaOH lub 1% roztworze lizolu.
d) H
2
CO
3
lub 4% roztworze lizolu.
4. Bakterie coli to mikroorganizmy bytujące w wodzie zanieczyszczonej
a) pestycydami.
b) siarczanami.
c) odchodami.
d) azotanami.
5. Brzeczka jest pożywką, której sucha masa zawiera:
a) chlorek sodu, dekstryny, amylazę.
b) maltozę, dekstryny, sacharozę.
c) amylazę, laktozę, bulion.
d) pepton, wyciąg mięsny, wodę destylowaną.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
6. Do oznaczania ogólnej liczby drobnoustrojów stosuje się metodę:
a) Grama.
b) porównawczą.
c) reduktazową.
d) rezazurynową.
7. Do badań bakterioskopowych stosuje się preparaty odciskowe barwione metodą
a) Leifsona.
b) Grama.
c) Browna.
d) Schaeffera-Fultona.
8. Bakterie gnilne wywołują:
a) rozkład tłuszczów.
b) redukcję azotynów.
c) rozkład cukrów.
d) rozkład białek.
9. Wyciąg mięsny stosowany do podłoży i pożywek otrzymywany jest ze ścięgien i tłuszczu
mięsa:
a) wieprzowego lub kurzego.
b) baraniego lub cielęcego.
c) wołowego lub końskiego.
d) koziego lub oślego.
10. Płytki Petriego przeznaczone do wyjaławiania umieszcza się w:
a) puszkach metalowych.
b) folii aluminiowej.
c) bibule do sączenia.
d) szmatce lnianej.
11. Do hodowli drobnoustrojów w metodzie płytkowej używane są:
a) rurki Durhama.
b) płytki Petriego.
c) szkiełka mikroskopowe.
d) anaerostaty.
12. Do oznaczania laseczek beztlenowych przetrwalnikujących używa się:
a) podłoża Wrzoska.
b) agaru wodnego.
c) podłoża Wilson- Blaira.
d) wyciągu mięsnego.
13. W rurkach Durhama o obecności drobnoustrojów świadczy zmętnienie i gazy:
a) CO
2
i H
2
.
b) CH
4
i NH
3
.
c) CO
2
i O
2
.
d) CO i NH
3
.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
14. Pałeczki odmieńca mają właściwości:
a) fermentacyjne.
b) gnilne.
c) rozkładania cukrowców.
d) porażania mięśni.
15. Pożywki i podłoża stosowane do hodowli drobnoustrojów muszą:
a) zawierać wszystkie składniki pokarmowe.
b) wykazywać właściwy odczyn środowiska.
c) być jałowe i przejrzyste.
d) spełniać wymienione wyżej warunki.
16. Roztwór fizjologiczny soli zawiera
a) NaCl i wodę destylowaną.
b) Laktozę i KCl.
c) CaCl i wodę destylowaną.
d) Na
2
CO
3
i wodę destylowaną.
17. Jeżeli nie ma wzrostu bakterii coli to miano wynosi:
a) 0,5 lub 5.
b) 0,1 lub1,0.
c) 1,5 lub 15.
d) 2,0 lub 20.
18. Do podłóż o przeznaczeniu ogólnym zalicza się:
a) bulion mięsny, agar.
b) podłoże Wrzoska.
c) podłoże Endo.
d) fuksynę fenolową.
19. Do oznaczania pałeczek duru i czerwonki stosuje się podłoże:
a) z czterotionianem sodu.
b) z kwaśnym seleninem sodu.
c) Mac Conkeya i „SS”.
d) wszystkie odpowiedzi są prawdziwe.
20. W skład płynu Lugola wchodzi:
a) jod i jodek potasu.
b) alkohol i błękit metylenowy.
c) chlorek sodu i woda destylowana.
d) laktoza i wodorotlenek potasu.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie mikrobiologicznych badań żywności
Zakreśl poprawną odpowiedź
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
6. LITERATURA
1. Budsławski J., Drabant Z.: Metody analizy żywności. WNT, Warszawa 1999
2. Drewniak T.: Analiza techniczna w przemyśle mięsnym. WSiP Warszawa1993
3. Drzazga B.: Analiza techniczna w przemyśle spożywczym. WSiP, Warszawa 1992
4. Drzazga B.: Analiza techniczna w przemyśle spożywczym. WSiP, Warszawa 1992
5. Kosewska L.: Analiza mikrobiologiczna w przemyśle spożywczym. WSiP, Warszawa
1986
6. Maliszewski J.: Higiena w przemyśle spożywczym. Aspekty mikrobiologiczne. WNT,
Warszawa 1982
7. Sobczak E. red.: Teoria i ćwiczenia z mikrobiologii ogólnej. SGGW, Warszawa 1993
8. http://www.pol-eko.com.pl/
Wyszukiwarka
Podobne podstrony:
35 Wykonywanie mikrobiologicznych badań żywności
36 Wykonywanie towaroznawczych badań żywności
36 Wykonywanie towaroznawczych badań żywności
35 Wykonywanie dokumentacji kon Nieznany
32 Wykonywanie wagowej analizy żywności
UzupeLnienie do szybkich metod mikrobiologicznej analizy żywności, Studia - materiały, semestr 4, Mi
Mikrobiologia pasz i żywnosci
33 Wykonywanie objętościowej analizy żywności
MIKROBIOLOGIA OGÓLNA I ŻYWNOŚCI
35. Problemy etyczne badań eksperymentalnych nad rozwojem człowieka.
MIKROBIOLOGIA OGÓLNA I ŻYWNOŚCI
34 Wykonywanie instrumentalnej analizy żywności
Sciaga mikrobiologia, technologia żywności, mikrobiologia, mikro egzamin
Poprawione szybkie metody mikrobiologicznej analizy żywności, Studia - materiały, semestr 4, Mikrobi
Metody ilościowe w mikrobiologicznych badaniach żywności Cz 2
Metody ilościowe w mikrobiologicznych badaniach żywności Cz 1
35 Wykonywanie dokumentacji kon Nieznany
32 Wykonywanie wagowej analizy żywności
więcej podobnych podstron