Wykonały: Szczecin 27.10.03 r.
Elżbieta Jabłońska
Aneta Lipińska
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 18.
WYZNACZANIE PK ORANŻU METYLOWEGO METODĄ SPEKTROFOTOMETRYCZNĄ.
Wstęp.
Wskaźniki alkacymetryczne - zwane również indykatorami charakteryzują się tym, że ich roztwory zmieniają zabarwienie przy zmianie stężenia jonów wodorowych. Istotę tego zjawiska można łatwo zrozumieć jeśli wziąć pod uwagę, że indykatory są słabymi kwasami, bądź zasadami organicznymi, a zatem ulegają w roztworach wodnych dysocjacji, przy czym przynajmniej jedna z form każdego indykatora - cząsteczki niezdysocjowane, bądź powstające w wyniku dysocjacji jony - ma wyraźne pasmo absorpcyjne w widzialnym zakresie fal elektromagnetycznych.
Rozważmy wskaźnik o charakterze kwasowym, na przykład HA, który w roztworze wodnym dysocjuje zgodnie z równaniem:
HA ↔ H+ + A-
W przypadku, gdy roztwór tego wskaźnika nie jest zbyt stężony, równowagę dysocjacji określa prawo działania masy, które zgodnie z propozycją Hendersona i Hasselbacha - można wyrazić w postaci
pH = pK + log[A-]/[HA] (1)
gdzie pH jest wykładnikiem jonów wodorowych, K - stałą dysocjacji wskaźnika HA /pK = - log K/, a przez [A-] i [HA] oznaczono stężenia [mol/dm3] odpowiednich form tego wskaźnika.
Dla naszych celów wygodnie będzie wyrazić stężenia [A-] i [HA] przez stopień dysocjacji α i całkowite stężenie wskaźnika c, które zgodnie ze stechiometrią równania dysocjacji jest równe sumie stężeń [A-] + [HA]. Ponieważ w myśl definicji stopnia dysocjacji
[A-] = α ⋅ c (2)
a stąd [HA] = (1 - α ) ⋅ c (3)
więc możemy równanie /1/ przepisać w postaci
pH = pK + log [α/(α-1)] (4)
Z równań (2) - (4) wynika, że w roztworach kwaśnych występuje praktycznie tylko forma niezdysocjowana, natomiast w alkalicznych zdysocjowana (ściślej : jeżeli pH >> pK - 3, to α<0,001, natomiast jeżeli pH >> pK + 3, to α > 0,999.
Jeżeli obie formy wskaźnika są barwne - jak np. w przypadku oranżu metylowego - to barwa roztworu kwaśnego jest barwą dopełniającą do tej, którą absorbują cząsteczki niezdysocjowane HA, analogicznie absorpcja światła przez jony A- określa barwę roztworu alkalicznego.
Ilościowo absorpcję światła przez roztwór można opisać zależnością:
E = εA- ⋅l⋅[A-] + εHA⋅l⋅[HA] (5)
lub uwzględniając zależności (2) i (3)
E = (εA-- εHA) ⋅ l⋅ c⋅ α+ εHA⋅ l⋅ c (6)
gdzie E jest absorbancją ( ekstynkcją ) roztworu, l- grubością warstwy roztworu przez którą przechodzi światło , a εA- i εHA są molarnymi współczynnikami absorpcji odpowiednich form wskaźnika ( ściśle rzecz biorąc εA- i εHA są charakterystykami funkcyjnymi, bowiem zależą od długości fali ).
Na podstawie równań (4) i (6) nie trudno wskazać, że zmiana barwy roztworu wywołana zmianą pH jest tym wyraźniejsza, im bardziej pH roztworu jest zbliżone do pK wskaźnika. Aby tego dowieść wystarczy zauważyć, że dla c= const.
dE/dpH = 2,303 (εA - εHA)⋅ l⋅ c⋅ α (1-α) (7)
gdzie 2,303 jest przybliżoną wartością przelicznika logarytmów dziesiętnych na naturalne (dokładna wartość: ln 10).
Z równania (7) wynika, że dE/dpH osiąga maksimum dla α= 1/2, a wówczas, zgodnie z równaniem (4), pH= pK
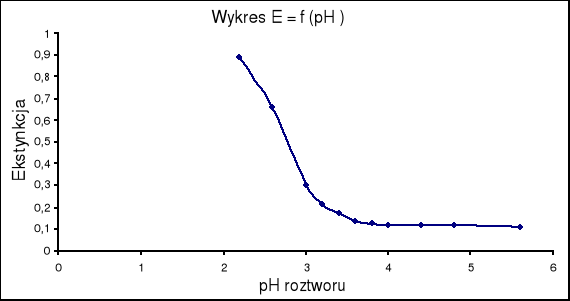
Na tym spostrzeżeniu opiera się między innymi przybliżona metoda wizualnego określania pH roztworów, a także - co jest dla naszych celów istotniejsze - jedna z najstarszych metod wyznaczania pK wskaźników. Prostota tej metody polega na tym, że jeżeli zmierzymy ekstynkcję roztworów danego wskaźnika w wodnych roztworach buforowych o różnych wartościach pH, zachowując stałe stężenie wskaźnika ( c= const. ) i stałą długość fali (λ= const.) w całej serii pomiarów, a wykreślimy krzywa E= f (pH), to punkt przecięcia tej krzywej odpowiada wartości pH= pK. Ze względu na to, że metoda graficznego różniczkowania jest mało dokładna, punkt przegięcia wyznacza się praktycznie w ten sposób, iż mierzy się dodatkowo ekstynkcje dwóch roztworów wskaźnika: roztworu kwaśnego, Ek o pH< pK- 3 oraz zasadowego Ez o pH> pK+3, przy zachowaniu tego samego stężenia wskaźnika i tej samej długości fali, jakie stosowano w serii badań, na podstawie których sporządzono wykres E = f (pH), a następnie oblicza się średnią arytmetyczną z obydwu wyników pomiarów
E= (Ek+ Ez) (8)
i odczytuje z krzywej E= f (pH) wartość pH odpowiadającą tej wartości ekstynkcji; można łatwo dowieść, że tak wyznaczona wartość pH jest równa pK wskaźnika.
Warto jeszcze podkreślić , że pK można wyznaczyć tym dokładniej, im większa będzie bezwzględna wartość różnicy współczynnika absorpcji εA- i εHA. Dlatego jest wskazane, aby pomiary ekstynkcji były przeprowadzane przy takiej samej długości fali, dla której wyrażenie (εA-- εHA ) osiąga maksimum ( dla oranżu metylowego najodpowiedniejsza jest długość fali 525nm).
OPRACOWANIE WYNIKÓW
Lp |
pH roztworu |
Ekstynkcja |
Stopień dysocjacji α |
Pochodna |
1 |
kwaśny |
0,890 |
- |
- |
2 |
2,2 |
0,892 |
0,052 |
-0,089 |
3 |
2,6 |
0,656 |
0,121 |
-0,192 |
4 |
3,0 |
0,302 |
0,257 |
-0,345 |
5 |
3,2 |
0,214 |
0,354 |
-0,413 |
6 |
3,4 |
0,172 |
0,465 |
-0,449 |
7 |
3,6 |
0,135 |
0,579 |
-0,439 |
8 |
3,8 |
0,123 |
0,686 |
-0,388 |
9 |
4,0 |
0,118 |
0,776 |
-0,313 |
10 |
4,4 |
0,118 |
0,897 |
-0,166 |
11 |
4,8 |
0,12 |
0,956 |
-0,075 |
12 |
5,4 |
0,110 |
0,992 |
-0,012 |
13 |
zasadowy |
0,106 |
- |
- |
Stężenie procentowe oranżu metylowego przeliczam na stężenie molowe. Zakładam, że d = 1g/dm3.
jeżeli 100 cm3 roztworu - zawiera 0,0012g oranżu metylowego
to 5 cm3 roztworu - zawiera x g oranżu metylowego
x = 0,00006 g
z kolei
jeżeli 1 mol - zawiera 341,45g oranżu metylowego
to y moli - zawiera 0,00006 g oranżu metylowego
y = 1,757⋅10-7mola
Obliczam stężenie molowe oranżu metylowego przy uwzględnieniu zmiany objętości wywołanej
dodaniem kwasu lub zasady :
![]()
przy czym V = 2⋅5cm3 = 10 cm3 = 10⋅10-3 dm3. Czyli
![]()
Obliczamy wartość współczynników εA- i εHA. Korzystam ze wzoru:
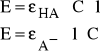
l=0, 996 cm = 0,0996 dm
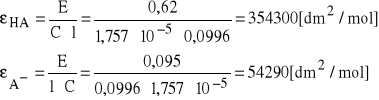
Znając wartości molowych współczynników adsorpcji obliczam wartość ekstynkcji roztworu dla
α = ½ ze wzoru :
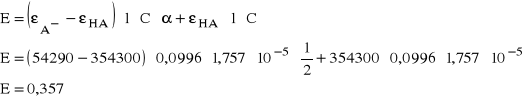
Wartość ekstynkcji w punkcie przegięcia krzywej jest inna i wynosi około E = 0,35.
pK oranżu metylowego zgodnie z danymi literaturowymi ( „Poradnik fizykochemiczny”) wynosi 3,46.
Wartość pH odczytana w punkcie przegięcia krzywej różni się od wartości pK oranżu metylowego podanej w literaturze i wynosi pK = 3,08.
Obliczam stopień dysocjacji α oranżu metylowego w poszczególnych próbkach wiedząc , że pK wynosi 3,08. Wyniki zamieszczam w tabeli , a korzystam ze wzoru:
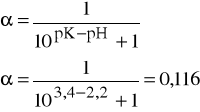
Obliczam wartości pochodnej dE/d(pH) dla poszczególnych roztworów z następującego wzoru
(wyniki umieszczamy w tabeli) :

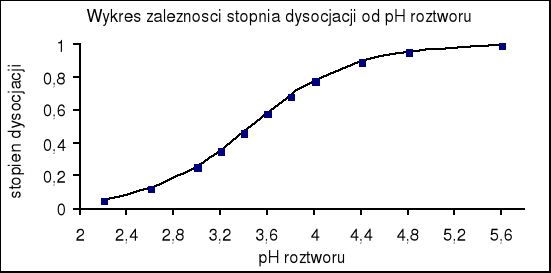
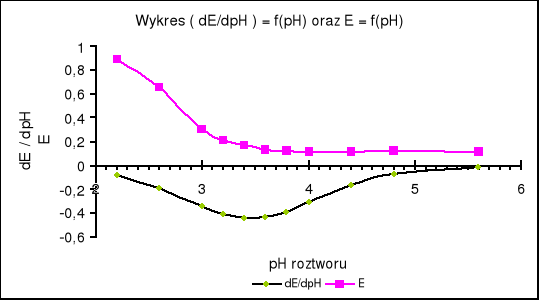
Wykreślamy zależność E = f(pH) , (dE/dpH) = f(pH) .
Z równania :
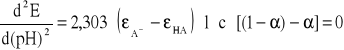
wynika , że druga pochodna funkcji E = f (pH) jest równa zero dla α=1/2. w tym punkcie pierwsza pochodna osiąga ekstremum , a funkcja E = f (pH) ma punkt przegięcia. Wówczas zgodnie z równaniem
![]()
pH roztworu jest równe co do wartości pK oranżu metylowego
pH = pK
Na tej podstawie z ostatniego wykresu odczytujemy , że punktowi przegięcia funkcji E = f (pH) odpowiada wartość pH równa 3,08. czyli pK oranżu metylowego wynosi :
pK = 3,08
pK oranżu metylowego zgodnie z danymi literaturowymi („Poradnik fizykochemiczny”) wynosi 3,46 natomiast pH oranżu odczytane z wykresu mniejsze jest o 0,38 do pK literaturowego.
4
1
Wyszukiwarka
Podobne podstrony:
50 Jakie formy promocji są stosowane na rynku dóbr i usług przemysłowych
czym są negocjacje i jak je prowadzić, Materiały szkoleniowe
CZYM SĄ PRZEBARWIENIA I JAK Z NIMI WALCZYĆ
CO TO SĄ SAKRAMENTALIA I JAK Z NICH KORZYSTAĆ (POMOC DUCHOWA), Sakramentalia, Sakramentalia
CO TO SĄ SAKRAMENTALIA I JAK Z NICH KORZYSTAĆ (POMOC DUCHOWA), SAKRAMENTALIA- PRAWO KANONICZNE, SAKR
Chemia - wskaźniki chemiczne, przydatne teksty (np. do szkoły)
Są chwile jak ta
Polacy są kochliwi jak Latynosi
cO TO SA EMOCJE I JAK JE WYRAŻAMY
Czym są granice i jak z sukcesem stawiać je dziecku
19a Formy podawcze w dramacie w rozwoju historycznym (np apart, dialog właściwy, monolog, parabaza,
Dlaczego porosty są dobrym wskaźnikiem zagrożeń, Biologia
Jakie są dopuszczalne formy zgłoszeń INTRASTAT, Prawna ochrona pracy, Kadry i Płace(1)
interpretacje wskaznikow dla TVN SA analiza finansowa
Tworzywa na formy, MASY FORMIERSKIE, MASY FORMIERSKIE-są to wszystkie materiały, surowce i produkty,
Dlaczego porosty są dobrym wskaźnikiem zagrożeń, Biologia
więcej podobnych podstron