
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Urszula Żłobińska
Wykonywanie analiz jakościowych
311[31].O1.02
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
prof. nadzw. dr hab. Witold Ciesielski
dr Władysław Goworek
Opracowanie redakcyjne:
mgr inż. Małgorzata Urbanowicz
Konsultacja:
dr inż. Bożena Zając
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[31].O1.02
„Wykonywanie analiz jakościowych” zawartej w modułowym programie nauczania dla
zawodu technik technologii chemicznej.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
15
5.1. Techniki i znaczenie analizy jakościowej. Zasady pracy w laboratorium
15
5.1.1. Ćwiczenia
15
5.2. Operacje stosowane w półmikroanalizie. Zastosowanie iloczynu rozpuszczalności
w analizie jakościowej
17
5.2.1. Ćwiczenia
17
5.3. Zastosowanie związków buforowych i kompleksowych w analizie
jakościowej. Grupy analityczne kationów
19
5.3.1. Ćwiczenia
19
5.4. Reakcje charakterystyczne, selektywne i specyficzne kationów
21
5.4.1. Ćwiczenia
21
5.5. Grupy analityczne anionów, odczynniki grupowe. Reakcje charakterystyczne,
selektywne i specyficzne anionów
25
5.5.1. Ćwiczenia
25
5.6. Identyfikacja prostych soli rozpuszczalnych w wodzie
28
5.6.1. Ćwiczenia
28
5.7. Jakościowe oznaczanie pierwiastków w związkach organicznych
30
5.7.1. Ćwiczenia
30
6. Ewaluacja osiągnięć ucznia
32
7. Literatura
44

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Wykonywanie analiz jakościowych”,
który będzie pomocny w prowadzeniu zajęć dydaktycznych w szkole kształcącej w zawodzie
technik technologii chemicznej 311[31].
W poradniku zamieszczono:
−
wymagania wstępne,
−
wykaz umiejętności, jakie uczeń opanuje podczas zajęć,
−
przykładowe scenariusze zajęć,
−
propozycje ćwiczeń, które mają na celu wykształcenie u uczniów umiejętności
praktycznych,
−
wykaz literatury, z jakiej uczniowie mogą korzystać podczas nauki,
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem:
−
pokazu z objaśnieniem,
−
tekstu przewodniego,
−
metody projektów,
−
ćwiczeń praktycznych.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej.
W celu sprawdzenia wiadomości i umiejętności ucznia, nauczyciel może posłużyć się
zamieszczonym w rozdziale 6 zestawem zadań testowych, zawierającym różnego rodzaju
zadania oraz przeprowadzić test typu próba pracy.
W tym rozdziale podano do testu:
−
plan testu w formie tabelarycznej,
−
punktację zadań,
−
propozycje norm wymagań,
−
instrukcję dla nauczyciela,
−
instrukcję dla ucznia,
−
kartę odpowiedzi,
−
zestaw zadań testowych.
Test typu próba pracy zawiera:
−
plan testu w formie tabelarycznej,
−
punktację zadań,
−
propozycje norm wymagań,
−
instrukcję dla nauczyciela,
−
instrukcję dla ucznia,
−
kartę pracy,
−
kartę oceny.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
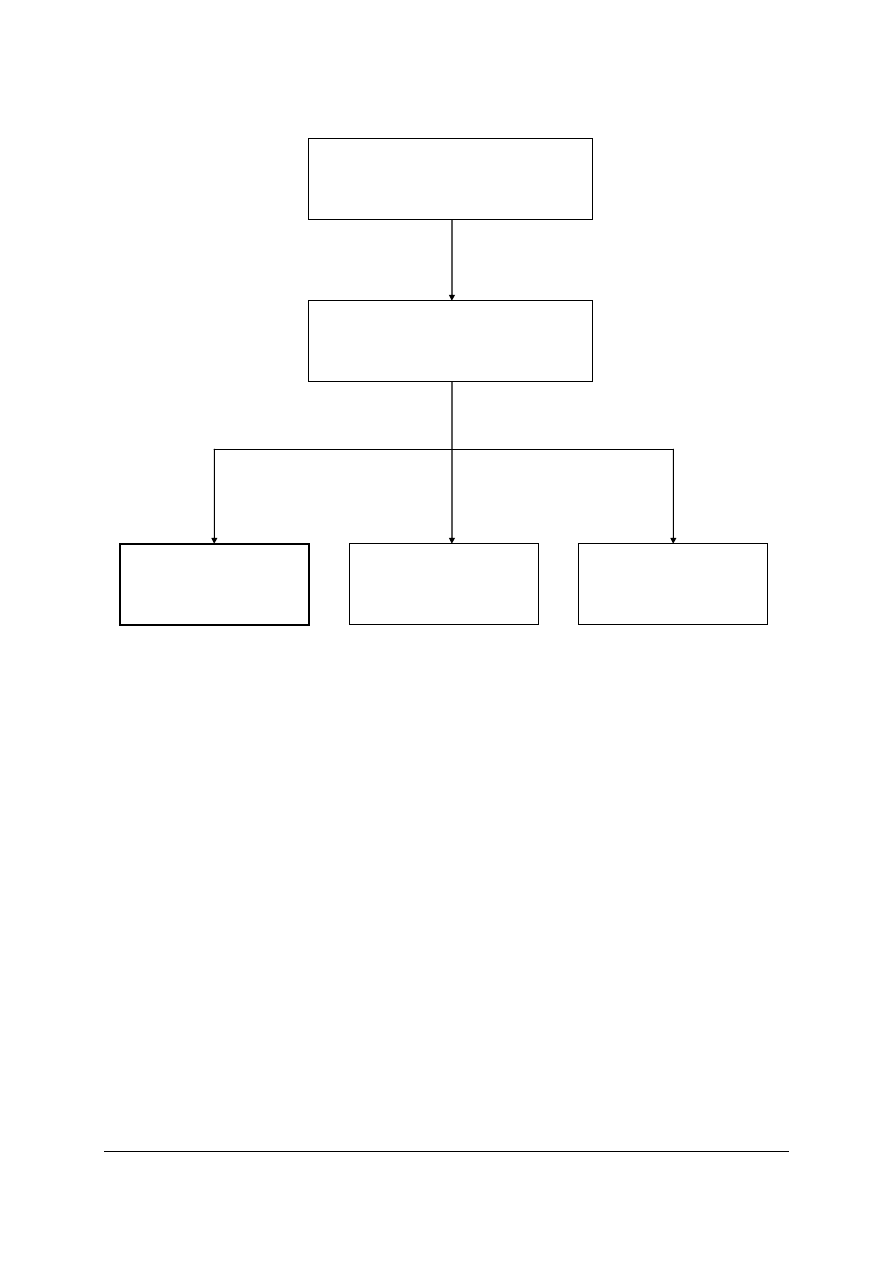
311[31].O1
Technika laboratoryjna
i analityczna
311[31].O1.01
Wykonywanie podstawowych
czynności laboratoryjnych
311[31].O1.03
Badanie fizycznych
właściwości substancji
311[31].O1.02
Wykonywanie
analiz jakościowych
311[31].O1.04
Wykonywanie
analiz ilościowych
Schemat układu jednostek modułowych

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, uczeń powinien umieć:
−
korzystać z różnych źródeł informacji,
−
posługiwać się poprawną nomenklaturą i symboliką chemiczną,
−
posługiwać się pojęciami: reakcje hydrolizy, strącania, przemiana fizyczna i chemiczna,
−
zapisywać równania reakcji w formie cząsteczkowej i jonowej,
−
wykonywać obliczenia związane ze stężeniem procentowym i stężeniem molowym
roztworu, z rozpuszczalnością substancji,
−
rozpoznawać podstawowy sprzęt laboratoryjny,
−
przestrzegać przepisów bhp w pracowni chemicznej.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej, uczeń powinien umieć:
−
zorganizować stanowisko pracy,
−
scharakteryzować techniki analizy jakościowej,
−
wyjaśnić pojęcia: odczynnik grupowy, selektywny, maskujący, specyficzny,
−
wyjaśnić zasadę podziału kationów i anionów na grupy analityczne,
−
przeprowadzić operacje wytrącania, rozpuszczania i roztwarzania osadów,
−
zidentyfikować kationy w badanych próbkach,
−
zidentyfikować aniony w badanych próbkach,
−
wykryć pierwiastki w związkach organicznych,
−
zapisać równania reakcji zachodzących w czasie wykonywania analiz jakościowych,
−
wykorzystać w sposób racjonalny sprzęt i aparaturę laboratoryjną,
−
wykorzystać w sposób racjonalny substancje i czynniki energetyczne,
−
sporządzić dokumentację laboratoryjną,
−
zinterpretować wyniki przeprowadzonych analiz,
−
zastosować przepisy bhp oraz ochrony przeciwpożarowej podczas wykonywania analiz
jakościowych.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł: Technika laboratoryjna i analityczna 311[31].O1
Jednostka modułowa: Wykonywanie analiz jakościowych 311[31].O1.02
Temat: Identyfikacja kationów II grupy analitycznej.
Cel ogólny: kształtowanie umiejętności identyfikowania kationów obecnych w roztworach
wodnych.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
−
przygotować niezbędne odczynniki,
−
zorganizować stanowisko pracy zgodnie z zasadami bezpiecznej pracy,
−
zaplanować czynności,
−
zidentyfikować kationy II grupy w pojedynczych próbkach,
−
zapisać wyniki badań w postaci równań reakcji chemicznych.
Metody nauczania–uczenia się:
−
metoda tekstu przewodniego,
−
ćwiczenia praktyczne.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 90 minut.
Środki dydaktyczne:
−
tekst przewodni do wykonania zadania,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane roztwory zawierające kationy II grupy analitycznej,
−
samodzielne stanowisko przy stole laboratoryjnym z dostępem do wyciągu,
−
łaźnia wodna.
Przebieg zajęć:
Zadanie dla ucznia:
W pięciu probówkach znajdują się kationy II grupy analitycznej. Dokonaj identyfikacji
tych kationów.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Tekst przewodni do wykonywania zadania
Działania
Lp. Nazwa etapu
nauczyciela
uczniów
1.
Informacje
1.
2.
3.
4.
5.
6.
7.
8.
9.
Pytania i polecenia wprowadzające:
Wymień kationy należące do II grupy i podaj
ich nazwy.
Jaki odczynnik grupowy należy zastosować
do wytrącenia kationów II grupy?
Jakim kwasem zakwaszamy roztwór przed
strącaniem kationów II grupy i dlaczego?
Zapisz jonowe równania reakcji kationów II
grupy z odczynnikiem grupowym.
Który kation znajduje się w I i II grupie
analitycznej?
Jaki kation z odczynnikiem grupowym II
grupy tworzy czarny osad, który roztwarza się
w wodzie królewskiej?
Który z kationów II grupy z roztworem NaOH
wytrąca niebieski osad?
Zaproponuj reakcję charakterystyczną dla
kationu Bi
3+
.
Jaki kation z jonami S
2-
wytrąca żółty osad?
Odpowiadają
na pytania
wprowadzające.
2.
Planowanie
1.
2.
3.
Polecenia prowadzące:
Zaplanuj sprzęt i odczynniki konieczne do
wykonania zadania.
Zaplanuj kolejność czynności niezbędnych
do wykonania zadania.
Ustal zasady bhp podczas wykonywania
ćwiczenia.
Planują sprzęt
i odczynniki,
kolejność
czynności,
ustalają zasady
bhp.
3.
Ustalenia
1. Analizuje zaproponowany przez uczniów
sprzęt, odczynniki i zasady bhp.
2. Analizuje kolejność czynności zaplanowanych
przez uczniów.
3. Wspólnie z uczniami ustala kryteria ocen
zadania.
Dyskutują nad
ustalonym
planem,
wspólnie
z nauczycielem
ustalają kryteria
ocen.
4.
Wykonanie
1. Zwraca uwagę na bezpieczeństwo pracy
podczas przeprowadzania reakcji.
2. Czuwa nad prawidłowym przebiegiem
wykonywania analiz.
Wykonują
zadanie,
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Działania
Lp. Nazwa etapu
nauczyciela
uczniów
3. Podaje sposób przedstawienia przebiegu
ćwiczenia w tabeli.
Czynności
Obserwacje
Wnioski
Numer
probówki
Odczynniki
Kation Równanie
reakcji
wypełniają
tabelę.
5.
Sprawdzenie
1. Ocenia wykonane zadanie zgodnie
z przyjętymi kryteriami.
2. Wskazuje nieprawidłowości wykonania
poszczególnych czynności.
Dokonują
samooceny.
6.
Analiza
Pytania:
1. Co sprawiło Ci największą trudność przy
wykonywaniu zadania?
2. Gdzie tkwi przyczyna wystąpienia tej
trudności?
Odpowiadają
na pytania.
Kryteria oceny
Lp.
Czynności
Kryterium oceny
Punktacja
1.
Przygotowanie stanowiska
pracy
Poprawne:
- dobranie stanowiska,
- dobranie sprzętu,
- dobranie odczynników
chemicznych.
1
1
1
2.
Wykonanie zadania
Poprawne:
- pobranie odczynników
chemicznych,
- zachowanie kolejności
dodawania odczynników
chemicznych,
- ogrzewanie,
- wykrycie kationów
1
1
1
5
3. Przestrzeganie przepisów bhp.
1
4. Zachowanie porządku na stanowisku pracy.
1
Razem:
13

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Punktacja Ocena
13 – 12 punktów – bardzo dobry
11 – 10 punktów – dobry
9 – 8 punktów – dostateczny
7 – 6 punktów – dopuszczający
poniżej 6 punktów – niedostateczny
Zakończenie zajęć
Praca domowa
1. Napisz równanie reakcji hydrolizy amidu kwasu tiooctowego.
2. Wyjaśnij, dlaczego strącanie siarczków kationów II grupy prowadzimy za pomocą AKT
w środowisku kwasu solnego?
3. Dlaczego do strącania siarczków nie stosujemy siarkowodoru?
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć i zdobytych
umiejętności.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Scenariusz zajęć 2
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł: Technika laboratoryjna i analityczna 311[31].O1
Jednostka modułowa: Wykonywanie analiz jakościowych 311[31].O1.02
Temat: Identyfikacja soli rozpuszczalnej w wodzie.
Cel ogólny: kształtowanie umiejętności identyfikowania soli.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
−
przygotować niezbędne odczynniki,
−
zorganizować stanowisko pracy zgodnie z zasadami bezpiecznej pracy,
−
zaplanować czynności,
−
zbadać jaki kation i anion wchodzi w skład analizowanej soli,
−
zapisać wzór zidentyfikowanej soli,
−
zapisać wyniki badań w postaci równań reakcji chemicznych.
Metody nauczania–uczenia się:
−
ćwiczenia praktyczne,
−
metoda tekstu przewodniego.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 90 minut.
Środki dydaktyczne:
−
tekst przewodni do wykonania zadania,
−
tablice rozpuszczalności,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
próbka badanej soli,
−
samodzielne stanowisko przy stole laboratoryjnym z dostępem do wyciągu,
−
łaźnia wodna.
Przebieg zajęć:
Zidentyfikuj otrzymaną sól stałą, rozpuszczalną w wodzie.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Tekst przewodni do wykonywania zadania
Działania
Lp. Nazwa etapu
nauczyciela
uczniów
1.
Informacje
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Pytania i polecenia wprowadzające:
Wskaż grupy soli rozpuszczalnych w wodzie.
Podaj przykłady chlorków, które nie
rozpuszczają się w wodzie.
Wymień nazwy soli barwnych.
Wymień kationy, których sole barwią płomień
palnika.
Jak należy przygotować roztwór soli?
Jak należy zbadać odczyn soli?
Jakie kationy należy wykryć na wstępie
systematycznej analizy kationów?
Jakich informacji należy szukać w tabeli
rozpuszczalności soli po wykryciu kationu?
Jakie aniony można wykryć w próbach
wstępnych?
Kiedy sporządza się wyciąg sodowy?
Jakimi zasadami bhp należy kierować się przy
wykonywaniu ćwiczenia?
Odpowiadają
na pytania
wprowadzające.
2.
Planowanie
1.
2.
3.
Polecenia prowadzące:
Zaplanuj sprzęt i odczynniki konieczne do
wykonania zadania.
Zaplanuj kolejność czynności niezbędnych
do wykonania zadania.
Ustal zasady bhp podczas wykonywania
ćwiczenia.
Planują sprzęt
i odczynniki,
kolejność
czynności,
ustalają zasady
bhp.
3.
Ustalenia
1. Analizuje zaproponowany przez uczniów
sprzęt, odczynniki i zasady bhp.
2. Analizuje kolejność czynności zaplanowanych
przez uczniów.
3. Wspólnie z uczniami ustala kryteria ocen
zadania.
Dyskutują nad
ustalonym
planem,
wspólnie
z nauczycielem
ustalają kryteria
ocen.
4.
Wykonanie
1. Zwraca uwagę na bezpieczeństwo pracy
podczas przeprowadzania reakcji.
2. Czuwa nad prawidłowym przebiegiem
wykonywania analiz.
3. Podaje sposób przedstawienia przebiegu
ćwiczenia w tabeli.
Wykonują
zadanie,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Działania
Lp. Nazwa etapu
nauczyciela
uczniów
Odczynniki
Czynności
Obserwacje
Wnioski
badania wstępne
................
identyfikacja
kationu
.................
identyfikacja
anionu
.................
wypełniają
tabelę.
5.
Sprawdzenie
1. Ocenia wykonane zadanie zgodnie
z przyjętymi kryteriami.
2. Wskazuje nieprawidłowości wykonania
poszczególnych czynności.
Dokonują
samooceny.
6.
Analiza
Pytania i polecenia:
1. Które z przeprowadzonych reakcji
charakterystycznych pozwoliły Ci
zidentyfikować kation i anion soli?
2. Zapisz wzór sumaryczny soli.
3. Napisz po dwa równania reakcji
charakterystycznych dla wykrytego przez
ciebie kationu i anionu.
Odpowiadają
na pytania.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Kryteria oceny
Lp.
Czynności
Kryterium oceny
Punktacja
1.
Przygotowanie stanowiska
pracy
Poprawne:
- dobranie stanowiska,
- dobranie sprzętu,
- dobranie odczynników
chemicznych.
1
1
1
2. Wykonanie zadania
Poprawne:
- pobieranie odczynników
chemicznych,
- zachowanie kolejności
dodawania odczynników
chemicznych,
- zapalanie płomienia palnika,
- ogrzewanie,
- wykrycie kationów,
- wykrycie anionu,
- zapisanie wzoru soli.
1
1
1
1
1
1
1
3. Przestrzeganie przepisów bhp.
1
4. Zachowanie porządku na stanowisku pracy.
1
Razem 12
Punktacja Ocena
12 – 11 punktów – bardzo dobry
10 – 9 punktów – dobry
8 – 7 punktów – dostateczny
6 – 5 punktów – dopuszczający
poniżej 5 punktów – niedostateczny
Zakończenie zajęć
Praca domowa
1. Podaj, jakie reakcje charakterystyczne należy przeprowadzić w celu zidentyfikowania
(NH
4
)
2
CO
3
. Napisz odpowiednie równania reakcji.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
anonimowe ankiety ewaluacyjne dotyczące sposobu prowadzenia zajęć, trudności
podczas realizowania zadania i zdobytych umiejętności.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5. ĆWICZENIA
5.1. Techniki i znaczenie analizy jakościowej Zasady pracy
w laboratorium
5.1.1. Ćwiczenia
Ćwiczenie 1
Zaplanuj stanowisko pracy do sporządzenia roztworu kwasu siarkowego(VI) o stężeniu
c = 2 mol · dm
-3
ze stężonego H
2
SO
4
( 96%, o gęstości 1,84 g · cm
-3
).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy ze stężonymi kwasami,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności,
6) wykonać obliczenia,
7) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
−
metoda projektów.
Środki dydaktyczne:
−
odpowiedni sprzęt laboratoryjny i odczynniki,
−
okulary ochronne i rękawice,
−
samodzielne stanowisko przy stole laboratoryjnym z dostępem do wyciągu.
Ćwiczenie 2
Przygotuj 200 g nasyconego roztworu wody gipsowej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać odpowiedni sprzęt laboratoryjny,
2) przygotować niezbędne odczynniki,
3) zorganizować stanowisko pracy,
4) zaplanować czynności,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5) wykonać obliczenia,
6) sporządzić roztwór,
7) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni do wykonania zadania,
−
odpowiedni sprzęt laboratoryjny i odczynniki,
−
stół laboratoryjny,
−
waga techniczna.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
5.2. Operacje stosowane w półmikroanalizie Iloczyn rozpuszczalności
w analizie jakościowej
5.2.1. Ćwiczenia
Ćwiczenie 1
Otrzymaną próbkę tlenku glinu przeprowadź w postać rozpuszczalną w wodzie przez
roztwarzanie w kwasie.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z kwasami,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) zorganizować stanowisko pracy,
4) sprawdzić w literaturze właściwości tlenku glinu,
5) dobrać odpowiedni kwas,
6) zaplanować czynności,
7) wykonać roztwarzanie tlenku glinu w kwasie,
8) zapisać przebieg ćwiczenia i odpowiednie reakcje w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
odpowiedni sprzęt laboratoryjny i odczynniki,
−
okulary ochronne,
−
tekst przewodni,
−
Kalendarz chemiczny, poradniki,
−
tablice rozpuszczalności,
−
stół laboratoryjny.
Ćwiczenie 2
W roztworze znajdują się jony Cu
2+
, Mg
2+
i Ag
+
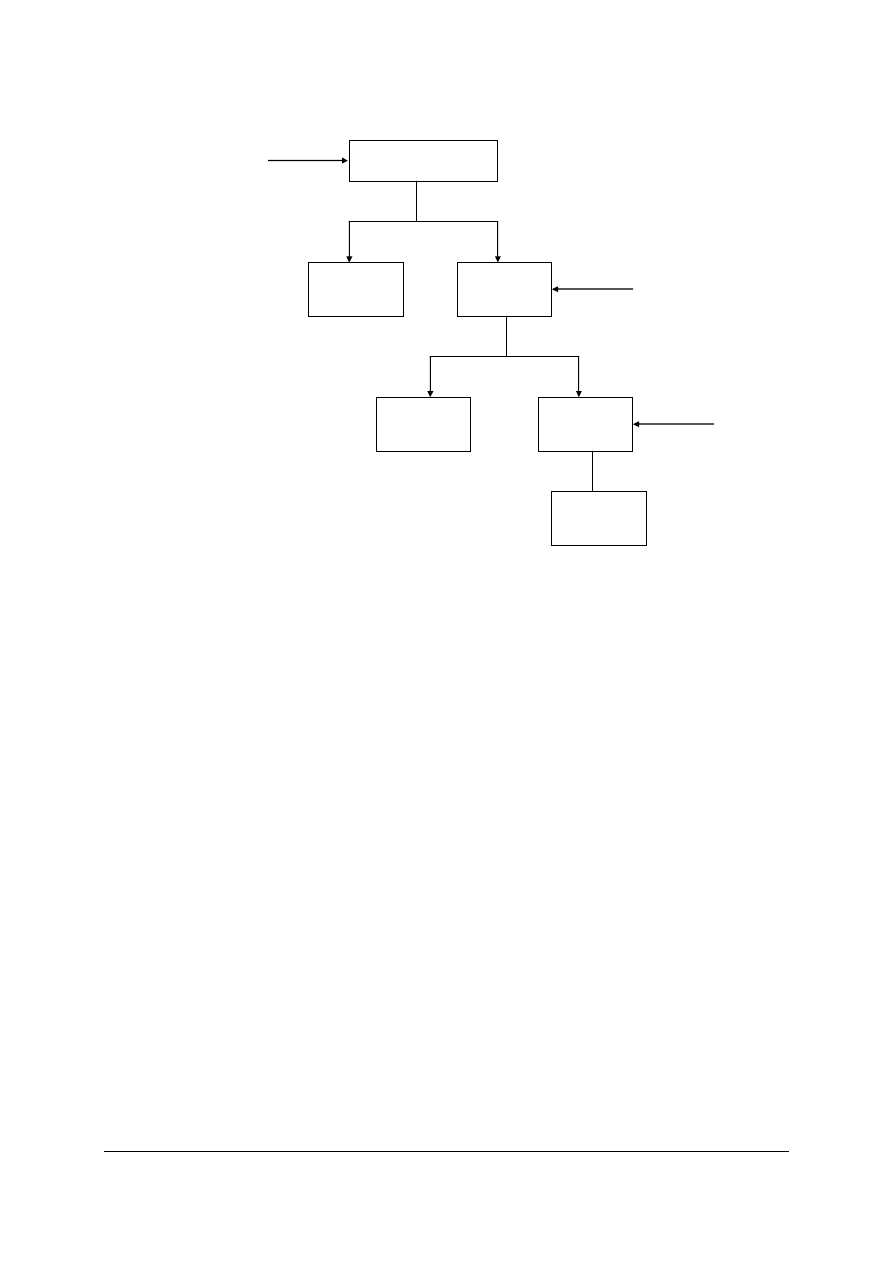
. Należy je rozdzielić przez selektywne
wytrącenie w postaci osadów. Odczynnikami mogą być: kwas solny, węglan sodu,
siarkowodór. Osady powstające w wyniku działania tych odczynników mają różną
rozpuszczalność. Korzystając z tablic rozpuszczalności i Kalendarza chemicznego uzupełnij
podany schemat w kolejności wytrącania osadów (rys. 1). Zapisz odpowiednie równania
w formie jonowej skróconej.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Rys. 1. Schemat kolejności wytrącania osadów [źródło własne]
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić jego zakres
i techniki wykonania.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) sprawdzić w tablicach rozpuszczalność poszczególnych chlorków,
siarczków i węglanów miedzi(II), magnezu i srebra(I),
2) porównać iloczyny rozpuszczalności CuS, CuCO
3
, AgCl, Ag
2
S, Ag
2
CO
3
, MgCO
3
,
3) zaprojektować kolejność wytrącania osadów,
4) uzupełnić podany schemat,
5) zapisać odpowiednie równania rekcji w formie jonowej skróconej.
Zalecane metody nauczania–uczenia się:
–
metoda projektów.
Środki dydaktyczne:
−
Kalendarz chemiczny,
−
tablice rozpuszczalności,
−
schemat do uzupełnienia.
Na
2
CO
3
H
2
S
HCl
Ag
+
, Cu
2+
, Mg
2+
osad
...............
.
roztwór
...............
.
osad
...............
.
roztwór
...............
.
osad
...............
.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
5.3. Zastosowanie związków buforowych i kompleksowych
w analizie jakościowej Grupy analityczne kationów
5.3.1. Ćwiczenia
Ćwiczenie 1
W pięciu probówkach znajdują się roztwory kationów z różnych grup analitycznych.
Określ ich przynależność do odpowiedniej grupy. Sposób przedstawienia wyników pokazuje
tabela 4 (Poradnik dla ucznia, rozdział 4, s. 25).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy,
przeprowadzić reakcje z odczynnikami grupowymi.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 3 (Poradnik dla ucznia, rozdział 4, s. 23 – 24),
6) wykonać analizę badanych próbek,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 4, Poradnik dla ucznia,
rozdział 4, s. 25).
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
odczynniki grupowe,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.
Ćwiczenie 2
Uzupełnij niżej podaną tabelę, wpisując w wolną kolumnę numer grupy oraz symbole
kationów, które mogą dawać osady podanej barwy.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Tabela 1. Określanie grupy analitycznej i kationów należących do tych grup
Lp.
Odczynnik grupowy
Barwa osadu
Grupa analityczna i symbole
kationów
1. H
2
S w roztworze HCl
o c = 0,3 mol · dm
-3
czarna
2. (NH
4
)
2
CO
3
w roztworze NH
4
Cl i NH
3aq
biała
3. H
2
S w roztworze NH
4
Cl
i NH
3aq
zielona
4. HCl
o c = 2 mol · dm
-3
biała
5. H
2
S w roztworze HCl
o c = 0,3 mol · dm
-3
żółta
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z materiałem nauczania,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) wykonać ślepe próby,
5) uzupełnić podaną wyżej tabelę.
Zalecane metody nauczania–uczenia się:
–
metoda projektów.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
odczynniki grupowe,
−
roztwory kationów pięciu grup analitycznych,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
5.4. Reakcje charakterystyczne, selektywne i specyficzne kationów
5.4.1. Ćwiczenia
Ćwiczenie 1
W pięciu probówkach znajdują się roztwory kationów I grupy analitycznej. Dokonaj
identyfikacji tych kationów. Sposób przedstawienia wyników pokazuje tabela 13 (Poradnik
dla ucznia, rozdział 4, s. 36).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 6 (Poradnik dla ucznia, rozdział 4, s. 28),
6) wykryć kationy I grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 13, Poradnik dla ucznia,
rozdział 4, s. 36).
Zalecane metody nauczania–uczenia się:
–
metoda projektów,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
tekst przewodni,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna,
−
badane próbki.
Ćwiczenie 2
W pięciu probówkach znajdują się roztwory kationów II grupy analitycznej. Dokonaj
identyfikacji tych kationów. Sposób przedstawienia wyników pokazuje tabela 13 (Poradnik
dla ucznia, rozdział 4, s. 36).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 7 (Poradnik dla ucznia, rozdział 4, s. 29-30),
6) wykryć kationy II grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 13, Poradnik dla ucznia,
rozdział 4, s. 36).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej, drucik platynowy,
−
zestaw odczynników do analizy jakościowej,
−
tekst przewodni,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna,
−
badane próbki.
Ćwiczenie 3
W pięciu probówkach znajdują się roztwory kationów III grupy analitycznej. Dokonaj
identyfikacji tych kationów. Sposób przedstawienia wyników pokazuje tabela 13 (Poradnik
dla ucznia, rozdział 4, s. 36).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 8 (Poradnik dla ucznia, rozdział 4, ss. 31-33),
6) wykryć kationy III grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 13, Poradnik dla ucznia,
rozdział 4, s. 36).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane próbki,
−
tekst przewodni,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.
Ćwiczenie 4
W pięciu probówkach znajdują się roztwory kationów IV grupy analitycznej. Dokonaj
identyfikacji tych kationów. Sposób przedstawienia wyników pokazuje tabela 13 (Poradnik
dla ucznia, rozdział 4, s. 36).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 9 i 10 (Poradnik dla ucznia, rozdział 4,
ss. 33 – 34),
6) wykryć kationy IV grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 13, Poradnik dla ucznia,
rozdział 4, s. 36).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej, drucik platynowy,
−
zestaw odczynników do analizy jakościowej,
−
tekst przewodni,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna.
−
badane próbki.
Ćwiczenie 5
W pięciu probówkach znajdują się roztwory kationów V grupy analitycznej. Dokonaj
identyfikacji tych kationów. Sposób przedstawienia wyników pokazuje tabela 13 (Poradnik
dla ucznia, rozdział 4, s. 36).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 11 i 12 (Poradnik dla ucznia, rozdział 4,
ss. 34 – 35),
6) wykryć kationy V grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 13, Poradnik dla ucznia,
rozdział 4, s. 36).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej, drucik platynowy,
−
zestaw odczynników do analizy jakościowej,
−
tekst przewodni,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna,
−
badane próbki.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
5.5. Grupy analityczne anionów, odczynniki grupowe Reakcje
charakterystyczne, selektywne i specyficzne anionów
5.5.1. Ćwiczenia
Ćwiczenie 1
W pięciu probówkach znajdują się roztwory anionów różnych grup analitycznych. Określ
ich przynależność do odpowiedniej grupy. Sposób przedstawienia wyników pokazuje
tabela 29 (Poradnik dla ucznia, rozdział 4, s. 46).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabeli 14 (Poradnik dla ucznia, rozdział 4, s. 39).
6) wykonać analizę badanych próbek,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 29, Poradnik dla ucznia,
rozdział 4, s. 46).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
odczynniki grupowe,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu.
Ćwiczenie 2
W pięciu probówkach znajdują się roztwory anionów I i II grupy analitycznej. Dokonaj
identyfikacji tych anionów. Sposób przedstawienia wyników pokazuje tabela 30 (Poradnik
dla ucznia, rozdział 4, s. 47).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabel 15 – 21 (Poradnik dla ucznia, rozdział 4,
ss. 40 – 43).
6) zidentyfikować aniony I i II grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 30, Poradnik dla ucznia,
rozdział 4, s. 47).
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna.
Ćwiczenie 3
W pięciu probówkach znajdują się roztwory anionów III i IV grupy analitycznej.
Dokonaj identyfikacji tych anionów. Sposób przedstawienia wyników pokazuje tabela 30
(Poradnik dla ucznia, rozdział 4, s. 47).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabel 15 – 21 (Poradnik dla ucznia, rozdział 4,
ss. 40 – 43),
6) zidentyfikować aniony III i IV grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 30, Poradnik dla ucznia,
rozdział 4, s. 47).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna.
Ćwiczenie 4
W pięciu probówkach znajdują się roztwory anionów V, VI i VII grupy analitycznej.
Dokonaj identyfikacji tych anionów. Sposób przedstawienia wyników pokazuje tabela 30
(Poradnik dla ucznia, rozdział 4, s. 47).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) przypomnieć zasady bezpiecznej pracy z substancjami chemicznymi,
2) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
3) przygotować niezbędne odczynniki,
4) zorganizować stanowisko pracy,
5) zaplanować czynności, korzystając z tabel 15 i 26 – 28, (Poradnik dla ucznia, rozdział 4,
ss. 40, 45),
6) wykryć aniony V, VI i VII grupy w badanych próbkach,
7) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 30, Poradnik dla ucznia,
rozdział 4, s. 47).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu, łaźnia wodna.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
5.6. Identyfikacja prostych soli rozpuszczalnych w wodzie
5.6.1. Ćwiczenia
Ćwiczenie 1
Zidentyfikuj otrzymaną sól stałą, rozpuszczalną w wodzie. Sposób przedstawienia
wyników pokazuje tabela 31 (Poradnik dla ucznia, rozdział 4, s. 51).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
2) przygotować niezbędne odczynniki,
3) zorganizować stanowisko pracy,
4) zaplanować czynności, korzystając ze schematu (rys. 3, Poradnik dla ucznia, rozdział 4, s.50),
5) rozpuścić w wodzie próbkę soli,
6) wykryć kation w próbce badanej,
7) wykryć anion w próbce badanej,
8) zapisać wzór soli,
9) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 31, Poradnik dla ucznia,
rozdział 4, s. 51).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badana próbka soli,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.
Ćwiczenie 2
Zidentyfikuj otrzymaną w postaci roztworu sól prostą. Sposób przedstawienia wyników
pokazuje tabela 31 (Poradnik dla ucznia, rozdział 4, s. 51).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Uczeń powinien:
1) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
2) przygotować niezbędne odczynniki,
3) zorganizować stanowisko pracy,
4) zaplanować czynności, korzystając ze schematu (rys. 3, Poradnik dla ucznia, rozdział 4, s. 50),
5) wykryć kation w próbce badanej,
6) wykryć anion w próbce badanej,
7) zapisać wzór soli,
8) przedstawić wyniki wykonanych analiz w postaci tabeli (tab. 31a, Poradnik dla ucznia,
rozdział 4, s. 52).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badana próbka soli,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
5.7. Jakościowe oznaczanie pierwiastków w związkach organicznych
5.7.1. Ćwiczenia
Ćwiczenie 1
Przeprowadź analizę dwóch otrzymanych próbek substancji w celu rozróżnienia związku
organicznego od związku nieorganicznego. Sposób przedstawienia wyników pokazuje
tabela 34 (Poradnik dla ucznia, rozdział 4, s. 55).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
2) przygotować niezbędne odczynniki,
3) zorganizować stanowisko pracy,
4) zaplanować czynności, korzystając z tabeli 32 (Poradnik dla ucznia, rozdział 4, s. 53),
5) wykonać analizę,
6) przedstawić wyniki wykonanej analizy w postaci tabeli (tab. 34, Poradnik dla ucznia,
rozdział 4, s. 55).
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badane próbki,
−
stół laboratoryjny z dostępem do wyciągu,
−
łaźnia wodna.
Ćwiczenie 2
Zbadaj obecność azotu, siarki i fluorowców w badanej próbce. Sposób przedstawienia
wyników pokazuje tabela 35 (Poradnik dla ucznia, rozdział 4, s. 56).
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać odpowiedni sprzęt laboratoryjny i środki ochrony osobistej,
2) przygotować niezbędne odczynniki,
3) zorganizować stanowisko pracy,

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
4) zaplanować czynności, korzystając z tabeli 33 (Poradnik dla ucznia, rozdział 4, s. 54,
5) wykonać analizę,
6) przedstawić wyniki wykonanej analizy w postaci tabeli (tab. 35, Poradnik dla ucznia,
rozdział 4, s. 56).
Zalecane metody nauczania–uczenia się:
–
metoda tekstu przewodniego,
–
ćwiczenia praktyczne.
Środki dydaktyczne:
−
tekst przewodni,
−
sprzęt laboratoryjny do analizy jakościowej,
−
zestaw odczynników do analizy jakościowej,
−
badana próbka,
−
stół laboratoryjny z dostępem do wyciągu,
−
palnik.
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test do jednostki modułowej „Wykonywanie analiz jakościowych”
Test składa się z 20 zadań, z których:
−
zadania 1, 2, 3, 6, 7, 9, 10,12, 13, 14, 15, 17, 18, 19, 20 są z poziomu podstawowego,
−
zadania 4, 5, 8, 12, 16 są z poziomu ponadpodstawowego.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
-
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
-
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
-
dobry – za rozwiązanie 15 zadań, w tym co najmniej 4 z poziomu ponadpodstawowego,
-
bardzo dobry – za rozwiązanie 17 zadań, w tym co najmniej 6 z poziomu
ponadpodstawowego,
Klucz odpowiedzi: 1. a, 2. a, 3. d, 4. d, 5. b, 6. a, 7. c, 8. c, 9. a, 10. c, 11. c,
12. a, 13. b, 14. d, 15. c, 16. d, 17. c, 18. b, 19. c, 20. d
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1.
Określić kolejność strącania osadów na
podstawie wartości iloczynów
rozpuszczalności
B
P
a
2.
Rozpoznać odczynniki grupowe
kationów i anionów
A
P
a
3. Wskazać kationy II grupy
B
P
d
4.
Dobrać odczynniki na podstawie zapisu
przebiegu reakcji chemicznej
C
PP
d
5.
Dobrać odczynniki na podstawie zapisu
przebiegu reakcji chemicznej
C
PP
b
6.
Rozpoznać obecność kationu na
podstawie zabarwienia roztworu
B
P
a
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
7.
Zidentyfikować kation na podstawie
barwy osadu, powstałego w reakcji
kationu z odczynnikiem grupowym
C
P
c
8.
Zidentyfikować kation na podstawie
przebiegu charakterystycznych reakcji
C
PP
c
9.
Wskazać kationy tworzące siarczki
w środowisku kwaśnym
B
P
a
10.
Wskazać kationy tworzące siarczki
w środowisku amoniakalnym
B
P
c
11.
Zidentyfikować kationy III grupy,
które
w reakcji z odczynnikiem grupowym
tworzą osady wodorotlenków
C
P
c
12.
Ustalić przyczyny strącania się
wodorotlenków w III grupie kationów
D
PP
a
13.
Wskazać substancje dającą reakcję
charakterystyczną z podanym
odczynnikiem
B
P
b
14.
Przewidzieć odczyn wodnych
roztworów soli
C
P
d
15.
Wskazać aniony reagujące
z kwasem siarkowym(VI)
z wydzieleniem gazu
B
P
c
16.
Wskazać aniony o właściwościach
utleniająco-redukujących
C
PP
d
17.
Wskazać jony wymagające badań
wstępnych w analizie soli prostej
B
P
c
18.
Zastosować tabelę rozpuszczalności
soli do identyfikacji soli baru
C
P
b
19.
Identyfikować kationy na podstawie
zabarwienia płomienia palnika
C
P
c
20.
Wskazać substancję używaną
do sporządzenia wyciągu sodowego
A
P
d

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Przebieg testowania
INSTRUKCJA DLA NAUCZYCIELA
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych,
jakie będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań dotyczących wykonywania analiz jakościowych. Są to zadania
wielokrotnego wyboru i tylko jedna odpowiedź jest prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi. Prawidłową odpowiedź
zaznacz X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową).
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego
rozwiązanie na później i wróć do niego, gdy zostanie Ci wolny czas. Trudności mogą
przysporzyć Ci zadania: 1, 4, 5, 8, 12, 15, 16, gdyż są one na poziomie trudniejszym niż
pozostałe.
8. Na rozwiązanie testu masz 60 minut.
Powodzenia
Materiały dla ucznia:
-
instrukcja,
-
zestaw zadań testowych,
-
karta odpowiedzi.
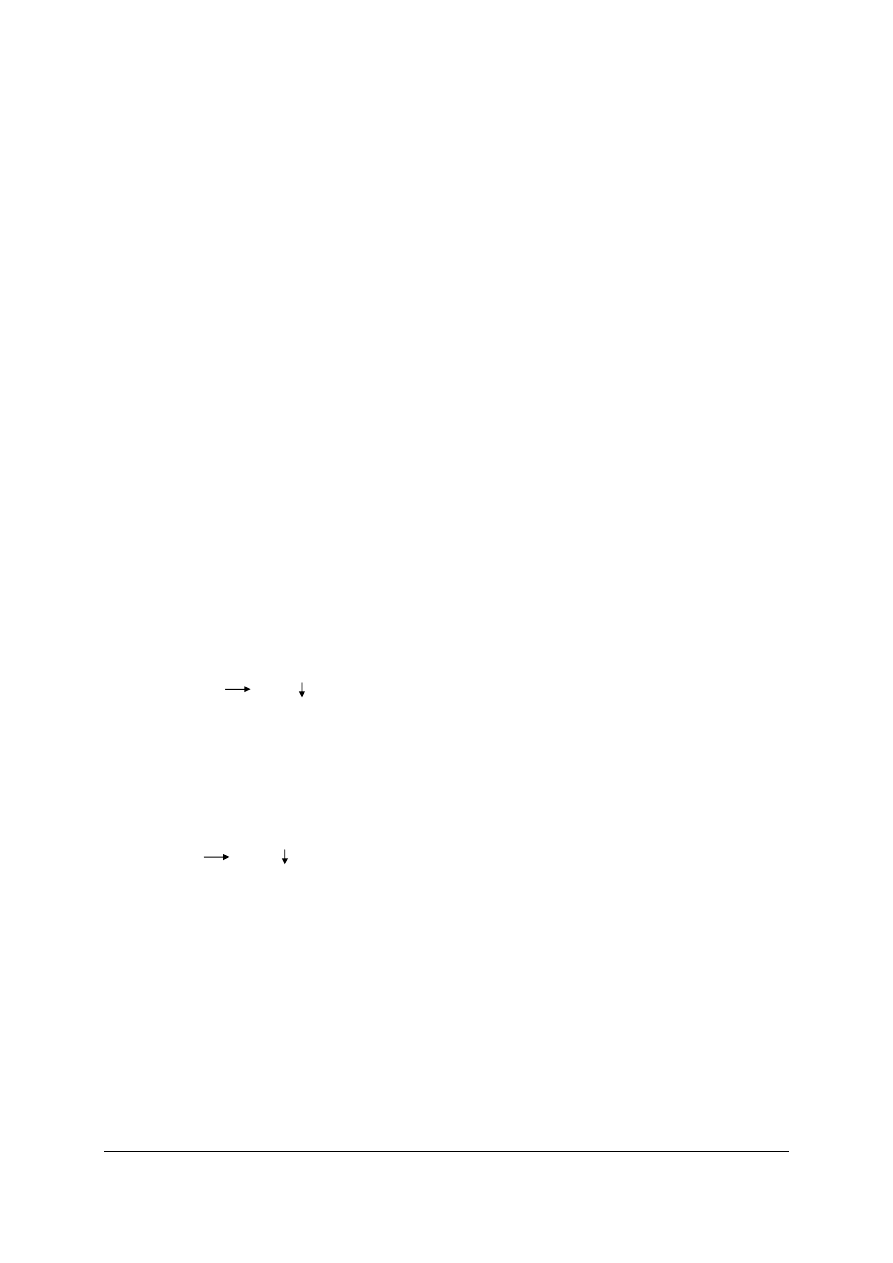
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
ZESTAW ZADAŃ TESTOWYCH
1. Wartości iloczynów rozpuszczalności siarczanów(VI ) wybranych pierwiastków wynoszą:
BaSO
4
1,1·10
-10
CaSO
4
6,1·10
-5
PbSO
4
2,2·10
-8
SrSO
4
2,8·10
-7
Jeśli w roztworze znajdują się Ba
2+
, Ca
2+
, Pb
2+
, Sr
2+
, to kolejność strącania się siarczanów
po dodaniu H
2
SO
4
będzie następująca:
a) BaSO
4
, PbSO
4,
SrSO
4
, CaSO
4
b) PbSO
4
, CaSO
4
, SrSO
4,
BaSO
4
c) BaSO
4
, CaSO
4,
PbSO
4
, SrSO
4
d) CaSO
4
, SrSO
4
, PbSO
4,
BaSO
4
2. Wyłącznie „analityczne odczynniki grupowe” wymieniono w punkcie:
a) HCl, AgNO
3
, BaCl
2
b) HCl, H
2
S, NaOH
c) HCl, KI, NH
3aq
d) AgNO
3
, (NH
4
)
2
CO
3
, NaOH
3. Kationy wyłącznie jednej grupy wymieniono w punkcie:
a) Hg
2+
, Pb
2+
, Ag
+
b) Fe
3+
, Fe
2+
, Cu
2+
c) Ca
2+
, Mg
2+
, Ba
2+
d) K
+
, Na
+
, NH
4
+
4. Aby zademonstrować reakcję
Pb
2+
+ 2Cl
-
PbCl
2
należy zastosować następujące związki:
a) PbSO
4
, HCl
b) PbCrO
4
, HCl
c) PbS, HCl
d) Pb(NO
3
)
2
, HCl
5. Aby przeprowadzić reakcję
Ag
+
+ Br
-
AgBr
należy wykorzystać związki:
a) Ag
2
S, NaBr
b) AgNO
3
, KBr
c) AgCl, KBr
d) Ag
2
CrO
4
, HBr
6. Niebieskie zabarwianie roztworu soli prostej w wodzie, świadczy o obecności jonu:
a) Cu
2+
b) Cr
3+
c) S
2
O
3
2-
d) Zn
2+

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
7. Większość siarczków kationów II i III grupy analitycznej to osady czarne
i ciemnobrunatne. Żółty osad siarczku z odczynnikiem grupowy tworzy kation:
a) Cu
2+
b) Fe
3+
c) Cd
2+
d) Bi
3+
8. Przeprowadzono następujące reakcje, w celu identyfikacji kationu pierwiastka X
X + S
2-
XS biały
X + 2OH
-
X(OH)
2
biały
X + 2NH
3aq
+ 2H
2
O 2NH
4
+
+
X(OH)
2
biały roztwarzający się w nadmiarze NH
3aq
Identyfikowanym pierwiastkiem jest:
a) Cu
b) Mg
c) Zn
d) Ca
9. Kationy tworzące siarczki w środowisku kwaśnym to:
a) Cu
2+
, Hg
2+
b) Cr
3+
,Fe
3+
c) Fe
2+
, Zn
2+
d) Fe
3+
, Ca
2+
10. W środowisku amoniakalnym siarczki tworzą kationy:
a) Cu
2+
, Al
3+
b) Cr
3+
,Fe
3+
c) Fe
2+
, Zn
2+
d) Fe
3+
, Ca
2+
11. W III grupie analitycznej kationów, w reakcji z odczynnikiem grupowym, wytrącają się
siarczki lub wodorotlenki. Wodorotlenki tworzą :
a) Al
3+
, Zn
2+
b) Fe
3+
, Fe
2+
c) Al
3+
, Cr
3+
d) Zn
2+
, Fe
3+
12. Strącanie wodorotlenków w reakcji niektórych kationów III grupy z odczynnikiem
grupowym spowodowane jest :
a) K
so
wodorotlenku < K
so
siarczku
b) K
so
wodorotlenku > K
so
siarczku
c) hydrolizą siarczków
d) kompleksowaniem
13. Jony Fe
3+
w roztworze reagują z roztworem NH
4
SCN, dając krwistoczerwone zabarwienie
roztworu w skutek powstawania Fe(SCN)
3
i [Fe(SCN)
6
]
3-
.
Aby przeprowadzić tę reakcję, należy użyć roztworu:
a) FeSO
4
b) Fe(NO
3
)
3
c) FeCl
2
d) FeSO
3

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
14. Solą, której wodny roztwór ma odczyn zasadowy, jest:
a) NH
4
Cl
b) KNO
3
c) FeCl
2
d) Na
2
CO
3
15. Reakcji ze stężonym H
2
SO
4
z wydzieleniem substancji gazowej ulegają aniony:
a) SO
4
2-
, HPO
4
2-
b) PO
4
3-
, SCN
-
c) NO
3
-
,CO
3
2-
d) SiO
3
2-
, SO
4
2-
16. Do odczynników badających właściwości utleniająco-redukujące anionów nie należą:
a) KI w środowisku kwaśnym
b) KMnO
4
c) I
2
w KI
d) AgNO
3
lub rozcieńczony H
2
SO
4
17. Przed systematyczną analizą kationu w soli prostej rozpuszczalnej w wodzie należy
zbadać obecność:
a) Ag
+
, Pb
2+
, K
+
b) Cu
2+
, Ca
2+
, Mg
2+
c) NH
4
+
, Fe
3+
, Fe
2+
d) Al
3+
, Ba
2+
, Hg
2+
18. Wykrycie kationu Ba
2+
w soli prostej rozpuszczalnej w wodzie, wyklucza obecność
anionu :
a) Cl
-
b) SO
4
2-
c) S
2-
d) Br
-
19. Ceglastoczerwone zabarwienie płomienia gazowego świadczyć może o obecności
w roztworze:
a) Ba
2+
b) Cu
2+
c) Ca
2+
d) K
+
20. Do sporządzania „wyciągu sodowego” stosowany jest:
a) NaCl
b) NaOH
c) NaNO
3
d) Na
2
CO
3
„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie analiz jakościowych
Zakreśl poprawną odpowiedź
,
wpisz brakujące części zadania lub wykonaj rysunek.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
TEST 2
Próba pracy do jednostki modułowej „Wykonywanie analiz jakościowych”
Zadanie dla ucznia:
Dokonaj identyfikacji soli stałej, rozpuszczalnej w wodzie.
Plan testu
Lp.
Nazwa czynności
Liczba punktów
możliwych do
uzyskania
1.
2.
3.
I. Planowanie wykonania analizy:
– projektowanie etapów pracy,
– projektowanie zestawu sprzętu laboratoryjnego
i odczynników,
– ustalenie warunków bezpiecznej pracy,
1
2
1
4.
5.
6.
7.
8.
9.
II. Wykonanie zadania:
– opisanie cech zewnętrznych soli,
– badanie odczynu roztworu wodnego soli,
– określanie grupy analitycznej kationu,
– zidentyfikowanie składników soli: kationu i anionu,
– zapisanie po dwa równania reakcji pozwalających
zidentyfikować kation i anion,
– podanie wzoru analizowanej soli.
1
1
1
2
4
1
III. Zachowanie porządku na stanowisku pracy
1
Razem:
15
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
15 – 13 punktów – bardzo dobry
12 – 11 punktów – dobry
10 – 9 punktów – dostateczny
8 – 7 punktów – dopuszczający

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
NSTRUKCJA DLA NAUCZYCIELA
1) Przed rozpoczęciem wykonywania zadania przez uczniów należy:
-
zapewnić warunki do samodzielnej pracy,
-
rozdać karty pracy oraz instrukcje dla ucznia,
-
odczytać uczniom przeznaczoną dla nich instrukcję oraz udzielić odpowiedzi na
pytania.
2) Podczas wykonywania zadania powinny być spełnione następujące warunki:
-
czas trwania próby pracy 90 minut,
-
praca samodzielna, indywidualne stanowiska pracy,
-
maksymalna liczba uczniów w grupie – 16 osób,
-
wykonane zadanie uczeń opisuje na karcie pracy,
-
nauczyciel pełni rolę obserwatora,
-
kilka minut przed zakończeniem sprawdzianu nauczyciel przypomina uczniom
o zbliżającym się czasie zakończenia zadania,
-
po wykonaniu zadania uczeń oddaje kartę pracy nauczycielowi.
3) Po wykonania zadania nauczyciel:
-
wpisuje do karty oceny wyniki przeprowadzonego testowania,
-
przeprowadza analizę wyniku sprawdzianu,
-
opracowuje wnioski do dalszego postępowania, mającego na celu uniknięcie
niepowodzeń dydaktycznych.
Uczeń może otrzymać maksymalnie 15 punktów.
INSTRUKCJA DLA UCZNIA
Zadanie, które będziesz wykonywać polega na identyfikacji soli prostej rozpuszczalnej
w wodzie.
Aby wykonać zadanie, powinieneś w karcie pracy:
1) zaprojektować etapy pracy,
2) zaprojektować zestaw sprzętu laboratoryjnego i odczynników,
3) ustalić warunki pracy,
4) opisać cechy zewnętrzne soli,
5) zbadać odczyn roztworu wodnego soli,
6) określić grupę analityczną kationu,
7) zidentyfikować składniki soli: kation i anion,
8) zapisać dwa równania reakcji pozwalających zidentyfikować kation i dwa – anion,
9) podać wzór analizowanej soli.

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
KARTA PRACY
Imię i nazwisko..........................................................................................
TEST
Próba pracy do jednostki modułowej „Wykonywanie analiz jakościowych”
Zadanie dla ucznia:
Dokonaj identyfikacji soli stałej, rozpuszczalnej w wodzie.
1) Etapy pracy (1pkt)
2) Zestaw sprzętu laboratoryjnego i odczynników (2 pkt)
3) Warunki pracy (1 pkt)
4) Cechy zewnętrzne soli (1 pkt)
5) Odczyn roztworu wodnego soli (1 pkt)

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
6) Określenie grupy analitycznej kationu (1 pkt)
7) Identyfikacja składników soli: kationu i anionu (2 pkt)
8) Równania reakcji pozwalających zidentyfikować: (4 pkt)
kation
anion
9) wzór analizowanej soli (1 pkt)

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
KARTA OCENY
Imię i nazwisko..........................................................................................
TEST
Próba pracy do jednostki modułowej „Wykonywanie analiz jakościowych”
Plan testu
Lp.
Nazwa czynności
Liczba punktów
możliwych do
uzyskania
1.
2.
3.
I. Planowanie wykonania analizy:
– projektowanie etapów pracy,
– projektowanie zestawu sprzętu laboratoryjnego
i odczynników,
– ustalenie warunków bezpiecznej pracy,
4.
5.
6.
7.
8.
9.
II. Wykonanie zadania:
– opisanie cech zewnętrznych soli,
– badanie odczynu roztworu wodnego soli,
– określanie grupy analitycznej kationu,
– zidentyfikowanie składników soli: kationu i anionu,
– zapisanie po dwa równania reakcji pozwalających
zidentyfikować kation i anion,
– podanie wzoru analizowanej soli.
III. Zachowanie porządku na stanowisku pracy
Razem:
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
15 – 13 punktów – bardzo dobry
12 – 11 punktów – dobry
10 – 9 punktów – dostateczny
8 – 7 punktów – dopuszczający

„
Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
7. LITERATURA
1. Klepaczko-Filipiak B., Sadlak E.: Badania chemiczne. Analiza jakościowa substancji.
WSiP, Warszawa 1998
2. Klepaczko-Filipiak B., Jakubiak Z., Wulkiewicz U.: Badania chemiczne. Technika pracy
laboratoryjnej. WSiP, Warszawa 1998
3. Kocjan R.: Chemia analityczna. Tom1. Analiza jakościowa. Analiza ilościowa klasyczna.
PZWL, Warszawa 2005
4. Minczewski J., Marczenko Z.: Chemia analityczna. Tom 1. Podstawy teoretyczne
i analiza jakościowa. PWN, Warszawa, 2005
5. Rosołowski S.: Pracownia chemiczna. Analiza jakościowa. WSiP, Warszawa 1993
Wyszukiwarka
Podobne podstrony:
02 Wykonywanie analiz jakosciow Nieznany (2)
02 Wykonywanie analiz jakościowych
05 Wykonywanie analizy jakościowej i ilościowej produktów
5 Wykonywanie analizy jakościowej i ilościowej produktów leczniczych
05 Wykonywanie analizy jakościowej i ilościowej produktów
05 Wykonywanie podstawowych analiz jakościowych
Wykonywanie podstawowych analiz jakościowych
Analiza jakościowa kationów i anionów, Analiza jakościowa
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE CHLORKÓW I SIARCZANÓW
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
27 Kardas Prusak Gajek Analiza jakosci wyrobow
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
analiza jakościowa kationów
02 Opracowanie i analiza materi Nieznany (2)
Badanie właściwości i analiza jakościowa tłuszczów
1 ćwiczenie (Analiza jakościowa wody) PARAMETRY FIZYCZNE WODY
4.Analiza jakościowa kationów. Reakcja kationu manganu (Mn2+). NaOH, NH4OH, MnSO4., Państwowa Wyższa
02 Wykonywanie masazu pielegnac Nieznany (2)
więcej podobnych podstron