
Ogólny podział:
1. W zależności od składu i funkcji podłoża dzielimy na:
- proste
- wzbogacone
- specjalne
- wybiórcze (selektywne)
- różnicujące
- transportowe
- transportowo-wzrostowe
2. Ze względu na konsystencję pożywki:
- stałe (dodatek agaru; żelatyny; żelu krzemionkowego. Agar –dodany w
stężeniu – 0,5 – 1% = podłoże półpłynne; 1,5-3% = podłoże stałe)
- płynne
Najprostszym podłożem płynnym jest:
• bulion mięsny – wyciąg mięsny + 1% peptony + 0,5% NaCl
• bulion drożdżowy – wyciąg drożdżowy + pepton + NaCl
Podłoża wzbogacone: są to podłoża z dodatkiem krwi, surowicy lub innych składników,
zawierających dodatkowe czynniki wzrostowe, które umożliwiają hodowlę i rozwój
najbardziej wybrednych pod względem odżywczym bakterii
Podłoża specjalne: są to podłoża z dodatkiem węglowodanów lub innych specyficznych
substratów. Służą m.in. do określania cech hodowanych drobnoustrojów np. właściwości
fermentacyjnych danego drobnoustroju, lub do wytwarzania specyficznych produktów
metabolizmu takich jak: toksyny, antybiotyki itd. Przykładem podłoży specjalnych są
pożywki wchodzące w skład tzw. szeregów biochemicznych używanych do identyfikacji
bakterii – podłoże Kliglera, podłoże Stuarta (wykrywanie urezay)
Podłoża różnicujące: są to podłoża gdzie może rosnąć kilka lub kilkanaście gatunków
drobnoustrojów, ale każdy z nich wytwarza charakterystyczne, łatwe do zróżnicowania
kolonie, co pozwala na ich szybką i dalszą, już ukierunkowaną, szczegółowa identyfikację.
Stałe podłoża różnicujące często są jednocześnie wybiórczymi dla określonej grupy, rodzaju
drobnoustrojów i są nazywane wybiórczo-różnicującymi.
Podłoża wybiórczo-różnicujące: np.
• podłoża do hodowli bakterii z rodziny Enterobacteriaceae: MacConkey, Endo, SS,
Levina; podłoża do hodowli maczugowców: podłoże Clauberga z tulerynem potasu
• podłoże do hodowli gronkowców: podłoże Champamana
• podłoże do hodowli grzybów i pleśni: podłoże Saburoda
Podłoża wybiórcze: są to podłoża z dodatkiem takim substancji, które umożliwiają wzrost
tylko pewnych określonych gatunków bakteryjnych czy grzybiczych a jednocześnie hamują
wzrost innych gatunków. Podłoża te pozwalają na wyizolowanie jednego lub kilku gatunków
bakteryjnych czy grzybiczych z materiału, w którym znajduje się cała masa drobnoustrojów.
Np. podłoże z dodatkiem fioletu krystalicznego, które umożliwia wzrost tylko bakterii Gram-
ujemnych, podłoże do hodowli prądków – Löwenssteina-Jensena, różne podłoża selektywne
do hodowli bakterii z rodzaju Campylobacter, Yersinia, Vibrio, gatunków Listeria
monocytogenes
, Helicobacter pylori, itd.; wiele z nich zawiera antybiotyki jako składnik
selekcjonujący drobnoustroje.
Do podłoży dodawane są barwniki (wskaźniki), które zmieniają swoje zabarwienie w
zależności od pH podłoża (często jest to błękit bromotymolowy, czerwień fenolowa, purpura
bromkokrezolowa i inne).
Przy podłożach wybiórczo-różnicujących zmiana zabarwienia w czasie wzrostu określonego
drobnoustroju informuje o określonej właściwości w zależności od danego substratu (np.
rozkład laktozy, manitolu itd.)
Hodowla drobnoustrojów może być prowadzona:
• w warunkach tlenowych – cieplarki 35°- 37° C lub 22°-30°C, 42°C
• w warunkach mikroaerofilnych (eksykatory i generatory wytwarzające gaz i/lub jego
mieszaniny o określonym stosunku ilościowym i/lub procentowym np. CO
2
; H
2
+CO
2
• w warunkach beztlenowych – generatory z gotową
Czas inkubacji hodowli: 24h do 7 doby/ dla grzybów niedoskonałych - 14 dni
Metody hodowli drobnoustrojów, połączone z wyosobnieniem i identyfikacją, nazywane
metodami konwencjonalnymi (klasycznymi) pozostają do chwili obecnej referencyjne w
diagnostyce mikrobiologicznej.
Do hodowli bakterii i grzybów najczęściej wykorzystywane są podłoża stałe, rzadziej płynne.
Posiew materiałów oraz posiewy bakterii lub grzybów na podłoża stałe dokonywany jest przy
użyciu ezy: platynowe, z drutu Kanthalowego, plastikowe =jednorazowe
Najczęściej stosowana technika = technika posiewu redukcyjnego (technika posiewu z
izolacją).
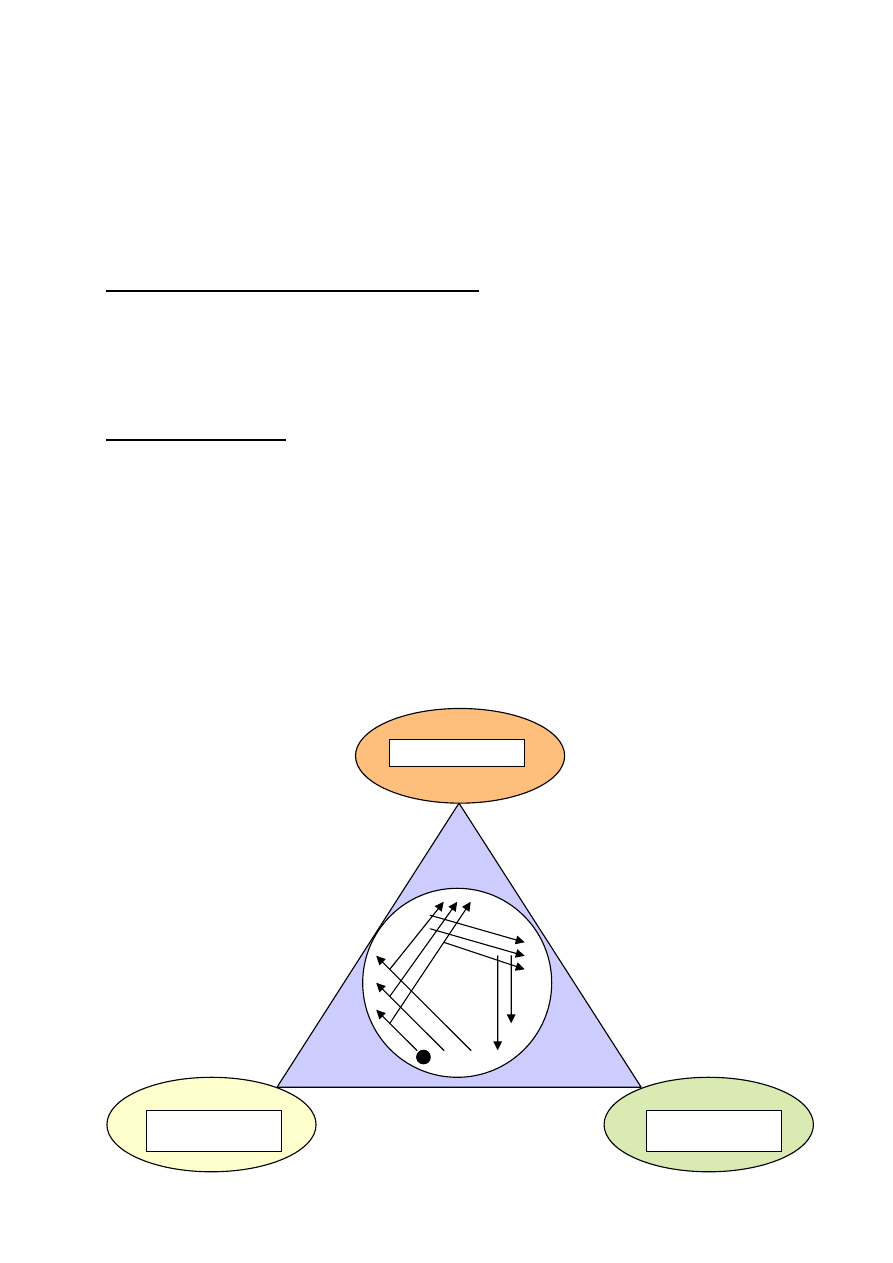
Kolonia jest zbiór komórek wyrastających na podłożu stałym, widoczny gołym okiem.
Posiew redukcyjny
Izolacja
drobnoustrojów
Kolonia bakterii
i/lub grzyba

Przyjmuje się (w posiewach półilościowych i ilościowych), że jedna kolonia odpowiada
jednej komórce bakteryjnej lub grzybiczej.
Zamiast liczby komórek przypadających na g (gram) lub ml (mililitr), wprowadzono do badań
ilościowych określenie cfu (ang. colony forming units), czyli jednostki tworzące kolonie.
Przy opisie kolonii (osobnik I rzędu) = MORFOLOGIA KOLONII najczęściej bierze się
pod uwagę:
1. kształt – okrągły, owalny, nieregularny, postrzępiony, gwiazdkowaty, promienisty,
soczewkowaty, głowa meduzy i inne,
2. wielkość – średnica kolonii w mm,
3. brzeg – równy, falisty, zatokowaty, postrzępiony, poszarpany, ząbkowany i inny;
4. powierzchnia – gładka, szorstka, drobno- lub gruboziarnista, pomarszczona matowa,
błyszcząca, brodawkowata itp.;
5. struktura – bezkształtna, szorstka, nitkowata, ziarnista i inne;
6. wyniosłość ponad powierzchnię – brak, wypukła, płaska, stożkowata, o wyniosłym
brzegu i zapadłym środku, kopulasta ze środkiem wzniesionym w postaci guziczka,
itp.;
7. kolor – barwa w świetle odbitym i przepuszczalnym, zabarwienie samej kolonii,
zabarwienie podłoża (barwniki rozpuszczalne). Najczęstsze barwy – biała, żółta,
pomarańczowa, czerwona, czarna, zielona, niebieska, brązowa, i inne;
8. przejrzystość – przejrzysta, mętna, przeświecająca, opalizująca, nieprzejrzysta
9. konsystencja – masłowata, sucha, lepka, błoniasta, skórzasta, ciągła, śluzowata,
10. zapach – mdławy (np. Pseudomonas aeruginosa = kredki świecowe, jaśmin), kwaśne
= gronkowce, piwa, miodu, gliny itp.,
11. zawieszalność – zdolność do tworzenia jednolitej zawiesiny w roztworze soli
fizjologicznej – łatwa; niezawieszalna – grudkowa,
12. inne cechy, takie jak: typ hemolizy na podłożu z dodatkiem krwi:
- typ β – całkowita liza wokół kolonii
- typ α – częściowa liza, zazielenienie wokół kolonii
- typ γ – brak hemolizy
Typy wzrostu na podłożach płynnych, jako ocena morfologii niektórych drobnoustrojów,
wiążą się ściśle ze sposobem oddychania.
Drobnoustroje tlenowe rosną na powierzchni podłoża płynnego; względne beztlenowce
powodują zmętnienie całej pożywki, a beztlenowce tworzą osad na dnie próbówki – np.
wzrost drobnoustrojów na podłożu półpłynnym Schedlera.

Podłoża opis:
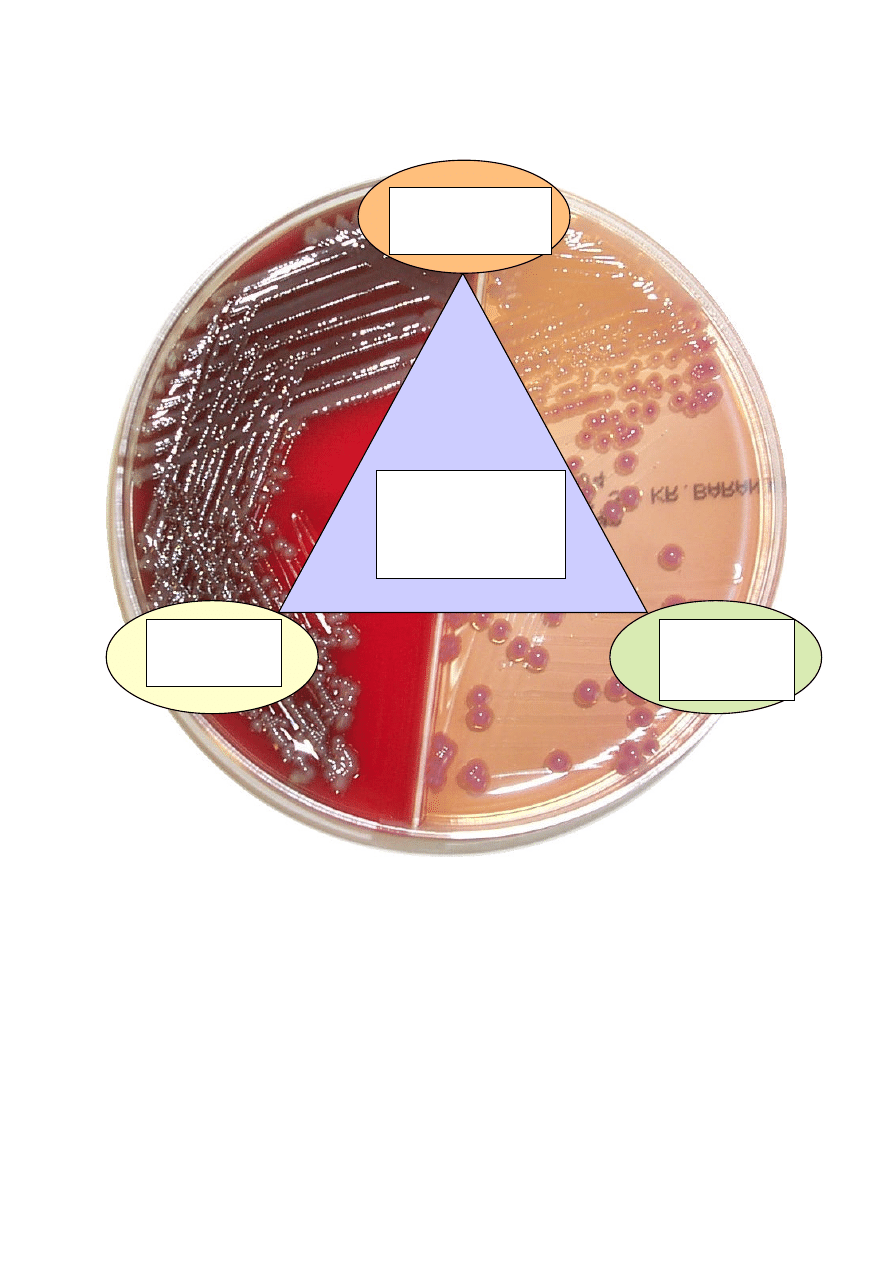
Agar MacConkey – podłoże wybiórczo-różnicujące; służy do izolacji pałeczek Gram-
ujemnych z materiałów klinicznych. Jest to podłoże diagnostyczne o słabej wybiórczości.
Zawartość soli żółci i fioletu krystalicznego hamuje wzrost bakterii Gram-dodatnich i Gram-
ujemnych, które mają duże wymagania odżywcze. Zawartość laktozy jako jedynego cukru
pozwala na odróżnienie pałeczek laktozo-dodatnich od laktozo-ujemnych. W obecności
zawartego w podłożu wskaźnika – czerwieni obojętnej, wskutek zależnego od rozkładu
laktozy zakwaszenia środowiska, kolonie bakterii rozkładających laktozę zabarwiają się na
kolor różowy. Kolonie, które aktywnie rozkładają laktozę (np. Escherichia coli), są ponadto
otoczone różową strefa wytrąconych soli kwasów żółciowych. Kolonie szczepów
rozkładających laktozę słabo lub z opóźnieniem (np. Citrobacter sp.) mogą pozostać
bezbarwne lub stają się lekko różowe dopiero po 48 godzinach hodowli. Pałeczki laktozo-
ujemne (np. Shigella sp.; Salmonella sp.; Pseudomonas sp.;) mają bezbarwne kolonie.
Podłoże hamuje mgławicowy (rozpełzliwy) wzrost bakterii z rodzaju Proteus np. Proteus
mirabilis
.
2.4.1. Identyfikacja i wykonanie antybiogramu dla pałeczki z rodziny Enterobacteriaceae
– Escherichia coli.
2.4.2. Wykonanie preparaty mikroskopowego z kolonii bakteryjnej barwionego metodą
Grama (Załacznik 1).
2.4.3. Wykonanie testu bibułowego – wykrywanie indolu.
2.4.4. Wykonanie krótkiego szeregu biochemicznego dla pałeczek z rodzaju
Enterobacteriaceae
:
2.4.4.1. Podłoże Kliglera: jest to stałe podłoże diagnostyczne dla pałeczek Gram-
ujemnych o małych wymaganiach odżywczych, szczególnie używane w
diagnostyce Enterobacteriaceae. Pozwala ono zbadać zdolność rozkładu
glukozy, laktozy i wytwarzanie siarkowodoru. Przygotowane jest w
probówkach w postaci małych półskosów (rysunki 1, 2, 3,). Podłoże
wymaga starannego posiewu zarówno w części słupkowej (wkłucie), jak i
skośnej. Proporcja masy podłoża do posianego inokulum w obu częściach
Pałeczka Gram-ujemna
z rodziny
Enterobacteriaceae
–
fermentująca laktozę
Escherichia coli
Wykonanie preparatu
met. Grama
Test bibułowy –
wykrywanie indolu
Rząd biochemiczny
lub identyfikacja
met. automatyczna
karty GNI+
Wykonanie
antybiogramu: met.
krążkowo-dyfuzyjna,
E-testy , met.
automatyczna

jest odwrotna – w części słupkowej przy małym inokulum jest dużo
podłoża, a w skośnej odwrotnie. Podłoże zawiera między innymi glukozę i
laktozę (w proporcji 1:10), tiosiarczan i jony żelaza, które są wskaźnikiem
wytwarzania H
2
S, oraz wskaźnik pH.
Rozkład glukozy przejawia się zakwaszeniem i zażółceniem wyjściowo
łososiowego podłoża. Zmiana postępuje szybciej w części skośnej, gdzie
wkrótce pojawia się powrót do barwy wyjściowej, z powodu wtórnej
alkalizacji będącej wynikiem rozkładu aminokwasów (skos łososiowy +
słupek żółty = rozkład glukozy – schemat III-3). Jeżeli będzie rozkładana
laktoza, żółte zabarwienie obu części utrzymuje się przez wiele godzin
(skos żółty + słupek żółty = rozkład laktozy – schemat III-2).
Brak rozkładu cukrów wiąże się z alkalizacją pożywki, która pogłębia
swoją wyjściową barwę – przyjmując kolor czerwony – schemat III -1.
Wytwarzanie w czasie fermentacji cukrów dużych ilości CO
2
lub H
2
uwidacznia się przez rozerwanie lub unoszenie podłoża.
Tworzenie się H
2
S z tiosiarczanu zachodzi powoli w kwaśnym środowisku
słupka i powoduje powstawanie nierozpuszczalnego czarnego strątu
siarczku żelaza. Ocena podłoża powinna być dokonana po 24 godzinach.
1.
2.
3.
Schemat III. Podłoże Kliglera i efekt fermentacji cukrów – 1. - brak frementacji cukrów; 2. -
rozkład laktozy; 3. – rozkład glukozy
2.4.4.2 . Rozkład mocznika (wytwarzanie ureazy) – najpopularniejsze
podłoże ubogie, podłoże Stuarta – w postaci płynnej. Podłoże to zawiera
między innymi mocznik (2%), tryptofan oraz wskaźnik pH – czerwień
fenolową . Bakterie posiewa się na podłoże i inkubuje przez 24 godziny w
temperaturze 37°C. Bakterie wytwarzające enzym ureazę rozkładają mocznik
do NH
3
i CO
2
. Powstający w trakcie hodowli NH
3
alkalizuje podłoże i
powoduje zmianę barwy z żółtej (schemat IV – 1) na różowoamarantową
(schemat IV – 2).
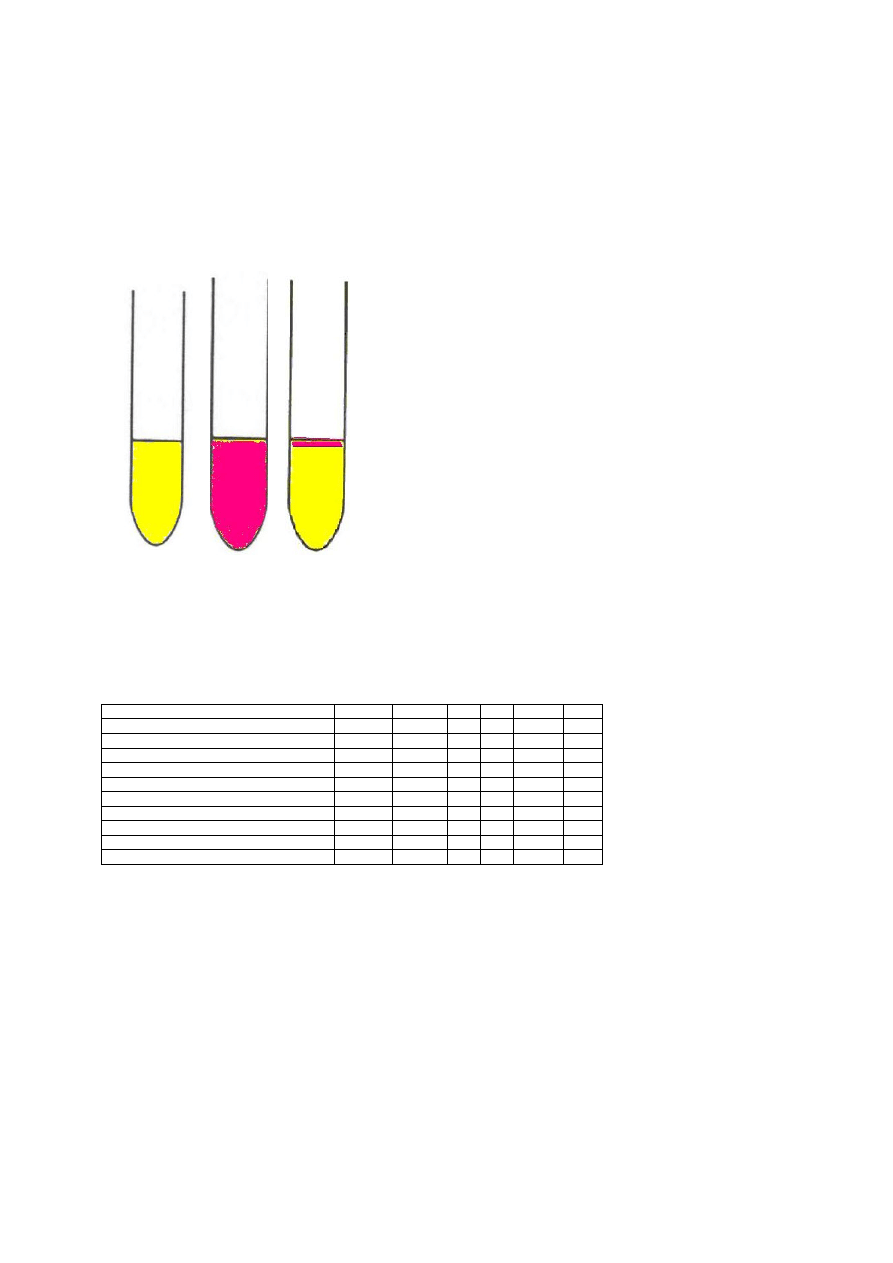
Dodanie do podłoża odczynnika Ehrlicha w skład, którego wchodzi : p-
dimetyloaminobenzaldehyd, alkohol amylowy i stężony kwas solny - w
przypadku reakcj dodatniej powoduje pojawienie się ciemnoamarantowej
obrączki na powierzchni podłoża (tryptofan zawarty w podłożu za
pośrednictwem tryptofanazy przekształcany jest w indol, skatol i kwas
pirogronianowy i NH
3
.
1.
2.
3.
Schemat IV. Podłoże – rozkład mocznika (wytwarzanie ureazy); 1- brak wytwarzania ureazy,
2-wytwarzanie ureazy, 3- wytwarzanie indolu.
Tabela 2. Wstępna identyfikacja pałeczek Gram-ujemnych z rodziny Enterobacteriaceae na
podstawie wyniku reakcji biochemicznych uzyskanych na podstawie krótkiego szeregu
biochemicznego.
Gatunek
Glukoza Laktoza Gaz H2S Ureaza Indol
E. coli
+
+
+
(-)
(-)
+
Klebsiella
sp.
+
+
+
(-)
+
+/-
Enterobacter
sp.
+
+
+
(-)
(-)
(-)
Citrobacte
r sp.
+
+
+
+
(-)
+/-
Serratia marcescens
+
(-)
(-)
(-)
(-)
(-)
Proteus mirabilis
+
(-)
+
+
+
(-)
Proteus vulgaris
+
(-)
+/-
+
+
+
Morgalella morgani/Providentia rettgeri
+
(-)
(-)
(-)
+
+
Salmonella
sp.
+
(-)
+/-
+
(-)
(-)
Shigella
sp.
+
(-)
+/-
(-)
(-)
+/-

Pałeczki Gram-ujemne niefermentujące:
Np. Pseudomonas aeruginosa
Wzrost kolonii
P.aeruginosa
na
agarze MacConkey’u
Kolonie laktozo-
ujemne
Wzrost kolonii
P.aeruginosa
na podłożu
Columbia agar + 5%
krwinek baranich

Opis testu API20N
Zestaw do identyfikacji niefermentujących pałeczek Gram-ujemnych nie należących do
rodziny Enterobacteriaceae - API 20NE (Nr kat. 20050 firmy, bioMérieux) jest
wystandaryzowaną mikrometodą do identyfikacji drobnoustrojów nie należących do
Enterobacteriaceae
, takich jak: Psudomonas spp., Acinetobacter spp., Flavobacterium spp.,
Vibrio
spp., Aeromonas spp. i inne.
Skład testu
Test API 20NE (bioMérieux) składa się z 20 mikrostudzienek zawierających
odwodnione substraty i podłoża tworzące szereg biochemiczny, w skład którego wchodzi 8
testów powszechnie stosowanych, takich jak: redukcja azotanów, wytwarzanie indolu,
fermentacja glukozy, dehydrolaza argininy, ureaza, hydroliza eskuliny, hydroliza żelatyny,
β-galaktozydaza oraz 12 testów asymilacyjnych takich jak: asymilacja glukozy, arabinozy,
mannozy, mannitolu, N–acetyloglukozaminy, maltozy, glukonianu, kaprynianu, adypinianu,
jabłczanu, cytrynianu, octanu fenylu, które umożliwiają określenie zdolności adaptacji
enzymatycznej badanych drobnoustrojów.
Materiały (firmy bioMérieux
)
1.
Test API 20NE (Nr kat. 20050) z Kartami Wyników
2.
NaCL 0,85% Medium (2 ml) (Nr kat. 20070)
3.
McFarland Standard (0,5) (Nr kat. 70900)
4.
Jałowy olej mineralny (Nr kat. 70100)
5.
Odczynniki Griessa do wykrywania azotynów – NIT 1 (Nr kat. 70440) oraz NIT 2
(Nr kat. 70450)
6.
Odczynik JAMES do wykrywania indolu (Nr kat. 70540)
7.
Odczynnik OX do wykrywania oksydazy (Nr kat. 70460)
8.
Książka Kodów API 20 NE (Nr kat. 20090)
Wykonanie
Test API 20NE wykonano wg standardowej procedury podanej przez producenta w
następujących etapach:
9.
Przygotowanie pasków testu API 20NE.
10.
Przygotowanie badanej zawiesiny bakteryjnej.
11.
Napełnienie pasków testu API 20NE sporządzoną zawiesiną bakteryjną.
12.
Inkubacja testów w temperaturze 30
°C przez 48 godzin.

13.
Odczyt szeregu biochemicznego po 24 godzinach zgodnie z Tabelą Odczytu
(Załącznik 1) oraz zapis wyników na Karcie Wyników.
14.
Dalsza inkubacja testu API 20NE.
15.
Ponowny odczyt wyników reakcji biochemicznych w celu uzyskania 7 - cyfrowego
kodu numerycznego, będącego ostateczną identyfikacją gatunkową pałeczek Gram-
ujemnych niefermentujących odczytaną z Książki Kodów.
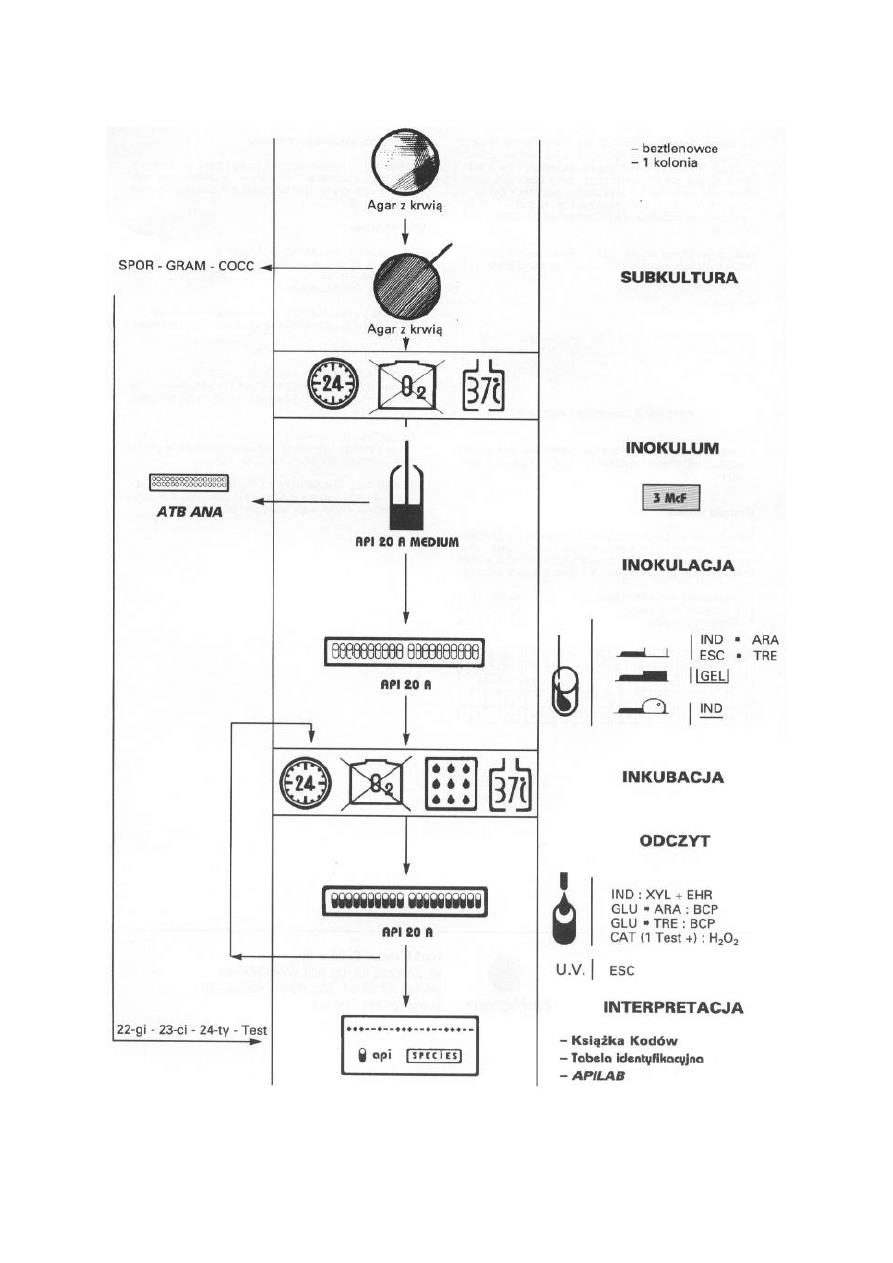
Procedura wykonania API20N – schemat.

Odczyt API20N po inkubacji w 30°C w warunkach tlenowych przez 24 godziny.
2.4.3. Wykonanie oznaczenia lekooporności:
2.4.3.1. Oznaczanie lekooporności metodą krążkowo-dyfuzyjną Kirby-Bauera
Metoda krążkowo-dyfuzyjna Kirby-Bauera jest oparta na dyfuzji antybiotyku
zawartego w krążku do podłoża. Antybiotyk dyfunduje promieniście przez agar, tworząc
gradient stężeń. Największa jego koncentracja występuje przy brzegach krążka i spada wraz z
odległością od krążka. Wielkość strefy zahamowania wzrostu bakterii jest wprost
proporcjonalna do stopnia wrażliwości bakterii na antybiotyk - im większa jest strefa
zahamowania, tym bakteria jest bardziej wrażliwa.
W zależności od wielkości strefy, bakterie określa się jako: wrażliwe, średnio wrażliwe lub
oporne na podstawie przyjętych standardów (M100-S10NCCLS, 2000). Metoda krążkowo-
dyfuzyjna jest najczęściej używaną metodą testowania lekooporności. Jest ona dobrze
wystandaryzowana, powtarzalna, relatywnie tania. Posiada jednak ograniczenia. Nie jest
wiarygodna w testowaniu wolno-rosnących organizmów, bezwzględnych bakterii
beztlenowych. Niektóre antybiotyki słabo dyfundują w agarze, przez co różnica w strefach
zahamowania dla bakterii wrażliwych i opornych jest niewielka, co może prowadzić do
nieprawidłowego określenia lekooporności (antybiotyki glikopeptydowe, polimyksyna B).
2.4.3.2. Materiały:
• podłoże agar Mulera- Hinton (MHA2)
• 1 ml jałowej 0,85% soli fizjologiczna (NaCl)
• krążki bibułowe z antybiotykiem – np. firma Oxoid
• zawiesina bakteryjna – w skali 0,5 McFarlanda
• wzorzec – 0,5 McFarlanda
• jałowe wymazówki
2.4.3.3. Procedura przygotowania inoculum i interpretacja wyników
Inoculum przygotować ze świeżej, osiemnastogodzinnej hodowli bakterii na podłożu
MHA2. Kilka kolonii bakterii zawiesić w jałowym fizjologicznym roztworze 0,85% NaCl,
celem uzyskania zawiesiny o gęstości 0,5 w skali McFarlanda, co w przybliżeniu odpowiada
liczbie od 1
× 10
8
do 2
× 10
8
c.f.u./ml. Gęstość zawiesiny oznaczyć nefelometrycznie przy
użyciu kolorymetru (Nr kat. V1210 firmy bioMérieux).
Gotową zawiesinę w ciągu 15 minut rozprowadzić na powierzchni podłoża MHA2 przy
użyciu jałowej wymazówki. Po 15 minutach na posiane podłoże nakłożyc krążki z
antybiotykami i chemioterapeutykami. Tak przygotowane płytki w ciągu następnych 15 minut
wstawić do cieplarki i inkubowć w warunkach tlenowych 16-18 godzin, w temperaturze
37
°C.
Wyniki interpretować zgodnie z zaleceniami NCCLS, według średnicy uzyskanych stref
zahamowania wzrostu.
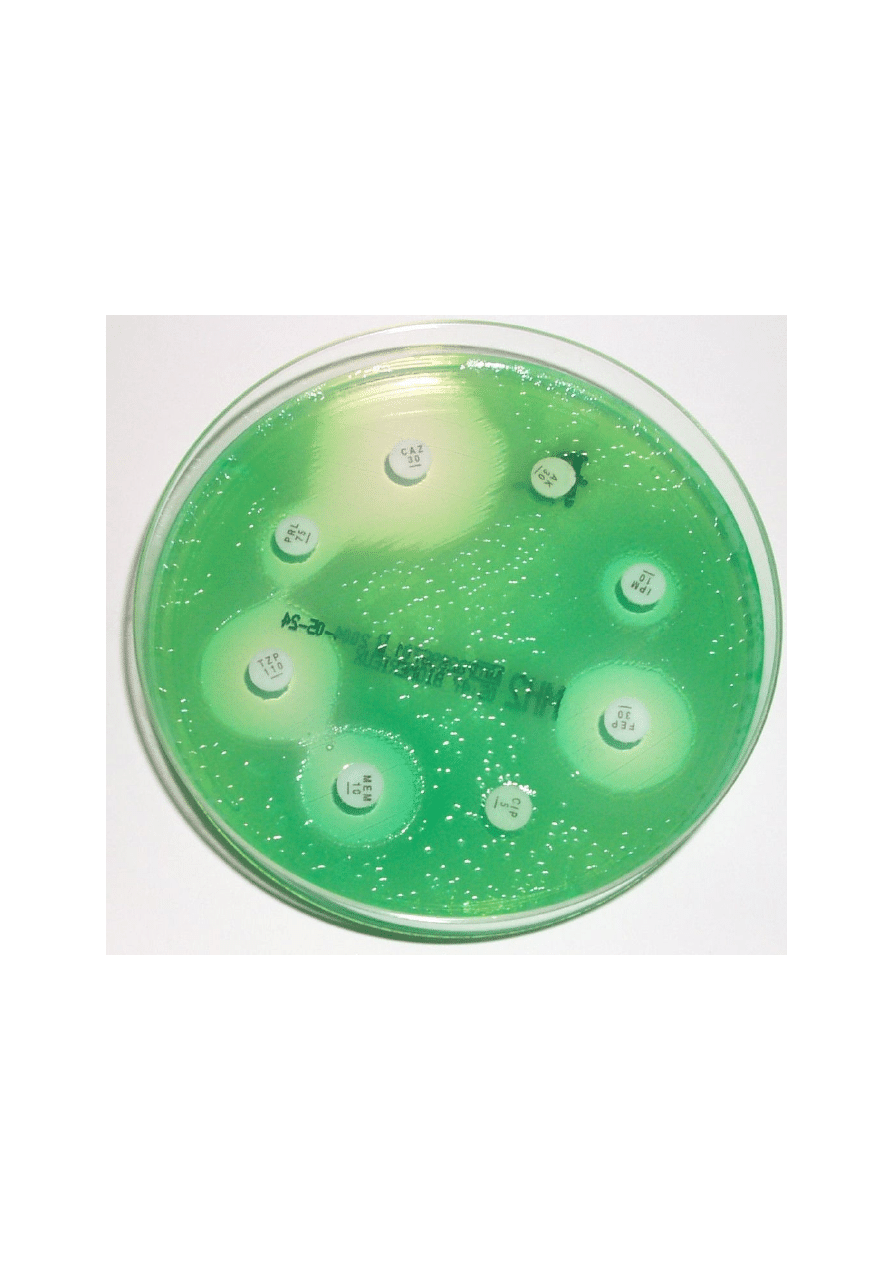
Fotografia. Lekwrażliwość krażkowo-dyfuzyjna podłoże Muller-Hinton - P.aeruginosa

Wyszukiwarka
Podobne podstrony:
Podłoża - podział, ANALITYKA MEDYCZNA, MIKROBIOLOGIA
CENA WYTWORZENIA PODŁOŻA HODOWLANEGO, ZiIP, biotechnologia
notatek pl typy hodowli mikrobiologicznych opracowanie
mikrobiologia sciaga, Podłoża używane w Mikrobiologii:
4-enzymy - poprawiony z podlozem lipolitycznym, Mikrobiologia przemysłowa
podłoża, STUDIA, mikrobiologia
hodowla, Mikrobiologia wet, sem 2
CENA WYTWORZENIA PODŁOŻA HODOWLANEGO, ZiIP, biotechnologia
notatek pl typy hodowli mikrobiologicznych opracowanie
Żymańczyk Duda, mikrobiologia, hodowle mikrobiologiczne
Wymagania wzrostowe komórek Podłoża hodowlane
mikrobiologia ćw 4, Oznaczanie liczebności Escherichia coli w hodowli nocnej
(), mikrobiologia przemysłowa L,Podział enzymów ze względu na działanie
MIKROBIOLOGIA laboratorium 7 Metody posiewu i hodowli (2), Studia, OŚ, Mikrobiologia
Metody hodowli drobnoustrojĂłw, mikrobiologia
Podział wirusów ze względu na rodzaj kwasu nukleinowego, Ratownicto Medyczne, MIKROBIOLOGIA
więcej podobnych podstron