
Kultury Tkankowe Zwierzęce i Roślinne
Hodowle komórkowe w produkcji
szczepionek przeciwwirusowych,
przeciwnowotworowych.

Układ odpornościowy/immunologiczny:
• Narządy limfatyczne
- centralne:
grasica, szpik
- obwodowe
: węzły chłonne, grudki limfatyczne, migdałki,
wyrostek robaczkowy, śledziona
*
,
• Krążące limfocyty
*
narząd krwiolimfatyczny

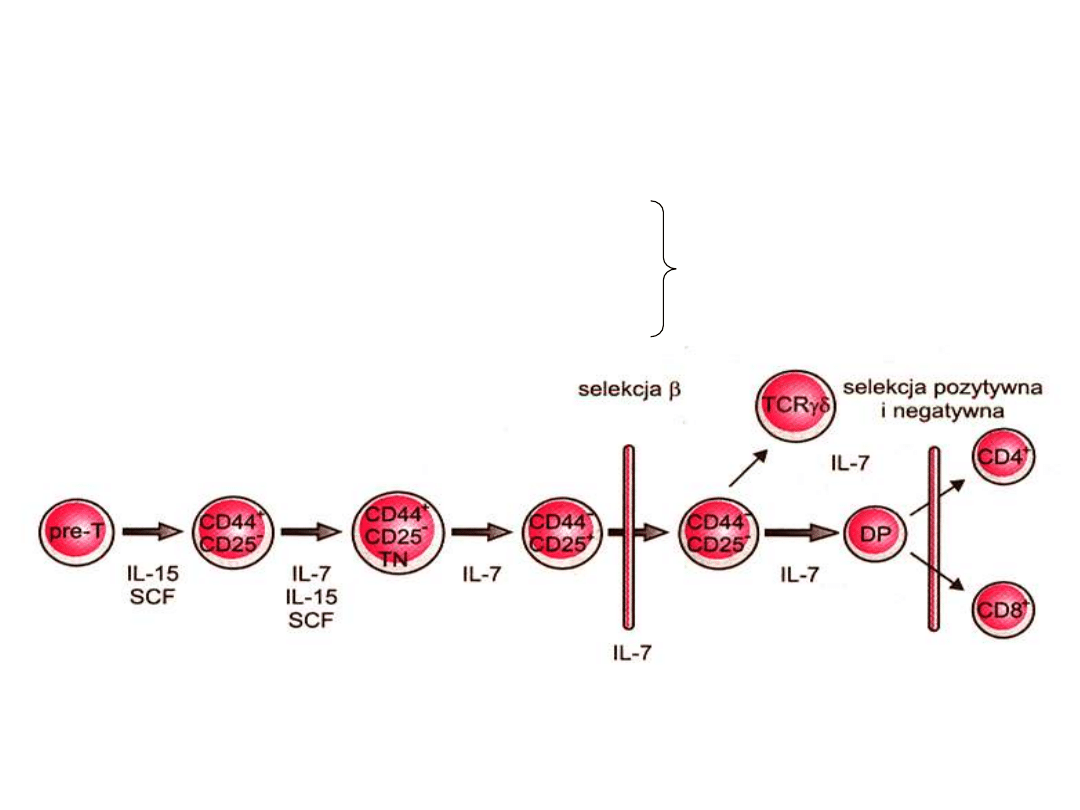
• Limfocyty T
(tymocyty) po opuszczeniu centralnych narządów
lokują się w obszarach grasiczozależnych (thymus dependent):
strefa przykorowa węzłów i wokół tętniczek w śledzionie gdzie
namnażają się i dojrzewają
• Limfocyty B
(bone marrow dependent
) lokują się w obszarach
grasiczoniezależnych: rozsiane i skupione grudki limfatyczne
także namnażają się i dojrzewają
• Limfocyty T - odpowiedź immunologiczna typu komórkowego
• Limfocyty B - odpowiedź humoralna (produkcja przeciwciał)
Subpopulacje limfocyt
ów/antygeny różnicowania CD
(cluster of differentiation)
Limfocyty B (CD19)
–
aktywność humoralna
Limfocyty T (CD4), pomocnicze
Limfocyty T (CD8), supresorowe
Komórki NK (CD16) naturalni zabójcy
DP= podwójnie dodatni
(CD4CD8) tymocyt
Aktywność
komórkowa

Limfocyty T pomocnicze (helper T)

Limfocyty T cytotoksyczne/supresorowe

Naturalni zabójcy
(natural killer T lymphocytes)

Limfocyty B
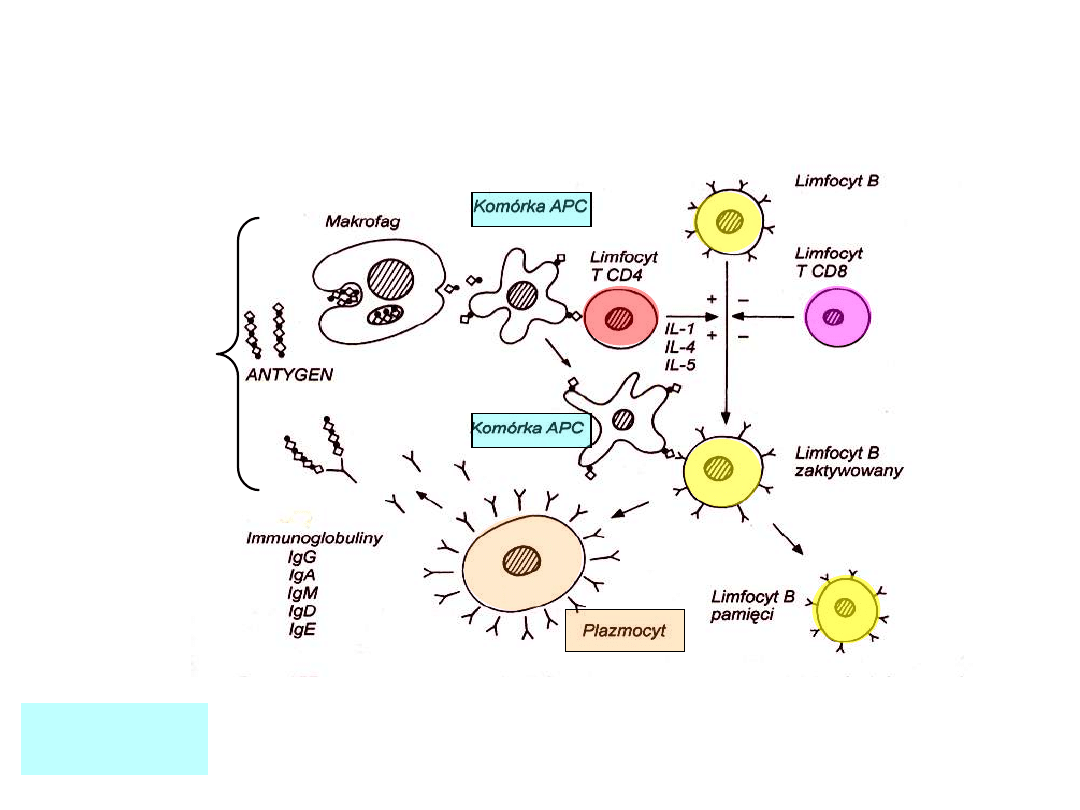
Komórki plazmatyczne powstające z dzielących się
limfocytów B intensywnie uwalniają przeciwciała do
osocza i przestrzeni pozakomórkowej
Antygeny związane
przez przeciwciała
są pożerane przez
makrofagi
Odpowiedź humoralna i komórkowa są powiązane
APC,
antigen
presenting cell
Każdy limfocyt B w stanie spoczynku zawiera na
powierzchni swoiste przeciwciało (receptor).

Rodzaje odporności przeciwzakaźnej
1.
Odporność naturalna:
-
bierna (przejście przeciwciał klasy IgG przez łożysko)
-
czynna (zakażenie, przechorowanie)
2.
Odporność sztucznie wytworzona:
- czynna (szczepionki)
-
adoptywna (podanie swoistych limfocytów Tc)
- bierna (podanie immunoglobin)
- czynno-bierna (szczepienie + podanie IgG)

• Szczepionka
- produkt pochodzenia biologicznego
zawierający substancje (antygeny) zdolne do indukcji
określonych procesów immunologicznych warunkujących
powstanie trwałej odporności bez wywoływania działań
toksycznych
• Odporność
jest wynikiem wytworzenia
przeciwciał
,
immunoglobin mających zdolność wiązania się z antygenem
(obecne w płynach ustrojowych i wydzielinach błon
śluzowych dróg oddechowych, układu pokarmowego)

Cel szczepień
• Wytworzenie indywidualnej odporności adaptacyjnej
wobec określonego drobnoustroju
• Eliminacja drobnoustrojów ze środowiska życiowego
człowieka (także zwierząt)

Szczepionki swoiste
• Indukują trwałą i specyficzną odpowiedź immunologiczną
przeciw danemu drobnoustrojowi
-
Monowalentne
(zawierają jeden typ drobnoustroju/antygenu)
-
Poliwalentne
(kilka typów serologicznych tego samego
drobnoustroju, n.p. szczepionka przeciw grypie, poliomyelitis,
pneumokokom)
-
Swoiste skojarzone (bakteryjne, Di-Per-Te p-
w błonicy,
krztuścowi i tężcowi lub wirusowe p-w różyczce, odrze i śwince)

Szczepionki nieswoiste
• Mieszaniny zabitych drobnoustrojów lub ich lizaty
–
niespecyficzne stymulatory odporności stosowane w
nawracających zakażeniach o różnej etiologii
(zwykle słabo oczyszczone: białka, peptydy, lipopolisacharydy,
kwasy nukleinowe; możliwość efektów niepożądanych)
• Autoszczepionki
(zawiesiny inaktywowanych drobnoustrojów
wyizolowanych z flory bakteryjnej chorego)
• Oba rodzaje nie przeszły żadnych tzw. randomizowanych badań
klinicznych!

Zgodnie z technologią otrzymywania wyróżniamy szczepionki:
•
Zawierające żywe drobnoustroje
(atenuowane/odzjadliwione)
o zmodyfikowanych właściwościach (osłabiona wirulencja, szczepy
niezjadliwe
–na drodze manipulacji genetycznej)
•
Zawierające inaktywowane drobnoustroje
(chemicznie np.
fortmaldehyd, alkohole; fizycznie np. ultrawirowanie, wysokie
ciśnienie, temperatura)
•
Zawierające oczyszczone fragmenty
drobnoustrojów (antygeny
powierzchniowe, inaktywowane toksyny)
•
Zawierające produkty rekombinowanego DNA
Najwyższy poziom bezpieczeństwa !

BCG (Bacillus Calmette-
Guérin)
-
szczepionka przeciw gruźlicy
opracowana we Francji przez Alberta Calmette i Camille'a Guérin
i wprowadzona w 1921.
Stanowi ona atenuowany szczep Mycobacterium bovis
(wywołuje
gruźlicę bydła), uodparnia na Mycobacterium tuberculosis (gruźlica
u człowieka.
Atenuacja zaszła wskutek 231 pasaży na podłożu z żółcią.
BCG jest przydatna w immunoterapii nowotworów (powierzchownych
postaci raka pęcherza moczowego). Mechanizm jest niejasny, wydaje
się, że przeciwko guzowi zostaje uruchomiona lokalna reakcja
immunologiczna, zapobiega nawrotom w ⅔ przypadków.
BCG bywa także do wykorzystywana w immunoterapii raka okrężnicy.

Wirusowe szczepionki atenuowane:
Wirus odry, różyczki, świnki, polio
Szczególny typ szepionki p-ospie
Edward Jenner -
1796 dokonał szczepienia wirusem krowianki 8-letniego
chłopca
Jedyną szczepionkę
z żywych wirusów
stosowano do roku 1980
przeciwko ospie prawdziwej. Były to wirusy krowianki, mało wirulentne
dla człowieka, ale dawały odporność przeciw ospie prawdziwej (Variola
vera);
Obecnie ospa została opanowana i na całym świecie nie stwierdza
się choroby

Wirus ospy prawdziwej; Orthopoxvirus; duży –
widoczny w mikroskopie świetlnym (230x400nm);
dwuniciowe, linearne DNA; glikolipidowa otoczka
- bardzo odporny na wysychanie
– średnio kilka lat
ale izolowany z mumii Ramzesa V (1100r.p.n.e.) !

Obecnie, zgodnie z zaleceniami WHO
przechowuje się 200
mln dawek szczepionki liofilizowanej (Genewa, Lozanna, New
Dehli);
każdy kraj posiada swoje zapasy
istnieje obowiązek zgłaszania niejasnych przypadków
gorączki z wysypką i wykluczenia zakażenia na podstawie
badań laboratoryjnych
wirus przechowywany jest w USA (Atlanta, CDC) i w Rosji
(Moskwa, Instytut Preparatów Wirusowych), gdzie
prowadzone są badania nad tzw. białymi pokswirusami, tj.
ortopokswirusami podobnymi do ospy prawdziwej.
Szczepionki atenuowane:
• Poliomyelitis , choroba Heinego-Medina (zapalenie rogów
przednich rdzenia).
• Komórki pierwotne z nerek małp, linie komórek nerki małp,
komórki diploidalne ludzkie, fibroblasty MRC5)
Szczepionka Sabina (OPV
– Oral Poliovirus Vaccine), w
zależności od ilości typów wirusa (I, II lub III) rozróżnia się:
mOPV
– monovalent OPV lub tOPV – trivalent OPV)- zawiera
żywe, atenuowane wirusy. Jest podawana doustnie.
(Możliwość rewersji zjadliwości wirusa)
• Hilary Koprowski
(ur.1916)
– twórca pierwszej atenuowanej
szczepionki przeciw polio
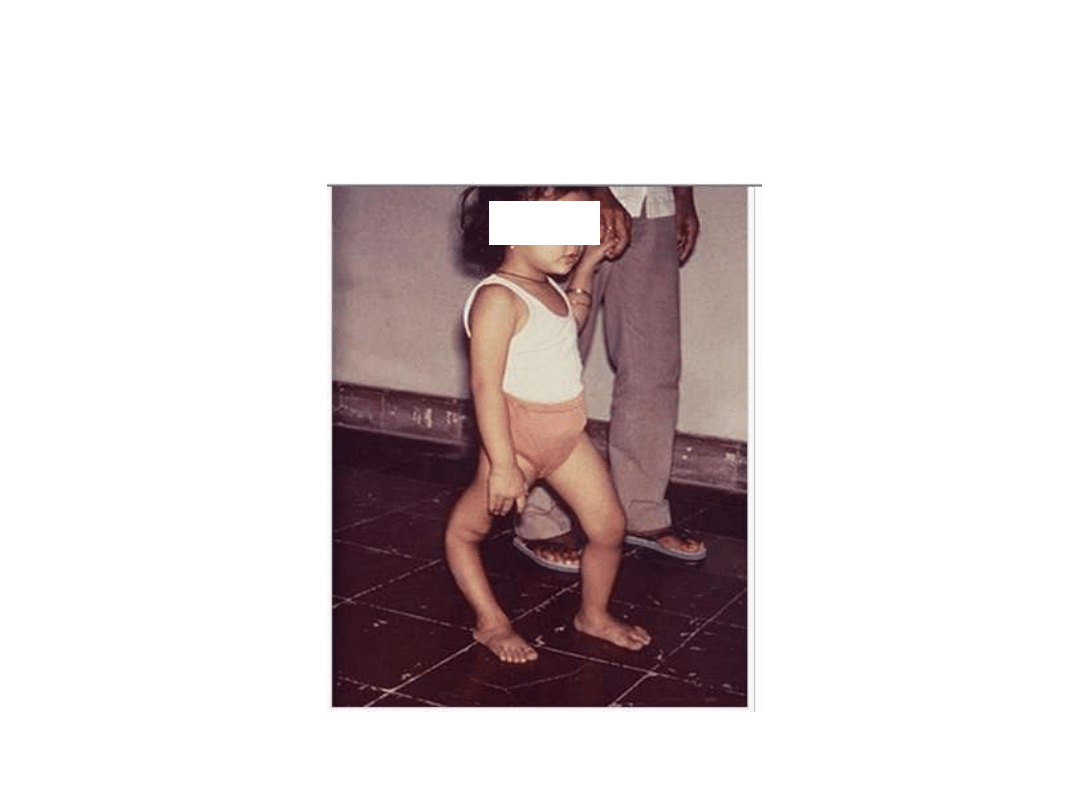
Następstwo choroby poliomyelitis

Nagminne wirusowe zapalenie przyusznic
– świnka (mumps),
Niebezpieczna dla chłopców w okresie dojrzewania !
Do produkcji szczepionki używa się komórki diploidalne
ludzkie, fibroblasty MRC5
Odra, różyczka*, żółta febra, opryszczka-varicella zoster
(diploidalne komórki ludzkie lub fibroblasty zarodków kurzych)
*
Niebezpieczna dla płodu: wady serca, opóźnienie w rozwoju,
głuchota, zaćma, niekiedy obumarcie płodu.
2. Szczepionki przeciwwirusowe inaktywowane:
• Poliomyelitis
(komórki pierwotne z nerek małp, linie komórek
nerki małp, komórki diploidalne ludzkie, fibroblasty MRC5)
Szczepionka Salka (IPV
– Inactivated Poliovirus Vaccine) –
zawiera zabite wirusy podawane pozajelitowo (iniekcja).
Wywołuje tylko odpowiedź ogólnoustrojową, wirusy nie
kolonizują nabłonka jelit i nie pobudzają produkcji
odpowiedniej Ig A.
• Wścieklizna
• (ludzkie komórki diploidalne lub fibroblasty zarodków kurzych)
• Odkleszczowe zapalenie opon mózgowo-rdzeniowych
(fibroblasty zarodków kurzych)

Szczepionki, które nie pochodzą z hodowli
komórek ludzkich:
• Szczepionka przeciw grypie
(wirus namnażany jest w
zarodkach kurzych jaj)
•
Szczepionka przeciw WZW B
(wirusowemu zapaleniu
wątroby, hepatitis B). Antygen wytwarzany jest na drodze
inżynierii genetycznej w komórkach drożdży, szczepionka
podjednostkowa
• Infekcja wirusem HBV o przebiegu chronicznym może
prowadzić do powstania raka wątroby

Wirus HBV
– szczepionka podjednostkowa
• Genom zawiera 3182 nukleotydy
• Kapsyd zbudowany jest z glikoproteiny HBsAg (antygen Australia)
• Hepatocyty chorych wydzielają do krwi antygen HBsAg związany z
lipidami w postaci 22 nm-
sferycznych cząstek i większe 42 nm-
cząstki DNA-zakaźne, cząstki Dana;
• Do ~1980 r cząstki te, z surowicy ozdrowieńców (inaktywowane
formaliną) były stosowane jako szczepionka
• Produkt inżynierii genetycznej uzyskano przez rekombinację
genomu drożdży z sekwencją kodującą HBsAg (835 par zasad)
genomu wirusa HBV
• Produkowany przez drożdże antygen prezentuje dobrą
immunogenność, a pacjenci szczepieni taką szczepionką wykazują
dobrą tolerancję.
(Szczepienia trzeba powtarzać po 1/2, 3 i 5 latach)

Szczepionki trzeciej generacji (szczepionki DNA)
(profilaktyka genowa/wprowadzenie do organizmu czystego
genu)
Szczepionki te często określa się mianem "nagich”
Celem-
dostarczenie organizmowi DNA kodującego białka
antygenów wirusowych
(S
ynteza endogennego białka naśladuje infekcję wirusową,
produkowany antygen jest prezentowany LyT
przez cząsteczki MHC kl.I)
Komórki wykazujące ekspresję antygenu wirusowego są niszczone,
antygen jest uwalniany i dalej prezentowany przez komórki MHC kl.II
komórkom produkującym przeciwciała

Wprowadzanie szczepionek DNA
Bezpośrednio do komórek mięśniowych lub śródskórnie
(śródskórne 200-300 razy bardziej wydajne), lub w postaci aerozolu
do górnych dróg oddechowych
Na przykład :
Wstrzyknięcie do komórek mięśni szkieletowych cząsteczek kwasu
nukleinowego wirusa grypy w postaci plazmidu stymuluje
powstanie wyspecjalizowanych populacji cytotoksycznych
limfocytów (Tc), (
na etapie prób klinicznych
).
Zaletą szczepionek uzyskiwanych z zastosowaniem technik
rekombinacji DNA jest:
-
stabilność,
-
bezpieczeństwo procesu produkcji
-
brak efektów ubocznych.
-
możliwość relatywnie szybkiej modyfikacji (wprowadzanie
zmian odzwierciedlających mutacje zachodzące w patogenach).

Szczepionki przeciwgrypowe
• Grypa – ostra choroba zakaźna powodowana przez wirus
grypy atakujący górne drogi oddechowe
• Wirus grypy (Influenzavirus A, B, C)
• Objawy: wysoka gorączka, kaszel, ból głowy, ogólne rozbicie
• Groźne dla zdrowia i życia są powikłania pogrypowe:
zapalenie oskrzeli, płuc, ucha środkowego oraz zapalenie
mięśnia sercowego i osierdzia

• Według WHO, co roku na świecie choruje na grypę od
330 mln do 1,5 mld ( z czego umiera 0,5-1 mln)
• Zachorowania mają charakter epidemii
• Co kilkanaście/kilkadziesiąt lat mają charakter pandemii
(zasięg ogólnoświatowy):
• 1918-1919 „hiszpanka” (100 mln zgonów, a w I wojnie
św. 9 mln)
• 1957-1958 pandemia grypy azjatyckiej
• 1968-1970 pandemia grypy Hongkong
• Pandemie
wywoływane przez nowo pojawiający się typ
wirusa, na który większość ludzi nie jest uodporniona
(np. wirus ptasi)

• Szczepionki p-grypie są szczepionkami inaktywowanymi
(zawierają fragmenty wirusa niezdolnego do namnażania się
w komórce, „zabity”-pozbawiony jakiegoś genu
odpowiadającego za proliferację)
• Szczepienia na dany sezon chronią jedynie przed typem
wirusa, który wchodzi w skład szczepionki lub przed blisko
spokrewnionymi
• Szczepienia nie chronią przed ptasią grypą i przed pandemią
(nigdy nie wiadomo jaki typ wirusa, jaki mutant wywoła
pandemię).
• Zmniejszają jednak ryzyko podwójnego zakażenia wirusem
grypy ludzkiej i ptasiej (co mogłoby doprowadzić do
powstania mutanta, nowego typu wirusa zdolnego do
wywołania pandemii)

W ostatnim roku rzekomą pandemię grypy wiązano
głównie z wirusem grypy ptasiej podtypu A/H5N1/
Zanamivir - do leczenia i profilaktyki
Oseltamivir
– do leczenia, okazał się skuteczny
przeciwko ptasiej grypie

Czy szczepionki przeciw chorobom wirusowym
(a także bakteryjnym) są bezpieczne ?
• Bardziej bezpieczne są szczepionki zawierające drobnoustroje
inaktywowane (są jednak mniej immunogenne od atenuowanych)
• W rzadkich przypadkach obserwowano rewersję zjadliwości
atenuowanego wirusa poliomyelitis (rok 1970, Dominikana),
świnki szczepu Urabe Am9 i innych – wynik upośledzonej
odporności tych osób (?)
• Działania niepożądane mogą wywoływać adiuwanty* i substancje
konserwujące
*
adiuwanty
-
nieswoiste modulatory zwiększające naturalne
zdolności antygenu do wywołania odpowiedzi immunologicznej
(spowalniają uwalnianie antygenu, aktywują limfocyty:
wodorotlenek/ fosforan glinu, LPS, liposomy i polimery, emulsje
olejowe, cytokiny)
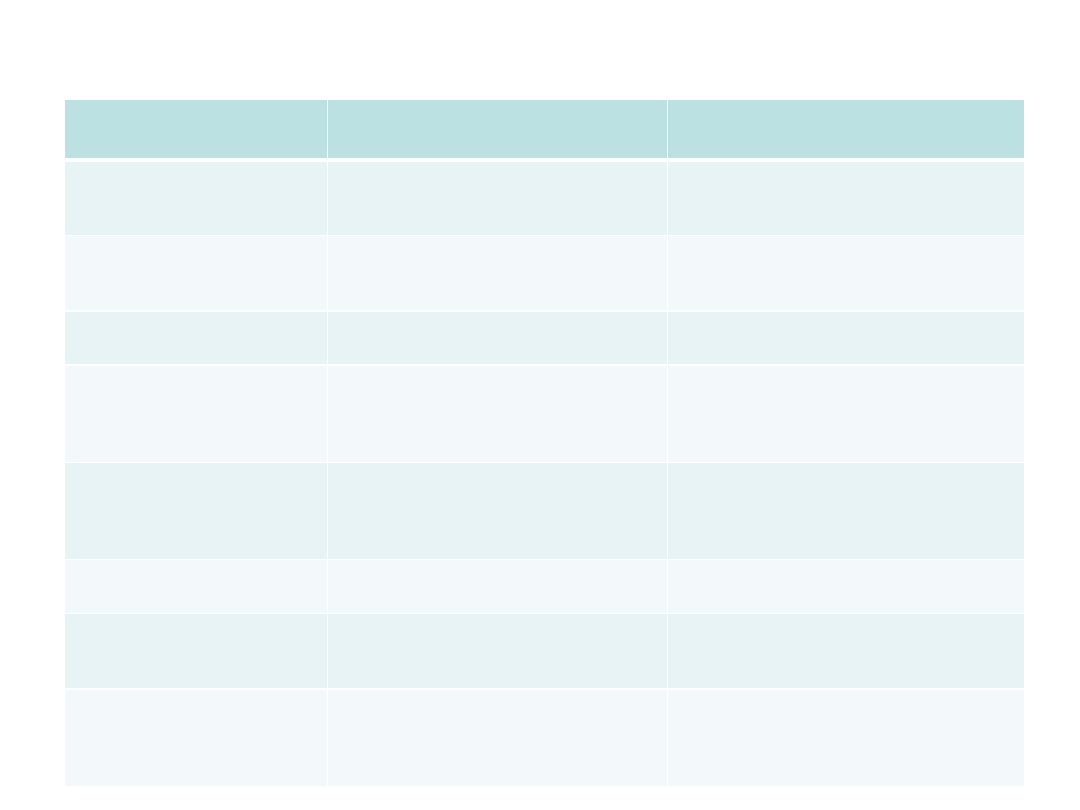
Szczepionka
Podejrzewany związek
ze szczepieniem
Wyniki badań
Czterowalentna
szczepionka rotawirusowa
(RRV-TV)
Wgłobienie jelit
Potwierdzono związek, wycofana
Szczepionka doustna Polio
Rewersja zjadliwości, poszczepienne
poliomyelitis
Potwierdzono dla typu 2 i 3 wirusa w
pierwszych szczepionkach; obecnie
nie stosowana
Skojarzona p-odrze,
różyczce i śwince
Przewlekłe zapal. jelita grubego;
autyzm
Wykluczono związek przyczynowy
Rekombinowana szcz. p-
wirusowemu zapaleniu
wątroby typu B
Zespoły demielinizacyjne i
autoimunizacyjne
SM, toczeń
rumieniowaty, reumatoidalne
zapalenie stawów
Brak danych potwierdzających
związek; szerokie badania w toku
Szczepionki produkowane
w zarodkach kurzych (p-w
odrze, różyczce i żółtej
febrze)
Zanieczyszczenie wirusem ptasim
Wykazano małą aktywność odwrotnej
transkryptazy
wirusowej, bez wpływu
na bezpieczeństwo szczepionek
Szczepionka p-grypie, typ
A/New Jersey
Zespół Giullaina Barrego
1 przypadek/mln szczepionych;
obecnie nie stosuje się tego serotypu
Pełnokomórkowa szcz. p-
krztuścowi; p-grypie
Astma, zaostrzenie choroby
oskrzelowo-
płucnej
Niektóre szcz. aktywują odpowiedź
typu Th2, jednak w bad. epidemiol. nie
wykazano związku z alergią
Szczepionki BCG, DTP,
ospa wietrzna, hemofilus
influenzae typ b
(niemowlęce)
Cukrzyca typu pierwszego
Wykluczono związek przyczynowy w
badaniach epidemiologicznych
Obecny stan wiedzy na temat powikłań poszczepiennych

• Większość obecnie stosowanych szczepionek uzyskuje
się z hodowli ludzkich diploidalnych linii komórkowych:
-
Fibroblastów
-
Niektóre są produkowane w hodowlach fibroblastów
zarodków kurzych
-
Komórek nerek małp
-
Zarodkach kurzych
-
W drożdżach
Systemy komórkowe do produkcji szczepionek
wirusowych
• Wyjściowe kultury (klonowane z jednej komórki, namnożone w
większych ilościach i bankowane) stanowią
zasób komórek
matecznych
• Z odbankowanych komórek zakłada się hodowlę na większą
skalę uzyskując
bank komórek produkcyjnych
(część
ponownie zamraża się dla zachowania zapasu komórek
produkcyjnych)
System banków komórkowych można stworzyć tylko dla komórek,
które są zdolne dzielić się w nieskończoność, albo przynajmniej w
ograniczonym zakresie (human diploid cells, HDC, np. fibroblasty
ludzkie MRC-5, WI-38)

Charakterystyka systemów komórkowych
Próbki z obu banków (mateczne i produkcyjne) poddaje
się wszechstronnej kontroli:
Za pomocą testów serologicznych i cytogenetycznych
wykonuje się identyfikację komórek
Bada się mutagenność i genotoksyczność– testy in vitro i
in vivo
Bada się ewentualną kontaminację bakteryjną – testy
bakteriologiczne
Wykonuje się testy na obecność wirusów – złożone

Testy na obecność wirusów:
Inokulacje komórkami zarodków kurzych dla wykazania
zakaźności
Iniekcje zwierzętom doświadczalnym w celu wykazania
zakaźności lub wywoływania przeciwciał przez ewentualne
wirusy
Testy na obecność specyficznych polimeraz wirusowych
Bezpośrednie sprawdzanie obecności wirusów z użyciem
mikroskopii elektronowej, metody HIS/FISH
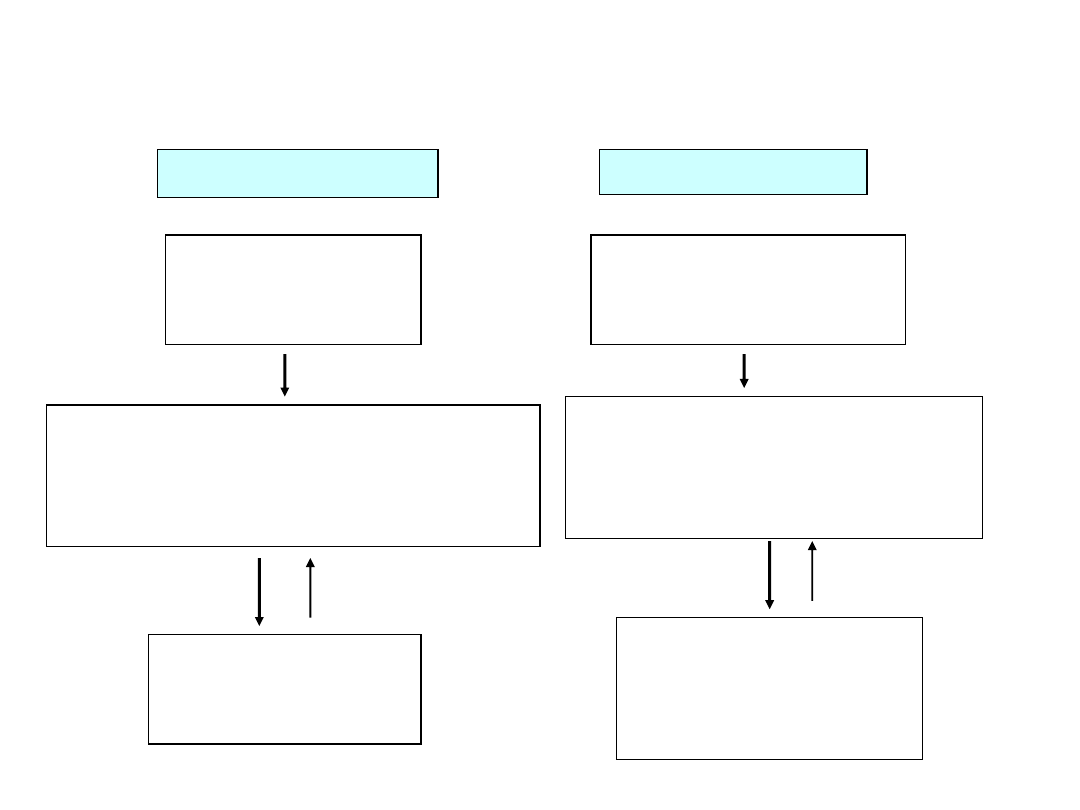
Systemy komórkowe do produkcji
szczepionek i procedury postępowania
Linie komórkowe
Zasób komórek
matecznych
(master cell bank)
Kwarantanna
dostawców komórek
pierwotnych
Testowanie w kierunku:
potwierdzenia linii, mutagenności,
nieobecności mykoplazmy, bakterii,
wirusów
Testowanie w kierunku:
potwierdzenia nieobecności
i nosicielstwa bakterii
chorobotwórczych i wirusów
Zasób komórek
produkcyjnych
(working cell bank)
Pobieranie materiału i
zakładanie hodowli
pierwotnych
(primary
cultures)
Komórki pierwotne
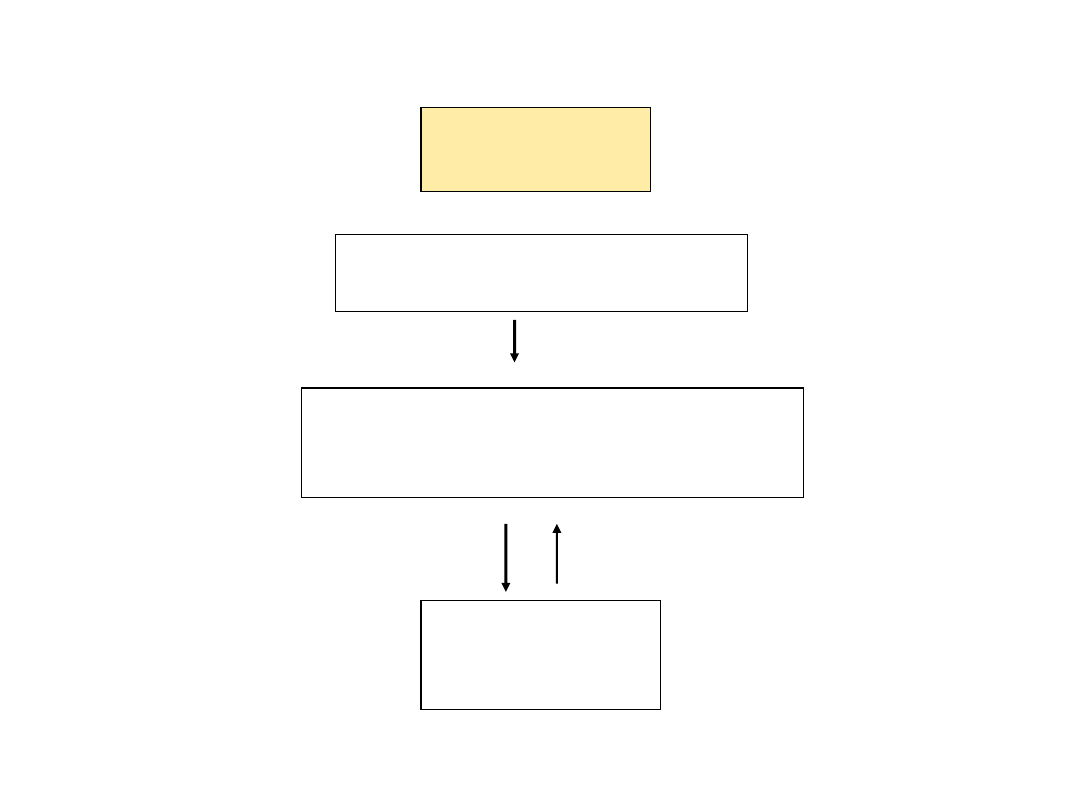
Drobnoustroje
(wirusy)
Zasób wirusów matecznych
(master seed)
Kontrola identyczności, wykazanie
nieobecności mykoplazmy, bakterii,
wirusów zanieczyszczających
Zasób wirusów
produkcyjnych
(working seed)
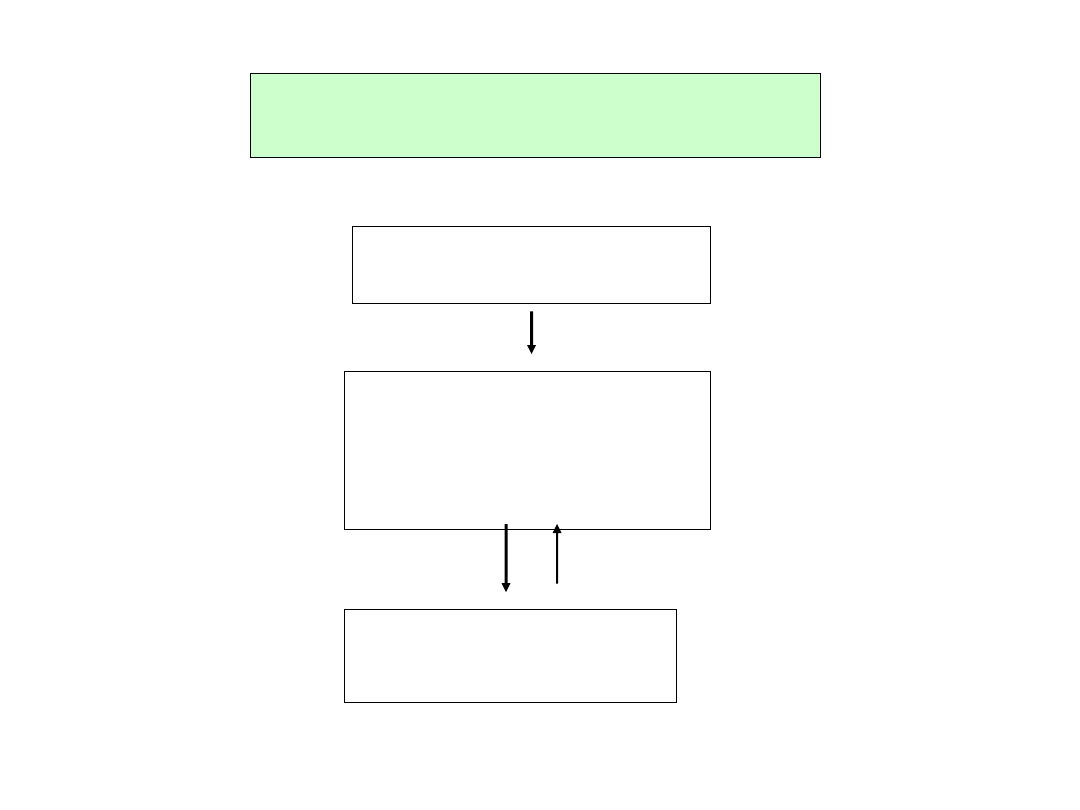
Podłoża i inne niezbędne substancje
oraz materiały
Sprawdzanie jałowości
(kwarantanna)
Analiza identyczności,
sterylności, specyfikacje
(opis szarż),
testy „zwalniające”
Wyniki testów:
materiał zwolniony

• kilkustopniowy system kolekcji komórek
i drobnoustrojów oraz kwarantanna
są niezbędne dla zapewnienia właściwej
jakości zarówno materiałów wyjściowych,
jak i ostatecznego produktu tj. szczepionek
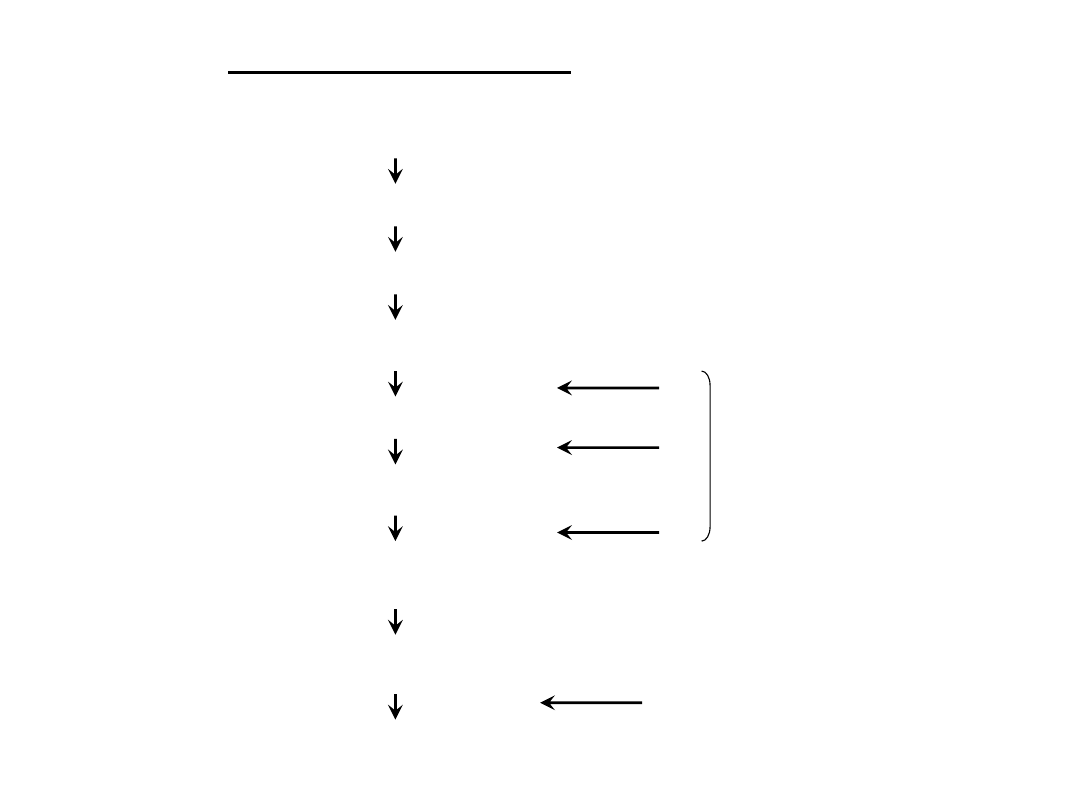
Proces produkcyjny
Założenie hodowli komórkowej
Zaszczepienie i namnożenie wirusów
Zbiór oraz oddzielenie komórek
Oczyszczanie wstępne oraz zatężanie
Oczyszczanie główne
Oczyszczanie ostateczne
Formułowanie
Stabilizowane
Porcjowanie
Pakowanie
inaktywacja
liofilizacja

Wymagania wobec szczepionek (idealnych)
• Wysoka immunogenność (indukowanie odporności
najlepiej w 100% po jednorazowym podaniu)
• Odporność utrzymująca się przez całe życie
• Brak efektów toksycznych (samej szczepionki i adiuwantu)
• Łatwość podania (najlepiej doustna, donosowa)
• Akceptowalna cena wytworzenia

IMMUNOTERAPIA NIESWOISTA obejmuje:
preparaty immunostymulujące i cytokiny, komórki LAK
(lymphokine activated killer),
monocyty, komórki
dendrytyczne (DC).
IMMUNOTERAPIA SWOISTA obejmuje:
„szczepionki” antynowotworowe (cancer vaccines)
przeciwciała monoklonalne
limfocyty (głównie limfocyty T)
Szczepionki przeciwnowotworowe/Immunoterapia
nowotworów

Immunoterapia nieswoista
Komórki LAK
-
duże dawki IL-2 stymulują prekursory komórek LAK
(limfocyty) do proliferacji.
Odzyskiwane z krwi, namnaża się i ponownie aplikuje chorym.
Skuteczność tej terapii badano w stosunku do czerniaka, raka nerki
i wątroby jednak nie okazała się ona specjalnie efektywna.
Monocyty
-
źródło komórek fagocytujących - makrofagów, które po
stymulacji in vitro (rekombinowanymi cytokinami, głównie INF-γ
i podaniu miejscowym wykazują lokalny efekt terapeutyczny.

Preparaty immunostymulujące i cytokiny
Celem jest wzmocnienie odpowiedzi immunologicznej chorego.
Levamisol
– lek immunostymulujący, którego skojarzenie z chemioterapią
5-FU (5-
fluorouracyl) wybitnie obniżyło remisje nowotworów u pacjentów
po resekcji guza okrężnicy
BCG
(bacille Calmette Guerin)
– preparat atenuowanych prątków
gruźlicy; stosowany w nowotworach pęcherza
IFN-
α
– wykorzystywany w leczeniu od 1986 r.; skuteczny w schorzeniach
tj. białaczka włochatokomórkowa, przewlekła białaczka szpikowa, mięsak
Kaposiego, czerniak, nowotwory nerki
IL-2
– zarejestrowana w 1992 r. przez US. FDA; stosowana w leczeniu raka
nerki i czerniaka złośliwego

Inne zastosowanie cytokin w immunoterapii nowotworów- działanie
ochronne ograniczające niepożądane efekty wywoływane chemio- i
radioterapią (głównie ich destrukcyjny wpływ na czynność szpiku
kostnego pacjenta) :
G-CSF
(granulocyte colony-stimulating factor)
– pobudzający
proliferację granulocytów w szpiku
GM-CSF
(granulocyte-macrophage colony-stimulating factor)
–
pobudzający proliferację granulocytów i makrofagów w szpiku
IL-11
– pobudzająca powstawanie płytek krwi
Erytropoetyna
– pobudzająca regenerację erytrocytów

Immunoterapia nowotworów
• Immunoterapia swoista
-
indukcja swoistych mechanizmów
odporności (przy trwającej już chorobie)
• Polega na podawaniu autologicznych lub allogenicznych,
odpowiednio spreparowanych (np. napromieniowanych)
komórek nowotworowych lub ich ekstraktów (często +BCG)
• Mogą być najbardziej skuteczne w przypadku nowotworów o
dobrze zdefiniowanych antygenach (czerniak); w Kanadzie
dopuszczono szczepionkę „Melacin” – z 2 linii czerniaka,
testowana jest inna CancerVax

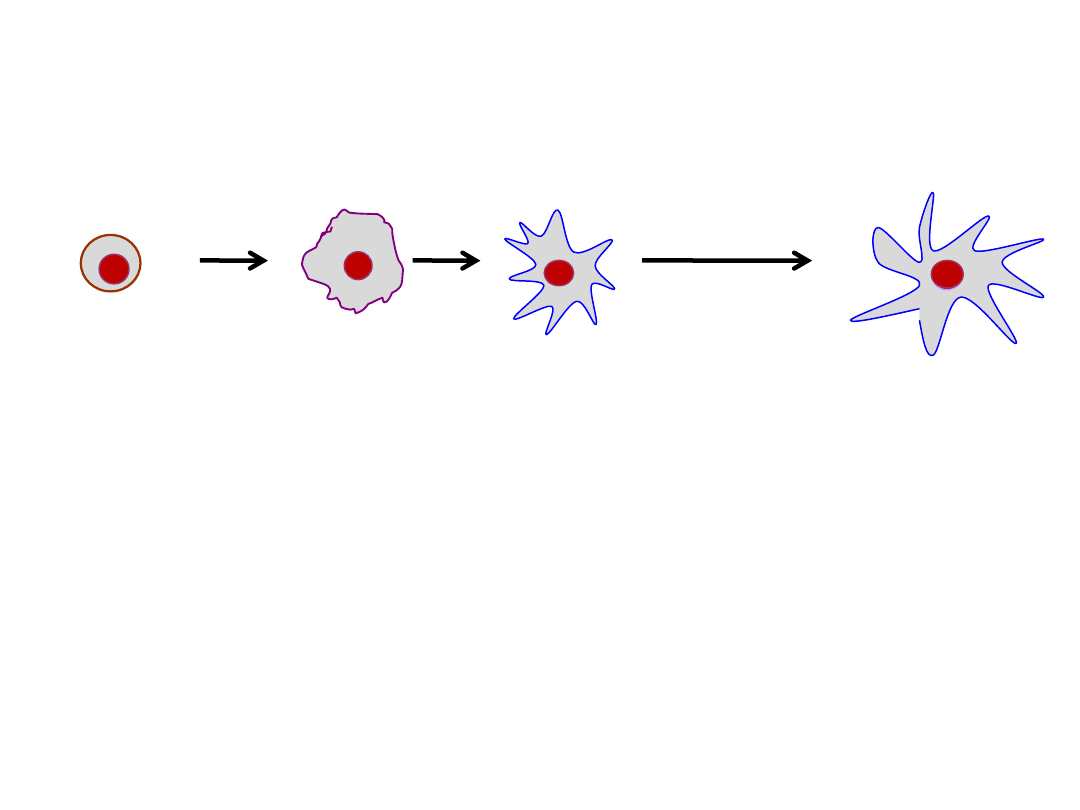
Komórki dendrytyczne - cztery etapy różnicowania
1. Prekursorowe komórki dendrytyczne – obecne w szpiku,
2. Niedojrzałe komórki dendrytyczne – obecne w narządach
nielimfatycznych, gotowe do kontaktu z obcym antygenem
i przeniesienia go do narządów limfatycznych,
3. Migrujące komórki dendrytyczne – obecne w limfie i krwi,
4. Dojrzałe komórki dendrytyczne – obecne w narządach limfatycznych,
przygotowane do prezentacji antygenu związanego w trakcie pobytu
w narządach nielimfatycznych.
W różnicowaniu i proliferacji DC biorą udział m.in. GM-CSF, TNF-α, oraz
IL-
4, natomiast hamuje ich aktywację IL-10. DC fuzjowane z komórkami
nowotworowymi, transfekowane genami antygenów nowotworowych
mogą wywołać skuteczną odpowiedź immunologiczną.
PREKURSORY
SZPIKOWE
NIEDOJRZAŁE
(mielolimfoidalne
FcγRI, FcγRII
CD68, CCR1
CCR4, CCR5
CXCR4
WELONOWATE
CD80
CD83
CD86
CCR7
DOJRZAŁE DCs
CD54, CD58
CD80, CD86
CD83, CD40L
DC-LAMP
CCR7
ZMIANA FENOTYPU KOMÓREK DENDRYTYCZNYCH W TRAKCIE DOJRZEWANIA
Krew
NIEDOJRZAŁE DCs
„wartownicy spokoju
immunologicznego”
Tkanki
Narządy
limfatyczne
Naczynia
limfatyczne
Dojrzewające po
kontakcie z
antygenem
Do kontaktu komórek dendrytycznych z antygenami dochodzi w nabłonkach i tkance
łącznej większości narządów, skąd antygeny są transportowane naczyniami
limfatycznymi doprowadzającymi do węzłów chłonnych, tam są prezentowane
limfocytom T.
Tylko dojrzałe DC indukują odpowiedź immunologiczną.

Ze względu na funkcje, miejsce występowania, zestaw antygenów,
produkcję cytokin wyróżnia się:
1.
mieloidalne komórki dendrytyczne (MDC)
: CD11c+, CD123
dim
, CD1c+
(BDCA-1+), CD141+ (BDCA-
3+), z silną ekspresją antygenów HLA-DR;
zdolne do rozpoznawania, przetwarzania i prezentacji antygenów;
znajdowane są w różnych tkankach organizmu
2.
plazmocytoidalne komórki dendrytyczne (PDC)
, CD11c-, CD123
bright
,
CD303+ (BDCA-2+), CD304+ (BDCA-
4+); ze słabą zdolnością
przetwarzania i prezentacji antygenu, będące głównym producentem
interferonu α (IFNα) w organizmie; mogą aktywować odpowiedź
antywirusową i antynowotworową
3.
grudkowe komórki dendrytyczne (FDC)
,
w grudkach chłonnych,
węzłach chłonnych, śledzionie; nie mają zdolności do migracji
i przetwarzania antygenów, zapobiegają apoptozie limfocytów B,
pobudzają interakcje między komórkami i ich stymulują ich proliferację

Komórki nowotworowe
, przeciwko którym przygotowywana jest
szczepionka, powinny prezentować określone antygeny:
1. specyficzny antygen nowotworowy TSA (Tumor Specific Antigen),
np. białko chimeryczne bcr-abl występujące w przewlekłej białaczce
szpikowej, PSA (prostate specific antigen) w raku stercza;
2. antygen związany z nowotworem TAA (Tumor Associated
Antigen), np. związane z różnymi nowotworami geny Ras, p53
występujący w guzach litych (np. raku piersi), gen MAGE-1 związany
z czerniakiem.
Komórki DC jako szczepionka powinny zawierać antygen TSA lub
TAA konkretnego pacjenta.

Metody uzyskania komórek dendrytycznych jako „szczepionek”
dla celów immunoterapii
Trzy podstawowe źródła DC stosowane obecnie to:
1. Monocyty uzyskane drogą leukaferezy (separacji komórek
jednojądrzastych z krwi obwodowej), różnicowane do mieloidalnych
komórek dendrytycznych (MDC) przy pomocy GM-CSF i IL-4 (lub IL-13)
2. Hematopoetyczne komórki progenitorowe CD34+ uzyskane drogą
leukaferezy, różnicowane do komórek dendrytycznych in vitro przy
pomocy GM-CSF I TNF-
α (uzyskuje się mieszaninę śródmiąższowych
komórek dendrytycznych i komórek Langerhansa)
3. Bezpośrednia izolacja komórek dendrytycznych z krwi (wirowanie
w gradiencie gęstości, izolacja na kolumnach immunomagnetycznych);
w efekcie - mieszanina plazmocytoidalnych i mieloidalnych (PDC+ MDC).
DC uzyskane każdą z metod mogą stymulować antygenowo specyficzną
odpowiedź limfocytów T (mechanizm nie jest do końca poznany).

Dojrzewanie DC
(uzyskanie komórek zdolnych do prezentacji antygenu,
przebiega w hodowlach
wzbogaconych w mediatory prozapalne:
interleukiny (IL-
1β, IL-6), interferony (IFNα/β, IFNγ), MCM (Monocyte
Conditioned Medium), TNFα, PGE2 (Prostaglandin E2); chemokiny;
kompleksy immunologiczne
Komórka DC staje się aktywną (prezentująca antygen) po ekspozycji
cząsteczek MHC na antygen i wprowadzeniu go do wnętrza komórki (tzw.
pulsowanie DC). Ważnym etapem jest wybór antygenu nowotworowego,
przy czym powinien to być antygen krytyczny dla wzrostu i przeżycia
nowotworu.
W preparatyce szczepionek z komórek dendrytycznych wykorzystywane
są zarówno określone epitopy, antygeny związane z guzem lub całe
komórki nowotworowe

Antygeny wprowadzanego do komórki dendrytycznej:
1. peptydy, proteiny/rekombinowane białka;
2. zabite komórki nowotworowe, lizaty komórek nowotworowych;
3. kompleksy antygen-
przeciwciało;
4. RNA, DNA (z nowotworu
– pojedynczy gen lub cały genom guza);
5. białka idiotypowe (monoklonalne immunoglobuliny zawierające
specyficzne sekwencje białkowe w regionach zmiennych, w miejscach
wiążących antygen, produkowane przez komórki nowotworowe);
6. fuzje DC-
komórka nowotworowa;
7. ciałka apoptotyczne komórek guza;
8. wektory wirusowe;
9. Antygeny nienowotworowe (VEGF, VEGFR).

Szczególny rodzaj szczepionek przeciwnowotworowych
stanowią szczepionki uzyskane z komórek nowotworowych
zmienionych genetycznie
– temat kolejnego wykładu
„Terapii Genowej”
Wyszukiwarka
Podobne podstrony:
Wykł 12 Kult 2010 Hodowle roślinne Biotechnologia roślin
WstĂŞp do Filozofii wykÂł.V - 10.11.2010, Wstęp do filozofii
Wykł 11 Kult 2010 Terapia genowa
Podstawy metrologii wykł 10 2010 statystyka
WstĂŞp do Filozofii. wykÂł I.6.10.2010, Wstęp do filozofii
Podstawy metrologii wykł 10 2010 statystyka
Wykł 9 Kult 2010 Przeciwciała monoklonalne
10.11.2010, prawo administracyjne ćwiczenia(2)
Smolensk Katastrofa ktorej nie bylo, SMOLENSKN 10 04 2010 MORDERSTWO W IMIE GLOBALIZACJI
klamstwo smolenskie MIEDZYNARODOWY SPISEK, SMOLENSKN 10 04 2010 MORDERSTWO W IMIE GLOBALIZACJI
65 lat temu NKWD aresztowało 16 przywódców Polskiego Państwa Podziemnego, SMOLENSKN 10 04 2010 MORD
Rewolucja Na Talerzu s01e07 Wędliny 10 06 2010
Chów i Hodowla Koni (1), ● Chów i hodowla i Technologie w produkcji
Chów i Hodowla Koni, ● Chów i hodowla i Technologie w produkcji
wykład 3 - podstawy zarządzania - 10.01.2010
10 4 05 2010
11 10 stycznia 2011 www.przeklej.pl, 10 stycznia 2010
więcej podobnych podstron