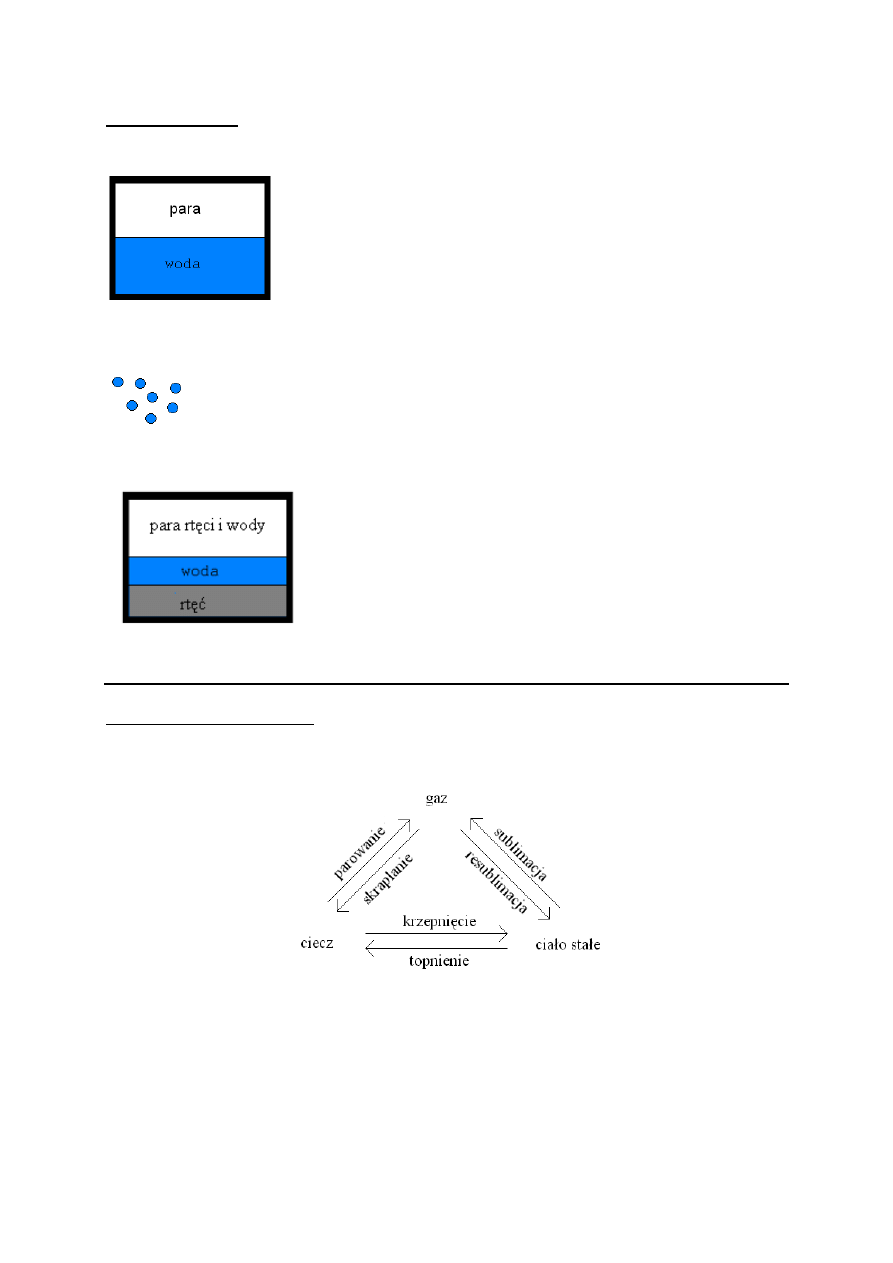
Przejścia fazowe.
← powierzchnia rozdziału
- skokowa zmiana niektórych parametrów na granicy faz.
← kropelki wody w atmosferze
- dwie fazy ciekłe
- jedna faza gazowa
- dwa składniki
Przykłady przejść fazowych:
• zmiany stanu skupienia
1
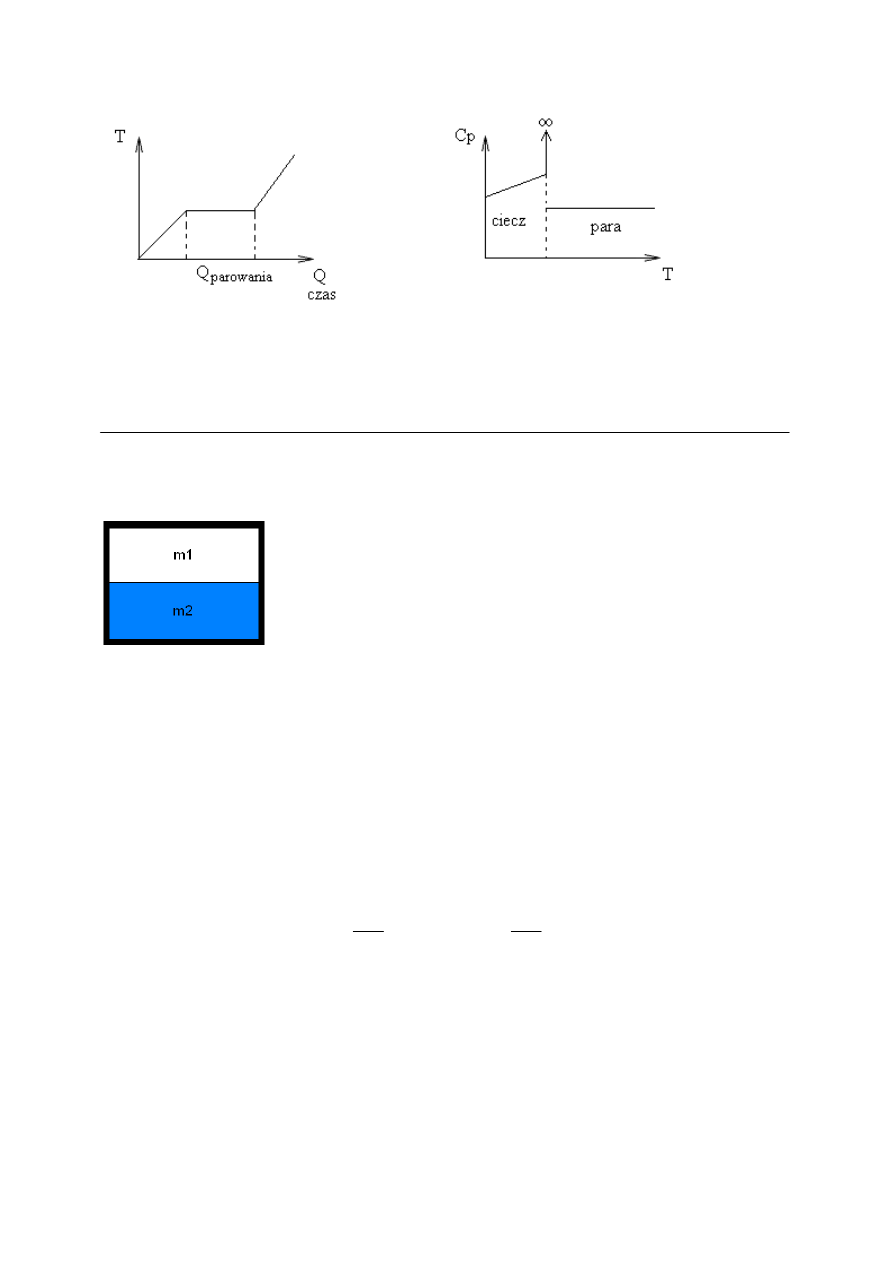
0
≠
przemiany
Q
- przemiana fazowa I rodzaju,
p
c - zmienia się skokowo
0
=
przemiany
Q
- różne pochodne parametrów względem temperatury – przemiany II rodzaju.
Rozważmy dwie fazy:
const
m
m
=
+
2
1
-
układ jest izolowany
Współistnienie faz ma miejsce, jeśli są one ze sobą w równowadze.
)
2
(
)
1
(
p
p
=
, T
)
2
(
)
1
(
T
=
0
,
0
=
= dT
dp
Równowaga mechaniczna i termiczna nie wystarcza, by fazy znajdowały się w równowadze.
Warunkiem wystarczającym jest minimum funkcji Gibbsa G :
2
2
1
1
dm
dm
Vdp
SdT
dG
µ
µ
+
+
+
−
=
2
,
,
1
1
m
T
p
m
G
∂
∂
=
µ
,
1
,
,
2
2
m
T
p
m
G
∂
∂
=
µ
Dla rozważanej przemiany w stanie odbiegającym od równowagi:
0
)
(
2
2
1
1
,
<
+
=
dm
dm
dG
p
T
µ
µ
0
)
(
1
2
1
<
−
dm
µ
µ
, dm
2
2
dm
−
=
Ta nierówność jest spełniona, jeśli:
2
0
1
<
dm
2
1
µ
µ >
lub:
0
1
>
dm
2
1
µ
µ <
Znaczy to, że strumień materii jest skierowany od fazy z większym potencjałem chemicznym
do fazy o mniejszym potencjale.
W stanie równowagi:
2
1
µ
µ =
- warunek równowagi faz.
Równowaga pomiędzy fazami ma charakter dynamiczny
cząstki przechodzą w obie strony
Potencjały chemiczne są funkcjami i T :
p
)
,
(
)
,
(
2
1
p
T
p
T
µ
µ
=
(*)
Warunek (*) wyznacza w płaszczyźnie (
krzywą równowagi między fazą 1
)
,T
p
i fazą 2. Można napisać:
)
(T
p
p
=
Wyznaczenie tej zależności jest na ogół trudne. Możemy jednak łatwo wyliczyć
dT
dp
.
Z (*) mamy:
)
,
(
)
,
(
2
1
p
T
d
p
T
d
µ
µ
=
Z relacji Gibbsa-Duhema:
0
=
+
−
µ
Nd
Vdp
SdT
wynika, że:
dp
N
V
dT
N
S
T
p
d
dp
N
V
dT
N
S
T
p
d
2
2
2
2
2
1
1
1
1
1
)
,
(
)
,
(
+
−
=
+
−
=
µ
µ
Wprowadzając oznaczenia:
i
i
i
N
S
S
=
~
,
i
i
i
N
V
V
=
~
,
2
,
1
=
i
i z warunku równości potencjałów otrzymujemy:
dp
V
dT
S
dp
V
dT
S
2
2
1
1
~
~
~
+
−
=
+
−
)
(
)
(
)
1
2
1
2
~
~
~
~
S
S
dT
V
V
dp
−
=
−
a stąd wynika:
3
1
2
1
2
~
~
~
~
V
V
S
S
dT
dp
−
−
=
Równanie Clapeyrona-Clausiusa
Definiując:
)
~
~
(
~
1
2
S
S
T
Q
przemiany
−
=
dostajemy:
T
V
V
Q
dT
dp
przemiany
)
~
~
(
~
1
2
−
=
Dla przemiany zachodzącej z pochłonięciem ciepła
Q
0
~
>
przem
0
>
dT
dp
jeśli V
(np. wrzenie wody)
1
2
~
~
V
>
Przykład: Topnienie lodu.
W temperaturze
:
, V
,
C
o
0
)
15
.
273
(
K
o
3
2
1
)
(
~
cm
woda
V
=
3
1
091
.
1
)
(
~
cm
lód
=
g
J
przem
7
.
333
=
Q
Otrzymujemy:
atm
K
Pa
K
dp
dT
0075
.
0
10
417
.
7
8
−
=
⋅
−
=
−
.
Zależność ciśnienia pary nasyconej od temperatury.
Jeśli założyć, że V
, to:
ciecz
para
V
~
~
>>
para
przem
V
T
Q
dT
dp
~
~
=
Korzystając z równania stanu gazu doskonałego dla pary można napisać:
2
~
)
(ln
1
RT
Q
dT
p
d
dT
dp
p
przem
=
=
Przyjmując Q
po scałkowaniu dostajemy:
const
przem
=
~
−
=
RT
Q
c
p
przem
~
exp
a stałą c można wyznaczyć z warunków
i T
..
0
p
p
=
0
T
=
4
Dotąd rozważaliśmy istnienie dwóch faz. Teraz rozważmy istnienie trzech faz: ciekłej (1),
gazowej (2) i stałej (3). Aby układ znajdował się w równowadze muszą być spełnione
następujące warunki:
)
,
(
)
,
(
2
1
p
T
p
T
µ
µ
=
,
,
)
,
(
)
,
(
3
1
p
T
p
T
µ
µ
=
)
,
(
)
,
(
3
2
p
T
p
T
µ
µ
=
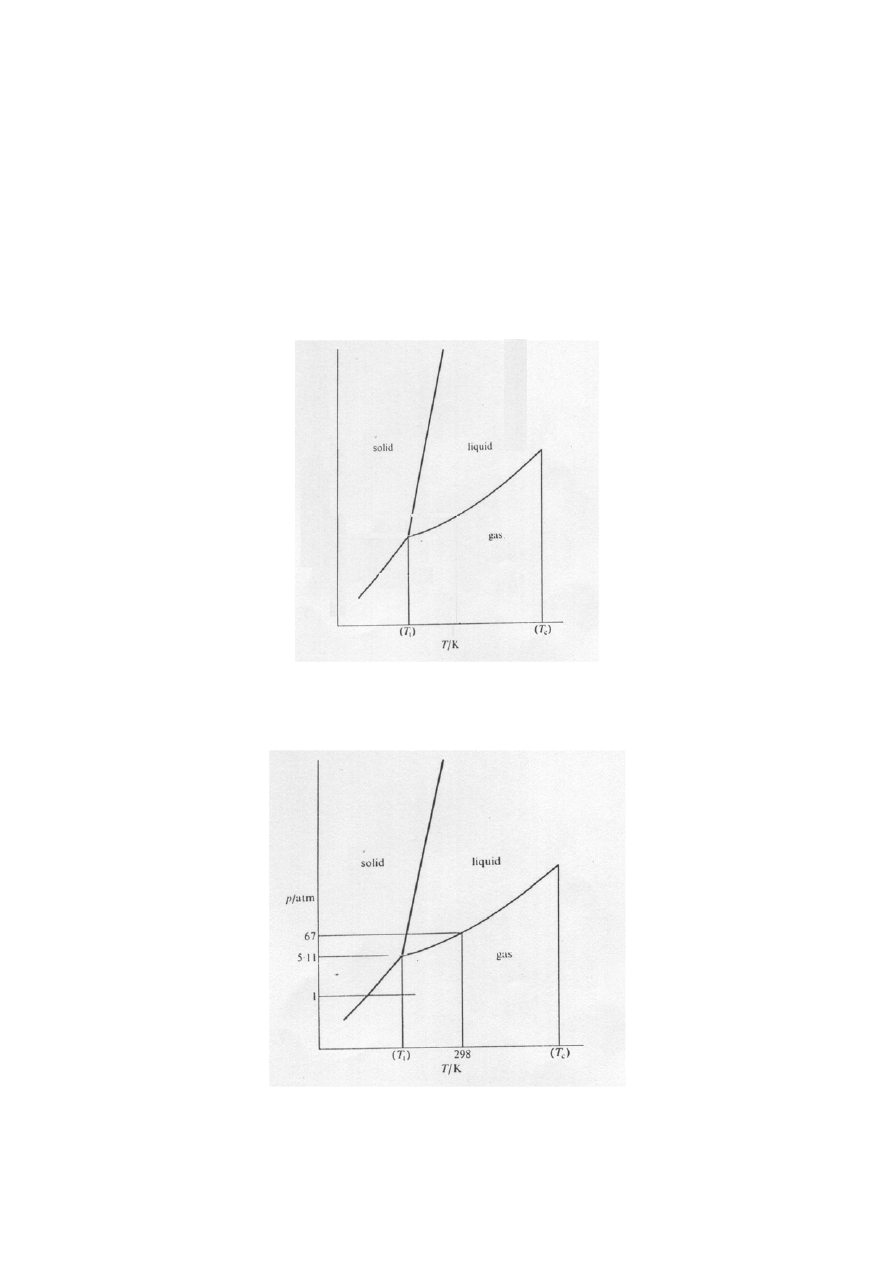
(krzywa wrzenia) (krzywa topnienia) (krzywa sublimacji)
Istnieje punkt wspólny tych trzech krzywych – jest to tzw. punkt potrójny.
Dla wody mamy następujące zależności
Wykres fazowy dla wody.
punkt potrójny: T
,
/
C
o
01
,
0
=
Pa
p
62
,
610
=
Wykres fazowy dla dwutlenku węgla:
5
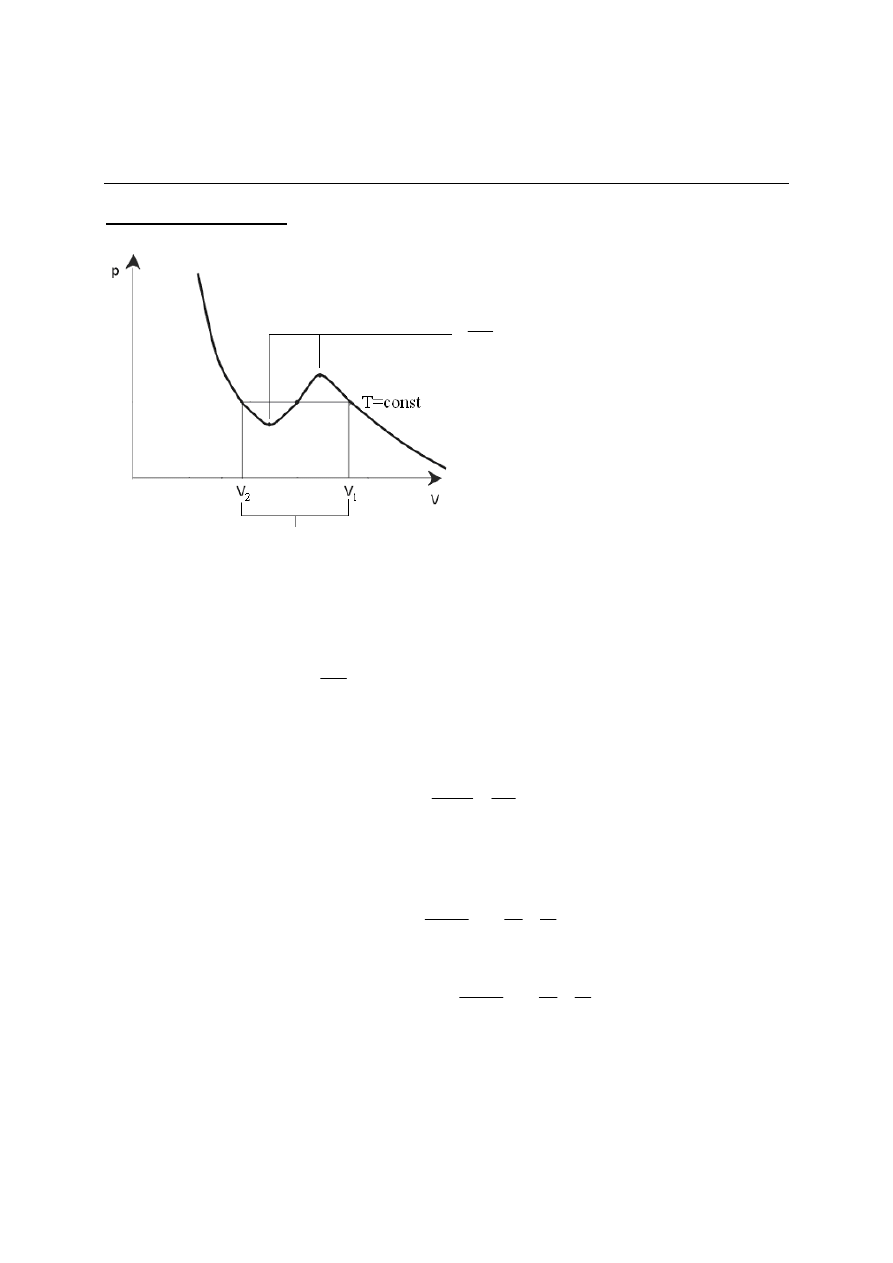
punkt potrójny: T
,
C
o
6
.
56
−
=
atm
p
1
.
5
=
punkt krytyczny: T
,
C
K
o
31
=
atm
p
K
73
=
Konstrukcja Maxwella.
0
>
dV
dp
- obszar niefizyczny,
Li – ciecz,
v – gaz.
współistnienie cieczy i gazu:
p
Li
=p
v
, T
Li
=T
v
,
µ
Li
(p,T)=
µ
v
(p,T).
)
,
( T
V
U
- przy ustalonej ilości cząstek:
∫
−
=
∆
2
1
)
(
V
V
dV
V
p
U
Nie mamy tutaj wkładu od
∫
∂
∂
dT
T
U
V
, bo
- proces izotermiczny.
0
=
dT
U jest różniczką zupełną, można zatem liczyć
wzdłuż dowolnej krzywej, w
szczególności wzdłuż prostej
lub wzdłuż krzywej van der Waalsa:
U
∆
V
Li
p
p
=
2
)
(
V
a
b
V
RT
V
p
−
−
=
Zatem:
)
(
1
2
V
V
p
U
Li
−
−
=
∆
oraz:
−
−
−
−
−
=
∆
1
2
1
2
1
1
ln
V
V
a
b
V
b
V
RT
U
z porównania wynika:
−
−
−
−
−
=
−
−
1
2
1
2
1
2
1
1
ln
)
(
V
V
a
b
V
b
V
RT
V
V
p
Li
można z tego warunku i równania van der Waalsa określić
.
2
1
,
,
V
V
p
Li
6

Reguła faz Gibbsa.
Załóżmy, że mamy układ wielofazowy i wieloskładnikowy:
K - liczba składników
P - liczba faz (np: gazowa, ciekła, stała).
Każda faza może być traktowana jako podsystem całego systemu.
Dla każdej fazy możemy zapisać:
∑
=
+
−
=
K
l
i
l
i
l
i
i
i
i
i
dN
dV
p
dS
T
dU
1
)
(
)
(
)
(
)
(
)
(
)
(
)
(
µ
P
i
,...
2
,
1
=
Dla każdej fazy U jest funkcją
2 zmiennych ekstensywnych
.
Razem dla faz mamy
zmiennych.
)
(i
+
K
)
)
(
)
(
1
)
(
)
(
,...
,
,
i
K
i
i
i
N
N
V
S
P
2
(
+
K
P
Jeśli system jest w równowadze termodynamicznej, to mamy następujące warunki na
zmienne:
)
(
)
2
(
)
1
(
...
P
T
T
T
=
=
=
- równowaga cieplna
)
(
)
2
(
)
1
(
...
P
p
p
p
=
=
=
- równowaga mechaniczna
)
(
)
2
(
)
1
(
...
P
l
l
l
µ
µ
µ
=
=
=
, l
- równowaga chemiczna
K
,...,
1
=
Każda linia zawiera
warunków wiążących zmienne.
1
−
P
Razem mamy (
warunków.
)
2
)(
1
+
−
K
P
Ponieważ T
są funkcjami
, to liczba niezależnych zmiennych jest
równa:
)
(
)
(
)
(
,
,
i
l
i
i
p
µ
)
(
)
(
)
(
,
,
i
l
i
i
N
V
S
2
)
1
)(
2
(
)
2
(
+
=
−
+
−
+
K
P
K
P
K
.
Wystarczy znać tylko wartości zmiennych ekstensywnych, aby określić stan
równowagi całego systemu.
2
+
K
Jeśli rozważymy przypadek, że ekstensywnych zmiennych
określa
rozmiar każdej z faz, to potrzebujemy
P
)
,...
1
,
:
.
(
)
(
P
i
V
np
i
=
P
K
F
−
+
=
2
zmiennych intensywnych - reguła faz Gibbsa.
Przykłady:
1) Zbiornik zawierający gaz w objętości V:
1
=
K
,
2 - dwa parametry intensywne i T .
1
=
P
⇒
=
F
p
2) ,
1 - możemy zmieniać np. T , a wartość określa równanie
1
=
K
2
=
P
⇒
=
F
p
)
(T
p
(np. woda w równowadze z parą).
7

3) ,
0 - punkt potrójny, wszystkie parametry określone.
1
=
K
3
=
P
→
=
F
4) - nienasycony roztwór soli kuchennej
, możemy zmieniać
ciśnienie, temperaturę, stężenie
.
3
1
,
2
=
→
=
=
F
P
K
NaCl
NaCl
5) - nad roztworem mamy jego parę. Możemy zmieniać tylko dwa
parametry.
2
2
,
2
=
→
=
=
F
P
K
6) - mamy roztwór nasycony w równowadze ze swoją parą (fazy: gaz,
ciecz, ciało stałe: lód lub
). Możemy zmieniać tylko 1 parametr.
1
3
,
2
=
→
=
=
F
P
K
NaCl
7) - mamy fazę gazową, roztwór nasycony (ciecz) i dwie fazy stałe
(lód, kryształy soli).
0
4
,
2
=
→
=
=
F
P
K
8
Zależność temperatury krzepnięcia
roztworu NaCl w wodzie od składu
roztworu.
Stężenie roztworu: części
na 100 części
.
x
NaCl
O
H
2
E jest to tzw. punkt eutektyczny - punkt współistnienia czterech faz. Dla roztworu soli
NaCl w wodzie, jego parametry wynoszą:
C
T
°
−
=
5
,
21
,
3
,
31
=
x
Jeśli oziębiamy roztwór rozcieńczony, to najpierw wydziela się czysty lód.
Jeśli oziębiamy roztwór stężony, to początkowo wydziela się czysta sól i układ zmierza do
punktu eutektycznego.
Reguła faz Gibbsa w przypadku, gdy poszczególne składniki układu mogą wchodzić w
reakcje chemiczne:
R
P
K
F
−
−
+
=
2
,
gdzie - liczba zachodzących reakcji.
R
Document Outline
Wyszukiwarka
Podobne podstrony:
14 przejscia fazoweid 15265 Nieznany (2)
55 Przejscie fazowe lipidow
PRZEJSCIA FAZOWE JAKO PRZEMIANY FIZYCZNE
PRZEJŚCIA FAZOWE ŚRODOWISKOWO PODATNYCH ŻELI POLIMEROWYCH ITD
14 przejscia fazoweid 15265 Nieznany (2)
PRZEJŚCIA FAZOWE ŚRODOWISKOWO PODATNYCH ŻELI POLIMEROWYCH CZĘŚĆ II WYKORZYSTANIE WŁAŚCIWOŚCI ŻELI PO
W3B Układy fazowe
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
7 uklady rownowagi fazowej id 4 Nieznany
C DOCUME~1 GERICOM USTAWI~1 Temp plugtmp 1 plugin lokalizacja przejsc problemy i dobre praktyki rkur
PRACA PRZEJŚCIOWA OPTYMALIZACJA PROCESÓW ENERGETYCZNYCH POPRZEZ ZASOTOWANIE NOWOCZESNYCH ALGORYTMÓW
Pracownik musi poinformować pracodawcę o przejściu na emeryturę
01-Antylitania na czasy przejściowe, J. Kaczmarski - teksty i akordy
Cukrzyca przezywaczy, Diagnostyka biochemiczna chorob okresu przejsciowego bydla
Projekt przejściowy
Droga Obliczenie punktów głównych łuku kołowego z krzywymi przejściowymi
Karta pracy przejściowej
karta inf praca przejściowa projekt
więcej podobnych podstron