
WODA JAKO CHEMICZNY ELEMENT ŚRODOWISKA:
75 % planety jest pokryte wodą
Ż
ycie wyszło z wody to ona rozpoczęła ewolucję
W organizmie człowieka woda (osocze) to praocean
Jest niezbędnym składnikiem w funkcjonowaniu gospodarki i w życiu każdego organizmu
Tzw. Biały węgiel -> energia pobierana z wody
65% organizmu ludzkiego to woda ( ubytek 10% prowadzi do poważnych zaburzeń)
REKORDY:
20% masy wody w organizmie- pewny zgon
Bez jedzenia można wytrzymać 7 dni, zagrożenie dla życia -30 dni /rekord 72 dni
Bez wody 7 dni /rekord 14
CECHY FIZYCZNE WODY
- wzorzec masy 1g = 1 cm
3
wody w temperaturze 4
o
C
- w skali Celsjusza 0
o
C -> zamarzanie
100
o
C -> wrzenie
- ze wzrostem temperatury spada gęstość wszystkich substancji, bo objętość rośnie. Wszystkie substancje mają też
charakterystyczne punkty nieciągłości, czyli punkty przejścia z jednej do drugiej fazy (np. ze stanu ciekłego w stały)
Dla wody jest inaczej… Jej gęstość spada, gdy temperatura spada. Dzięki temu mamy do czynienia z pokrywą lodową
zimą – występuje od powierzchni (woda nie zamarza od dna) Lód nie typowo, jako ciało stałe, ma niższą gęstość niż
ciecz.
WODA:
najlepszy rozpuszczalnik
pozostaje kwestia skali rozpuszczalności, bo w wodzie rozpuszcza się wszystko tylko w różnym stopniu. ( są
trudności w zbadaniu rozpuszczalności platyny i irydu ze względu na niedokładność mierników ); rozpuszczalności
szkła nie mierzymy bo jest to materiał do przechowywania płynów. Ścieków nie przechowujemy w szkle, bo na dnie
znajdują się metale ciężkie
woda czysta to słaby przewodnik prądu
idealnie czysta woda to świetny izolator
Przewodnictwo cieplne: dla metali wręcz izolator, dla izolatorów dobry przewodnik.
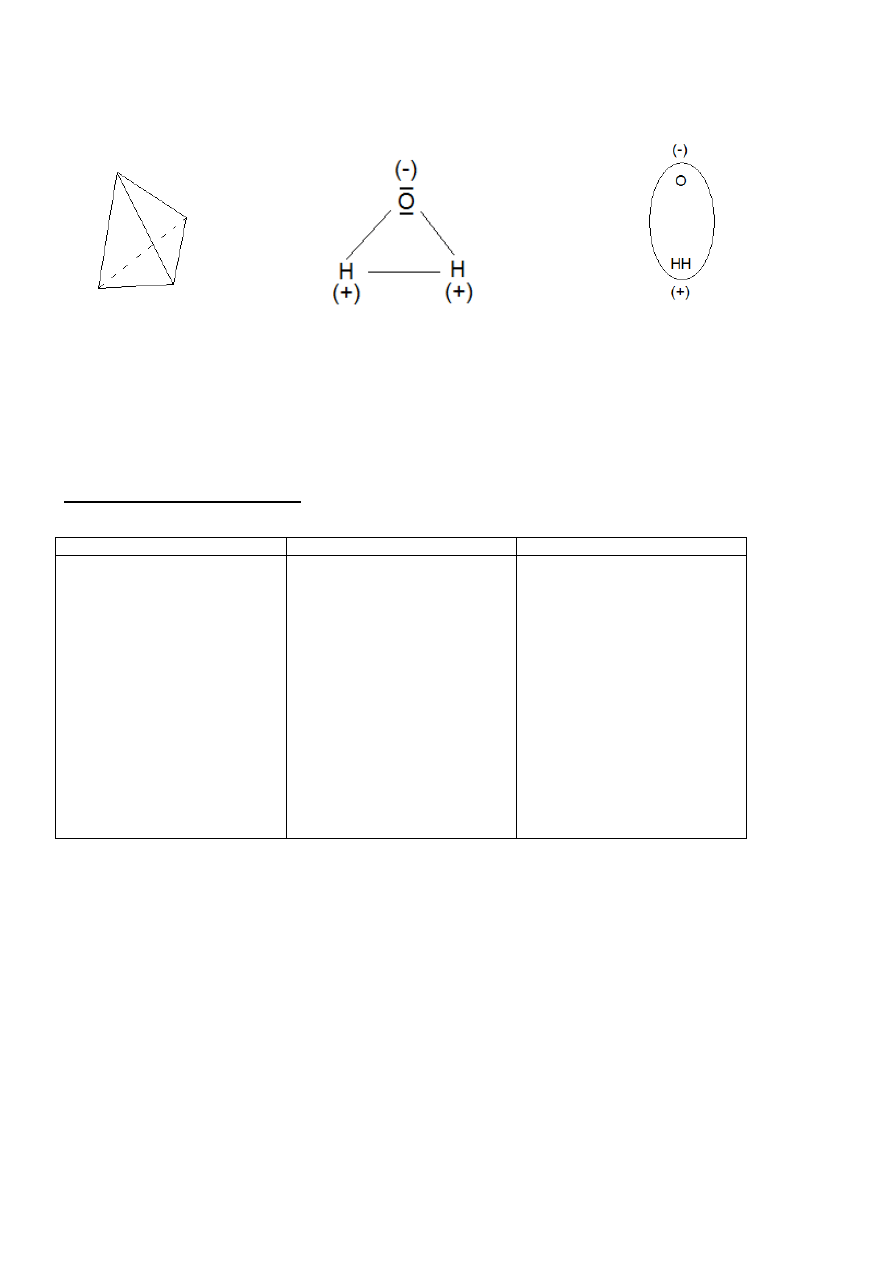
Cząsteczka wody to tetraedr (czworościan foremny).
Reakcję uwadniania nazywamy hydratacją; np.: CaO+ H
2
O= Ca(OH)
2
.
Reakcję podwójnej wymiany nazywamy hydrolizą; np.: PCl
3
+ 3H
2
O= 3HCl+ H
3
PO
4
.
Wody naturalna to woda, która bierze udział w kołowym obiegu w przyrodzie. Wody związane chemicznie to np.: gips
(CaSO
4
•2H
2
O).
PODZIAŁ WÓD NATURALNYCH:
OPADOWE
POWIERZCHNIOWE
PODZIEMNE
•
Znajdują się w atmosferze dopóki
nie opadną na powierzchnię.
•
Bardzo czyste, nisko
zmineralizowane
•
Lekki odczyn kwaśny (pH=6,5)
•
W postaci opadów, do momentu
zetknięcia z powierzchnią Ziemi
•
Zasolenie rzędu 10-20 mg/dm
3
•
Ś
nieg zawiera zanieczyszczenia z
powietrza.
•
Wody stojące, płynące,
ś
ródlądowe (słodkie), morskie
(słone)
•
Odbiorniki ścieków
•
Znacząca zawartość
mikroorganizmów
•
Zasolenie rzędu 100-300
mg/dm
3
•
Znaczna mętność,
zanieczyszczone
•
Duża ilośc bakterii
•
Mają zabarwienie, ale ludzkie
oko tego nie dostrzega
•
Wyróżnia się wody podziemne:
o
Podskórne (0,5-1m)
o
Gruntowe (kilkanaście m)
o
Wgłębne (100-200m)
o
Głębinowe (powyżej 1km)\
•
Czystość i zasolenie wzrastają
wraz z głębokością
•
Wody gruntowe można
spożywać, bo zostały oczyszczone
przez warstwę zaskórną i
pozbawione bakterii
•
Wody wgłębne są oddzielone
przynajmniej 2 warstwami
nieprzepuszczalnymi.
•
Wody głębinowe są mocno
zasolone
Zanieczyszczenia – składniki znajdujące się w wodzie poprzez działalnoś ć człowieka
Domieszki - składniki znajdujące się w wodzie poprzez warunki naturalne
Wody niezanieczyszczone – czysta woda bez domieszek i zanieczyszczeń
•
Jak mało Cl
-
to małe prawdopodobieństwo, że woda zanieczyszczona.
•
So
4
2-
+ Cl
-
to wody na 97% niezanieczyszczone.
•
Ph w okolicach 0 to wody niezanieczyszczone
•
Ph większe od zera to im większe tym większe prawdopodobieństwo, że wody są zanieczyszczone.
Ścieki to wszelkie płynne produkty nieprzydatne w czasie i miejscu gdzie powstały. Ścieki dzielimy na:
•
Bytowe- zużyte przez człowieka wody potrzebne dla zaspokojenia potrzeb bytowych;
•
Przemysłowe- wynik funkcjonowania przemysłu;
•
Komunalne- mieszanina bytowych i przemysłowych;
•
Opadowe- wody powierzchniowe ujmowane do sieci kanalizacyjnych.

TLEN W WODZIE:
Rozpuszczalność gazów w wodzie spada wraz ze wzrostem temperatury (wyższa temperatura oznacza mniej tlenu w wodzie).
Ś
ciekami więc nazywamy także ciecze niosące ze sobą ładunek cieplny (zaburzają one równowagę biologiczną).
Ś
cieki bytowe zawierają ogromne ilości związków organicznych, taka ilość wpływa na środowisko (doprowadza do deficytu
tlenu). Umownie możemy przyjąć poniższe reakcje zużycia tlenu podczas rozkładu:
C
org
= CO
2;
C
org
= CO
3
2-
;
C
org
= HCO
3
2-
;
Tlen trafia do wody dwutorowo:
•
dyfuzja z powietrza
•
rośliny zielone w wodzie
Stężenie tlenu:
•
10 mg O
2
/dm
3
to maksymalne stężenie
•
6 mg O
2
/dm
3
oznacza śnięcie narybku ryb łososiowatych
•
4 mg O
2
/dm
3
bez ingerencji z zewnątrz woda przekształca się w ściek (wartość krytyczna)
W warunkach beztlenowych powstają związki toksyczne, oznacza to całkowitą zagładę życia.
WSKAŹNIKI JAKOŚCI WODY:
•
Biologiczne: zawartość bakterii w wodzie. Przy badaniu biologicznym wykorzystuje się bakterie grupy Coli, a
konkretnie najbardziej prawdopodobną liczbę bakterii w 100cm
3
wody. Podstawowe oznaczenia:
Liczba bakterii wyhodowanych z 1cm
3
wody na obszarze odżywczym w temperaturze 20 C w ciągu 72
godzin
Liczba bakterii wyhodowanych z 1cm
3
wody na obszarze odżywczym w temperaturze 37 C w 24 godziny
Miano Coli- ilość cm
3
wody przypadająca na 1 bakterię; E. Coli- NPL/100cm
3
(Najbardziej
Prawdopodobna Liczba)
•
Fizyczne:
Temperatura
Mętność:
jednostką jest mg SiO
2
/dm
3
- czynnikiem mętnienia wody może być cokolwiek innego, co daje
taki sam efekt co dana objętość krzemionki.
Przezroczystość:
bada się np.: poprzez układanie pręta z białym krążkiem o średnicy 25cm w badaną wodę
i ustalenie, na jakiej głębokości staje się on niewidoczny.
Barwa:
nadają ją wodzie związki humusowe lub rozpuszczone związki mineralne; istnieje barwa pozorna
(wystarczy filtracja zawiesiny) oraz rzeczywista (nieusuwalna fizycznie). Umowną jednostką barwy jest
mg Pt/dm
3
.
Zapach:
określony w warunkach (z-zimne, g-gorące), przydzielając do jednej z grup zapachowych (R-
roślinne, G- gnilne, S- specyficzne pochodzenia nienaturalnego) i określa jego intensywność (5-cio
stopniowa skala).
Smak:
ze względu na niebezpieczeństwo z tym związane sprawdza się rzadko; wyróżniamy słony, kwaśny,
alkaliczny i gorzki.
Przewodnictwo elektryczne:
czym większa przewodność wody tym wyższe zasolenie.
•
Chemiczne:
Nieorganiczne
(wykazują prawdopodobne zanieczyszczenie, twardosc wody, zasadowosc wody)
PH, Cl
-
, SO
4
2
- oddziaływanie korozyjne wody
PH>7 – kwas, który będzie atakował konstrukcje metalowe, betonowe itp.
Cl
-
- korozja stali
SO
4
2
- korozja
Organiczne
(oddziałują trochę toksycznie – ropopochodne, ich nadmiar jest szkodliwy, bo mogą rozwijac
się bakterie)
Biogenne:
dosłownie ‘rodzące życie’- (N, P)
Normą pH jest zakres 6,7-7,5. Latem zwiększone zużycie CO
2
oznacza większą liczbę roślinności w zbiornikach wodnych, a
także większe uwalnianie z powodu wzrostu temperatury; może to doprowadzić do znacznego wzrostu pH, co wcale nie musi
ś
wiadczyć o zanieczyszczeniu.

WSKAŹNIKI JAKOŚCI WODY OGÓLNIE:
Siarczany i chlorki (Podwyższona zawartość daje prawdopodobieństwa zanieczyszczenia ściekami)
Odczyn PH (mówi o agresywności wody)
Poziom tlenu
Im większe stężenie tlenu tym woda jest czystsza. Teoretycznie stężenie tlenu wynosi 10mgO
2
/dm
3
(dla wody
bardzo czystej)
Stężenie tlenu:
•
10 mg O
2
/dm
3
to maksymalne stężenie
•
6 mg O
2
/dm
3
oznacza śnięcie narybku ryb łososiowatych
•
4 mg O
2
/dm
3
bez ingerencji z zewnątrz woda przekształca się w ściek (wartość krytyczna)
Związek tlenu i związków organicznych: Bakterie odżywiają się węglem ze związków organicznych, powodują
ich rozkład przez enzymy, które wydzielają otoczkę bakterii. Bakterie potrzebują tlen do przerobienia związków
organicznych. Dostarczania tlenu z atmosfery jest powolne. Gdy tlenu zabraknie giną bakterie tlenowe. Są jeszcze
bakterie beztlenowe, które powodują korozję betonu.
Potencjał redoks E
n
– mówi o zdolności utleniającej danego ośrodka
Twardość wody
•
Przez wiele lat miernikiem twardości wody była zdolność do zmydlania wody (było to bardzo niewygodne)
•
Obecnośc wapnia i magnezu jest przyczyną twardości, bądź miękkości wody.
•
Definicja wg inżynierii sanitarnej: metale ciężkie- metale szkodliwe (o masie atomowej > 56) oddziałujące na
organizmy żywe. Od lat 70 XXw twardość określamy na podstawie zawartości wapnia i magnezu:
Tw
ogólna
= Tw
Ca
+ Tw
Mg
Tw
węglanowa
wynika z obecności HCO
3
-
oraz CO
3
2-
.
Tw
niewęglanowa
wynika z obecności SO
4
2-
, Cl
-
oraz NO
3
-
.
Twardość węglanowa i niewęglanowa to związki Ca i Mg z wymienionymi substancjami.
Jednostki twardości:
•
Stopie
ń
niemiecki- 1 n= 10 mg CaO/dm
3
•
Miligramorównowa
ż
nik- 1 mval/dm
3
= 2,8 n
•
Obecnie jednostk
ą
w wi
ę
kszo
ś
ci krajów jest miligram
- mg CaCo
3
/dm
3
.
Twardość wód naturalnych waha się od 50 do 100mg CaCo
3
/dm
3
.
Twarda woda oznacza większe zużycie mydła, proszków do prania, szybsze zyżycie tkanin, spada wartość
odżywcza mięsa gotowanego w twardej wodzie, tworzenie się tzw. kamienia. Węglan wapnia jest głównym
przedstawicielem kamienia kotłowego. Aby zmniejszyć twardość należy usunąć CO
2
, np.:
CO
2
+ Ca(OH)
2
= CaCO
3
+ H
2
O
Nie można go usunąć całkowicie, musi pozostać stan równowagi, tzw.: dwutlenek węgla równowagi; nadmiar
nazywa się dwutlenkiem węgla agresywnym.
Zasadowość (zdolność wody do neutralizacji kwasów)

MIERNIKI ZAWARTOŚCI ZWIĄZKÓW ORGANICZNYCH:
•
BzT
5
:
5-dobowe biochemiczne zapotrzebowanie tlenu, jednostka:
mg O
2
/dm
3
.
Obecnie technika pozwala zbadać BzT w ciągu 2-3h. Można również badać ilość związków chemicznych (ilość tlenu zużytego
na natlenienie związków organicznych) KMnO
4
, K
2
Cr
2
O
7
. Często występuje zawyżenie wyniku, bo utleniają one nie tylko
związki organiczne ale i chemiczne.
•
ChzT:
chemiczne zapotrzebowanie tlenu -
mg O
2
/dm
3
(oznacza ze mamy wodę o takiej zawartości chemicznej w
1dm
3
, która zużywa x mg substancji)
Prawie zawsze ChzT>BzT
5
.
•
OWO: ogólny węgiel organiczny- polega na katalitycznym spaleniu związków organicznych, policzeniu pozostałego
węgla i przeliczeniu go na związki organiczne [mg C/dm
3
].
•
EE: ekstrakt eterowy- nie rozpuszcza się w wodzie, natomiast wiele związków w nim się rozpuszcza (większość
związków ropopochodnych z wody).
RÓWNOWAGA WĘGLANOWO WAPNIOWA WODY:
….czyli kiedy woda jest agresywna, a kiedy mogą się z niej wytrącać węglany
Tematyka równowagi węglanowo - wapniowej jest zapomnianym elementem technologii uzdatniania wody zarówno
podziemnej jak i powierzchniowej.
Tymczasem niestabilna woda może być albo agresywna, mając własności korozyjne, sprzyjając niszczeniu urządzeń
technologicznych (zwłaszcza filtrów studziennych, rurociągów tłoczących wodę surową, urządzeń napowietrzających, filtrów -
albo z drugiej strony mogą się z niej intensywnie wytrącać węglany wapnia czy magnezu i to nie tylko po przegotowaniu, czy
podgrzaniu (popularny "kamień"), co również jest przyczyną poważnych komplikacji technologicznych - zwłaszcza przy
filtracji.
CaCO
3
+ CO
2
Ca(HCO
3
)
2
[wodorowęglan wapnia]
- przy wzroście CO
2
rozpuszcza się więcej CaCO
3
- przy ogrzewaniu CO
2
uwalnia się do atmosfery, powstaje osad CaCO
3
i kamień (tylko gdy T>57
o
)
MAGNEZ I WAPŃ:
Mg – metal dość twardy, niekowalny, najlżejszy z użytkowych metali, otrzymujemy go z elektrolizy: MgCl
2
Mg + Cl
2
.
Ca – jeden z najbardziej rozpowszechnionych pierwiastków na ziemi, występuje w e wszystkich skałach osadowych, metal
srebrzysto-biały
Węglan wapniowy: praktycznie nie rozpuszczalny w wodzie, rozpuszczalność zaledwie 14 mg/dm
3
, rozpuszczalność jednak
wzrasta w wodach ze zwiększoną obecnością CO
2
. Następuje wtedy przemiana na Ca(HCO
3
)
2
bardzo dobre rozpuszczalny w
wodzie.
Wapno – materiał stosowany w budownictwie.
CaCO
3
CaO + CO
2
– Q (reakcja endotermiczna pod wpływem 100-1000
o
C)
Reakcja realizowana w piecach „wapiennikach”, wypala się wapień i powstaje wapno palone. Gdy zostawi się je na
powietrzu do wapna palonego zacznie się przyłączac CO2 i powoli będzie przebiegała reakcja odwrotna.
Przy reakcji wapna palonego zachodzi bardzo szybko reakcja
CaO + H
2
O
Ca(OH)
2
+ Q
Ca(OH)
2
+ CO
2
CaCO
3
+ H
2
O
W wyniku tych procesów powstaje spoiwo.
SPOIWA:
Spoiwa budowlane – materiały otrzymywane z surowców mineralnych na drodze wypału i rozdrobnienia, które po
zmieszaniu z wodą tworzą plastyczne masy, które po dalszych procesach tracą właściwości plastyczne, wiążą i twardnieją.
Fazy wiązania spoiw:
•
I faza – hydroliza i hydratacja (składniki spoiwa częściowo rozpuszczają się w wodzie)
•
II faza – wydzielanie się substancji koloidalnych (masa zaczyna tracic własności plastyczne)
•
III faza – przejście ze stanu koloidalnego w postac krystaliczną
Rodzaje spoiw:
•
Powietrzne – tylko wiążą w powietrzu
•
Hydrauliczne – wiążą na powietrzu i pod wodą
Służą do wyrobów budowlanych i cementu.

SPOIWA POWIETRZNE:
Zaprawa murarska – mieszanina wapna, piasku i wody
Proces wypalania wapienia:
CaCO
3
CaO (wapno palone) + CO
2
CaO + H
2
O
Ca(OH)
2
+ Q (silny efekt cieplny, woda się zagotuje, ryzyka dla robotników)
Ca(OH)
2
+ CO
2
CaCO
3
(węglan wapniowy) + H
2
O
Zatem wapno palone „gasi się” wodą. Wapno to dodajemy z piaskiem i wodą dla uplastycznienia. Wiązanie
przyspiesza się zwiększając stężenie CO
2
w powietrzu, ale wpływa to na zmniejszenie wytrzymałości.
Występują także reakcje, które zachodzą powoli ( po miesiącach i latach)
wiązania pucalonowe (krzemianowe)
np. SiO
2
(piasek) + CaO
CaO * SiO2. Dzięki tym wiązaniom konstrukcje mają dodatkowe umocnienie.
„Wapno hydrauliczne”: spoiwo budowlane wiążące na powierzchni i pod wodą, podstawowym składnikiem jest
wapno gaszone, ale do jego gaszenia stosuje się wapno margliste + od 6% do10% materiałów ilastych.
Spoiwo gipsowe
CaSO
4
– anhydryt (forma bez wodna)
CaSO
4
+ ½ H
2
O – gips półwodny
CaSO
4
+ 2H
2
O – gips dwuwodny
Wiązanie gipsu następuje bardzo szybko. Już po godzinie otrzymujemy maksymalną wytrzymałoś w stanie
wilgotnym.
T
1
– po tym czasie powstają zarodniki siarczanu wapnia dwuwodnego,
kryształy zaczynają rosnac i stykac się między sobą
T
2
– wartość maxymalna – krysztaly tworzą pewną strukturę całościową
T
3
– następuje dalszy rozrost kryształów przy dużej obecności wody
Po czasie T
3
następuje odparowanie wody (suszenie), jest to wzrost
wytrzymałości, ale to etap odwracalny
Gdy zwiększymy wilgotnośc zaledwie o 1-3% następuje spadek
wytrzymałości. Przy dalszej wilgotności rzędu 20-30% spadek
wytrzymałości nie występuje, lecz związek (słabo rozpuszczalny w wodzie)
przy dużej wilgotności może zostać wypłukany.
Współczynnik rozmiękczenia:
W = Wytrzymałość w stanie nasycenia wody (Rnas) / Wytrzymałość w stanie suchym (Rsuch)
Dla gipsu W= 0,3-0,4.
Metody przeciwdziałania:
•
powlekanie powierzchni gipsowych powierzchniami malarskimi (uniemożliwa wnikanie wody)
•
ż
ywice syntetyczne powodują, że gips staje się substancją mniej nasiąkliwą
•
płyty gipsowe (wodoodporne)

SPOIWA HYDRAULICZNE:
Cement – duża grupa różnych substancji; posiadają zdolność do twardnienia po rozrobieniu z wodą i posiadają
odporność na działanie wody i atmosfery
Cement powstaje z glino-krzemianu
Warunek by otrzymać cement: Stosunek tlenków zasadowych [CaO] do sumy tlenków kwasowych
[SiO
2
]+[Al
2
O
3
]+[Fe
2
O
3
] może wahac się w granicach 2-3.
Cement podajemy prażeniu w temperaturach od 1400 do 1600
o
C w piecach cementowych
Przy produkcji trzeba uważac na MgO i SO
3
!!! Ich zawartość nie może przekraczac podanej ilości procent:
[MgO]< 5%, [SO
3
]< 3%, ponieważ, zbyt duża ilość siarczanów i magnezu powoduje pęcznienie.
Odmiany cementu:
o
Cement portlandzki (naturalnie szary)
Ze względu na barwę cement portlandzki dzielimy na: biały (bezbarwny), kolorowy (odpowiednie dodatki metali),
ekspansywny (cement, który pęcznieje w trakcie wiązania)
Cement biały i kolorowy używany jest do wykończeń np. fug
o
Cement glinowy (podwyższona zawartość gliny)
Większa odporność na korozję, korzystny w warunkach zimowych, korzystny do napraw, szybko schnie i szybko
zyskuje wytrzymałość, drogi.
o
Cementy żużlowe (na bazie żużlu)
•
Cement hutniczy (na bazie żwiru wielkopiecowego, czyli takiego, który powstaje w wielkich piecach
hutniczych; wysoka odporność na korozję, korzystny w wodach morskich)
•
Cement gipsowo-żużlowy (na bazie żużlu i gipsu, brak zmian objętości, bez pęcznienia i kurczenia,
korzystny przy wielkich blokach betonowych, w wielkich konstrukcjach)
•
Cement wapienno-żużlowy (słaba wytrzymałość, wapno palone + żużel, nie potrzebuje powietrza do
wiązania, zastępuje zaprawę murarską, stosunkowo tani)
Wyszukiwarka
Podobne podstrony:
Chemia II kolo (1), CHEMIA - WYKŁADY PART 2
CHEMIA II KOLO, AM Gdynia, Sem. III,IV, Chemia wody, paliw i smarów
Chemia II kolo
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
Chemia wykłady, koło II sem v.3.01, Izomeria optyczna
II koło chemia, Chemia nieorganiczna Seliger
II koło chemia
chemia-sciaga II koło, ✔ ★Weterynaria, weta, Chemia, Chemia- kolosy
chemia żywnosci II koło
Chemia wykłady, koło II sem v.3.0 długopis, Izomeria optyczna
Chemia wykłady, koło II sem v.2.0, Izomeria optyczna
chemia żywnosci II koło 2
II koło chemia opracowane
PYTANIA NA II KOŁO Z MECHANIKI
botanika II koło
Chemia II Budowa atomu
Konwersatorium z Fizyki Zestaw 1 Chemia II
więcej podobnych podstron