
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Elżbieta Pietrasz
Określanie właściwości surowców szklarskich
311[33].Z1.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Stanisław Pelczar
mgr inż. Krzysztof Kubit
Opracowanie redakcyjne:
mgr Elżbieta Pietrasz
Konsultacja:
mgr Czesław Nowak
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[33].Z1.01
Określanie właściwości surowców szklarskich, zawartego w modułowym programie nauczania
dla zawodu technik technologii szkła
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
4
3. Cele kształcenia
5
4. Materiał nauczania
6
4.1. Budowa chemiczna i fizyczna szkła
6
4.1.1. Materiał nauczania
6
4.1.2. Pytania sprawdzające
20
4.1.3. Ćwiczenia
21
4.1.4. Sprawdzian postępów
22
4.2. Surowce szklarskie podstawowe
23
4.2.1. Materiał nauczania
23
4.2.2. Pytania sprawdzające
39
4.2.3. Ćwiczenia
39
4.2.4. Sprawdzian postępów
42
4.3. Surowce szklarskie pomocnicze i dodatkowe
43
4.3.1. Materiał nauczania
43
4.3.2. Pytania sprawdzające
50
4.3.3. Ćwiczenia
51
4.3.4. Sprawdzian postępów
53
5. Sprawdzian osiągnięć
54
6. Literatura
59
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o właściwościach surowców
szklarskich
W poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane, abyś
bez problemu mógł korzystać z poradnika,
−
cele kształcenia – wykaz umiejętności, jaki ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania – wiadomości teoretyczne niezbędne do opanowania treści jednostki
modułowej,
−
zestaw pytań, abyś mógł sprawdzić, czy już opanowałeś określone treści,
−
ćwiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian postępów,
−
sprawdzian osiągnięć, przykładowy zestaw zadań. Zaliczenie testu potwierdzi opanowanie
materiału całej jednostki modułowej,
−
literaturę obowiązującą.
Schemat układu jednostek modułowych
311[33].Z1
Metody badania surowców szklarskich
i szkła
311[33].Z1.01
Określanie właściwości surowców
szklarskich
311[33].Z1.02
Badanie właściwości szkła
311[33].Z1.03
Wykonywanie analiz laboratoryjnych
surowców szklarskich i szkła

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
charakteryzować budowę atomu,
−
określać liczbę atomową i masową pierwiastków,
−
posługiwać się układem okresowym pierwiastków,
−
zapisywać proste reakcje chemiczne,
−
określać sposoby otrzymywania związków nieorganicznych,
−
charakteryzować tlenki, wodorotlenki, kwasy, sole,
−
korzystać z różnych źródeł informacji,
−
współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
określić chemiczne właściwości pierwiastków,
−
rozróżnić rodzaje wiązań chemicznych oraz określić ich wpływ na właściwości związków
chemicznych,
−
określić właściwości związków chemicznych nieorganicznych i organicznych,
−
określić właściwości związków chemicznych w różnych stanach skupienia,
−
obliczyć efekty masowe i energetyczne reakcji chemicznych,
−
wyjaśnić pochodzenie surowców szklarskich,
−
określić właściwości surowców szklarskich,
−
sklasyfikować surowce ze względu na skład chemiczny,
−
określić przeznaczenie surowców szklarskich,
−
wyjaśnić strukturę wewnętrzną krzemianów,
−
rozróżnić więźbotwórcze składniki szkła.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
4. MATERIAŁ NAUCZANIA
4.1. Budowa chemiczna i fizyczna szkła
4.1.1. Materiał nauczania
Chemiczne właściwości pierwiastków
Podstawowym pojęciem nowożytnej chemii jest wprowadzenie przez Roberta Boyle`a
w 1661 roku określenia pierwiastka chemicznego.
W starożytności wyróżniano cztery żywioły czyli ziemię, powietrze wodę i ogień, ale
znano i stosowano też inne substancje, jak: złoto, srebro, miedź, żelazo, cynę, ołów, rtęć
węgiel czy siarkę. W średniowieczu i na początku czasów nowożytnych do tej grupy dołączyły
inne nowo odkryte, jak: arsen, bizmut, cynk, fosfor i antymon. Następne stulecia przyniosły
odkrycia nowych pierwiastków, tak że pod koniec XIX wieku znanych było ich już około 63.
Zaczęto klasyfikować znane wówczas pierwiastki a podstawą klasyfikacji było kryterium
wzrastającej ich masy atomowej (prawo okresowości). Znany uczony rosyjski Dmitrij I.
Mendelejew opracował do dziś używany układ okresowy pierwiastków. Układ okresowy
pierwiastków podany przez Mendelejewa składał się z rzędów poziomych (okresów) i
pionowych (grup), przy czym grupy tworzyły pierwiastki o zbliżonych właściwościach. Puste
miejsca pozostawione były dla odkrytych później pierwiastków jak: skand, german, itr, technet,
ind, cer i ren. Mimo rozwoju chemii w późniejszych latach, poznania budowy atomów,
odkrycia i otrzymania wielu nowych pierwiastków, tablica Mendelejewa została tylko
poszerzona. Współczesna wersja prawa okresowości mówi, że właściwości pierwiastków
chemicznych uporządkowanych według wzrastających liczb atomowych powtarzają się
okresowo.
Rys.1. Układ okresowy pierwiastków. [ 12 ].
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
Obecnie używany układ okresowy pierwiastków uzupełniono o grupę gazów szlachetnych
oraz zawiera nowo odkryte i sztucznie wytworzone pierwiastki. Układ ten składa się z 18 grup
i 7 okresów. Pionowe kolumny układu okresowego (grupy) zawierają pierwiastki, których
atomy mają podobne właściwości chemiczne. Poziome szeregi układu okresowego (okresy)
zawierają pierwiastki, których właściwości zmieniają się stopniowo. Każdy okres zaczyna się
bardzo aktywnym metalem, wraz ze wzrostem grupy w okresie aktywność pierwiastków
maleje aż dochodzimy do zupełnie nieaktywnego gazu szlachetnego. Osobno w dwu
dodatkowych okresach umieszczone są lantanowce i aktynowce.
Podstawę współczesnego układu okresowego pierwiastków stanowi ich konfiguracja
elektronowa czyli rozmieszczenie elektronów na powłokach elektronowych, wyznaczająca
podział na bloki: s, p d, f
–
Blok s obejmuje pierwiastki 1 i 2 grupy
–
Blok p obejmuje pierwiastki grup od 13 do 18
–
Blok d obejmuje pierwiastki grup od 3 do 12
–
Blok f tworzą lantanowce i aktynowce
Wiązania chemiczne
Tylko nieliczne pierwiastki występują w przyrodzie w stanie atomowym. Większość wiąże
się z innymi atomami tworząc cząsteczki. Takie zachowanie atomów jest zgodne z ich
dążnością do uzyskania konfiguracji elektronów na zewnętrznej powłoce elektronowej
zapewniającej im minimum energetyczne i bierność chemiczną. Pożądaną konfigurację atomy
uzyskują wchodząc w kontakt z innymi atomami. Dochodzi wówczas do wzajemnego
oddziaływania elektronów walencyjnych tych atomów a takie oddziaływanie nosi nazwę
wiązania chemicznego. Reagujące ze sobą atomy dążą do uzupełnienia walencyjnej
(zewnętrznej) powłoki elektronowej lub jej zredukowania do powłoki najbliższego helowca.
Pierwiastki tej grupy mają na powłoce walencyjnej 8 elektronów (oktet elektronowy), lub dwa
elektrony (dublet elektronowy).
Elektroujemność jest miarą zdolności przyciągania elektronów przez atom danego pierwiastka
(w wiązaniu kowalencyjnym). Niska elektroujemność cechuje pierwiastki metaliczne, zaś
wysoka – niemetale. Pierwiastki metaliczne nazywa się pierwiastkami elektrododatnimi, czyli
łatwo oddającymi elektrony. Niemetale nazywa się elektroujemnymi czyli łatwo przyjmującymi
elektrony.
Typy wiązań
chemicznych
wiązanie jonowe wiązanie kowalencyjne
∆E > 1,7
niespolaryzowane
wiązanie kowalencyjne ∆E (0 – 0,4)
spolaryzowane
∆E (0,4 – 1,7)
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
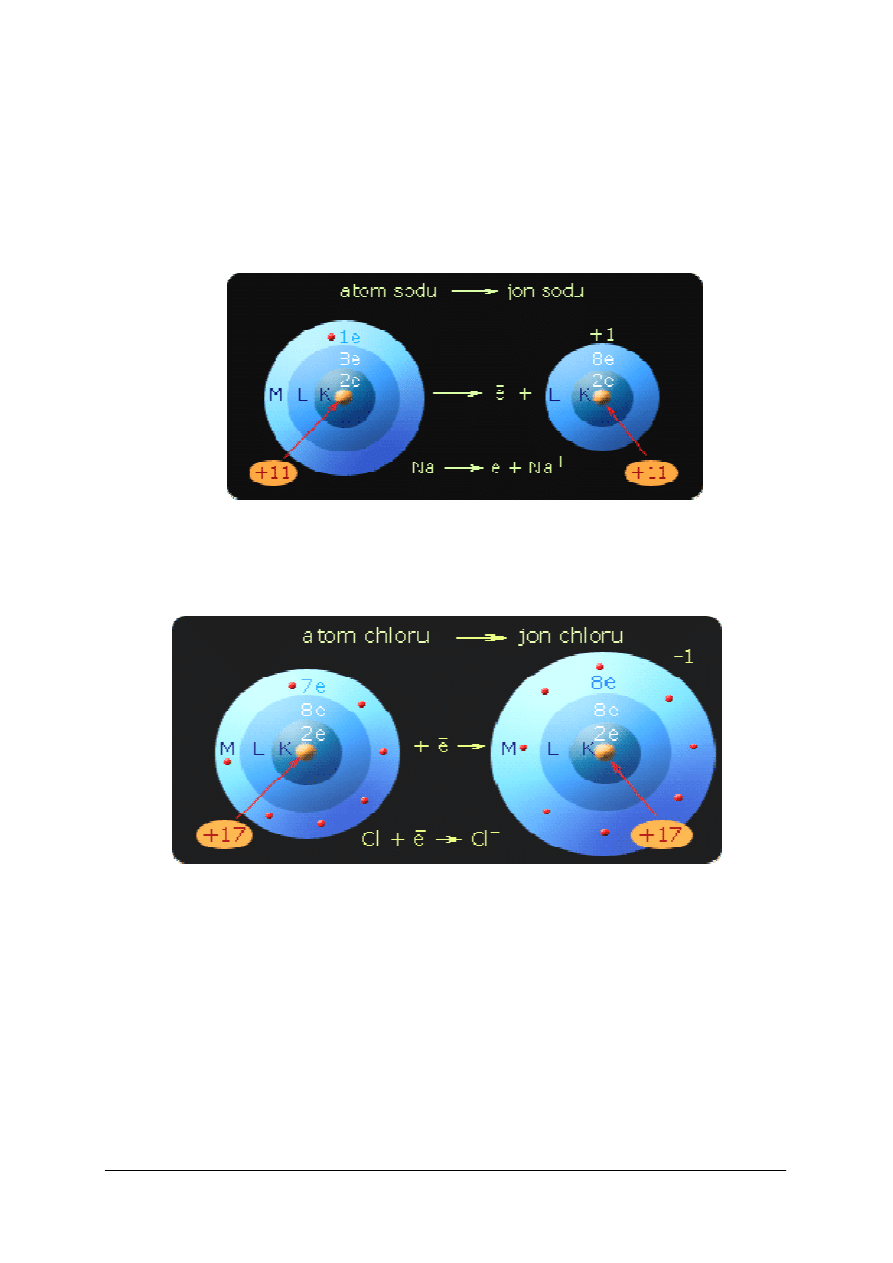
Wiązanie jonowe
Wiązania jonowe będą się tworzyć w związkach gdzie różnica elektroujemności pierwiastków
tworzących związek jest duża ∆E > 1,7. Istotą tego wiązania jest oddziaływanie
elektrostatyczne między jonami powstającymi na skutek przeniesienia elektronów z atomu
mniej elektroujemnego do atomu bardziej elektroujemnego.
Rys.2. Atom sodu (Na) oddaje elektron i staje się kationem (Na
+
).
Na (2, 8, 1) - e
-
---> Na
+
(2, 8) . [12].
Rys.3. Atom chloru (Cl) przyjmuje elektron i staje się
anionem (Cl
-
).
Cl (2, 8, 7) + e
-
---> Cl
-
(2, 8, 8) . [12].

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Rys.4. Siły elektrostatycznego przyciągania pomiędzy jonami Na
+
i Cl
-
. [12].
Wiązanie kowalencyjne niespolaryzowane
Wiązania kowalencyjne niespolaryzowane będą się tworzyć w związkach gdzie różnica
elektroujemności jest bardzo mała ∆E (0 – 0,4). Wiązanie to polega na uwspólnieniu jednej lub
kilku par elektronowych, dzięki czemu każdy z atomów zachowuje się tak jakby miał trwałą
konfigurację gazu szlachetnego
Rys.5. Mechanizm powstawania wiązania kowalencyjnego w cząsteczce wodoru . [12]
Rys.6. Mechanizm powstawania wiązania kowalencyjnego w cząsteczce chloru . [12].

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Wiązanie kowalencyjne spolaryzowane
Wiązania kowalencyjne spolaryzowane będą się tworzyć w związkach gdzie różnica
elektroujemności wynosi ∆E (0,4 – 1,7). Wiązanie to polega na uwspólnieniu jednej lub kilku
par elektronowych, które są przesunięte w kierunku atomu o większej elektroujemności.
Rys.7. Mechanizm powstawania wiązania kowalencyjnego
spolaryzowanego w cząsteczce chlorowodoru. [12].
Wpływ rodzaju wiązań na właściwości związków chemicznych
−
Substancje mające wiązania kowalencyjne – wiązania te łączące atomy w cząsteczki są
silne, rozbicie takich cząsteczek na atomy wymaga dużego nakładu energii, substancje
takie reagują powoli, gdyż te silne wiązania nie ulegają łatwo zerwaniu.
−
Substancje mające wiązania jonowe – w stanie stałym tworzą sieci jonowe, w których nie
ma cząsteczek ani atomów tylko ułożone naprzemiennie jony dodatnie i ujemne. Związki
jonowe są substancjami krystalicznymi, twardymi o wysokich temperaturach topienia,
dobrze rozpuszczają się w wodzie.
Właściwości związków nieorganicznych
Tlenki – są to związki pierwiastków (metali i niemetali) z tlenem, w których tlen występuje na
–II stopniu utlenienia.
Wzór ogólny tlenków
E
x
O
II
Gdzie:
E – symbol pierwiastka
x – wartościowość pierwiastka

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Ze względu na charakter chemiczny tlenki tworzą następujące grupy:
–
Tlenki zasadowe – tlenki metali, które reagują z kwasami dając sole
(MgO, CaO, BaO, Na
2
O, K
2
O)
MgO + 2 HCl → MgCl
2
+ H
2
O
–
Tlenki kwasowe – tlenki niemetali, które reagują z zasadami dając sole
(SO
3
, P
4
O
10
, SiO
2
)
SO
3
+ 2NaOH → 2 Na
2
SO
4
+ H
2
O
–
Tlenki amfoteryczne – tlenki metali, które reagują z kwasami i z zasadami dając sole
(Al(OH)
3
, Zn(OH)
2
)
Al
2
O
3
+ 12 HF → 2[AlF
6
]
3-
+ 3 H
2
O
Al
2
O
3
+ 2 NaOH + 3 H
2
O → 2 Na[Al(OH)
4
]
–
Tlenki obojętne – tlenki niemetali które nie reagują ani z kwasami ani z zasadami, np.
CO i NO.
W układzie okresowym właściwości tlenków zmieniają się następująco:
–
w okresie – od typowo zasadowych w grupie 1 i 2, poprzez amfoteryczne w grupie 13, aż
po typowo kwasowe w grupie 17.
–
w grupie – ze wzrostem okresu w grupie rośnie charakter zasadowy ich tlenków.
Wodorotlenki – są to związki chemiczne zbudowane z metalu i jednej lub kilku grup
wodorotlenowych – OH.
Wzór ogólny wodorotlenku
M
n
(OH)
n
Gdzie:
M – kation metalu
n – wartościowość metalu
Ze względu na charakter chemiczny wodorotlenki dzielą się na:
–
wodorotlenki zasadowe – reagujące z kwasami i niereagujące z zasadami.
NaOH + HCl → NaCl + H
2
O
–
wodorotlenki amfoteryczne – reagujące zarówno z kwasami jak i zasadami
Zn(OH)
2
+ 2 HCl → ZnCl
2
+ 2 H
2
O
Zn(OH)
2
+ 2 NaOH → Na
2
ZnO
2
+ 2 H
2
O

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Kwasy – są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
Wzór ogólny kwasu
H
m
R
m
R – reszta kwasowa
m – wartościowość reszty kwasowej
Kwasy reagują z :
–
wodorotlenkami – reakcje zobojętnienia
HNO
3
+ KOH → KNO
3
+ H
2
O
–
tlenkami zasadowymi
2 HBr + CaO → CaBr
2
+ H
2
O
–
metalami aktywnymi (aktywniejsze od wodoru)
2 H
3
PO
4
+ 3 Mg → Mg
3
(PO
4
)
2
+ 3 H
2
Sole – są związkami chemicznymi zbudowanymi z metalu i reszty kwasowej.
Wzór ogólny soli
M
m
n
R
n
m
Gdzie:
M – kation metalu
R – reszta kwasowa
m – wartościowość reszty kwasowej
n – wartościowość metalu
Rodzaje soli:
a) sole obojętne
–
sole proste – zawierające jeden rodzaj kationów i jeden rodzaj anionów, np.
Na
2
SO
4
zawierające Na
+
i SO
4
2-
–
sole podwójne – zawierające dwa rodzaje kationów i jeden rodzaj anionu np.
MgAl
2
(SO
4
)
4
–
hydraty – sole uwodnione, zawierające wbudowane w sieć krystaliczną
cząsteczki wody, np. CuSO
4
∙ 5 H
2
O
b) wodorosole – zawierające aniony powstające podczas stopniowej dysocjacji kwasów
np. anion wodorowęglanowy HCO
3
-
c) hydroksosole – zawierające aniony OH
-
, aniony reszt kwasowych i kationy metalu
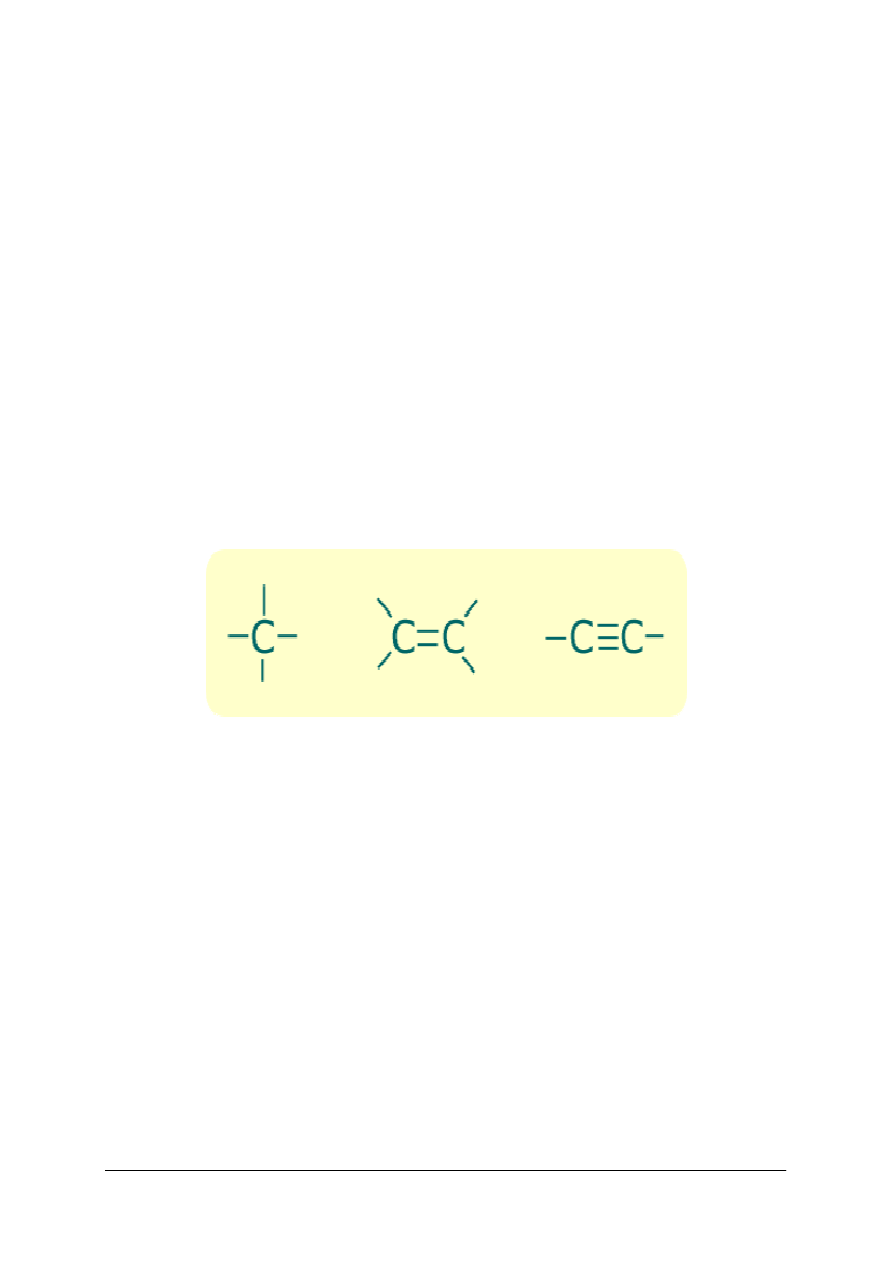
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Właściwości związków organicznych
Chemia organiczna jest chemią związków węgla. Prawie wszystkie związki pochodzące
od organizmów żywych odznaczają się tym, że ich cząsteczki zawierają atomy węgla. Atomy
węgla mogą łączyć się ze sobą tworząc struktury:
–
liniowe,
–
rozgałęzione,
–
cykliczne.
Do atomów węgla tworzących te łańcuchy i pierścienie mogą przyłączać się inne atomy,
głównie: wodoru, tlenu, azotu, siarki, fosforu, fluoru, chloru, bromu, jodu, i wiele innych
pierwiastków.
Węgiel jest pierwiastkiem o dużej aktywności chemicznej i zdolnością do łączenia się między
sobą. Ponadto sąsiadujące atomy węgla mogą łączyć się ze sobą za pomocą wiązań:
–
pojedynczych,
–
podwójnych,
–
potrójnych.
O tych właściwościach węgla decyduje jego budowa elektronowa. Atom węgla ma cztery
elektrony walencyjne, które może wykorzystać do utworzenia czterech wiązań kowalencyjnych
z innymi atomami węgla, wodorem i innymi pierwiastkami.
Rys.8 Wiązania kowalencyjne atomu węgla. [12].
Właściwości związków chemicznych w różnych stanach skupienia
Materia występuje w trzech dających się łatwo rozróżnić stanach skupienia, tj.
–
stałym,
–
ciekłym,
–
gazowym.
Istnieje również czwarty stan skupienia, stan plazmy, który istnieje jedynie w zakresie
niezwykle wysokich temperatur.
Stan stały charakteryzuje się utrzymaniem kształtu, postaci i objętości próbki, niezależnie od
kształtu naczynia.
Stan ciekły odznacza się tym, że próbka zachowuje swoją określoną objętość podczas
przelewania z jednego zbiornika do drugiego, ale przyjmuje kształt dna mieszczącego ją
naczynia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Stan gazowy charakteryzuje się tym, że próbka nie ma ani własnego kształtu, ani objętości
i może rozprzestrzeniać się po całej objętości naczynia, w której jest zawarta.
Rys. 9. Stany skupienia materii.[12].
Różnice te można łatwo wyjaśnić za pomocą teorii kinetycznej materii zgodnie z którą
w temperaturach powyżej zera absolutnego (tj. powyżej -273
o
C) atomy i cząsteczki substancji
znajdują się w nieustannym ruchu.
W ciałach stałych ruch ten nie jest wielki i odnosi się głównie do oscylacji atomów
i cząsteczek względem węzłów sieci krystalicznej.
W miarę ogrzewania rośnie energia kinetyczna ruchów a w temperaturze zwanej
temperaturą topnienia cząsteczki lub pojedyncze atomy tracą zdolność powrotu do swych
pierwotnych położeń i substancja stała przechodzi w ciecz.
Wzajemne oddziaływanie między atomami i cząsteczkami jest jednak ciągle tak duże, że
objętość cieczy w danej temperaturze pozostaje stała. Dalsze ogrzewanie cieczy prowadzi
wreszcie do stanu, w którym cząsteczki uzyskują energię kinetyczną wystarczającą do
pokonania sił wzajemnego przyciągania i ciecz zamienia się w gaz, zdolny do
rozprzestrzeniania się w całej dostępnej przestrzeni.
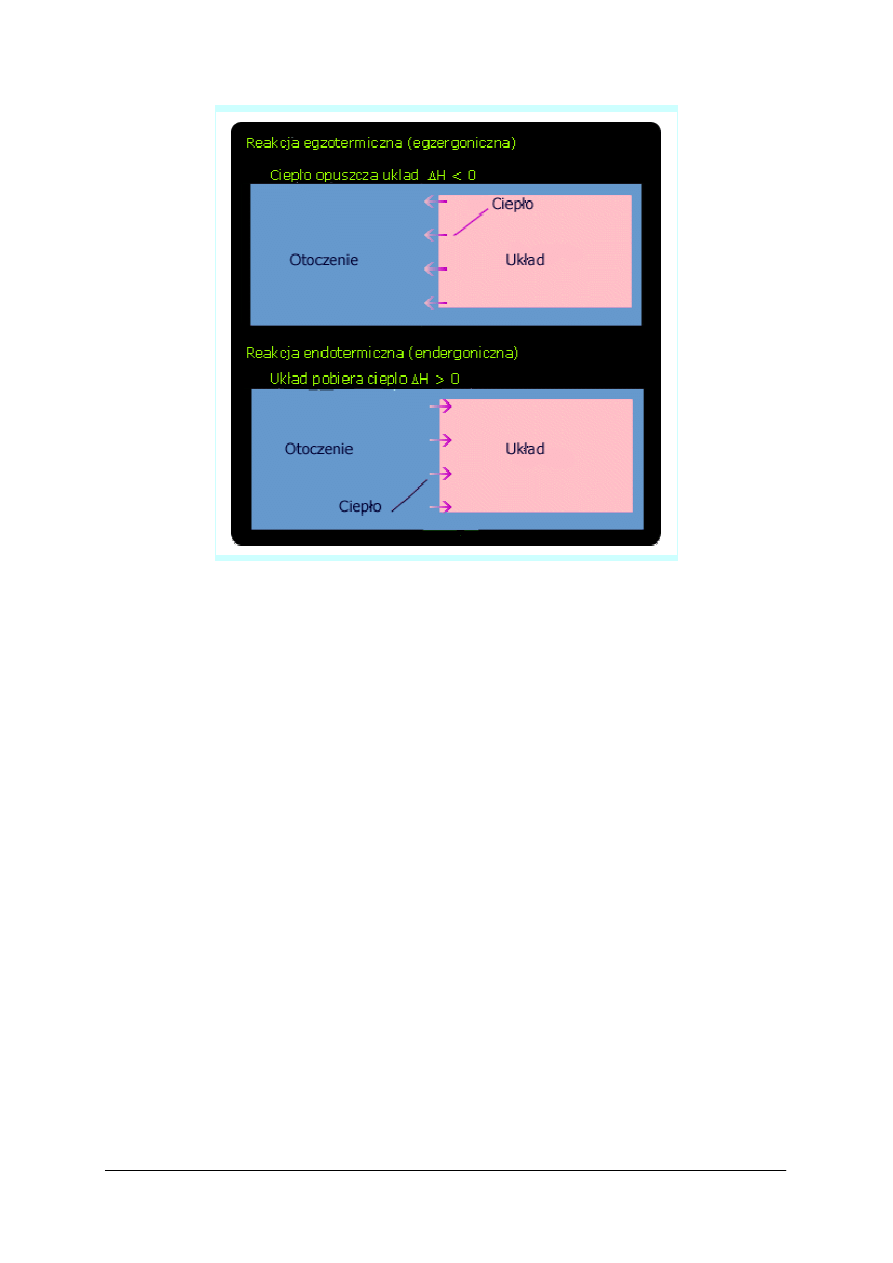
Efekty energetyczne reakcji
Najczęściej podczas reakcji chemicznych zmiany energii występują w postaci ciepła bądź
oddawanego do otoczenia i wtedy mamy do czynienia z przemianą chemiczną egzotermiczną,
bądź pochłanianego z otoczenia, i mamy wtedy do czynienia z przemianą chemiczną
endotermiczną.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Rys. 10.
Reakcje chemiczne zmiany energii . [12].
Jaka jest różnica między tymi obiema przemianami? W przypadku przemiany egzotermicznej
mieszanina reagująca na ogół ogrzewa się, w przypadku zaś przemiany endotermicznej - staje
się zimniejsza.
Ciepło wydzielane lub pobrane, w odniesieniu do określonych ilości (moli) substancji nazywa
się ciepłem reakcji. Wartość ciepła reakcji oznacza się różnymi znakami, w zależności od tego,
czy energia jest przekazywana do otoczenia, czy do układu;
–
znakiem minus (-) oznacza się efekt cieplny, podczas którego układ przekazuje do
otoczenia energię na sposób ciepła,
–
znakiem plus (+) oznacza się efekt cieplny, podczas którego otoczenie przekazuje do
układu energię na sposób ciepła.
Dla interpretacji wyników dogodne jest wprowadzenie tzw. funkcji termodynamicznej –
entalpii (oznaczamy ja literą H), będącej funkcją stanu (zmiana ∆H zależy tylko od stanu
początkowego i końcowego)
przykład:
reakcja egzotermiczna
C + O
2
→ CO
2
+ 394 kJ Q
p
= 394 kJ/mol ∆H = -394 kJ/mol
reakcja endotermiczna
N
2
+ O
2
→ 2 NO – 180,8 kJ Q
p
= -180 kJ/mol ∆H = 180,8 kJ/mol
Zmiana entalpii ∆H ma znak odwrotny. Dla reakcji egzotermicznych ujemny,
a endotermicznych dodatni.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Użytecznym pojęciem jest standardowa entalpia tworzenia, którą definiuje się jako entalpię
towarzyszącą syntezie 1 mola związku chemicznego w warunkach standardowych.
Tabela 1. Molowe entalpie standardowe tworzenia niektórych związków chemicznych
Zwi
ązek
∆
H
o
298
kJ/mol
Zwi
ązek
∆
H
o
298
kJ/mol
H
2
O
(c)
H
2
O
(g)
HCl
(g)
HNO
3(c)
H
2
SO
4(c)
CO
(g)
CO
2(g)
NH
3(g)
NO
(g)
NO
2(g)
-285,85
-241,79
-92,30
-173,22
-811,32
-110,54
-393,42
-46,19
+90,37
+33,85
SO
2(g)
SO
3(g)
NaCl
(s)
KCL
(s)
NaOH
(s)
CH
4(g)
CH
3
OH
(c)
C
2
H
5
OH
(c)
CH
3
COOH
(c)
C
6
H
6(c)
-296,86
-385,18
-410,99
-435,90
-426,77
-74,85
-238,57
-277,65
-487,01
-49,03
Przykład:
Wypisz entalpie standardowe reagentów w poniższej reakcji:
CH
4(g)
+ 2 O
2(g)
= CO
2(g)
+ 2 H
2
O
(c)
.
Odczytujemy entalpie tworzenia następujących substancji z tablic:
∆H (CO
2
) = -393,1 kJ/mol,
∆H (H
2
O) = -285,9 kJ/mol,
∆H (CH
4
) = -74,8 kJ/mol,
∆H (O
2
) = 0 kJ/mol (entalpia tworzenia każdej substancji pierwiastkowej jest równa zero).
Prawo Hessa oraz prawo Laplace'a umożliwiają obliczanie efektów cieplnych różnego rodzaju
procesów. Ilustracją tego prawa niech będzie przykład, w którym wychodząc z gazowego
HCl, gazowego NH
3
oraz wody, otrzymamy dwiema różnymi drogami roztwór wodny chlorku
amonowego.
Struktura wewnętrzna krzemianów
W przyrodzie występuje około 800 znanych minerałów krzemianowych co czyni z nich
najliczniejszą grupę minerałów. Ilościowy udział krzemianów i glinokrzemianów w budowie
skał wynosi około 75% wagowych. Krzemiany, oprócz dominującego znaczenia
skałotwórczego, mogą być także źródłem wielu cennych metali (np. krzemiany Ni, Zn, Zr, Li),
tworzą również złoża wielu ważnych surowców mineralnych (kaolin, azbest, skalenie). Wśród
krzemianów znaleźć można także piękne kamienie szlachetne i ozdobne (np. szmaragd,
turmalin, topaz, nefryt).
Współczesna systematyka krzemianów i glinokrzemianów opiera się na ich
właściwościach krystalochemicznych, tj. na budowie sieci krystalicznej. Podstawowymi
elementami strukturalnymi tej sieci są ściśle obok siebie ułożone 4 aniony tlenu oraz zawarty
między nimi kation krzemu. Modelem przestrzennym tak ułożonego anionu [SiO
4
]
4 –
jest
tetraedr, czyli czworościan foremny:
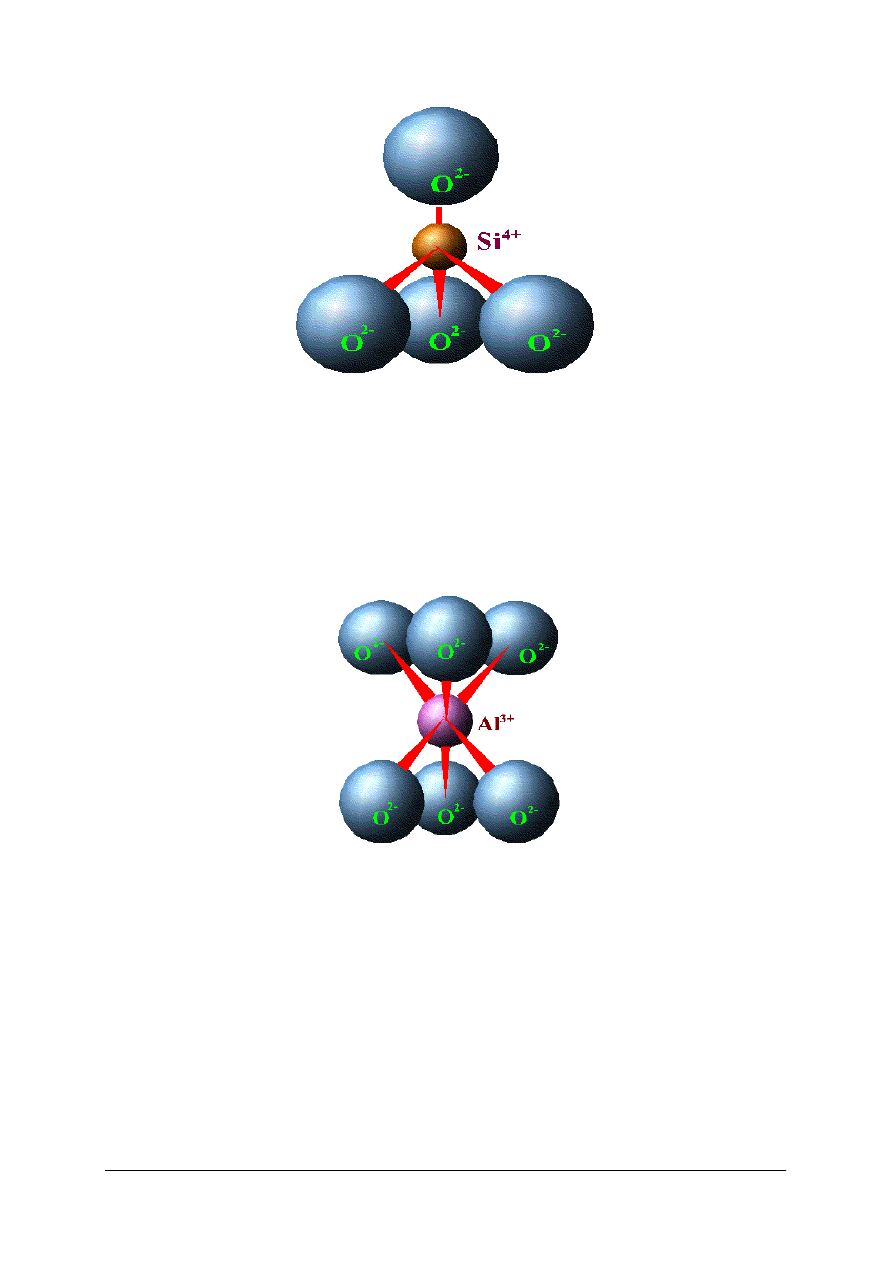
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Komórka [SiO
4
]
4-
Rys. 11. Element strukturalny krzemianów [ 12]
Wewnątrz tetraedru w miejscu krzemu może występować także glin. Różnice ładunków
wywołane podstawieniem Si
4 +
przez Al
3 +
kompensowane są przez podstawianie dodatkowych
kationów. Krzemiany, w których część anionów [SiO
4
]
4 -
zastąpiona jest anionami [AlO
4
]
5 -
,
określane są jako glinokrzemiany.
Oprócz tetraedrów w sieci krystalicznej krzemianów występują też połączenia tlenowo-
hydroksylowo-glinowe, tworzące oktaedry (ośmiościany foremne). Zbudowane są one
z sześciu jonów tlenowych lub hydroksylowych i znajdującego się w ich wnętrzu kationu glinu:
Komórka [AlO
6
]
9-
Rys. 12.
Element strukturalny krzemianów
. [12].
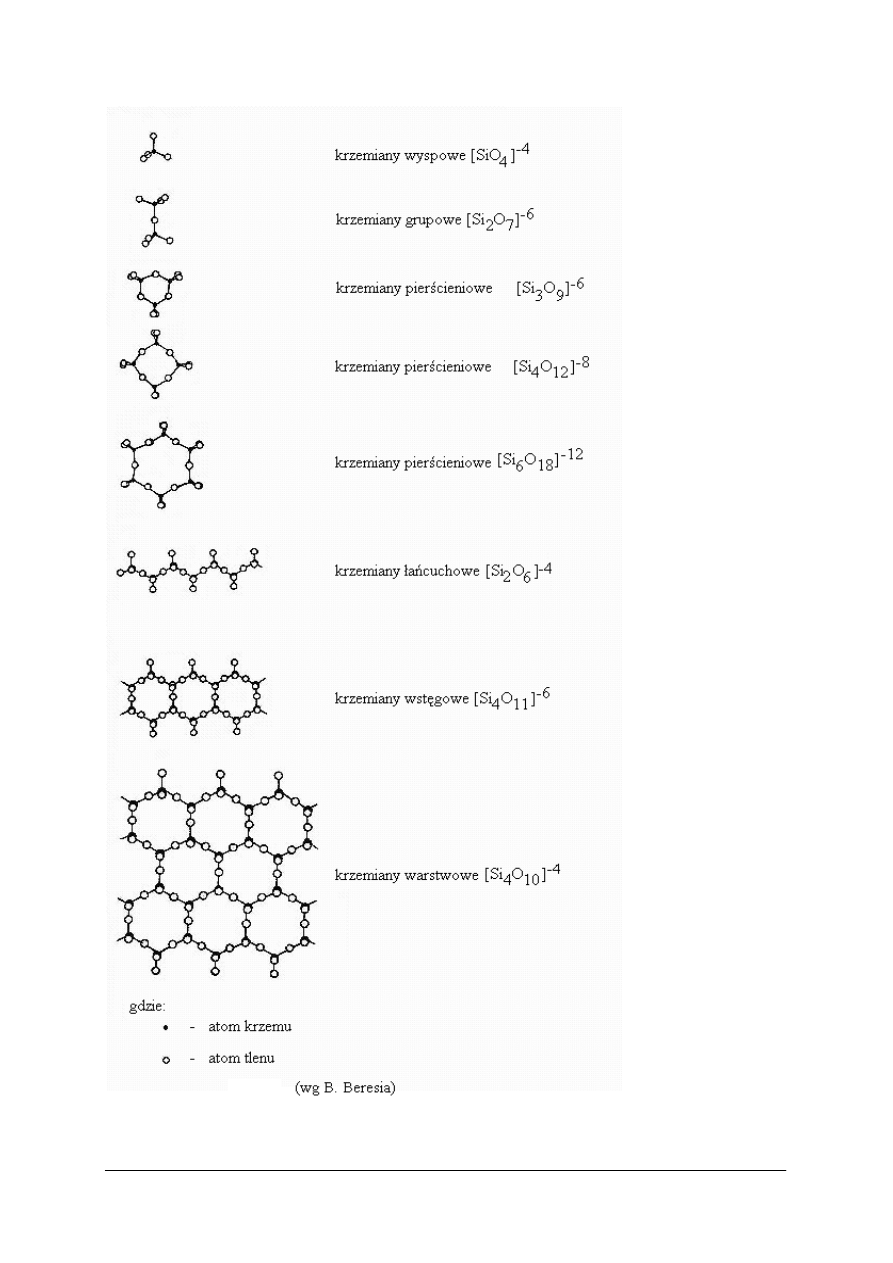
W zależności od sposobu łączenia tetraedrów i stopnia ich kondensacji krzemiany dzieli
się na:
–
krzemiany wyspowe,
–
krzemiany grupowe,
–
krzemiany pierścieniowe,
–
krzemiany łańcuchowe,
–
krzemiany wstęgowe,
–
krzemiany warstwowe,
–
krzemiany szkieletowe.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Rys. 13.
Elementy struktury krzemianów
. [12].
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Tabela 2.
Charakterystyka głównych grup krzemianów
[12].
Krzemiany
Charakterystyka
Podział
Przykłady związków
Ortokrzemiany proste
jednokationowe
Na
4
[SiO
4
]
K
4
[SiO
4
]
Mg
2
[SiO
4
]
ZrSiO
4
wyspowe
Stanowią
najprostsze
związki
krzemianów
w
grupie
minerałów
krzemianowych. Zawierają
one nie połączone ze sobą
tetraedry [SiO
4
]
4-
Ortokrzemiany wielokationowe
MgMn[SiO
4
]
MgCa[SiO
4
]
Mg
3
Al
2
[SiO
4
]
3
Krzemiany
o
łańcuchu
pojedynczym
Mg
2
[Si
2
O
6
]
Fe
2
[Si
2
O
6
]
MgCa[Si
2
O
6
]
Krzemiany
o
łańcuchu
pojedynczym rozgałęzionym
Pb
12
[SiO
3
]
12
łańcuchowe
Zbudowane są z tetraedrów
połączonych
w
długie
łańcuchy. Każdy tetraedr
posiada dwa naroża wspólne
z sąsiednimi tetraedrami.
Krzemiany o łańcuchu podwójnym
MgCa[Si
2
O
6
]
Dwuwarstwowe (pakiet 1:1)
Al
4
[Si
4
O
10
] (OH)
8
Mg
6
[Si
4
O
10
] (OH)
8
warstwowe
Stanowią strukturę w której
każdy tetraedr ma trzy
wspólne naroża z sąsiednimi
tetraedrami. Mają budowę
pakietową.
Trójwarstwowe (pakiet 2:1)
Al
2
[Si
4
O
10
] (OH)
2
Mg
3
[Si
4
O
10
] (OH)
2
Minerały z grupy krzemionki
SiO
2
SiO
2
∙ nH
2
O
Skalenie
K[AlSi
3
O
8
]
Na[AlSi
3
O
8
]
Ca[Al
2
Si
2
O
8
]
szkieletowe
Stanowią
produkt
najsilniejszej
kondensacji
tetraedrów, które łączą się
równomiernie
we
wszystkich
kierunkach,
poprzez
narożne
atomy
tlenu
Skaleniowe
K[AlSi
2
O
6
]
Na[AlSiO
4
]
Budowa chemiczna szkła
Materiały, z których po stopieniu można otrzymać szkło – to materiały szkłotwórcze.
Należą do nich: SiO
2
, i tlenki: B
2
O
3
, P
2
O
5
, TiO
2
,
Rozróżniamy więc szkła: - krzemianowe, - boranowe, - fosforanowe, lub mieszane boranowo
– krzemianowe.
Dodawanie do materiałów szkłotwórczych innych materiałów – tlenków, nie tworzących
szkła, ma na celu ułatwienie topienia mieszaniny albo zmianę właściwości; lub możliwość
przechłodzenia stopu bez krystalizacji. Tego rodzaju tlenki nazywamy modyfikatorami. Są to
przeważnie tlenki metali jednowartościowych R
2
O (topniki alkaliczne), najczęściej: Na
2
O,
K
2
O, Li
2
O lub tlenki metali dwuwartościowych RO, najczęściej : CaO, MgO, ZnO, BaO, PbO
(stabilizujące).
Dodawane są tez takie tlenki, jak: Al
2
O
3
, ZrO
2
, BeO, TiO
2
- Odgrywające rolę
pośrednią, częściowo szkłotwórczą , częściowo modyfikującą.
Szkło można otrzymać z samej krzemionki, wystarczy stopić je w temperaturze 1730
o
C
i stop odpowiednio przechłodzić aby otrzymać szkło – szkło krzemionkowe- kwarcowe.
Krzemionka z dodatkiem jednego a tlenków metali jednowartościowych (sód, potas, lit)
nazywanych zasadowymi – alkalicznymi, np. z Na
2
O topi się w temperaturze niższej niż
krzemionka bez domieszek. Krzemionka reaguje z Na
2
O tworząc krzemiany sodowe. Roztwór
– stopiona masa – jest bardzo płynna (ma małą lepkość). Roztwór wodny krzemianu
sodowego lub potasowego nazywamy szkłem wodnym.
Dodanie do krzemionki jednego z tlenków metali dwuwartościowych np. CaO, powoduje
obniżenie temperatury topienia – tworzą się krzemiany wapniowe, topiące się łatwo
i rozpuszczające nadmiar krzemionki. Masa taka nie daje się normalnie przechłodzić ponieważ
łatwo krystalizuje.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Dopiero łączne zestawienie tlenków: sodowego, wapniowego w odpowiednich ilościach
jako dodatku do krzemionki ułatwia otrzymanie szkła trójskładnikowego - szkło zwykłe.
Szkło jest roztworem krzemianów: sodowego i wapniowego oraz wolnej krzemionki
pozostałej w nadmiarze, dla której do reakcji nie wystarczyło Na
2
O i CaO
Na
2
SiO
3
• CaSiO
3
• SiO
2
Do zwykłego trójskładnikowego szkła dodaje się innych tlenków dla uzyskania lepszych
właściwości szkła (szkła wieloskładnikowe, uszlachetnione).
Ciała stałe (znajdujące się w stanie stałym, czyli odznaczające się sztywnością), można
podzielić na krystaliczne i bezpostaciowe.
Ciała krystaliczne wykazują całkowite uporządkowanie elementów struktury: atomów,
cząsteczek i jonów. Ciała bezpostaciowe wykazują brak uporządkowania elementarnego
struktury.
Ciała krystaliczne i ciała bezpostaciowe różnią się właściwościami, nawet jeśli są to ciała
jednakowe pod względem chemicznym. Inne jest ich zachowanie się podczas przechodzenia
pod wpływem ogrzewania ze stanu stałego w ciekły, a inne podczas przechodzenia ze stanu
ciekłego w stały.
Podstawowymi, właściwościami fizycznymi zwykłego szkła, związanymi z jego budowa
wewnetrzną, są:
−
bezpostaciowość – niekrystaliczność,
−
nietrwałość układu, czyli nadmierna energia wewnętrzna sprzyjająca krystalizacji,
−
izotropowość, czyli niezależność właściwości od kierunku ich badania w szkle,
−
zwiększenie się w sposób ciągły lepkości wraz ze spadkiem temperatury – lub
zmniejszenie się lepkości wraz ze wzrostem temperatury,
−
duża lepkość w normalnej temperaturze, powodujaca że szkło ma właściwości
mechaniczne podobne do właściwości ciał stałych,
−
przeźroczystość i przejrzystość.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie są typy wiązań chemicznych?
2. Co to są wiązania jonowe, w związkach chemicznych?
3. Co to są wiązania kowalencyjne, w związkach chemicznych?
4. Jaki jest wpływ wiązań na właściwości związków chemicznych?
5. Jakie grupy tworzą tlenki pod względem charakteru chemicznego?
6. Jakie grupy tworzą wodorotlenki pod względem charakteru chemicznego?
7. Co to są sole w ujęciu chemicznym związków nieorganicznych?
8. Jakie struktury mogą tworzyć atomy węgla łącząc się z sobą?
9. W jakich stanach skupienia występuje materia?
10. Jaką reakcję nazywamy egzotermiczną?
11. Jaką reakcję nazywamy endotermiczną?
12. Jakie są podstawowe elementy strukturalne sieci krystalicznej?
13. W jaki sposób dzieli się krzemiany?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
4.1.3. Ćwiczenia
Ćwiczenie 1
Przyporządkuj podane poniżej tlenki do określonych grup.
Tabela do ćwiczenia 1.
1. Li
2
O
A.
Tlenki kwasowe
2. ZnO
3. BaO
B.
Tlenki zasadowe
4. SiO
2
5. K
2
O
C.
Tlenki amfoteryczne
6. SO
2
7. MgO
D.
Tlenki obojętne
8. Al
2
O
3
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące właściwości związków
nieorganicznych,
2) dokonać analizy treści,
3) przyporządkować tlenki do określonych grup.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
karty z załączoną tabelą,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Narysuj element struktury krzemianów wyspowych, łańcuchowych, warstwowych
i szkieletowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące budowy wewnętrznej
krzemianów,
2) dokonać analizy treści,
3) narysować elementy struktury poszczególnych krzemianów.
Wyposażenie stanowiska pracy:
−
papier formatu A4, pisaki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Ćwiczenie 3
Podane poniżej krzemiany przyporządkuj do określonych grup.
Tabela do ćwiczenia 3.
1. Rb
4
[SiO
4
]
2. Mg
2
[Si
2
O
6
]
A.
krzemiany wyspowe
3. Na [Al
2
Si
2
O
8
]
4. Fe Ca [Si
2
O
6
]
B.
krzemiany łańcuchowe
5. Mg
6
[Si
4
O
10
] (OH)
8
6. Ba
2
[SiO
4
],
C.
krzemiany warstwowe
7. SiO
2
8. ZrSiO
4
D.
krzemiany szkieletowe
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące budowy wewnętrznej
krzemianów,
2) dokonać analizy treści,
3) przyporządkować krzemiany do określonych grup.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
karty z załączoną tabelą,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.1.2. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić typy wiązań chemicznych?
2) wyjaśnić na czym polega wiązanie jonowe?
3) wyjaśnić na czym polega wiązanie kowalencyjne?
4) określić wpływ wiązań na właściwości związków chemicznych?
5) określić grupy jakie tworzą tlenki pod względem charakteru
chemicznego?
6) określić budowę soli jako związków chemicznych nieorganicznych?
7) określić struktury jakie mogą tworzyć atomy węgla?
8) określić występowanie materii w różnych stanach skupienia?
9) wyjaśnić pojęcie reakcji endotermicznej?
10) wyjaśnić pojęcie reakcji egzotermicznej?
11) wyjaśnić pojęcie reakcji endotermicznej?
12) określić elementy strukturalne sieci krystalicznej?
13) dokonać podziału krzemianów?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
4.2. Surowce szklarskie podstawowe
4.2.1. Materiał nauczania
Podział surowców szklarskich jest dokonywany z różnych punktów widzenia. Dawniej
dzielono surowce szklarskie na pospolite i rzadkie. Do pospolitych zaliczano: piasek, sodę,
potaż, wapień, sulfat i minię. Pozostałe surowce zaliczano do rzadkich. Podział ten jest obecnie
nieuzasadniony, gdyż wiele surowców rzadkich stało się pospolitymi.
Według funkcji pełnionych w szkle, surowce szklarskie dzielą się na:
1. Surowce podstawowe.
a)
Surowce wprowadzające tlenki szkłotwórcze. Surowce tej grupy zawierają tlenki,
które tworzą zasadniczą więźbę szkła lub do niej mogą wstąpić. Do tlenków
o charakterze wybitnie szkłotwórczym należą: SiO
2
, B
2
O
3
i P
2
O
5
. Do tlenków
o charakterze amfoterycznym, które mogą tworzyć więźbę, zaliczamy: Al
2
O
3
, TiO
2
i ZrO
2
.
b)
Surowce wprowadzające tlenki modyfikujące. Tlenki o własnościach zasadowych
tworzą grupę modyfikatorów więźby szkła. Modyfikatory rozrywają lub rozluźniają
sieć przestrzenną szkła. Modyfikatorami najsilniej zrywającymi sieć są jony alkaliów.
Jony metali dwuwartościowych nie zrywają sieci, lecz zmniejszają ilość tlenków
szkłotwórczych powodując rozluźnienie sieci przestrzennej szkła. Surowce należące
do tej grupy wprowadzają do szkła następujące tlenki: Na
2
O, K
2
O, Li
2
O, CaO, MgO,
BaO, BeO, PbO i ZnO.
2. Surowce pomocnicze. Surowce klarujące i przyśpieszające topienie szkła. Surowce
stosowane do klarowania i przyśpieszania topienia szkła biorą udział w procesach
technologicznych o specjalnym charakterze, z których każdy wymaga określonych
surowców. Wiele z tych surowców ma charakter więcej niż jednofunkcyjny.
3. Surowce dodatkowe.
a) Surowce do barwienia szkła. Do tej grupy należą surowce o ściśle określonej funkcji
barwienia szkła.
b) Surowce do zmącania szkła.
c) Surowce do odbarwiania masy szklanej.
4. Surowce wtórne.
Ze względu na pochodzenie, wyróżnić można dwie grupy surowców:
−
mineralne – naturalne, występujące w przyrodzie,
−
sztuczne – syntetyczne, produkowane przez przemysł chemiczny celowo lub powstające
jako produkt odpadowy.
Surowce podstawowe, do zestawu szklarskiego, dobiera się tak, aby wprowadziły w skład
szkła określone tlenki. W tabeli 1 przedstawiono surowce podstawowe, w których wprowadza
się do masy szklanej 12 tlenków najczęściej spotykanych w szkłach przemysłowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Tabela 3. Wykaz tlenków wchodzących najczęściej w skład szkieł przemysłowych oraz surowców
podstawowych stosowanych dla wprowadzenia tych tlenków w skład szkła. [ 6,s. 50].
Surowce
Tlenki
Mineralne (naturalne)
Sztuczne
I. Szkłotwórcze
Kwaśne
SiO
2
B
2
O
3
P
2
O
5
Amfoteryczne
Al
2
O
3
ZrO
2
TiO
2
II. Modyfikujące
Grupa R
2
O
Na
2
O
K
2
O
Li
2
O
Grupa R
2
O
CaO
MgO
ZnO
BaO
PbO
Piasek kwarcowy (szklarski)
Spodumen
-
-
skalenie, kaolin, skały
magmowe
cyrkon (krzemian cyrkonowy)
rutyl (dwutlenek tytanu)
-
-
-
wapienie: kalcyt, marmur,
kamień wapienny, kreda
dolomit
-
-
-
-
boraks, kwas borowy
kwas ortofosforowy, fosforany
wodorotlenek glinowy, tlenek
glinowy, glinian sodowy
dwutlenek cyrkonu
biel tytanowa (dwutlenek tytanu)
soda, sulfat
potaż, kwaśny węglan potasowy
techniczny węglan litu
–
magnezyt
biel cynkowa, tlenek cynkowy
techniczny
węglan barowy techniczny
minia, glejta
Surowce wprowadzające tlenki szkłotwórcze
Związki krzemu
Dwutlenek krzemu należy uważać za podstawowy składnik szkła. Szkła przemysłowe
zawierają najczęściej 55 – 80% SiO
2
. Wraz ze wzrostem zawartości SiO
2
w szkłach:
−
zwiększa się temperatura mięknięcia szkła,
−
rośnie jego lepkość,
−
maleje długość technologiczna.
SiO
2
poprawia szereg właściwości technicznych szkieł:
−
maleje współczynnik rozszerzalności liniowej szkła,
−
wzrasta jego twardość i uzyskuje lepsze właściwości mechaniczne,
−
zmniejsza się gęstość i współczynnik załamania światła,
−
rośnie odporność chemiczna zwłaszcza na działanie wody i kwasów,
−
poprawiają się właściwości dielektryczne.
Szkła ze wzrastającą zawartością krzemionki topią się trudniej i mają większą skłonność do
krystalizacji.
Do zestawów szklarskich SiO
2
wprowadza się głównie w postaci kwarcu za pomocą
piasków kwarcowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Piaski szklarskie
Piaski kwarcowe powstały wskutek wietrzenia kwaśnych skał magmowych a następnie
osadzone w złożach wskutek działania wiatru i wody. Piasek szklarski wydobyty wprost ze
złoża przeważnie nie nadaje się do topienia szkła. Piaski surowe zawierają liczne
zanieczyszczenia i domieszki, dla których oddzielenia stosuje się różne metody
uszlachetniające. Metody te muszą zapewnić nie tylko równomierne uziarnienie, ale także
minimalną zawartość szkodliwych domieszek, zwłaszcza związków żelaza.
Do metod uszlachetniania piasku szklarskiego należą:
−
płukanie piasku, polega na wypłukiwaniu zanieczyszczeń z piasku za pomocą urządzeń
mechanicznych - płuczek do piasku,
−
separacja mechaniczna, polega na separacji cząstek według ich ciężarów za pomocą
stołów koncentracyjnych,
−
separacja magnetyczna, oddzielenie związków żelaza od ziaren piasku za pomocą
elektromagnesów,
−
separacja elektrostatyczna, polega na różnym odchyleniu drogi spadku poszczególnych
minerałów w silnym polu elektrostatycznym,
−
flotacja, polega na intensywnym mieszaniu piasku za pomocą sprężonego powietrza
w wodzie z dodatkiem środków tworzących pianę,
−
procesy chemiczne, polegają na rozpuszczeniu związków żelaza zawartych w piasku lub
przeprowadzeniu ich w związki lotne.
Ze względu na występowanie obcych domieszek, piaski można podzielić na 4 grupy:
a) piasek kwarcowy płukany zawierający co najmniej 98% SiO
2
,
b) piasek kwarcowo-ilasty płukany zawierający co najmniej 2% Al
2
O
3
,
c) piasek kwarcowo-wapienny zmieszany z węglanem wapniowym w postaci skorup
skamielin,
Dla produkcji szkła największe znaczenie ma piasek kwarcowy, zwany piaskiem
szklarskim. Jest on głównym surowcem szklarskim, dlatego jego chemiczny skład ma
zasadniczy wpływ na jakość szkła.
O przydatności piasku do zestawu szklarskiego decydują następujące cechy:
a) niska zawartość części ilastych,
b) odpowiednie uziarnienie,
c) niska zawartość mechanicznych zanieczyszczeń organicznych,
d) niska zawartość związków żelaza,
e) niska zawartość innych tlenków barwiących lub wpływających na skład masy szklanej.
Piaski szklarskie zawierają różne ilości substancji ilastych (ok.10%). Składają się one
głównie z uwodnionych glinokrzemianów o wielkości ziaren poniżej 0,01 mm. Zazwyczaj
w tych drobnych iłach znajduje się przeważająca ilość zanieczyszczeń piasku związkami żelaza.
Również tlenek glinowy zawarty w iłach jest szkodliwy, gdyż obniża zawartość dwutlenku
krzemu.
Duży wpływ nie tylko na jakość szkła, ale i na szybkość topienia masy szklanej ma
uziarnienie piasków szklarskich. Od ziarnistości piasku zależy także dobre mieszanie
surowców. Stosowanie piasku zbyt drobnego nie jest korzystne, gdyż dwutlenek krzemu
reaguje bardzo szybko z węglanami i azotanami, powodując gwałtowne wydzielanie części
lotnych z zestawu. Pienienie zestawu utrudnia wówczas prowadzenie procesu topienia.
Wydobyty piasek ze złóż rozdzielany jest na odpowiednie pod względem uziarnienia gatunki
nazywane frakcjami.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Tabela 4. Podział piasków szklarskich według uziarnienia. [ 7, s.137].
Frakcja
Oznaczenie
Wielkość
ziaren określona
wymiarami oczek sit [mm]
Wielkoziarnista
Gruboziarnista
Średnioziarnista
Drobnoziarnista
Miałka
Pylasta
W
G
Ś
D
M
P
1,25 - 0,71
0,71 - 0,50
0,50 - 0,315
0,315 - 0,10
0,10 - 0,05
poniżej 0,05
Do zestawu nadaje się najlepiej piasek zawierający przeważającą ilość frakcji
średnioziarnistej (S) i drobnoziarnistej (D).
Ważne znaczenie w topieniu zestawu ma kształt ziaren kwarcowych. Ziarna ostrokrawędziowe
mają większą w stosunku do objętości powierzchnię styku z topnikami, z którymi szybciej
reagują niż ziarno kuliste.
Substancje organiczne mogą zanieczyścić piasek w czasie transportu i składowania.
Bardzo niebezpieczna jest obecność węgla w piaskach przy topieniu szkła ołowiowego, gdyż
może on spowodować redukcję tlenku ołowiawego do metalicznego ołowiu. Wyższa
zawartość węgla w piasku przyczynia się do powstania brunatnego odcienia, zwłaszcza przy
odbarwianiu szkieł sodowo-potasowo-wapniowych. W takim przypadku substancje organiczne
należy usunąć przez wyprażenie piasku. Zawartość węgla do 0,2% w piasku szklarskim nie jest
szkodliwa
.
Główną substancję barwiącą, która przechodzi z piasku szklarskiego do szkła, stanowią
związki żelaza. Barwią one masę szklaną na kolor niebieski, zielony, żółty względnie brązowy,
w zależności od ilości i stopnia utlenienia. Zawartość związków żelaza w piasku szklarskim
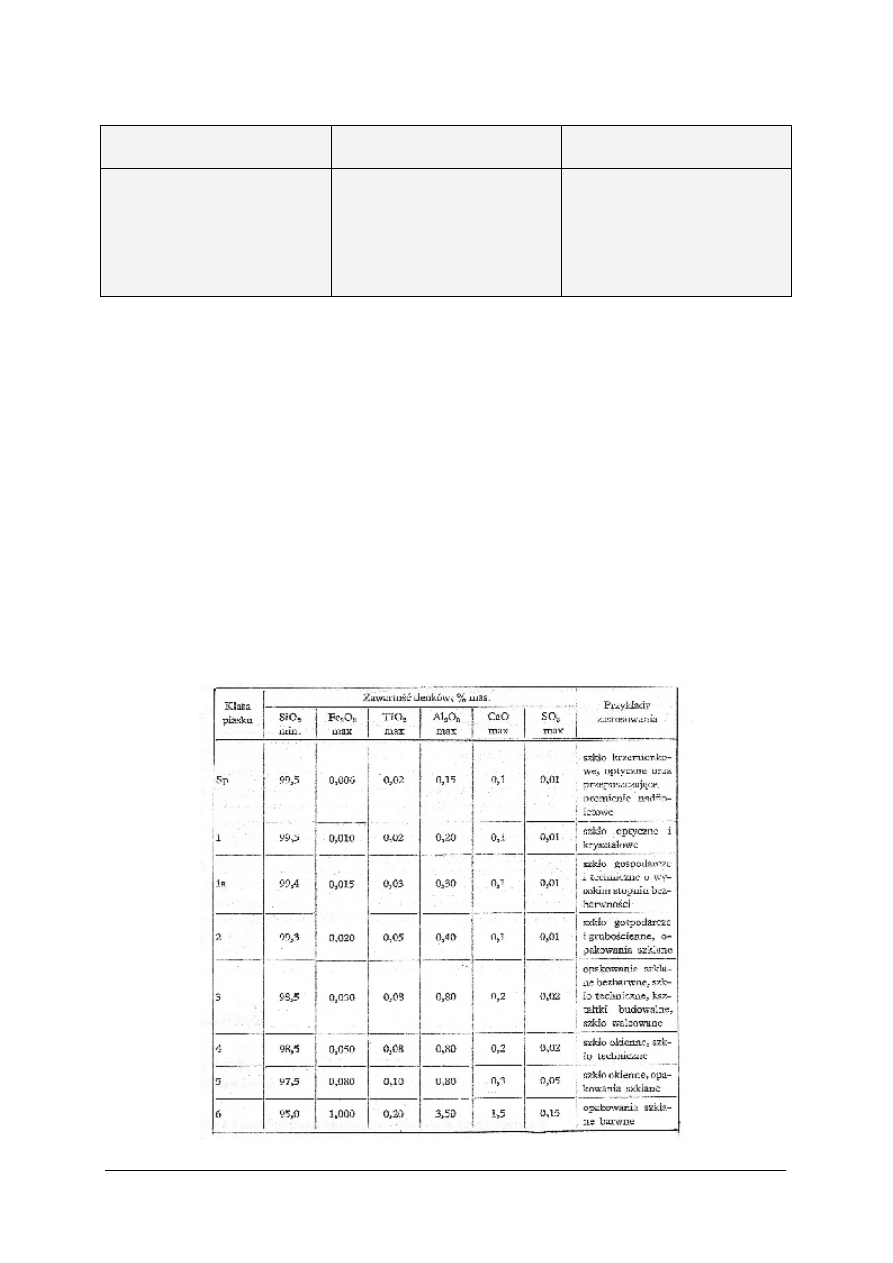
decyduje o jego przeznaczeniu. Ustalono kilka gatunków piasku szklarskiego nadających się
do wytwarzania odpowiednich rodzajów szkła. Gatunki piasku są normowane.
Tabela 5. Klasyfikacja piasków szklarskich wg BN-80/6811-01. [12,s.150].

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Obecność dwutlenku tytanu dopiero w większej ilości spowoduje zabarwienie szkła.
Przeważnie zawartość TiO
2
w piaskach szklarskich nie przekracza 0,05% i nie ma ona wpływu
na zabarwienie szkła.
Tlenek chromowy Cr
2
O
3
wykazuje zdolności intensywnego barwienia i już 0,003% Cr
2
O
3
w piasku wystarcza, aby powstał odcień żółtozielony trudny do odbarwienia.
Inne tlenki barwiące (Mn
2
O
3
, NiO, CoO) znajdują się w piaskach szklarskich w tak małych
ilościach, że praktycznie nie zabarwiają szkła.
Do niebarwiących zanieczyszczeń piasku należy zaliczyć tlenki: glinowy, wapniowy
i magnezowy oraz tlenki alkaliczne. W piasku dopuszcza się do 1 % AL
2
O
3
, z wyjątkiem
piasków do szkieł optycznych i szkieł kryształowych wysokiej jakości.
Bardzo czysty kwarc stosuje się w przemyśle szklarskim do produkcji szkła kwarcowego.
Najczystsza, zupełnie bezbarwna, krystaliczna odmiana kwarcu nosi nazwę kryształu
górskiego. Dla produkcji przezroczystego szkła kwarcowego mączka kwarcowa powinna
odpowiadać następującym warunkom:
mączka kwarcowa, gatunek I – min 99,98% SiO
2
mączka kwarcowa, gatunek II – min 99,96% SiO
2
Charakterystyka fizyko – chemiczna piasku kwarcowego:
−
główny składnik SiO
2
, zawartość 99,0% - 99,7%,
−
postać: ziarnista,
−
kolor: biały do szarego, w zależności od zawartości zanieczyszczeń,
−
bez zapachu,
−
nierozpuszczalny w wodzie.
Polska dysponuje licznymi złożami piasków. Najbardziej znane złoża piasków dobrej
jakości są eksploatowane w kopalniach:
−
Osiecznica – k. Bolesławca, główny producent to Kopalnia i Zakład Przeróbczy piasków
szklarskich w Osiecznicy,
−
rejon Tomaszów-Opoczno – kopalnia Biała Góra,
−
rejon Żary – kopalnia Lutynka,
−
rejon Baranów – kopalnia Świniary,
−
rejon Bolesławiec – kopalnia Kleszczowa.
Dostarczony do hut piasek standardowej jakości może być jeszcze suszony i przesiewany
kontrolnie. Przechowywanie piasku nie sprawia trudności, należy go chronić przed deszczem,
mrozem oraz zanieczyszczeniami. Nie są konieczne też specjalne warunki magazynowania.
Podczas pracy z piaskiem szklarskim należy unikać powstawania pyłu ponieważ dłuższe
wdychanie pyłu może powodować chorobę nazywaną pylicą płuc.
Spodumen
W przemyśle szklarskim znajduje zastosowanie surowiec o nazwie spodumen.
Charakterystyka fizyko – chemiczna:
−
zawiera: SiO
2
62 – 75%, Al.
2
O
3
18 – 26%, Li
2
O 5 – 7,5%,
−
ma postać proszku o barwie kości słoniowej do białej,
−
jest o bardzo słabym zapachu oleju żywicznego,
−
nie rozpuszcza się w wodzie,
−
produkt naturalny,
−
jest niepalny.
Jako minerał nie wykazuje toksycznego działania, jednak ze względu na to, że zawiera
kwarc, podczas stosowania i przechowywania należy przestrzegać przepisów bhp:
−
zapewnić odpowiednią wentylację,
−
unikać tworzenia i wdychania pyłu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Związki boru
Tlenek borowy B
3
O
3
wprowadza się do szkła w postaci czystych produktów sztucznych –
dziesięciowodnego czteroboranu sodowego (boraksu) Na
2
B
4
O
7
· 10H
2
O lub kwasu borowego
H
3
BO
3
.
B
2
O
3
wprowadzany do szkieł zwykłych sodowo-wapniowych nawet w niewielkich ilościach
spełnia rolę przyspieszacza topienia i klarowania masy szklanej. W większych ilościach do 12%
dodaje się go przy produkcji szkieł laboratoryjnych i technicznych borokrzemowych.
Kwas borowy H
3
BO
3
tworzy białe, lśniące, rozpuszczalne w wodzie płatki. Roztarty
w palcach daje wrażenie tłustości. W procesie topienia rozkłada się na tlenek borowy i wodę:
2H
3
BO
3
→ B
2
O
3
+ 3H
2
O
Kwas borowy otrzymuje się z minerałów zawierających bor, a głównie z sasolinu .
Boraks krystaliczny sztuczny jest produktem bardzo czystym. Otrzymywanym
z minerałów borowych najczęściej z tynkalu.
Na
2
B
4
O
7
·10H
2
O w procesie topienia rozkłada się na: tlenek borowy, tlenek sodowy i wodę
według reakcji:
Na
2
B
4
O
7
· 10H
2
O → 2B
2
O
3
+ Na
2
O + 10H
2
O
Boraks krystaliczny tworzy drobne, bezbarwne kryształy z wyglądu przypomina miałką sól
kuchenną. Rozpuszcza się łatwo w wodzie, ogrzany do temperatury 75
o
C pęcznieje i kipi
następnie topi się na przeźroczystą bezbarwną masę nazywaną szkliwem boraksowym (perła
boraksowa).
Związki fosforu
Pięciotlenek fosforu P
2
O
5
jest związkiem o silnych właściwościach szkłotwórczych,
zwłaszcza w połączeniu z wieloma tlenkami.
Pięciotlenek fosforu wprowadzać można do szkieł za pomocą apatytów, które zawierają
w swym składzie znaczne ilości tlenku glinu i krzemionki. Do szkieł specjalnych P
2
O
5
wprowadza się za pomocą fosforanów sodowych, amonowych lub kwasu fosforowego,
związków otrzymywanych w drodze przeróbki chemicznej fosforytów.
Kwas fosforowy H
3
PO
4
jest silnie higroskopijny. W handlu występuje zazwyczaj w postaci
wodnego roztworu o konsystencji syropu. Jako surowca szklarskiego używa się najczęściej 85
% roztwór. W takiej postaci miesza się go z zestawem, przed zasypaniem mieszanka powinna
być dobrze wysuszona.
Związki glinu
Surowce glinowe wprowadzają do szkła tlenek glinu Al
2
O
3
.
Można je podzielić następująco:
1. Naturalne związki glinu – glinokrzemiany:
−
skaleń,
−
kaolin,
−
skały magmowe.
2. Syntetyczne (sztuczne związki) glinu:
−
techniczny tlenek glinu,
−
wodorotlenek glinu,
−
glinian sodowy.
Naturalne surowce glinowe są częściej stosowane w odróżnieniu do surowców sztucznych
z uwagi na:
−
niską temperaturę topienia (łatwiej topliwe),
−
są tańsze i łatwiej dostępne,
−
oprócz tlenku glinu i ewentualnie innych tlenków zawierają krzemionkę zwykle w dużych
ilościach.
Wadą stosowania surowców naturalnych jest :

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
−
niestałość składu chemicznego,
−
znaczne zanieczyszczenie związkami barwiącymi, głównie związkami żelaza.
Tlenek glinu jest związkiem amfoterycznym. W szkłach zachowuje też podwójny charakter:
−
może występować jako tlenek szkłotwórczy, zastępując krzemionkę (najczęściej),
−
może występować jako tlenek modyfikator, zastępując tlenek z grupy RO np. tlenek
wapniowy.
W przemyśle szklarskim najczęściej stosowanym naturalnym surowcem glinowym jest skaleń.
Do najbardziej znanych skaleni należą:
−
skaleń potasowy (ortoklaz) – K
2
O • Al
2
O
3
• 6 SiO
2
,
−
skaleń sodowy (albit) – Na
2
O• Al
2
O
3
•6 SiO
2
,
−
skaleń wapniowy (anortyt) – CaO • Al
2
O
3
• 2 SiO
2
.
Dla przemysłu szklarskiego ma znaczenie skaleń potasowy i sodowy. Przygotowuje się je
w postaci mączki, posiadającej barwę kremową lub lekko różową.
Skalenie eksploatowane są i przerabiane na mączkę skaleniową w Strzelbowie oraz
w Kopańcu.
Dostarczona do hut mączka skaleniowa nie wymaga żadnych przygotowań do zestawu,
oprócz sprawdzenia jakości i ustalenia składu chemicznego.
Glin do szkieł trudnotopliwych np. włókno szklane, szkła żaroodporne, szkła zamącone
należy wprowadzać przez kaolin.
Surowce glinowe sztuczne są znacznie czyściejsze, mają stały skład chemiczny, lecz są
droższe a także trudno topliwe i trudno rozpuszczalne w masie szklanej. Do nich należą:
Techniczny wodorotlenek glinu Al(OH)
3
,
−
produkowany jest w cementowni jako produkt uboczny cementu szybkowiążącego,
−
jest to biały drobny proszek,
−
stosowany do topienia szkieł o dużej bezbarwności (szkła optyczne) oraz do szkieł
technicznych o dużej zawartości tlenku glinowego i niskiej zawartości alkaliów,
−
silnie ogrzewany przechodzi w kalcynowany tlenek glinowy:
2 Al(OH)
3
→
Al
2
O
3
+ 3 H
2
O
Techniczny tlenek glinu Al
2
O
3
−
jest to biały proszek o wysokiej temperaturze topienia,
−
nie rozpuszcza się w wodzie ani w kwasach wyjątek stanowi kwas fluorowodorowy,
−
posiada dużą stałość składu chemicznego,
−
najlepszy do topienia jest tlenek glinu drobnoziarnisty ponieważ grube ziarna są przyczyną
powstawania kamieni i smug.
Glinian sodowy Al
2
O
3
• 3 Na
2
O
−
zawiera 35,40 % Al
2
O
3
i 64,60 % Na
2
O,
−
jest proszkiem szarobiałym,
−
jest higroskopijny.
Związki tytanu
Tytan występuje w szkle w postaci jonu więźbotwórczego. Dwutlenek tytanu TiO
2
w ilościach śladowych występuje w szkłach przemysłowych jako składnik niepożądany,
wprowadzany z piaskiem szklarskim.
Tlenek tytanu TiO
2
w szkłach:
−
zwiększa współczynnik załamania światła, wprowadzany jest w dużych ilościach do
niektórych szkieł optycznych,
−
szkła z jego zawartością ulegają łatwo krystalizacji, dlatego bywa stosowany do pewnych
rodzajów tworzyw szklanokrystalicznych,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
−
ze względu na bardzo silne pochłanianie promieniowania szkła tytanowe stosuje się jako
filtry optyczne.
TiO
2
wprowadza się do szkła za pomocą bieli tytanowej.
Związki cyrkonu
Cyrkon występuje w szkle w postaci jonu więźbotwórczego. Do wprowadzenia w skład
szkła dwutlenku cyrkonu ZrO
2
, najczęściej stosowany jest techniczny dwutlenek cyrkonu.
Surowców mineralnych, cyrkonowych nie stosuje się z powodu dużej zmienności składu
chemicznego.
Techniczny tlenek cyrkonu ZrO
2
:
−
jest białym proszkiem,
−
posiada wysoką temperaturę topienia,
−
masa nasypowa 5730 kg/m
3
,
−
wprowadzany na miejsce Al
2
O
3
, w szkłach, zwiększa odporność chemiczną,
−
zmniejsza współczynnik rozszerzalności cieplnej.
Surowce wprowadzające tlenki modyfikujące
I. Surowce zasadnicze z grupy R
2
O
Surowce tej grupy zawierają tlenki o właściwościach silnie zasadowych, nie wchodzą w skład
więźby szkłotwórczej, lecz niszczą ją przez rozrywanie i lokowanie się między elementami
więźby. Tym sposobem zmieniają one właściwości szkła:
−
zmniejszają lepkość masy szklanej,
−
przyspieszają jej topienie,
−
wskutek znacznego osłabienia struktury szkła, pogarszają jego właściwości chemiczne
i mechaniczne.
Do grupy R
2
O należą tlenki pierwiastków metalicznych: litu Li, sodu Na, potasu K.
Ich aktywność chemiczna jest bardzo duża. W stosunkowo niewysokiej temperaturze tworzą z
krzemionką łatwo topliwe krzemiany.
W szklarstwie surowców tych używa się do zestawu w postaci soli, głównie węglanów
jako surowców podstawowych, a także siarczanów i azotanów jako surowców pomocniczych.
Soda
Jako surowców wprowadzających tlenek sodowy używa się prawie wyłącznie sody
i sulfatu. Tlenek sodowy może być wprowadzony do szkła także z innymi surowcami, jak np.
skały magmowe, środki zmętniające (fluorokrzemian sodowy, kriolit), środki klarujące (saletra
sodowa, chlorek sodu) a także boraks.
Soda jest to techniczny węglan sodowy o zawartości powyżej 98% Na
2
CO
3
, rozkładający
się według schematu:
Na
2
CO
3
→
Na
2
O +
↑
CO
2
Soda jest produktem sztucznym otrzymywanym fabrycznie metodą Solvaya, nazywaną
kalcynowaną lub amoniakalną. W handlu znajduje się dwa rodzaje sody:
−
soda kalcynowana lekka – to, drobnokrystaliczny biały proszek o masie nasypowej
600 – 900 kg/m
3
,
−
soda kalcynowana ciężka – to, grubokrystaliczny, o odcieniu kremowym lub brunatnym
proszek o masie nasypowej 1000 – 1300 kg/m
3
.
Przez zastosowanie sody ciężkiej osiąga się następujące korzyści:
1) równe wagowo ilości sody ciężkiej wymagają o wiele mniejszej przestrzeni
magazynowania aniżeli soda lekka,
2) soda ciężka jest mniej higroskopijna i zachowuje większą stałość składu,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
3) soda ciężka powoduje mniejszy rozkurz, zmniejsza zmiany zestawu i korozję materiałów
ogniotrwałych, poprawia warunki higieny pracy w hutach szkła,
4) soda ciężka z powodu lepszej przewodności cieplnej przyśpiesza topienie.
Sodę lekką należy stosować do produkcji trudno topliwych wysokokrzemowych szkieł.
Soda:
−
dobrze rozpuszcza się w wodzie,
−
jest bardzo higroskopijna, w czasie przyłączania wody wydziela się ciepło, zbrylenia
twardniejące pojawiają się z upływem czasu,
−
roztarta w palcach powoduje wrażenie śliskości wskutek zmydlenia naskórka,
−
charakteryzuje się dużą stałością składu chemicznego,
Sodę należy przechowywać w składach suchych i ciepłych. Ze względu na żrące działanie sody
na naskórek oraz śluzówkę oczu nosa i gardła podczas jej stosowania wymaga się
przestrzegania przepisów bhp.
Przygotowanie sody do zestawu obejmuje:
−
przesianie lub zmielenie zbryleń,
−
kontrola składu chemicznego oraz ustalenie wilgotności sody.
Związki potasu
Tlenek potasowy K
2
O ma w szkle własności podobne do tlenku sodowego. Tlenek potasowy
w szkłach:
−
poprawia właściwości optyczne, nadaje ładny połysk,
−
zwiększa lepkość co powoduje trudniejsze klarowanie,
−
wykazuje pozytywne zachowanie wobec tlenków barwiących, mają one bardziej
selektywną absorpcję widma i dają pełniejsze oraz bardziej czyste odcienie,
−
zwiększa współczynnik rozszerzalności cieplnej w mniejszym stopniu od tlenku
sodowego,
−
przy uderzeniu wydają czysty dźwięk, są szlachetniejsze,
−
mają większą odporność na działanie wody.
Tlenek potasowy jest stosowany do wytopu szkła kryształowego, optycznego, barwnego,
aparaturowego, gospodarczego oraz szkła technicznego. Jako surowiec podstawowy stosuje
się węglan potasowy, a do klarowania szkła saletrę potasową.
Potaż jest to techniczny węglan potasowy K
2
CO
3
. Zawiera 68,16% tlenku potasowego
i 31,84% dwutlenku węgla. Rozkłada się według schematu:
K
2
CO
3
→
K
2
O +
↑
CO
2
Potaż jest surowcem sztucznym, może być pochodzenia:
−
roślinnego,
−
mineralnego,
−
zwierzęcego.
W przemyśle szklarskim stosuje się potaż pochodzenia mineralnego ze względu na
ustabilizowany skład chemiczny. Do szkieł droższych np. kryształów stosuje się potaż
pochodzenia roślinnego z wywaru melasy.
Potaż pochodzenia mineralnego, to:
−
biały proszek,
−
bez zapachu,
−
topi się w temperaturze 890
o
C,
−
o gęstości nasypowej ok. 500-600 kg/m
3
,
−
jest łatwo rozpuszczalny w wodzie,
−
roztarty w wilgotnych palcach powoduje wrażenie śliskości,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
−
jest silnie higroskopijny z tego powodu należy go przechowywać w szczelnie zakrytych
zasobnikach lub w suchych i ciepłych składach.
Wilgotny potaż początkowo zbryla się, poczym rozpuszcza we wchłoniętej wodzie tworząc
papkowatą masę, przez co zmienia się jego skład chemiczny. Odważanie takiego surowca jest
utrudnione. Potaż jest surowcem żrącym działającym szczególnie szkodliwie na śluzówkę
gardła, oczu, nosa, może wywołać rany i owrzodzenia.
Praca z potażem wymaga ścisłego przestrzegania przepisów bhp.
Przygotowanie potażu do zestawu polega na jego ewentualnym przesianiu, należy również
kontrolować zawartość K
2
CO
3
i na podstawie wyników korygować ilość wskazaną w recepcie
na zestaw.
Związki litu
Lit jest pierwiastkiem bardzo rozpowszechnionym w przyrodzie lecz rzadko występuje
w większych ilościach. Surowcem wprowadzającym tlenek litowy do szkła jest techniczny
węglan litowy Li
2
CO
3
. Jest on otrzymywany syntetycznie z minerałów zawierających lit, tj.
lepidolitu – miki litowej, spodumenu
Al.
2
O
3
• Li
2
O • 4 SiO
2 ,
Techniczny węglan litowy rozkłada się według schematu:
Li
2
CO
3
→
Li
2
O +
↑
CO
2
Charakterystyka Li
2
CO
3
:
−
jest białym krystalicznym proszkiem topiącym się w temp. 618°C,
−
w wodzie jest mało rozpuszczalny,
−
nie jest higroskopijny,
−
czysty węglan litowy zawiera 40,6% Li
2
O i 59,4°/o CO
2
,
−
jego masa nasypowa wynosi 211 kg/m
3
Przygotowanie węglanu litowego do zestawu obejmuje:
−
sprawdzenie jego składu chemicznego,
−
rozdrobnieniu ewentualnych zbryleń.
Li
2
O znajduje zastosowanie do produkcji szkieł kineskopowych i pyroceramu.
Tlenek litowy:
−
powoduje łatwą topliwość szkieł, co umożliwia wprowadzenie mniejszych ilości tlenków
alkalicznych,
−
obniża punkt mięknienia szkła,
−
wykazuje niski współczynnik rozszerzalności cieplnej i dlatego szkła mają większą
odporność na szybkie zmiany temperatury,
−
zmniejsza współczynnik załamania światła,
−
dodawany jest do trudno topliwych szkieł.
II. Surowce zasadnicze z grupy RO
Surowce tej grupy zawierają tlenki o właściwościach zasadowych, lecz słabszych od
tlenków z grupy R
2
O. Nie tworzą więźby szkłotwórczej są tylko jej modyfikatorami lecz
niektóre mogą wchodzić w skład więźby szkła. Surowce grupy RO są to przeważnie związki
pierwiastków metalicznych : Ca, Mg, Zn, Ba, Pb. Wszystkie te pierwiastki w temperaturze
topienia masy szklanej łatwo tworzą z krzemionką krzemiany. Do zestawu są stosowane jako
sole przeważnie węglany albo tlenki.
Związki wapnia
Do wprowadzenia w skład szkła tlenku wapniowego CaO włącza się do zestawu tanie
i rozpowszechnione surowce mineralne – wapienie.
Tlenek wapniowy:
−
nadaje szkłu wiele cennych własności,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
−
wpływa korzystnie na niektóre własności mechaniczne szkieł, np. zwiększa najbardziej ze
wszystkich tlenków wytrzymałość na rozerwanie i współczynnik sprężystości,
−
większe jednak ilości CaO zwiększają kruchość szkła i obniżają wytrzymałość na
ściskanie,
−
wzrost tlenku wapniowego w szkle kosztem SiO
2
podnosi odporność szkła na działanie
wody,
−
zmniejsza lepkość szkła w wysokich temperaturach, a zwiększa w zakresie temperatur
odprężania,
−
zwiększa skłonność do krystalizacji szkła.
Zwykłe szkła sodowo-wapniowe powinny zawierać co najmniej 6% CaO, przeciętna zawartość
wynosi 7-10% CaO.
Tlenek wapniowy wprowadza się do szkła głównie w postaci wapienia i kredy.
Wapienie stosowane w przemyśle szklarskim dzielimy według struktury na:
1) kalcyty – wapienie czyste gruboziarniste,
2) marmury – wapienie drobnokrystaliczne,
3) wapienie – kamień wapienny o bardzo drobnych ziarnach,
4) kreda - wapień o strukturze ziemistej.
Kalcyt – szpat wapienny, jest najczystszym surowcem wapiennym. Występuje w postaci
żył, zbudowany z dużych kryształów o barwie miodowej.
Marmury – powstają w wyniku przekrystalizowania wapieni pod wpływem wysokiego
ciśnienia i temperatury. Posiadają strukturę zbitą ale są miękkie. Barwa marmuru zależy od
obecności innych minerałów i może być: biała przeświecająca, kremowa, różowa zielonkawa.
Spotyka się marmury o zabarwieniu wstęgowym.
Wapienie noszą nazwę kamienia wapiennego, są skałą osadową głównie pochodzenia
organicznego. W zależności od warunków powstawania wapień może mieć różną strukturę.
Kreda – jest to wapienna skała osadowa, ma barwę białą, kremową, szarą lub zielonkawą.
Masa nasypowa zależy od rodzaju rozdrobnienia i może wynosić 1,2 kg/dm
3
. Ze względów
technologicznych, kreda jest chętnie stosowana, ponieważ:
−
jest niekrystaliczna, miękka,
−
najłatwiej miesza się z zestawem,
−
ułatwia topienie.
O możliwości stosowania kredy decyduje niezbędna czystość surowca, głównie dopuszczalna
zawartość związków żelaza.
Polska ma bardzo bogate złoża wapieni. Kalcyt występuje jednak bardzo rzadko. Nasze
niewielkie złoża dotychczas nie są dokładnie poznane. Eksploatuje się je sporadycznie na
potrzeby przemysłu szklarskiego w Jurze Krakowsko-Wieluńskiej (Ogrodzieniec), okręgu
świętokrzyskim (Trzuskawica) oraz w Górach Świętokrzyskich (Wola Murowana). Kalcyt ten
zawiera ponad 99 % CaCO
3
i poniżej 0,05% Fe
2
O
3
. Przemysł szklarski zaopatrywany jest
w wapienie
z
okręg
dolnośląskiego
(Wojcieszów),
krakowskiego
(Krzeszowice)
i pomorskiego (Piechocin).
Związki magnezu
Tlenek magnezowy: wprowadza się do szkła z surowcami mineralnymi zawierającymi
węglan magnezowy MgCO
3
rozkładający się według schematu:
MgCO
3
→
MgO +
↑
CO
2
Tlenek magnezowy:
−
nadaje szkłu bardzo dobre własności i jest powszechnie stosowany dla częściowej zamiany
tlenku wapniowego,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
−
znaczniejsze obniżenie lepkości następuje w temperaturach niskich i wskutek tego szkła
magnezowo-wapniowe są dłuższe od szkieł wapniowych oraz łatwiej się odprężają,
−
obniżanie zdolności do krystalizacji umożliwia pracę maszynom formującym w niższych
temperaturach,
−
ma pewne znaczenie także przy ręcznej produkcji wyrobów cienkościennych, przez
zastąpienie tlenku wapniowego tlenkiem magnezowym w szkłach sodowo- wapniowych
systematycznie obniża się górna temperatura krystalizacji,
−
posiada w szkle najniższy ze wszystkich tlenków ziem alkalicznych współczynnik
rozszerzalności cieplnej, szkła zawierające MgO wykazują większą odporność termiczną,
−
przy zawartości 3 ÷ 4% MgO zmniejsza się także szybkość krystalizacji.
Tlenek magnezowy jest wprowadzany do szkła przeważnie w postaci dolomitu, a do
szkieł o niskiej zawartości tlenku wapniowego - w postaci magnezytu.
Dolomit
Głównym składnikiem dolomitu jest podwójny węglan wapniowo magnezowy
MgCa(CO
3
)
2
. Skład chemiczny dolomitów waha się przeciętnie w zakresie:
CaO 27 – 32 %
MgO 18 – 20 %
SiO
2
0,5 – 1,5 %
Al
2
O
3
0,1 – 0,5 %
Fe
2
O
3
0,06 – 0,1 %
Mączka dolomitowa nie powinna zawierać ziaren powyżej 0,5 mm. Dopuszcza się również
bardzo drobny przemiał (do 85% poniżej 0,10 mm). Jest to biały, szorstki proszek
nierozpuszczalny w wodzie. Jest higroskopijny – zawartość wody może dochodzić do 12%.
Mączkę dolomitową należy przechowywać w suchych i ciepłych składach lub zasobnikach.
Ze względu na bardzo zmienny skład chemiczny, dolomit można wprowadzać do zestawu po
oznaczeniu zawartości MgO i CaO.
Złoża czystych dolomitów o stałym składzie występują w Rędzinach na Dolnym Śląsku.
Złoża te mają ogromne znaczenie dla przemysłu szklarskiego Dolomit o zmiennym składzie
i bardziej zanieczyszczony występuje w Zagłębiu Śląsko - Dąbrowskim (np. Siewierz).
Dolomit rędziński zawiera przeciętnie do 0,3% Fe
2
O
3
.
Magnezyt
Jest minerałem zawierającym węglan magnezowy MgCO
3
.
Naturalnego magnezytu prawie nie stosuje się w przemyśle szklarskim, gdyż jest bardzo
zanieczyszczony związkami żelaza. W przemyśle szklarskim stosuje się sztuczny magnezyt
produkowany z ługów pokrystalicznych przy produkcji soli potasowych. Jest to produkt
bardzo czysty (98 ÷ 99% MgCO
3
) z niewielkimi śladami żelaza.
Związki baru
Tlenek barowy BaO wprowadza się do topienia szkieł: laboratoryjnych, optycznych,
wysokogatunkowych szkieł gospodarczych oraz do szkieł formowanych metodą wytłaczania.
Wprowadzony do szkieł tlenek barowy:
−
korzystnie wpływa na proces topienia masy szklanej,
−
małe ilości BaO przyśpieszają topienie,
−
szkła barowe wykazują dużą skłonność do krystalizacji, jednak mniejszą niż szkła
wapniowe,
−
powoduje wydłużenie szkła i obniża lepkość, szczególnie w niższych temperaturach, co
także upodobnia szkła barowe do ołowiowych,
−
nadaje szkłu własności pośrednie między własnościami tlenku wapniowego i tlenku
ołowiawego. Dotyczy to przede wszystkim takich własności, jak: połysk, współczynnik

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
załamania światła, układ lepkości, odporność chemiczna, własności mechaniczne
i przewodność elektryczna. Z tych własności szczególnie często wykorzystuje się
własności optyczne, gdyż prowadzi to do zaoszczędzenia PbO.
Czyste szkło barowe topi się i klaruje źle, dlatego w zwykłych szkłach ilość tlenku barowego
nie powinna przekraczać 7 %.
Szkła wapniowo-barowe topią się łatwiej aniżeli czyste szkła wapniowe lub barowe. Najlepsze
wyniki otrzymuje się przy stosunku 3 cz. wag. CaO i 1 cz. wag. BaO.
Surowcami wprowadzającymi do szkła tlenek baru sa minerały o nazwie baryt BaSO
4
i rzadko występujący witeryt
BaCO
3
. Ze względu na duże zanieczyszczenia zarówno baryt
jak i witeryt są przerabiane na techniczny węglan i siarczan barowy zawierający ok. 98%
czystego związku.
Najważniejszym surowcem szklarskim wprowadzającym BaO jest węglan barowy.
Siarczan barowy stosuje się jako surowiec przyśpieszający topienie.
Węglan barowy
Techniczny węglan barowy rozkłada się według schematu:
BaCO
3
→
BaO +
↑
CO
2
Jest surowcem dostatecznie czystym, zawiera nieduże ilości zanieczyszczeń nie szkodliwych
dla szkła,
−
jest drobnym bardzo białym proszkiem,
−
nierozpuszczalny w wodzie,
−
jest higroskopijny, pod wpływem wilgoci zbija się w grudki,
−
dostarczany jest w szczelnych pojemnikach, przechowywany w suchych i ciepłych
składach,
−
gęstość nasypowa ok. 350 kg/m
3
.
−
rozkłada się w temp. 1350°C.
Węglan barowy jest silną trucizną, gdyż w organizmie rozkłada się na trujące
nierozpuszczalne sole barowe i dlatego przy jego stosowaniu należy bezwzględnie
przestrzegać przepisów bhp.
Związki ołowiu
Tlenek ołowiu PbO jest zaliczany do grupy szkłotwórczych. Ilość PbO w szkłach może
dochodzić nawet do 80%.
Szkła ołowiowe o zmniejszonej ilości alkaliów wykazują wiele korzystnych własności, jak
większą odporność hydrolityczną i niższą przewodność elektryczną, dlatego tlenek ołowiawy
jest wprowadzany do różnych szkieł elektrotechnicznych.
Tlenek ołowiu:
−
powoduje najwyższy ze wszystkich tlenków wzrost współczynnika załamania światła
i dlatego wchodzi w skład szkieł optycznych i kryształowych,
−
zmniejsza twardość szkła i odporność na działanie kwasów, dzięki czemu szkła
kryształowe można łatwo rzeźbić i polerować kwasami,
−
nadaje szkłom mocny dźwięk z powodu niskiego współczynnika sprężystości,
−
łatwo się w szkle redukuje, co stanowi pewną trudność przy topieniu i obróbce na
palnikach szkieł ołowiowych,
−
zmniejsza lepkość w całym zakresie temperatur, dlatego szkła ołowiowe topią się
i formują łatwo.
Jako kryształy określa się szkła zawierające ponad 18% PbO. Szeroki zakres stosowania szkieł
ołowiowych wynika z dużej absorpcji promieni Roentgena i dlatego służą one jako szkła
ochronne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Minia ołowiowa
Minia ołowiowa jest podstawowym surowcem służącym do wprowadzania tlenku
ołowiawego do szkła. Minię otrzymuje się przez utlenienie czystego metalicznego ołowiu.
Minia rozkłada się już w temp. 500°C z wydzielaniem tlenu:
2Pb
3
O
4
→ 6PbO + O
2
Wydzielanie tlenu rozpoczyna się już na początku topienia zestawu. Wydzielający się tlen
utlenia zanieczyszczenia organiczne zawarte w zestawie.
Minia ołowiowa:
−
to proszek barwy od pomarańczowej do mocno czerwonej, barwa uzależniona jest od
gatunku,
−
ogrzewana staje się czarna, lecz po ostygnięciu przybiera barwę poprzednią,
−
nie rozpuszcza się w wodzie,
Minię produkuje się w trzech gatunkach.
I gatunek – minia kryształowa, o zawartości tlenku żelazowego Fe
2
O
3
- najwyżej 0,004%, jest
barwy ognisto czerwonej, stosowana przede wszystkim do produkcji szkieł
optycznych i kryształowych. Warunki techniczne są bardzo rygorystyczne;
II gatunek – minia czysta, o zawartości tlenku żelazowego Fe
2
O
3
- najwyżej 0,03%, ma barwę
pomarańczową, stosowana jest do produkcji szkieł barwnych i technicznych;
III gatunek – minia zwykła, barwy brunatno pomarańczowej, zawiera najwięcej zanieczyszczeń
, stosowana jest do malowania metali w celu ochrony przed korozją.
Do produkcji szkła stosuje się minię gatunku pierwszego i drugiego. Jest higroskopijna,
dostarczana jest w szczelnych pojemnikach. Jest produktem szkodliwym dla zdrowia.
Wchłanianie minii ołowiowej powoduje ciężkie chroniczne zatrucie organizmu, nazywane
ołowicą. Z tego względu podczas pracy z minią obowiązuje bezwzględne przestrzeganie
przepisów bhp.
Glejta
Tlenek ołowiawy PbO nazywany glejtą jest żółtym ciężkim proszkiem. Zdarza się, że szkło
z dodatkiem ołowiu nie może być topione w atmosferze utleniającej.
Z powodu niewielkiej zawartości ołowiu przetopiony tlenek ołowiawy, czyli glejta, znajduje
zastosowanie jako czynnik redukujący przy wytapianiu rubinu miedziowego.
Związki cynku
Tlenek cynkowy ZnO wprowadza się do szkieł najczęściej dla podwyższenia własności
termicznych i chemicznych, mniej mechanicznych.
Oprócz tego tlenek cynkowy w ilości 5 ÷ 8% w szkle jest wraz z siarczkiem kadmowym
niezbędnym środkiem do produkcji rubinów selenowych oraz do produkcji szkieł zamąconych
(dla wzmocnienia działania fluorowych środków mącących).
Tlenek cynkowy ZnO :
−
jest niezwykle trudno topliwy,
−
w połączeniu z krzemionką tworzy dość łatwo topliwe krzemiany,
−
zwiększa przewodność cieplną, dlatego szkła cynkowe mają dobrą wytrzymałość
termiczną,
−
polepsza odporność chemiczną,
−
nie ma dużego wpływu na własności mechaniczne szkła, jedynie zwiększa twardość szkła,
−
w wyższych temperaturach znacznie zmniejsza lepkość szkła.
Przez wprowadzenie tlenku cynkowego do szkła zamiast alkaliów i krzemionki można
otrzymać szkła o takiej samej lepkości i topliwości, lecz o zwiększonej odporności termicznej i
chemicznej. Czyste szkła cynkowe mają skłonność do krystalizacji, natomiast szkła mieszane -

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
np. glinowo-cynkowe - nie wykazują jej. W szkłach bezołowiowych wprowadzenie do 8%
ZnO nie powoduje krystalizacji. W szkłach ołowiowych 9% ZnO zamącą szkło.
Jako surowca szklarskiego używa bieli cynkowej. Otrzymywana jest z rud cynkowych.
Polska posiada bardzo bogate złoża galmanu ZnCO
3
, występujące na Górnym Śląsku
i w okolicach Olkusza.
Biel cynkowa
Biel cynkowa jest czystym tlenkiem cynkowym ZnO.
Biel cynkowa:
−
jest drobnym białym proszkiem,
−
roztarta w palcach nie jest śliska lecz maże się,
−
nie rozpuszcza się w wodzie,
−
ogrzana przybiera zabarwienie żółte, które znika po ostygnięciu próbki,
−
jest nieco higroskopijna, powinna być przechowywana w zakrytych zasobnikach,
pojemnikach,
−
jest stosowana do topienia szkieł termometrycznych oraz do szkieł barwnych w celu
utrwalenia barwy.
Przed wprowadzeniem bieli cynkowej do zestawu należy kontrolować jej czystość, czy nie
zawiera związków wapnia, magnezu, baru. Nie są one szkodliwymi domieszkami, ale
zmniejszają procentową zawartość ZnO.
Surowce wtórne
Wykorzystywanie odpadów przemysłowych stosowane jest w społeczeństwach o wysokiej
kulturze technicznej, które doceniają ich wartość a selekcjonowanie i przeróbka na
pełnowartościowy surowiec jest opłacalna.
Warunkiem szerszego wykorzystania odpadów jest możliwość uzdatniania ich polegająca
na ujednorodnieniu w celu zapewnienia stałości składu chemicznego i uziarnienia a także
zastosowaniu prostych operacji w celu zmniejszenia zawartości szkodliwych domieszek.
W przemyśle szklarskim do wykorzystania nadają się głównie: granulowane żużle
wielkopiecowe oraz stłuczka szklana.
Przykładem surowca szklarskiego będącego odpowiednio uzdatnionym żużlem
wielkopiecowym jest Calumite. Proces jego wytwarzania polega na selekcji partii żużla
o odpowiednim składzie chemicznym a następnie dwustopniowym rozdrobnieniu i klasyfikacji
ziaren połączonych z separacją magnetyczną dla zmniejszenia zawartosci żelaza. Calumite jest
najtańszym surowcem glinowym dla szkła okiennego, wprowadzając prawie cały glin i magnez,
równocześnie zmniejszając zużycie mączki wapiennej. Przyspiesza on proces topienia, ułatwia
klarowanie a także daje oszczędność paliw. Żużle hutnicze zawierają siarkę w formie
siarczków, które mogą barwić szkło. Aby temu zapobiec należy stworzyć odpowiednio
utleniające warunki topienia masy szklanej.
W skład żużli wchodzą następujące tlenki:
SiO
2
37,68 %
Al
2
O
3
8,88 %
CaO 44,78 %
MgO 4,83 %
Fe
2
O
3
1,12 %
TiO
2
0,1 %
MnO 0,99 %
SO
3
1,6 %

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Stłuczka szklana jako surowiec szklarski
Bardzo cennym surowcem do topienia szkła i produkcji wszelkiego rodzaju wyrobów
szklanych jest stłuczka szklana. Zastosowanie jej pozwala na:
−
oszczędność składników surowcowych,
−
zmniejszenie w sposób znaczny zużycia energii na topienie masy szklanej,
−
zmniejszenie emisji CO
2
do atmosfery,
−
przyspieszenie procesu wytopu oraz przedłużenie żywotności agregatów topliwych,
−
czyli zmniejszenie zużycia materiałów ogniotrwałych, donic i basenu wanny.
Główne jej znaczenie polega na tym, że nie posiadająca jako odpad wartości użytkowej może
być użyta zamiast pełnowartościowych surowców.
Stosuje się stłuczkę własną i obcą pochodzącą ze zbiornic.
Stłuczka szklana własna ma taki sam lub zbliżony skład chemiczny, jaki posiada gotowy
produkt, czyli otrzyma w piecu szklarskim masa szklana.
Będąc pod względem chemicznym całkowicie ukształtowana nie wymaga ona dla
przekształcenia się w ciekłą masę tak wysokiej temperatury i tak długiego oddziaływania jak w
stosunku do pozostałych składników zestawu szklarskiego. Topi się ona i osiąga stan ciekły
już w temperaturze poniżej 1000
o
C. Każdy kilogram szkła wytopionego ze stłuczki wymaga
zużycia znacznie mniejszej ilości ciepła i czasu niż kilogram szkła wytopionego z mieszanki
surowców, czyli z zestawu.. Szkło wytopione tylko z samej stłuczki źle kształtuje się (formuje
się), a wyroby z niego wytwarzane często pękają. Powodem tego jest zbyt duża lepkość szkła
w czasie topienia, podczas topienia stłuczki nie tworzą się gazy tak jak podczas stapiania
zestawu a wiadomo gazy te kłębią masę, mieszając ją i ujednoradniając.
Stłuczka własna pozostająca w hucie szkła z odpadów produkcyjnych (np. obrzeży taśmy szkła
wytarzanej metodą ciągnienia pionowego), braków odrzuconych przy sortowaniu, powinna
być starannie zbierana i przechowywana tak, aby można było wykorzystać bez zanieczyszczeń
w procesie wytwarzania szkła. Przy prawidłowej gospodarce stłuczka znajduje się w ciągłym
obiegu.
Stłuczka szklana obca pochodząca ze skupu, głównie od odbiorców opakowań szklanych
oraz ze zbiornic odpadów aby mogła być użyta musi spełniać wymagania obowiązujących
norm. Opracowane zostały sposoby odzysku stłuczki szklanej z odpadów komunalnych,
wykorzystujące metody:
−
klasyfikacji na sitach,
−
separacji magnetycznej,
−
urządzeń flotacyjnych.
Pozwalają one oddzielić szkło od metali, papieru, odpadów organicznych a także ceramiki,
gruzu i betonu. Uzyskaną stłuczkę można wykorzystać do produkcji barwnych opakowań
szklanych. Stłuczkę tą sortuje się według jej zabarwienia korzystając z separatorów
elektrooptycznych reagujących na światło przechodzące przez szkło lub odbite od niego. Ilość
stłuczki dodawanej do zestawu jest ściśle związana z jakością otrzymanego szkła, sposobem
produkcji wyrobów oraz od tego czy dane szkło ma być bezbarwne czy kolorowe. Udział
stłuczki szklanej w zestawie może wynosić nawet około 55% masy zestawu.
Stłuczka szklana zasypywana jest w stanie rozdrobnionym oddzielnie warstwowo lub po
uprzednim zmieszaniu z zestawem.
Wraz ze stłuczką należy wprowadzić takie surowce do zestawu aby wydzielające się z nich
gazy wystarczyły do ujednorodnienia się masy szklanej. Powierzchnia stłuczki jest zubożona w
alkalia, dlatego ich zawartość należy korygować.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak dzielą się surowce szklarskie według funkcji pełnionej w szkle?
2. Jak dzielą się surowce szklarskie według pochodzenia?
3. Jak sklasyfikować surowce pod względem składu chemicznego?
4. Jakie tlenki nazywamy więźbotwórczymi?
5. Jakie tlenki zaliczamy do modyfikujących?
6. Jakie cechy piasku szklarskiego decydują o jego przydatności do zestawu szklarskiego?
3. Jakie tlenki wprowadza do masy szklanej dolomit?
4. Jakie surowce wprowadzają do szkła tlenek wapnia?
5. Jakimi właściwościami charakteryzuje się potaż?
6. Jakie są gatunki minii ołowiowej?
7. Jakie surowce wtórne znajdują zastosowanie w przemyśle szklarskim?
8. Jakie są zalety stłuczki szklanej własnej?
9. Jaki są sposoby uzdatniania stłuczki szklanej obcej?
10. Jakie korzyści można uzyskać stosując Calumite, jako surowiec wtórny w zestawie szklarskim?
14. Gdzie w Polsce eksploatuje się złoża piasku szklarskiego?
4.2.3. Ćwiczenia
Ćwiczenie 1
Wykonaj badanie rozpuszczalności w wodzie surowców szklarskich oznaczonych cyframi
od 1 do 7.
Tabela do ćwiczenia 1.
Rozpuszczalność
w wodzie
Nazwa surowca
Tak
Nie
1.
2.
3.
4.
5.
6.
7.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z próbkami surowców wskazanych przez nauczyciela,
2) rozpoznać surowce,
3) wpisać nazwy do tabeli,
4) określić rozpuszczalność w wodzie otrzymanych surowców,
5) zapisać przeprowadzone rozpoznanie w tabeli.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Wyposażenie stanowiska pracy:
–
przybory do pisania,
–
kolekcja surowców szklarskich,
–
sprzęt laboratoryjny do badania rozpuszczalności w wodzie surowców szklarskich,
–
karty papieru z załączoną tabelą,
–
poradnik dla ucznia,
–
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Przyporządkuj tlenek do grupy tlenków więźbotwórczych lub grupy tlenków
modyfikujących.
Tabela do ćwiczenia 2.
1. MgO
2. Na
2
O
3. PbO
4. SiO
2
5. ZnO
6. B
2
O
3
7. BaO
8. Li
2
O
9. Al
2
O
3
10. TiO
2
11. K
2
O
12. CaO
13. ZrO
2
14. P
2
O
5
A.
Grupa tlenków
więźbotwórczych
B.
Grupa tlenków
modyfikujących.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców podstawowych:
więźbotwórczych i modyfikujących,
2) dokonać analizy treści,
3) przyporządkować tlenek do właściwej grupy.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
poradnik dla ucznia,
−
karty papieru z załączoną tabelą,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
Ćwiczenie 3
Określ, jakie korzyści można osiągnąć stosując surowce wtórne do topienia masy szklanej.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców wtórnych,
2) dokonać analizy treści,
3) zapisać korzyści zastosowania surowców wtórnych.
Wyposażenie stanowiska pracy:
−
papier formatu A4, pisaki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 4
Dla podanych w tabeli surowców szklarskich zapisz ich skład chemiczny oraz określ
pochodzenie.
Tabela do ćwiczenia 4.
Nazwa surowca
Skład chemiczny
Pochodzenie
1. Dolomit
2. Soda
3. Piasek kwarcowy
4. Spodumen
5. Minia ołowiowa
6. Kreda
7. Boraks
8. Skaleń
9. Potaż
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców podstawowych,
2) dokonać analizy treści,
3) zapisać w tabeli składy chemiczne poszczególnych surowców oraz ich pochodzenie,
4) określić pochodzenie surowców.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
karty papieru z załączoną tabelą,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
4.2.2. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) dokonać podziału surowców szklarskich według funkcji pełnionych w
szkle?
2) określić pochodzenie surowców szklarskich?
3) sklasyfikować surowce pod względem składu chemicznego?
4) rozpoznać tlenki więźbotwórcze?
5) rozpoznać tlenki modyfikujące?
5) określić cechy piasku szklarskiego decydujące o jego przydatności do
zestawu szklarskiego?
6) określić jakie tlenki wprowadza do zestawu szklarskiego dolomit?
7) scharakteryzować surowce wprowadzające do szkła tlenek wapnia?
8) scharakteryzować potaż jako surowiec szklarski?
9) sklasyfikować minię ołowiową?
11) wymienić surowce wtórne znajdujące zastosowanie w przemyśle
10) szklarskim?
11) określić zalety stłuczki szklanej własnej?
12) określić sposoby uzdatniania stłuczki szklanej obcej?
14) określić zalety stosowania Calumitu, jako surowieca wtórnego
w zestawie szklarskim?
13) określić miejsca eksploatacji złóż piasku szklarskiego w Polsce?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
4.3. Surowce szklarskie pomocnicze i dodatkowe
4.3.1. Materiał nauczania
Surowce pomocnicze
Surowce pomocnicze dodawane są do zestawu w niewielkiej ilości w celu:
−
ułatwienia i przyspieszenia procesów topienia masy szklanej, wytworzenia w czasie
topienia szkła produktów gazowych ułatwiających wydzielanie się pecherzy,
−
wytworzenia szczególnych warunków topienia, np. wytworzenia odpowiedniej atmosfery
utleniającej bądź redukującej.
Jako surowce pomocnicze stosowane są:
a) azotany, czyli saletry:
−
sodowa NaNO
3
,
−
potasowa KNO
3
,
−
barowa Ba(NO
3
)
2
,
b) siarczany:
−
sodowy (sulfat) Na
2
SO
4
,
−
amonowy (NH
4
)
2
SO
4
,
−
barowy (baryt) Ba SO
4
,
c) chlorki:
−
amonowy (salmiak) NH
4
Cl,
−
sodowy (halit) NaCl,
−
potasowy (sylwin) KCl,
d) arszenik As
2
O
3
i związki fluoru.
Saletry – azotany
Są surowcami produkowanymi sztucznie w zakładach przemysłu azotowego. Dla
przemysłu szklarskiego używa się azotanów o technicznym stopniu czystości.
Saletra sodowa (azotan sodowy) NaNO
3
, tworzy bezbarwne kryształy dobrze
rozpuszczalne w wodzie. Jest bardzo higroskopijna, wchłaniając przez dłuższy czas wilgoć
z powietrza ulega całkowitemu rozpuszczeniu.
W czasie ogrzewania do temperatury 308°C topi się a następnie przy dalszym ogrzewaniu
rozkłada się wg reakcji:
4NaNO
3
→ 2Na
2
O + ↑2N
2
+ ↑5O
2
Jest substancją silnie utleniającą i te właściwości są wykorzystywane również w czasie topienia
szkła.
Saletra potasowa (azotan potasowy) KNO
3
otrzymywana jest z saletry sodowej
i chlorku potasowego w wyniku reakcji wymiany. Jest substancją krystaliczną, bezbarwną,
dobrze rozpuszcza się w wodzie. Jest mało higroskopijna. Topi się w temperaturze 334°C
i rozkłada w 400° C w podobny sposób jak saletra sodowa.
4KNO
3
→ 2K
2
O + ↑2N
2
+ ↑5O
2
Saletra barowa (azotan barowy) Ba(NO
3
)
2
otrzymywana przez działanie kwasu
azotowego na węglan barowy, tworzy bezbarwne kryształy słabiej rozpuszczalne w wodzie.
Jest mało higroskopijna. Topi się w temperaturze 592°C. Dalsze ogrzewanie powoduje
rozkład:
Ba(NO
3
)
2
→ 2BaO + 4NO + ↑3O
2

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
Siarczany
Siarczan sodowy (Sulfat) Na
2
SO
4
. W Polsce jako surowca używa się technicznego
bezwodnego siarczanu wytwarzanego przez przemysł chemiczny z soli kamiennej.
Jest drobno krystalicznym proszkiem, łatwo rozpuszczalnym w wodzie. Jest higroskopijny
i łatwo ulega zbryleniu. Topi się w temperaturze 884°C. Jego działanie klarujące wyjaśnia
reakcja rozkładu rozpoczynająca się w temperaturze 1200°C:
2Na
2
SO
4
→ 2Na
2
O + ↑2SO
2
+ ↑O
2
Siarczan amonowy (NH
4
)
2
SO
4
jest surowcem otrzymywanym sztucznie. Jest to biały
drobno krystaliczny proszek łatwo rozpuszczalny w wodzie. W czasie ogrzewania do
temperatury 513°C ulega rozkładowi:
2(NH
4
)
2
SO
4
→ ↑4NH
3
+ ↑2SO
2
+ ↑2H
2
O + ↑O
2
Siarczan barowy (baryt) BaSO
4.
Jest substancją krystaliczną, zmielony (mączka
barytowa) jest szarym lub brunatnym proszkiem, nierozpuszczalnym w wodzie. Jest minerałem
zawierającym głównie siarczan barowy BaSO
4
, rozkładający się w temperaturze topienia masy
szklanej według schematu:
2BaSO
4
→ 2BaO + ↑2SO
2
+ ↑O
2
Stosuje się go w celu przyspieszenia topienia i klarowania masy szklanej, ponieważ
zmniejsza jej lepkość a także wprowadza do masy BaO, korzystnie wpływający na proces
topienia. Wadą surowca jest duże zanieczyszczenie, zwłaszcza związkami żelaza.
Chlorki
Chlorek amonowy (salmiak) NH
4
Cl, otrzymywany jest syntetycznie (produkt uboczny
przy wytwarzaniu sody) jest to substancja krystaliczna w postaci białego proszku, dobrze
rozpuszczalna w wodzie. W czasie ogrzewania łatwo sublimuje, zestalone w powietrzu pary
tworzą białe dymy.
Chlorek sodowy - NaCl występuje w przyrodzie jako minerał halit znany powszechnie
pod nazwą soli kamiennej. W Polsce bogate złoża soli kamiennej występują w Wieliczce,
Bochni, Inowrocławiu. Sól kamienna jest skałą osadową występującą w skupieniach zbitych
a niekiedy w postaci dużych kryształów (układ regularny). Chlorek sodowy dobrze rozpuszcza
się w wodzie. W stanie czystym nie jest higroskopijny. Topi się w temperaturze 800°C, a przy
ogrzaniu do temperatury 1413°C całkowicie ulatnia się.
Chlorek potasowy - KCl jest rozpowszechniony jako minerał sylwin. Jego właściwości są
podobne do chlorku sodowego.
Arszenik
Jest technicznym tlenkiem arsenawym As
2
O
3
i zwany również trójtlenkiem arsenu.
Arszenik jest białym proszkiem trudno rozpuszczalnym w wodzie. W 100 cm
3
wody w 0°C
rozpuszcza się 1,21 g As
2
O
3
, tworzy się przy tym słaby kwas arsenawy
o właściwościach amfoterycznych:
As
2
O
3
+ 3H
2
O → 2H
3
AsO
3
Arszenik występować może również w postaci szklistej substancji o masie właściwej
3,8 g/cm
3
. Arszenik rozpuszcza się w stężonym kwasie solnym tworząc chlorek arsenawy
AsCl
3
, rozpuszcza się on również w wodorotlenkach sodu i potasu tworząc arseniny np.
Na
3
AsO
3
. Po ogrzaniu do temperatury 193°C sublimuje a w temperaturze 275°C topi się.
Ogrzany z węglem łatwo redukuje się do metalicznego arsenu.
Arszenik jest bardzo silną trucizną, dawka śmiertelna wynosi ok. 0,1 g i dlatego wszystkie
czynności z arszenikiem należy wykonywać bardzo ostrożnie, bezwzględnie przestrzegając
przepisów bhp.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
Surowce szklarskie dodatkowe
Surowce dodatkowe wprowadza się do zestawu w niedużych ilościach, głównie w celu
nadania szkłom szczególnych właściwości. W zależności od roli jaką pełnią surowce w szkle
można je podzielić na następujące grupy:
1) Barwniki masy szklanej, czyli środki wywołujące wybiórcze pochłanianie promieni
świetlnych przez działanie jonów odpowiednich metali ciężkich, np. mangan, nikiel miedź,
chrom, żelazo, lub przez działanie powstającej w masie szklanej zawiesiny koloidalnej, np.
zawiesina srebra, złota, kadmu.
2) Środki mącące masę szklaną, czyli powodujące powstawanie w niej zawiesiny,
przeważnie, krystalicznej, rozpraszającej światło i czyniące szkło nieprzezroczystym
mlecznym.
Surowce barwiące masę szklaną
Szkło barwi się przez dodanie do zestawu a następnie rozpuszczenie w masie szklanej
pewnych związków chemicznych lub pierwiastków mających określone właściwości i siłę
barwiącą. Jest wiele środków powodujących barwność masy szklanej. Zawierają one
najczęściej pierwiastki: żelazo, chrom, mangan, nikiel, kobalt, miedź, selen, antymon, tytan,
kadm, srebro.
Poszczególne związki wywołują określone z góry przewidziane zabarwienie, ale odcień
barwy nie zawsze jest jednakowy. Zależy on od wielu czynników, z których najważniejszymi
są:
−
skład chemiczny masy szklanej,
−
temperatura topienia,
−
utleniające lub redukujące warunki topienia,
−
ciśnienie,
−
skład barwnika,
−
stężenie barwnika.
Barwniki szkła dzielimy na:
1) barwniki jonowe,
2) barwniki koloidalne.
Barwniki jonowe rozpuszczają się w szkle, nadając szkłu zabarwienie o intensywności
proporcjonalnej do stężenia barwnika w szkle.
Do barwników jonowych należą tlenki: Fe, Mn, Co, Ni, Cu i ziem rzadkich. Barwniki jonowe
dzielimy z kolei na dwie grupy:
a) tlenki metali o jednym stopniu utlenienia, np. tlenki Co, Ni, Nd i in.
b) tlenki metali o dwóch lub więcej stopniach utlenienia, np. tlenki Mn, Cr, Ce i in.
Barwniki koloidalne barwią szkło przez wytworzenie określonych roztworów
koloidalnych w szkle. Barwniki te barwią szkło dopiero wtedy, gdy są dodane w odpowiedniej
ilości i zostaną spełnione określone warunki technologiczne. Do grupy barwników
koloidalnych zaliczyć należy: związki złota, miedzi, srebra i in. W grupie barwników
koloidalnych można wydzielić barwniki dyfuzyjne. Barwią one szkło w temperaturze poniżej
punktu mięknienia przez powierzchniową dyfuzję jonów. Do barwników dyfuzyjnych należą
związki srebra i miedzi.
Surowce do barwienia szkła można podzielić również z punktu widzenia barwy, jaką
nadają szkłu:
związki manganu
1) barwią na fioletowo
związki niklu
związki neodymu

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
związki kobaltu
2) barwią na niebiesko
związki miedzi
związki żelaza
3) barwią na zielono
związki chromu
związki siarki
związki żelaza
4) barwią na żółto
związki kadmu
związki srebra
związki ceru
związki selenu
5) barwią na czerwono
związki miedzi
związki złota
Związki żelaza i chromu
Związki żelaza. Często występują w surowcach jako zanieczyszczenie. Ich obecność
powoduje barwienie szkła zależnie od stopnia utleniania żelaza na niebiesko, gdy żelazo
występuje jako Fe
2+
lub na żółto w przypadku występowania żelaza Fe
3+
.W szkle występują
najczęściej oba tlenki, tj. FeO i Fe
2
O
3
. Ponadto żelazo występując w szkle w postaci siarczków
barwi je na żółtobrunatno.
Jako surowce wprowadzające żelazo stosuje się sztucznie otrzymany z rud żelaza:
−
tlenek żelazawy Fe
2
O
3
- (minia żelazowa) jest proszkiem barwy czerwonobrązowej,
nierozpuszczalnym w wodzie,
−
siarczan żelazowy FeSO
4
7H
2
O - tworzy kryształy barwy zielonej, łatwo rozpuszczalne
w wodzie.
Związki chromu. Stosowane są do barwienia szkła na zielono a w odpowiednich
warunkach uzyskać można barwę żółtą lub pomarańczową. Jako surowce barwiące stosuje się
najczęściej sztucznie otrzymane związki jak tlenek chromowy Cr
2
O
3
oraz chromiany
i dwuchromiany potasu i sodu. Związki te uzyskuje się z rud chromu, głównie chromitu
FeO Cr
2
O
3
.
Tlenek chromowy Cr
2
O
3
jest ciemnozielonym proszkiem nierozpuszczalnym w wodzie,
kwasach i alkaliach. Stapiany z substancjami utleniającymi np. azotanami przechodzi
w chromiany.
Dwuchromian potasowy K
2
Cr
2
O
7
barwy pomarańczowej i chromian potasowy K
2
CrO
4
barwy
żółtej są substancjami łatwo rozpuszczalnymi w wodzie.
Chromian i dwuchromian sodowy mają podobne właściwości jak sole potasowe lecz jako
higroskopijne i tworzące hydraty o zmiennej zawartości wody rzadko są stosowane.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
Związki manganu
Wprowadzane są do zestawu w celu zabarwienia szkła na fioletowo, jak też dla usunięcia
zabarwienia spowodowanego obecnością żelaza, przez wytworzenie barwy dopełniającej.
Najczęściej stosowany jest w tym celu dwutlenek manganu MnO
2
zwany braunsztynem.
Jako ruda występuje również manganit Mn
2
O
3
· H
2
O. Sztucznie braunsztyn otrzymywany jest
przez prażenie azotanu manganawego, powinien zawierać nie mniej niż 90% MnO
2
.
Rzadziej stosowany jest nadmanganian potasowy KMnO
4
, substancja tworząca kryształy
barwy szarofioletowej. Nadmanganian potasowy rozpuszcza się w wodzie z zabarwieniem
fioletowym. W temperaturze ok. 200°C rozkłada się wydzielając manganian potasowy
K
2
MnO
4
barwy zielonej, dwutlenek manganu i tlen. Ma właściwości silnie utleniające.
Związki niklu
Związki niklu. Wprowadzają do szkła jon niklawy Ni
2+
powodujący zabarwienie fioletowe,
choć można uzyskać również inne barwy. Stosowane są w tym celu najczęściej otrzymywane
chemicznie z rud niklowych tlenek niklawy – NiO i tlenek niklowy - Ni
2
O
3
. Mogą być również
używane wodorotlenek niklawy – Ni(OH)
2
i węglan niklawy – NiCO
3
.
Tlenek niklawy NiO jest proszkiem barwy szarozielonej nierozpuszczalnym w wodzie, trudno
topliwym (2090°C). Rozpuszcza się w kwasach z wytworzeniem odpowiednich soli niklawych
mających w roztworze barwę zieloną.
Tlenek niklowy – Ni
2
O
3
barwy szaroczarnej, ogrzany do temperatury powyżej 600°C rozkłada
się z wydzieleniem tlenu.
Związki kobaltu
Związki kobaltu. Powodują zabarwienie szkła na ciemnoniebiesko. Stosowane są również
do odbarwiania szkła poprzez wygaszanie barwy żółtej pochodzącej od jonów Fe
3+
.
Najczęściej stosowany jest tlenek kobaltawy CoO
Tlenek kobaltawy jest proszkiem barwy szarozielonej, trudno topliwym, nierozpuszczalnym
w wodzie. Reaguje z kwasami tworząc odpowiednie sole. Stosowane są również tlenek
kobaltowy Co
2
O
3
, brunatnoczarny. Rzadziej stosowane są: węglan, fosforan i arsenian
kobaltawy.
Związki miedzi
Związki miedzi. Barwią szkło na niebiesko lub czerwono (rubin miedziowy). Jako surowiec do
barwienia masy szklanej stosowany jest. najczęściej tlenek miedziowy CuO i znacznie rzadziej
siarczan miedziowy CuSO
4
· 5H
2
O. Oba związki otrzymuje się w wyniku przeróbki chemicznej
rud miedzi.
Tlenek miedziowy CuO jest czarnym proszkiem nierozpuszczalnym w wodzie a łatwo
wchodzącym w reakcje z kwasami. Powstają odpowiednie sole miedziowe.
Siarczan miedziowy krystalizuje z roztworów wodnych w postaci hydratu CuSO
4
·5H
2
O barwy
niebieskiej. Przez wyprażenie następuje wydzielenie wody krystalizacyjnej i powstaje
bezwodny siarczan miedziowy w postaci białego proszku.
Związki selenu
Selen i jego związki. Selen Se oraz seleniny np. selenin sodowy Na
2
SeO
3
, cynkowy
ZnSeO
3
, barowy BaSeO
3
wywołują czerwone zabarwienie szkła. Stosowane są również do
odbarwiania szkła (najczęściej w zestawie z kobaltem).
Jako surowca szklarskiego używa się selenu szarego, zwanego metalicznym.
Jest to szary proszek o temperaturze topnienia 220° C, wrze w temperaturze 688°C
a po zestaleniu pary tworzy czerwoną odmianę. Selen spala się w powietrzu z niebieskim
płomieniem tworząc dwutlenek selenu SeO
2
, który rozpuszcza się w wodzie dając słaby kwas
selenawy H
2
SeO
3
. Po rozcieńczeniu wodą powstaje koloidalny selen czerwony.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
Związki antymonu
Związki antymonu. Używa się je do barwienia szkła na czerwono. Jako surowiec
stosowany jest przeważnie trójtlenek antymonu Sb
2
O
3
(stosowany razem z siarką), rzadziej
inne związki np. siarczki. Trójtlenek antymonu (tlenek antymonawy) otrzymywany jest
chemicznie z przeróbki występującego w przyrodzie antymonitu Sb
2
S
3
, ciemnego łatwo
topliwego minerału. Tlenek Sb
2
S
3
jest białym proszkiem, źle rozpuszczalnym w wodzie.
Związki kadmu
Związki kadmu. Stosowany najczęściej bywa siarczek kadmowy CdS barwiący szkło na
kolor żółty. Jest to żółty proszek otrzymywany chemicznie z metalicznego kadmu
uzyskiwanego jako produkt uboczny przy przeróbce rud cynkowych.
Związki tytanu
Używany w zestawieniu z innymi tlenkami np. cerowym CeO
2
dwutlenek tytanu TiO
2
wywołuje w szkle barwę żółtą. Dwutlenek tytanu (tlenek tytanowy) zwany niekiedy bielą
tytanową uzyskiwany jest w wyniku przeróbki chemicznej minerałów głównie ilmenitu
FeOTiO
2
oraz rutylu TiO
2
. Dwutlenek tytanu jest białym proszkiem nierozpuszczalnym
w wodzie, w kwasach oraz w zasadach.
Związki srebra
Stosowany bywa najczęściej azotan srebrowy AgNO
3
wywołujący, w wyniku tworzenia
w szkle zawiesiny metalicznego srebra, barwę żółtą. Rzadziej używany jest chlorek srebrowy
AgCl. Azotan srebrowy jest substancją w postaci bezbarwnych kryształów ciemniejących przy
dłuższym naświetlaniu w wyniku rozkładu i wydzielania metalicznego srebra. Jest dobrze
rozpuszczalny w wodzie.
Związki siarki
Siarki elementarnej nie stosuje się do produkcji szkieł użytkowych. Znaczenie ma siarka
występująca w postaci siarczków. W praktyce przy współdziałaniu ze związkami żelaza nadaje
ona szkłu barwę od żółtej do brunatnej. Dla wyraźnego zabarwienia szkła wystarczą te ilości
siarki i żelaza, które jako zanieczyszczenia występują w surowcach szklarskich. Topienie szkła
musi odbywać się w warunkach redukcyjnych. Rolę środka redukującego spełniają substancje
zawierające węgiel.
FeS powoduje powstawanie brudnych odcieni szkła. Jego działanie zwiększa się przy
większej zawartości żelaza w szkle lub w szkłach niskoalkalicznych. Przy produkcji brązowych
szkieł barwionych siarką stosuje się zwiększoną ilość alkaliów. Część Na
2
O wprowadzana jest
do zestawu w postaci siarczanu. Równocześnie stosowany jest dodatek węgla lub grafitu.
Jako surowiec wprowadzający siarkę stosuje się sulfat. Jako środki redukujące – koks lub
grafit. Używa się także innych substancji organicznych, np. trocin lub mąki. Mają one różny
skutek barwienia, co wynika raczej z różnic w równomiernym ich rozdziale w zestawie.
Związki złota
Związki złota służą do wytwarzania szkieł o barwie czerwonopurpurowej. Jest to tzw.
złoty rubin. Zabarwienie szkła polega na koloidalnym rozproszeniu złota metalicznego w szkle.
Złoto rozpuszcza się w szkle w małych ilościach tworząc roztwór pyrozolowy. Po ostygnięciu
szkła powstaje roztwór przesycony i tworzy się duża ilość zarodków krystalicznych. Zbyt duża
lepkość szkła nie pozwala na tworzenie się kryształków tworzących barwę. Dopiero przy
powtórnym ogrzaniu szkła następuje wzrost kryształków i wystąpienie barwy. Przeważnie
wytwarza się złoty rubin ołowiowy, zawierający 32 ÷ 42% PbO. Takie szkło powoduje
korzystne powstawanie barwy w dłuższym czasie i w niższych temperaturach, przy tym
zużywa się o połowę mniej złota aniżeli w szkłach bezołowiowych. Jako surowiec stosuje się
chlorek złotowy.
Chlorek złotowy AuCl
3
otrzymuje się przez rozpuszczenie złota w wodzie królewskiej lub
przez działanie chloru na złoto w temp. 300°C w rurze kwarcowej. Chlorek złotowy jest

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
substancją krystaliczną o temp. topnienia 288°C. Jest silnie higroskopijny. W handlu spotyka
się go w ampułkach po 1 g. Zawiera 50 ÷ 58% Au.
Ziemie rzadkie
Ziemie rzadkie stosuje się w produkcji szkła dla osiągnięcia następujących celów:
1) charakterystycznego zabarwienia szkła,
2) odbarwiania wysokojakościowych szkieł,
3) produkcji szkieł o specjalnych własnościach fizycznych i optycznych.
Największe znaczenie mają związki ceru i neodymu.
Związki ceru
Związki ceru. Stosuje się związki ceru nie tylko do barwienia szkła, ale i do odbarwiania.
Cer barwi szkło żółto i brązowo w zależności od stężenia tlenku cerowego CeO
2
.
W szkle nie zawierającym ołowiu 3,5% CeO
2
powoduje powstanie żółtego zabarwienia
z odcieniem czerwonym. W wyższych temperaturach CeO
2
rozkłada się z wydzieleniem tlenu i
zabarwienie szkła zmniejsza się. Barwa szkieł cerowych jest bardzo wrażliwa na związki
żelaza, gdyż tlenek cerowy utlenia FeO na Fe
2
O
3
i sam przechodzi w odmianę bezbarwną.
Dlatego szkła barwione cerem nie powinny zawierać dużo żelaza, a z drugiej strony -
własności te wykorzystuje się do odbarwiania szkieł.Tlenek cerowy ma znaczenie dla
wytwarzania szkieł o specjalnych własnościach fizycznych i optycznych. Bezbarwne szkła
zawierające 2 ÷ 4% tlenku cerawego Ce
2
O
3
selektywnie pochłaniają promienie nadfioletowe.
Służy również do wytwarzania szkieł okularowych, chroniących wzrok przed promieniami
nadfioletowymi.
Tlenek cerowy CeO
2
, tworzy w stanie czystym biały proszek. Techniczny tlenek cerowy
zawiera do 99,5% CeO
2
. Często bywa zanieczyszczony innymi ziemiami rzadkimi i ma barwę
od żółtej do brunatnej.
Związki neodymu
Związki neodymu. Stosuje się je przede wszystkim do wytwarzania szkieł
o bardzo pięknych efektach barwnych. Szkła barwione neodymem wykazują oryginalną
przepuszczalność promieni świetlnych. Mają one barwę fioletową, ale złożoną z promieni
fioletowych, niebieskich, czerwonych, a ponadto przepuszczają wąskie pasmo promieni
żółtozielonych, dla których barwa fioletowa jest dopełniającą. Jest to przyczyną występowania
zjawiska dwoistości barwy lub mienienie się barwy tzw. dichroizm. Tlenek neodymu jest
barwnikiem mało intensywnym i wymaga użycia go w ilości 4 ÷ 10 kg na 100 kg szkła.
Tlenek neodymowy Nd
2
O
3
ma barwę niebieskoróżową. W praktyce stosuje się jego sole.
Surowce mącące masę szklaną
Środki mącące wytwarzają w szkle zawiesinę krystalicznych lub koloidalnych cząstek
rozpraszających światło a przez to czyniących szkło nieprzejrzystym. W tym celu używa
się związków fluoru jak fluorytu CaF
2
, kriolitu Na
3
[AlF
6
], fluorokrzemianu sodowego
Na
2
[SiF
6
], związków fosforu, głównie fosforytu Ca
3
(PO
4
)
2
, rzadziej inne surowce np. talk
3MgO·4SiO
2
H
2
O, tlenek cynowy SnO
2
.
Związki fluoru
Fluoryt - fluorek wapniowy CaF
2
. Jest minerałem występującym w skupieniach ziarnistych
a niekiedy w postaci dużych kryształów o różnym zabarwieniu. Kryształy te są kruche,
o połysku szklistym, twardość 4. Po oczyszczeniu i rozdrobnieniu stanowi białą lub kremową
mączkę. Jest trudno topliwy - 1360°C, barwi płomień na ceglasto. W wodzie nie rozpuszcza
się, kwas siarkowy rozkłada go z wydzieleniem fluorowodoru łatwego do wykrycia poprzez
trawienie szkła.
Kriolit Na3[AlF
6
] lub 3NaF • AlF
3
- fluoroglinian sodowy, jest minerałem kruchym,
niełupliwym, o twardości 3,5 w skali Mohsa o połysku szklistym lub perłowym. Wykazywać
może różne zabarwienie, w postaci drobnych kryształów tworzy zbitą masę barwy białej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
Po zmieleniu czystego kriolitu powstaje biały proszek o masie nasypowej 1,8 kg/dm
3
.
Ponieważ naturalny kriolit występuje w niewielkich ilościach, wytwarza się go syntetycznie.
Syntetyczny kriolit ma dwukrotnie mniejszą masę nasypową od kriolitu naturalnego. W czasie
ogrzewania do temperatury 1020°C kriolit stapia się w płomieniu palnika na białą perłę. Kriolit
nie rozpuszcza się w wodzie. Nieznaczną rozpuszczalność wykazuje kriolit sztuczny, przy
czym roztwór posiada odczyn kwaśny lub zasadowy.
Fluorokrzemian sodowy Na
2
[SiF
6
] - występuje w postaci białego proszku źle
rozpuszczającego się w wodzie. W czasie ogrzewania rozkłada się wydzielając czterofluorek
krzemu SiF
4
. Rozkłada się pod wpływem stężonego kwasu siarkowego, wydzielający się przy
tym fluorowodór może trawić szkło:
Na
2
[SiF
6
] + H
2
SO
4
→ Na
2
SO
4
+ ↑SiF
4
+ 2HF
Związki fosforu
Są to skały osadowe przeważnie pochodzenia organicznego, zawierające jako główny
składnik fosforan trójwapniowy Ca
3
(PO
4
)
2
. Są zanieczyszczone wieloma składnikami jak
kwarcem, kalcytem, itp. Zawierając w swym składzie fluor, chlor, noszą nazwę apatytów.
Fosforan wapniowy Ca
3
(PO
4
)
2
(dokładnie ortofosforan trójwapniowy) w stanie czystym
uzyskuje się w wyniku przeróbki chemicznej surowców naturalnych. Jest to biały proszek
nierozpuszczalny w wodzie.
Talk
Jest krzemianem magnezowym 3MgO • SiO
2
• H
2
O. Powstał jako produkt przeobrażenia
krzemianów magnezowych ubogich w tlenek glinowy. Talk występuje najczęściej w postaci
skupień blaszkowatych o różnej barwie lub w postaci zbitej masy barwy białej. Jest bardzo
miękki, w dotyku tłusty, o połysku perłowym. Talk nie rozpuszcza się w wodzie ani
w kwasach, z wyjątkiem kwasu fluorowodorowego. Topi się w temperaturze 1500°C.
Tlenek cynowy
Jako surowiec stosowany jest tlenek cynowy otrzymywany przez utlenianie metalicznej
cyny w wysokiej temperaturze. Jest to biały proszek topiący się w temperaturze 1127°C,
nierozpuszczalny w wodzie, jak również w roztworach kwasów i zasad.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jaką rolę pełnią w procesie topienia masy szklanej surowce klarujące?
2. Jakie grupy związków należą do pomocniczych w procesie topienia masy szklanej?
3. Jakie własności posiadają saletry?
4. Jaka jest reakcja rozkładu termicznego sulfatu?
5. Jakie związki stosowane są do mącenia masy szklanej?
6. Jakie pierwiastki chemiczne występują w surowcach barwiących masę szklaną?
7. Jakie związki barwią szkło na żółto?
8. Jakie związki niklu stosuje się jako surowce barwiące?
9. W jakim celu stosowany jest przy topieniu szkła dwutlenek manganu (brausztyn)?
10. Jak można wyjaśnić pojęcie dwoistości barwy podczas barwienia masy szklanej?
11. Jakie związki barwią szkło na zielono?
12. Jaki związek barwiący masę szklaną zastosujesz, aby uzyskać złoty rubin?
13. Jakich związków barwiących należy użyć, aby zabarwić szkło na kolor czerwony?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
4.3.3. Ćwiczenia
Ćwiczenie 1
Przyporządkuj barwę otrzymaną w szkle do surowców szklarskich które wywołują
określony odcień barwy szkła.
Tabela do ćwiczenia 1.
A.
1.
dwutlenek manganu (brausztyn)
B.
2.
tlenek kobaltu
C.
3.
siarczek kadmu
D.
4.
selen metaliczny
E.
5.
dwuchromian potasu
F.
6.
tlenek ceru
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców barwiących szkło,
2) dokonać analizy treści,
3) przyporządkować barwę do surowców barwiących na określony kolor.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
karty z załączoną tabelą,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
Ćwiczenie 2
Zapisz, surowce mącące masę szklaną.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców mącących masę
szklaną,
2) dokonać analizy treści,
3) zapisać związki mącące masę szklaną i krótko scharakteryzować.
Wyposażenie stanowiska pracy:
−
papier formatu A4, pisaki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 3
Dla podanych w tabeli surowców szklarskich zapisz ich symbol chemiczny oraz określ
przeznaczenie.
Tabela do ćwiczenia 3.
Nazwa surowca szklarskiego
Symbol chemiczny
Przeznaczenie
surowca szklarskiego
1. Brausztyn
2. Azotan potasu
3. Tlenek neodymu
4. Azotan srebra
5. Kriolit
6. Salmiak
7. Tlenek niklu
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące surowców mącących masę
szklaną,
2) dokonać analizy treści,
3) zapisać związki mącące masę szklaną i krótko scharakteryzować.
Wyposażenie stanowiska pracy:
−
przybory do pisania,
−
karty z załączoną tabelą,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić role, jaką pełnią w procesie topienia masy szklanej surowce
klarujące?
2) wymienić grupy związków stosowanych jako pomocnicze w procesie
topienia masy szklanej?
3) określić właściwości saletr jako surowców klarujących masę szklaną?
4) zapisać reakcję rozkładu termicznego sulfatu?
5) rozpoznać związki mącące masę szklaną?
6) rozpoznać pierwiastki chemiczne występujące w surowcach
barwiących masę szklaną?
6) wymienić surowce barwiące szło na kolor żólty?
7) rozpoznać związki niklu barwiące masę szklaną?
9) określić, w jakim celu stosowany jest dwutlenek manganu w procesie
topienia masy szklanej ?
8) wyjaśnić pojęcie dwoistości barwy podczas barwienia masy szklanej?
9) rozpoznać surowce barwiące szło na kolor zielony?
10) rozpoznać związki barwiące szkło na kolor czerwony?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań. Do każdego zadania dołączone są 4 możliwości odpowiedzi.
Tylko jedna jest prawidłowa.
5. Udzielaj odpowiedzi na załączonej karcie odpowiedzi, stawiając w odpowiedniej rubryce
znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową.
6. Zadania wymagają stosunkowo prostych obliczeń, które powinieneś wykonać przed
wskazaniem poprawnego wyniku.
7. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcje z wykonania zadania.
8. Jeżeli udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
9. Na rozwiązanie testu masz 60 minut.
Powodzenia!
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
ZESTAW ZADAŃ TESTOWYCH
1. Soda, potaż, dolomit rozkładając się pod wpływem temperatury wydzielają
a) dwutlenek węgla.
b) tlen.
c) tlenek siarki.
d) azot.
2. Tlenki, wprowadzane do masy szklanej przez dolomit, to
a) Na
2
O i Li
2
O.
b) MgO i CaO.
c) PbO i Pb
3
O
4
.
d) ZnO i BaO.
3. Schemat przedstawia krzemiany
a) wstęgowe.
b) warstwowe.
c) łańcuchowe.
d) pierścieniowe.
4. Związek o wzorze chemicznym Na
4
[SiO
4
], to
a) ortokrzemian sodu.
b) skaleń potasowy.
c) skaleń sodowy.
d) krzemionka.
5. Fluoryt jest stosowany w technologii topienia masy szklanej do
a) klarowania.
b) barwienia.
c) mącenia.
d) odbarwiania.
6. Dodając do zestawu CdS, zabarwimy szkło na kolor
a) niebieski.
b) zielony.
c) żółty.
d) czerwony.
7. Tlenek glinu do zestawu szklarskiego wprowadza
a) dolomit.
b) skaleń.
c) potaż.
d) baryt.
8. Surowiec podstawowy stosowany do topienia masy szklanej to
a) minia ołowiowa.
b) siarczan baru.
c) chlorek sodu.
d) azotan potasu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
56
9. Nazwa handlowa siarczanu sodu, to
a) glejta.
b) saletra.
c) kreda.
d) sulfat.
10. Spośród wymienionych surowców, rozpuszczalny w wodzie jest
a) minia ołowiowa.
b) saletra potasowa.
c) biel cynkowa.
d) węglan barowy.
11. Rysunek przedstawia mechanizm powstawania wiązańia
a) jonowego w cząsteczce wodoru.
b) kowalencyjnego w cząsteczce wodoru.
c) kowalencyjnego spolaryzowanego w cząsteczce wodoru.
d) kowalencyjnego spolaryzowanego w cząsteczce chlorowodoru.
12. Tlenki metali, które reagują z kwasami i z zasadami dając sole, to tlenki
a) zasadowe.
b) amfoteryczne.
c) kwasowe.
d) obojętne.
13. Do produkcji szkła kryształowego bezbarwnego zastosujesz minię ołowiową
a) I gatunku.
b) II gatunku.
c) III gatunku.
d) baz określenia gatunku.
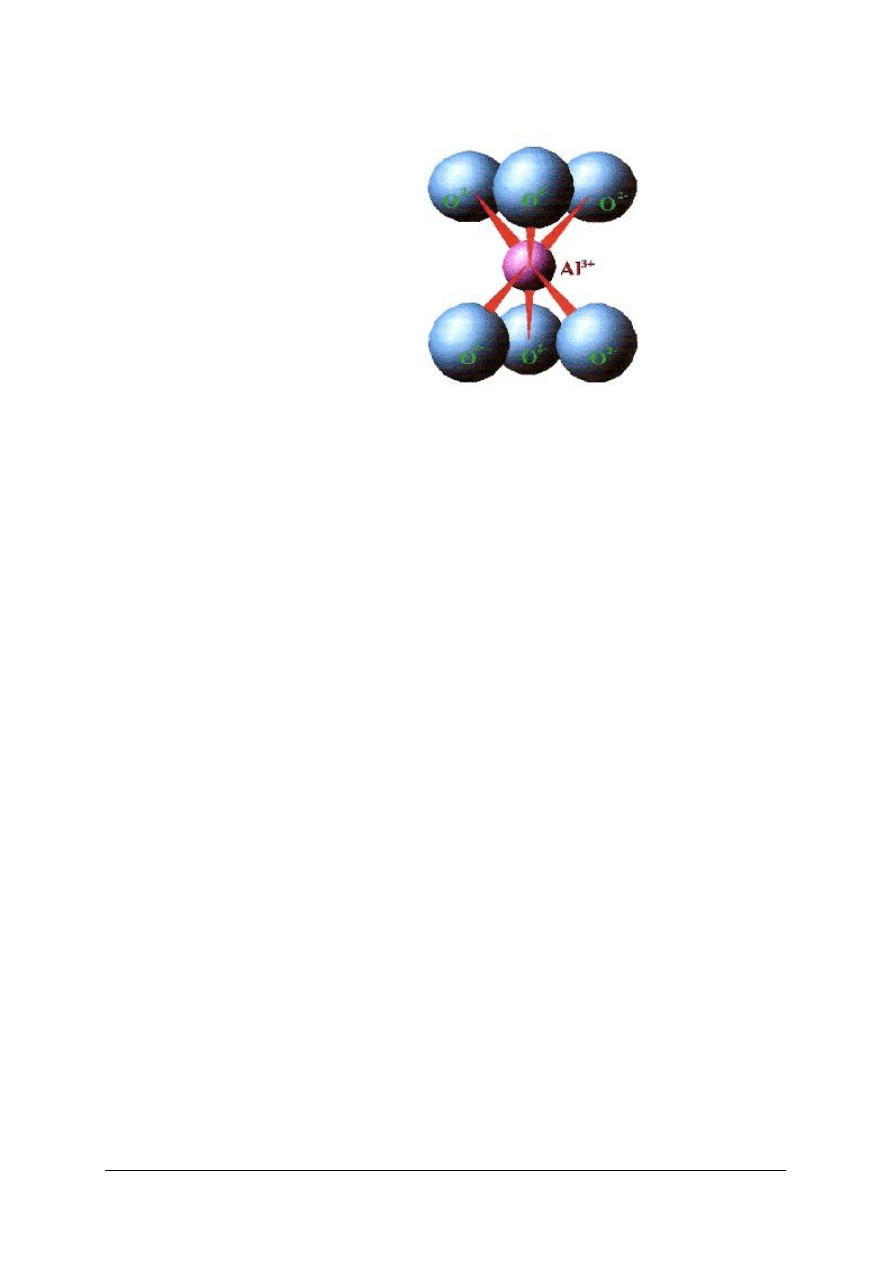
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
57
14. Rysunek przedstawia komórkę strukturalną krzemu o wzorze
a) [SiO
4
]
4‾
.
b) [AlO
6
]
9‾
.
c) [Si
3
O
9
]
6-
.
d) [AlO
6
]
4-
.
15. Dwutlenek manganu wprowadza się do szkła w celu
a) przyspieszenia topienia.
b) zabarwienia masy szklanej na fioletowo.
c) oczyszczenia masy szklanej z pęcherzy.
d) zabarwienia masy szklanej na czerwono.
16. Surowce należące do podstawowych, to
a) potaż, saletra sodowa, skaleń, wapień.
b) sulfat, węglan baru, piasek szklarski, potaż.
c) wapień, dolomit, boraks, minia ołowiowa.
d) dolomit, sulfat, piasek szklarski, soda.
17. Surowcem szklarskim powodującym niszczenie naskórka i błon śluzowych nosa, gardła,
oczu jest:
a) soda.
b) minia.
c) dolomit.
d) baryt.
18. Surowiec podstawowy zawierający w składzie chemicznym: SiO
2
, Al
2
O
3
, Li
2
O, to
a) biel cynkowa.
b) spodumen.
c) minia ołowiowa.
d) biel tytanowa.
19. Spośród poniższych, surowiec naturalny, to
a) biel cynkowa.
b) soda.
c) minia ołowiowa.
d) skaleń.
20. Kriolit wprowadzony do masy szklanej, spowoduje
a) zwiększenie twardości szkła.
b) zmianę barwy szkła.
c) zmniejszenie gęstości szkła.
d) zamącenie szkła.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
58
KARTA ODPOWIEDZI
Imię
i
nazwisko.............................................................................................................................
Określanie właściwości surowców szklarskich
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
59
6. LITERATURA
1. Dobrzański S., Żołędziowski W.: Materiałoznawstwo szklarskie i ceramiczne.WSiP,
Warszawa 1978
2. Drapała T.: Chemia fizyczna.PWN, Warszawa 1982
3. Kluz Z., Poźniczek M.: Chemia dla szkół ponadgimnazjalnych. ZamKor, Kraków 2003
4. Litwin M., Styka-Wlazło S., Szymońska J.: Chemia ogólna i nieorganiczna. Nowa Era,
Warszawa 2002
5. Litwin M., Styka-Wlazło S., Szymońska J.: Chemia organiczna. Nowa Era, Warszawa
2004
6. Nowotny W.: Technologia szkła cz.2.WSiP, Warszawa 1974
7. Nowotny W.: Technologia szkła cz.1.WSiP, Warszawa 1975
8. Pampuch R., Stoch L.: Technologia szkła. Właściwości fizykochemiczne szkła. Polskie
Towarzystwo Ceramiczne, Kraków 2002
9. Płoński I.(red.):Technologia szkła. Arkady, Warszawa 1972
10. Poźniczek M., Kluz Z.: Chemia. WSiP, Warszawa 2002
11. Szeromski T., Włodarczyk R.: Pracownia chemiczna. WSiP, Warszawa 1977
12. www.dami.pl
13. Ziemba B.(red.): Technologia szkła 1. Wydawnictwo Arkady, Warszawa1987
Wyszukiwarka
Podobne podstrony:
04 Określanie właściwości surowców i materiałów
Określenie właściwości surowca rybnego
04 Określanie właściwości surowców i skór
Określanie właściwości surowców i skór wyprawionych do produkcji obuwia
Cw 07 E 01 Badanie właściwości elektrycznych kondensatora pł
Określanie właściwości skór, tworzyw sztucznych i skóropodobnych stosowanych w tapicerstwie
InstrukcjeĆw.2009 2010, Cw.1.E-01. Badanie właściwości elektrycznych kondensatora płaskiego, Laborat
3 Okreslanie wlasciwosci uklado Nieznany
02 Okreslanie wlasciwosci mater Nieznany (2)
04 Okreslanie wlasciwosci akust Nieznany
Instrukcja B, Poniedziałek - Materiały wiążące i betony, 04. (27.10.2011) Ćw B - Badanie właściwości
STALI O OKREŚLONYCH WŁAŚCIWOŚCIACH FIZYCZNYCH I CHEMICZNYCH - Lab 10, Studia, Materiałoznastwo, Meta
OKREŚLENIE WŁAŚCIWOŚCI TRAKCYJNYCH POJAZDÓW SAMOCHODOWYCH
Instrukcja F, Poniedziałek - Materiały wiążące i betony, 10. (08.12.2011) Ćw F - Badanie właściwości
09 Okreslanie wlasciwosci biolo Nieznany (2)
02 Określanie właściwości drewna
02 Okreslanie wlasciwosci mater Nieznany
311[15] O1 02 Okreslanie wlasci Nieznany
więcej podobnych podstron