
2008
Testy z chemii 1
h t t p : / / w w w . c h e m i a . s o s . p l
Odpowiedzi do testów
Krzysztof G
ę
bicki

Osoby zamierzające studiować
medycynę muszą zdawać maturę
na poziomie rozszerzonym. Testy
zwarte w tym arkuszu (100 pytań
testowych), wraz z omówionymi
dokładnie odpowiedziami
umożliwią solidne przygotowanie
się do matury z chemii.
Do test
ów dołączony jest arkusz
odpowiedzi, oraz arkusz
poprawnych odpowiedzi, dzięki
któremu w łatwy i szybki sposób
możesz skontrolować swoją
wiedzę.
Rozwiązania informatyczne
Pomoc i korepetycje z chemii,
przygotowanie do matury
rozszerzonej z chemii
Chemia SOS- pomoc i korepetycje z chemii
Omówione odpowiedzi do zestawu 100 pytań, oraz
kartę odpowiedzi możesz otrzymać w cenie 2 zł
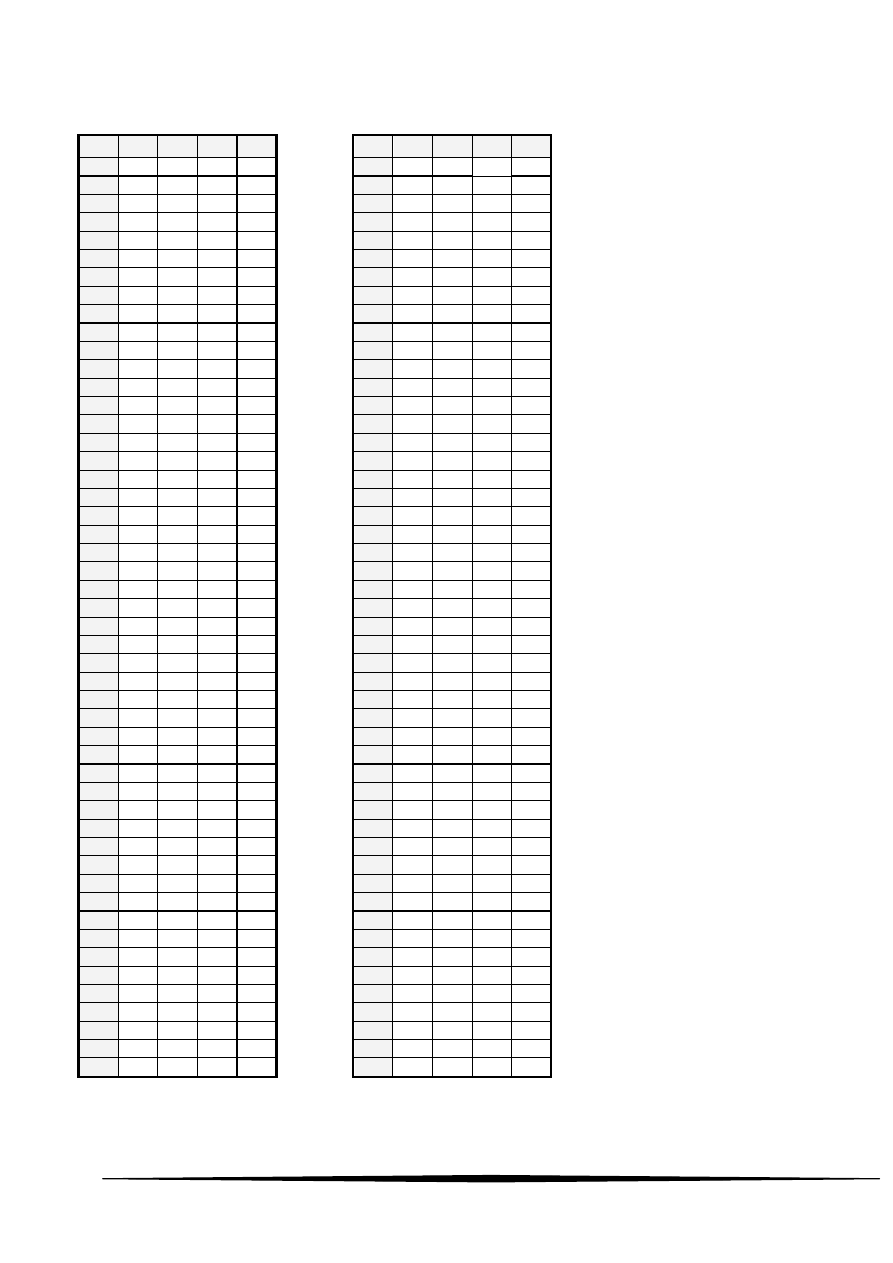
- 1 -
Karta odpowiedzi
A
B
C
D
A
B
C
D
1
51
2
52
3
53
4
54
5
55
6
56
7
57
8
58
9
59
10
60
11
61
12
62
13
63
14
64
15
65
16
66
17
67
18
68
19
69
20
70
21
71
22
72
23
73
24
74
25
75
26
76
27
77
28
78
29
79
30
80
31
81
32
82
33
83
34
84
35
85
36
86
37
87
38
88
39
89
40
90
41
91
42
92
43
93
44
94
45
95
46
96
47
97
48
98
49
99
50
100
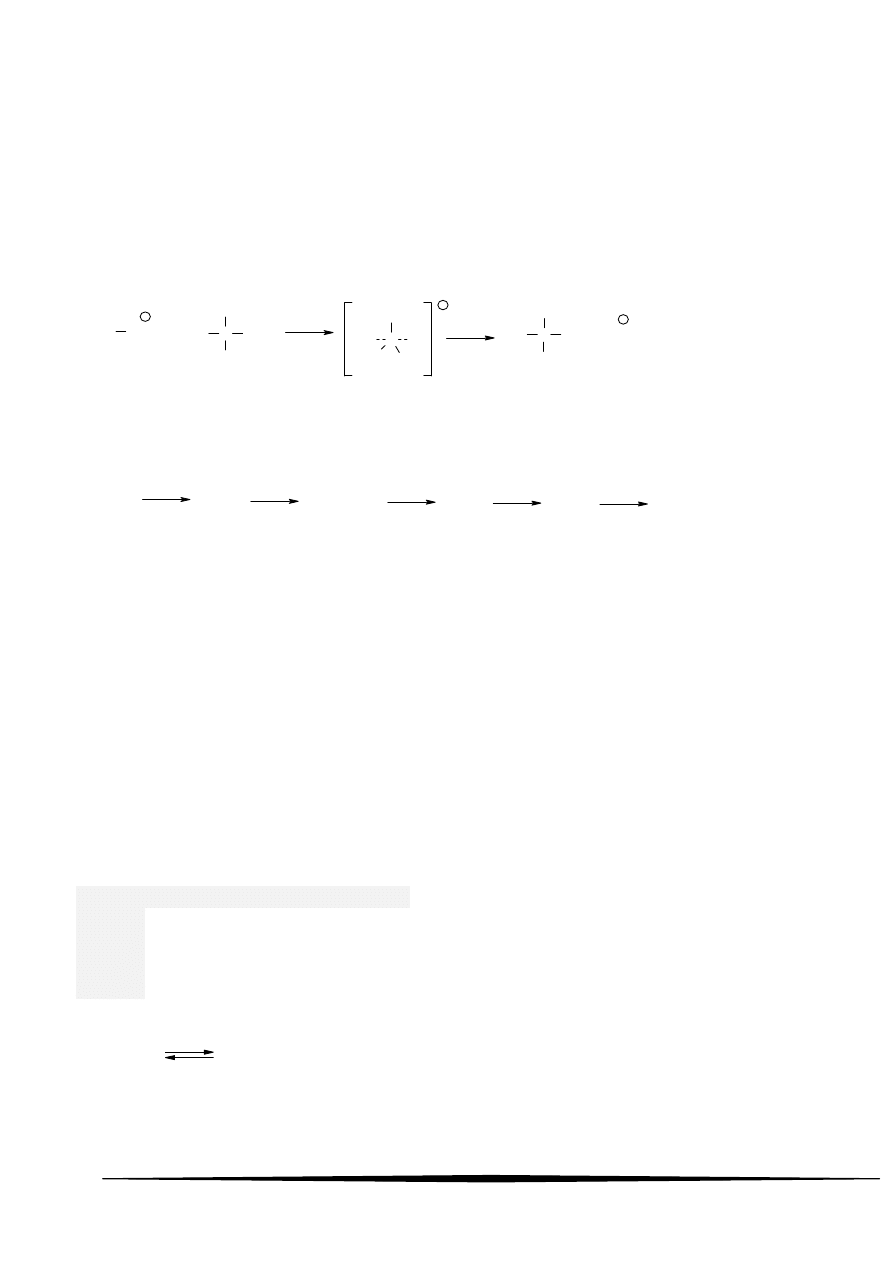
- 2 -
1 Reakcje katalitycznego bromowania benzenu i nitrowania benzenu są przykładami reakcji
elektrofilowego podstawienia aromatycznego. Odczynnikami elektrofilowymi w reakcjach są:
w reakcji bromowania
w reakcji nitrowania
A
Br
-
NO
3
-
B
Br
2
NO
2
C
Br
+
HSO
4
-
D
Br
+
NO
2
+
2 Poniższy schemat przedstawia mechanizm reakcji:
H O
-
C
H
3
C
H
H
Cl
>
CH
3
C
H
H
O
H
Cl
-
CH
3
C
O
H
H
H
-
..
..:
+
+ Cl
: :
..
..
A podstawienia nukleofilowego
B podstawienia elektrofilowego
C eliminacji
D kondensacji
3 Wskaż w poniższym szeregu reakcje podstawienia:
eten
etanol
bromoetan
etanol
etanal
kwas octowy
1
2
3
4
5
A 1, 2, 3
B 2, 3
C 4, 5
D 2, 3, 4
4 W wyniku reakcji addycji 2 moli cząsteczek bromowodoru do 1 mola cząsteczek propynu zgodnie z
regułą Markownikowa otrzymano:
A 1,1-dibromopropan
B 1,2-dibromopropan
C 1,3-dibromopropan
D 2,2-dibromopropan
5 4 gramy pewnego metalu wypiera z kwasu solnego 2,24dm
3
wodoru w warunkach normalnych i
powstaje chlorek, w którym metal jest dwudodatni. Masa atomowa tego pierwiastka wynosi:
A 20g
B 20u
C 40g
D 40u
6 Przygotowano roztwory wodne trzech substancji:
1 7,5g KNO
3
i 30g wody
2 125g 20# CaCl
2
i 125g wody
3 155cm
3
30% KOH o gęstości 1,29g/cm
3
i 400g wody;
Wskaż prawidłowo obliczone stężenia procentowe roztworów.
1
2
3
A
20% 17%
13%
B
20% 10%
10%
C
25% 20%
13%
D
20% 20%
10%
7 W pewnym doświadczeniu reakcja:
A
2
+ B
2
2AB
osiągnęła stan równowagi. Początkowe stężenia substratów były jednakowe. Przereagowało 80%
substancji A. Stała równowagi reakcji w warunkach doświadczenia wynosiła:
A 16
B 32
C 40
D 64

- 3 -
8 18-procentowy roztwór chlorku sodu krzepnie w temperaturze –14
o
C, a 18-procentowy roztwór
sacharozy w temperaturze –1,3
o
C. Różnice temperatur krzepnięcia obu roztworów wynikają z tego, że:
A chlorek sodu jest solą, a sacharoza węglowodanem
B rozpuszczalność chlorku sodu w wodzie jest większa niż rozpuszczalność sacharozy
C sacharoza ulega hydrolizie, a chlorek sodu nie ulega hydrolizie
D liczba moli jonów w 18% roztworze NaCl jest większa niż liczba moli cząsteczek sacharozy w
roztworze o takim samym stężeniu.
9 Jeżeli podziałamy kwasem solnym na miedź bez dostępu powietrza to:
A nie zajdzie żadna reakcja chemiczna
B miedź ulegnie pasywacji
C powstaną jony miedzi dwudodatniej i wydzieli się tlenek chloru
D powstanie tlenek miedzi(I), który następnie utleni się do tlenku miedzi(II)
10 Wskaż stopień utlenienia azotu w tlenku, w którym stosunek masowy azotu do tlenu wynosi 1,75:1
A +I
B +II
C +III
D +IV
11 W ilu gramach tlenku azotu(II) znajduje się tyle samo gramów azotu, co w jednym molu azotanu(V)
amonu?
A 28g
B 30g
C 60g
D 108g
12 Na całkowite rozpuszczenie mieszaniny magnezu i tlenku magnezu zużyto 272,9cm
3
15% roztworu
kwasu solnego o gęstości 1,07g/cm
3
i otrzymano 8,96dm
3
gazu (warunki normalne). Do reakcji użyto:
A 0,4 mola magnezu i 0,4mola tlenku magnezu
B 9,6g magnezu i 1,2
.
10
24
cząsteczek tlenku magnezu
C 9,6g magnezu i 8g tlenku magnezu
D 2,4
.
10
23
atomów magnezu i 2,4
.
10
23
cząsteczek tlenku magnezu
13 Podczas reakcji 3,25g cynku z siarką wydzieliło się 19,15kJ energii na sposób ciepła. Entalpia
tworzenia siarczku cynku wynosi:
A –203kJ/mol
B –101kJ/mol
C –20,3kJ/mol
D 203kJ/mol
14 Wydajność reakcji:
2H
2
S
(g)
+ 3O
2(g)
= 2SO
2(g)
+ 2H
2
O
(c)
ΔH=-1106kJ/mol
wzrośnie jeżeli:
1. ogrzejemy układ
2. zmniejszymy stężenie tlenku siarki(IV)
3. odprowadzimy wodę z układu
4. zwiększymy ciśnienie
5. zmniejszymy ciśnienie
6. wprowadzimy katalizator
Prawdziwe zdanie powstaje, gdy zostaną zachowane warunki:
A 2, 3, 4
B 1, 5, 6
C 1, 3, 5
D 2, 4, 6
15 Do 6,32g KMnO
4
dodano stężony kwas solny. Wydzielający się gaz zbierano w 298K i pod
ciśnieniem 1013hPa. Otrzymano:
A 2,24dm
3
chloru
B 0,109mola chloru
C 2,44dm
3
chloru
D prawidłowe są odpowiedzi B i C
- 4 -
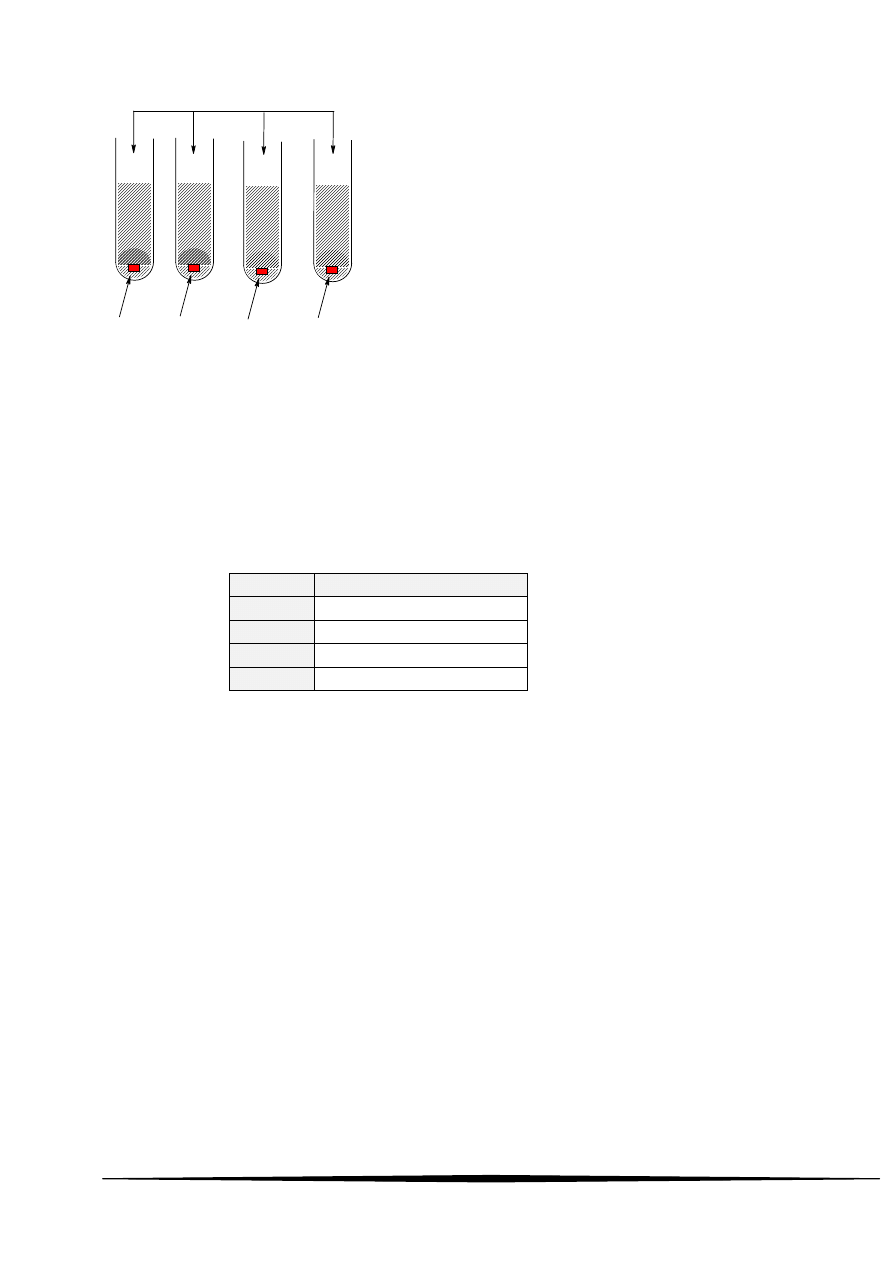
16 Wykonano doświadczenie według schematu:
nadmiar kwasu solnego o stężeniu 0,1M
1g Zn
1g Cu
1g Mg
1g Fe
I
II
III
IV
Stwierdzono, że:
A reakcje zaszły we wszystkich probówkach, a w probówce III wydzieliła się największa objętość
wodoru
B reakcje zaszły w probówkach I, III i IV, a w probówce III wydzieliła się największa objętość wodoru
C reakcje zaszły w probówkach I, III i IV, a w probówce III wydzieliła się najmniejsza objętość wodoru
D reakcje zaszły we wszystkich probówkach i objętość wydzielonego wodoru była we wszystkich
probówkach jednakowa
17 W tabeli podano wartości temperatur wrzenia związków pierwiastków 17 grupy układu okresowego z
wodorem:
Temperatura wrzenia [
o
C]
HF 19,5
HCl -85,0
HBr -66,8
HI -35,4
Temperatura wrzenia HF jest tak wysoka i odmienna od temperatur wrzenia pozostałych związków
ponieważ:
A masa atomowa fluoru jest mniejsza od mas atomowych fluorowców
B cząsteczki HF ulegają asocjacji
C długość wiązania H-F jest najmniejsza w porównaniu z długością wiązań H-Cl, H-Br i H-I
D żadne uzasadnienie nie tłumaczy tak wysokiej temperatury wrzenia HF
18 Wskaż pH wodnego roztworu amoniaku o stężeniu 0,0001M, jeśli stopień dysocjacji przy tym
stężeniu wynosi 10%
A 4
B 5
C 9
D 10
19 Do roztworu, zawierającego 4 mole azotanu(V) srebra dodano 6 moli kwasu chlorowodorowego.
Osad odsączono, a do przesączu dodano 4 mole wodorotlenku baru i roztwór lakmusu. Roztwór
zabarwił się na kolor:
A czerwony
B fioletowy
C żółty
D niebieski
20 Który zbiór zaliczysz do kwasów według teorii protonowej Brønsteda?
A KOH, H
3
O
+
, NO
3
-
, H
2
O
B NH
4
+
, H
2
O, HCl, HS
-
C [Cu(H
2
O)
4
]
2+
, CO
3
2-
; NH
4
+
, OH
-
D F
-
, H
2
O, H
3
O
+
, HSO
3
-

- 5 -
21 Między formą obojętną i anionową oranżu metylowego ustala się stan równowagi zgodnie z
równaniem:
N N
SO
3
H
(CH
3
)
2
N
N N
SO
3
(CH
3
)
2
N
-
+
+ H
forma I
forma II
Które z poniższych zdań jest prawdziwe:
A w środowisku kwaśnym oranż metylowy występuje głównie w postaci anionu i przyjmuje barwę żółtą
B w środowisku zasadowym oranż metylowy występuje głównie w formie I i przyjmuje barwę żółtą
C w środowisku obojętnym oranż metylowy występuje głównie w formie II i przyjmuje barwę czerwoną
D w środowisku zasadowym oranż metylowy występuje głównie w postaci anionu i przyjmuje barwę
żółtą.
22 3dm
3
wodnego roztworu kwasu o ogólnym wzorze HX zawiera 5,418
.
10
23
jonów X
-
i 6moli
niezdysocjowanych cząsteczek HX. Stopień i stała dysocjacji kwasu HX wynosi:
stała dysocjacji
stopień dysocjacji
A
13% 4,5
.
10
-2
B
13% 3,9
.
10
-2
C
15% 9
.
10
-2
D
17,6% 4,5
.
10
-2
23 Na roztwór siarczanu(VI) cynku podziałano roztworem wodorotlenku sodu w nadmiarze. Produktami
reakcji są:
A Na
2
[Zn(OH)
4
] i Na
2
SO
4
B Zn(OH)
2
, Na
2
O i H
2
O
C Zn(OH)
2
i Na
2
SO
4
D Na
2
[Zn(OH)
4
], Na
2
O i H
2
O
24 Wybierz grupę związków, których wszystkie cząsteczki mają moment dipolowy równy zero:
A wodór, tlenek węgla(IV), tlenek siarki(IV)
B jod, fluorek boru, 1,4-dimetylobenzen
C tlenek węgla(IV), tlenek siarki(IV), nadtlenek wodoru
D tlenek węgla(II), metan, chlorometan
25 Wybierz prawidłowe stwierdzenia:
1. zdolność pierwiastka do występowania w kilku postaciach, różniących się liczą atomów w
cząsteczce lub sposobem rozmieszczenia atomów w sieci krystalicznej nazywa się
alotropią.
2. kryształy jonowe dobrze przewodzą prąd elektryczny
3.
substancje kowalencyjne tworzące kryształy cząsteczkowe mają stosunkowo niskie
temperatury topnienia
4. jeżeli łączą się dwa metale o niewielkiej różnicy elektroujemności, to powstaje wiązanie
metaliczne na skutek delokalizacji elektronów
5. wiązanie metaliczne i wiązanie jonowe mają charakter kierunkowy
A 1, 3, 4
B 2, 3, 5
C 1, 2, 3, 4
D 1, 3, 4, 5
26 W którym szeregu wszystkie tlenki reagują z wodą?
A CaO, MgO, CuO, CO
2
B K
2
O, BaO, NO
2
, Cl
2
O
7
C Li
2
O, CrO, SiO
2
, SO
2
D Na
2
O, BeO, CO
2
, P
2
O
5
- 6 -
27 Badano moc kwasów tlenowych i beztlenowych fluorowców i stwierdzono, że zmienia się ona w
następujący sposób:
A HClO> HBrO>HIO
B HClO<HClO
2
<HClO
3
<HClO
4
C HI>HBr>HCl
D wszystkie odpowiedzi są prawidłowe
28 Dane są trzy substancje I, II i III. Substancja I nie daje pozytywnego wyniku próby Trommera.
Ogrzewana z wodą w środowisku kwaśnym ulega hydrolizie, w wyniku której powstają substancje II i III,
dające pozytywny wynik próby Trommera. Substancja II reaguje z wodą bromową w obecności
wodorowęglanu sodu. Substancja III nie ulega tej reakcji. Substancja II jest jednym z najważniejszych
związków organicznych w przyrodzie. Substancjami I, II i III są:
I
II
III
A
maltoza glukoza laktoza
B
sacharoza glukoza
fruktoza
C
skrobia glukoza galaktoza
D
sacharoza maltoza
galaktoza
29 Liczba izomerów 1,2-dimetylocyklopropanu wynosi:
A 7
B 5
C 3
D 1
30 Utlenianie aldoheksozy kwasem azotowym(V) prowadzi do utlenienia grupy aldehydowej i -CH
2
OH.
Wybierz aldoheksozę, której produkt utlenienia kwasem azotowym(V) będzie optycznie nieczynny.
C
C
C
C
CH
2
OH
OH
H
H
O
H
OH
H
OH
H
CHO
C
C
C
C
CH
2
OH
OH
H
OH
H
H
H
OH
H
CHO
C
C
C
C
CH
2
OH
OH
H
OH
H
OH
H
OH
H
CHO
C
C
C
C
CH
2
OH
H
O
H
H
O
H
OH
H
OH
H
CHO
A
B
C
D
31 Ile stereoizomerów posiada związek o wzorze?
C
H
3
CH
2
CH
N
H
CH
3
CH
2
CH
2
N
H
CH
CH
2
CH
3
CH
3
A 1
B 2
C 3
D 4
32 Podczas rozładowywania akumulatora ołowiowego na elektrodzie ujemnej zachodzi reakcja:
A PbSO
4
+ 2H
+
+ 2e Pb + H
2
SO
4
B Pb + SO
4
2-
- 2e PbSO
4
C PbO
2
+ 4H
+
+ SO
4
2-
+ 2e PbSO
4
+ H
2
O
D PbSO
4
+ SO
4
2-
+ 2H
2
O –2e PbO
2
+ 2H
2
SO
4
33 Zmieszano roztwory zawierające jednakowe ilości moli siarczanu(VI) miedzi(II) i wodorotlenku sodu.
Układ po reakcji zawierał:
A CuSO
4
, Na
+
, OH
-
B Cu(OH)
2
, Na
+
, Cu
2+
, OH
-
C Cu(OH)
2
, Na
+
, Cu
2+
, SO
4
2-
D tylko Cu(OH)
2

- 7 -
34 Reakcja: 2NO + O
2
= 2NO
2
przebiega według równania kinetycznego: v=k
.
[NO]
2.
[O
2
]. Jak zmieni się
szybkość reakcji, jeżeli ciśnienie reagujących gazów wzrośnie dwukrotnie?
A nie zmieni się
B zmniejszy się 8 razy
C zwiększy się trzy razy
D zwiększy się 8 razy
35 w 5,0
.
10
-4
mola cząsteczek pewnego związku znajduję się 12,04
.
10
20
atomów tlenu. Związkiem tym
jest:
A octan magnezu
B siarczan(IV) sodu
C fosforan(V) magnezu
D mrówczan sodu
36 Dla której reakcji przeprowadzonej w warunkach normalnych wartości
ΔU i ΔH są takie same?
A 3C
2
H
2
C
6
H
6
B Ba
2+
(aq)
+ SO
4
2-
(aq)
BaSO
4
C H
2
O
(s)
H
2
O
(g)
D N
2
O
4(g)
2NO
(g)
37 Objętość mieszaniny gazów, składających się z metanu, propanu, tlenku węgla(II) wynosi 27,4dm
3
.
Po całkowitym spaleniu mieszaniny otrzymano 51,4dm
3
tlenku węgla(IV). Zawartość procentowa
propanu w % objętościowych wynosiła:
A 12%
B 23,3%
C 33,3%
D 43,8%
38 Dane są dwa węglowodory I i II o tym samym wzorze elementarnym. Węglowodór I odbarwia wodę
bromową. Węglowodór II nie odbarwia wody bromowej, reaguje jednak z bromem w obecności
katalizatora. Węglowodór II można otrzymać bezpośrednio z węglowodoru I. Opisane węglowodory to:
I
II
A
acetylen benzen
B
etyn cykloheksan
C
benzen
cykloheksan
D
metylocykloheksan toluen
39 Ze skróconego zapisu tetrapeptydu Ser-Gly-Cys-Leu wynika, że w reakcjach kondensacji udział
brały grupy:
A aminowa: seryny, glicyny, cysteiny
karboksylowa: glicyny, cysteiny, leucyny
B aminowa: glicyny, cysteiny
karboksylowa: seryny, glicyny, cysteiny
C aminowa: glicyny, cysteiny, leucyny
karboksylowa: seryny, glicyny, cysteiny
D aminowa: glicyny, cysteiny, leucyny
karboksylowa: glicyny, cysteiny, leucyny
40 Do całkowitego spalenia pewnego węglowodoru zużyto 784cm
3
tlenu. Otrzymany dwutlenek węgla
przepuszczono przez płuczkę z wodą wapienną. Otrzymano 2g osadu. Węglowodorem był:
A eten
B atan
C etyn
D propyn

- 8 -
41 Wykonano doświadczenie według schematu:
Mn
Cd
Ag
wodny roztwór CuSo
4
Po pewnym czasie wyjęto płytki z roztworu, osuszono i zważono. Stwierdzono, że masa płytek
odpowiednio:
Mn
Cd
Ag
A
zmalała wzrosła nie
uległa zmianie
B
wzrosła zmalała nie
uległa zmianie
C
nie uległa zmianie
zmalała nie
uległa zmianie
D
wzrosła wzrosła wzrosła
42 W celu wykazania utleniających właściwości dwuchromianów, należy do zakwaszonego roztworu
K
2
Cr
2
O
7
dodać:
A siarkowodoru lub tlenku siarki(IV)
B azotanu(V) sodu lub siarczanu(VI) sodu
C związków zawierających jony jodkowe lub żelazowe(II)
D substancji wymienionych w punkcje A lub C
43 Które z podanych reakcji nie są reakcjami utleniania i redukcji:
1. 2AsH
3
+ 3O
2
As
2
O
3
+ 3H
2
O
2.
CO + NH
3
HCN + H
2
O
3. Cr
2
(SO
4
)
3
+ 3Zn 2Cr + 3ZnSO
4
4. CrCl
3
+ 3NaOH 3NaCl + Na[Cr(OH)
4
]
5. (NH
4
)
2
Cr
2
O
7
Cr
2
O
3
+ N
2
+ H
2
O
6. K
2
Cr
2
O
7
+ KCl + 2H
2
SO
4
2K
2
SO
4
+ CrO
2
Cl
2
+ H
2
O
A 1, 3, 5
B 2, 4
C 2, 4, 6
D 4, 6
44 Wybierz, dla którego związku podano poprawny opis jego cząsteczki:
wzór związku
hybrydyzacja atomu centralnego
ilość wiązań
σ
ilość wiązań
π
A
SO
2
sp
2
2
B
HClO
2
sp
3
3
1
C
HNO
2
sp
2
3
1
D
H
2
SO
3
sp
3
5
1
45 Oblicz ile elektronów tworzy wiązania w cząsteczkach HSCN, SO
2
, SO
3
, COCl
2
i CO oraz wskaż
poprawną odpowiedź:
HSCN
SO
2
SO
3
COCl
2
CO
A
10 8 12 6 4
B
10 6 8 8 6
C
8 8 10 6 4
D
8 6 10 8 6

- 9 -
46 Atomy czterech pierwiastków mają następującą konfigurację elektronową:
1 1s
2
2s
2
2p
6
3s
2
3p
5
2 1s
2
2s
2
2p
6
3s
2
3p
3
3 1s
2
2s
2
2p
3
4 1s
2
2s
2
2p
2
Najwyższą wartościowość w związku z wodorem wykazuje atom o konfiguracji:
A 1
B 2
C 3
D 4
47 Rozczepienie uranu
235
U zachodzi zgodnie z równaniem:
n
3
E
Kr
n
U
1
0
A
Z
92
36
1
0
235
92
+
+
→
+
Nuklidem
E
A
Z
jest:
A
Ba
141
56
B
Ba
138
56
C
Kr
85
36
D
Kr
84
36
48 Rozpatrując substancję o składzie ECl
x
w szeregu zawierającym kolejne pierwiastki E z trzeciego
okresu układu okresowego pierwiastków:
NaCl, MgCl
2
, AlCl
3
, SiCl
4
, PCl
5
, SCl
6
, Cl
2
można stwierdzić, że:
A pierwsza substancja w tym szeregu jest substancją o wiązaniu jonowym, a ostatnia o wiązaniu
typowo kowalencyjnym
B następuje stopniowa zmiana właściwości pierwiastków E do sodu do chloru
C elektroujemność kolejnych pierwiastków E od sodu do chloru wzrasta
D wszystkie odpowiedzi są prawidłowe
49 Zakwalifikuj do koloidów hydrofilowych lub hydrofobowych następujące substancje:
1 albumina
2 kleik skrobiowy
3 koloidalne srebro 4 żelatyna
5 koloidalna siarka
koloidy:
hydrofilowe
hydrofobowe
A
1, 2, 4
3, 5
B
3, 5
1, 2, 4
C
2, 4
1, 3, 5
D
1, 3, 5
2, 4
50 Fluor występuje w przyrodzie jako pierwiastek charakteryzujący się jedną liczbą masową, a w skład
argonu wchodzą atomy o liczbach masowych 36, 38, 40. Opierając się na powyższym stwierdzeniu
wybierz prawidłową odpowiedź:
A
F
19
9
jest jednym z izotopów fluoru
B fluor i argon występujące w przyrodzie są nuklidami
C w skład argonu wchodzą nuklidy:
Ar
36
18
,
Ar
38
18
,
Ar
40
18
D trzy nuklidy argonu mają taką samą liczbę nukleonów
51 Denaturację białek powoduje:
A reakcja z formaliną
B reakcja ksantoproteinowa
C reakcja z siarczanem(VI) miedzi(II)
D wszystkie reakcje

- 10 -
52 W podanym schemacie:
X
+Cl
2
światło
+2NH
3
Y
Z + NH
4
Cl
substancjami X, Y i Z są:
X
Y
Z
A
kwas octowy
kwas chlorooctowy
glicyna
B
aldehyd octowy
kwas chlorooctowy
kwas octowy
C
aldehyd octowy
chlorooctan metylu
acetamid
D
kwas octowy
chlorek acetylu
octan amonu
53 Które z podanych związków należą do tego samego szeregu homologicznego?
1 pentan-2-on
2 3-metylo-2-butanon
3 2,2-dimetylopropanal
4 aceton 5 2,2-dimetylopropanol
A 3, 5
B 1, 4
C 1, 2, 4
D 1, 3, 4
54 Głównym produktem nitrowania aniliny w środowisku kwaśnym jest:
A mieszanina o-nitroaniliny i p-nitroaniliny
B m-nitroanilina
C p-nitroanilina
D o-nitroanilina
55 Wybierz zestaw zawierający wyłącznie związki, które mogą być optycznie czynne:
A propan-2-ol, kwas 2-chloropropanowy, 2-fenyloetanol
B butan-2-ol, kwas 3-hydroksybutanowy, 2,3-dichydroksypropanal
C kwas 2-hydroksypropanowy, 2-chlorobutan, 2-metylopropanal
D wszystkie wymienione związki są optycznie czynne
56 W wyniku zasadowej hydrolizy próbki tłuszczu otrzymano glicerol oraz 1,505
.
10
22
cząsteczek mydła
palmitynowego i 3,01
.
10
22
cząsteczek mydła stearynowego. Który z podanych wzorów odpowiada
hydrolizowanemu tłuszczowi?
C
H
2
C
H
C
H
2
OCOC
17
H
35
OCOC
17
H
35
OCOC
17
H
33
C
H
2
C
H
C
H
2
OCOC
17
H
35
OCOC
17
H
35
OCOC
15
H
31
C
H
2
C
H
C
H
2
OCOC
17
H
35
OCOC
15
H
31
OCOC
15
H
31
C
H
2
C
H
C
H
2
OCOC
17
H
35
OCOC
17
H
33
OCOC
17
H
33
A
B
C
D
57 Wskaż w których parach (wierszach) związki mają taką samą rzędowość:
1. C
2
H
5
CONH
2
i CH
3
CH
2
CH(OH)CH
2
CH
3
2.
acetamid i (CH
3
)
2
CHOH
3. C
2
H
5
CONHCH
3
i (CH
3
)
2
COH
4. C
2
H
5
CON(CH
3
)
2
i (C
2
H
5
)COH
5. CH
3
CONHC
2
H
5
i cyklopentanol
A 4, 5
B 1, 2
C 1, 5
D 3, 4
58 Dane są cztery substancje I, II, III i IV. Wszystkie rozpuszczają się w wodzie i roztworach wykazują
odczyn obojętny. Substancja I jest w warunkach normalnych gazem. Substancje I, II i IV dają
pozytywny wynik próby Tollensa. Tylko substancja II reaguje z bromem w obecności wodorowęglanu
sodowego. Substancjami I, II, III i IV są:
I
II
III
IV
A
aldehyd mrówkowy aceton
fruktoza
glukoza
B
glukoza dimetyloketon
fruktoza
metanal
C
metanal fruktoza
propanon
glukoza
D
metanal glukoza
aceton
fruktoza

- 11 -
59 Przygotowano 0,1M wodne roztwory kwasów: metanowego, etanowego, etanodiowego,
aminoetanowego. Uszereguj roztwory kwasów według rosnącego pH:
A kwas etanodiowy, kwas metanowy, kwas etanowy, kwas aminoetanowy
B kwas aminoetanowy, kwas etanowy, kwas metanowy, kwas etanodiowy
C kwas etanodiowy, kwas etanowy, kwas metanowy, kwas aminoetanowy
D kwas metanowy, kwas etanodiowy, kwas etanowy, kwas aminoetanowy
60 Aspartam jest stosowany jako środek słodzący tam, gdzie użycie cukru jest niemożliwe lub
niewskazane, na przykład do słodzenia leków lub niskokalorycznych deserów i lodów. poniższy wzór
przedstawia cząsteczkę aspartamu
N
H
2
CH
CH
2
C
O
N
H
CH
CH
2
C
6
H
5
C
O
O CH
3
COOH
I
II
Jak nazywają się wiązania I i II?
I
II
A
peptydowe estrowe
B
amidowe glikozydowe
C
peptydowe hemiacetalowe
D
eterowe estrowe
61 Wskaż określenie prawdziwe dla izotopów danego pierwiastka:
A różnią się liczbą protonów
B różnią się liczbą neutronów
C zawierają taką samą liczbę neutronów D mają taką samą liczbę masową
62 O orientacji przestrzennej obszaru orbitalnego decyduje:
A spinowa liczba kwantowa
B magnetyczna liczba kwantowa
C poboczna liczba kwantowa
D główna liczba kwantowa
63 Po reakcji w 100cm
3
mieszaniny wodoru i tlenu, oprócz otrzymanego produktu reakcji pozostało
16cm
3
tlenu. Objętości substratów i pozostałość tlenu zmierzono w tych samych warunkach ciśnienia i
temperatury. jaki był skład procentowy mieszaniny, w % objętościowych, przed reakcją?
A wodoru: 84, tlenu 16
B wodoru: 72, tlenu 28
C wodoru: 56, tlenu 44
D wodoru: 44, tlenu 56
64 W zapisie konfiguracji elektronowej atomu w stanie podstawowym liczba niesparowanych
elektronów atomu tytanu wynosi:
A 3
B 2
C 1
D 0
65 Wykorzystując dane zawarte w „Tabeli rozpuszczalności soli w wodzie w zależności od temperatury”
wskaż, jakie jest stężenie procentowe nasyconego roztworu chlorku potasu w temperaturze 30
o
C.
A 27%
B 30% C 34% D 37%

- 12 -
66 Konfigurację elektronową identyczną z konfiguracją Ca
2+
mają:
Jony
Atomy
A
K
+
, S
2-
, Cl
-
Ar
B
Mg
2+
, Br
-
, Se
2-
Kr
C
K
+
, Mg
+2
, Cr
2+
Kr
D
Cr
2+
, Se
2-
, Cl
-
Ar
67 Do reaktora o pojemności 1dm
3
wprowadzono substraty reakcji w stosunku molowym X:Y=1:2 i
zainicjowano reakcję opisaną schematem:
X
(g)
+ Y
(g)
Z
(g)
+ W
(g)
Po ustaleniu się stanu równowagi w T=500K (w tej temperaturze K
c
=1) stwierdzono, że stężenie
produktu Z jest równe 4mol/dm
3
. Liczba moli substratu X wprowadzona do reaktora wynosiła:
A 4 B 6
C 9
D 12
68 126g pewnej substancji X rozłożono całkowicie zgodnie z równaniem:
X Y + Z + W
W wyniku tej reakcji otrzymano produkty w stosunku masowym Y:Z:W = 4:5:9. Ilość otrzymanej
substancji W, jest równa:
A 81g
B 63g C 35g D 14g
69 Na 300g wapienia zawierającego 10% zanieczyszczeń nie reagujących z HCl, podziałano kwasem
solnym w nadmiarze. Objętość CO
2
wydzielonego w tej reakcji, mierzona w warunkach normalnych,
jest równa:
A 151,2dm
3
B 108,02dm
3
C 60,5dm
3
D 11,9dm
3
70 W dwóch reaktorach 1 i 2 przebiegają reakcje:
C
(s)
+ CO
2(g)
2CO
(g)
ΔH
0
=171kJ
3H
2(g)
+ N
2(g)
2NH
3(g)
ΔH
0
=-91kJ
1
2
Po ustaleniu się stanu równowagi reakcji 1 i 2 w obu reaktorach zwiększono ciśnienie w warunkach
izotermicznych. W nowym stanie równowagi można powiedzieć, że liczba moli:
CO
NH
3
A
jest mniejsza
jest większa
B
nie zmieniła się jest większa
C
jest większa nie
zmieniła się
D
jest większa jest
mniejsza
71 Do wody wodociągowej dodano AgNO
3
i stwierdzono, że w wyniku reakcji strąciło się 0,287g
chlorku srebra, na każdą pobraną próbkę o objętości 0,2dm
3
. Stężenie molowe jonów chlorkowych w
badanej próbce wynosiło:
A 0,001mol/dm
3
B 0,002mol/dm
3
C 0,01mol/dm
3
D 0,01mol/dm
3
- 13 -
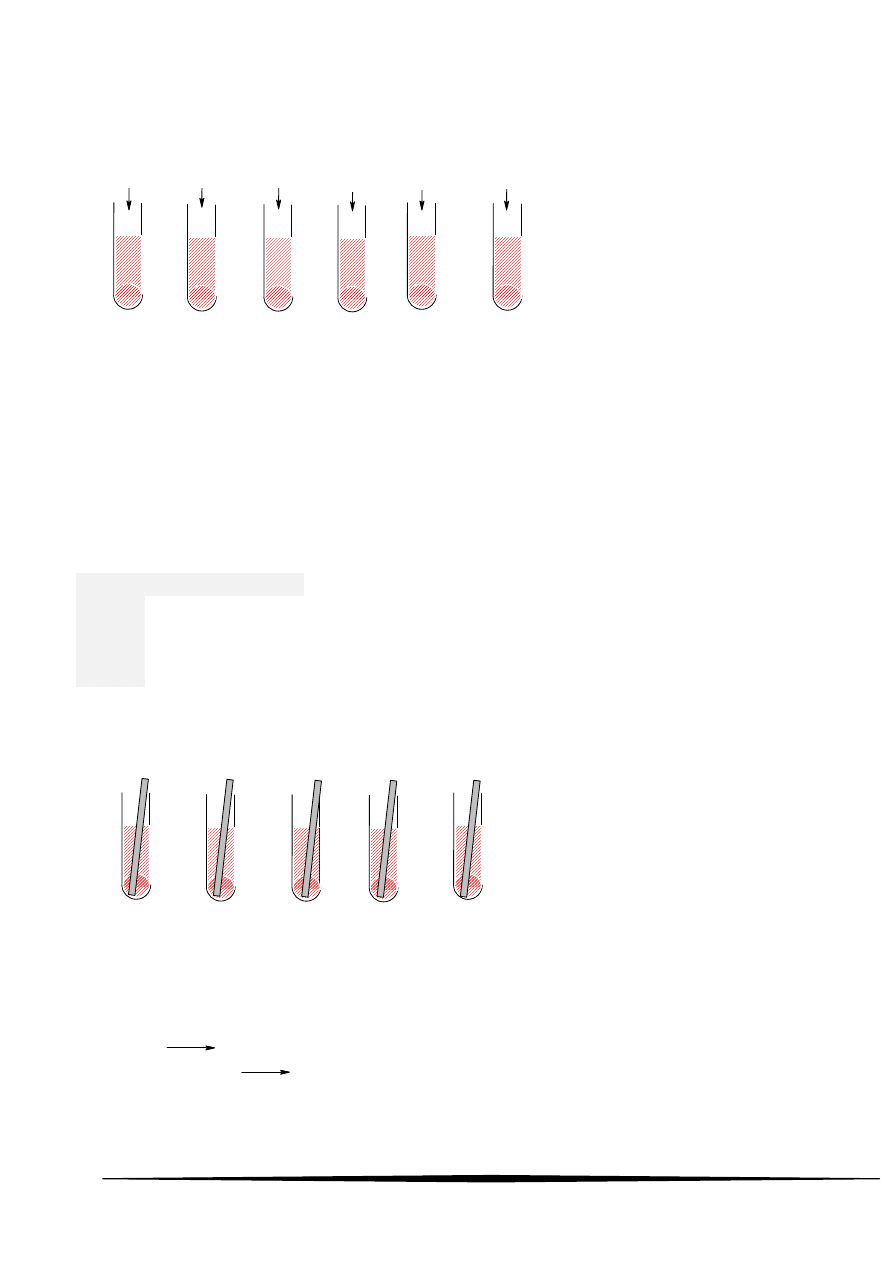
72 Rozważ następujący eksperyment. W probówkach oznaczonych numerami od 1 do 6 umieszczono
po 5cm
3
2% roztworu siarczanu(VI) miedzi(II) i 1cm
3
10% roztworu wodorotlenku sodu. Wstrząśnięto, a
następnie dodano do oznaczonych probówek po 0,001 mola substancji podanych na rysunku i
ogrzewano przez kilka minut każdą z nich.
1
2
3
4
5
6
aceton
glukoza
heksanal
kwas
octowy
propanal
sacharoza
Po ogrzewaniu zaobserwowano zmianę zabarwienia spowodowaną redukcją jonów miedzi(II) w
probówkach oznaczonych numerami:
A 1, 2, 5 B 2, 3, 4
C 2, 3, 5
D 2, 3, 6
73 Wskaż zbiór tlenków amfoterycznych, czyli takich układów, które wszystkie mogą reagować
zarówno z kwasami, jak i zasadami.
A Al
2
O
3
, As
2
O
3
, MnO
2
, ZnO
B Al
2
O
3
, CuO, SO
2
, ZnO
C As
2
O
3
, CuO, CrO
3
, MgO
D CrO
3
, CuO, MnO, FeO
74 Przeprowadzono oddzielnie elektrolizę: wodnego roztworu chlorku sodu i stopionego wodorku sodu.
Na anodzie otrzymano odpowiednio:
NaCl
(aq)
NaH
A
wodór wodór
B
wodór sód
C
chlor sód
D
chlor wodór
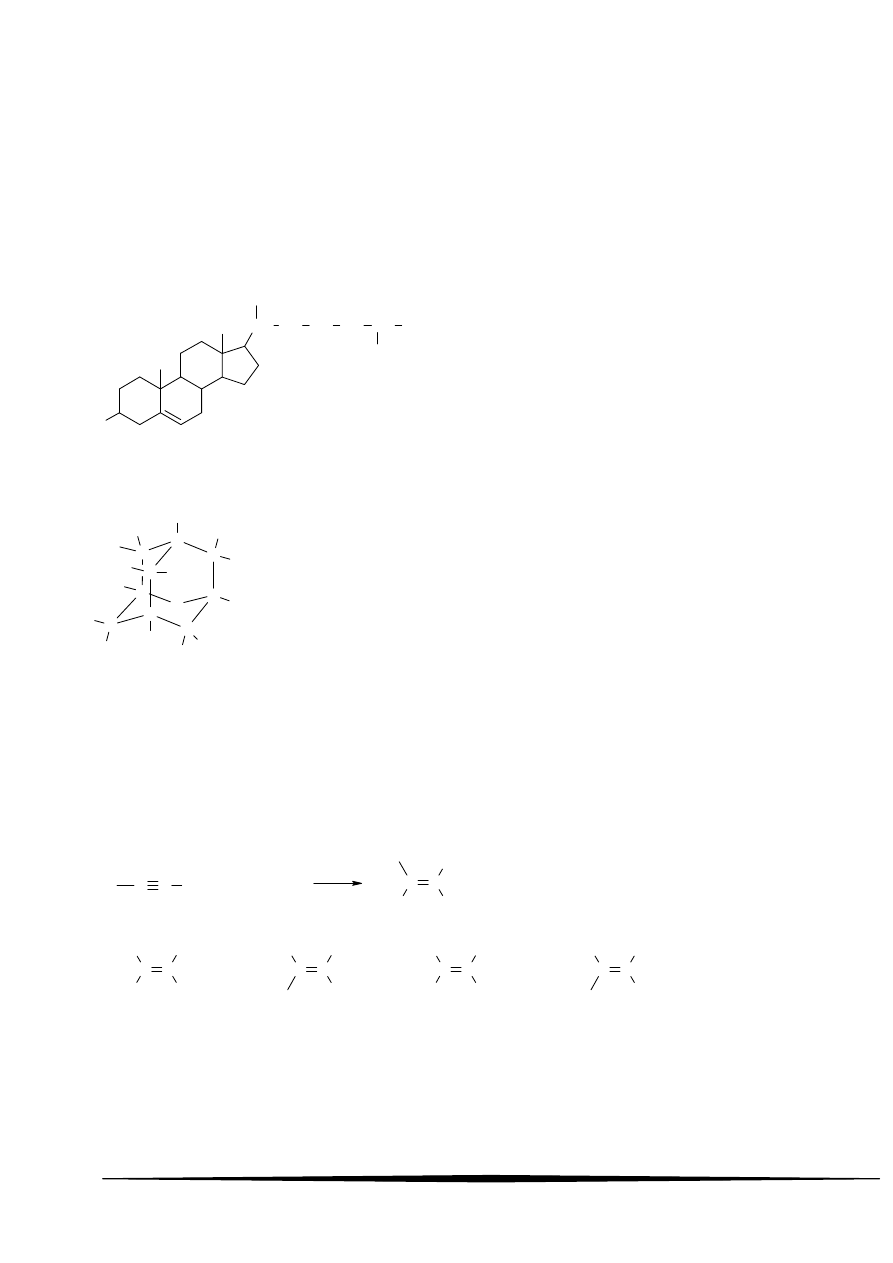
75 Przeprowadzono badanie zachowania się metali w 1-molowych roztworach soli, w sposób podany
na rysunku:
1
2
3
4
5
Fe
Fe
Pb
Pb
Ag
Cu
2+
SO
4
2-
Ag
+
NO
3
-
Mg
2+
2Cl
-
Sn
2+
2Cl
-
Zn
2+
SO
4
2-
Po 5-ciu minutach zauważono zmiany w probówkach oznaczonych numerami:
A 1 i 3
B 1, 3 i 5
C 2 i 4 D 2, 4 i 5
76 Dane są następujące równania reakcji połówkowych:
1 H
2
O
2
O
2
+ 2H
+
+ 2e
2 MnO
4
-
+ 8H
+
+ 5e
Mn
2+
+ 4H
2
O
Wskaż ile moli jonów MnO
4
-
zużywa się przy utlenianiu 1 mola H
2
O
2
:
A 0,1
B 0,4 C 0,8 D 1,2

- 14 -
77 W którym z poniższych związków znajduje się pierwiastek o tym samym stopniu utlenienia, co
mangan w K
2
MnO
4
?
A Cl
2
O
7
B Ca
3
(PO
4
)
2
C K
2
Cr
2
O
7
D Na
2
SO
3
78 Jeżeli 4,32g kwasu szczawiowego (COOH)
2
znajduje się w 1,2dm
3
roztworu, to stężenie tego
roztworu wynosi:
A 0,02 mol/dm
3
B 0,04 mol/dm
3
C 0,002 mol/dm
3
D 0,004 mol/dm
3
79 Chlorowodór można otrzymać w reakcji:
1. NaCl + H
2
SO
4
2. NH
4
Cl + NaOH
3. NaCl + H
2
CO
3
A 1, 2 i 3 B tylko 1 i 3 C tylko 1
D tylko 3
80 W 5 dm
3
wody rozpuszczono 2,5 dm
3
gazowego amoniaku (objętość zmierzono w warunkach
normalnych). Stężenie molowe otrzymanego roztworu jest w przybliżeniu równe:
A 0,5 mol/dm
3
B 0,33 mol/dm
3
C 2,23
.
10
-2
mol/dm
3
D 1,49
.
10
-2
mol/dm
3
81 O tlenkach zapisanych w następującym porządku: Na
2
O, MgO, Al
2
O
3
, SiO
2
, P
2
O
5
, SO
3
Cl
2
O
7
możemy powiedzieć, że uszeregowane są zgodnie z:
A narastającą różnicą elektroujemności składników
B wzrostem jonowości wiązań i zasadowości związków
C wzrostem jonowości i wzrostem kowalencyjności wiązań
D wzrostem kowalencyjności i spadkiem jonowości wiązań
82 W którym zestawie jony mają jednakową konfigurację elektronową?
A Ca
2+
, F
-
, K
+
, S
2-
B Al
3+
, Mg
2+
, Na
+
, F
-
C As
3-
, Ca
2+
, Se
2-
, Br
-
D Cl
-
, Mg
2+
, Na
+
, S
2-
83 Przeprowadzono trzy reakcje, których substraty podane są poniżej:
1. Na i H
2
O
2. Na
2
O i H
2
O
3. NaH i H
2
O
Wodorotlenek sodu można otrzymać w reakcjach:
A wszystkich
B tylko 1 i 2 C tylko 1 i 3 D tylko 2 i 3
84 Spośród następujących związków:
1. octan etylu;
2. mrówczan propylu;
kwas butanowy
izomerami propionianu metylu są:
A 1, 2 i 3 B tylko 1 i 2 C tylko 2 i 3 D tylko 1 i 3
85 Pewien aldehyd po przeprowadzonej redukcji daje alkohol, który po odwodnieniu przechodzi w
2-metylobut-1-en. Wskaż uproszczony wzór tego aldehydu.
A CH
3
CH
2
C(CH
3
)
2
CHO B CH
3
CH(CH
3
)CH
2
CHO
C CH
3
CH
2
CH(CH
3
)CHO D CH
3
C(CH
3
)
2
CHO

- 15 -
86 Rozważ następujące równania reakcji chemicznej:
1 CH
3
CH
2
Cl + OH
-
X + Cl
-
2 CH
3
CH
2
Cl + NH
3
Y + HCl
Z + Cl
-
+ H
2
O
3 CH
3
CH
2
Cl + OH
-
H
2
O
temp. pok.
C
2
H
5
OH
Δ
Wskaż nazwy produktów X, Y i Z.
X
Y
Z
A
eten nitroetan
etanol
B
etanol etyloamina
eten
C
eten nitroetan
eten
D
etanol etyloamina
etanol
87 O pewnym związku organicznym można powiedzieć, że:
1. podczas reakcji tego związku z węglanem sodu wydziela się CO
2
2. daje pozytywny wynik próby z odczynnikiem Tollensa
Związkiem tym może być:
A kwas mrówkowy B fenol C aceton
D kwas salicylowy
88 Atraktant płciowy karalucha, którego uproszczony wzór umieszczono poniżej poddano reakcji
uwodornienia:
CH
3
(CH
2
)
17
C
CH
3
H
(CH
2
)
7
C
H
CH
3
C CH
3
O
Otrzymany produkt należy do rodziny:
A alkoholi I-rzędowych
B alkoholi II-rzędowych
C hemiacetali D ketali
89 Na moc kwasów karboksylowych wpływa liczba obecnych w cząsteczce atomów o dużej
elektroujemności oraz ich położenie względem grupy karboksylowej. Wpływ ten jest następujący:
1. im większa liczba takich atomów, tym moc kwasu jest większa
2. im bardziej atomy te są oddalone od grupy karboksylowej, tym moc kwasu jest mniejsza
Na tej podstawie wybierz szereg, w którym kwasy ułożono według malejącej mocy:
A C
3
H
7
COOH, CH
3
CHClCH
2
COOH, C
2
H
5
CHClCOOH, C
2
H
5
C(Cl)
2
COOH
B C
2
H
5
C(Cl)
2
COOH, C
2
H
5
CHClCOOH, CH
3
CHClCH
2
COOH, C
3
H
7
COOH
C C
3
H
7
COOH, C
2
H
5
CHClCOOH, C
2
H
5
C(Cl)
2
COOH, CH
3
CHClCH
2
COOH
D CH
3
CHClCH
2
COOH, C
2
H
5
CHClCOOH, C
2
H
5
C(Cl)
2
COOH, C
3
H
7
COOH
90 Stosunek masowy C:H:O w pewnym alkoholu jest równy 9:2:12. Zawartość procentowa tlenu w tym
alkoholu wynosi:
A 63,6% B 52,2%
C 34,8%
D 26,7%
91 Izomerem węglowodoru cyklicznego o wzorze:
C
C
C
C
C
C
H
H
H
H
H
H
H
H
H
H
H
H
jest związek o nazwie:
A cykloheksen
B heksan
C heks-1-en
D heks-1-yn
- 16 -
92 W wyniku spalenia 36mg węglowodoru nasyconego X otrzymano 110mg CO
2
i wodę. Węglowodór
X to:
A etan
B propan
C butan
D pentan
93 Wskaż, ile różnych aldehydów można otrzymać przez utlenianie alkoholi o wzorze sumarycznym
C
4
H
9
OH
A 1 B 2
C 3
D 4
94 Ustalenie budowy cholesterolu od czasu wydzielenia go z kamieni żółciowych zajęło chemikom
prawie półtora wieku, obecnie wiadomo, że jego struktura ma postać:
O
H
C
H
3
CH
3
CH
CH
3
CH
2
CH
2
CH
2
CH
CH
3
CH
3
Wskaż liczbę pierwszorzędowych atomów węgla w
cząsteczce cholesterolu:
A 4
B 5
C 6
D 7
95 Adamantan może występować w ropie naftowej i posiada, jak na węglowodory wysoką temperaturę
topnienia 268
o
C. Oto wzór strukturalny cząsteczki adamantanu:
C
C
C
C
C
C
C
C
C
C
H
H
H
H
H
H
H H
H
H
H
H
H
H
Ile moli zawiera 0,68g tego węglowodoru:
A 5
.
10
-5
B 5
.
10
-4
C 5
.
10
-3
D 5
.
10
-2
96 Spośród następujących alkanów:
1 2-metylopropen, 2 but-2-en, 3 2,3-dimetylobut-2-en,
4 pent-2-en
w postaci izomerów trans występują:
A wszystkie
B tylko 2, 3 i 4 C tylko 1 i 2 D tylko 2 i 4
97 W celu otrzymania alkenów o konfiguracji trans, prowadzi się uwodornienie wiązań potrójnych za
pomocą sodu w ciekłym amoniaku według następującego równania reakcji:
C C R
2
R
1
C C
R
1
H
R
2
H
+ 2Na + 3NH
3
+ 2NaNH
2
Wskaż wzór produktu uwodornienia heks-2-ynu tą metodą:
C C
C
2
H
5
C
2
H
5
H
H
C C
H
C
2
H
5
H
C
2
H
5
C C
C
3
H
7
CH
3
H
H
C C
H
CH
3
H
C
3
H
7
A
B
C
D

- 17 -
98 Podstawowymi cegiełkami struktury białka są reszty
α-aminokwasowe o określonej konfiguracji
przestrzennej. Poniżej wybrano cztery aminokwasy oznaczone numerami od 1 do 4
COO
C
H
H
3
N
H
-
+
COO
C
CH
3
H
3
N
H
-
+
COO
C
CH
2
OH
H
3
N
H
-
+
COO
C
CH
2
SH
H
3
N
H
-
+
1
2
3
4
Wskaż aminokwas, który nie może występować w postaci izomerów optycznych.
A 1 B 2
C 3
D 4
99 Ile możliwych tetrapeptydów można otrzymać z połączenia dwóch cząsteczek alaniny i dwóch
cząsteczek fenyloalaniny. Wskaż prawidłową odpowiedź
A 3 B 5
C 6
D 8
100 Niektóre wyroby spożywcze zamiast cukru zawierają aspartam, który jest syntetycznym środkiem
słodzącym 160 razy słodszym od cukru. Uproszczony wzór cząsteczki aspartamu jest następujący:
CH
2
CH
NH
2
C
O
N
H
CH
CH
2
C
6
H
5
HOOC
COOCH
3
Wskaż produkty hydrolizy tego związku:
A CH
3
CH
2
NH
2
, C
6
H
5
CH
2
CH
2
NH
2
, CH
3
OH, CO
2
B HOOCCH
2
CH
2
NH
2
, C
6
H
5
CH
2
CH
2
NH
2
, CH
3
COOH
C HOOCCH
2
CH
2
COOH, C
6
H
5
CH
2
CH
3
, CH
3
COOH, NH
3
D HOOCCH
2
CH(NH
2
)COOH, C
6
H
5
CH
2
CH(NH
2
)COOH, CH
3
OH
- 18 -
ODPOWIEDZI
1
Odp. D
Reagentami w tych reakcjach są elektrofile – czyli cząsteczki (jony) ubogie w elektrony (elektro
fil
–
cząsteczka lubiąca elektrony). Takimi cząsteczkami (jonami) są brom, Br
2
i jon bromoniowy, Br
+
, oraz
jon nitroniowy – NO
2
+
. Brom mimo, że jest elektrofilem jego aktywność jest zbyt mała by reagować z
benzenem, ale jest wystarczająco aktywny by reagować z alkenem.
2
Odp. A
Jon OH
-
jest bogaty w elektrony – jest więc nukleofilem (nukleo
fil
– cząsteczka lubiąca jądra atomowe).
Jon ten podstawia się za chlor, mamy do czynienia z reakcją podstawienia nukleofilowego (substytucji
nukleofilowej S
N
).
3
Odp. B
C
H
2
CH
2
CH
3
CH
2
OH
CH
3
CHO
CH
3
COOH
CH
3
CH
2
Br
CH
3
CH
2
OH
reakcja addycji
wody do wiązania
podwójnego C=C
brom podstawił
się za grupę
hydroksylową
grupa hydroksylowa
podstawiła się za
brom
utlenienie alkoholu
do aldehydu
utlenienie aldehydu
do kwasu karoboksylowego
1
2
3
4
5
4
Odp. D
Zgodnie z regułą Miarkownikowa cząsteczki niesymetryczne H-X przyłączają się do podwójnego
wiązania C=C w taki sposób, że wodór przyłącza się do tego atomu węgla, który jest bogatszy w atomy
wodoru:
C
H
C CH
3
C C
H
H
Br
CH
3
C
H
3
C
Br
Br
CH
3
+ HBr
atom węgla bogatszy
w atomy wodoru
atom węgla bogatszy
w atomy wodoru
+ HBr
5
Odp. D
Zapiszmy równanie reakcji i przeczytajmy je:
Me + 2HCl MeCl
2
+ H
2
Jeżeli 4g metalu wypiera 2,24dm
3
wodoru z kwasu, to
x g tego metalu będzie wypierać 22,4dm
3
wodoru (1mol)
x=40g
40g metalu wypiera 1mol wodoru z kwasu, czyli masa molowa tego metalu (zgodnie z równaniem
reakcji) wynosi 40g/mol, a masa atomowa wynosi 40u.
6
Odp. B
1.
20%
100%
37,5
7,5
100%
m
m
c%
roztwor.
subst.
=
⋅
=
⋅
=
2. W 125g 20% roztworu CaCl
2
znajduje się 0,2
.
125g=25g substancji. Po dodaniu 125g wody
otrzymamy 250g roztworu, c%=10%
3. 155cm
3
roztworu o gęstości 1,29g/cm
3
waży m=200g (d=m/V) i znajduje się w nim 60g KOH. Masa
roztworu m
roztw.
=600g. c%=10%.

- 19 -
7
Odp. D
Stała równowagi reakcji A
2
+ B
2
= 2AB opisana jest wzorem:
]
][B
[A
[AB]
K
2
2
2
=
. Zakładając, że początkowo
mieliśmy po 1 molu substratów, to w stanie równowagi pozostało: [A
2
]=0,2mola, [B
2
]=0,2mola, oraz
powstało [AB]=1,6mola. Podstawiając te dane do wzoru na stałą równowagi otrzymamy: K=64
8
Odp. D
Temperatura wrzenia oraz temperatura krzepnięcia roztworów zależą od liczby moli jonów (cząsteczek)
w roztworze. Podwyższenie temperatury wrzenia (obniżenie temperatury krzepnięcia) w stosunku do
czystego rozpuszczalnika jest proporcjonalne do stałej ebulioskopowej (stałej krioskopowej) i stężenia
molalnego roztworu (stężenie wyrażone w ilości moli substancji na kg rozpuszczalnika m=n/m
rozp.
):
ΔT=m
.
K
e
(
ΔT=m
.
K
k
). W 18% roztworze NaCl znajduje się więcej jonów (Na
+
oraz Cl
-
) niż w 18%
roztworze sacharozy.
9
Odp. A
Miedź w szeregu napięciowym metali znajduje się za wodorem i jeżeli podziałamy na nią stężonym
kwasem solnym bez dostępu powietrza nie zajdzie żadna reakcja.
10
Odp. A
Wzór tlenku azotu N
x
O
y
. Jeżeli stosunek masowy azotu do tlenu wynosi 1,75:1 Po pomnożeniu
stronami przez 16 otrzymamy stosunek mas: 28:16. Związkiem tym jest N
2
O, stopień utlenienia azotu w
tym gazie wynosi +I.
11
Odp. C
W 1 molu NH
4
NO
3
znajduje się 2mole atomów azotu (N) czyli 28g. Tlenku azotu(II), NO, musimy wziąć
2 mole by znalazło się w nim 2 mole atomów azotu, czyli 2
.
(14+16)=60g.
12
Odp. C
Magnez i tlenek magnezu reagują z kwasem solnym wg. równania reakcji:
Mg + 2HCl MgCl
2
+ H
2
MgO + 2HCl MgCl
2
+ H
2
O
Tylko w reakcji z magnezem wydziela się wodór w ilości mol (22,4dm
3
) wodoru na mol magnezu.
Jeżeli wydzieliło się 8,96/22,4=0,4mola wodoru, to musiało przereagować 0,4mola (9,6g) magnezu,
zużywając 0,8mola HCl. Zużyto 272,9cm
3
kwasu o gęstości 1,07g/cm
3
, czyli m=292g (d=m/V). W tej
ilośći 15% roztworu znajduje się m=0,15
.
292g=43,8g HCl, czyli 1,2mola. Jeżeli na rozpuszczenie
magnezu zużyto 0,8mola, to na rozpuszczenie tlenku magnezu zużyto 0,4mola kwasu. Tlenku
magnezu było zatem 0,2mola (8g).
13
Odp. A
Zn + S ZnS
Jeżeli podczas reakcji 3,25g (0,05mola) wydzieliło się 10,15kJ energii na sposób ciepła, to
w reakcji 1mola cynku wydzieli się x energii.
x=203kJ/mol
Entalpia tworzenia ZnS wynosi zatem
ΔH=-203kJ/mol (ciepło się wydziela, entalpia jest mniejsza od 0).
Wyszukiwarka
Podobne podstrony:
Testy z chemii cz 3
Testy z chemii cz 2
TESTY FUNKCONALNE cz 2
Testy nieparametryczne cz I medycyna praktyczna
Testy z Lepu I cz.5, VI rok, VI rok, Pediatria, Pediatria, PEDIATRIA OLA, Egzamin, Pisemny, Testy
Biofizyka testy semII cz 3
Testy z chemii tom 1
Testy z chemii
08 Testy 343 [01] 0X 081 Arkusz Egzaminacyjny Etap Pisemny Stycze%c5%84 2008 Odpowiedzi Cz%c4%9
23 Testy 343 [01] 0X 102 Arkusz Egzaminacyjny Etap Pisemny Czerwiec 2010 Odpowiedzi Cz%c4%99%c5
Zadania dla I roku Chemii przed drugim, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1,
więcej podobnych podstron