
qwertyuiopasdfghjklzxcvbnmqwert
yuiopasdfghjklzxcvbnmqwertyuiopas
dfghjklzxcvbnmqwertyuiopasdfghjklz
xcvbnmqwertyuiopasdfghjklzxcvbnm
qwertyuiopasdfghjklzxcvbnmqwerty
uiopasdfghjklzxcvbnmqwertyuiopasd
fghjklzxcvbnmqwertyuiopasdfghjklzx
cvbnmqwertyuiopasdfghjklzxcvbnmq
wertyuiopasdfghjklzxcvbnmqwertyui
opasdfghjklzxcvbnmqwertyuiopasdfg
hjklzxcvbnmqwertyuiopasdfghjklzxc
vbnmqwertyuiopasdfghjklzxcvbnmq
wertyuiopasdfghjklzxcvbnmqwertyui
opasd
http://www.chemia.sos.pl
asdfghjklzxcvbnmrtyuiopasdfghjklzx
cvbnmqwertyuiopasdfghjklzxcvbnmq
wertyuiopasdfghjklzxcvbnmqwertyui
Testy z chemii
Część I

Osoby zamierzające studiować
medycynę muszą zdawać maturę
na poziomie rozszerzonym. Testy
zwarte w tym arkuszu (316
pytań
testowych pogrupowanych
tematycznie z zakresu chemii
nieorganicznej), wraz z
omówionymi dokładnie
odpowiedziami umożliwią solidne
przygotowanie się do matury z
chemii.
Rozwiązania informatyczne
Pomoc i korepetycje z chemii,
przygotowanie do matury
rozszerzonej z chemii
Chemia SOS- pomoc i korepetycje z chemii
Omówione odpowiedzi do zestawu 316
możesz otrzymać w cenie 3 zł (3,69 zł brutto).

3
Spis treści
1.
OBLICZENIA W OPARCIU O WZORY ZWIĄZKÓW, RÓWNANIA REAKCJI CHEMICZNYCH I
PODSTAWOWE PRAWA CHEMICZNE ................................................................................................................... 4
1.1.
C
HEMIA NIEORGANICZNA
............................................................................................................................ 4
1.2.
C
HEMIA ORGANICZNA
................................................................................................................................. 5
2.
USTALANIE WZORU EMPIRYCZNEGO I RZECZYWISTEGO BADANEGO ZWIĄZKU .............. 6
3.
STECHIOMETRIA MIESZANIN. REAKCJE SUBSTRATÓW ZMIESZANYCH W STOSUNKU
NIESTECHIOMETRYCZNYM. ................................................................................................................................... 8
4.
WYDAJNOŚĆ REAKCJI CHEMICZNEJ .................................................................................................... 9
5.
ROZTWORY .................................................................................................................................................. 10
5.1.
P
OJECIA PODSTAWOWE
.
R
OZTWORY RZECZYWISTE I KOLOIDALNE
.......................................................... 10
5.2.
Z
OBOJĘTNIANIE ROZTWORÓW
................................................................................................................... 13
6.
BUDOWA ATOMU ........................................................................................................................................ 14
7.
ZWIĄZEK BUDOWY ATOMU Z UKŁADEM .......................................................................................... 17
8.
PRZEMIANY JĄDROWE............................................................................................................................. 19
9.
PRZEWIDYWANIE BUDOWY PRZESTRZENNEJ ................................................................................ 21
9.1.
H
YBRYDYZACJA
........................................................................................................................................ 21
9.2.
M
ETODA
VSEPR ....................................................................................................................................... 24
10. WIĄZANIA CHEMICZNE ........................................................................................................................... 25
11. STRUKTURA CIAŁ STAŁYCH .................................................................................................................. 27
12. EFEKTY ENERGETYCZNE ........................................................................................................................ 29
13. KINETYKA I STATYKA REAKCJI ........................................................................................................... 32
14. KATALIZA ..................................................................................................................................................... 33
15. DYSOCJACJA ................................................................................................................................................ 35
15.1. P
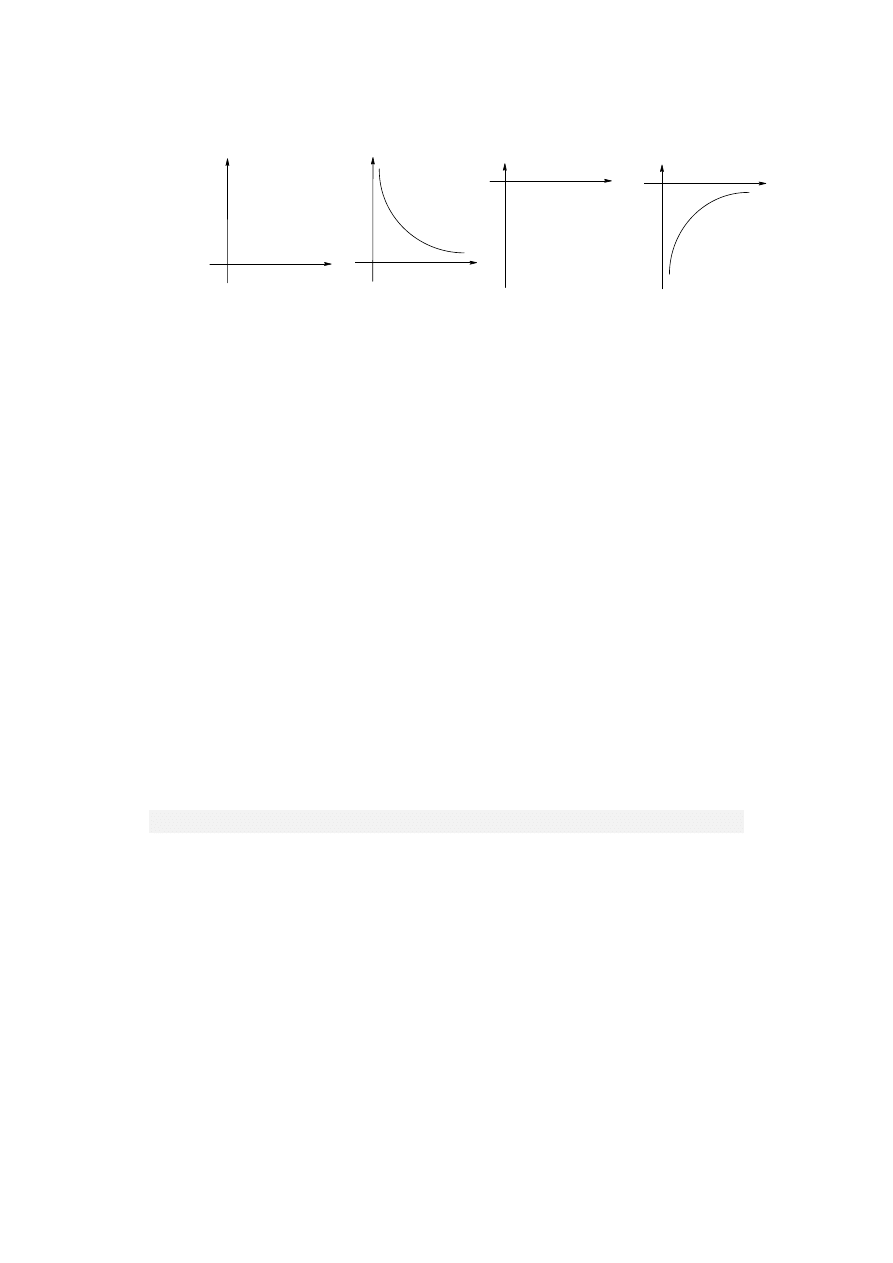
OJĘCIA PODSTAWOWE
.
S
TAŁA I STOPIEŃ DYSOCJACJI
............................................................................. 35
15.2. S
TĘŻENIE JONÓW WODOROWYCH
,
P
H
ROZTWORU
.................................................................................... 37
16. WSKAŹNIKI, PRZEWODNICTWO ROZTWORÓW .............................................................................. 38
17. TEORIE KWASÓW I ZASAD ...................................................................................................................... 40
18. AMFOTERYCZNOŚĆ ................................................................................................................................... 42
19. HYDROLIZA .................................................................................................................................................. 43
20. ILOCZYN ROZPUSZCZALNOŚCI ............................................................................................................ 45
21. ZWIĄZKI KOMPLEKSOWE ...................................................................................................................... 46
22. PROCESY REDOX ........................................................................................................................................ 48
22.1. P
OJĘCIA PODSTAWOWE
.............................................................................................................................. 48
22.2. P
RZEWIDYWANIE KIERUNKU REAKCJI
....................................................................................................... 50
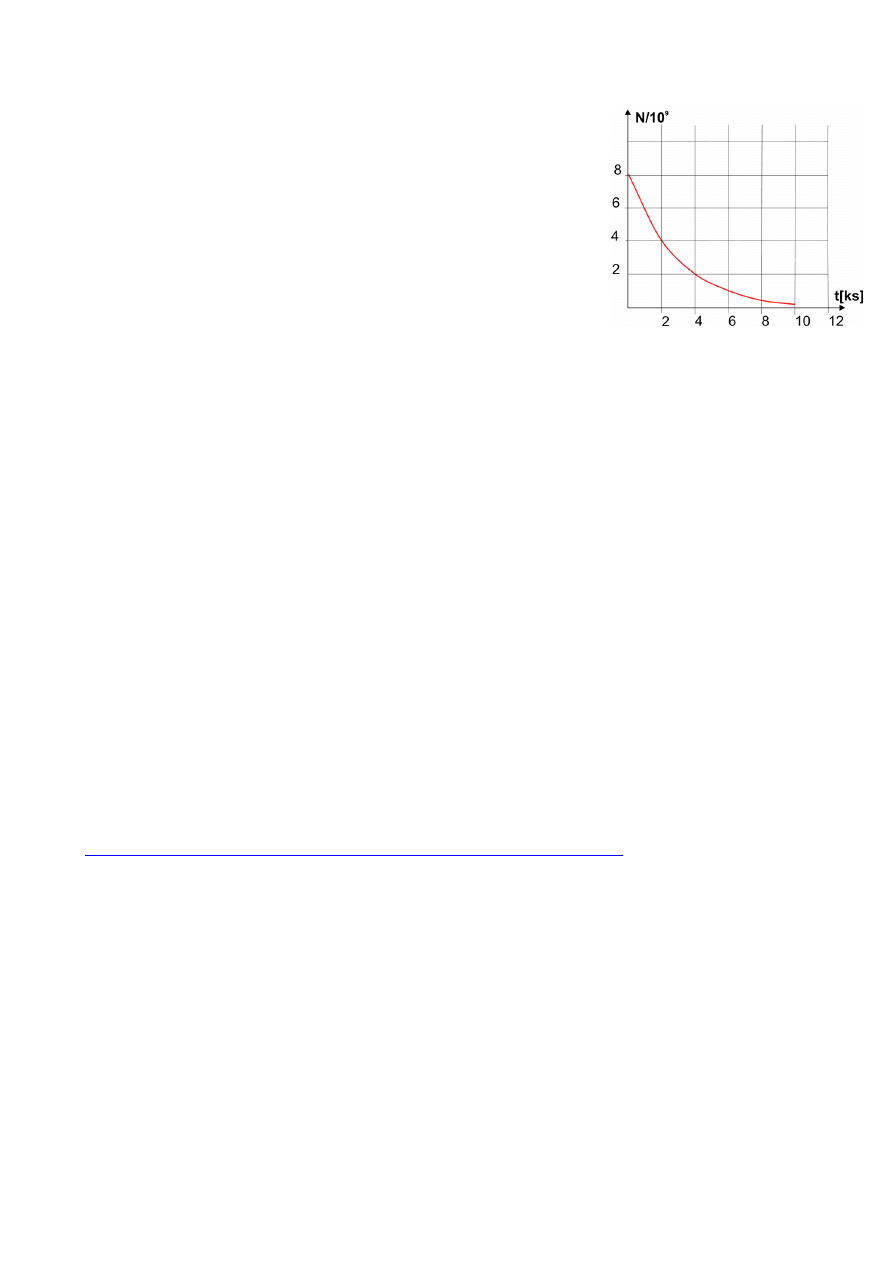
22.3. R
EAKCJE REDOX
........................................................................................................................................ 52
23. OGNIWA ......................................................................................................................................................... 54
24. ELEKTROLIZA ............................................................................................................................................. 55

4
1. Obliczenia w oparciu o wzory zwi
ą
zków, równania reakcji chemicznych i podstawowe
prawa chemiczne
1.1. Chemia nieorganiczna
1.
Jeden mol H
2
O w temperaturze T=277K i pod ci
ś
nieniem 1013hPa zajmuje obj
ę
to
ść
:
A 10
-3
dm
3
B 1,8
.
10
-2
dm
3
C 1dm
3
D 22,4dm
3
2.
Obj
ę
to
ść
wdychanego przez człowieka powietrza wynosi 500cm
3
. Je
ż
eli N wyra
ż
a liczb
ę
cz
ą
steczek
zawartych w 1 molu, to liczba cz
ą
steczek tlenu, jaka dostaje si
ę
do płuc przy jednym wdechu wynosi około:
A N/2,24
B N/22,4
C N/224
D N/44,8
3.
Aby próbka siarczku
ż
elaza(II) zawierała tyle atomów, ile ich jest w 22g tlenku w
ę
gla(IV), nale
ż
y
odwa
ż
y
ć
siarczku
ż
elaza(II):
A 22g
B 44g
C 66g
D 88g
4.
W ilu gramach tlenku azotu(II) znajduje si
ę
tyle samo azotu co w 1molu tlenku azotu(III)?
A 14g
B 28g
C 30g
D 60g
E 76g
5.
Jak
ą
obj
ę
to
ść
zajmuje w warunkach normalnych mieszanina zawieraj
ą
ca 0,4mola SO
2
oraz 88g CO
2
A 66,0dm
3
B 53,7dm
3
C 44,8dm
3
D 33,6dm
3
6.
Aby ci
ś
nienie powietrza o temperaturze pocz
ą
tkowej –23
o
C podwoiło si
ę
izochorycznie, nale
ż
y ogrza
ć
gaz do temperatury:
A 23
o
C
B 230K
C 500K
D 500
o
C
7.
W czterech zamkni
ę
tych naczyniach o jednakowej pojemno
ś
ci znajduj
ą
si
ę
(w warunkach normalnch)
argon, brom, chlor i wodór. Najwi
ę
ksza ilo
ść
atomów znajduje si
ę
w naczyniu z:
A argonem
B bromem
C chlorem
D wodorem
8.
100g stopu glinu z cynkiem utleniono i otrzymano 51g Al
2
O
3
i 91g ZnO. W skład badanego stopu
wchodzi:
A 73% Zn. i 27% Al
B 27% Zn i 73% Al.
C 50% Zn i 50% Al.
D 46% Zn i 54% Al.
9.
Chlor na skal
ę
laboratoryjn
ą
mo
ż
na otrzyma
ć
działaj
ą
c na tlenek manganu(IV) kwasem solnym. Ile
chloru otrzyma si
ę
działaj
ą
c nadmiarem kwasu solnego na 26,1g tlenku manganu(IV)?
A 6,72dm
3
B 21,3g
C 0,3mola
D wszystkie odpowiedzi s
ą
poprawne

5
10.
Ile gramów chlorku baru nale
ż
y doda
ć
do roztworu, w którym rozpuszczono 4g mieszaniny Na
2
SO
4
i
K
2
SO
4
, aby mie
ć
pewno
ść
całkowitego wytr
ą
cenia siarczanów?
A 2,08g
B 5,86g
C 4,78g
D 8,49g
11.
2g pewnego dwuwarto
ś
ciowego metalu wypiera z roztworu kwasu w warunkach normalnych 1,12dm
3
wodoru. Wodorotlenek tego pierwiastka ma wzór:
A Ca(OH)
2
B Zn(OH)
2
C Pb(OH)
2
D Sr(OH)
2
E Ba(OH)
2
1.2. Chemia organiczna
12.
W wyniku utlenienia pewnego aldehydu otrzymano 43,2g srebra oraz 17,6g kwasu. Utlenianym
aldehydem był:
A aldehyd octowy (etanal)
B aldehyd propionowy (propanal)
C aldehyd masłowy (butanal)
D aldehyd walerianowy (pentanal)
13.
Podczas działania jednego mola bromu na jeden mol pewnego w
ę
glowodoru otrzymano tylko jeden
produkt reakcji – zwi
ą
zek o masie cz
ą
steczkowej 202. Reakcji bromowania został poddany:
A propan
B propen
C butan
D 2-buten
E benzen
14.
Do utwardzenia pewnego glicerydu zu
ż
yto 17,92dm
3
wodoru zmierzonego w warunkach normalnych.
Uzyskano przy tym 0,4mola tristearynianu gliceryny. Liczba wi
ą
za
ń
podwójnych w cz
ą
steczce tego
glicerydu przed uwodornieniem wynosiła:
A 1
B 2
C 3
D 4
15.
Na spalenie 2dm
3
acetylenu zu
ż
yto 20dm
3
powietrza (warunki normalne). Produktami tej reakcji były:
A C + H
2
O
B C + CO + H
2
O
C CO + CO
2
+ H
2
O
D CO
2
+ H
2
O
16.
Je
ś
li skroplimy wod
ę
wydzielaj
ą
c
ą
si
ę
podczas spalania 1mola glukozy C
6
H
12
O
6
, to jej obj
ę
to
ść
w
warunkach pokojowych b
ę
dzie wynosiła:
A ok. 135dm
3
B ok. 105dm
3
C ok. 134cm
3
D ok. 108cm
3
17.
Masa cz
ą
steczkowa tetrapeptydu otrzymanego w wyniku kondensacji cz
ą
steczek glicyny wynosi:
A 300u
B 246u
C 228u
D 210u
18.
Jaka jest masa cz
ą
steczkowa celulozy, je
ż
eli przyjmiemy,
ż
e jest ona zbudowana z 2000 reszt
glukozowych?
A 324000
B 360000
C 684000
D 648000

6
19.
Zakładaj
ą
c,
ż
e benzyna jest czystym oktanem, oblicz ile dm
3
tlenu (zmierzonego w warunkach
normalnych) potrzeba do spalenia 1g tej substancji?
A 1,26dm
3
B 2,46dm
3
C 22,4dm
3
D 44,8dm
3
20.
W warunkach normalnych 1dm
3
propanu wa
ż
y?
A 0,7g
B 1,34g
C 1,96g
D 2,58g
21.
G
ę
sto
ść
gazu b
ę
d
ą
cego mieszanin
ą
2 cz
ęś
ci obj
ę
to
ś
ciowych wodoru i 1 cz
ęś
ci obj
ę
to
ś
ciowej tlenku
w
ę
gla wyznaczona wzgl
ę
dem metanu wynosi:
A 0,67
B 1,49
C 0,33
D 10,67
E 16
2. Ustalanie wzoru empirycznego i rzeczywistego badanego zwi
ą
zku
22.
Jaki jest wzór hydratu chlorku wapnia, je
ż
eli wiadomo,
ż
e zawiera on 49,3% wody?
A CaCl
2
.
6H
2
O
B CaCl
2
.
2H
2
O
C CaCl
2
.
3H
2
O
D CaCl
2
.
4H
2
O
E CaCl
2
.
5H
2
O
23.
Odwa
ż
k
ę
hydratu siarczanu magnezu o masie 2,46g rozpuszczono w wodzie, nast
ę
pnie dodano w
nadmiarze chlorku baru i wytr
ą
cono osad BaSO
4
. Str
ą
cony osad wysuszono i zwa
ż
ono. Jaki jest wzór
hydratu siarczanu magnezu je
ś
li otrzymano 2,33g osadu siarczanu baru?
A MgSO
4
.
2H
2
O
B MgSO
4
.
5H
2
O
C MgSO
4
.
7H
2
O
D MgSO
4
.
10H
2
O
24.
Próbk
ę
uwodnionego jodku baru o masie 10,407g ogrzewano ostro
ż
nie a
ż
do całkowitego usuni
ę
cia
wody. Masa bezwodnej próbki wynosiła 9,520g. Ustal wzór hydratu jodku baru (uwodnionej soli).
A BaI
2
.
H
2
O
B BaI
2
.
2H
2
O
C BaI
2
.
3H
2
O
D BaI
2
.
4H
2
O
25.
Pewien zwi
ą
zek składa si
ę
w 18,26% z wapnia, w 32,42% z chloru, w 5,48% z wodoru i w 42,84% z
tlenu. Zwi
ą
zkiem tym jest:
A CaCl
2
.
4H
2
O
B CaCl
2
.
6H
2
O
C CaCl
2
.
8H
2
O
D CaCl
2
.
10H
2
O
26.
0,126g pewnego dikarboksylowego kwasu organicznego zawieraj
ą
cego wod
ę
krystalizacyjn
ą
rozpuszczono w wodzie uzyskuj
ą
c 25cm
3
roztworu, na zmiareczkowanie którego zu
ż
yto 20cm
3
0,1M roztworu
NaOH. Masa molowa bezwodnego, analizowanego kwasu wynosi 90g/mol. Kwas ten krystalizuje z:
A dwoma cz
ą
steczkami wody
B trzema cz
ą
steczkami wody
C czterema cz
ą
steczkami wody
D pi
ę
cioma cz
ą
steczkami wody E dziesi
ę
cioma cz
ą
steczkami wody

7
27.
Chloropochodna benzenu zawiera 48,35% chloru. Liczba atomów chloru w cz
ą
steczce tej pochodnej
wynosi:
A 4
B 3
C 2
D 1
28.
Zwi
ą
zek organiczny o masie cz
ą
steczkowej 92, w którym stosunek wagowy C:H:O=0,9:0,2:1,2 jest
alkoholem:
A alifatycznym jednowodorotlenowym
B alifatycznym dwuwodorotlenowym
C alifatycznym trójwodorotlenowym
D alifatycznym czterowodorotlenowym
E aromatycznym
29.
W wyniku analizy elementarnej stwierdzono,
ż
e próbka zwi
ą
zku o masie 1,5g zawierała 0,6g w
ę
gla, 0,1g
wodoru i tlen. Wybierz grup
ę
zwi
ą
zków, której wszystkie zwi
ą
zki spełniaj
ą
wyniki analizy:
A etanal, kwas 2-hydroksypropanowy, octan metylu
B metanal, kwas octowy, mrówczan metylu
C mrówczan 1-propylu, propionian metylu, eten-1,2-diol
D etanal, kwas mrówkowy, mrówczan 1-propylu
30.
Z 8g siarki otrzymano 20g tlenku. Siarka w tym tlenku wykazuje warto
ś
ciowo
ść
:
A +2
B +4
C +6
D -4
31.
Pewna masa w
ę
glowodoru składaj
ą
cego si
ę
z C i H w stosunku wagowym 6:1, zajmuje połow
ę
obj
ę
to
ś
ci, jak
ą
zaj
ę
łaby w tych samych warunkach ci
ś
nienia i temperatury dwa razy mniejsza masa CO.
Badanym w
ę
glowodorem jest:
A C
2
H
4
B C
3
H
6
C C
4
H
8
D C
8
H
16
32.
W wyniku całkowitego spalenia 2 moli pewnego w
ę
glowodoru powstaje 8moli wody. Ilo
ść
tlenu zu
ż
ytego
do spalenia jest równa 14moli. Spalanym w
ę
glowodorem jest:
A naftalen
B toluen
C pentyn
D okten

8
3. Stechiometria
mieszanin.
Reakcje
substratów
zmieszanych
w
stosunku
niestechiometrycznym.
33.
W czystym tlenie amoniak spala si
ę
do azotu wg równania reakcji:
4NH
3(g)
+ 3O
2(g)
2N
2(g)
+ 6H
2
O
(c)
Odmierzono 13dm
3
mieszaniny amoniaku i tlenu w warunkach normalnych. Obj
ę
to
ść
gazów po reakcji w
tych samych warunkach wynosiła 5,5dm
3
, a po przepuszczeniu ich przez płuczk
ę
z wod
ą
zmalała do 3dm
3
.
Skład obj
ę
to
ś
ciowy mieszaniny gazów przed reakcj
ą
był nast
ę
puj
ą
cy (w dm
3
):
Amniak
Tlen
A
6,5
6,5
B
10,2
2,8
C
8,5
4,5
D
7,4
5,6
34.
Do spalenia całkowitego 10cm
3
mieszaniny gazowej zło
ż
onej z metanu i propanu zu
ż
ywa si
ę
29cm
3
tlenu (w warunkach normalnych). Mieszanina zawierała (procent obj
ę
to
ś
ciwy):
A 70% CH
4
, 30% C
3
H
8
B 50% CH
4
, 50% C
3
H
8
C 30% CH
4
, 70% C
3
H
8
D 25% CH
4
, 75% C
3
H
8
35.
Mieszanina gazów w warunkach normalnych składa si
ę
z 4 moli CO, 2 moli CO
2
, 8 moli H
2
i 6 moli N
2
.
Masa tej cz
ęś
ci mieszaniny, w której znajduje si
ę
80dm
3
gazów niepalnych wynosi:
A 114,2g
B 171,4g
C 228,6g
D 342,8g
36.
Do spalenia dwóch obj
ę
to
ś
ci gazu syntezowego wystarcza jedna obj
ę
to
ść
tlenu. Gdyby w gazie
syntezowym zwi
ę
kszy
ć
zawarto
ść
tlenku w
ę
gla do 75% kosztem wodoru, wówczas do spalenia dwóch
obj
ę
to
ś
ci gazu potrzebna by była:
A taka sama obj
ę
to
ść
tlenu
B trzy razy mniejsza obj
ę
to
ść
tlenu
C 1,5 raza wi
ę
ksza obj
ę
to
ść
tlenu
D dwukrotnie wi
ę
ksza obj
ę
to
ść
tlenu
37.
Mieszanina gazów zawiera 25% obj
ę
to
ś
ciowych chloru i 75% obj
ę
to
ś
ciowych wodoru. Skład tej
mieszaniny w % wagowych jest nast
ę
puj
ą
cy:
A 75% chloru i 25% wodoru
B 92,2% chloru i 7,8% wodoru
C 71,8% chloru i 28,2% wodoru
D 97,2% chloru i 2,8% wodoru
38.
Ile powietrza potrzeba do otrzymania 77dm
3
dwutlenku siarki, w wyniku spalenia pirytu?
A 110dm
3
B 238dm
3
C 340dm
3
D 550dm
3
39.
Próbka zawieraj
ą
ca 0,5g mieszaniny stałych wodorków litu i wapnia podczas reakcji z wod
ą
tworzy
1,12dm
3
wodoru (w przeliczeniu na warunki normalne). Procentowa zawarto
ść
wodorku wapnia w
mieszaninie wynosi:
A 32,3%
B 66,7%
C 64,6%
D 11,2%
E 50%

9
40.
Do 100g mieszaniny CaCO
3
i CaO dodano nadmiar kwasu solnego. Obj
ę
to
ść
wydzielonego dwutlenku
w
ę
gla była równa (warunki normalne) 5,6dm
3
. Zawarto
ść
procentowa CaO w mieszaninie wynosi:
A 10%
B 25%
C 50%
D 75%
41.
Mieszanina BaCl
2
.
2H
2
O i LiCl wa
ż
y 0,6g, a po dodaniu AgNO
3
otrzymano 1,44g AgCl. Procentowa
zawarto
ść
Ba w mieszaninie pierwotnej wynosi:
A 13,7%
B 25%
C 75%
D 50%
E 16,7%
42.
Do probówek zawieraj
ą
cych po 25cm
3
0,5 molowych roztworów kwasów (rysunek) wprowadzono 0,05g
magnezu do ka
ż
dej
Mg
I
II
III
IV
HCl
H
2
SO
4
CH
3
COOH
H
3
PO
4
Obj
ę
to
ść
wydzielonego wodoru najwi
ę
ksza b
ę
dzie w probówce:
A I i II
B III
C IV
D we wszystkich jednakowa
4. Wydajno
ść
reakcji chemicznej
43.
Ile gramów chlorku metylu mo
ż
na otrzyma
ć
ze 100g metanolu, je
ż
eli wydajno
ść
reakcji wynosi 60%?
A 45,2g
B 68,7g
C 94,6g
D 100g
E 9,5g
44.
Zakładaj
ą
c,
ż
e przemiana:
etanol
etanal
kwas octowy
przebiega w ka
ż
dym etapie z 90% wydajno
ś
ci
ą
to z 23g etanolu otrzymano gramów kwasu octowego:
A 12,1
B 15,0
C 24,3
D 30,0
45.
Je
ż
eli w reakcji 30g glinu z nadmiarem rozcie
ń
czonego roztworu wodnego kwasu siarkowego(VI)
powstaje 30dm
3
H
2
(warunki normalne) to wydajno
ść
reakcji wynosi:
A 80,4%
B 85%
C 91,5%
D 100%

10
46.
Jaka obj
ę
to
ść
acetylenu (w przeliczeniu na warunki normalne) jest potrzebna do otrzymania 600g kwasu
octowego (metod
ą
Kuczerowa), je
ś
li wydajno
ść
w poszczególnych etapach przedstawionego poni
ż
ej
procesu wynosi: I – 45%, II – 40%:
H
C
C
H
+ H
2
O
kat.
CH
3
CHO
CH
3
CHO + [O]
kat.
CH
3
COOH
I
II
A 1,244m
3
B 0,224m
3
C 0,264m
3
D 0,600m
3
E 0,622m
3
47.
W procesie fermentacji octowej otrzymano 0,6kg 10% kwasu octowego Ile gramów 10% etanolu zu
ż
yto
w tym procesie je
ż
eli wydajno
ść
reakcji wynosiła 50%?
A 460g
B 920g
C 600g
D 1200g
E 230g
48.
Roztwór zawieraj
ą
cy 17g azotanu(V) srebra nasycono siarkowodorem. Masa wydzielonego siarczku
srebra(I) po ods
ą
czeniu i wysuszeniu wynosiła 7,44g. Wydajno
ść
procentowa tej reakcji jest równa:
A 30%
B 60%
C 43,8%
D 78,1%
49.
W reakcji CO + H
2
O = CO
2
+ H
2
u
ż
yto 2 mole CO i 1 mol H
2
O otrzymuj
ą
c 0,5 mola CO
2
. Wyznaczona na
podstawie powy
ż
szych danych wydajno
ść
reakcji wynosiła:
A 50%
B 25%
C 75%
D 12,5%
5. Roztwory
5.1. Pojecia podstawowe. Roztwory rzeczywiste i koloidalne
50.
Podstawowym kryterium podziału układów na roztwory rzeczywiste, koloidalne i zawiesiny jest:
A stopie
ń
rozdrobienia fazy zdyspergowanej
B rodzaj fazy zdyspergowanej
C wła
ś
ciwo
ś
ci elektryczne układu
D rodzaj fazy dyspersyjnej i zdyspergowanej
51.
W pojemniku w którym znajduje si
ę
w stanie równowagi woda w postaci ciekłej, para wodna i lód
znajduje si
ę
układ:
A niejednorodny, jednofazowy, wieloskładnikowy
B niejednorodny, wielofazowy, jednoskładnikowy
C jednorodny, jednofazowy, wieloskładnikowy
D jednorodny, wielofazowy, jednoskładnikowy

11
52.
Koloidy liofilowe w porównaniu z koloidami liofobowymi charakteryzuj
ą
si
ę
:
A wi
ę
ksz
ą
zdolno
ś
ci
ą
do peptyzacji
B łatwiejszym uleganiem procesowi spalania
C wi
ę
ksz
ą
odporno
ś
ci
ą
na działanie mocnych elektrolitów
D stopniem rozdrobnienia fazy dyspersyjnej
53.
Zjawisko wysalania białek polega na zmniejszeniu wzajemnych oddziaływa
ń
cz
ą
steczek białek i wody w
wyniku wprowadzenia jonów danej soli. Które z do
ś
wiadcze
ń
obrazuje to zjawisko?
białko + H
2
O
CuSO
4
Ca(OH)
2
(NH
4
)
2
SO
4
(CH
3
COO)
2
Pb
A
B
C
D
54.
Koagulacja białka jest to:
A zmiana sekwencji aminokwasów
B nieodwracalna zmiana struktury drugo- i trzeciorz
ę
dowej
C przej
ś
cie ze stanu zolu w
ż
el
D przej
ś
cie ze stanu
ż
elu w zol
55.
Elektroforeza jest procesem polegaj
ą
cym na ruchu cz
ą
steczek koloidalnych w polu elektrycznym
wytworzonym pomi
ę
dzy elektrodami. Je
ś
li proces ten przebiega w kierunku elektrody dodatniej nosi on nazw
ę
:
A migracji kationowej
B kataforezy
C anaforezy
D elektrodializy
56.
Dyfuzja to proces polegaj
ą
cy na:
A samorzutnym wyrównaniu st
ęż
e
ń
roztworów w wyniku przechodzenia substancji z o
ś
rodka o st
ęż
eniu
wy
ż
szym do o
ś
rodka o st
ęż
eniu ni
ż
szym
B podwy
ż
szaniu st
ęż
enia roztworu w wyniku przechodzenia substancji z osadu do roztworu, w wyniku
podwy
ż
szenia temperatury
C obni
ż
aniu st
ęż
enia roztworu w wyniku samorzutnego wytr
ą
cania si
ę
osadu z roztworu przesyconego
D zoboj
ę
tnianiu ładunku zewn
ę
trznego miceli w wyniku dodania mocnego elektrolitu

12
57.
Sporz
ą
dzono 105g nasyconego roztworu azotanu potasu, w temperaturze 60
o
C, który nast
ę
pnie
ozi
ę
biono do temperatury 20
o
C. Oszacuj mas
ę
wydzielonej po ozi
ę
bieniu soli, liczb
ę
moli (n) soli
rozpuszczonej w 105g roztworu – w temperaturze 60
o
C oraz st
ęż
enie procentowe (c
p
) roztworu w
temperaturze 20
o
C.
masa wydzielonej soli n
soli
w 60
o
C c
p
w 20
o
C
A
78,4g
5,4mol
48,02%
B
55,0g
2,70mol
24,00%
C
39,2g
0,54mol
24,01%
D
31,6g
0,44mol
12,00%
58.
Jaka jest rozpuszczalno
ść
CuSO
4
.
5H
2
O w wodzie w temperaturze 70
o
C je
ś
li st
ęż
enie nasyconego
roztworu siarczanu miedzi w tej temperaturze wynosi 28,6%?
A 80,8 g soli na 100g wody
B 28,6g soli na 100g wody
C 14,3g soli na 100g wody
D 20g soli na 100g wody
59.
Rozpuszczalno
ść
gazowego amoniaku w wodzie w temp. 293K i pod ci
ś
nieniem 1013hPa wynosi
702dm
3
w 1dm
3
wody. St
ęż
enie procentowe nasyconego roztworu amoniaku w wodzie w podanych
warunkach ci
ś
nienia i temperatury wynosi:
A 41,2%
B 34,8%
C 33,2%
D 70,2%
60.
Do 100g wody wprowadzono 1,29g w
ę
gliku wapnia. Otrzymany w wyniku reakcji roztwór rozcie
ń
czono
do obj
ę
to
ś
ci 1dm
3
. St
ęż
enie molowe Ca(OH)
2
w roztworze po rozcie
ń
czeniu wynosiło:
A 0,01M
B 0,02M
C 0,05M
D 0,2M
61.
St
ęż
enie procentowe roztworu kwasu ortofosforowego, który otrzymano w wyniku reakcji 14,2g
pi
ę
ciotlenku fosforu z 85,8g wody wynosi w przybli
ż
eniu:
A 10%
B 14%
C 20%
D 25%
62.
Nale
ż
y otrzyma
ć
10g 20% roztworu NaCl, maj
ą
c do dyspozycji stały NaCl oraz 10% roztwór NaCl. Ile
gramów stałego NaCl oraz jego 10% roztworu nale
ż
y zmiesza
ć
ze sob
ą
aby otrzyma
ć
żą
dany roztwór?
A 5g stałego NaCl i 5g 10% roztworu
B 2g stałego NaCl i 18g 10% roztworu
C 1,11g stałego NaCl i 8,89g 10% roztworu
D 0,55g stałego NaCl i 9,45g 10% roztworu
63.
Ile gramów siarczanu(VI) potasowego znajduje si
ę
w 125cm3 0,5M roztworu tej soli?
A ok. 87g
B ok. 67g
C ok. 22g
D ok. 11g
64.
Ile gramów wody nale
ż
y doda
ć
do 240g roztworu NaCl o st
ęż
eniu 10% aby otrzyma
ć
roztwór 6%?
A 60g
B 144g
C 160g
D 400g

13
65.
Zmieszano trzy roztwory tej samej substancji: 100g 50% roztworu, 300g –30% i 600g – 10%. St
ęż
enie
otrzymanego roztworu wynosi:
A 20%
B 30%
C 45%
D 21%
66.
W jakim stosunku obj
ę
to
ś
ciowym nale
ż
y zmiesza
ć
wod
ę
z roztworem NaNO
3
o st
ęż
eniu 1,5M aby jego
st
ęż
enie zmalało trzykrotnie?
A 1:2
B 1:1
C 1:3
D 2:1
67.
Przeprowadzono całkowit
ą
fermentacj
ę
glukozy zawartej w 20dm
3
roztworu i otrzymano 6,02
.
10
24
cz
ą
steczek CO
2
. St
ęż
enie molowe glukozy w badanym roztworze wynosiło:
A 0,2M
B 0,25M
C 0,5M
D 2M
5.2. Zoboj
ę
tnianie roztworów
68.
Jaka obj
ę
to
ść
2-molowego roztworu H
2
SO
4
jest potrzebna do zoboj
ę
tnienia roztworu zawieraj
ą
cego 37g
Ca(OH)
2
i 28g KOH?
A 0,375dm
3
B 0,500dm
3
C 0,750dm
3
D 0,250dm
3
69.
W reakcji zoboj
ę
tnienia 20cm
3
kwasu solnego u
ż
yto 16cm
3
0,1M roztworu zasady sodowej. Okre
ś
l
st
ęż
enie molowe kwasu.
A 0,10mol/dm
3
B 0,01mol/dm
3
C 0,05mol/dm
3
D 0,08mol/dm
3
70.
W jakim stosunku obj
ę
to
ś
ciowym nale
ż
y zmiesza
ć
2M roztwór HCl i 1,5 molowy roztwór Ca(OH)
2
aby
otrzyma
ć
roztwór oboj
ę
tny?
A 2:1
B 2:1,5
C 4:1,5
D 3:2
71.
Do reakcji zoboj
ę
tnienia zu
ż
yto 125cm
3
0,5M roztworu H
2
SO
4
. Ile gramów jonów wodorowych wzi
ę
ło
udział w reakcji?
A 0,625g H
+
B 0,500g H
+
C 0,250g H
+
D 0,125g H
+
72.
Próbk
ę
składaj
ą
c
ą
si
ę
wył
ą
cznie Li
2
CO
3
i BaCO
3
o masie 1g zoboj
ę
tniono przy pomocy 15cm
3
1 molowego kwasu solnego. Procentowa zawarto
ść
BaCO
3
w próbce wynosiła:
A 71,3%
B 50%
C 25%
D 79,2%
73.
Zmieszano 40% roztwór wodorotlenku potasu ze stechiometryczn
ą
ilo
ś
ci
ą
8 molowego roztworu kwasu
azotowego(V) o g
ę
sto
ś
ci 1,24g/cm
3
. St
ęż
enie procentowe otrzymanego roztworu azotanu(V) potasu wynosi:
A 41,9%
B 40,3%
C 34,2%
D 32,3%

14
74.
Do roztworu zawieraj
ą
cego 0,25mola NH
3
dodano 0,125mola H
2
SO
4
. Uzyskany roztwór ma odczyn:
A kwa
ś
ny
B oboj
ę
tny
C zasadowy
D na podstawie danych zawartych w zadaniu nie mo
ż
na okre
ś
li
ć
odczynu.
75.
Do 20cm
3
roztworu Ca(OH)
2
o st
ęż
eniu 0,01M dodano 20cm
3
roztworu HCl o takim samym st
ęż
eniu
oraz kilka kropel fenoloftaleiny. Roztwór po do
ś
wiadczeniu:
A miał barw
ę
malinowo-czerwon
ą
B był bezbarwny
C miał barw
ę
ż
ółt
ą
D miał barw
ę
niebiesk
ą
6. Budowa atomu
76.
Który zestaw liczb kwantowych dotyczy elektronów atomu helu?
jeden elekton
drugi elektron
n
m
l
m
s
n
m
l
m
s
A
1
1
0
-1/2
1
0
1
+1/2
B
1
0
0
-1/2
1
0
0
+1/2
C
1
0
1
-1/2
1
1
0
+1/2
D
1
1
1
-1/2
1
1
1
+1/2
77.
Ile powłok elektronowych posiadaj
ą
nast
ę
puj
ą
ce jony:
Na
+
Mn
2+
As
3+
S
2-
Fe
3+
A
3
3
4
4
3
B
2
4
3
2
3
C
2
3
4
3
3
D
3
4
3
2
4
E
2
3
4
3
4
78.
Rozwa
ż
nast
ę
puj
ą
cy zapis konfiguracji elektronowej
przedstawiony za pomoc
ą
liczb kwantowych oraz
systemem klatkowym: 1s
2
2s
2
2p
6
3s
2
3p
6
1s
2
2s
2
2p
6
3s
2
3p
6
Wska
ż
, który atom lub jon nie mo
ż
e posiada
ć
takiego zapisu konfiguracji elektronowej
A Ar
B Cl
-
C Mg
2+
D S
2-
79.
Pewien pierwiastek jest mieszanin
ą
dwóch izotopów, z których jeden o zawarto
ś
ci procentowej 54,8% -
zawiera 44 neutrony w j
ą
drze, drugi za
ś
46 neutronów. Masa atomowa tego pierwiastka jest równa
79,904u. Liczba atomowa tego pierwiastka wynosi:
A 35
B 45
C 80
D 122
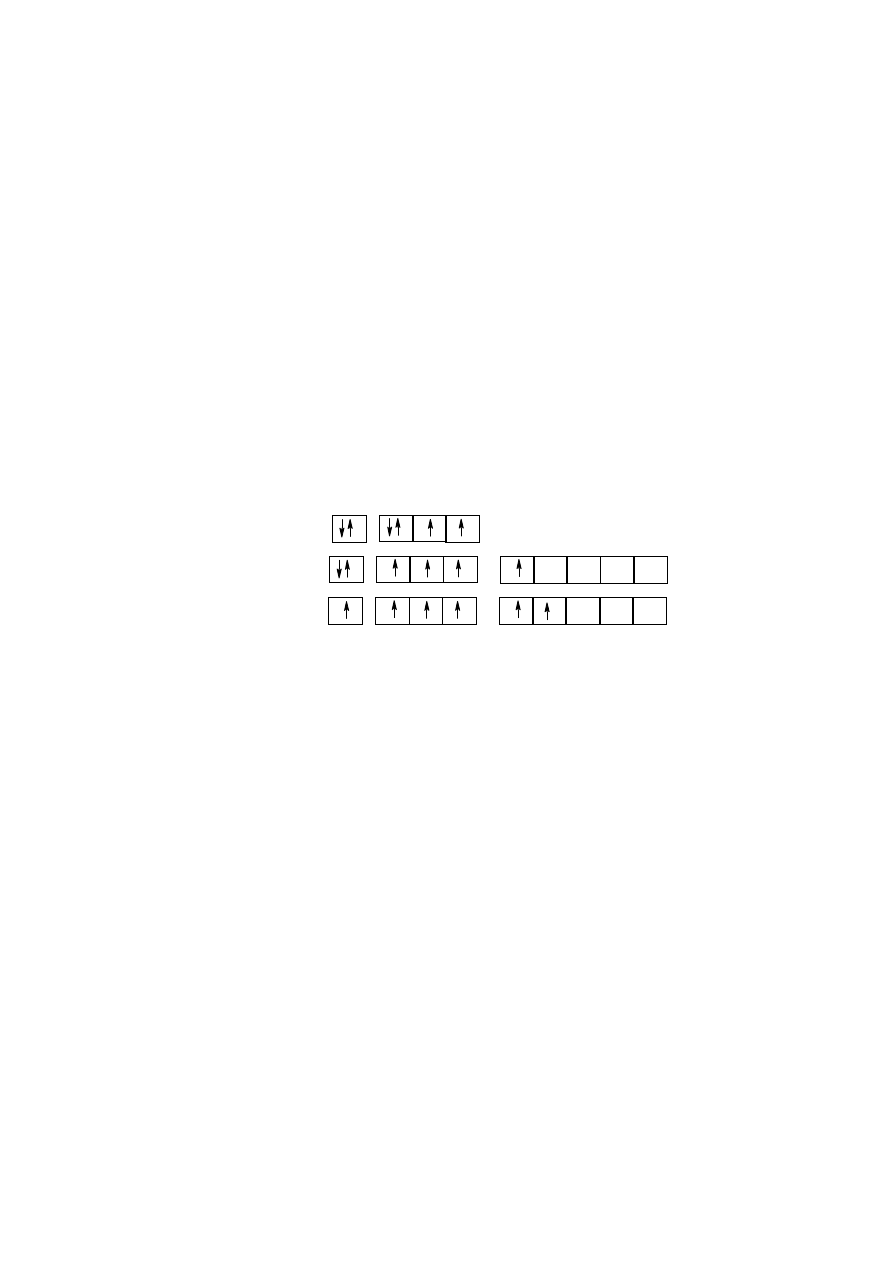
15
80.
Naturalna mied
ź
składa si
ę
z izotopów
63
Cu i
65
Cu. Stosunek liczby atomów
63
Cu do liczby atomów
65
Cu
w mieszaninie jest równy 8:3.
Ś
rednia masa atomowa miedzi wynosi:
A 63,35
B 63,54
C 64,00
D 64,05
81.
W reakcji jednowarto
ś
ciowego pierwiastka A b
ę
d
ą
cego mieszanin
ą
trzech izotopów z jenowarto
ś
ciowym
pierwiastkiem B otrzymano 9 cz
ą
steczek typu AB ró
ż
ni
ą
cych si
ę
składem izotopowym. Pierwiastek B
wchodz
ą
cy w t
ę
reakcj
ę
był mieszanin
ą
:
A 2 izotopów
B 5 izotopów
C 3 izotopów
D 6 izotopów
E 9 izotopów
82.
Energia reakcji
−
+
+
→
e
Cl
Cl
(g)
0
(g)
wynosz
ą
ca
∆
E=+1254kJ jest dla atomu chloru:
A energi
ą
wi
ą
zania chemicznego
B energi
ą
jonizacji
C elektroujemno
ś
ci
ą
D powinowactwem elektronowym
83.
Które rysunki przedstawiaj
ą
stan podstawowy, a które stan wzbudzony atomu siarki?
I
II
III
A I i II stan podstawowy, a III stan wzbudzony B I i III stan wzbudzony, a II stan podstawowy
C I i III stan podstawowy, a II stan wzbudzony D I stan podstawowy, a II i III stan wzbudzony
84.
Liczba atomowa bromu wynosi 35, a liczba masowa jednego z jego izotopów wynosi 79. Odpowiadaj
ą
cy
mu jon bromkowy zawiera nast
ę
puj
ą
c
ą
liczb
ę
elektronów:
A 34
B 36
C 78
D 80
85.
Jon glinowy Al
3+
zbudowany jest z 14 neutronów oraz:
A 16 protonów i 13 elektronów
B 10 protonów i 13 elektronów
C 10 protonów i 10 elektronów
D 13 protonów i 10 elektronów
86.
Ni
ż
ej podano kilka cech, które mo
ż
na przypisa
ć
cz
ą
steczce elementarnej:
a) wyst
ę
puje w j
ą
drze
b) wyst
ę
puje w warstwie elektronowej
c) posiada dodatni ładunek elektryczny
d) posiada ujemny ładunek elektryczny
e) nie posiada ładunku elektrycznego
f) posiada mas
ę
atomow
ą
1
g) przyjmuje si
ę
,
ż
e posiada znikom
ą
mas
ę
protonowi przypisuje si
ę
cechy:
A a, c, f
B a, d, g
C a, e, f
D b, d, g

16
87.
Najwy
ż
sza liczba elektronów o tej samej głównej liczbie kwantowej wynosi:
A 2n
B n
C 2n
2
D n/2
88.
Wodór, deuter i tryt ró
ż
ni
ą
si
ę
mi
ę
dzy sob
ą
liczb
ą
:
A protonów
B atomow
ą
C elektronów
D neutronów
89.
Przedstawione j
ą
dra atomowe
F
O,
N,
17
9
17
8
17
7
s
ą
izobarami poniewa
ż
:
A znajduj
ą
si
ę
w tym samym okresie
B posiadaj
ą
równ
ą
liczb
ę
protonów w j
ą
drze
C posiadaj
ą
równ
ą
liczb
ę
neutronów w j
ą
drze D posiadaj
ą
równ
ą
liczb
ę
nukleonów
90.
Gazowy chlor stanowi mieszanin
ę
dwóch trwałych izotopów: 75,53%
35
Cl i 24,47%
37
Cl. Jego g
ę
sto
ść
w
warunkach normalnych wynosi:
A 3,17g/dm
3
B 22,4g/dm
3
C 7,1g/dm
3
D 3,55g/dm
3
91.
Długo
ść
fali odpowiadaj
ą
cej granicy serii widmowej w atomie wodoru obliczamy ze wzoru:
A
)
k
1
n
1
cR(
λ
1
2
2
−
=
B
2
n
cR
λ
1
=
C
2
n
R
λ
1
=
D
)
k
1
n
1
cR(
λ
1
2
2
+
=
92.
Długo
ść
fali odpowiadaj
ą
cej przej
ś
ciu elektronu z poziomu n na poziom 3 obliczymy ze wzoru:
A
)
3
1
n
1
R(
λ
1
2
2
−
=
B
)
n
1
3
1
R(
λ
1
2
2
−
=
C
)
n
R(3
λ
1
2
2
−
=
D
)
3
R(n
λ
1
2
2
−
=
93.
Energia elektronu na pierwszej orbicie dozwolonej w atomie wodoru ma warto
ść
E=-13,6eV.
Przeskakuj
ą
c z tej orbity na trzeci
ą
orbit
ę
elektron pochłania kwant energii o warto
ś
ci:
A 1,5eV
B 4,5eV
C 9,1eV
D 12,1eV
94.
Energia elektronu wodoru w stanie podstawowym wynosi E=-13,6eV. Kwant emitowany przy przej
ś
ciu z
orbity drugiej na pierwsz
ą
ma zatem energi
ę
:
A 3,4eV
B 6,8eV
C 10,2eV
D 12,1eV
17
95.
Zale
ż
no
ść
energii całkowitej elektronu w atomie wodoru od głównej liczby kwantowej najlepiej
przedstawia rysunek:
E
n
0
.
.
.
. .
.
E
n
0
E
n
0
.
.
.
. . .
E
n
0
A
B
C
D
96.
Ile linii b
ę
dzie zawierało widmo emisyjne, je
ż
eli atomy badanego pierwiastka w warunkach rejestracji
widma znajdowały si
ę
w 5 ró
ż
nych stanach energetycznych?
A 5
B 10
C 15
D 25
97.
W ilu ró
ż
nych stanach energetycznych znajdowały si
ę
elektrony atomu danego pierwiastka, je
ś
li
podczas rejestracji widma emisyjnego stwierdzono obecno
ść
6 linii?
A 3
B 4
C 6
D 12
7. Zwi
ą
zek budowy atomu z układem
98.
Reaktywno
ść
fluorowców, jak wykazano do
ś
wiadczalnie maleje w kierunku Cl>Br>I. Jest to
spowodowane zmianami:
♦
promienia atomowego
♦
powinowactwa elektronowego
♦
elektroujemno
ś
ci
Wielko
ś
ci te zmieniaj
ą
si
ę
kolejno:
promie
ń
atomowy
powinowactwo elektronowe
elektroujemno
ść
A
ro
ś
nie
maleje
maleje
B
maleje
jest stałe
ro
ś
nie
C
ro
ś
nie
ro
ś
nie
maleje
D
maleje
jest stałe
ro
ś
nie
99.
Charakter metaliczny pierwiastków w tej samej grupie ro
ś
nie ze wzrostem liczby atomowej poniewa
ż
:
A ro
ś
nie wtedy liczba elektronów walencyjnych
B rosn
ą
promienie atomowe pierwiastków i łatwiej je zjonizowa
ć
C wzrasta ładunek j
ą
dra i elektrony silniej z nim oddziaływuj
ą
D wi
ę
ksza liczba atomowa oznacza wi
ę
ksz
ą
liczb
ę
elektronów i wi
ę
ksz
ą
elektroujemno
ść

18
100.
Na podstawie budowy atomu podanych metali okre
ś
l, który z nich ma najmniejsz
ą
elektroujemno
ść
:
X: 1s
2
2s
2
2p
6
3s
1
Y: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
Z 1s
2
2s
1
A atom Z, gdy
ż
elektron walencyjny le
ż
y najbli
ż
ej j
ą
dra
B atom Y, gdy
ż
elektron walencyjny le
ż
y najdalej od j
ą
dra
C wszystkie atomy maj
ą
jednakow
ą
elektroujemno
ść
, gdy
ż
posiadaj
ą
jeden elektron w powłoce
walencyjnej
D atom X, gdy
ż
le
ż
y w I grupie układu okresowego
101.
Rysunek obok przdstawia uproszczony schemat
układu okresowego. Która linia wskazuje
wzorost elektroujemno
ś
ci pierwiastków?
A linie a i d
B tylko linia a
C tylko linia c
D linia b i c
I II III IV V VI VII VIII
1
2
3
4
5
6
7
a
b
c
d
102.
Wielko
ść
promienia kationów pierwiastków nale
żą
cych do tej samej grupy głównej wraz ze wzrostem
masy atomowej:
A maleje
B wzrasta
C nie zmienia si
ę
D równa jest promieniowi odpowiadaj
ą
cych atomów
103.
Pewien pierwiastek X reaguje z fluorem, daj
ą
c zwi
ą
zki o wzorach: XF
2
, XF
4
, X
2
F
10
, XF
6
. Do której grupy
układu okresowego nale
ż
y pierwiastek X?
A II
B IV
C V
D VI
104.
Pierwiastki znajduj
ą
ce si
ę
w jednej głównej grupie układu okresowego maj
ą
:
A tak
ą
sam
ą
liczb
ę
elektronów walencyjnych
B w analogicznych zwi
ą
zkach t
ę
sam
ą
warto
ś
ciowo
ść
C zbli
ż
one wła
ś
ciwo
ś
ci chemiczne
D wszystkie wymienione wy
ż
ej zdania s
ą
prawdziwe
105.
Pierwiastki chemiczne C, N, O, F:
A nale
żą
do jednego okresu i charakteryzuj
ą
si
ę
jednakow
ą
elektroujemno
ś
ci
ą
B s
ą
uszeregowane według malej
ą
cej elektroujemno
ś
ci
C s
ą
uszeregowane według wzrastaj
ą
cej elektroujemno
ś
ci
D niemetaliczny charakter tych pierwiastków od C do F ro
ś
nie, za
ś
kwasowe wła
ś
ciwo
ś
ci malej
ą

19
106.
Spo
ś
ród pierwiastków II okresu nale
żą
cych do bloku energetycznego p, w stanie wzbudzonym mog
ą
wyst
ę
powa
ć
:
A tylko bor i w
ę
giel
B beryl, bor i w
ę
giel
C azot, tlen, fluor
D wszystkie za wyj
ą
tkiem neonu
107.
Zapis rozmieszczenia elektronów powłoki walencyjnej ns
2
np
2
odpowiada pierwiastkom grupy:
A w
ę
glowców
B tlenowców
C berylowców
D azotowców
108.
Który z poni
ż
szych szeregów pierwiastków jest uło
ż
ony według wzrastaj
ą
cych promieni atomowych:
A Li, Be, B, C
B I, Br, Cl, F
C Si, P, S, Cl
D P, As, Sb, Bi
8. Przemiany j
ą
drowe
109.
Szybko
ść
rozpadu promieniotwórczego jest cz
ę
sto wyra
ż
ana okresem połowicznego zaniku, to znaczy
czasem w którym połowa izotopu ulegnie rozpadowi. Czas połowicznego zaniku dla izotopu w
ę
gla
C
14
6
oszacowano na 5720 lat. Je
ś
li zało
ż
ymy,
ż
e w dniu dzisiejszym w badanej próbce stwierdzono 60mg
izotopu w
ę
gla
C
14
6
to jaka masa tego izotopu pozostanie po 22880 latach?
A 3,75mg
B 7,5mg
C 15mg
D 30mg
110.
Okres połowicznego rozpadu pewnego pierwiastka promieniotwórczego
τ
=15dni. 12,5% j
ą
der tego
pierwiastka pozostanie po czasie:
A 45dni
B 60dni
C 90dni
D 120dni
111.
Czas połowicznego zaniku izotopu
218
Po wynosi 3,03min. St
ą
d mo
ż
na obliczy
ć
,
ż
e
ś
redni czas
ż
ycia
jednego nuklidu wynosi: (ln2=0,693)
A 6,1min
B 4,4min
C 0,227min
D 0,44min
112.
W ci
ą
gu 4 godzin 75% pocz
ą
tkowej liczby j
ą
der izotopu promieniotwórczego uległo rozpadowi. Czas
połowicznego zaniku tego izotopu wynosi:
A 12 godz.
B 6 godz.
C 4 godz.
D 2 godz.
113.
Liczba rozpadów promieniotwórczych pierwiastka X, zachodz
ą
cych w danej próbce w jednostce czasu,
w miar
ę
upływu czasu:
A maleje gdy
ż
maleje liczba j
ą
der danego pierwiastka
B maleje na skutek zmniejszenia si
ę
aktywno
ś
ci tej próbki
C nie ulega zmianie, gdy
ż
stała rozpadu nie zale
ż
y od czasu
D nie ulega zmianie, bo w ka
ż
dym okresie półtrwania rozpadowi ulega połowa j
ą
der atomowych

20
114.
Pacjentowi podano do
ż
ylnie 1cm
3
roztworu izotopu promieniotwórczego, nie adsorbowalnego w
organizmie, o aktywno
ś
ci A
1
. Aktywno
ść
1cm
3
krwi pobranej od pacjenta po 30min wynosiła A
2
. Je
ż
eli okres
połowicznego rozpadu tego izotopu promieniotwórczego wynosił
τ
=30min, to obj
ę
to
ść
krwi pacjenta
wyra
ż
ona w cm
3
była równa:
A 0,25A
1
/A
2
B 0,5A
1
/A
2
C A
1
/A
2
D 2A
1
/A
2
115.
J
ą
dro pierwiastka o liczbie masowej A i liczbie atomowej Z uległo dwukrotnie przemianie
α
i dwukrotnie
przemianie
β
−
.
Pierwiastek który powstał w wyniku tych przemian:
A ma liczb
ę
masow
ą
A
1
=A-10 i liczb
ę
atomow
ą
Z
1
=Z
B ma liczb
ę
masow
ą
A
1
=A-8 i liczb
ę
atomow
ą
Z
1
=Z
C ma liczb
ę
masow
ą
A
1
=A-8 i liczb
ę
atomow
ą
Z
1
=Z-2
D ma liczb
ę
masow
ą
A
1
=A-4 i liczb
ę
atomow
ą
Z
1
=Z+2
116.
W wyniku przemian j
ą
drowych j
ą
dro
Ra
226
88
przekształciło si
ę
w j
ą
dro
At
218
85
. S
ą
przy tym emitowane:
A cz
ą
stka
β
−
i cz
ą
stka
α
B 2 cz
ą
stki
β
−
i cz
ą
stka
α
C cz
ą
stka
β
−
i 2 cz
ą
stki
α
D 2 cz
ą
stki
β
−
i 2 cz
ą
stki
α
117.
Najwi
ę
kszy zasi
ę
g w powietrzu z podanych poni
ż
ej rodzajów promieniowania ma promieniowanie:
A
α
B
β
−
C
β
+
D
γ
118.
Rozczepienie uranu
235
U zachodzi zgodnie z równaniem:
n
3
E
Kr
n
U
1
0
A
Z
92
36
1
0
235
92
+
+
→
+
Nuklidem
E
A
Z
jest:
A
Ba
141
56
B
Ba
138
56
C
Kr
86
36
D
Kr
84
36
119.
Wska
ż
izobary i izotopy:
Izobary
Izotopy
A
Th
i
Ra
228
90
224
88
At
i
Po
216
85
216
84
B
Rn
i
Ra
220
86
228
88
At
i
Rn
216
85
220
86
C
Po
i
Th
216
84
228
90
Th
i
Ra
228
90
223
88
D
At
i
Po
216
85
216
84
Ra
i
Ra
224
88
228
88
21
120.
Na wykresie przedstawiono zale
ż
no
ść
liczby j
ą
der pierwiastka
promieniotwórczego w
ź
ródle promieniowania od czasu. Z wykresu
wynika,
ż
e okres połowicznego rozpadu i stała rozpadu
promieniotwórczego tego pierwiastka wynosz
ą
:
A
τ
=1ks, k=7,0
.
10
-4
s
-1
B
τ
=1ks, k=3,5
.
10
-4
s
-1
C
τ
=2ks, k=7,0
.
10
-4
s
-1
D
τ
=2ks, k=3,5
.
10
-4
s
-1
121.
Stała rozpadu promieniotwórczego pewnego izotopu wynosi 1,73
.
10
-4
lat
-1
. Oznacza to,
ż
e po upływie
12000lat pozostała nast
ę
puj
ą
ca cz
ęść
pocz
ą
tkowej ilo
ś
ci tego izotopu (ln2=0,693):
A 1/20
B 1/8
C ¼
D 1/2
122.
Przemianie j
ą
drowej zwanej „wychwytem K” polegaj
ą
cej na wychwyceniu przez j
ą
dro elektronu z
poziomu elektronowego K towarzyszy:
A obni
ż
enie liczby atomowej o 1, przy równoczesnym wzro
ś
cie liczby masowej pierwiastka o 1 w wyniku
zachodz
ą
cej reakcji:
n
e
p
1
0
1
1
→
+
−
B obni
ż
enie liczby atomowej o 1 bez zmiany liczby masowej pierwiastka
C podwy
ż
szenie o 1 liczby masowej bez zmiany liczby atomowej pierwiastka
D utworzenie jonu jednododatniego przy jednoczesnym wzro
ś
cie liczby masowej pierwiastka o 1
9. Przewidywanie budowy przestrzennej
9.1. Hybrydyzacja
Przed rozwi
ą
zywaniem testów poczytaj o hybrydyzacji na stronie:
http://www.chemorganiczna.com/nieorganiczna/hybrydyzacja/hybrydyzacja.shtml
123.
Hybrydyzacja orbitali atomowych to:
A egzotermiczny proces uwspólniania pary elektronowej
B mieszanie funkcji falowych atomów tworz
ą
cych wi
ą
zanie
C zabieg czysto matematyczny prowadz
ą
cy do obliczenia rozkładu przestrzennego elektronów w
cz
ą
steczkach
D delokalizacja elektronów na cał
ą
cz
ą
steczk
ę
, jak np. w cz
ą
steczce benzenu
E zmiana kształtu orbitali atomowych pod wpływem ró
ż
nic w elektroujemno
ś
ci atomów tworz
ą
cych wi
ą
zanie
22
124.
K
ą
ty mi
ę
dzy wi
ą
zaniami w cz
ą
steczce CO
2
wynosz
ą
180
o
, a w cz
ą
steczce H
2
O ok. 105
o
, poniewa
ż
:
A ró
ż
nica elektroujemno
ś
ci mi
ę
dzy atomami tlenu i w
ę
gla jest mniejsza ni
ż
mi
ę
dzy atomami tlenu i wodoru
B w cz
ą
steczce CO
2
wyst
ę
puj
ą
wi
ą
zania podwójne, a w cz
ą
steczce H
2
O pojedyncze
C atomy tlenu s
ą
dwuwarto
ś
ciowe, a w
ę
gla czterowarto
ś
ciowe
D orbitale atomu w
ę
gla w CO
2
s
ą
w stanie hybrydyzacji sp, a orbitale atomu tlenu w H
2
O w stanie
hybrydyzacji sp
3
E prawdziwe jest A i B
125.
Wybierz grup
ę
trzech zwi
ą
zków, w cz
ą
steczkach których chocia
ż
jeden atom ma zhybrydyzowane
orbitale sp
3
A HCHO, CH
3
COCH
3
, HCOOH
B CO, BeCl
2
, CH
3
OH
C C
2
H
4
, C
6
H
6
, H
2
O
D H
2
O, CH
4
, NH
3
E CH
3
CONH
2
, BF
3
, C
2
H
2
126.
Jakie figury geometryczne opisuj
ą
cz
ą
steczk
ę
nast
ę
puj
ą
cego zwi
ą
zku organicznego:
CH
2
=CH-CH
2
-CH=CH
2
A cz
ą
steczka ma budow
ę
liniow
ą
B ze wzgl
ę
du na wi
ą
zania wielokrotne cz
ą
steczka nie jest liniowa, ale całkiem płaska
C poza jednym tetraedrem reszta atomów w
ę
gla umieszczona jest nieliniowo i niekoniecznie w jednej
płaszczy
ź
nie
D poza jednym tetraedrem reszta atomów w
ę
gla umieszczona jest wzdłu
ż
jednej prostej
E ze wzoru strukturalnego tego w
ę
glowodoru nie mo
ż
na okre
ś
li
ć
uło
ż
enia atomów w
ę
gla i wodoru w
cz
ą
steczce tego zwi
ą
zku.
127.
Cz
ą
steczki: tiofenu, aldehydu benzoesowego i chloroetenu wykazuj
ą
wspólne wła
ś
ciwo
ś
ci:
A atomy w
ę
gla w nich s
ą
w stanie hybrydyzacji sp
B wykazuj
ą
wła
ś
ciwo
ś
ci zasadowe
C s
ą
zwi
ą
zkami aromatycznymi
D atomy w
ę
gla w nich s
ą
w stanie hybrydyzacji sp
2
i w zwi
ą
zku z tym s
ą
płaskie
E atomy w
ę
gla w nich s
ą
w stanie hybrydyzacji sp
3
128.
Rysunki od I do IV przedstawiaj
ą
kształty orbitali:
I
II
III
IV
I
II
III
IV
A
zhybrydyzowane orbitale sp
orbital p
orbital s
zhybrydyzowane orbitale sp
2
B
orbital p
orbital d
orbital f
zhybrydyzowane orbitale sp
2
C
zhybrydyzowane orbitale sp
3
orbital p
orbital p
zhybrydyzowane orbitale sp
D
zhybrydyzowane orbitale sp
2
zhybrydyzowane
orbitale sp
zhybrydyzowane orbitale
sp
2
orbital p

23
129.
W cz
ą
steczce zwi
ą
zku organicznego o nazwie trans-2-buten (trans-but-2-en), w jednej płaszczy
ź
nie le
żą
:
A 2 atomy w
ę
gla
B 3 atomy w
ę
gla
C 4 atomy w
ę
gla
D wszystkie atomy
130.
Hybrydyzacja digonalna atomu w
ę
gla wyst
ę
puje jako jedyna we wszystkich cz
ą
steczkach wymienionych
w punkcie:
A C
2
H
2
, CO
2
, C
4
H
2
, HCN
B CO, C
3
H
4
, C
6
H
6
, C
60
C (COOH)
2
, C
2
H
4
, CH
3
COOH, C
3
H
8
D C
2
H
4
, C
2
H
5
CN, C
3
H
4
, HCN
131.
W cz
ą
steczce acetylenu HC
≡
CH obydwa atomy w
ę
gla wykazuj
ą
hybrydyzacj
ę
sp. Wynika z tego,
ż
e
wi
ą
zania w tej cz
ą
steczce utworzone zostały przez nast
ę
puj
ą
ce orbitale ka
ż
dego atomu w
ę
gla:
A 1 orbital atomowy s i jeden orbital atomowy p
B 2 orbitale atomowe s i dwa orbitale atomowe p
C 1 orbital zhybrydyzowany sp i 2 orbitale atomowe p
D 2 orbitale zhybrydyzowane sp i 2 orbitale atomowe p
132.
Wybierz zestaw w którym cz
ą
steczki ró
ż
ni
ą
si
ę
momentem dipolowym
A BCl
3
, SO
2
B SO
3
, CO
2
C BeH
2
, CH
4
D CCl
4
, NO
3
-
133.
Moment dipolowy cz
ą
steczki azotu równa si
ę
zero poniewa
ż
atomy azotu:
A s
ą
mało aktywne chemicznie
B charakteryzuj
ą
si
ę
jednakow
ą
elektroujemno
ś
ci
ą
C ulegaj
ą
hybrydyzacji typu sp
D tworz
ą
ze sob
ą
jedno wi
ą
zanie
σ
i dwa mało trwałe wi
ą
zania typu
π
134.
Warto
ść
momentu dipolowego cz
ą
steczki wynika z niesymetrycznego rozło
ż
enia ładunku elektrycznego
zwi
ą
zanego z polaryzacj
ą
wi
ą
za
ń
i ich geometri
ą
. Spo
ś
ród poni
ż
ej wymienionych:
1. CH
4
2 CH
3
Cl
3. CH
2
Cl
2
4 CHCl
3
5 CCl
4
momentem dipolowym równym zeru charakteryzuj
ą
si
ę
cz
ą
steczki substancji:
A wszystkich
B tylko 1, 3 i 5
C tylko 1 i 5
D
ż
adnej
24
9.2. Metoda VSEPR
135.
Metoda VSWPR pozwala na okre
ś
lenie budowy przestrzennej ka
ż
dej drobiny zło
ż
onej z pierwiastków
nale
żą
cych do grup głównych układu okresowego, je
ś
li t
ę
drobin
ę
mo
ż
na zapisa
ć
w postaci wzoru
ogólnego: EA
n
H
m
gdzie:
E- atom centralny; A – ligand z wyj
ą
tkiem atomu wodoru jako ligandu
n – ł
ą
czna liczba ligandów A; m – liczba atomów wodoru
O geometrii zwi
ą
zku decyduje liczba przestrzenna (Lp).
Warto
ś
ci liczby przestrzennej dla nast
ę
puj
ą
cych drobin: HCN, SO
4
2-
, NH
4
+
, SO
2
wynosz
ą
odpowiednio:
HCN
SO
4
2-
NH
4
+
.
SO
2
A
2
4
4
3
B
0
-2
1
0
C
2
4
4
2
D
4
2
3
2
E
4
2
2
4
136.
Jedn
ą
z metod pozwalaj
ą
cych na okre
ś
lenie budowy przestrzennej drobiny zło
ż
onej z pierwiastków
nale
żą
cych do grup głównych układu okresowego jest metoda VSEPR (Valence Shell Electron Pair
Repulsion). Według wylicze
ń
w oparciu o zało
ż
enia metody VSEPR jon SO
4
2-
wykazuje symetri
ę
:
A tetragonaln
ą
B liniow
ą
C trójk
ą
tn
ą
płask
ą
D piramidy trygonalnej
137.
Cz
ą
steczka C
2
H
2
jest apolarna poniewa
ż
:
A składa si
ę
z czterech atomów
B zawiera wi
ą
zanie potrójne mi
ę
dzy atomami w
ę
gla, a pojedyncze mi
ę
dzy atomami w
ę
gla i wodoru
C w jej skład wchodz
ą
atomy dwóch ro
ż
nych pierwiastków nale
żą
cych do ró
ż
nych grup układu
okresowego
D wszystkie atomy w cz
ą
steczce le
żą
w jednej linii, a długo
ś
ci wi
ą
za
ń
w
ę
giel-wodór s
ą
równe
138.
W oparciu o podstawowe zało
ż
enia metody VSEPR przyporz
ą
dkuj liczb
ę
elektronów walencyjnych
podanym ni
ż
ej drobinom:
SO
2
SO
4
2-
CO
3
2-
PO
4
3-
NH
4
+
A
12
32
24
24
4
B
18
32
24
32
8
C
18
24
18
18
8
D
6
4
6
18
4
139.
Korzystaj
ą
c z metody VSEPR okre
ś
l kształt przestrzenny cz
ą
steczki CCl
2
H
2
. Jest to cz
ą
steczka o
budowie:
A liniowej B trygonalnej
C tetragonalnej (tetraedrycznej) D bipiramidy trygonalnej
140.
Korzystaj
ą
c z metody VSEPR okre
ś
l kształt cz
ą
steczki PCl
5
. Jest to cz
ą
steczka o budowie:
A liniowej B trygonalnej
C tetragonalnej (tetraedrycznej) D bipiramidy trygonalnej

25
10. Wi
ą
zania chemiczne
141.
Który z podanych zwi
ą
zków: etan, propan, eten, kwas octowy, alkohol metylowy i alkohol etylowy ma
najni
ż
sz
ą
a który najwy
ż
sz
ą
temperatur
ę
wrzenia?
Temperatura wrzenia
min
max
A
CH
3
OH
C
3
H
8
B
CH
3
COOH
C
2
H
5
OH
C
C
2
H
6
CH
3
COOH
D
CH
3
OH
C
2
H
4
E
C
2
H
4
CH
3
COOH
142.
Wi
ą
zanie wodorowe mo
ż
e si
ę
tworzy
ć
mi
ę
dzy cz
ą
steczkami:
A metanu
B kwasów karboksylowych C wodorku litu
D wodoru
143.
Bardzo dobr
ą
rozpuszczalno
ść
niskocz
ą
steczkowych alkoholi i kwasów karboksylowych w wodzie
najlepiej wyja
ś
nia stwierdzenie:
A wszystkie zwi
ą
zki organiczne s
ą
dobrze rozpuszczalne w wodzie
B mi
ę
dzy cz
ą
steczkami wymienionych alkoholi, kwasów karboksylowych i wody tworz
ą
si
ę
wi
ą
zania
wodorowe
C małe rozmiary cz
ą
steczek umo
ż
liwiaj
ą
mieszanie si
ę
z cz
ą
steczkami dowolnych rozpuszczalników
D długo
ść
ła
ń
cucha w
ę
glowego nie ma
ż
adnego wpływu na rozpuszczalno
ść
w wodzie
144.
Które z podanych wi
ą
za
ń
jest najsłabsze:
A wodorowe
B kowalencyjne
C jonowe
D koordynacyjne
145.
Liczba wi
ą
za
ń
typu
σ
i typu
π
w cz
ą
steczce etinu wynosi:
A 2
σ
i 1
π
B 3
σ
i 2
π
C 3
σ
i 1
π
D 2
σ
i 3
π
146.
Wska
ż
poprawny opis wi
ą
za
ń
w cz
ą
steczkach. W cz
ą
steczce:
A Cl
2
wyst
ę
puje tylko jedno wi
ą
zanie
π
B N
2
wyst
ę
puj
ą
dwa wi
ą
zania
σ
i jedno
π
C O
2
obydwa wi
ą
zania s
ą
wi
ą
zaniami
σ
D F
2
wyst
ę
puje jedno wi
ą
zanie
σ
147.
Chlor mo
ż
e tworzy
ć
wi
ą
zania:
A tylko jonowe
B tylko kowalencyjne
C tylko koordynacyjne
D tylko kowalencyjne spolaryzowane
E wszystkie wymienione
26
148.
Poni
ż
sze wzory elektronowe przedstawiaj
ą
:
O
O
O
O
H
:
..
:
..
S
H
*
*
*
*
.
*
.
*
.
*
.
*
..
..
..
..
: :
..
..
C C C
C C C
C C C
:
:
..
..
:
:
..
..
:
:
..
..
:
:
..
..
:
..
..
:
:
:
I
II
III
asocjacj
ę
cz
ą
steczek wody
budow
ę
cz
ą
steczki H
2
SO
4
budow
ę
diamentu
O
H
:
..
O
H
O
H
O
H
O
H
H
H
H
H
:
..
:
..
:
..
:
..
:
..
:
..
..
:
.. :
.. :
H
Jakiego typu wi
ą
zania wyst
ę
puj
ą
w podanych substancjach:
I
II
III
A
jonowe
kowalencyjne, jonowe
koordynacyjne
B
wodorowe,
kowalencyjne
koordynacyjne, kowalencyjne
spolaryzowane
kowalencyjne
C
metaliczne
wodorowe, koordynacyjne
kowalencyjne
spolaryzowane
D
metaliczne
jonowe, koordynacyjne
metaliczne
149.
Rysunki przedstawiaj
ą
powstawanie orbitali molekularnych:
I
II
III
IV
+
+
+
+
A typu
σ
– I, II, III i typu
π
– IV
B typu
σ
– I, III, IV i typu
π
– II
C typu
σ
– II, III, IV i typu
π
– I
D typu
σ
– I, II, IV i typu
π
– III
150.
W której z podanych cz
ą
steczek wszystkie elektrony powłoki walencyjnej ka
ż
dego atomu bior
ą
udział w
tworzeniu wi
ą
za
ń
?
A BH
3
B NH
3
C N
2
D CO
2
151.
Który z modeli nakładania si
ę
dwu orbitali atomowych nie ilustruje powstawania wi
ą
zania
σ
?
A
B
C
D
152.
Którego spo
ś
ród podanych wi
ą
za
ń
chemicznych nie zawiera saletra sodowa?
A koordynacyjne B metaliczne
C jonowe
D kowalencyjne spolaryzowane

27
153.
Mówi
ą
c o jonie wodorowym w wodzie mamy w rzeczywisto
ś
ci na my
ś
l uwodniony proton czyli jon
hydroniowy (H
3
O
+
). W jonie tym cz
ą
steczka wody zwi
ą
zana jest z protonem za pomoc
ą
:
A wi
ą
zania jonowego mi
ę
dzy ujemnym biegunem dipola wody i protonem
B wi
ą
zania koordynacyjnego utworzonego przez woln
ą
par
ę
elektronow
ą
atomu tlenu cz
ą
steczki wody
C wi
ą
zania wodorowego
D wi
ą
zania koordynacyjnego utworzonego przez elektron atomu tlenu i elektron jonu wodorowego
154.
Kreskowe wzory elektronowe dwóch zwi
ą
zków mo
ż
na przedstawi
ć
nast
ę
puj
ą
co:
H
X
H
H
F
Y
F
F
:
zwi
ą
zki te:
A nie mog
ą
poł
ą
czy
ć
si
ę
ze sob
ą
B ł
ą
cz
ą
si
ę
w cz
ą
steczki wi
ą
zaniem jonowym
C ł
ą
cz
ą
si
ę
w cz
ą
steczki wi
ą
zaniem wodorowym
D ł
ą
cz
ą
si
ę
w cz
ą
steczki wi
ą
zaniem koordynacyjnym
155.
Dlaczego zasady i alkohole, pomimo analogicznych wzorów ogólnych Me-OH i R-OH, ró
ż
ni
ą
si
ę
wła
ś
ciwo
ś
ciami chemicznymi?
A poniewa
ż
alkohole s
ą
cieczami, a zwi
ą
zki o wzorze Me-OH ciałami stałymi
B poniewa
ż
w rodniku R wyst
ę
puje wiele atomów, a Me oznacza zawsze jeden atom metalu
C poniewa
ż
wi
ą
zanie Me-O ma charakter jonowy, a wi
ą
zanie C-O ma charakter kowalencyjny
D poniewa
ż
jedne nale
żą
do zwi
ą
zków nieorganicznych, a drugie do organicznych
11. Struktura ciał stałych
156.
Uwzgl
ę
dniaj
ą
c rodzaj wzajemnego oddziaływania drobin, kryształy mo
ż
emy podzieli
ć
na:
I molekularne
II kowalencyjne
III jonowe
IV metaliczne
CH
4
tworzy kryształy typu:
A I
B II
C III
D IV
157.
Z podanych wła
ś
ciwo
ś
ci wybierz te, które s
ą
charakterystyczne dla zwi
ą
zków o budowie jonowej
1. tworz
ą
twarde kryształy oraz maj
ą
wysokie temperatury topnienia i wrzenia
2. w stanie stopionym lub w roztworze przewodz
ą
pr
ą
d elektryczny
3. rozpuszczaj
ą
si
ę
w rozpuszczalnikach niepolarnych, a wyj
ą
tkowo w polarnych
4. reaguj
ą
zwykle wolno, gdy
ż
warunkiem zaj
ś
cia reakcji jest konieczno
ść
rozerwania wi
ą
zania
A tylko 1
B 1 i 2
C 1, 2 i 3
D 1, 2, 3 i 4
28
158.
Pewien zwi
ą
zek chemiczny, wyst
ę
puj
ą
cy w zwykłych warunkach w postaci krystalicznej, ma budow
ę
jonow
ą
. Która wła
ś
ciwo
ść
kryształów tego zwi
ą
zku została podana bł
ę
dnie?
A temperatura topnienia tych kryształów jest stosunkowo wysoka
B twardo
ść
tych kryształów jest stosunkowo wysoka
C kryształy te przewodz
ą
pr
ą
d elektryczny
D kryształy te dobrze rozpuszczaj
ą
si
ę
w rozpuszczalnikach polarnych
159.
Z podanych poni
ż
ej wła
ś
ciwo
ś
ci wybierz t
ą
, która nie jest charakterystyczna dla zwi
ą
zków o wi
ą
zaniu
kowalencyjnym:
A dobra rozpuszczalno
ść
w rozpuszczalniku niepolarnym
B niska temperatura przej
ść
fazowych
C dobre przewodnictwo elektryczne roztworów wodnych tych zwi
ą
zków
D mniejsza szybko
ść
reakcji w porównaniu ze zwi
ą
zkami jonowymi, gdy
ż
warunkiem zaj
ś
cia reakcji jest
konieczno
ść
uprzedniego rozerwania wi
ą
za
ń
atomowych
160.
I Izomorfizm to wyst
ę
powanie ró
ż
nych substancji w tych samych strukturach krystalograficznych
II Polimorfizm to wyst
ę
powanie tego samego zwi
ą
zku w ró
ż
nych strukturach krystalograficznych
III Alotropia to wyst
ę
powanie tego samego pierwiastka w ró
ż
nych strukturach krystalograficznych lub
cz
ą
steczkowych
IV Odmiany alotropowe maj
ą
identyczne wła
ś
ciwo
ś
ci chemiczne i fizyczne
Spo
ś
ród wymienionych zda
ń
prawdziwymi s
ą
:
A wszystkie
B I, II i III
C I i II
D I i III
E tylko III
161.
Rysunek przedstawia model fragmentu kryształu chlorku sodu z zaznaczonym poło
ż
eniem jednego z
jonów chlorkowych (-). Która z liter A, B, C czy D na zał
ą
czonym modelu wskazuje na poło
ż
enie jednego z
jonów sodu?
-
A
B
C
D
162.
Sie
ć
krystalograficzna kryształu Cu składa si
ę
z komórek elementarnych w krysztale sze
ś
cianu
periodycznie powtarzanych w przestrzeni. Atomy Cu znajduj
ą
si
ę
dokładnie w
ś
rodku ka
ż
dej
ś
ciany i w
naro
ż
ach komórki elementarnej. Ile atomów Cu przypada w tej sieci na jedn
ą
komórk
ę
elementarn
ą
:
A 1
B 4
C 14
D
ż
adna z podanych liczb nie jest poprawna
163.
Ozon jest:
A homologiem tlenu
B odmian
ą
alotropow
ą
tlenu
C odmian
ą
izomorficzn
ą
tlenu
D izomerem telnu
29
164.
Zjawisko izomorfizmu mo
ż
emy obserwowa
ć
w przypadku:
A ałunów np. K
2
SO
4
.
Cr
2
(SO
4
)
3
.
24H
2
O i K
2
SO
4
.
Al
2
(SO
4
)
3
.
24H
2
O
B hydratów np. CuSO
4
.
5H
2
O i BaCl
2
.
2H
2
O
C wodorosoli np. KH
2
PO
4
i K
2
HPO
4
D hydroksosoli np. Cu(OH)
2
.
CuCO
3
i Al(OH)
2
Cl
12. Efekty energetyczne
165.
Jedn
ą
z reakcji otrzymywania etanolu mo
ż
e by
ć
reakcja
zapisana w nast
ę
puj
ą
cy sposób:
CH
3
CH
2
Br + OH
-
CH
3
CH
2
OH + Br
-
Schemat przebiegu reakcji przez kompleks aktywny
przedstawia poni
ż
szy wykres.
Z tego wykresu mo
ż
emy stwierdzi
ć
,
ż
e reakcja jest:
A egzoenergetyczna i
ś
wiadczy o tym warto
ść
energii oznaczona nr 3
B egzoenergetyczna i
ś
wiadczy o tym warto
ść
energii oznaczona nr 2
C endoenergetyczna i
ś
wiadczy o tym warto
ść
energii oznaczona nr 1
D endoenergetyczna i
ś
wiadczy o tym warto
ść
energii oznaczona nr 1 i 2
166.
Przykładem procesu endotermicznego jest:
A spalanie magnezu w tlenie
B spalanie w
ę
gla w tlenie
C otrzymywanie wapna gaszonego
D rozkład CaCO
3
na tlenek wapnia i dwutlenek w
ę
gla
167.
Na wykresach warto
ś
ci energii dla dwóch ró
ż
nych reakcji oznaczono numerami:
Który numer wskazuje warto
ść
energii aktywacji dla reakcji endotermicznej?
A 1’
B 1’’
C 2’ i 2’’
D 3’’
Droga reakcji
E
n
e
rg
ia
Substraty
Produkty
1
2
3

30
168.
Wiedz
ą
c,
ż
e entalpia tworzenia fosforiaku PH
3
wynosi odpowiednio: z fosforu białego –17,17kJ/mol a z
fosforu czerwonego +1,26kJ/mol, oblicz entalpi
ę
przemiany alotropowej fosforu białego w czerwony w
warunkach standardowych [kJ/mol]. Wynosi ona:
A –15,91
B –18,43
C +18,43
D +15,91
169.
Entalpia reakcji
C
(s)
+ O
2(g)
CO
2
I
II
w kierunku oznaczonym cyfr
ą
I wynosi –393,5kJ. Entalpia
reakcji przebiegaj
ą
cej w kierunku oznaczonym cyfr
ą
II jest równa:
A –393,5kJ
B 393,5kJ
C 196,75kJ
D zero, gdy
ż
produktami reakcji II s
ą
substancje proste
170.
Zgodnie z prawem Hessa ilo
ść
energii wymienionej w formie ciepła mi
ę
dzy układem a otoczeniem pod
stałym ci
ś
nieniem lub w stałej obj
ę
to
ś
ci (T=const.) zale
ż
y od:
A drogi przemiany układu
B stanu pocz
ą
tkowego układu
C stanu pocz
ą
tkowego i ko
ń
cowego układu
D stanu ko
ń
cowego układu
171.
Obliczona przy wykorzystaniu podanych obok warto
ś
ci energii wi
ą
za
ń
entalpia reakcji:
N
2(g)
+ 3H
2(g)
2NH
3(g)
wynosi:
wi
ą
zanie
energia wi
ą
zania w kJ/mol
H-H
N
≡
N
N-H
436
946
390
A +1772kJ
B –86kJ
C +4594kJ
D –1772kJ
172.
Przeczytaj poni
ż
sze stwierdzenia:
I W procesie skraplania 1mola pary wodnej z układu do otoczenia przekazywana jest na sposób ciepła
energia równa 44kJ
II Standardowa entalpia tworzenia H
2
O
(g)
jest równa –242kJ/mol
Na podstawie powy
ż
szych stwierdze
ń
s
ą
dzisz,
ż
e standardowa entalpia tworzenia H
2
O
(c)
wynosi:
A –154kJ/mol
B –198kJ/mol
C –286kJ/mol
D –330kJ/mol
173.
Dane s
ą
nast
ę
puj
ą
ce warto
ś
ci standardowych entalpii tworzenia (kJ/mol):
kwas octowy (ciecz)
dwutlenek w
ę
gla (gaz)
woda (ciecz)
-487,1
-393,5
-285,8
Entalpia spalania kwasu octowego ma warto
ść
:
A –1166,4kJ/mol B +871,5kJ/mol
C –871,5kJ/mol
D +192,2kJ/mol
E –192,2kJ/mol
174.
N
2(g)
+ O
2(g)
2NO
(g)
–181kJ
Na podstawie podanego równania termochemicznego entalpia reakcji i zmiana energii wewn
ę
trznej
układu w warunkach standardowych wynosi odpowiednio:
A +181kJ +183kJ
B +181kJ +181kJ
B +181kJ +178,5kJ
D –181kJ -183,5kJ

31
175.
Dla której reakcji przeprowadzonej w warunkach normalnych warto
ś
ci
∆
U i
∆
H s
ą
takie same?
A 3C
2
H
2
C
6
H
6
B Ba
2+
aq
+ SO
4
2-
aq
BaSO
4(s)
C H
2
O
(s)
H
2
O
(c)
D N
2
O
4(g)
2NO
2(g)
176.
Najwy
ż
sz
ą
temperatur
ę
wrzenia b
ę
dzie posiadał roztwór:
A glukozy o st
ęż
eniu 0,2M
B chlorku sodu o st
ęż
eniu 0,15M
C siarczanu(VI) potasu o st
ęż
eniu 0,1M
D fluorku glinu o st
ęż
eniu 0,1M
177.
18-procentowy roztwór chlorku sodu krzepnie w temperaturze –14
o
C, a 18-procentoewy roztwór
sacharozy w temperaturze –1,3
o
C. Ró
ż
nice temperatur krzepni
ę
cia obu roztworów wynikaj
ą
z tego,
ż
e:
A chlorek sodu jest sol
ą
a sacharoza w
ę
glowodanem
B rozpuszczalno
ść
chlorku sodu w wodzie jest wi
ę
ksza ni
ż
sacharozy
C sacharoza ulega hydrolizie, a chlorek sodu nie ulega hydrolizie
D liczba moli jonów w 18% roztworze NaCl jest wi
ę
ksza ni
ż
liczba moli cz
ą
steczek sacharozy w
roztworze o takim samym st
ęż
eniu procentowym
178.
W zimie układy chłodzenia silników samochodowych s
ą
wypełnione mieszanin
ą
wody i glikolu
etylenowego, poniewa
ż
mieszanina ta ma ni
ż
sz
ą
temperatur
ę
krzepni
ę
cia ni
ż
czysta woda. W jakim
stosunku wagowym nale
ż
y zmiesza
ć
wod
ę
z glikolem, aby otrzymana mieszanina miała temperatur
ę
krzepni
ę
cia –40
o
C?
A 3:4
B 4:3
C 1:1
D 1:2
179.
Temperatura wrzenia roztworu otrzymanego przez rozpuszczenie 12g MgSO
4
w 500g wody wynosi
(P=1013hPa):
A 100,21
o
C
B 106
o
C
C 112
o
C
D 100,52
o
C
180.
Roztwór otrzymany w wyniku rozpuszczenia w 500g wody 100g pewnego zwi
ą
zku organicznego (nie
ulegaj
ą
cego dysocjacji) krzepnie w temperaturze 268,96K. Masa molowa tego zwi
ą
zku wynosi:
A 92
B 55,8
C 180
D 60
Do rozwi
ą
zania zada
ń
testowych o numerach 176-180 przydatna jest poni
ż
sza informacja:
Podwy
ż
szenie temperatury wrzenia (
∆
T
W
) podobnie jak obni
ż
enie temperatury topnienia (
∆
T
K
) roztworów w
stosunku do czystego rozpuszczalnika jest wprost proporcjonalne do st
ęż
enia (m) wyra
ż
onego w molach substancji na
kg rozpuszczalnika (molalno
ś
ci):
∆
T
W
=C
m
.
K
E
oraz
∆
T
K
=C
m
.
K
K
gdzie warto
ść
stałych krioskopowej K
K
i ebulioskopowej K
E
dla roztworów wodnych wynosz
ą
odpowiednio: -1,86
o
C
i 0,52
o
C dla substancji nie ulegaj
ą
cych procesowi dysocjacji. W obliczeniach nale
ż
y uwzgl
ę
dni
ć
fakt,
ż
e zarówno
∆
T
W
jak i
∆
T
K
s
ą
wielko
ś
ciami koligatywnymi.
W przypadku substancji ulegaj
ą
cych dysocjacji st
ęż
enie molalne
m
n
C
n
1
1
i
m
∑
=
=
gdzie:
n
i
- liczba moli poszczególnych jonów
m – masa rozpuszczalnika
32
13. Kinetyka i statyka reakcji
181.
Szybko
ść
reakcji chemicznej nie zale
ż
y od:
A energii aktywacji
B stałej równowagi chemicznej
B temperatury
D katalizatora
182.
Na zał
ą
czonym wykresie mamy przedstawion
ą
zale
ż
no
ść
st
ęż
enia reagentów od czasu trwania reakcji.
czas reakcji
s
te
z
e
n
ie
[
m
o
l/
d
m
3
]
[HI]
[H
2
] + [I
2
]
Wykres ten opisze najlepiej nast
ę
puj
ą
ce równanie reakcji:
A H
2(g)
+ I
2(g)
2HI
(g)
B 2HI
(g)
H
2(g)
+ I
2(g)
C H
2(g)
+ I
2(g)
⇔
2HI
(g)
D H
2
I
2
⇔
2HI
(aq)
183.
Je
ś
li wzrost ci
ś
nienia przesuwa równowag
ę
reakcji w prawo, to mo
ż
na stwierdzi
ć
,
ż
e:
A obj
ę
to
ść
reagentów podczas reakcji maleje
B obj
ę
to
ść
reagentów podczas reakcji ro
ś
nie
C ro
ś
nie energia aktywacji
D obj
ę
to
ść
reagentów podczas reakcji nie zmienia si
ę
184.
T
K
I
II
Poni
ż
szy wykres przedstawia zale
ż
no
ść
stałych równowagi K
od temperatury. Zmiany stałych dla reakcji I i II przedstawiaj
ą
odpowiednio:
Reakcje te charakteryzuj
ą
si
ę
zmianami energii opisywanymi poni
ż
ej symbloami
reakcja I
reakcja II
A
∆
H<0
∆
H>0
B
∆
H>0
∆
H>0
C
∆
H<0
∆
H<0
D
∆
H>0
∆
H<0
185.
W my
ś
l ogólnych zasad reakcji przebiegaj
ą
cych w fazie gazowej synteza amoniaku:
N
2
+ 3H
2
⇔
2NH
3
+ Q
Przebiega z najwi
ę
ksz
ą
wydajno
ś
ci
ą
je
ż
eli:
A stosunek obj
ę
to
ś
ciowy wodoru do azotu wynosi 2:1
B zmniejszymy ci
ś
nienie i temperatur
ę
C obni
ż
ymy temperatur
ę
i podwy
ż
szymy ci
ś
nienie
D podwy
ż
szymy temperatur
ę
i obni
ż
ymy ci
ś
nienie
33
186.
Podczas syntezy zwi
ą
zku AB ze stechiometrycznych ilo
ś
ci A i B osi
ą
gni
ę
to stan równowagi w którym
st
ęż
enia molowe wszystkich substancji były równe. Ile procent substancji A przereagowało?
A 33%
B 77%
C 50%
D 67%
187.
Stwierdzono,
ż
e w sanie równowagi układu opisanego równaniem: 2A + B
⇔
A
2
B
ilo
ś
ci równowagowe substancji wynosz
ą
odpowiednio:
A – 2 mole
B – 5 moli
A
2
B – 2 mole
Ilo
ść
moli substratów (w sumie A + B) u
ż
ytych w reakcji wynosiła:
A 7 moli
B 9 moli
C 12 moli
D 13 moli
E 11 moli
188.
Stała równowagi reakcji CO
2
+ H
2
⇔
CO + H
2
O w temperaturze 1100K wynosi K=1. Ilo
ść
moli CO w
zbiorniku zamkni
ę
tym po zmieszaniu 1 mola wodoru z 1 molem CO
2
po ustaleniu si
ę
równowagi wynosi:
A 0,25
B 0,5
C 0,75
D 1
189.
Zmieszano 3 mole pewnego chlorowca z 6 molami wodoru. W ustalonym stanie równowagi stwierdzono
powstanie 4 moli chlorowcowodoru obok odpowiednich ilo
ś
ci nieprzereagowanych substratów. Stała
równowagi reakcji syntezy chlorowcowodoru wynosi:
A 2
B 3
C 4
D 5
190.
Zmieszano 3 mole octanu etylu z 5 molami wody i 1 molem kwasu octowego. Stała równowagi reakcji
hydrolizy estru wynosi 0,25. W wyniku reakcji powstało alkoholu:
A 1 mol
B 3 mole
C 5 moli
D 0,25 mola
14. Kataliza
191.
Katalizator to substancja, która:
I zazwyczaj zwi
ę
ksza szybko
ść
przebiegu reakcji
II obni
ż
a energi
ę
niezb
ę
dn
ą
do utworzenia kompleksu aktywnego
III mo
ż
e zmniejsza
ć
szybko
ść
reakcji
IV wpływa na poło
ż
enie stanu równowagi chemicznej
Prawdziwe stwierdzenia zawieraj
ą
zdania:
A I, III, IV
B I, II, III
C tylko III
D I i II
192.
Ustal w któr
ą
stron
ę
przesunie si
ę
stan równowagi reakcji:
2SO
2
+ O
2
= 2SO
3
∆
H=-192kJ
Podwy
ż
szenie temperatury
Dodanie katalizatora
Zwi
ę
kszenie st
ęż
enia tlenu
A
nie zmieni si
ę
B
C
D
nie zmieni si
ę

34
193.
Reakcja autokatalityczna polega na tym,
ż
e przy
ś
piesza j
ą
:
A ka
ż
de zanieczyszczenie wprowadzone do układu
B wzrost st
ęż
enia substratu
C wzrost st
ęż
enia produktu
D wzrost temperatury układu
194.
Która z poni
ż
szych reakcji jest przykładem reakcji homogenicznej:
2SO
2
+ O
2
2SO
3
4NH
3
+ 5O
2
4NO + 6H
2
O
CH
3
COOH + C
2
H
5
OH
C
2
H
2
+ H
2
O
CH
3
CHO
V
2
O
5
Pt
H
2
SO
4
Hg
2+
CH
3
COOC
2
H
5
+ H
2
O
A
B
C
D
E
N
2
+ 3H
2
2NH
3
Fe
195.
Enzymy s
ą
katalizatorami białkowymi reakcji chemicznych w układach biologicznych. Wyró
ż
niamy
sze
ść
głównych klas enzymów: oksydoreduktazy, transferazy, hydrolazy, liazy, izomerazy, ligazy. Poni
ż
ej
podano zdania dotycz
ą
ce tych klas enzymów:
I Hydrolazy s
ą
to enzymy katalizuj
ą
ce hydroliz
ę
wi
ą
za
ń
estrowych i peptydowych
II Izomerazy s
ą
to enzymy katalizuj
ą
ce wewn
ę
trzne przekształcenie izomerów optycznych,
geometrycznych i pozycyjnych
III Transferazy s
ą
to enzymy katalizuj
ą
ce przeniesienie grupy X (innej ni
ż
wodór) pomi
ę
dzy par
ą
substratów A i B (A-X + B
B-X + A)
IV Liazy s
ą
to enzymy katalizuj
ą
ce ł
ą
czenie dwóch cz
ą
steczek z rozbiciem wi
ą
zania pirofosforowego w ATP.
Prawdziwe informacje zawieraj
ą
zdania:
A I, II, III
B tylko I
C II i III
D tylko IV
E wszystkie
196.
W celu ograniczenia negatywnego wpływu spalin na zanieczyszczenie powietrza w wielu krajach został
wprowadzony obowi
ą
zek instalowania katalizatorów w pojazdach z silnikiem spalinowym. Głównym
zadaniem tego typu katalizatorów jest:
A redukcja zwi
ą
zków ołowiu zawartych w gazach spalinowych do ołowiu metalicznego, który nast
ę
pnie
jest osadzany na odpowiednich, wymienianych filtrach.
B absorpcja tlenków azotu(IV) zawartego w gazach spalinowych na alkalicznym, wymiennym filtrze
C utlenianie czteroetylku ołowiu zawartego w benzynie do tlenku ołowiu(IV)
D utlenianie CO zawartego w gazach spalinowych do CO
2
, oraz redukcja tlenków azotu do azotu.

35
15. Dysocjacja
15.1.
Poj
ę
cia podstawowe. Stała i stopie
ń
dysocjacji
197.
Przedstawiony rysunek ilustruje proces prowadz
ą
cy do:
A hydrolizy
B dysocjacji
C elektrolizy
D substytucji
-
+
+
- + -
-
+
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
198.
Dysocjacja elektrolityczna zachodzi pod wpływem:
A dowolnego rozpuszczalnika
B pr
ą
du elektrycznego
C rozpuszczalników o budowie polarnej
D wył
ą
cznie wody
199.
Stopie
ń
dysocjacji elektrolitycznej okre
ś
la:
A liczba jonów, na które dysocjuje elektrolit
B stosunek liczby moli elektrolitu, która uległa dysocjacji do pocz
ą
tkowej liczby moli elektrolitu
C stosunek st
ęż
enia jonów do st
ęż
enia cz
ą
steczek zdysocjowanych
D suma algebraiczna ładunku jonów na które dysocjuje cz
ą
steczka elektrolitu
200.
Roztwór kwasu o wzorze HR zawiera 0,2 mola jonów R
-
i 2 mole niezdysocjowanych cz
ą
steczek HR.
Stopie
ń
dysocjacji tego kwasu wynosi:
A 0,091
B 0,1
C 0,182
D 0,2
201.
Stopie
ń
dysocjacji pewnego kwasu organicznego jednokarboksylowego w roztworze wodnym o st
ęż
eniu
0,1M wynoci 20%. Stała dysocjacji tego kwasu jest równa:
A 4
.
10
-3
B 5
.
10
-3
C 2
.
10
-3
D 4
.
10
-2
202.
Oblicz stopie
ń
dysocjacji 0,1molowego roztworu kwasu HX, którego stała dysocjacji w danych
warunkach wynosi 1,21
.
10
-5
A 0,5%
B 1,1%
C 1,6%
D 2%

36
203.
Na podstawie podanych ni
ż
ej reakcji
2CH
3
COOH + Na
2
CO
3
2CH
3
COONa + CO
2
+ H
2
O
H
2
CO
3
+ Na
2
SiO
3
Na
2
CO
3
+ H
2
SiO
3
oraz stałych dysocjacji kwasu benzoesowego (benzenokarboksylowego): K=6,3
.
10
-5
oraz kwasu
octowego: K=1,8
.
10
-5
wska
ż
zbiór kwasów uszeregowanych według rosn
ą
cej mocy:
A H
2
SiO
3
, H
2
CO
3
, CH
3
COOH, C
6
H
5
COOH
B CH
3
COOH, C
6
H
5
COOH, H
2
SiO
3
, H
2
CO
3
C H
2
SiO
3
, H
2
CO
3
, C
6
H
5
COOH, CH
3
COOH
D H
2
CO
3
,
C
6
H
5
COOH, H
2
SiO
3
, CH
3
COOH
204.
3dm
3
wodnego roztworu kwasu o ogólnym wzorze HX zawiera 5,418
.
10
23
jonów X
-
i 6 moli
niezdysocjowanych cz
ą
steczek HX. Stopie
ń
i stała dysocjacji kwasu HX wynosi:
stopie
ń
dyscocjacji
stała
dysocjacji
A
13%
4,5
.
10
-2
B
13%
9
.
10
-2
C
15%
4,5
.
10
-2
D
17,6%
4,5
.
10
-2
205.
Warto
ść
pK
a
dla kwasu octowego i trichlorooctowego wynosz
ą
odpowiednio 5,0 i 1,0. Stosunek stałych
dysocjacji tych kwasów
COOH
CH
COOH
CCl
3
3
K
K
x
=
wynosi:
A 5
B 10
-4
C 10000
D 0,2
206.
Jakie b
ę
d
ą
st
ęż
enia poszczególnych jonów po zmieszaniu ze sob
ą
100cm
3
0,1M roztworu KOH z
200cm
3
roztworu HCl o tym samym st
ęż
eniu?
[H
+
]
[OH
-
]
[K
+
]
[Cl
-
]
A
0,033
3
.
10
-13
0,033
0,067
B
3
.
10
-13
0,033
0,033
0,067
C
0,033
0
0,033
0,067
D
0,033
3
.
10
-13
0,067
0,033

37
15.2.
St
ęż
enie jonów wodorowych, pH roztworu
207.
Sporz
ą
dzono roztwory kwasu solnego o pH=2 i o pH=4. Które z poni
ż
szych stwierdze
ń
jest prawdziwe?
St
ęż
enie jonów H
+
w roztworze:
A o pH=2 jest 100 razy wy
ż
sze ni
ż
w roztworze o pH=4
B o pH=2 jest 100 razy mniejsze ni
ż
w roztworze o pH=4
C o pH=2 jest 2 razy mniejsze ni
ż
w roztworze o pH=4
D o pH=2 jest 2 razy wy
ż
sze ni
ż
w roztworze o pH=4
208.
Stwierdzono,
ż
e 1cm
3
roztworu zawiera 4,0
.
10
-2
mg całkowicie zdysocjowanego wodorotlenku sodu.
Jaka jest warto
ść
pH tego roztworu?
A 12
B 11
C 10
D 9
209.
pH 0,01 molowego roztworu fenolu o stałej dysocjacji K=10
-10
wynosi:
A 5
B 6
C 7
D 8
210.
pH 0,01 molowego roztworu aniliny o stałej dysocjacji zasadowej 4
.
10
-10
wynosi:
A 5,7
B 8,3
C 4,7
D 9,3
211.
Stopie
ń
dysocjacji jednomolowego roztworu kwasu octowego wynosi 0,4%. W 0,5dm
3
tego kwasu
znajduje si
ę
:
A 0,002 mola jonów H
+
B 0,004 mola jonów H
+
C 0,02 mola jonów H
+
D 0,5 mola jonów H
+
212.
Jakiej obj
ę
to
ś
ci roztworu kwasu solnego o pH=1 nale
ż
y u
ż
y
ć
do całkowitego zoboj
ę
tnienia 20cm
3
5%
roztworu zasady sodowej o g
ę
sto
ś
ci 1g/cm
3
.
A 0,20cm
3
B 0,25cm
3
C 0,20dm
3
D 0,25dm
3
213.
Je
ż
eli pH jakiego
ś
roztworu wynosi 3, to st
ęż
enie jonów wodorotlenowych w tym roztworze ma warto
ść
:
A 10
-3
mol/dm
3
B 10
-7
mol/dm
3
C 10
-11
mol/dm
3
D 10
-14
mol/dm
3
214.
Do probówek z wod
ą
(rys.) wprowadzono substancje:
H
2
S
CO
NH
3
KBr
CH
3
OH
I
II
III
IV
V
W probówkach mo
ż
na stwierdzi
ć
st
ęż
enie jonów:

38
H
+
>OH
-
OH
-
>H
+
H
+
=OH
-
A
I, II
III, IV
V
B
I, II, V
III, V
IV
C
I
III
II, IV, V
D
I, IV
III, V
II
E
I, II
III, V
IV
215.
Do naczynia zawieraj
ą
cego 250cm
3
kwasu solnego dodano 10g 1% roztworu Ca(OH)
2
otrzymuj
ą
c
roztwór o odczynie oboj
ę
tnym. Jakie pH miał roztwór kwasu solnego.
A 2
B 2,6
C 2,3
D 2,9
16. Wska
ź
niki, przewodnictwo roztworów
216.
Pewien wska
ź
nik ma charakter bardzo słabej zasady, w postaci niezdysocjowanej jest bezbarwny, za
ś
w
postaci jonowej czerwony. W zale
ż
no
ś
ci od warto
ś
ci pH wska
ź
nik ten mo
ż
e przyjmowa
ć
barwy:
pH<7
pH=7
pH>7
A
bezbarwny
bezbarwny
czerwony
B
czerwony
czerwony
czerwony
C
bezbarwny
czerwony
bezbarwny
D
czerwony
bezbarwny
bezbarwny
217.
Stopie
ń
dysocjacji oran
ż
u metylowego (wska
ź
nik ma charakter słabego kwasu typu HX) w roztworze
kwa
ś
nym wynosi 20%. Jakie jest pH tego roztworu je
ś
li stała dysocjacji wska
ź
nika jest równa 2
.
10
-4
?
A 3,0
B 3,1
C 5,0
D 10,3
218.
W wyniku reakcji potasu z wod
ą
wobec fenoloftaleiny powstały roztwór zabarwił si
ę
na kolor malinowy,
poniewa
ż
:
A jony uległy hydratacji
B st
ęż
enie jonów wodorowych jest wy
ż
sze ni
ż
st
ęż
enie jonów wodorotlenowych
C wzrosło st
ęż
enie jonów wodorotlenowych
D zmniejszyło si
ę
pH roztworu
219.
Przeprowadzono nast
ę
puj
ą
ce do
ś
wiadczenie:
HCl
NaOH
HCl
NaOH
Na
2
CO
3
NH
4
Cl
CuSO
4
Na
2
S
I
II
III
IV
39
U wylotu której probówki zwil
ż
ony wod
ą
papierek lakmusowy zabarwi si
ę
na niebiesko?
A I
B II
C III
D IV
220.
Rysunek obrazuje urz
ą
dzenie słu
żą
ce do analitycznej
czynno
ś
ci laboratoryjnej. Na wykresie podano zmiany pH
roztworu 2 w kolbce pod wpływem dodawania roztworu 1
z biurety. Wybierz odpowiedzi dotycz
ą
ce roztworów 1 i 2,
nazwy opisywanej tu czynno
ś
ci laboratoryjnej oraz podaj
barw
ę
fenoloftaleiny na pocz
ą
tku i ko
ń
cu operacji.
nazwa czynno
ś
ci
laboratoryjnej
roztwór 1
roztwór 2
barwa wska
ź
nika
pocz
ą
tkowa
ko
ń
cowa
A
kompleksowanie
woda amoniakalna
Ag
2
SO
4(aq)
bezbarwna
malinowa
B
miareczkowanie
kwas
zasada
malinowa
bezbarwna
C
odmineralizowanie wody
roztwór jonitu
NaCl
(aq)
bezbarwna
malinowa
D
miareczkowanie
zasada
kwas
malinowa
bezbarwna
221.
Miareczkowano mocny kwas mocn
ą
zasad
ą
. Wyniki zarejestrowano na wykresie. Który z wykresów
odpowiada wykonanemu do
ś
wiadczeniu?
A
B
C
D
V
pH
12
10
6
2
4
8
µ
V zasady
µ
V zasady
µ
V zasady
µ
V zasady

40
222.
η
0
H
2
SO
4
(cm
3
)
punk rownowaznikowy
Wykres przedstawia zmiany przewodnictwa elektrycznego
roztworu
η
elektrolitu w zale
ż
no
ś
ci od ilo
ś
ci dodanego roztworu
kwasu siarkowego(VI):
Elektrolitem tym jest:
A NaOH
B NaCl
C Ba(OH)
2
D BaSO
4
223.
Wodny roztwór amoniaku i siarkowodoru słabo przewodz
ą
pr
ą
d elektryczny. Podaj, jak zmieni si
ę
przewodnictwo pr
ą
du elektrycznego po zmieszaniu tych roztworów.
A nie zmieni si
ę
B zmaleje prawie do zera
C wzro
ś
nie
D zmaleje
224.
Ile miligramów Ca(OH)
2
znajdowało si
ę
w 100cm
3
roztworu wodorotlenku wapnia, je
ś
li na
miareczkowanie tego roztworu wobec fenoloftaleiny jako wska
ź
nika zu
ż
yto 50cm
3
roztworu HCl o st
ęż
eniu
0,2mol/dm
3
?
A 370,00
B 740,00
C 0,37
D 0,74
E 37,00
225.
Próbk
ę
składaj
ą
c
ą
si
ę
wył
ą
cznie z Li
2
CO
3
i BaCO
3
o masie 1g miareczkowano 15cm
3
kwasu solnego o
st
ęż
eniu 1M. Procentowa zawarto
ść
w
ę
glanu litu w próbce wynosi w przybli
ż
eniu:
A 71%
B 50%
C 40%
D 29%
E 14%
17. Teorie kwasów i zasad
226.
Zgodnie z teori
ą
Brønsteda-Lowry’ego kwasami s
ą
zwi
ą
zki oddaj
ą
ce protony (jony wodorowe), a
zasadami zwi
ą
zki przył
ą
czaj
ą
ce protony (jony wodorowe). Zgodnie z teori
ą
woda w reakcjach
przedstawionych równaniami:
I H
2
O + NH
3
NH
4
+
+ OH
-
II H
2
O + HCl
H
3
O
+
+ Cl
-
III H
2
O + CO
3
-2
HCO
3
-
+ OH
-
zachowuje si
ę
jak:
I
II
III
A
zasada
kwas
zasada
B
kwas
kwas
zasada
C
zasada
zasada
kwas
D
kwas
zasada
kwas

41
227.
W których z podanych ni
ż
ej równa
ń
reakcji protolitycznych woda zachowuje si
ę
jak kwas, a w których jak
zasada w uj
ę
ciu teorii Brønsteda-Lowry’ego?
a HSO
4
-
+ H
2
O = H
3
O
+
+ SO
4
2-
b SO
3
2-
+ H
2
O = HSO
3
-
+ OH
-
c NH
3
+ H
2
O = NH
4
+
+ OH
-
d H
2
S + H
2
O = H
3
O
+
+ HS
-
e CH
3
COO
-
+ H
2
O = CH
3
COOH + OH
-
kwas
zasada
A
b, c, d
a, e
B
a, d
b, c, e
C
c, e
a, b, d
D
b, c, e
a, d
228.
Wska
ż
sprz
ęż
on
ą
według Brønsteda par
ę
kwas-zasada:
A HCl – H
2
O
B H
3
O
+
- H
2
O
C NH
3
– OH
-
D H
2
O – FeCl
3
229.
Wska
ż
kwas Lewisa, który nie jest kwasem według Arheniusa ani według Brønsteda:
A HCN
B C
2
H
5
OH
2
+
C H
3
O
+
D Cu
2+
230.
Wska
ż
, które z reakcji kwasowo-zasadowych zachodz
ą
zgodnie z teori
ą
elektronow
ą
kwasów i zasad:
I H
2
O + H
+
H
3
O
+
II 2KOH + H
2
S
K
2
S + 2H
2
O
III Ag
+
+ 2NH
3
[Ag(NH
3
)
2
]
+
IV H
2
SO
4
+ 2NH
4
OH
(NH
4
)
2
SO
4
+ 2H
2
O
A I i II
B I i III
C I i IV
D II i IV
231.
Teoria Arheniusa ma ograniczon
ą
przydatno
ść
dla wyja
ś
nienia własno
ś
ci zasadowych:
A NaOH
B AgOH
C Al(OH)
3
D CH
3
NH
2
232.
Zgodnie z teori
ą
Brønsteda ka
ż
demu kwasowi odpowiada sprz
ęż
ona z nim zasada:
HB + H
2
O
B
-
+ H
3
O
+
kwas
zasada
sprz
ęż
ona
zasada
sprz
ęż
ony
kwas
przy czym im silniejszy jest kwas tym słabsza sprz
ęż
ona z nim zasada. Posługuj
ą
c si
ę
t
ą
reguł
ą
, wska
ż
która z poni
ż
szych zasad jest najsłabsza:
A Cl
-
B C
6
H
5
O
-
C OH
-
D CH
3
COO
-

42
18. Amfoteryczno
ść
233.
Które z równa
ń
reakcji ilustruj
ą
charakterystyczn
ą
wła
ś
ciwo
ść
tlenku glinowego?
Al
2
O
3
+ 6H
+
2Al
3+ +
3H
2
O
2Al(OH)
3
Al
2
O
3
+ 3H
2
O
Al
2
O
3
+ 3H
2
O
2Al(OH)
3
Al
2
O
3
+ 2OH
-
2AlO
2
-
+ H
2
O
I
II
III
IV
A I, III
B I, IV
C II, III
D II, IV
234.
Produktem reakcji Al(OH)
3
z KOH mo
ż
e by
ć
:
A KAlO
2
lub K
3
AlO
3
B tylko K
3
[Al(OH)
6
]
C KAlO
2
, albo K[Al(OH)
4
] albo K
3
[Al(OH)
6
]
D ka
ż
da z wymienionych soli
235.
Do probówki z roztworem siarczanu(VI) miedzi(II) stopniowo dodawano roztwór zasady sodowej. Które
równania chemiczne przedstawiaj
ą
zachodz
ą
ce reakcje:
Cu
2+
+ 2OH
-
Cu(OH)
2
CuSO
4
+ 2NaOH
Cu(OH)
2
+ Na
2
SO
4
Cu
2+
+ SO
4
2-
+ 2Na
+
+ 2OH
-
Cu
2+
+ 2OH
-
+ 2Na
+
+ SO
4
2-
Cu(OH)
2
+ 2OH
-
CuO
2
2-
+ 2H
2
O
I
II
III
IV
A I, III
B II, III
C I, IV
D I, II
236.
Porównuj
ą
c wła
ś
ciwo
ś
ci chemiczne wodorotlenku manganu(II), Mn(OH)
2
i wodorotlenku chromu(III)
Cr(OH)
3
, stwierdzono,
ż
e:
A obydwa zwi
ą
zki reaguj
ą
tylko z kwasami
B Mn(OH)
2
reaguje tylko z kwasami, a Cr(OH)
3
równie
ż
z zasadami
C Cr(OH)
3
reaguje tylko z kwasami, a Mn(OH)
2
równie
ż
z zasadami
D obydwa zwi
ą
zki reaguj
ą
z kwasami i zasadami
237.
Stop glinu z magnezem rozpuszczono w kwasie solnym. Do otrzymanego roztworu dodano nadmiar
NaOH. W jakiej postaci znajduje si
ę
glin po zako
ń
czonej reakcji:
A w roztworze, jako chlorek glinu
B w osadzie, jako Al(OH)
3
C w roztworze, jako glinian sodowy NaAlO
2
D stop glinu z magnezem nie rozpuszcza si
ę
w roztworach wodnych HCl i NaOH

43
238.
Wprowadzono 2,7g glinu do:
I nadmiaru st
ęż
onego kwasu solnego
II nadmiaru st
ęż
onego roztworu NaOH
Porównuj
ą
c ilo
ś
ci wydzielonego wodoru otrzymane w obu reakcjach (w przeliczeniu na warunki
normalne) stwierdzono,
ż
e:
A wi
ę
cej wodoru wydzieliło si
ę
w reakcji z NaOH
B wi
ę
cej wodoru wydzieliło si
ę
w reakcji z HCl
C w obu reakcjach wydzieliły si
ę
identyczne ilo
ś
ci wodoru
D wodór otrzymano tylko w reakcji z HCl, st
ęż
ony NaOH pasywuje glin – reakcja nie zachodzi.
239.
W czterech probówkach znajdowały si
ę
roztwory zawieraj
ą
ce ni
ż
ej wymienione jony. Po dodaniu
nadmiaru NaOH pozostanie osad w probówce zawieraj
ą
cej jony:
A Zn
2+
B Mg
2+
C Al
3+
D Cr
3+
240.
Do roztworu zawieraj
ą
cego 16,14g ZnSO
4
dodano roztwór zawieraj
ą
cy 0,25 mola NaOH. Masa
powstałego osadu w zlewce wynosiła:
A 9,94 g
B 7,46 g
C 24,85 g
D 4,97 g
19. Hydroliza
241.
W trzech probówkach znajduj
ą
si
ę
wodne roztwory nast
ę
puj
ą
cych soli: KCl, NH
4
Cl i K
2
S. Badaj
ą
c
odczyn tych roztworów stwierdzono,
ż
e substancja w probówce I ma odczyn kwa
ś
ny, w II zasadowy a w III
oboj
ę
tny. Na tej podstawie dokonano identyfikacji soli. Która odpowied
ź
zawiera poprawnie zidentyfikowane
sole:
I
II
III
A
NH
4
Cl
KCl
K
2
S
B
NH
4
Cl
K
2
S
KCl
C
K
2
S
KCl
NH
4
Cl
D
KCl
K
2
S
NH
4
Cl
242.
Wska
ż
par
ę
tlenków daj
ą
c
ą
w wyniku reakcji zwi
ą
zek, który w roztworze wodnym barwi fenoloftalein
ę
na ró
ż
owo.
A CaO i SO
3
B Na
2
O i NO
C Al
2
O
3
i SO
3
D K
2
O i CO
2
44
243.
Przygotowano roztwory wodne nast
ę
puj
ą
cych substancji:
I
II
III
IV
V
VI
CH
3
ONa
Fe(NO
3
)
2
K
3
PO
4
(NH
4
)
2
S
NaNO
3
CH
3
COONH
4
Hydrolizie kationowo-anionowej ulegaj
ą
substancje w probówkach:
A I, II i III
B II, V i VI
C I, III i V
D II, IV i VI
244.
Jakie odczyny wykazuj
ą
wodne roztwory Na
3
PO
4
, Na
2
HPO
4
, NaH
2
PO
4
o tych samych st
ęż
eniach?
Na
3
PO
4
Na
2
HPO
4
NaH
2
PO
4
A
silnie zasadowy
silnie zasadowy
silnie zasadowy
B
silnie zasadowy
słabo zasadowy
słabo kwasowy
C
oboj
ę
tny
słabo zasadowy
silnie zasadowy
D
silnie zasadowy
silnie zasadowy
słabo kwasowy
245.
Czterochlorek tytanu jest lotn
ą
ciecz
ą
o temperaturze wrzenia 136
o
C. W wojsku znalazł zastosowanie do
wytwarzania zasłon dymnych, poniewa
ż
z par
ą
wodn
ą
reaguje zgodnie z równaniem:
TiCl
4
+ 2H
2
O
TiO
2
+ 4HCl daj
ą
c g
ę
st
ą
mgł
ę
Równanie to opisuje reakcj
ę
:
A dysproporcjonowania
B hydrolizy
C zoboj
ę
tnienia
D utlenienia
246.
Stała i stopie
ń
hydrolizy jonów NO
2
-
w 0,01M roztworze NaNO
2
wynosz
ą
odpowiednio:
A K=2,5
.
10
-11
,
β
=5
.
10
-5
B K=2,5
.
10
-9
,
β
=5
.
10
-4
C K=2,5
.
10
-10
,
β
=1,58
.
10
-5
D K=2,5
.
10
-10
,
β
=5
.
10
-4
K
HNO2
=4
.
10
-4
247.
Stała i stopie
ń
hydrolizy CH
3
COONH
4
w 0,01M roztworze tej soli wynosz
ą
odpowiednio:
A K=3
.
10
-6
,
β
=0,055
B K=3
.
10
-5
,
β
=0,55
C K=3,1
.
10
-5
,
β
=0,55%
D K=3
.
10
-5
,
β
=5,5%
K
NH4OH
=1,7
.
10
-5
K
CH3COOH
=1,86
.
10
-5
248.
pH 0,001M roztworu CH
3
COONa wynosi w przybli
ż
eniu:
A 6
B 7
C 8
D 11
K
CH3COOH
=1,86
.
10
-5

45
249.
pH buforu powstałego ze zmieszania 500cm
3
0,2M CH
3
COOH i 500cm
3
0,2M CH
3
COONa wynosi w
przybli
ż
eniu:
A 5
B 9
C 7
D 6
20. Iloczyn rozpuszczalno
ś
ci
250.
Iloczyn rozpuszczalno
ś
ci CaSO
4
: I
R
=[Ca
+2
][SO
4
-2
]=6,3
.
10
-5
Po zmieszaniu równych obj
ę
to
ś
ci roztworów siarczanu potasu i chlorku wapnia o st
ęż
eniach0,010M
stwierdzamy,
ż
e:
A wytr
ą
cił si
ę
osad CaSO
4
B nie obserwujemy
ż
adnych zmian poniewa
ż
nie został przekroczony iloczyn rozpuszczalno
ś
ci CaSO
4
C wytr
ą
cił si
ę
osad KCl
D wytr
ą
cił si
ę
osad CaSO
4
, ale dopiero po silnym wytrz
ą
saniu
251.
Zmieszano 250cm
3
0,02M roztworu AgNO
3
z 250cm
3
0,01M NaCl (I
R AgCl
=1,58
.
10
-10
).
A osad si
ę
wytr
ą
ci, a w roztworze pozostanie nadmiar AgNO
3
B osad si
ę
wytr
ą
ci, a w roztworze pozostanie nadmiar NaCl
C osad si
ę
nie wytr
ą
ci
D wytr
ą
ci si
ę
osad AgNO
3
252.
Zwi
ą
zki AB i AC
2
maj
ą
warto
ś
ci iloczynów rozpuszczalno
ś
ci sobie równe (4
.
10
-18
). Mo
ż
na z tego
wywnioskowa
ć
,
ż
e:
A zwi
ą
zek AB jest lepiej rozpuszczalny ni
ż
AC
2
B zwi
ą
zek AC
2
jest lepiej rozpuszczalny ni
ż
AB
C zwi
ą
zki AB i AC
2
s
ą
jednakowo, słabo rozpuszczalne w wodzie
D oba zwi
ą
zki s
ą
dobrze rozpuszczalne w wodzi
253.
Iloczyn rozpuszczalno
ś
ci Ag
2
CrO
4
wynosi 9
.
10
-12
, a PbCrO
4
wynosi 1,8
.
10
-14
. który z tych zwi
ą
zków jest
słabiej rozpuszczalny?
A PbCrO
4
B AgCrO
4
C PbCrO
4
i AgCrO
4
s
ą
jednakowo trudno rozpuszczalne w wodzie
D na podstawie podanych informacji nie jest mo
ż
liwe porównanie rozpuszczalno
ś
ci omawianych
zwi
ą
zków.
254.
Iloczyn rozpuszczalno
ś
ci Ag
2
CrO
4
wynosi I
R
=1
.
10
-12
. Oznacza to,
ż
e 1dm
3
nasyconego roztworu tej soli
zawiera około:
A 6,3
.
10
-5
moli Ag
2
CrO
4
B 9,4
.
10
-7
moli Ag
2
CrO
4
C 1
.
10
-6
moli Ag
2
CrO
4
D 1
.
10
-3
moli Ag
2
CrO
4

46
255.
Po dodaniu do zlewki zawieraj
ą
cej nasycony, wodny roztwór BaSO
4
kropli 1M roztworu H
2
SO
4
:
A równowaga układu nie ulegnie zmianie
B wzro
ś
nie st
ęż
enie jonów Ba
+2
w roztworze w zlewce
C zmaleje st
ęż
enie jonów Ba
+2
w roztworze w zlewce
D zmaleje st
ęż
enie jonów SO
4
-2
w roztworze w zlewce
256.
Przy jakiej warto
ś
ci pH zaczyna si
ę
wytr
ą
ca
ć
osad Fe(OH)
2
(I
R Fe(OH)2
=10
-14
) z 0,01M roztworu wzgl
ę
dem
jonów Fe
+2
?
A 6
B 8
C 4,6
D 9,4
257.
Jaka jest rozpuszczalno
ść
BaSO
4
w 0,01M wodnym roztworze BaCl
2
? (I
R BaSO4
=1
.
10
-10
)
A 2,33
.
10
-3
g/dm
3
B 2,33
.
10
-6
g/dm
3
C 2,33
.
10
-4
g/dm
3
D 2,33
.
10
-2
g/dm
3
258.
Ile cm
3
0,01M roztworu wodorotlenku sodu nale
ż
y doda
ć
do 150cm
3
nasyconego roztworu Cd(OH)
2
, tak
aby rozpuszczalno
ść
wodorotlenku kadmu zmalała 50-krotnie? I
R
Cd(OH)2
=2,8
.
10
-14
A 4,2cm
3
B 9,7cm
3
C 28,3cm
3
D 38,3cm
3
21. Zwi
ą
zki kompleksowe
259.
Liczba koordynacyjna jonu centralnego mo
ż
e by
ć
zdefiniowana jako:
A liczba wszystkich jonów tworz
ą
ca zwi
ą
zek kompleksowy
B liczba jonów centralnych w zwi
ą
zku kompleksowym
C liczba ligandów jednopozycyjnych otaczaj
ą
ca jon centralny w zwi
ą
zku kompleksowym
D ilo
ść
jonów zawartych w zewn
ę
trznej sferze koordynacyjnej zwi
ą
zku kompleksowego
E suma ilo
ś
ci ligandów i jonów centralnych w wewn
ę
trznej sferze koordynacyjnej zwi
ą
zku
kompleksowego.
260.
Atom centralny w zwi
ą
zku zespolonym [Cr(NH
3
)
5
Cl]Cl
2
ma liczb
ę
koordynacyjn
ą
równ
ą
:
A 5
B 6
C 8
D 2
261.
I. Im mniejsza stał
ą
nietrwało
ś
ci tym bardziej trwały kompleks
II. Im mniejsza stała nietrwało
ś
ci tym kompleks jest mniej trwały
III. Im mniejsza stała nietrwało
ść
i tym wi
ę
ksza warto
ść
stałej trwało
ś
ci
IV. Ładunek jonu kompleksowego jest sum
ą
ładunków ligandów i jonu centralnego
V. Ładunek jonu kompleksowego jest iloczynem ładunków ligandów i jonu centralnego
Spo
ś
ród wymienionych powy
ż
ej zda
ń
prawdziwymi s
ą
:
A I, III, V
B II i IV
C I, III i IV
D tylko I
E I i IV

47
262.
Jonami centralnymi w podanych ni
ż
ej zwi
ą
zkach s
ą
jony: Ag
+
, Co
3+
, Cr
3+
, Pt
4+
. Okre
ś
l ładunek x, y, z, k,
w nast
ę
puj
ą
cych jonach zespolonych:
[Ag(CN)
2
]
x
[Co(CN)
6
]
y
[Cr(NH
3
)
5
Cl]
z
[PtCl
6
]
k
A
1+
3-
3+
2-
B
2-
3+
2+
4+
C
1-
3-
2+
2-
D
2+
3+
3+
4+
263.
Bis(tiosiarczano)srebrzan(I) sodu to zwi
ą
zek o wzorze:
A Na
3
[Ag(S
2
O
3
)
2
]
B NaAg(S
2
O
3
)
2
C Na[Ag(S
2
O
3
)
4
]
D Na[Ag
2
S
2
O
3
]
264.
Chlorek heksaakwachromu(III) to zwi
ą
zek o wzorze:
A [Cr(H
2
O)
6
]Cl
3
B [CrCl
6
]
.
H
2
O
C [Cr
6
Cl]
.
H
2
O
D [CrCl
3
]
.
H
2
O
265.
Podaj poprawne nazwy systematyczne poni
ż
szych zwi
ą
zków kompleksowych:
[Co(NO
3
)(NH
3
)
5
]Cl
2
K
2
[Fe(CN)
5
NO]
A chlorek pentaaminanitrokobaltu(III)
pentacyjanonitrozylo
ż
elazian(II) potasu
B chlorek pentaaminaazotanokobaltu(III)
pentacyjanonitrozyl
ż
elazian(III) potasu
C pentaaminadichloronitrylokobaltan(III)
cyjanek nitrozo
ż
elazianu(II)
D chlorek pentaaminaazotanokobaltu(II)
pentacyjanonitrozo
ż
elazian(III) potasu
266.
Do
ś
wiadczalnie stwierdzono,
ż
e jeden mol zwi
ą
zku kompleksowego tworzy z nadmiarem AgNO
3
dokładnie jeden mol AgCl. Budow
ę
tego zwi
ą
zku najlepiej przedstawia wzór:
A [Cr(NH
3
)
4
(H
2
O)
2
]Cl
3
B [Cr(NH
3
)
4
(H
2
O)
2
Cl]Cl
2
C [Cr(NH
3
)
4
(H
2
O)
2
Cl
2
]Cl D [Cr(NH
3
)
3
(H
2
O)
2
Cl
3
]
.
NHl
3
267.
St
ęż
enie jonów Ag
+
w 0,01M roztworze [Ag(NH
3
)
2
]
+
wynosi:
A 2,5
.
10
-5
M
B 1,25
.
10
-5
M
C 5,4
.
10
-4
M
D 1,6
.
10
-7
M
Stała trwało
ś
ci [Ag(NH
3
)
2
]
+
wynosi w przybli
ż
eniu 1,6
.
10
7
268.
Stopie
ń
dysocjacji jonu [Fe(CN)
6
]
3-
w 1M roztworze heksacyjano
ż
elazianu(III) potasu wynosi:
A 2
.
10
-6
%
B 2,2
.
10
-5
%
C 10
-2
%
D 10
-3
%
Stała trwało
ś
ci [Fe(CN)
6
]
3-
wynosi w przybli
ż
eniu 1
.
10
42

48
22. Procesy redox
22.1.
Poj
ę
cia podstawowe
269.
Zaznacz szereg zwi
ą
zków, w którym wyst
ę
puj
ą
wył
ą
cznie utleniacze:
A NaCl, NaOCl, NaClO
4
, Na
2
S
B SO
3
, KMnO
4
, H
2
O
2
, CrO
3
C Na
2
S
2
O
3
, O
2
, PbO
2
, HNO
3
D N
2
O
5
, K
2
Cr
2
O
7
, Na
2
CrO
4
, F
2
270.
Na podstawie równa
ń
reakcji:
1. H
2
O
2
+ 2I
-
+ 2H
+
2H
2
O + I
2
2. 5H
2
O
2
+ 2MnO
4
-
+ 6H
+
8H
2
O + 5O
2
+ 2Mn
2+
3. 3H
2
O
2
+ 2Cr
3+
+ 10OH
-
2CrO
4
2-
+ 8H
2
O
mo
ż
esz powiedzie
ć
,
ż
e nadtlenek wodoru:
A zawsze pełni rol
ę
utleniacza
B w
ś
rodowisku kwa
ś
nym jest zawsze utleniaczem, a w
ś
rodowisku zasadowym jest reduktorem
C utleniaczem jest w reakcji opisanej równaniem 2
D utleniaczem jest w reakcjach opisanych równaniami 1 i 3
271.
W podanych indywiduach chemicznych stopie
ń
utlenienia siarki wynosi kolejno:
H
2
S
S
2-
SO
3
2-
S
8
SO
4
2-
A
-2
-2
+4
0
+6
B
+2
-2
+6
+8
+4
C
+2
+2
+4
-8
-6
D
-1
0
+4
0
+6
272.
Poni
ż
ej przedstawiono kilka równa
ń
reakcji:
I. CH
3
OH + CH
3
COOH
CH
3
COOCH
3
+ H
2
O
II. C
6
H
5
NO
2
+ 6H
*
C
6
H
5
NH
2
+ 2H
2
O
III. C
2
H
4
+ Br
2
C
2
H
4
Br
2
IV. H
2
NCONH
2
+ HNO
3
[H
2
NCONH
3
]
+
+
NO
3
-
Reakcje utleniania i redukcji przedstawiaj
ą
równania:
A II i III
B I i IV
C I, III i IV
D I, II, III i IV
273.
W reakcji MnO
2
+ 2S
MnS + SO
2
:
A utleniaczem jest mangan i tlen a reduktorem siarka
B mangan jest utleniaczem, a siarka utleniaczem i reduktorem
C utleniaczem jest mangan a siarka reduktorem
D reduktorem jest mangan, a utleniaczem siarka
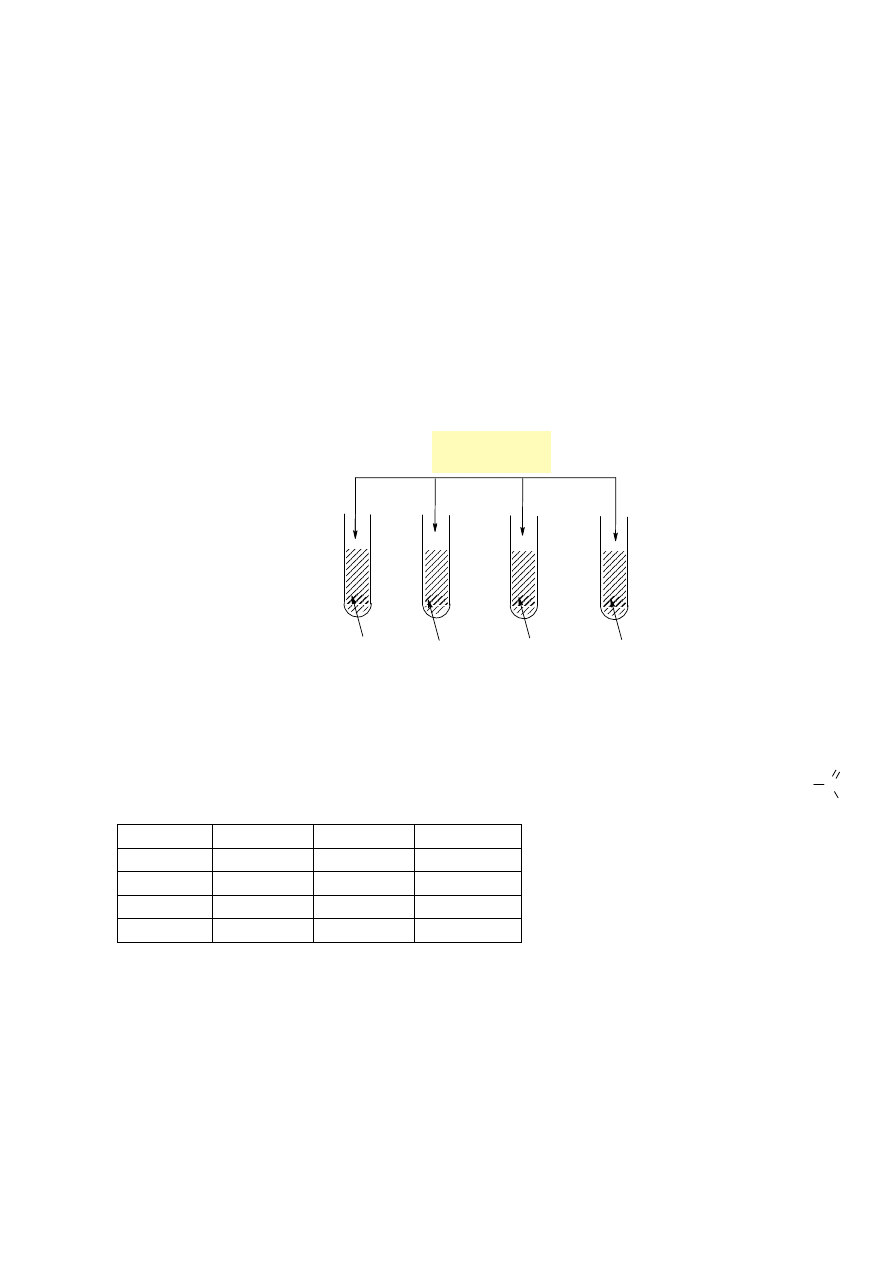
49
274.
W celu rozpuszczenia 8,7g tlenku manganu(IV) w kwasie solnym nale
ż
y u
ż
y
ć
:
A 400cm
3
0,2M roztworu tego kwasu
B 100cm
3
2M roztworu tego kwasu
C 200cm
3
2M roztworu tego kwasu
D 200cm
3
0,2M roztworu tego kwasu
275.
Podaj, które z poni
ż
szych równa
ń
reakcji chemicznych:
I Mg
+2
+ 2e
Mg
II CH
2
=CH
2
+ H
2
CH
3
-CH
3
III 2Br
-
+ Cl
2
Br
2
+ 2Cl
-
IV N
2
O
5
+ H
2
O
2HNO
3
V Fe + S
FeS
Ilustruj
ą
procesy utleniania i redukcji:
A II, III, V
B I, III, V
C III, IV, V
D I, II, IV
276.
Przeprowadzono do
ś
wiadczenie zgodne z poni
ż
szymi schematami:
KMnO
4
+ KNO
2
NaOH
H
2
O
H
2
SO
4
Na
2
CO
3
Zmian
ę
barwy z fioletowej na zielon
ą
zaobserwowano w do
ś
wiadczeniu:
A tylko w I
B I i IV
C tylko w II
D II i III
277.
Stopnie utlenienia atomów w
ę
gla i azotu w cz
ą
steczce acetamidu wynosz
ą
odpowiednio:
CH
3
C
NH
2
O
x
y
z
x
y
z
A
-III
III
-III
B
-III
IV
III
C
III
0
-III
D
-III
II
III

50
22.2.
Przewidywanie kierunku reakcji
278.
Dla podanych układów redoks potencjały standardowe wynosz
ą
:
MnO
2
+ 4H
+
+ 2e
2H
2
O + Mn
2+
1,28V
Cr
2
O
7
2-
+ 14H
+
+ 6e
7H
2
O + 2Cr
3+
1,36V
Cl
2
+ 2e <==> 2Cl
-
1,36V
MnO
4
-
+ 8H
+
+ 5e
4H
2
O + Mn
2+
1,52V
Wynika z tego,
ż
e:
A w
ś
rodowisku kwa
ś
nym MnO
4
-
mo
ż
e by
ć
utleniaczem jonów Cl
-
do chloru Cl
2
B w
ś
rodowisku zasadowym jony Cr
2
O
7
2-
mog
ą
utlenia
ć
jony Cl
-
do chloru Cl
2
C w
ś
rodowisku kwa
ś
nym jony Cr
2
O
7
2-
mog
ą
utlenia
ć
jony Cl
-
do chloru Cl
2
D w
ś
rodowisku kwa
ś
nym jony MnO
4
-
nie mog
ą
utlenia
ć
jonów Cl
-
do chloru Cl
2
E w
ś
rodowisku kwa
ś
nym MnO
4
-
nie mo
ż
e by
ć
utleniaczem jonów Cl
-
do chloru Cl
2
279.
Standardowe potencjały redoks reakcji utleniania i redukcji wynosz
ą
:
S + 2e
S
2-
-0,51V
Cr
2
O
7
2-
+ 14H
+
+ 6e
2Cr
3+
+ 7H
2
O
+1,36V
H
2
O
2
+ 2H
+
+ 2e
2H
2
O
+1,78V
MnO
4
-
+ 8H
+
+ 5e
Mn
2+
+ 4H
2
O
+1,52V
Wynika z tego,
ż
e:
A jony Cr
3+
nie mog
ą
w
ś
rodowisku kwa
ś
nym zredukowa
ć
H
2
O
2
B jony MnO
4
-
mog
ą
w
ś
rodowisku kwa
ś
nym by
ć
utleniaczem jonów S
2-
do siarki S
C jony Cr
2
O
7
2-
mog
ą
w
ś
rodowisku kwa
ś
nym zredukowa
ć
jony S
2-
do siarki S
D dwie odpowiedzi s
ą
prawdziwe
280.
Reakcj
ę
aldehydów z odczynnikiem Tollensa mo
ż
na przedstawi
ć
w pstaci równania redox:
HCHO + 2Ag
+
+ H
2
O
HCOOH + 2H
+
+ 2Ag
0
Potencjały normalny odpowiednich reakcji redoks wynosz
ą
:
HCOOH + 2H
+
+ 2e
HCHO + H
2
O
E
0
=+0,06V
Ag
+
+ e
Ag
0
E
0
=+0,80V
Ró
ż
nica potencjałów redox, która uzasadnia zachodzenie tej reakcji wynosi:
A 0,74V
B 0,86V
C 1,21V
D 0,40V
281.
Mied
ź
rozpuszczono (całkowicie) w 20cm
3
x-molowego roztworu kwasu azotowego. Wydzieliło si
ę
0,9cm
3
bezbarwnego gazu (warunki normalne). Jakie jest st
ęż
enie molowe tego kwasu, je
ś
li oba substraty
przereagowały całkowicie?
A 0,008M
B 0,8M
C 0,1M
D 0,004M
E 0,04M
51
282.
Przeprowadzono badanie zachowania si
ę
metali w 1-molowych roztworach soli, w sposób podany na
rysunku:
Fe
Fe
Pb
Pb
Ag
1
2
3
4
5
Cu
2+
SO
4
2-
Zn
2+
SO
4
2-
Ag
+
NO
3
-
Mg
2+
2Cl
-
Sn
2+
2Cl
-
Po pi
ę
ciu minutach zauwa
ż
ono zmiany w probówkach oznaczonych numerami:
A 1 i 3
B 1, 3 i 5
C 2 i 4
D 2, 4 i 5
283.
W reakcji kwasu azotowego(V) z fosforem wydziela si
ę
bezbarwny gaz. Do utlenienia 93g fosforu, 50%
roztworem kwasu azotowego(V) zu
ż
yto tego roztworu:
A 157,5g
B 315,0g
C 630,0g
D 930,0g
284.
W których probówkach wydzieli si
ę
gaz po dodaniu kwasu solnego:
HCl
Cu
Na
2
SO
4
CaCO
3
Al
4
C
3
KMnO
4
I
II
III
IV
V
A I, II, III
B I, IV, V
C II, III
D III, IV, V
285.
Aby ze 100cm
3
0,05 molowego roztworu H
2
SO
4
otrzyma
ć
maksymaln
ą
ilo
ść
wodoru, nale
ż
y doda
ć
:
A 0,3g Fe
0,3g Cu
C 0,3g Zn
D we wszystkich przypadkach wydzieli si
ę
tyle samo wodoru
286.
6,5g pewnego metalu wrzucono do soli srebrowej. Metal uległ roztworzeniu daj
ą
c jony dwudodatni, a
wydzielone srebro po przemyciu i wysuszeniu wa
ż
yło 21,6g. Obliczy
ć
mas
ę
atomow
ą
metalu.
A 65
B 32,5
C 108
D 208
52
287.
Porównuj
ą
c aktywno
ść
chemiczn
ą
chloru, bromu i jodu wykonano do
ś
wiadczenia:
Cl
2
Br
2
I
2
Br
2
Cl
2
CHCl
3
KI
KBr
KCl
KI
KBr
I
II
III
IV
V
Zmiany zabarwienia warstwy chloroformu zaobserwowano w probówkach:
A I, III i IV
B I, III i V
C II, III i IV
D I, II i V
22.3.
Reakcje redox
288.
W nast
ę
puj
ą
cych równaniach reakcji jonowych:
Cu + 4H
+
+ 2NO
3
-
Cu
2+
+ 2X + 2H
2
O
3Cu + 8H
+
+ 2NO
3
-
3Cu
2+
+ 2y + 4H
2
O
4Zn + 10H
+
+ NO
3
-
4Zn
2+
+ Z + 3H
2
O
w miejsce liter X, Y i Z zapisanych po stronie produktów nale
ż
y wpisa
ć
cz
ą
steczki lub jony, w których
azot przyjmuje nast
ę
puj
ą
ce stopnie utlenienia:
X
Y
Z
A
II
II
I
B
IV
II
-III
C
IV
II
II
D
I
I
-III
289.
aK
2
Cr
2
O
7
+ bH
2
S + cH
2
SO
4
dCr
2
(SO
4
)
2
+ eS + fK
2
SO
4
+ gH
2
O
a
b
c
d
e
f
g
A
1
3
4
1
3
1
7
B
1
3
3
1
4
1
7
C
1
2
3
2
2
1
5
D
2
3
1
1
3
2
4
290.
Współczynniki stechiometryczne reakcji redox w równaniu:
xNO
3
-
+ yS + zH
+
xNO
2
+ y SO
4
2-
+ mH
2
O
wynosz
ą
odpowiednio:
x
y
z
m
A
6
1
2
1
B
4
2
6
3
C
3
3
4
2
D
6
1
4
2
53
291.
Wska
ż
poprawnie dobrane współczynniki stechiometryczne reakcji:
aFe
2+
+ bClO
3
-
+ cH
+
dFe
3+
+ eCl
-
+ fH
2
O
a
b
c
d
e
f
A
3
2
6
3
2
3
B
4
1
6
4
1
3
C
5
2
6
5
2
3
D
6
1
6
6
1
3
292.
W poni
ż
szym równaniu reakcji:
aCH
3
CH
2
OH + bK
2
Cr
2
O
7
+ cH
2
SO
4
dCH
3
CHO+ eCr
2
(SO
4
)
3
+ fK
2
SO
4
+ gH
2
O
prawidłowymi współczynnikami s
ą
liczby:
a
b
c
d
e
f
g
A
2
3
1
4
2
7
7
B
3
1
4
3
1
1
7
C
2
2
3
4
5
2
1
D
2
1
6
5
2
3
4
293.
Współczynniki stechiometryczne reakcji redox w równaniu:
aS + bSO
4
2-
+cOH
-
dSO
4
2-
+ eH
2
O
wynosz
ą
kolejno:
a
b
c
d
e
A
2
4
4
4
2
B
1
2
2
3
1
C
1
2
4
3
2
D
2
4
2
3
1
294.
Współczynniki stechiometryczne w reakcji redox w równaniu:
aAs
2
S
3
+ bKNO
3
+ cH
2
SO
4
dNO
2
+ eK
2
SO
4
+ fK
3
AsO
4
+ gH
2
O
wynosz
ą
kolejno:
a
b
c
d
e
f
g
A
1
28
8
28
11
2
8
B
2
14
4
14
11
2
4
C
1
14
2
14
11
2
1
D
1
14
4
14
11
1
2
295.
Reakcja chemiczna:
Cl
2
+ ……….
ClO
-
+ Cl
-
+ H
2
O
mo
ż
e przebiega
ć
w
ś
rodowisku:
A kwa
ś
nym
B oboj
ę
tnym
C zasadowym
D oboj
ę
tnym lub zasadowym

54
23. Ogniwa
296.
Siła elektromotoryczna ogniwa jest równa:
A ró
ż
nicy potencjałów panuj
ą
cej na biegunach ogniwa, gdy obwód jest zamkni
ę
ty
B ró
ż
nicy potencjałów panuj
ą
cej na biegunach ogniwa, gdy obwód jest otwarty
C ró
ż
nicy spadków napi
ę
cia na oporze wewn
ę
trznym i zewn
ę
trznym
D spadkowi napi
ę
cia na sumie oporów wewn
ę
trznych
297.
Warto
ść
potencjału elektrody cynkowej zanurzonej w roztworze jonów Zn
2+
o st
ęż
eniu 0,01mol/dm
3
jest
równa:
A -0,7V
B -0,82V
C -0,76V
D -0,64V
298.
Podczas pracy ogniwa przedstawionego na rysunku, na elektrodach zachodz
ą
procesy:
Sn
Fe
1M Sn
2+
1M Fe
2+
elektroda dodatnia
elektroda ujemna
A
Fe
Fe
2+
+2e
Sn
2+
=2e
Sn
B
Sn
2+
=2e
Sn
Fe
Fe
2+
+2e
C
Fe
2+
+ 2e
Fe
Sn
Sn
2+
+ 2e
D
Sn
Sn
2+
+ 2e
Fe
2+
+ 2e
Fe
299.
Je
ś
li w czasie pracy ogniwa składaj
ą
cego si
ę
z elektrody wodorowej zanurzonej w 0,1dm
3
roztworu HCl
o pH=2 i elektrody miedzianej zanurzonej w 0,1dm
3
roztworu CuSO
4
o st
ęż
eniu 0,1M, pH roztworu obni
ż
yło
si
ę
o 1 jednostk
ę
, to masa elektrody miedzianej:
A wzrosła o 317mg
B wzrosła o 572mg
C wzrosła o 286mg
D zmalała o 317mg
300.
Podczas pracy ogniwa cynkowo-srebrowego masa elektrody srebrowej zmieniła si
ę
o 10,8mg. W tym
czasie masa elektrody cynkowej:
A wzrosła o 6,5mg
B zmalała o 6,5mg
C zmalała o 3,25mg
D wzrosła o 3,25mg
301.
I Półogniwa pierwszego rodzaju s
ą
odwracalne wzgl
ę
dem kationu
II Półogniwa drugiego rodzaju s
ą
odwracalne wzgl
ę
dem anionu
III Półogniwa pierwszego rodzaju składaj
ą
si
ę
z metalu zanurzonego do roztworu elektrolitu
zawieraj
ą
cego kationy tego metalu
IV Półogniwa drugiego rodzaju składaj
ą
si
ę
z metalu pokrytego trudno rozpuszczaln
ą
sol
ą
tego metalu
zanurzonego do roztworu elektrolitu zawieraj
ą
cego anion tej soli
V Półogniwa redox zbudowane s
ą
z metalu (nie daj
ą
cego w tym roztworze własnej reakcji elektrodowej)
zanurzonego w roztworze zawieraj
ą
cym zarówno utlenion
ą
jak i zredukowan
ą
posta
ć
układu redox.
Prawdziwymi s
ą
stwierdzenia:
A I, II, V
B I, II, III i IV
C tylko V
D tylko I i II
E wszystkie

55
302.
Dwie blachy
ż
elazne zanurzono do dwóch naczy
ń
zawieraj
ą
cych jony Fe
2+
o ró
ż
nym st
ęż
eniu: w
naczyniu pierwszym C
0
1
, a w drugim C
0
2
, przy czym C
0
1
>C
0
2
. Roztwory poł
ą
czono kluczem
elektrolitycznym. Wi
ę
kszy potencjał wyka
ż
e półogniwo w naczyniu:
A pierwszym
B drugim
C w obu jednakowy
D w obu zero
303.
W któr
ą
stron
ę
b
ę
dzie przebiegała reakcja w półogniwie:
I Cr
2
O
7
2-
+ 14H
+
+ 6e <==> 2Cr
2+
+ 7H
2
O
E
0
=1,33V
II SO
4
2-
+ H
2
O + 2e <==> SO
3
2-
+ 2OH
-
E
0
=-0,93V
Po poł
ą
czeniu ze standardow
ą
elektrod
ą
wodorow
ą
?
A I – w lewo, II – w prawo
B I – w prawo, II – w lewo
C I – w prawo, II – w prawo
D I – w lewo, II – w lewo
304.
Podczas pracy ogniwa Daniela masa elektrody cynkowej maleje z szybko
ś
ci
ą
3,25
.
10
-2
mg na sekund
ę
.
Nat
ęż
enie pr
ą
du płyn
ą
cego w obwodzie zewn
ę
trznym wynosi w przybli
ż
eniu:
A 0,4A
B 0,2A
C 0,1A
D 0,5A
24. Elektroliza
305.
Przeczytaj poni
ż
sze stwierdzenia:
I Podczas elektrolizy na katodzie zachodzi proces redukcji.
II Podczas pracy ogniwa na katodzie zachodzi proces redukcji.
III Katoda jest dodatnim biegunem ogniwa.
IV W elektrolizerze elektroda ujemna jest katod
ą
.
Prawdziwe s
ą
stwierdzenia:
A wszystkie
B tylko I, II i IV
C tylko I i IV
D tylko II i III
306.
Podczas elektrolizy wodnego roztworu pewnej substancji, prowadzonej przy u
ż
yciu elektrod w
ę
glowych
poczyniono nast
ę
puj
ą
ce obserwacje:
•
wzrosło pH roztworu
•
na obydwu elektrodach wydzielały si
ę
gazy
S
ą
dzisz,
ż
e przeprowadzono elektroliz
ę
:
A wody
B wodnego roztworu Na
2
SO
4
C wodnego roztworu NaOH
D wodnego roztworu H
2
SO
4
307.
Elektroliz
ę
wodnego roztworu CuSO
4
przeprowadzono w dwóch elektrolizerach. W pierwszym
zastosowano elektrody platynowe, a w drugim miedziane. Jakim zmianom uległo st
ęż
enie jonów Cu
2+
?
I elektrolizer
II elektrolizer
A
zmniejszało si
ę
pozostawało bez zmian
B
wzrastało
pozostawało bez zmian
C
zmniejszało si
ę
wzrastało
D
zmniejszało si
ę
zmniejszało si
ę
56
308.
Jak
ą
sól nale
ż
y podda
ć
elektrolizie, aby na anodzie wydzielał si
ę
wył
ą
cznie CO
2
?
A Na
2
CO
3
B CH
3
COONa
C HCOONa
D Na
2
C
2
O
4
309.
Je
ż
eli na anodzie wydzieliło si
ę
w czasie elektrolizy stopionego KOH 11,2dm
3
tlenu (w przeliczeniu na
warunki normalne), to ilo
ść
wydzielonego na katodzie potasu (w gramach) wynosi:
A 39,1
B 78,2
C 117,3
D 156,4
310.
Jaki ładunek musi teoretycznie przepłyn
ąć
przez roztwór zawieraj
ą
cy 1mol SnCl
2
i 2mole SnCl
4
aby z
roztworu zostały całkowicie wydzielone jony cynowe(II) i cynowe(IV) oraz jony chlorkowe
A 10F
B 20F
C 5F
D 6F
311.
Przeprowadzaj
ą
c elektroliz
ę
CuSO
4
sporz
ą
dzono wykres przedstawiony na rysunku. Jak długo musi
trwa
ć
elektroliza, aby na katodzie wydzieliło si
ę
31,7g miedzi?
1
2
3
4
5
6
7
8
4
8
12
16
20
24
t(h)
Q x10
4
C
A około 1,3h
B około 2,7h
C około 3,1h
D pkoło 6,3h
312.
Ładunek 5000 elektronów wyra
ż
ony w kulombach jest równy:
A 8,3
.
10
-21
B 8
.
10
-16
C 4,8
.
10
-8
D 1,6
.
10
-19
313.
Przez roztwór siarczanu(VI) miedzi(II) przepuszczono pr
ą
d o nat
ęż
eniu 0,5A w czasie 1h. Je
ś
li
wydajno
ść
pr
ą
dowa wynosiła 90% to masa wydzielonej na katodzie miedzi równa si
ę
:
A 0,54g
B 0,59g
C 0,27g
D 1,08g
314.
Dwa elektrolizery poł
ą
czono szeregowo i wł
ą
czono pr
ą
d. Po pewnym czasie na katodzie pierwszego
elektrolizera, w którym znajdował si
ę
roztwór AgNO
3
wydzieliło si
ę
2,16g srebra, a na katodzie drugiego
elektrolizera 0,64g miedzi. Warto
ś
ciowo
ść
miedzi w zwi
ą
zku chemicznym, który znajdował si
ę
w drugim
elektrolizerze wynosiła:
A +II
B +I
C –II
D +III

57
315.
Jakie jest najmniejsze st
ęż
enie cynku, przy którym zachodzi proces wydzielania cynku na elektrodzie
cynkowej; pH roztworu wynosi 1, a nadnapi
ę
cie wydzielania wodoru na cynku 0,76V (dla uproszczenia
przyj
ąć
,
ż
e nadnapi
ę
cie wydzielania cynku na elektrodzie cynkowej wynosi 0V)?
A 0,01M
B 0,001M
C 0,1M
D 1M
316.
Podczas elektrolitycznej rafinacji miedzi:
A masa katody i anody nie ulega zmianie
B masa katody zmniejsza si
ę
, a masa anody zwi
ę
ksza si
ę
C masa katody zwi
ę
ksza si
ę
, a masa anody zmniejsza si
ę
D masa anody maleje, a st
ęż
enie miedzi w roztworze ro
ś
nie proporcjonalnie do wielko
ś
ci ładunku
przepływaj
ą
cego przez elektrolit.
Wyszukiwarka
Podobne podstrony:
Testy z chemii cz 3
Testy z chemii cz 4
Testy z chemii cz 1
Testy z chemii cz 2
Testy z chemii
Zadania dla I roku Chemii przed drugim, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1,
I rok Chemii Egzamin 2003 poprawka, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1,
więcej podobnych podstron