2008
Testy z chemii 4
h t t p : / / w w w . c h e m i a . s o s . p l
Odpowiedzi do testów
Krzysztof G
ę
bicki

Osoby zamierzające studiować
medycynę muszą zdawać maturę
na poziomie rozszerzonym. Testy
zwarte w tym arkuszu (100 pytań
testowych), wraz z omówionymi
dokładnie odpowiedziami
umożliwią solidne przygotowanie
się do matury z chemii.
Do test
ów dołączony jest arkusz
odpowiedzi, oraz arkusz
poprawnych odpowiedzi, dzięki
któremu w łatwy i szybki sposób
możesz skontrolować swoją
wiedzę.
Rozwiązania informatyczne
Pomoc i korepetycje z chemii,
przygotowanie do matury
rozszerzonej z chemii
Chemia SOS- pomoc i korepetycje z chemii
Omówione odpowiedzi do zestawu 100 pytań, oraz
kartę odpowiedzi możesz otrzymać w cenie 2 zł
- 1 -
Karta odpowiedzi
A
B
C
D
A
B
C
D
1
51
2
52
3
53
4
54
5
55
6
56
7
57
8
58
9
59
10
60
11
61
12
62
13
63
14
64
15
65
16
66
17
67
18
68
19
69
20
70
21
71
22
72
23
73
24
74
25
75
26
76
27
77
28
78
29
79
30
80
31
81
32
82
33
83
34
84
35
85
36
86
37
87
38
88
39
89
40
90
41
91
42
92
43
93
44
94
45
95
46
96
47
97
48
98
49
99
50
100
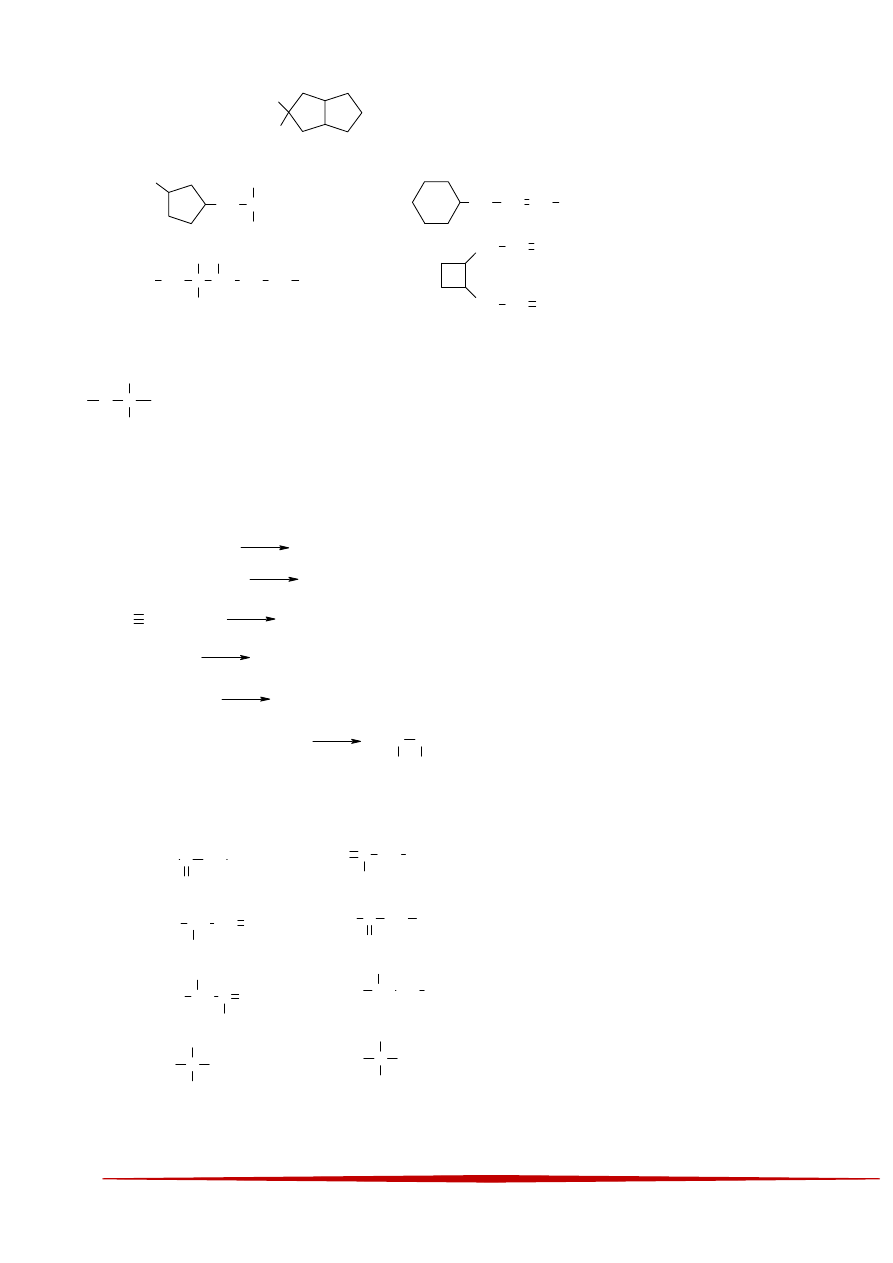
- 2 -
1 Z poniższych związków wybierz ten, który jest izomerem węglowodoru o wzorze:
C
H
3
C
H
3
C
H
3
CH
2
CH
CH
3
CH
3
CH
2
CH CH CH
3
CH
3
CH
2
C
C
H
3
C
H
3
CH
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH CH
2
CH CH
2
A
B
C
D
2 Jeżeli w cząsteczce cukru występuje poniższe ugrupowanie:
O C
OH
R
w którym R jest atomem wodoru lub grupą alkilową, to cukier ten:
A ma właściwości utleniające
B nie ma właściwości redukujących
C ma właściwości redukujące
D nie reaguje w środowisku kwasowym z alkoholami
3 Wybierz reakcje, w których co najmniej jeden atom węgla jest reduktorem:
C
H
CH
CH
2
=CH-CH
3
+ Cl
2
500
o
C
CH
2
=CH-CH
2
Cl + HCl
CH
3
COONa + NaOH
CaO
Δ
CH
4
+ Na
2
CO
3
+ H
2
O
HgSO
4
CH
3
CHO
CH
3
COONH
4
Δ
CH
3
CONH
2
+ H
2
O
I
II
III
IV
C
H
2
CH
2
O
H
OH
CH
2
=CH
2
+ H
2
O
H
+
CH
3
CH
2
OH
3CH
2
=CH
2
+ 2KMnO
4
+ 2H
2
O
3
+ 2MnO
2
+ 2KOH
V
VI
A I, VI
B I, II, IV, VI
C I, II, III, VI
D I, II, III, V, VI
4 Wskaż parę związków będących odmianami tautomerycznymi:
CH
3
C
O
CH
2
CH
3
CH
2
C
OH
CH
2
CH
3
CH
3
CH
OH
CH CH
2
CH
3
C
O
CH
2
CH
3
CH
3
CH
OH
C
OH
CH
2
CH
3
CH
OH
CH
2
CH
2
OH
H C
OH
H
OCH
2
CH
3
H C
OCH
2
CH
3
OH
OCH
2
CH
3
A
B
C
D

- 3 -
5 Wskaż, która para amina – alkohol ma taką samą rzędowość:
I
propano-2-amina; propan-2-ol
II
etyloamina; propan-2-ol
III
dietyloamina;
2,2-dimetylopropan-1-ol
IV
trietyloamina;
3-etylopentan-3-ol
V
dietyloamina;
cykloheksanol
A I
B II
C IV, V
D I, III, V
6 W poniższych wzorach węglowodorów:
C
H
3
C
CH
3
C
H
3
CH
CH
3
CH
2
CH
3
CH
3
CH
2
C
CH
3
CH
3
CH
2
CH
CH
3
CH
3
CH C CH
2
CH
C
H
3
C
CH
3
CH
3
CH
3
CH
3
CH
CH
3
CH CH CH
2
C
CH
3
CH
3
CH
2
CH
3
1
2
3
4
I, II, III i IV-rzędowe atomy węgla występują:
A tylko w 2 i 4 wzorze
B tylko w 1 i 3 wzorze C w żadnym wzorze D we wszystkich wzorach
7 Poniższy proces:
N
H
2
CH
2
COOH
N
H
2
CH
2
COOH
N
H
2
CH
2
CONH-CH
2
-COOH
+
H
+
lub OH
-
+ H
2
O
jest przykładem reakcji:
A estryfikacji i hydrolizy
C polimeryzacji i peptyzacji
B zobojętniania i strącania
D kondensacji i hydrolizy
8 W wyniku reakcji pewnego alkinu z wodą w obecności siarczanu(VI) rtęci(II) i kwasu siarkowego(VI)
otrzymano tylko keton etylopropylowy. Alkinem tym jest:
A pent-2-yn
B heks-1-yn
C heks-2-yn
D heks-3-yn
9 Wybierz związek, którego cząsteczki zawierają asymetryczny atom węgla:
A 1-bromopropan
C 1-bromo-2-chloroetan
B 2-propanol
D kwas 3-aminobutanowy
10 Produktem addycji dwóch cząsteczek bromowodoru do 3-metylobut-1-ynu jest:
A 2,2-dibromo-3-metylobutan
C 1,2-dibromo-4-metylobutan
B 2,3-dibromo-2-metylobutan
D 1,1-dibromo-3-metylobutan
11 W czterech probówkach znajdują się wodne roztwory o jednakowym stężeniu molowym: octanu
sodu, mocznika, chlorku etyloamoniowego, benzoesanu sodu. Wybierz szereg roztworów związków
ułożonych ze wzrastającym pH:
A octan sodu, benzoesan sodu, mocznik, chlorek etyloamoniowy
B chlorek etyloamoniowy, mocznik, octan sodu, benzoesan sodu
C chlorek etyloamoniowy, mocznik, benzoesan sodu, octan sodu
D benzoesan sodu, octan sodu, mocznik, chlorek etyloamoniowy

- 4 -
12 Kąt, o jaki zostaje skręcona płaszczyzna światła spolaryzowanego przez wodny roztwór mieszaniny
glukozy i fruktozy wynosi 30
o
. Skręcalność roztworu glukozy w tych warunkach wynosi 50
o
, a roztworu
fruktozy –90
o
. Skład procentowy tej mieszaniny wynosi:
fruktoza
glukoza
A
14,3% 85,7%
B
30% 70%
C
42,9% 57,1%
D
85,7% 14,3%
13 Związek o wzorze (CH
3
)
2
C=CH-COOH otrzymano w wyniku addycji cyjanowodoru do pewnego
aldehydu, a następnie hydrolizy otrzymanej pochodnej i eliminacji wody z hydroksykwasu. Wyjściowym
aldehydem był:
A 2-metylopropanal
B 3-metylobutanal
C butanal
D 2-metylopropenal
14 Występujący w naturze kwas D-winowy zestryfikowano alkoholem metylowym tak, że uzyskano jego
monoester. Produktem reakcji była:
A nieczynna optycznie równomolowa mieszanina enancjomerów
B mieszanina diastereoizomerów
C mieszanina związków optycznie czynnych
D jeden związek optycznie czynny
15 W wyniku reakcji gorącego alkoholowego roztworu wodorotlenku potasu z 3-bromoheptanem
otrzymano:
A jeden związek organiczny
C trzy związki organiczne
B dwa związki organiczne
D cztery związki organiczne
16 Propanal można przekształcić w propanon w wyniku czterech kolejnych przemian. Wybierz
poprawną odpowiedź:
I
II
III
IV
A
utlenianie eliminacja addycja redukcja
B
redukcja eliminacja
redukcja
addycja
C
eliminacja utlenianie addycja redukcja
D
redukcja eliminacja
addycja utlenianie
17 Ustal, który z poniższych izomerów konstytucyjnych heksanu może dawać cztery produkty
monochlorowania:
A heksan
C 3-metylopentan
B 2-metylopentan
D 2,2-dimetylobutan
18 W celu udowodnienia, że glukoza zawiera grupy hydroksylowe przy sąsiednich atomach węgla, należy
do wodnego roztworu glukozy dodać:
A roztór FeCl
3
C amoniakalny roztwór tlenku srebra
B zawiesinę wodorotlenku miedzi(II)
D wykonać wszystkie powyższe póby
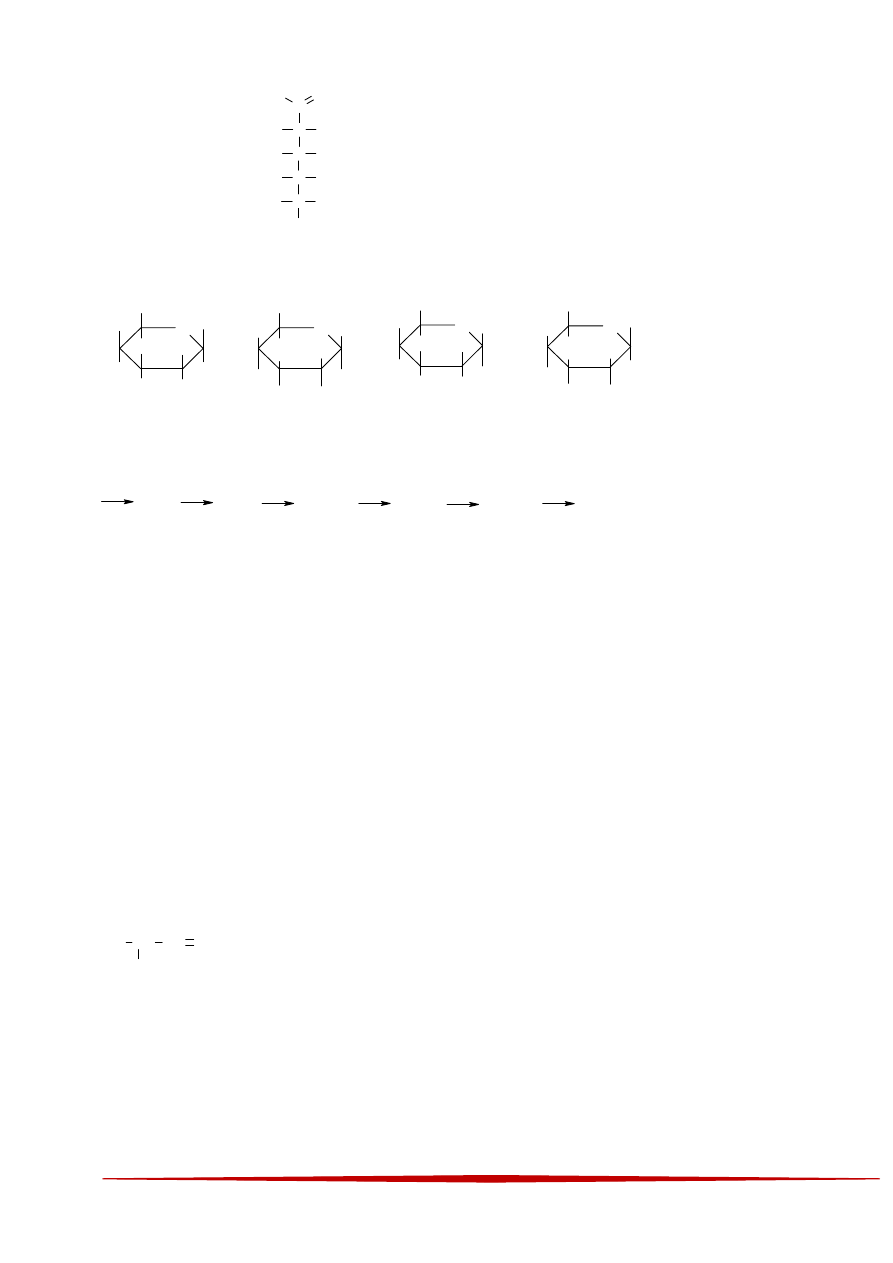
- 5 -
19 Cukier D-taloza ma następujący wzór Fiszera:
C
C
O
H
O
H
H
C H
O
H
C H
O
H
C OH
H
CH
2
OH
O
CH
2
OH
O
H
OH
OH
OH
O
CH
2
OH
O
H
OH
O
H
OH
O
CH
2
OH
O
H
OH
OH
OH
O
CH
2
OH
O
H
OH
O
H
OH
Wybierz wzór
β-talopiranozy.
A
B
C
D
20 W poniższym schemacie:
Cr
CrCl
2
CrCl
3
Cr(OH)
3
KCrO
2
K
2
CrO
4
K
2
Cr
2
O
7
I
II
III
IV
V
VI
procesami utlenienia i redukcji są:
A I, II, III
B III, IV, V
C I, II, V
D I, II, VI
21 Wskaż jak długo należy przepuszczać prąd o natężeniu 1A przez wodny roztwór siarczanu(VI)
miedzi(II), aby ze 100cm
3
0,5 molowego roztworu całkowicie wydzieliła się miedź:
A ok. 19300s
B ok. 9650s
C ok. 1206s
D ok. 603s
22 Wskaż ile gramów wapnia znajduje się w 0,5kg wody wapiennej o stężeniu 0,12%:
A 0,12g
B 0,32g
C 0,60g
D 0,74g
23 Wskaż stałą i stopień dysocjacji 0,05M roztworu kwasu jednowodorowego o pH=4:
stała dysocjacji
stopień dysocjacji
A
2
.
10
-7
2%
B
8
.
10
-5
2%
C
8
.
10
-5
0,2%
D
2
.
10
-7
0,2%
24 Wskaż liczbę wiązań
σ i π w następującym związku organicznym:
CH
3
CH
Cl
CH CH
2
liczba
wiązań
σ
π
A
2 1
B
11 1
C
10 2
D
3 1
- 6 -
25 Zbudowano ogniwo z dwóch półogniw: Zn|Zn
2+
i H
2
|H
+
, Pt będących w stanie standardowym. Określ
w tym ogniwie elektrodę na której zachodzi reakcja utlenienia i oblicz SEM tego ogniwa:
elektroda na której zachodzi reakcja utlenienia
wartość SEM [V]
A
Zn|Zn
2+
0,76
B
Zn|Zn
2+
0,00
C
H
2
|H
+
0,76
D
H
2
|H
+
0,00
26 Przeprowadzono następujące doświadczenia:
Ba(NO
3
)
2
K
3
PO
4
H
2
SO
4
Na
2
CO
3
I
II
III
Wskaż w których probówkach zachodzi reakcja jonowa:
A we wszystkich
B tylko w probówce II
C w probówkach I i III
D w probówkach II i III
27 Przygotowano po 20cm
3
niżej podanych roztworów o stężeniu 0,1M. Po zmieszaniu jakiej pary
roztworów otrzymano roztwór o odczynie obojętnym:
I NaOH i HCl
III KOH i HCOOH
II NaOH i HNO
2
IV Ba(OH)
2
i H
2
SO
4
A I i IV
B I, II i IV
C I, III i IV
D I, II, III i IV
28 Działając stężonym kwasem solnym na znajdujące się w probówkach sole:
I K
2
CO
3
II Na
2
SO
3
III Na
2
S
IV NH
4
NO
3
V KMnO
4
Wydzielanie się gazu zaobserwowano:
A tylko w I
B w II i III
C w I, II, III i V
D we wszystkich probówkach
29 Układem sprzężonym kwas-zasada według teorii Brønsteda nie może być następująca para
cząstek:
kwas
zasada
A
H
3
O
+
OH
-
B
C
6
H
5
NH
3
+
C
6
H
5
NH
2
C
C
6
H
5
COOH C
6
H
5
COO
-
D
HOOC-COO
-
-
OOC-COO
-
30 pH 0,2M roztworu etyloaminy o stałej dysocjacji K=5
.
10
-4
wynosi:
A 12
B 10
C 4
D 2
31 Do jakiej objętości należy rozcieńczyć 10cm
3
wodnego roztworu wodorotlenku baru o stężeniu c
p
=2% i
gęstości d=1,0175g/cm
3
, aby po rozcieńczeniu pH wynosiło 11:
A 373cm
3
B 1190cm
3
C 2380cm
3
D 2643cm
3

- 7 -
32 Podaj ile gramów substancji rozpuszczonej znajduje się w 480g nasyconego roztworu, jeżeli jej
rozpuszczalność w tej temperaturze wynosi 20g:
A 96g
B 80g
C 20g
D 4g
33 Spośród zapisanych poniżej równań reakcji wskaż te, dla której wzrost ciśnienia i temperatury
spowoduje przesunięcie stanu równowagi w prawo:
N
2(g)
+ 3H
2(g)
2NH
3(g)
ΔH
0
298
=-45,7kJ/mol
N
2
O
4(g)
2NO
2(g)
ΔH
0
298
=+153,5kJ/mol
3/2O
2(g)
O
3(g)
ΔH
0
298
=+142,4kJ/mol
NH
4
Cl
(s)
NH
3(g)
+ HCl
(g)
ΔH
0
298
=-175,7kJ/mol
A
B
C
D
34 W jakim stosunku objętościowym należy zmieszać wodę z roztworem Na
2
SO
4
o stężeniu 1,5M, aby
jego stężenie zmalało trzykrotnie:
A 1:1
B 1:2
C 1:3
D 2:1
35 Do zredukowania 6,9moli tlenku żelaza(II) zużyto 6,6moli węgla otrzymując mieszaninę tlenku(II) i
tlenku(IV) węgla. Molowy skład procentowy otrzymanej mieszaniny tlenków wynosi:
%CO
%CO
2
A
95,5 4,5
B
93,0 7,0
C
84,5 15,5
D
50,0 50,0
36 W procesie kondesacji wzięło udział 376kg fenolu i 400kg 30% roztworu metanalu. Oblicz masę
otrzymanej żywicy fenolowo-formaldehydowej, jeżeli wiadomo, że proces kondensacji przebiegał z 90%
wydajnością:
A 424,0kg
B 381,6kg
C 106,0kg
D 95,4kg
37 Na całkowite wytrącenie chlorków z roztworu otrzymanego przez rozpuszczenie 0,14g hydratu chlorku
baru zużyto 10cm
3
0,1M roztworu azotanu(V) srebra. Ustal, ile moli cząsteczek wody zawiera 1mol
hydratu:
A 1mol H
2
O
B 2mol H
2
O
C 3mol H
2
O
D 4mol H
2
O
38 Podczas elektrolizy wodnego roztworu azotanu(V) wapnia wydzielające się gazy zajęły objętość
5,04dm
3
. Masa roztworu poddanego elektrolizie zmniejszyła się o:
A 2,7g
B 5,4g
C 8,1g
D 10,8g
39 Wskaż, które z poniższych tlenków mogą reagować z KOH:
I MgO
II Cr
2
O
3
III NO
IV P
4
O
10
V CO
2
A I, II, III
B II, IV, V
C I, III, V
D III, IV, V

- 8 -
40 Spośród niżej zapisanych anionów:
Cl
-
; ClO
-
; ClO
4
-
; NO
2
-
; NO
3
-
; SO
3
2-
; SO
4
2-
; S
2-
wskaż te, które mogą być tylko utleniaczami, tylko reduktorami oraz utleniaczami lub reduktorami:
tylko reduktory
tylko utleniacze
utleniacze lub reduktory
A
Cl
-
; S
2-
ClO
4
-
; NO
3
-
; SO
4
-
ClO
-
; NO
2
-
; SO
3
2-
B
ClO
4
-
; NO
3
-
;
SO
4
2-
Cl
-
; S
2-
ClO
-
; NO
2
-
; SO
3
2-
C
S
2-
; SO
3
2-
; SO
4
2-
Cl
-
, ClO
-
, ClO
4
-
NO
2
-
; NO
3
-
D
Cl
-
; S
2-
ClO
4
-
; SO
4
2-
ClO
-
; NO
2
-
; NO
3
-
; SO
3
2-
41 Przeprowadzono oddzielnie elektrolizę: wodnego roztworu bromku magnezu i stopionego wodorku
potasu. Na katodzie otrzymano odpowiednio:
MgBr
2(aq)
KH
A
wodór wodór
B
magnez potas
C
wodór potas
D
brom wodór
42 Dobierz odpowiednie substraty tak, aby możliwe były przemiany I, II i III związków manganu zgodnie
z zaznaczonymi strzałkami w poniższym schemacie:
MnO
4
-
MnO
4
2-
MnO
2
I
II
III
I II
III
A
SO
3
2-
; H
2
O CO
2
I
-
; H
+
B
MnO
2
; OH
-
SO
3
2-
; H
2
O I
-
; H
+
C
MnO
2
; OH
-
H
+
SO
3
2-
; H
2
O
D
H
+
MnO
2
; OH
-
SO
3
2-
; H
2
O
43 Na dwie jednogramowe próbki MnO
2
i KMnO
4
podziałano stężonym kwasem solnym. W której
reakcji wydzieliło się więcej chloru:
A w obu przypadkach wydzieliła się taka sam ilość chloru
B kwas solny nie reaguje z tymi substancjami
C w reakcji z MnO
2
D w reakcji z KMnO
4
44 Związek składa się z 40,45% węgla, 7,87% wodoru. 35,95% tlenu, 15,73% azotu. Związkiem tym jest:
A propionamid
B azotan(V) propylu
C kwas 2-aminopropanowy
D propionian amonu
45 W reakcji 25,2g siarczanu (IV) sodu z kwasem siarkowym(VI) wydzieliły się 4dm
3
gazu w warunkach
normalnych. Podaj jaka jest wydajność tej reakcji:
A 100,00%
B 89,28%
C 25,20%
D 10,72%
46 Przeprowadzono reakcję otrzymywania etanolu z 4moli bromoetanu i 8moli wodorotlenku potasu. Stała
równowagi tej reakcji równa się 1/3. Wydajność procentowa reakcji wynosi:
A 33%
B 50%
C 75%
D 100%

- 9 -
47 Dla poniższej reakcji
2NO
2(g)
N
2
O
4(g)
ΔH<0
wzrost wydajności równowagi nastąpi w wyniku:
A obniżenia temperatury i zmniejszenia ciśnienia
B obniżenia temperatury i zwiększenia ciśnienia
C podwyższenia temperatury i zmniejszenia ciśnienia
D podwyższenia temperatury i zwiększenia ciśnienia
48 Dla reakcji zapisanej poniższym równaniem
2CO
2(g)
C
(s)
+ CO
2(g)
wzór na stałą równowagi chemicznej ma postać:
A
2
2
c
[CO]
]
[CO
[C]
K
⋅
=
B
2
2
c
[CO]
]
[CO
K
=
C
]
2
c
[CO
[C]
[CO]
K
⋅
=
D
]
2
c
[CO
[CO]
K
=
49 Stała równowagi reakcji:
X + Y
W + Z
wynosi 1 (K
c
=1). Jeżeli do reaktora o objętości 1dm
3
wprowadzono 2 mole X i 6 moli Y, to ustali się
pierwszy stan równowagi. Po dodaniu jeszcze jednego mola X ustalił się nowy (drugi) stan równowagi.
Stężenia równowagowe produktów wzrosły o:
A 0,5mol/dm
3
B 1mol/dm
3
C 3mol/dm
3
D 4mol/dm
3
50 Poniżej podano ogólne informacje o cząsteczkach związków chemicznych:
I cząsteczka ma kształt tetraedru;
II w cząsteczce kąt między wiązaniami wynosi 109
o
28
’
;
III cząsteczka ma budowę płaską;
IV w cząsteczce kąt między wiązaniami wynosi 180
o
;
V w cząsteczce wiązania leżą wzdłuż osi przechodzących przez jądra tworzących je atomów
Określ, jakiej hybrydyzacji ulegają centralne atomy opisanych cząsteczek (I-V)
hybrydyzacja
tetraedryczna
trygonalna
digonalna
A
I, IV
III
II, V
B
I, II
III
IV, V
C
I
II, V
III, IV
D
III
I, IV
II, V
51 Wskaż w ilu gramach węgla znajduje się tyle samo atomów co w 1dm
3
wodoru w warunkach
normalnych:
A 1,07g
B 0,53g
C 0,51g
D 0,08g
52 Większość związków metali bloku energetycznego d wykazuje silne zabarwienie. Własności te wiążą
się z pochłanianiem kwantów światła przez atomy zawierające elektrony na niecałkowicie zapełnionych
powłokach d. Jony zawierające wypełnioną elektronami podpowłokę d i nie zawierające elektronów d są
bezbarwne. Wskaż szereg zawierający bezbarwne jony:
A Ni
2+
; Mn
2+
, Cd
2+
B V
2+
; Zn
2+
; Fe
2+
C Ti
4+
; Sc
3+
; Cu
+
D Ti
2+
; V
3+
; Zn
2+

- 10 -
53 Wybierz konfigurację elektronową odpowiadającą stanowi wzbudzonemu atomu pewnego pierwiastka:
A 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
1
B 1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
C 1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
2
D 1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
1
54 Wiązanie kowalencyjne powstaje gdy:
A jeden z atomów posiada wolną parę elektronową
B łączą się atomy posiadające dużą różnicę w elektroujemności
C uwspólnieniu ulegają elektrony walencyjne tworzących je atomów
D wiążąca para elektronowa pochodzi od jednego atomu
55 Poniżej podano ogólne informacje o substancjach:
są krystaliczne
na ogół dobrze rozpuszczalne w rozpuszczalnikach polarnych
mają wysokie temperatury topnienia i wrzenia
w stanie stopionym i w roztworach wodnych dobrze przewodzą prąd elektryczny
Na podstawie podanych informacji określ rodzaj wiązania występujący w tych substancjach
A metaliczne
B jonowe
C koordynacyjne
D kowalencyjne
56 Wybierz prawidłowe stwierdzenie:
A rozpuszczalność dwutlenku węgla w wodzie wzrasta ze wzrostem temperatury
B dwutlenek węgla gorzej rozpuszcza się w wodzie niż amoniak
C temperatura wrzenia fluorowodoru jest niższa od temperatury wrzenia chlorowodoru, bromowodoru,
jodowodoru
D fosforowodór nie jest cząsteczką polarną, ponieważ elektroujemność atomów fosforu i wodoru jest
taka sama
57 Wskaż zdanie nieprawdziwe:
A w szeregu pierwiastków uporządkowanych według rosnących wartości liczb atomowych właściwości
chemiczne zmieniają się w sposób okresowy
B na podstawie układu okresowego można przewidzieć właściwości chemiczne nie tylko pierwiastków,
ale i ich prostych związków
C maksymalna wartościowość pierwiastków drugiego okresu jest zgodna z numerem okresu
D układ okresowy jest systemem klasyfikacyjnym pierwiastków, opartym na prawie okresowości.
58 Jony Na
+
i Cl
-
są w:
A stopionym chlorku sodu
C kryształach chlorku sodu
B wodnym roztworze chlorku sodu
D Odpowiedzi A, B i C są poprawne
59 Lit występuje w postaci dwóch izotopów
6
Li i
7
Li. Średnia masa atomowa listu jest równa 6,925u.
Zawartość procentowa obu izotopów litu w mieszaninie wynosi:
6
Li
7
Li
A
92,5% 7,5%
B
69,2% 30,8%
C
50,0% 50,0%
D
7,5% 92,5%
- 11 -
60 Jądro promieniotwórczego izotopu radu
Ra
226
88
uległo przemianom
α i jednej przemianie β
-
. Wskaż
skład jądra, które powstało w wyniku przemian:
Liczba protonów
Liczba neutronów
A
83 131
B
82 132
C
83 214
D
82 214
61 W jądrze atomu izotopu pierwiastka X liczba neutronów jest o 14 większa niż liczba protonów. Liczba
masowa tego izotopu wynosi 86. Podaj konfigurację elektronową atomu pierwiastka X:
A 1s
2
2s
2
p
6
3s
2
3p
2
4s
2
4p
6
C 1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
4s
2
4p
1
B 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
1
D 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
62 Jądro izotopu polonu
Po
215
84
uległo przemianie
α. Wskaż opis jądra, które powstało w wyniku tej
przemiany:
A
Rn
219
86
B
At
216
85
C
Bi
214
83
D
Pb
211
82
63 Wartości czterech liczb kwantowych dla elektronu
↑ w atomie wodoru wynoszą:
n
l
m
s
A
1 1
1
-½
B
1 0
1
½
C
1 0
0
½
D
1 1
0
-½
64 Masa próbki pewnego izotopu promieniotwórczego zmniejszyła się szesnastokrotnie w ciągu 16lat.
Okres połowicznego zaniku tego izotopu wynosi:
A 1 rok
B 2 lata
C 4 lata
D 8 lat
65 Sód jest mniej aktywny od potasu ponieważ:
A ma większą wartość energii jonizacji
B ma większy promień atomu niż jonu
C jego atomy mają inną liczbę elektronów na zewnętrznej powłoce
D jest mniej elektroujemnym pierwiastkiem niż potas
66 Gal (liczba atomowa 31) tworzy dwa trwałe izotopy. Izotop X zawiera w jądrze 38 neutronów, a izotop Y
40 neutronów. Masa atomowa galu wynosi 69,79u. Podaj udział procentowy masy izotopu x w masie
atomowej galu:
A 72,4%
B 60,5%
C 52,2%
D 48,3%
67 Z poniższych zdań:
1.
pary elektronów wiążących i niewiążących różnią się między sobą energią
2.
wiązania
π i σ różnią się między sobą kształtem chmury elektronowej
3.
wiążące pary elektronowe
π i σ mają taką samą energię
4.
wiązania
π i σ mają różną trwałość
prawdziwe są:
A 1 i 3
B 2 i 4
C 1, 2 i 4
D 2, 3 i 4
- 12 -
68 Wskaż zestaw cząsteczek charakteryzujących się wartością momentu dipolowego.
A CH
4
; NH
3
; SO
3
C CCl
4
; C
6
H
6
; HBr
B H
2
O; CO
2
; C
6
H
12
D HCl; NH
3
; CH
3
Cl
69 Pierwiastek X jest bardzo dobrym utleniaczem i gwałtownie reaguje z wodą. Jon prosty pierwiastka X
ma konfigurację neonu. Pierwiastkiem X jest:
A lit
B fluor
C sód
D chlor
70 Spośród podanych poniżej równań wskaż równania reakcji w przypadku których zwiększenie ciśnienia
spowoduje przesunięcie stanu równowagi w lewo:
1. C
(s)
+ H
2
O
(g)
CO
(g)
+ H
2(g)
2. CH
4(g)
+ H
2
O
(g)
CO
(g)
+ 3H
2(g)
3. C
(s)
+ 2H
2(g)
CH
4(g)
B 1 i 2
B tylko 1
C tylko 2
D tylko 3
71 Przed reakcją w reaktorze znajdowały się gazy H
2
i I
2
o stężeniu 0,02mol/dm
3
każdy. Po ustaleniu się
stanu równowagi (w temperaturze T) stężenie HI było równe 0,03mol/dm
3
. Podaj wartość stałej równowagi
reakcji
H
2
+ I
2
2HI
(w temperaturze T):
A 2,7
.
10
-2
B 6
C 36
D 1,2
.
10
3
72 Azotan(V) ołowiu(II) podczas ogrzewania ulega rozkładowi na tlenek ołowiu(II), tlenek azotu(IV) i tlen.
Objętość gazowych produktów reakcje (warunki normalne) powstałych podczas rozkładu 33,1g soli
wynosi:
A 1,12dm
3
B 4,48dm
3
C 5,6dm
3
D 11,2dm
3
73 Przepuszczono 1m
3
powietrza (warunki normalne) przez roztwór Ba(OH)
2
i stwierdzono powstanie
2,64g węglanu baru. Zawartość tlenku węgla(IV) w przepuszczonym powietrzu, wyrażona w procentach
objętościowych, jest w przybliżeniu równa:
A 0,01%
B 0,02%
C 0,03%
D 0,04%
74 Ile razy zwiększy się szybkość reakcji 2X
(g)
+ 2Y
(g)
→ W
(g)
+ Z
(g)
przebiegającej według równania
kinetycznego v=k[X]
2
[Y] jeżeli zwiększy się dwukrotnie stężenia substratów:
A 4
B 8
C 16
D 32
75 W podanych poniżej schematach reakcji:
1. Zn + X
→ ZnSO
4
+ Y
2. KBr + Z
→ Br
2
+ W
substancjami X, Y, W, Z nie mogą być:
X
Y
Z
W
A
MgSO
4
Mg Cl
2
KCl
B
CuSO
4
Cu
Cl
2
KCl
C
MgSO
4
Mg
I
2
KI
D
CuSO
4
Cu
I
2
KI

- 13 -
76 W poniższym równaniu reakcji:
C
H
CH
KOOC COOK
a
+ bKMnO
4
c
+ d KOH + e MnO
2
+ f H
2
O
współczynniki stechiometryczne a, b, c, d, e i f wynoszą:
a
b
c
d
e
f
A
3 6 3 2 6 4
B
6 10 6 4 10
2
C
1 6 1 4 6 4
D
3 8 3 2 8 2
77 W podanym schemacie:
K
2
Cr
2
O
7
+ KI + H
2
SO
4
→ a + b + K
2
SO
4
+ H
2
O
substancje a i b to:
a
b
A
Cr
2
(SO
3
)
3
HI
B
Cr
2
(SO
4
)
3
I
2
C
CrSO
4
K
2
SO
3
D
K
2
CrO
4
I
2
78 Wskaż zestaw roztworów, w których podczas elektrolizy roztwór w przestrzeni katodowej po dodaniu
fenoloftaleiny zabarwi się na malinowo:
A HCl; CuCl
2
; KOH
C CuSO
4
; H
2
SO
4
; Cu(NO
3
)
2
B KCl; Na
2
SO
4
; NaOH
D K
2
S; HNO
3
; AgNO
3
79 W podanym schemacie:
CH
3
CH
2
CH CH
3
OH
a
+ H
2
O
HgSO
4
H
2
SO
4
b
H
2
substancja a to
A but-2-yn (2-butyn)
C but-2-en (2-buten)
B but-1-en (1-buten)
D metylopropen
80 Trzej uczniowie analizowali budowę cząsteczki etenu i propenu i padali następujące stwierdzenia:
1.
eten i propen mają ten sam skład procentowy
2.
w 1g etenu i w 1g propenu znajduje się taka sama liczba atomów węgla
3.
w 1dm
3
etenu i w 1dm
3
propenu odmierzonych w tych samych warunkach
znajduje się taka sama liczba cząsteczek
Prawdziwe są stwierdzenia:
A 1, 2 i 3
B tylko 1 i 2
C tylko 1 i 3
D tylko 2 i 3
81 Liczba asymetrycznych atomów węgla w cząsteczce o podanym wzorze:
CH
OH
CH
NH
C
O
CHCl
2
CH
2
OH
O
2
N
wynosi:
A 1
B 2
C 3
D 4
- 14 -
82 Cysteina to aminokwas o wzorze:
C
N
H
2
H
CH
2
SH
COOH
Zawartość procentowa siarki w tym aminokwasie wynosi:
A 21,2%
B 26,5%
C 32,4%
D 37,6%
83 O glukozie i fruktozie można powiedzieć, że:
A są względem siebie izomerami konstytucyjnymi
B zawierają w cząsteczce grupę aldehydową
C są heksozami
D ulegają hydrolizie
84 Liczba wiązań podwójnych w łańcuchu węglowym cząsteczki kwasu linolenowego, o wzorze
sumarycznym C
17
H
29
COOH wynosi:
A 1
B 2
C 3
D 4
85 Toksyczne działanie tlenku węgla na organizm ludzki lub zwierzęcy polega na:
A tworzeniu z jonami żelaza w hemoglobinie krwi toksycznych węglanów
B tworzeniu koordynacyjnych połączeń tlenku węgla z żelazem hemoglobiny
C tworzeniu koordynacyjnych połączeń tlenku węgla z tlenem znajdującym się we krwi
D utlenieniu tlenku węgla do bardziej toksycznego dwutlenku węgla
86 Wskaż wzory związków X i Z występujących w następującym schemacie przemian:
C
H
3
CH
OH
CH
3
X
HCl
Y
NaOH
[O]
Z
związek X
związek Z
A
CH
3
CH=CH
2
CH
3
COCH
3
B
CH
3
CH=CH
2
CH
3
CH
2
CHO
C
CH
3
CH
2
CH
2
OH CH
3
COCH
3
D
CH
3
CH
2
CH
2
OH CH
3
CH
2
CHO
87 Laktydy to produkty wzajemnej estryfikacji dwóch cząsteczek hydroksykwasów. Laktyd o wzorze:
O
O
C
H
3
O
CH
3
O
powstał z kwasu:
A mlekowego (2-hydroksypropanowego)
B hydroksyoctowego (hydroksyetanowego)
C 3-hydroksypropanowego
D salicylowego (2-hydroksybenzoesowego)
88 Alkan, który w wyniku reakcji monochlorowania daje mieszaninę dwóch monochloropochodnych to:
A n-heksan
C 2,2-dimetylobutan
B 2-metylopentan
D 2,3-dimetylobutan
89 Spośród następujących chloropochodnych etanu:
C
2
H
5
Cl; C
2
H
4
Cl
2
; C
2
H
3
Cl
3
; C
2
Cl
6
wskaż te, które mogą występować w postaci izomerów:
A C
2
H
5
Cl; C
2
Cl
6
C C
2
H
5
Cl; C
2
H
3
Cl
3
B C
2
H
4
Cl
2
; C
2
H
3
Cl
3
D C
2
H
4
Cl
2
; C
2
Cl
6

- 15 -
90 Związek o wzorze CH
2
=CHCl może być produktem reakcji:
A etenu z chlorem
C etynu z chlorem
B etenu z chlorowodorem
D etynu z chlorowodorem
91 W poniższym schemacie:
C
H
2
CH
2
C
H
2
CH
3
CH CH
3
Cl
CH
3
CH CH
3
OH
CH
3
-CH
2
-CH
3
CH
3
-CH=CH
2
a
b
c
d
literami a; b; c; d oznaczono reakcje:
a
b
c
d
A
substytucji eliminacji addycji
substytucji
B
substytucji addycji
eliminacji addycji
C
addycji eliminacji
substytucji
addycji
D
addycji eliminacji
addycji substytucji
92 Z niżej wymienionych cząsteczek
diastereoizomerami są:
CH
3
C
Cl
H
C
H
Cl
CH
3
CH
3
C
Cl
H
C
Cl
H
CH
3
CH
3
C
H
Cl
C
Cl
H
CH
3
CH
3
C
H
Cl
C
H
Cl
CH
3
1
2
3
4
A 1 i 2
B 1 i 3
C 2 i 4
D żadne
93 Liczba izomerycznych trichlorobenzenów o wzorze sumarycznym C
6
H
3
Cl
3
wynosi:
A 2
B 3
C 4
D 5
94 Przeprowadzono doświadczenie:
I
II
K
2
S
H
2
O
CuCl
2
H
2
SO
4
Po zakończeniu reakcji w probówce II:
A powstał zasadowy roztwór
C roztwór pozostał bezbarwny
B wydzielił się bezbarwny gaz
D wytrącił się osad
95 Zgodnie z protonową teorią kwasów i zasad Brønsteda kwas jest donorem protonów a zasada ich
akceptorem. Wybierz spośród poniższych zdanie prawdziwe:
A jon H
3
O
+
jest zasadą
C jon ClO
4
-
jest kwasem
B jon F
-
jest kwasem
D jon NH
4
+
jest kwasem

- 16 -
96 Stężenie jonów wodorowych w 0,01molowym roztworze jednoprotonowego kwasu, którego stopień
dysocjacji
α=2% wynosi:
A 2
.
10
-2
mola/dm
3
C 2
.
10
-4
mola/dm
3
B 4
.
10
-2
mola/dm
3
D 2
.
10
-6
mola/dm
3
97 Zgodnie z równaniem 2X + Y
→ 2Z przereagowało 10g substancji Y. Stosunek mas molowych
substancji X i Y jest równy M
x
:M
y
=1,25. Ile gramów substancji Z powstało w wyniku reakcji?
A 22,5g
B 25g
C 32,5g
D 35g
98 W schemacie przemian:
Ca(OH)
2
CaCO
3
Ca(HCO
3
)
2
CO
2
Y
litera Y oznacza:
A CO
2
; H
2
O
B CaO; H
2
O
C CaH
2
D H
2
O
99 Zmieszano 100cm
3
2-molowego roztworu H
2
SO
4
z 100cm
3
9,1% roztworu NaOH o gęstości d-
1,1g/cm
3
. Zakładając, że otrzymaną solą jest wyłącznie Na
2
SO
4
stężenie molowe roztworu tej soli wynosi
około:
A 0,625 mol/dm
3
C 1,25 mol/dm
3
B 0,85 mol/dm
3
D 1,5 mol/dm
3
100 Do 80cm
3
wody (d=1g/cm
3
) dodano 30g KNO
3
i zawartość zlewki dokładnie wymieszano. Wskaż
prawidłowy opis zawartości zlewki o temperaturze 20
o
C. Skorzystaj z danych umieszczonych w tabeli:
układ w zlewce
stężenie roztworu
A
jednofazowy 27,3%
B
jednofazowy 34,8%
C
dwufazowy 24,0%
D
dwufazowy 25,3%

- 17 -
ODPOWIEDZI
1
Odp. C
Izomerami nazywamy związki o identycznych wzorach cząsteczkowych. Podany związek ma wzór
cząsteczkowy C
10
H
18
. Identyczny wzór cząsteczkowy posiada związek C
2
Odp. C
Ugrupowanie jak na rysunku jest ugrupowaniem hemiacetalowym. Istnieje równowaga z formą
aldehydową (ketonową):
C
R
O
OH
C O
R
która posiada właściwości redukujące. Forma ketonowa posiada również właściwości redukujące
ponieważ w środowisku alkalicznym przekształca się w formę aldehydową (w przypadku cukrów taka
izomeryzacja nazywana jest epimeryzacją):
CH
2
OH
C O
R
C
CH
O
H
R
OH
3
Odp. A
Jeżeli atom węgla ma być reduktorem (sam musi się utlenić), to inna substancja musi się zredukować
(musi być utleniaczem), ponieważ nie ma reakcji tylko redukcji. Zawsze musi jej towarzyszyć reakcja
utlenienia (i na odwrót). W podanych przykładach reakcji redukcji uległ Cl
2
do Cl
-
i MnO
4
-
do MnO
2
4
Odp. A
Tautomeria jest rodzajem izomerii. Pomiędzy izomerami istnieje równowaga, jeden izomer łatwo
przekształca się w drugi w wyniku przeniesienia jednego atomu wodoru. Ten warunek spełniony jest
dla związku A.
5
Odp. C
Rzędowość amin określamy po ilości atomów węgla przyłączonych do atomu azotu, natomiast o
rzędowości alkoholu decyduje rzędowość atomu węgla do którego przyłączona jest grupa
hydroksylowa.
I
C
H
3
C
H
CH
3
NH
2
C
H
3
CH CH
3
OH
I
II
II
CH
3
CH
2
NH
2
CH
3
CH
OH
CH
3
I
II
III
CH
3
CH
2
N
H
CH
2
CH
3
C
H
2
OH
C CH
3
CH
3
CH
3
I
II
IV
CH
2
N
CH
2
CH
2
CH
3
CH
3
CH
3
C
H
3
CH
2
C CH
2
CH
3
CH
2
CH
3
OH
III
III
V
CH
3
CH
2
N
H
CH
2
CH
3
OH
II
II
- 18 -
6
Odp. D
Rzędowość atomu węgla określa z iloma innymi atomami węgla jest on połączony:
I-rzędowy z jednym atomem węgla
II-rzędowy z dwoma atomami węgla
III rzędowy z trzema atomami węgla
IV-rzędowy z czterema atomami węgla
7
Odp. D
Dwie cząsteczki łączą się tworząc jedną, większą, wydziela się przy tym inna, prosta cząsteczka
(woda). Jest to definicja kondensacji. W przeciwną stronę następuje rozkład związku pod wpływem
wody – czyli reakcja hydrolizy.
8
Odp. D
Jeżeli otrzymano tylko jeden produkt reakcji, wyjściowy alkin musiał być symetryczny:
CH
3
CH
2
C
O
CH
2
CH
2
CH
3
CH
3
CH
2
C C CH
2
CH
3
H
2
O/HgSO
4
/H
2
SO
4
9
Odp. D
Asymetryczny atom węgla to taki atom, który połączony jest z czterema różnymi podstawnikami.
Warunek ten spełnia tylko kwas 3-aminobutanowy:
CH
2
Br
CH
2
CH
3
CH
3
CH CH
3
OH
CH
2
CH
2
Br Cl
CH
3
C
CH
2
NH
2
COOH
H
10
Odp. A
Rozwiązanie najlepiej znaleźć pisząc równanie addycji HBr (pamiętajmy o regule Markownikowa):
CH C CH CH
3
CH
3
CH
2
C CH CH
3
CH
3
Br
CH
3
C CH CH
3
CH
3
Br
Br
HBr
HBr
11
Odp. C
Zadanie najlepiej rozwiązać posługując się teorią kwasów i zasad Brønsteda:
CH
3
CH
2
NH
3
+
O
C
N
H
2
NH
2
COO
-
-
CH
3
COO
kwas
związek obojętny
w roztworze wodnym
zasada
zasada
Kwas benzoesowy jest silniejszym kwasem od kwasu octowego, więc jego sprzężona z nim zasada jest
słabszą zasadą od sprzężonej zasady z kwasem octowym (jonu octanowego). W takiej więc kolejności
rośnie pH wodnych roztworów tych związków.
12
Odp. A
Kąt skręcenia płaszczyzny światła spolaryzowanego jest proporcjonalny do stężenia:
[
α]
f
= (-90
o
)
.
c
f
oraz [
α]
g
=50
o.
c
g
c
g
=1-c
f
oraz wiadomo, że [
α]
f
+[
α]
g
=30
o
. Podstawiając dane do ostatniego równania otrzymamy:
(-90
o
)
.
c
f
+50
o.
(1-c
f
)=30
o
rozwiązując równanie otrzymamy:
-90
.
c
f
+50
o
-50
o.
c
f
=30
o
c
f
=0,143 oraz c
g
=0,857, czyli c
f
=14,3%, c
g
=85,7%
Wyszukiwarka
Podobne podstrony:
Testy z chemii cz 3
Testy z chemii cz 1
Testy z chemii cz 2
TESTY FUNKCONALNE cz 2
Testy nieparametryczne cz I medycyna praktyczna
Testy z Lepu I cz.5, VI rok, VI rok, Pediatria, Pediatria, PEDIATRIA OLA, Egzamin, Pisemny, Testy
Biofizyka testy semII cz 3
Testy z chemii tom 1
Testy z chemii
08 Testy 343 [01] 0X 081 Arkusz Egzaminacyjny Etap Pisemny Stycze%c5%84 2008 Odpowiedzi Cz%c4%9
23 Testy 343 [01] 0X 102 Arkusz Egzaminacyjny Etap Pisemny Czerwiec 2010 Odpowiedzi Cz%c4%99%c5
Zadania dla I roku Chemii przed drugim, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1,
więcej podobnych podstron