
2008
Testy z chemii 2
h t t p : / / w w w . c h e m i a . s o s . p l
Odpowiedzi do testów:
Krzysztof G
ę
bicki

Osoby zamierzające studiować
medycynę muszą zdawać maturę
na poziomie rozszerzonym. Testy
zwarte w tym arkuszu (100 pytań
testowych), wraz z omówionymi
dokładnie odpowiedziami
umożliwią solidne przygotowanie
się do matury z chemii.
Do test
ów dołączony jest arkusz
odpowiedzi, oraz arkusz
poprawnych odpowiedzi, dzięki
któremu w łatwy i szybki sposób
możesz skontrolować swoją
wiedzę.
Rozwiązania informatyczne
Pomoc i korepetycje z chemii,
przygotowanie do matury
rozszerzonej z chemii
Chemia SOS- pomoc i korepetycje z chemii
Omówione odpowiedzi do zestawu 100 pytań, oraz
kartę odpowiedzi możesz otrzymać w cenie 2 zł
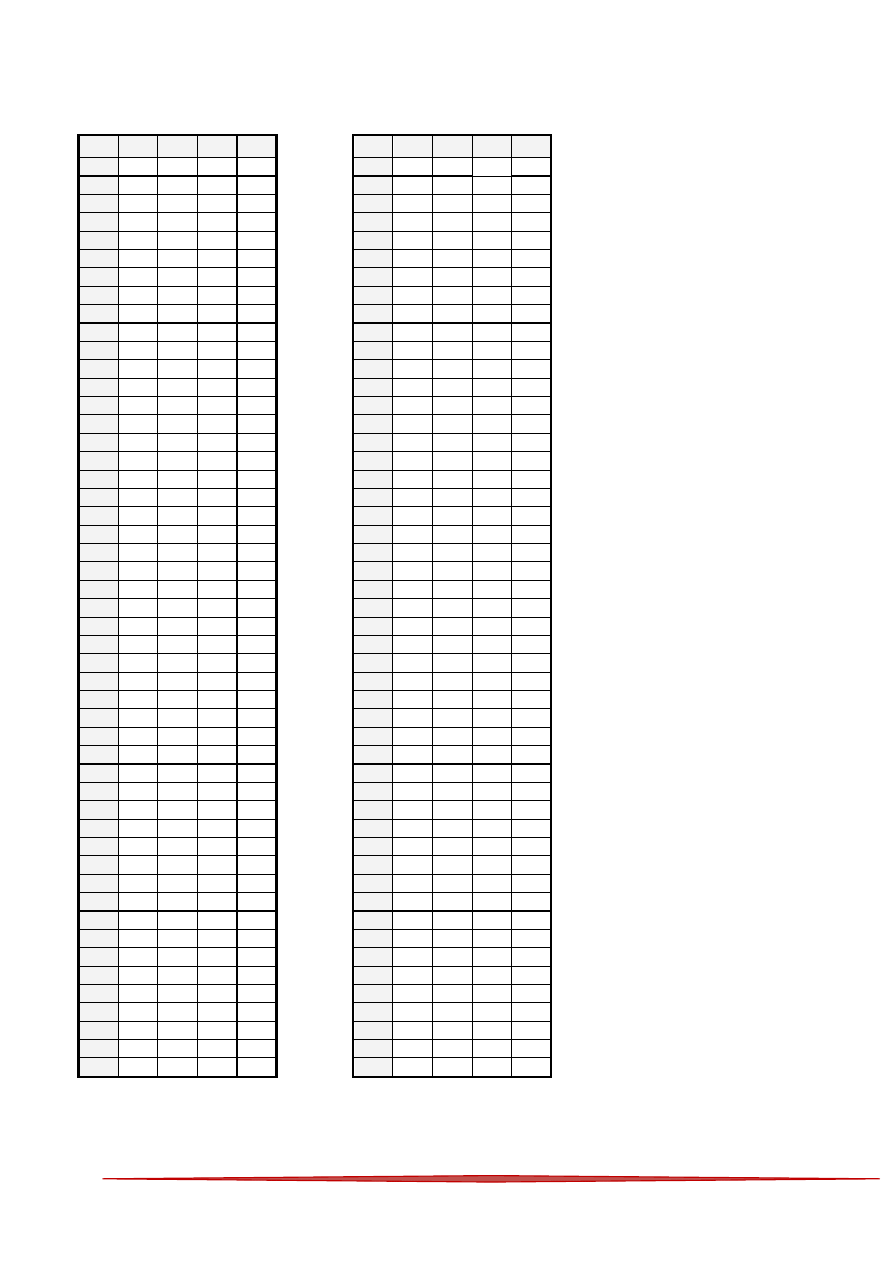
- 1 -
Karta odpowiedzi
A
B
C
D
A
B
C
D
1
51
2
52
3
53
4
54
5
55
6
56
7
57
8
58
9
59
10
60
11
61
12
62
13
63
14
64
15
65
16
66
17
67
18
68
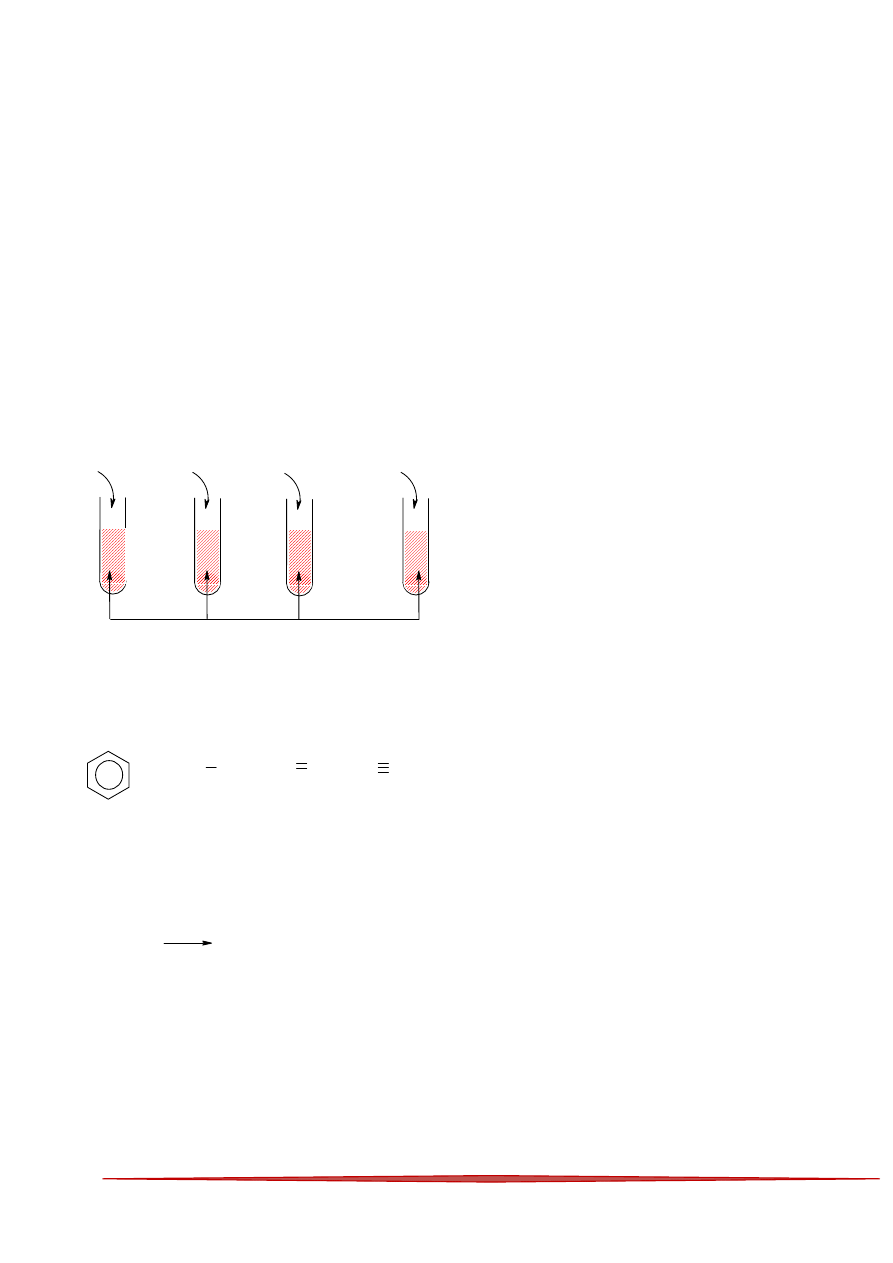
19
69
20
70
21
71
22
72
23
73
24
74
25
75
26
76
27
77
28
78
29
79
30
80
31
81
32
82
33
83
34
84
35
85
36
86
37
87
38
88
39
89
40
90
41
91
42
92
43
93
44
94
45
95
46
96
47
97
48
98
49
99
50
100
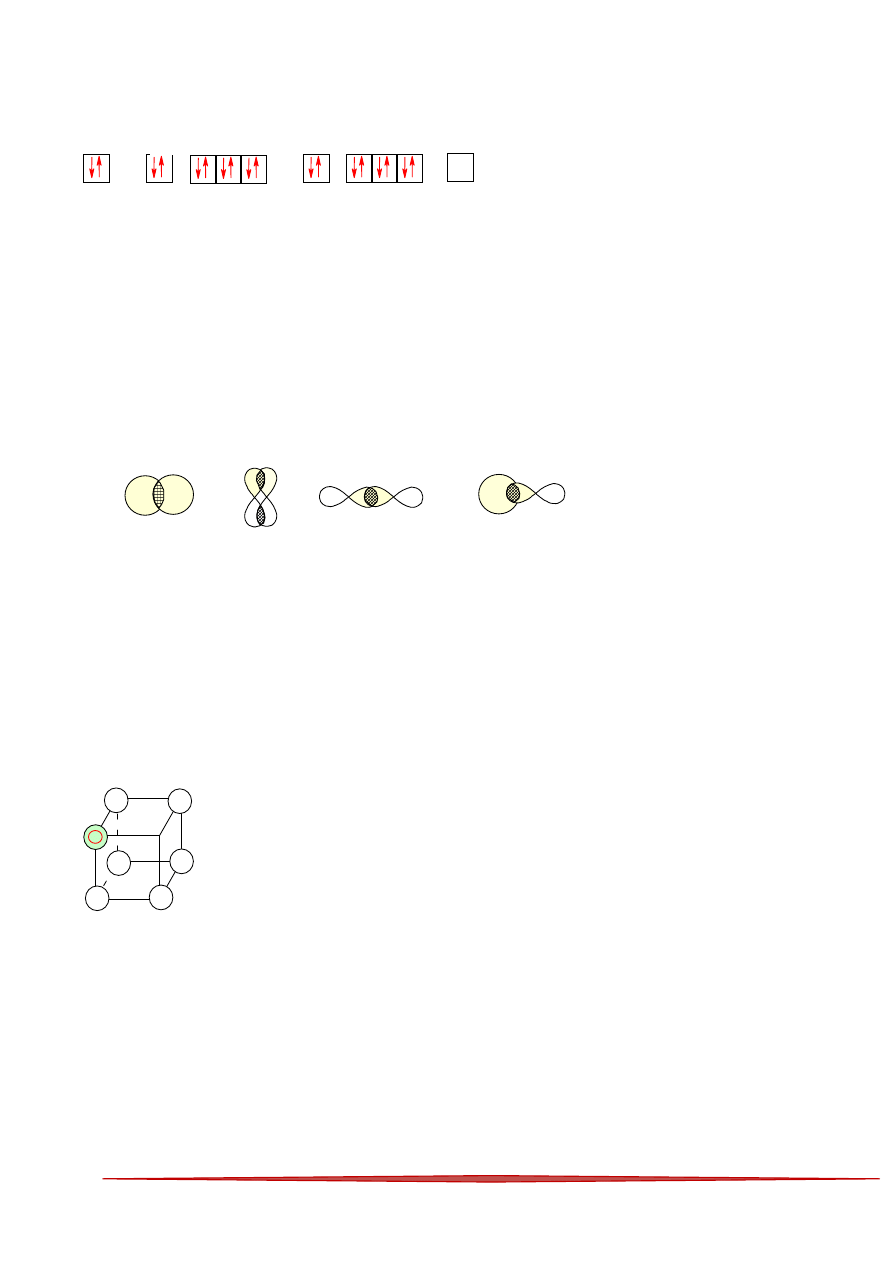
- 2 -
1 Rozważ następujący zapis konfiguracji elektronowej przedstawiony za pomocą liczb kwantowych oraz
systemem klatkowym:
Wskaż, który atom lub jon nie może posiadać takiego zapisu konfiguracji elektronowej
1s
2
2s
2
2p
6
3s
2
3p
6
4s
A Ar
B Cl
-
C Mg
2+
D S
2-
2 W opisie konfiguracji elektronowej atomu zapis 2p
3
informuje, że:
A w atomie trzy elektrony zajmują podwoziom typu p drugiego poziomu energetycznego
B rozmieszczenie elektronów na orbitalach typu p jest zgodne z regułą Hunda
C główna liczba kwantowa wynosi 3, a poboczna liczba kwantowa 2
D w danym orbitalu jest 6 elektronów
3 Wskaż jon, który posiada taką samą liczbę elektronów, co jon Ba
2+
A Br
-
B Rb
+
C Se
2-
D Te
2-
4 Który z modeli nakładania się dwu orbitali atomowych nie ilustruje powstawania wiązania
σ (sigma)
A
B
C
D
5 Wybierz cząsteczkę, w której wszystkie atomy uległy hybrydyzacji sp:
A C
2
H
2
B HCN
C CO
D N
2
6 Pierwiastek wykazuje duże powinowactwo elektronowe. Oznacza to, że:
A wydziela się znaczna ilość energii, gdy atom tego pierwiastka przyłącza elektron
B należy użyć dużej energii w celu otrzymania anionu tego pierwiastka
C oderwanie jednego elektronu walencyjnego wymaga małej energii
D pierwiastek ten jest mało aktywny
7
-
A
B
C
D
Rysunek przedstawia model fragmentu kryształu chlorku sodu z
zaznaczonym położeniem jednego z jonów chlorkowych (-). Która z liter
A, B, C czy D na załączonym modelu wskazuje położenie jednego z
jonów sodu?
8 Szybkość rozpadu promieniotwórczego często wyrażana jest okresem połowicznego zaniku, to znaczy
czasem, w którym połowa masy izotopu ulegnie rozpadowi. Czas połowicznego zaniku dla
s
C
137
55
oszacowano na 30 lat. Jeśli założymy, że w dniu dzisiejszym na pewnym obszarze znajduje się 10g tego
izotopu, to jaka masa tego izotopu pozostanie po 120 latach?
A 0,625g
B 0,750g
C 1,5g
D 2,5g
- 3 -
9 W 1932 roku James Chadwick podczas bombardowania jądra berylu cząstkami
α odkrył neutron
n
E
He
Be
1
0
A
Z
4
2
9
4
+
→
+
. Zderzenie neutronu z jądrem azotu atmosferycznego (
H
E
n
N
3
1
A
Z
1
0
14
7
+
→
+
) jest
powodem obecności trytu (
H
3
1
) w atmosferze ziemskiej. Nuklidem
E
A
Z
w powyższych przemianach jest:
A
C
12
6
B
C
13
6
C
N
12
7
D
N
15
7
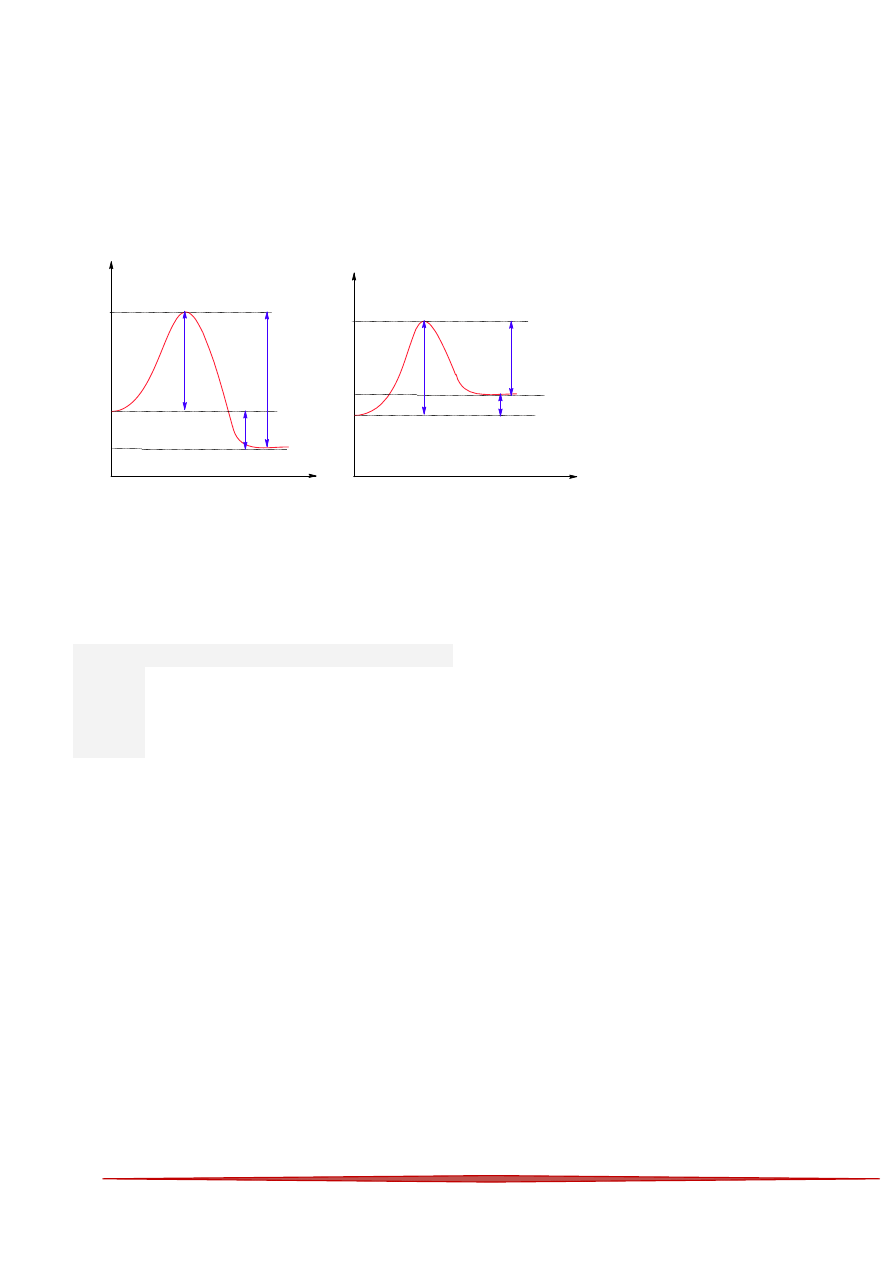
10 Na wykresach wartości energii dla dwóch różnych reakcji oznaczono numerami:
E
n
e
rg
ia
droga reakcji
E
n
e
rg
ia
droga reakcji
Substraty
produkty
Substraty
produkty
1'
2''
3''
1''
2'
3'
Który numer wskazuje wartość energii aktywacji dla reakcji endotermicznej?
A 1’
B 1’’
C 2’ i 2’’
D 3’’
11 Jak zachowa się entropia układu zamkniętego mieszaniny gazów, jeżeli układ zostanie poddany
następującym eksperymentom:
I. podwyższenie temperatury w układzie
II. podwyższenie ciśnienia gazów w tym układzie?
I temperatura
II ciśnienie
A
nie zmieni się zmaleje
B
zmaleje
nie zmieni się
C
zmaleje wzrośnie
D
wzrośnie zmaleje
12 Mieszanina gazów w warunkach normalnych składa się z 4moli CO, 2moli CO
2
, 8moli H
2
i 6moli N
2
.
Masa tej części mieszaniny, w której znajduje się 80dm
3
gazów niepalnych wynosi:
A 114,2g
B 171,4g
C 228,6g
D 342,8g
13 Równanie kinetyczne dla reakcji:
2NO + H
2
Æ N
2
O + H
2
O ma postać: v=k[NO]
2.
[H
2
]
Podniesienie o 10
o
temperatury reakcji przebiegającej w fazie gazowej, w warunkach standardowych
powoduje dwukrotny wzrost szybkości reakcji. Prowadząc reakcję w 308K przy podwójnym stężeniu
wodoru, szybkość reakcji zwiększy się:
A 4 razy
B 8 razy
C 10,5 razy
D 14 razy

- 4 -
14 Oszacuj gęstość [w g/dm
3
] azotu, argonu i tlenku węgla(II) w warunkach normalnych. Wartości
prawidłowe to:
azot
argon
tlenek węgla(II)
A
0,625 0,89
1,96
B
0,625 0,89
1,25
C
1,25 1,78 1,96
D
1,25 1,78 1,25
15 Sporządzono 105g nasyconego roztworu azotanu(V) potasu, w temperaturze 60
o
C, który następnie
oziębiono do temperatury 20
o
C. Oszacuj masę wydzielonej po oziębieniu soki, liczbę moli (n) soli
rozpuszczonej w 105g roztworu w temperaturze 60
o
C oraz stężenie procentowe (c
p
) roztworu w
temperaturze 20
o
C. (patrz tabelka rozpuszczalności).
masa soli wydzielonej
n
moli
w 60
o
C
c
p
w 20
o
C
A
78,4 g
5,40 moli
48,02%
B
55,0 g
2,70 moli
24,00%
C
39,2 g
0,54 moli
24,01%
D
31,6 g
0,44 moli
12,00%
16 Podaj stałą i stopień dysocjacji 0,056 molowego wodnego roztworu kwasu monokarboksylowego,
którego pH wynosi 3.
stała dysocjacji
stopień dysocjacji
A
1,79
.
10
-5
0,0179%
B
6,24
.
10
-3
0,0187%
C
1,79 17,85%
D
1,79
.
10
-5
1,79%
17 2dm
3
wodnego roztworu kwasu o ogólnym wzorze HA zawiera 3,612
.
10
23
jonów A
-
i 4 mole
niezdysocjowanych cząsteczek HA. Stopień dysocjacji i stała dysocjacji HA wynosi:
stopień dysocjacji
stała dysocjacji
A
13% 3,9
.
10
-2
B
13% 4,5
.
10
-2
C
15% 2,25
.
10
-2
D
15% 2,6
.
10
-2
18 Punku izoelektryczny jest to taka wartość pH roztworu, przy której występuje maksymalne stężenie
jonu obojnaczego. Dla alaniny wartość punktu izoelektrycznego wynosi pI=6. W roztworze pH=9
A cząsteczki alaniny wędrują w kierunku elektrody ujemnej
B cząsteczki alaniny wędrują w kierunku elektrody dodatniej
C alanina występuje w postaci kationy
D odpowiedzi A i C są prawdziwe
19 Stwierdzono, że 1cm
3
roztworu zawiera 4,0
.
10
-2
mg całkowicie dysocjowanego wodorotlenku sodu. Jaka
jest wartość pH tego roztworu?
A 12
B 11
C 10
D 9
20 Podczas elektrolizy stopionego chlorku sodu wydzieliło się 560dm
3
chloru mierząc w warunkach
normalnych. Jaką masę sodu otrzymano w tych samych warunkach?
A 0,29 kg
B 0,57 kg
C 1,15 kg
D 2,3 kg

- 5 -
21 W ogniwie pracującym, utworzonym ze standardowych półogniw, którego schemat podano poniżej:
Mg | Mg
2+
|| Au
3+
| Au
zachodzą reakcje opisane równaniami:
anoda
katoda
A
2Au Æ 2Au
3+
+ 6e
3Mg
2+
+ 6e Æ 3Mg
B
3Mg Æ 3Mg
2+
+ 6e
2Au Æ 2Au
3+
+ 6e
C
3Mg
2+
+ 6e Æ 3Mg
2Au Æ 2Au
3+
+ 6e
D
3Mg Æ 3Mg
2+
+ 6e
2Au
3+
+ 6e Æ 2Au
22 Pierwiastki 15 grupy układu okresowego tworzą, między innymi tlenki o ogólnym wzorze E
2
O
3
. Podaj,
jak ze wzrostem liczby atomowej pierwiastka E zmienia się charakter chemiczny tych tlenków:
A kwasowy – amfoteryczny – zasadowy
B kwasowy – zasadowy – amfoteryczny
C zasadowy – amfoteryczny - kwasowy
D wszystkie mają charakter kwasowy
23 Poniżej podano informacje dotyczące pierwiastków chemicznych:
I.
berylowce, ze względu na dużą reaktywność chemiczną nie występują w stanie
wolnym
II.
blok s tworzą litowce i berylowce
III.
wszystkie węglowce są ciałami stałymi
IV.
wśród fluorowców w temperaturze pokojowej: trzy pierwiastki są gazami, jeden
cieczą i jeden ciałem stałym
V.
wodorotlenki wapniowców są mocnymi elektrolitami
VI.
azotowce w połączeniu z fluorowcami są na +V stopniu utlenienia
VII.
w temperaturze pokojowej węgiel nie reaguje z żadnym pierwiastkiem
Prawdziwymi stwierdzeniami są:
A I, III, V, VII
B II, III, IV, VI
C I, II, IV, V, VI
D I, III, V, VI, VII
24 Podaj ile moli KOH zawarte jest w 600g 6% roztworu:
A 6,4 mola
B 6,0 moli
C 0,64 mola
D 0,36 mola
25 Podaj jakie będzie stężenie molowe jonów glinu po zmieszaniu 0,5dm
3
roztworu 1-molowego AlCl
3
z
1,5dm
3
roztworu 1-molowego Al
2
(SO
4
)
3
przy założeniu, że stopień dysocjacji obu soli wynosi 100%
A 1M
B 1,75M
C 2M
D 3,5M
26 Podaj, ile moli chlorku wapnia powstało w reakcji wapna palonego z kwasem solnym, jeżeli wiadomo,
że otrzymano jednocześnie 0,9g wody.
A 1,0 mol
B 0,5 mola
C 0,25 mola
D 0,05 mola
27 W trzech nieopisanych buteleczkach znajdują się roztwory: kwasu siarkowego(VI), siarczanu(VI)
potasu i wodorotlenku potasu. Mając do dyspozycji tylko roztwór Ba(NO
3
)
2
i fenoloftaleinę
zidentyfikowano te substancje. W tym celu należy:
A do próbki każdego roztworu dodano roztwór Ba(NO
3
)
2
i fenoloftaleinę
B do próbki każdego roztworu dodano fenoloftaleinę, a następnie do probówki w której fenoloftaleina
nie zmieniła zabarwienia, dodano roztwór Ba(NO
3
)
2
C do probówki każdego roztworu dodano roztwór Ba(NO
3
)
2
, a następnie roztworem w którym nie strącił
się osad podziałano kolejno na pozostałe, aż do roztworzenia się osadu w jednej z nich
D do probówki każdego roztworu dodano roztwór Ba(BO
3
)
2
, a następnie dwoma roztworami, z których
osad się strąca podziałano na trzeci w obecności fenoloftaleiny

- 6 -
28 Z którego z poniższych związków sporządzono roztwór, jeżeli po dodaniu do 100g wody 18g tego
związku otrzymano roztwór 2,15 molowy o gęstości 1,1g/cm
3
A azotan(V) sodu
B azotan(V) sodu
C siarczek sodu
D chlorek sodu
29 Po zmieszaniu po 1dm
3
jednomolowych roztworów szczawianu sodu i azotanu(V) wapnia wytrącił się
osad, którego rozpuszczalność wynosi 10
-4
mol/dm
3
. W roztworze pozostanie:
A 4mg jonów wapnia
B 8mg jonów wapnia
C 8,8mg jonów szczawianowych
D odpowiedzi A i C są poprawne
30 Osady powstaną w probówkach:
KOH
Na
2
CO
3
NaF
CaCl
2
KCl
Na
2
S
NaOH
Fe(NO
3
)
3
Pb(NO
3
)
3
AgNO
3
Na
2
SO
4
Na
2
S
AgNO
3
LiCl
I
II
III
IV
V
VI
VII
A we wszystkich
B I, II, IV, VI
C I, III, IV, VI, VII
D II, IV, VI, VII
31 Wykonano doświadczenia:
I
II
III
IV
V
VI
Al
Al
Al
Zn
Zn
Zn
HCl
stęż.
NaOH
stęż
H
2
SO
4stęż
HNO
3stęż
HCl
stęż.
NaOH
stęż
Wydzielenie gazu zaobserwowano w probówkach:
A we wszystkich
B I, III, IV, V, VI
C I, II, IV, V, VI
D I, II, IV, V
32 Zmieszano 40% roztwór wodorotlenku potasu ze stechiometryczną ilością 8 molowego roztworu kwasu
azotowego(V) o gęstości 1,24g/cm
3
. Stężenie procentowe otrzymanego roztworu azotanu (V) potasu
wynosi:
A 41,9%
B 40,3%
C 34,2%
D 32,3%
33 W 339cm
3
20% kwasu azotowego(V) o gęstości 1,115g/cm
3
roztworzono 0,3mola miedzi, a następnie
roztwór uzupełniono wodą do objętości 400cm
3
. Stężenie jonów azotanowych(V) w roztworze po reakcji
wynosiło:
A 2,5M
B 1,25M
C 1,0M
D 0,8M
34 Jedzenie jajka srebrną lub posrebrzaną łyżeczką powoduje jej czernienie i wskazuje na obecność w
białkach:
A tlenu, a na powierzchni łyżeczki powstaje czarny nalot tlenku srebra
B siarki, a na powierzchni łyżeczki powstaje czarny nalot siarczku srebra
C azotu, a na powierzchni łyżeczki powstaje czarny nalot związku srebra z azotem
D metali mniej aktywnych od srebra, ponieważ zostają wyparte z cząsteczki białka przez srebro
- 7 -
35 Srebrną obrączkę o masie 2,3g wrzucono do kwasu azotowego(V), a po przereagowaniu metalu, jony
srebrowe wytrącono chlorkiem srebra. Oszacuj procent srebra w obrączce wiedząc, że otrzymano 2,87g
produktu reakcji strąceniowej.
A 94%
B 90%
C 85%
D 80%
36 Rozważ równania połówkowe reakcji utleniania węgla drzewnego stężonym kwasem azotowym(V):
C + 2H
2
O Æ CO
2
+ 4H
+
+ 4e
NO
3
-
+ 2H
+
+ e Æ NO
2
+ H
2
O
Ile gramów węgla musiało przereagować, przy założeniu warunków normalnych reakcji, skoro wydzieliło
się 0,448dm
3
NO
2
?
A 0,24 g
B 0,12 g
C 0,06 g
D 0,03 g
37 Analiza elementarna pewnego związku organicznego wykazała następujący skład procentowy: 52,2%
C, 13,0% H i 34,8% O. Jaki jest najprostszy wzór empiryczny badanego związku?
A C
2
H
6
O
B CH
2
O
C CH
2
O
2
D CH
2
O
3
38 Do wody bromowej wprowadzono:
I
II
III
IV
toluen
benzen
cykloheksen
glukoza
Br
2aq
Odbarwienie wody bromowej nastąpiło w probówkach:
A I, II, III, IV
B II, III, IV
C III, IV
D III
39 W poniższych przykładach oznaczono literami a, b, c i d długość wiązania węgiel-węgiel:
C
H
3
CH
3
C
H
2
CH
2
C
H
CH
a
b
c
d
Która z poniższych relacji długości wiązań jest prawidłowa?
A a>b>c>d
B b>a>c>d
C b>c>a>d
D b>c>d>a
40 Pewien alkan o wzorze sumarycznym C
5
H
12
w obecności światła ulega następującej reakcji
chlorowania:
C
5
H
12
+ Cl
2
h
ν
C
5
H
11
Cl + HCl
Wskaż wzór tego węglowodoru, skoro analiza wykazała, że powstała tylko jedna monochloropochodna
tego węglowodoru
A (CH
3
)
2
C(CH
3
)
2
B CH
3
CH
2
CH(CH
3
)
2
C (CH
3
)
2
CHCH
2
CH
3
D CH
3
CH
2
CH
2
CH
2
CH
3

- 8 -
41 Wskaż, która para związków amina-alkohol są tego samego rzędu:
I.
propano-2-amina i propan-2-ol
II.
etyloamina i cyklopentanol
III.
dimetyloamina i 2-metylopropan-2-ol
IV.
trietyloamina i 2-metylocykloheksanol
A I, IV
B IV, V
C II, III, IV
D I, III, V
42 Wskaż szereg związków ułożonych według wzrastającej temperatury wrzenia w warunkach
normalnych.
A eten, butan, propan-1-ol, propanal, kwas octowy
B etyn, eten, propan, butan-1-ol, 1-chlorobutan
C etyn, pentan, propan-1-ol, butan-1-ol, octan etylu
D etyn, butan, 1-chlorobutan, butan-1-ol, kwas propanowy
43 Do 40cm
3
mieszaniny etenu i etynu dodano 160cm
3
tlenu. Objętość mieszaniny po spaleniu i
całkowitym wykropleniu pary wodnej wynosiła 136cm
3
. Wszystkie objętości mierzono w warunkach
normalnych. Skład wyjściowej mieszaniny był następujący:
eten
etyn
A
35cm
3
5cm
3
B
24cm
3
16cm
3
C
18cm
3
22cm
3
D
8cm
3
32cm
3
44 Związki o poniższych uproszczonych wzorach strukturalnych I – V:
O
Br
Br
Cl
I
II
III
IV
V
mają wzory sumaryczne:
I
II
III
IV
V
A
C
7
H
12
C
7
H
8
O C
8
H
12
Br
2
C
10
H
12
C
8
H
11
Cl
B
C
7
H
12
C
7
H
6
O C
8
H
10
Br
2
C
10
H
12
C
8
H
11
Cl
C
C
7
H
14
C
7
H
8
O C
8
H
10
Br
2
C
10
H
14
C
8
H
11
Cl
D
C
7
H
14
C
7
H
8
O C
8
H
10
Br
2
C
10
H
12
C
8
H
11
Cl
45 W celu spalenia 2,24dm
3
pewnego węglowodoru zużyto 11,2dm
3
tlenu i otrzymano 6,72dm
3
tlenku
węgla(IV) oraz wodę. Pomiary wykonano w tych samych warunkach ciśnienia i temperatury. Tym
węglowodorem był:
A propyn
B propen
C butan
D propan
46 W wyniku spalenia 60g węgla otrzymano 100dm
3
CO
2
odmierzonego w warunkach normalnych.
Procentowa wydajność tej reakcji wynosiła:
A 65,8%
B 70,2%
C 89,3%
D 92,2%

- 9 -
47 W szeregu reakcji przedstawionych schematem:
X
KOH
aq
Y
Al
2
O
3
temp.
Z
Br
2
T
W
CH
2
=CH-CH
3
Substratami X, Y, Z, T i W są:
X
Y
Z
T
W
A
1-chloropropan propan-1-ol propyn 1,2-dibromopropen
sód
B
2-chloropropen propan-2-ol propen 1,1-dibromopropan
sód
C
2-chloropropan propan-2-ol propen 1,2-dibromopropan
cynk
D
2-chloropropan propanal propyn 1,2-dibromopropen
cynk
48 Podaj, ile m
3
wodoru, odmierzonego w warunkach normalnych potrzeba do całkowitego uwodornienia 0,5
tony glicerydu trioleinowego (trioleinian gliceryny), jeśli użyty wodór przereaguje w 90%.
A 38,0m
3
B 42,2m
3
C 380,0m
3
D 422,3m
3
49 W poniższym schemacie:
C
2
H
5
OH
X
C
2
H
4
Y
C
2
H
5
Br
Z
C
2
H
5
OH
Literami X, Y i Z oznaczono reakcje:
X
Y
Z
A
addycji eliminacji
substytucji
B
substytucji addycji
eliminacji
C
eliminacji addycji
substytucji
D
eliminacji substytucji
addycji
50 Wybierz zestaw związków, w których wszystkie są bardziej podatne na substytucję elektrofilową od
benzenu:
A nitrobenzen, aldehyd benzoesowy, kwas benzoesowy
B etylobenzen, bromobenzen, kwas benzoesowy
C 1,4-dinitrobenzen, bromobenzen, 1,4-dibromobenzen
D fenol, anilina, benzeno-1,3-diol
51 Po przeprowadzonej hydrolizie i analizie aminokwasowe oczyszczonej wołowej pepsyny stwierdzono
tylko 0,43% lizyny. wzór lizyny jest następujący:
COO
C
H
3
N
H
(CH
2
)
4
NH
2
-
+
Oszacuj minimalną masę cząsteczkową tej pepsyny.
A 3300u
B 34000u
C 300000u
D 339000u
52 Dane są związki:
I.
1,2-dimetylocyklopropan
II.
2-metylopent-2-en
III.
1,3-dichlorocyklobutan
IV.
3,4-dietyloheks-3-en
V.
penta-1,3-dien
VI.
3-metyloheks-2-en
Wybierz związki, które posiadają izomery cis-trans
A I, III, V, VI
B I, II, V, VI
C III, V, VI
D IV, V, VI
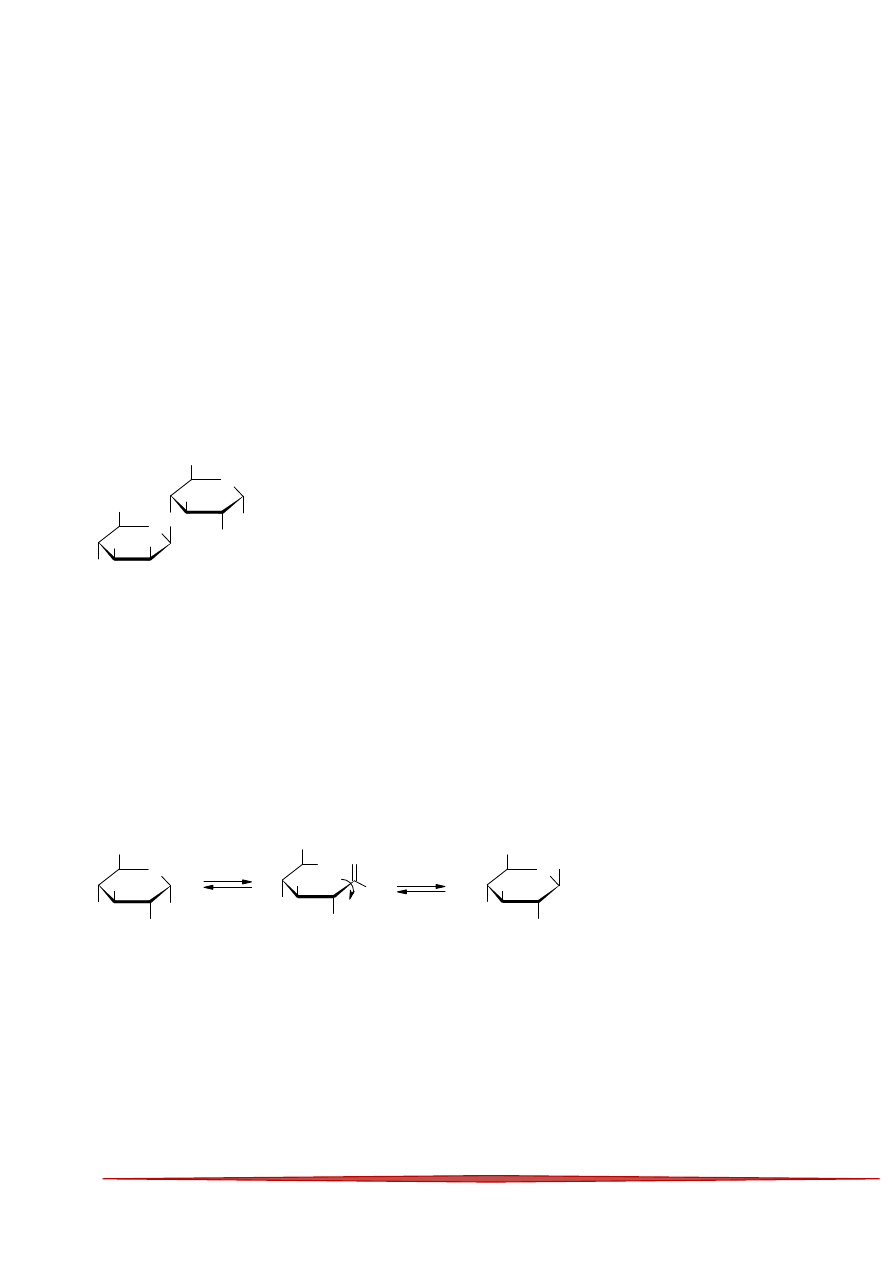
- 10 -
53 Liczba izomerów związku o wzorze C
4
H
8
wynosi:
A 2
B 3
C 4
D 6
54 Wskaż zbiór substancji optycznie czynnych:
A kwas mlekowy, glicyna, alanina
B kwas mlekowy, kwas mezowinowy, glicyna
C kwas mlekowy, glukoza, alanina
D glicyna, gliceryna, glukoza
55 który z podanych niżej związków nie może posiadać izomerów optycznych?
A 3-hydroksypropanal
B 2-hydroksybutanal
C 2-bromopentan
D 3-chloroheksan
56 Ile fenoli jest izomerami konstytucyjnymi 2-fenyloetanolu
A 3
B 6
C 8
D 9
57 Na podstawie wzoru disacharydu
O
CH
2
OH
O
OH
OH
OH
O
CH
2
OH
O
H
OH O
H
wybierz prawdziwe stwierdzenia:
I.
powstał z mannozy i glukozy
II.
nie wykazuje właściwości redukujących
III.
w cząsteczce disacharydu występuje wiązanie
β-1,4-diglikozydowe
IV.
ulega mutrarotacji
V.
zawiera asymetryczne atomy węgla
tworzy kompleks z jodem
A I, II, III, IV
B III, IV, V, VI
C I, III, IV, V
D I, II, IV, VI
58 Po rozpuszczeniu w wodzie
α-glukozy lub β-glukozy obserwuje się zjawisko opisane poniższym
schematem:
O
CH
2
OH
O
H
OH
OH
OH
OH
O
CH
2
OH
O
H
OH
OH
OH
CH
2
OH
O
H
OH
OH
H
O
α-glukoza
glukoza
forma łańcuchowa
β-glukoza
Wskaż liczbę, która jest sumą wszystkich centrów chiralności (asymetrycznych atomów węgla), w trzech
formach glukozy.
A 17
B 14
C 12
D 8
59 Występujący w naturze kwas D-winowy zestryfikowano alkoholem metylowym tak, że uzyskano jego
monoester. Produktem reakcji była:
A nieczynna optycznie równomolowa mieszanina enancjomerów
B mieszanina diastereoizomeró
C mieszanina związków optycznie czynnych
D jeden związek optycznie czynny
- 11 -
60 Dipeptyd o wzorze
N
H
2
CH
2
C
O
N
H
CH
CH
CH
3
CH
3
COOH
ma nazwę:
A glicylowalina
B glicyloglicyna
C alaniloglicyna
D waliloglicyna
61 Jon Fe
3+
ma następującą konfigurację elektronową: 1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
. Wskaż prawidłową
konfigurację elektronową atomu żelaza:
A 1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
2
4p
1
B 1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
C 1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
D 1s
2
2s
2
2p
6
3s
2
3p
6
3d
2
62 Pewien pierwiastek jest mieszaniną dwóch izotopów, z których jeden o zawartości procentowej 54,8% -
zawiera 44 neutrony w jądrze, zaś drugi 46 neutronów. Masa atomowa tego pierwiastka jest równa
79,904u. Liczba atomowa tego pierwiastka wynosi:
A 35
B 45
C 80
D 122
63 Okres półtrwania radu (Ra-226) wynosi 1620 lat. Ile razy zmniejszy się masa badanej próbki radu po
4860 latach?
A 3 razy
B 6 razy
C 8 razy
D 10 razy
64 Liczba wiązań
σ w cząsteczce kwasu szczawiowego wynosi:
A 6
B 7
C 8
D 9
65 Które z wymienionych grup substancji mogą być utleniaczami, a nie mogą być reduktorami:
A NO
3
-
, H
2
O
2
, S
2
O
3
2-
, Br
2
B MnO
4
-
, Fe
3+
, SO
3
2-
, IO
3
-
C F
2
, Pb
4+
, Cr
2
O
7
2-
D S, AsO
4
3-
, I
2
C
66 W temperaturze T stężeniowa stała równowagi reakcji X + Y =2Z jest równa 2. W tej temperaturze
równowagowe stężenie reagenta Z jest równe:
A
]
[
]
[
2
Y
X
⋅
B
]
[
]
[
2
Y
X
⋅
C
]
[
]
[
5
,
0
Y
X
⋅
D
]
[
]
[
5
,
0
Y
X
⋅
67 Laboratoryjna metoda otrzymywania tlenu polega na ogrzewaniu chloranu(V) potasu. W wyniku
rozkładu 27,3g chloranu(V) potasu, zawierającego 10% zanieczyszczeń, uzyskana objętość tlenu (warunki
normalne) wynosi:
A 1,12 dm
3
B 2,8 dm
3
C 6,7 dm
3
D 9,4 dm
3
68 Spośród poniższych zdań, wskaż te, które są prawdziwe dla reakcji opisanej równaniem:
N
2(g)
+ 3H
2(g)
= 2NH
3(g)
ΔH<0
1.
energia wewnętrzna substratów jest większa niż energia wewnętrzna
produktów
2.
podwyższenie temperatury reagentów powoduje przesunięcie równowagi w
prawo
3.
wzrost ciśnienia w układzie powoduje przesunięcie równowagi w prawo
A wszystkie
B tylko 1 i 2
C tylko 1 i 3
D tylko 2 i 3
- 12 -
69 Wiesz, że:
• mieszanina
składa się z wodoru i tlenu zmieszanych w stosunku molowym 2:1 nazywana jest
mieszaniną piorunującą
• entalpia tworzenia pary wodnej jest równa -242kJ/mol
• entalpia procesu H
2
O
(c)
Æ H
2
O
(g)
jest równa +44kJ/mol
Oblicz jaka ilość energii zostanie przekazana do otoczenia podczas wybuchu 6dm
3
mieszaniny
piorunującej (objętość zmierzona w warunkach normalnych) jeżeli produktem jest H
2
O
(c).
A 51kJ
B 43kJ
C 34kJ
D 26kJ
70 Spośród podanych niżej równań reakcji wybierz te, które są równaniami reakcji utleniania i redukcji:
1.
MnO
2
+ NaOH Æ Na
2
MnO
3
2.
MnO
2
+ 4HCl Æ MnCl
2
+ Cl
2
+ 2H
2
O
3.
K
2
Cr
2
O
7
2 2KOH Æ 2K
2
CrO
4
+ H
2
O
4.
(NH
4
)
2
Cr
2
O
7
Æ N
2
+ Cr
2
O
3
+ 4H
2
O
A wszystkie
B tylko 2, 3 i 4
C tylko 1 i 3
D tylko 2 i 4
71 Wskaż procesy, które zachodzą podczas pracy ogniwa niklowo-srebrowego.
Katoda
Anoda
A
2Ag
+
+ 2e Æ 2Ag
Ni Æ Ni
2+
+ 2e
B
2Ag Æ 2Ag
+
+ 2e
Ni
2+
+ 2e Æ Ni
C
Ni Æ Ni
2+
+ 2e
2Ag
+
+ 2e Æ 2Ag
D
Ni
2+
+ 2e Æ Ni
2Ag Æ 2Ag
+
+ 2e
72 Sporządzono dwa roztwory rozpuszczając całkowicie:
200g H
2
O
20g Na
2
O
20g K
2
O
I
II
Stężenia procentowe C
I
% i C
II
% otrzymanych roztworów wodorotlenków I i II wynoszą:
A C
I
=C
II
=9,09%
B C
I
=11,73%, C
II
=10,83%
C C
I
=20,50%, C
II
=18,00%
D C
I
=25,23%, C
II
=20,55%
73 W zlewce zmieszano chlorek sodu z wodą w stosunku masowym m
soli
:m
wody
=2:9. Wskaż prawidłową
charakterystykę mieszaniny w temperaturze 293K. Skorzystaj z tabeli rozpuszczalności soli.
Rodzaj mieszaniny
Stężenie roztworu [%]
A
roztwór nienasycony
18,2
B
roztwór nienasycony
22,2
C
roztwór nasycony w równowadze z osadem
26,5
D
roztwór nasycony w równowadze z osadem
36,0
74 Jeżeli pH roztworu wodorotlenku Me(OH)
2
wynosi 12, a stopień dysocjacji wodorotlenku
α=5% to
stężenie molowe roztworu Me(OH)
2
jest równe:
A 0,4 mol/dm
3
B 0,3 mol/dm
3
C 0,2 mol/dm
3
D 0,1 mol/dm
3
- 13 -
75 Do czterech probówek z podanymi metalami dodano nadmiar kwasu chlorowodorowego. Najwięcej
wodoru (warunki normalne) wydzieliło się w probówce:
A
B
C
D
5g Na
5g Ca
5g Al
5g Cu
76 Wodorotlenek pewnego metalu X nie reaguje z wodorotlenkiem sodu, reaguje natomiast z kwasem
solnym w stosunku molowym 1:2. Wodorotlenek na silne właściwości redukujące. Metalem X może być:
A wapń
B glin
C cynk
D mangan
77 Spośród następujących jonów prostych Cu
2+
. Na
+
, Ni
2+
, Zn
2+
wskaż ten, który ma najsilniejsze
właściwości utleniające:
A Zn
2+
B Na
+
C Ni
2+
D Cu
2+
78 Wskaż szereg w którym podano prawidłowo zmianę mocy kwasów i sprzężonych z nimi zasad.
Kwasy
zasady
A
HI > HBr > HCl
Cl
-
> Br
-
> I
-
B
HI > HBr > HCl
I
-
> Br
-
> Cl
-
C
HCl > HBr > HI
I
-
> Br
-
> Cl
-
D
HCl > HBr > HI
Cl
-
> Br
-
> I
-
79 W przedstawionym schemacie
Ag
H
2
S; O
2
a
HNO
3
b
mała
ilość NH
3
c
nadmiar
NH
3
d
NaCl
e
NH
3(aq)
f
h
ν
substancjami a, b, c, d, e i f zawierającymi srebro są:
a
b
c
d
e
f
A
Ag
2
SO
3
Ag
2
O AgOH [Ag(NH
3
)]
+
AgCl [AgCl]
-
B
Ag
2
S AgNO
3
Ag
2
O [Ag(NH
3
)
2
]
+
AgCl
Ag
C
Ag
2
S AgNO
3
AgOH [Ag(NH
3
)
2
]
+
AgCl
Ag
D
Ag
2
S AgOH AgNO
3
[Ag(NH
3
)]
+
AgCl
Ag

- 14 -
80 Przygotowano roztwory wodne następujących substancji:
I
II
III
IV
V
VI
CH
3
ONa
Fe(NO
2
)
2
K
3
PO
4
(NH
4
)
2
S
NaNO
3
CH
3
COONH
4
Hydrolizie kationowo-anionowej ulegają substancje w probówkach:
A I, II i III
B II, V i VI
C I, III i V
D II, IV i VI
81 Liczba możliwych izomerów alkenu o wzorze C
4
H
8
wynosi:
A 2
B 3
C 4
D 5
82 W poniższym schemacie litery a, b, c, d, e oznaczają odpowiednio:
CaC
2
H
2
O
a
trimeryzacja
b
HNO
3
H
2
SO
4
c
redukcja
d
HCl
e
a
b
c
d
e
A
eten cykloheksan
aminocykloheksan
nitrobenzen
m-chloronitrobenzen
B
acetylen benzen
fenyloamina
nitrobenzen
p-chloronitrobenzen
C
acetylen benzen
nitrobenzen
anilina
chlorowodorek
aniliny
D
eten cykloheksan
nitrocykloheksan
aminocykloheksan
chloroaminocykloheksan
83 Wskaż szereg, w którym węglowodory uporządkowane są według wzrastającej długości wiązań węgiel-
węgiel
A etyn, eten, benzen
B etyn, benzen, eten
C benzen, etyn, eten
D eten, benzen, etyn
84 Do całkowitego spalenia 0,05 mola pewnego węglowodoru zużyto 7,28dm
3
tlenu (warunki normalne).
Wzór sumaryczny tego węglowodoru wynosi:
A C
4
H
4
B C
4
H
6
C C
4
H
8
D C
4
H
10
85 Spośród podanych niżej nazw związków organicznych wskaż nazwę związku, w którym występuje co
najmniej jeden III-rzędowy atom węgla:
1.
2,2-dimetylopentan
2.
2,3-dimetylobutan
3.
2-metylopropan
A 1 i 2
B 2 i 3
C tylko 1
D tylko 3
86 W wyniku całkowitego spalenia próbki pewnego węglowodoru otrzymano 0,5mola CO
2
i 0,5mola H
2
O.
Masa spalonej próbki była równa:
A 31g
B 19g
C 15g
D 7g
87 Liczba możliwych izomerów o wzorze C
10
H
7
NO
2
powstałych podczas reakcji nitrowania naftalenu
wynosi:
A 1
B 2
C 4
D 6
- 15 -
88 Z podanych niżej schematów reakcji, wybierz te, których końcowym produktem będzie:
a)
p-bromonitrobenzen
b)
m-chloronitrobenzen
Br
NO
2
NO
2
Cl
?
?
?
?
Br
2
FeBr
3
Br
2
FeBr
3
HNO
3
H
2
SO
4
HNO
3
H
2
SO
4
HNO
3
H
2
SO
4
HNO
3
H
2
SO
4
Cl
2
AlCl
3
Cl
2
AlCl
3
1
2
3
4
A a-1, b-3
B a-1, b-4
C a-2, b-3
D a-2, b-4
89 W podanym schemacie:
etan
chloroetan
etanol
eten
bromoetan
1
2
3
4
prawidłowo typy reakcji określa:
1
2
3
4
A
addycja addycja eliminacja
substytucja
B
substytucja eliminacja substytucja substytucja
C
substytucja substytucja eliminacja addycja
D
addycja substytucja
addycja eliminacja
90 Który z podanych związków nie zawiera asymetrycznych atomów węgla w cząsteczce?
A kwas winowy (1,2-dihydroksyetano-1,2-dikarboksylowy)
B butan-2-ol
C kwas mlekowy (2-hydroksypropanowy
D propan-2-ol
91 W wyniku reakcji 7,5g pewnego monohydroksylowego alkoholu z sodem wydzieliło się 1,4dm
3
H
2
(warunki normalne). Liczba możliwych izomerów tego alkoholu wynosi:
A 2
B 3
C 4
D 5
92 Produktem końcowym reakcji
C C CH
3
C
H
3
CH
3
CH
2
C
O
CH
3
CH
3
CH
O
H
CH
OH
CH
3
CH
3
CH
2
CH
OH
CH
3
CH
3
CH
CH
3
C
H
O
HgSO
4
H
2
SO
4
jest:
A
B
C
D

- 16 -
93 Ustal wzory związków X i Y występujących w podanym poniżej schemacie reakcji:
CH
3
CH
2
CH
2
Br
KOH, H
2
O
CuO
X
Y
związek X
związek Y
A
CH
3
CHCH
2
CH
3
CCH
B
CH
3
CHCH
2
CH
3
CH
2
CHO
C
CH
3
CH
2
CH
2
OH CH
3
CCH
D
CH
3
CH
2
CH
2
OH CH
3
CH
2
CHO
94 Który z poniższych związków heterocyklicznych stanowi element struktury barwnika liści, chlorofilu:
A tiofen
B pirol
C furan
D pirydyna
95 Enzym lipaza może rozkładać następujący typ wiązania:
C O C
C
O
N
C
O
O C
C N C
A
B
C
D
96 Laktam o poniższym wzorze jest produktem wewnątrzcząsteczkowej kondensacji:
C
H
2
C
H
2
CH
2
NH
C
O
A kwasu 2-aminobutanowego
B kwasu 4-aminobutanowego
C kwasu 3-aminopropanowego
D kwasu aminooctowego
97
C
C
C
O
C
C
CH
2
OH
H
H
H
OH
OH
H
H
OH
C
C
C
O
C
C
CH
2
OH
H
H
O
H
H
OH
OH
H
O
H
Które ze zdań opisujących właściwości podanego cukru jest
prawdziwe:
A dwucukier składa się z jednego rodzaju monosacharydów
B reszty cukrowe połączone są wiązaniem
β-1,4-glikozydowym
C dwucukier ten pozbawiony jest właściwości redukujących
D pierścienie reszt monosacharydowych określa się jako furanozowe
98 Związek wielkocząsteczkowy, którego budowę łańcucha można zapisać:
H
O CH
2
OH
n
powstał w wyniku:
A polimeryzacji metanalu
B polikondensacji metanolu
C polikondensacji etanalu
D izomeryzacji metanolu
99 Ester izopropylowy pewnego kwasu monokarboksylowego ma masę molową równą 164g/mol. Kwas
tworzący ten ester to:
A kwas szczawiowy
B kwas masłowy
C kwas octowy
D kwas benzoesowy
100 Spośród podanych poniżej w białkach nie występuje
CH
2
OH
CH
NH
2
COOH
CH
2
SH
CH
NH
2
COOH
CH
3
CH
NH
2
CH
2
COOH
CH
3
CH
NH
2
COOH
A
B
C
D
- 17 -
ODPOWIEDZI
1
Odp. C
Zarówno chlor jak i siarka leżą w III okresie i przyjmą odpowiednią ilość elektronów by uzyskać
konfigurację argonu. Magnez również leży w III okresie, ale najbliższym gazem szlachetnym którego
konfigurację przyjmie jon Mg
2+
jest neon
2
Odp. A
Zapis ten informuje, że główna liczba kwantowa wynosi 2 a poboczna 1. Inaczej mówiąc na drugie
powłoce (2 poziomie energetycznym) 3 elektrony zajmują orbital p (3 elektrony znajdują się na
podpoziomie p)
3
Odp. D
Bar leży w VI okresie i 2 grupie. Jon Ba
2+
przyjmuje konfigurację Xe (ksenonu). Takiej konfiguracji nie
może przyjąć brom (IV okres), rubid (V okres), selen (IV okres). Może ją przyjąć tellur (V okres),
któremu brakuje tylko dwóch elektronów do konfiguracji ksenonu. Uzyska ją więc jon Te
2-
.
4
Odp. B
Wiązanie
σ powstaje poprzez czołowe pokrywanie się orbitali atomowych. Nie może powstać poprzez
boczne pokrywanie się orbitali (B)
5
Odp. D
Hybrydyzacji sp nie mogą ulec atomy wodoru. Atom w hybrydyzacji sp posiada dwa wiązania
σ lub
jedno wiązanie
σ i wolną parę elektronową. Warunek ten spełnia napewno cząsteczka azotu N
2
.
Jednakże jeżeli dla tlenku węgla napiszemy strukturę elektronową Lewisa (każdy atom musi mieć oktet
elektronowy) to zobaczymy, że i w tej cząsteczce wszystkie atomy są w hybrydyzacji sp:
C O
-
+
C
O
.
.
. .
.
..
.
.
.
=
:
:
Struktura taka choć poprawna ponieważ tłumaczy zachowanie się tlenku węgla, wykracza jednak poza
materiał szkoły średniej.
6
Odp. A
Powinowactwo elektronowe to chęć przyłączenia elektronu do atomu. Pierwiastek wykazujący duże
powinowactwo elektronowe jest jednocześnie silnie elektroujemny. Podczas przyłączenia elektronu do
takiego pierwiastka wydziela się znaczna ilość energii.
7
Odp. C
W krysztale chlorku sodu jony ułożone są naprzemiennie :
-
+
-
-
-
+
+
A
B
C
D

- 18 -
8
Odp. A
• 120 lat to 4 okresy połowicznego rozpadu, czyli masa próbki zmniejszy się 2
4
=16 razy. Jeżeli na
początku było 10g izotopu, to po 120 latach pozostanie 10/16=0,625g.
• Można skorzystać z zależności ln(C
0
/C)=kt oraz ln2=k
τ by wiliczyć stałą rozpadu k, a następnie
C. k=0,0231lat
-1
, oraz ln10g – lnC=k
τ, lnC=-0,469, oraz C=0,626g
9
Odp. A
Korzystając z prawa zachowania masy otrzymamy: Z: 4+2=Z+0; Z=6
A: 9+4=A+1; A=12
Z kolejnej przemiany: Z: 7+0=Z+1; Z=6 E: 14+1=A+3; A=12. Pierwiastkiem E jest
12
C.
10
Odp. B
Reakcja endotermiczna to reakcja w której entalpia produktów jest większa od entalpii substratów
(
ΔH>O rys. 2). Natomiast energią aktywacji nazywamy energię jaką należy dostarczyć substratom by
reakcja mogła przebiegać. Jest to zawsze max na wykresie energetycznym.
11
Odp. D
Entropie obliczamy ze wzoru
T
ΔH
ΔS
=
.
Podczas ogrzewania mieszaniny gazów dostarczamy jej energii na sposób ciepła, entalpia układu
wzrasta (
ΔH>0), dlatego entropia również wzrośnie.
Sprężanie gazów (podwyższanie ciśnienia) powoduje, że układ rozgrzewa się. Wydzielana jest energia
na sposób ciepła. Entalpia układu maleje, dlatego entropia również maleje.
12
Odp. B
Przy rozwiązywaniu tego problemu skorzystajmy z prawa Daltona. Dysponujemy 4+2+8+6=20 moli
gazów, które w warunkach normalnych zajmą objętość 448dm
3
i ważą 4
.
28+2
.
44+8
.
2+6
.
28=384g.
Gazy niepalne (azot i dwutlenek węgla) – 8moli zajmie objętość 179,2 dm
3
, czyli:
w 448dm
3
znajduje się 179,2 dm
3
gazów niepalnych co można zapisać:
w 384g mieszaniny znajduje się 179,2dm
3
gazów niepalnych, to
w x g mieszaniny znajduje się 80dm
3
gazów niepalnych
x=171,4g
13
Odp. A
Warunki standardowe to 298K. Podniesienie temperatury reakcji do 308K to wzrost temperatury o 10
o
,
czyli szybkość reakcji wzrośnie dwukrotnie. Zwiększenie stężenia wodoru dwukrotnie powoduje również
dwukrotny wzrost szybkości reakcji: v=k[NO]
2
[H
2
]; v
1
=k[NO]
2
2[H
2
]; v
1
/v=2. W sumie szybkość reakcji
wzrośnie czterokrotnie.
14
Odp. D
Gęstość d=m/V. Wiadomo, że każdy mol gazu w warunkach normalnych zajmuje objętość 22,4dm
3
(d=M/V
0
).
azot: d=28/22,4=1,25g/dm
3
argon: d=40/22,4=1,786g/dm
3
tlenek węgla: d=28/22,4=1,25g/dm
3
Wyszukiwarka
Podobne podstrony:
Testy z chemii cz 3
Testy z chemii cz 4
Testy z chemii cz 1
TESTY FUNKCONALNE cz 2
Testy nieparametryczne cz I medycyna praktyczna
Testy z Lepu I cz.5, VI rok, VI rok, Pediatria, Pediatria, PEDIATRIA OLA, Egzamin, Pisemny, Testy
Biofizyka testy semII cz 3
Testy z chemii tom 1
Testy z chemii
08 Testy 343 [01] 0X 081 Arkusz Egzaminacyjny Etap Pisemny Stycze%c5%84 2008 Odpowiedzi Cz%c4%9
23 Testy 343 [01] 0X 102 Arkusz Egzaminacyjny Etap Pisemny Czerwiec 2010 Odpowiedzi Cz%c4%99%c5
Zadania dla I roku Chemii przed drugim, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1,
więcej podobnych podstron