
1
Temat:
ŹRÓDŁA ENERGII ELEKTRYCZNEJ
(chemiczne źródła energii elektrycznej, źródła
energii prądu przemiennego)
2
Źródła energii elektrycznej:
1. Prądu przemiennego
• prądnice synchroniczne
2. Prądu stałego
• prądnice prądu stałego
• chemiczne źródła prądu (ogniwa pierwotne i wtórne)
• ogniwa paliwowe
• ogniwo fotowoltaiczne (fotoogniwa)
ŹRÓDŁA ENERGII ELEKTRYCZNEJ
ŹRÓDŁA ENERGII ELEKTRYCZNEJ
3
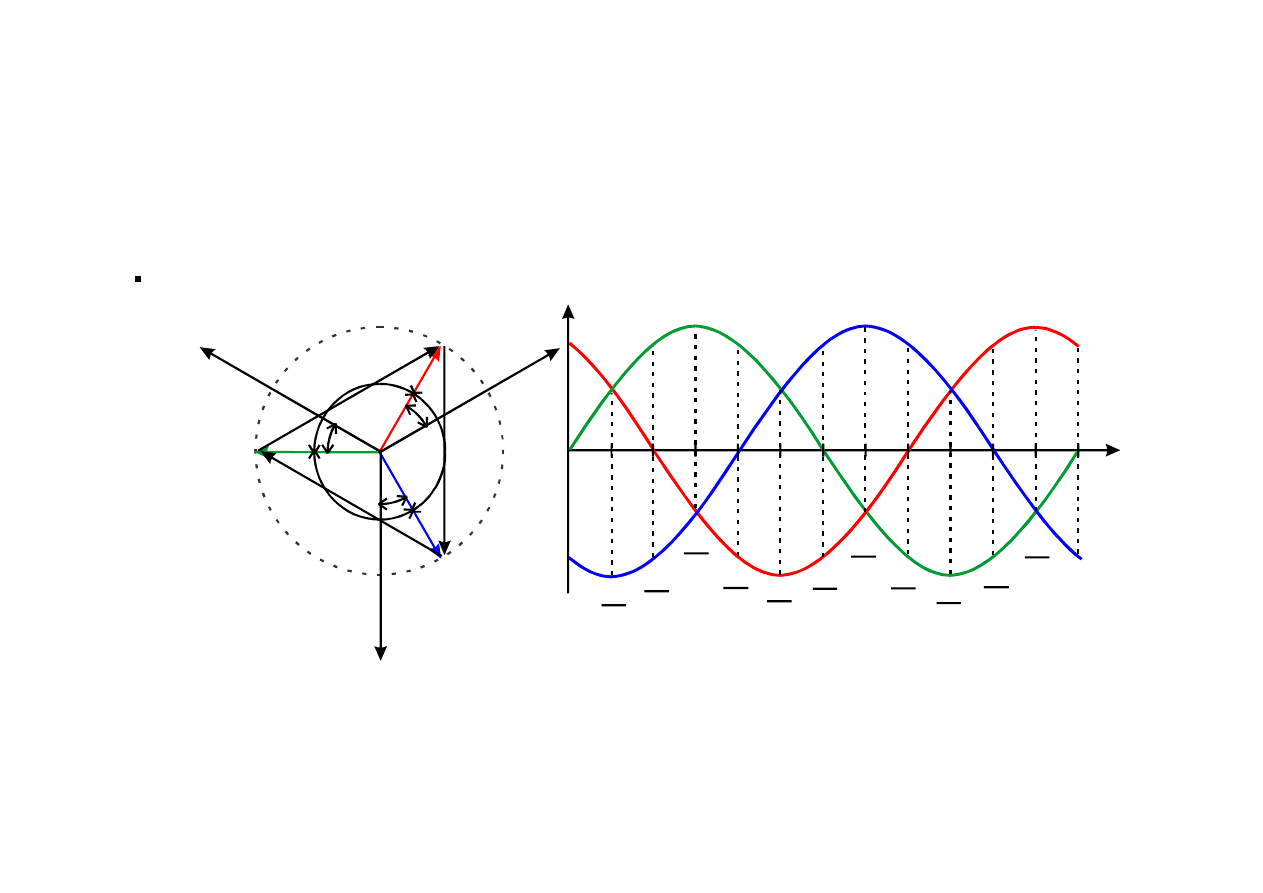
PARAMETRY SIECI PRADU PRZEMIENNEGO
PARAMETRY SIECI PRADU PRZEMIENNEGO
Sieć zasilająca przemysłowa oznaczona 3N ~ 50Hz 230/400V jest:
− trójfazowa symetryczna z przewodem neutralnym
− o napięciu fazowym U
f
= 230V,
− napięciu przewodowym U
p
= 400V,
−
oraz częstotliwości f=50 Hz.
Przebiegi napięć chwilowych w sieci trójfazowej
U
f
=U
w
=U
v
=U
u
= 230V
U
p
=U
u
-U
w
= U
v
-U
u
= U
w
-U
v
=400V
u
w
u
v
u
u
0
T
12
5T
12
11T
12
7T
12 8T
12 3T
4
T
6
5T
6
T
4 T
3
T
2
T
u
t
Uu
Uv
Uw
u
v
w
120 o
12
0 o
120
o
U u
-U w
U
w -U
v
U
v-U
u
u
v
w
4
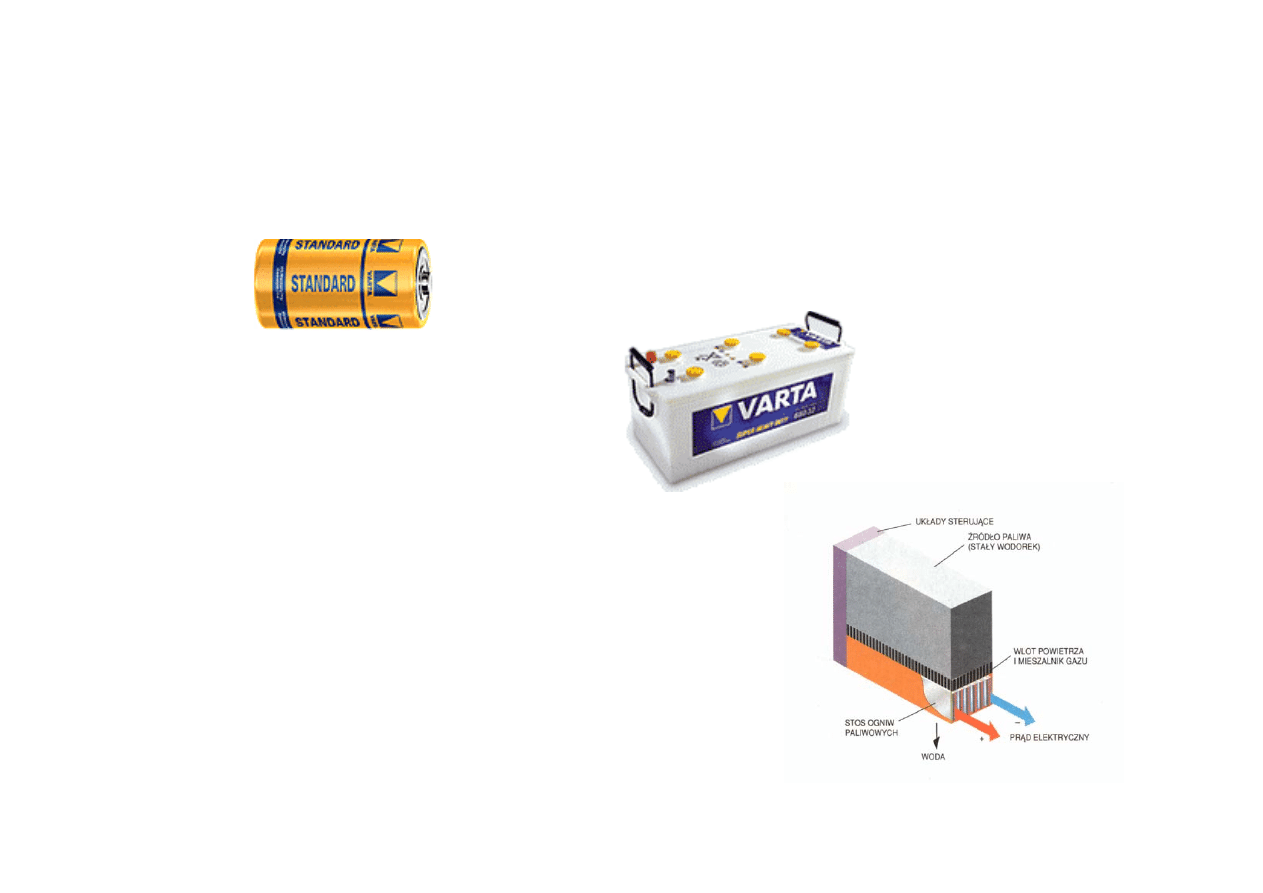
Ogniwa pierwotne
Ogniwa wtórne
(akumulatory
Ogniwo paliwowe
PODSTAWOWE SPOSOBY GROMADZENIA ENERGII
PODSTAWOWE SPOSOBY GROMADZENIA ENERGII

5
PARAMETRY OGNIW GALWANICZNYCH
PARAMETRY OGNIW GALWANICZNYCH
Parametry elektryczne
1.
Duża gęstość energii [Wh/l] i gęstość mocy [W/l]
2.
Niewielki ciężar
3.
Duży prąd wyładowania
4.
Niewielka oporność wewnętrzna
5.
Stabilność napięcia w czasie wyładowania
Parametry czasowe
6.
Długi czas życia
7.
Duża liczba cykli ładowanie/wyładowania
8.
Łatwe ładowanie
9.
Krótki czas ładowania
Parametry inne
10.
Mała zależność parametrów od temperatury
11.
Nie zanieczyszczanie środowiska
C
C
e
e
c
c
h
h
y
y
d
d
o
o
b
b
r
r
e
e
g
g
o
o
c
c
h
h
e
e
m
m
i
i
c
c
z
z
n
n
e
e
g
g
o
o
ź
ź
r
r
ó
ó
d
d
ł
ł
a
a
e
e
n
n
e
e
r
r
g
g
i
i
i
i
:
:

6
PODSTAWOWE POJĘCIA I PARAMETRY
PODSTAWOWE POJĘCIA I PARAMETRY
CHEMICZNYCH ŹRÓDEŁ PRĄDU
CHEMICZNYCH ŹRÓDEŁ PRĄDU
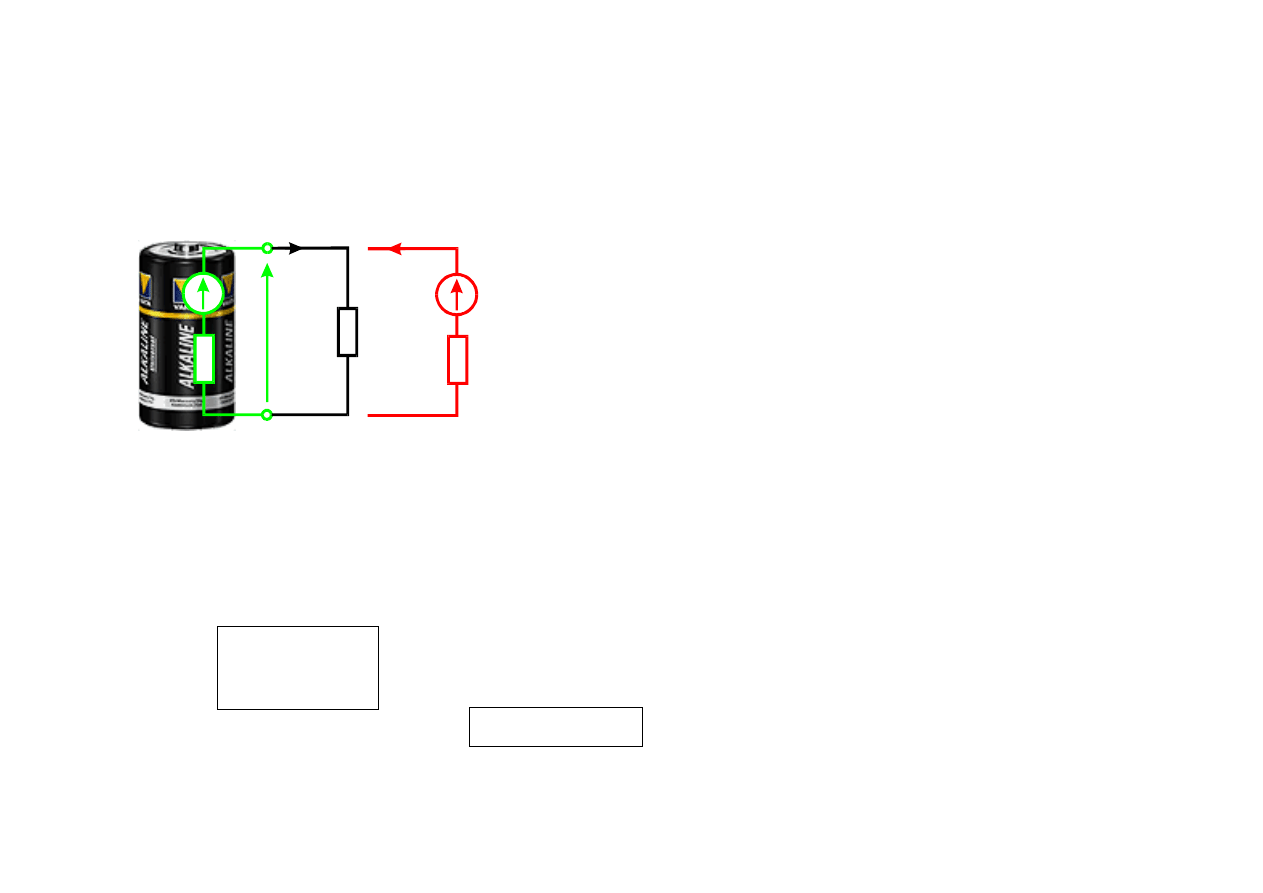
Schemat elektrochemiczny ogniwa
Elektroda dodatnia
Elektrolit
elektroda ujemna
Dysocjacja elektrolityczna
- proces samorzutnej jonizacji (rozpadu na jony)
wodnych roztworów kwasów, zasad i soli.
Elektrolit
- zdysocjowany roztwór dodatnio naładowanych cząstek
zwanych
kationami
i ujemnie
naładowanych zwanych
anionami.
Ogniwo galwaniczne
- to dwie elektrody z różnych metali o różnych
potencjałach normalnych (względem elektrody wodorowej)zanurzone w
elektrolicie
W wyniku reakcji chemicznej na elektrodzie dodatniej następuje redukcja
materiału elektrodo-wego, na elektrodzie ujemnej utlenianie oraz
wydzielanie wodoru (polaryzacja ogniwa).
Elektroliza
- Procesy towarzyszące zjawisku powstawania prądu w elektrolicie.
7
Napięcie źródłowe ogniwa
oblicza się z potencjałów elektrod
wyrażonych w postaci potencjałów
normalnych w stanie równowagi,
czyli dla nie obciążonego prądem
ogniwa z następującej zależności
0
2
E
0
1
E
E
−
=
gdzie: E [V] - napięcie źródłowe
ogniwa,
0
1
E
[V] - potencjał normalny
pierwszej elektrody,
0
2
E
[V] - potencjał normalny
drugiej elektrody
.
Potencjały normalne elektrod mierzone
względem normalnej elektrody wodorowej
Elektroda
Potencjał
normalny E
0
[V]
Lit
− 3,01
Cynk
− 0,76
Żelazo
− 0,44
Kadm
− 0,40
Ołów
− 0,23
Nikiel
− 0,126
Wodór
0,00
Miedź
+ 0,34
Srebro
+ 0,80
Dwutlenek ołowiu
+ 1,69
PODSTAWOWE POJĘCIA I PARAMETRY
PODSTAWOWE POJĘCIA I PARAMETRY
CHEMICZNYCH ŹRÓDEŁ PRĄDU
CHEMICZNYCH ŹRÓDEŁ PRĄDU
8
PODSTAWOWE POJĘCIA I PARAMETRY
PODSTAWOWE POJĘCIA I PARAMETRY
CHEMICZNYCH ŹRÓDEŁ PRĄDU
CHEMICZNYCH ŹRÓDEŁ PRĄDU
Napięcie źródłowe E (SEM) [V]
- różnica potencjałów elektrody dodatniej i ujemnej baterii
mierzona w stanie jałowym (bez obciążenia)
Napięcie U [V]
- różnica potencjałów między elektrodami mierzona przy zamkniętym
obwodzie zewnętrznym (przy obciążeniu)
Napięcie końcowe wyładowania
[V]
-wartość napięcia (pod obciążeniem), po osiągnięciu
której wyładowanie uważa się za zakończone.
Rezystancja wewnętrzna R
w
[
Ω]
- jest to suma rezystancji elektrod, styku elektrod z
elektrolitem, elektrolitu i separatorów.
Ogniwo galwaniczne pierwotne (bateria)
– nieodwracalny przetwornik energii
chemicznej w energię elektryczną. Przy
rozładowaniu ogniwa następuje zużycie
materiałów z których wykonane jest
ogniwo.
Ogniwo galwaniczne wtórne (akumulator)
–
odwracalny przetwornik energii chemicznej w
energię elektryczną. Po wyczerpaniu energii
ogniwa (rozładowaniu) można ponownie
„napełnić” ogniwo (naładować) przez
przepuszczenie prądu w przeciwnym
kierunku.
Bateria
– kilka ogniw połączonych
szeregowo lub równolegle
2
1
2
1
w
I
I
U
U
R
−
−
=
Gdzie: U
1
napięcie przy prądzie obciążenia I
1
U
2
napięcie przy prądzie obciążenia I
2
9
PODSTAWOWE POJĘCIA I PARAMETRY
PODSTAWOWE POJĘCIA I PARAMETRY
CHEMICZNYCH ŹRÓDEŁ PRĄDU
CHEMICZNYCH ŹRÓDEŁ PRĄDU
Schemat zastępczy ogniwa
wyładowanie
U= E
1
− I
wył
R
w1
ładowanie
U= E
1
+ I
ład
R
w1
Pojemność znamionowa elektryczna Q
el zn
; (C) [Ah]
- ilość elektryczności którą źródło oddaje
w czasie wyładowania w warunkach znamionowych określonych przez producenta ( prąd
wyładowania, temperatura otoczenia, napięcie końcowe wyładowania). Pojemność
najczęściej określana jest dla wyładowania prądem 5-cio, 10-cio lub 20-to godzinnym w
temperaturze pokojowej.
∫
=
wył
T
0
wył
el
dt
i
Q
T
wył
–czas wyładowania,
i
wył
– prąd wyładowania
jeżeli i
wył
= I
wył
= const to
wył
wył
el
T
I
Q
⋅
=
Iwył
Iład
R
Rw1
E2
E1
U
Rw2
og
ni
w
o
10
PODSTAWOWE POJĘCIA I PARAMETRY
PODSTAWOWE POJĘCIA I PARAMETRY
CHEMICZNYCH ŹRÓDEŁ PRĄDU
CHEMICZNYCH ŹRÓDEŁ PRĄDU
Sprawność elektryczna
η
el
– jest to stosunek ilości elektryczności otrzymanej z ogniwa w
czasie rozładowania do ilości elektryczności dostarczonej w czasie ładowania
ład
el
wył
el
el
Q
Q
=
η
Q
el wył
– ładunek otrzymany w czasie rozładowania
Q
el ład
– ładunek dostarczony w czasie ładowania
Samowyładowanie
ρ [%]
– określa procentowy ubytek pojemności ogniwa w ciągu
pewnego okresu czasu
%
100
Q
q
q
zn
el
T
0
⋅
−
=
ρ
q
0
- pojemność na początku
q
T
- pojemność po czasie T
11
1. Ogniwo cynkowo-chlorkowe (Leclanche, ~1866r)
2. Ogniwo rtęciowe (Rubena-Mallory’ego, ~1940)
3. Ogniwo alkaliczne manganowe
4. Ogniwo srebrowe-cynkowe (Andre, ~1930)
5. Ogniwo cynkowo-powietrzne
6. Ogniwo litowe ~1976r
1.
Akumulator kwasowo-ołowiowy (Pb) -
Gaston Plante, 1859 r
2.
Akumulator niklowo-kadmowy (NiCd)- W. Junger, 1895 r
3.
Akumulator srebrowo-cynkowy (AgZn)
4.
Akumulator niklowo-wodorkowy (NiMH) ~1990 r
5.
Akumulator litowy (Li) - Sanyo, ~1989 r
6.
Akumulator alkaliczne manganowe MnO
2
7.
Akumulator litowo-jonowy (Li-Ion)- Sony, ~1991 r
8.
Akumulator litowo-polimerowy (Li-Polymer)- 1999 r
9.
Akumulator wanadowy
10.
Akumulator polimerowy
RODZAJE OGNIW GALWANICZNYCH
RODZAJE OGNIW GALWANICZNYCH
PIERWOTN
PIERWOTNE
WTÓRNE
WTÓRNE
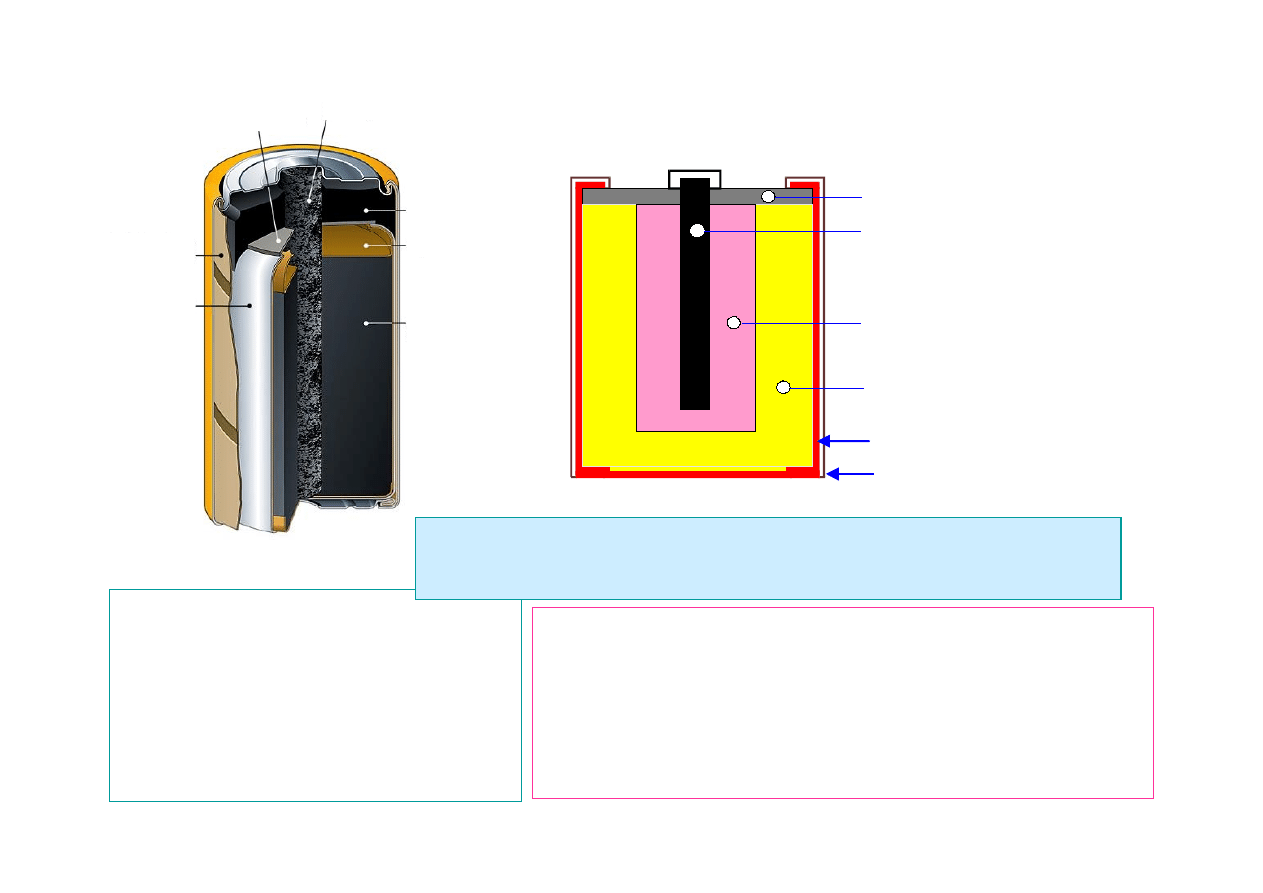
12
Dwutlenek
manganu
MnO2
Uszczelka
Cynkowe
kubek
Izolująca
tuleja
Pręt
węglowy
Tekturowy
krążek
Tworzywo
bitumiczne
OGNIWO LECLANCHE
OGNIWO LECLANCHE
ZnCl
ZnCl
(cynkowo-chlorkowe)
(cynkowo-chlorkowe)
(~1866 r)
Zalety: tanie ponieważ zbudowane jest z łatwo
dostępnych materiałów
Wady: nieprzyjazne środowisku, duża zmiana
napięcia wyładowania (szczególnie w temp.
ujemnych), krótki czas pracy
El. dodatnia
– MnO
2
(brausztyn)
El. ujemna
− Zn (cynk)
Elektrolit
−NH
4
Cl (salmiak)
Napięcie
−1,5V
Reakcja chemiczna
Zn + 2NH
4
Cl
→
ZnCl
2
+ H
2
+ 2NH
3
(amoniak)
MnO
2
+ H
2
→
MnO + H
2
O
Izolacja
Pręt węglowy
Elektroda dodatnia i
depolaryzator
(ditlenek manganu)
MnO2
Elktrolit NH4CL
(chlorek amonu, salmiak)
Elektroda ujemna Zn
Obudowa (stal)
(+)
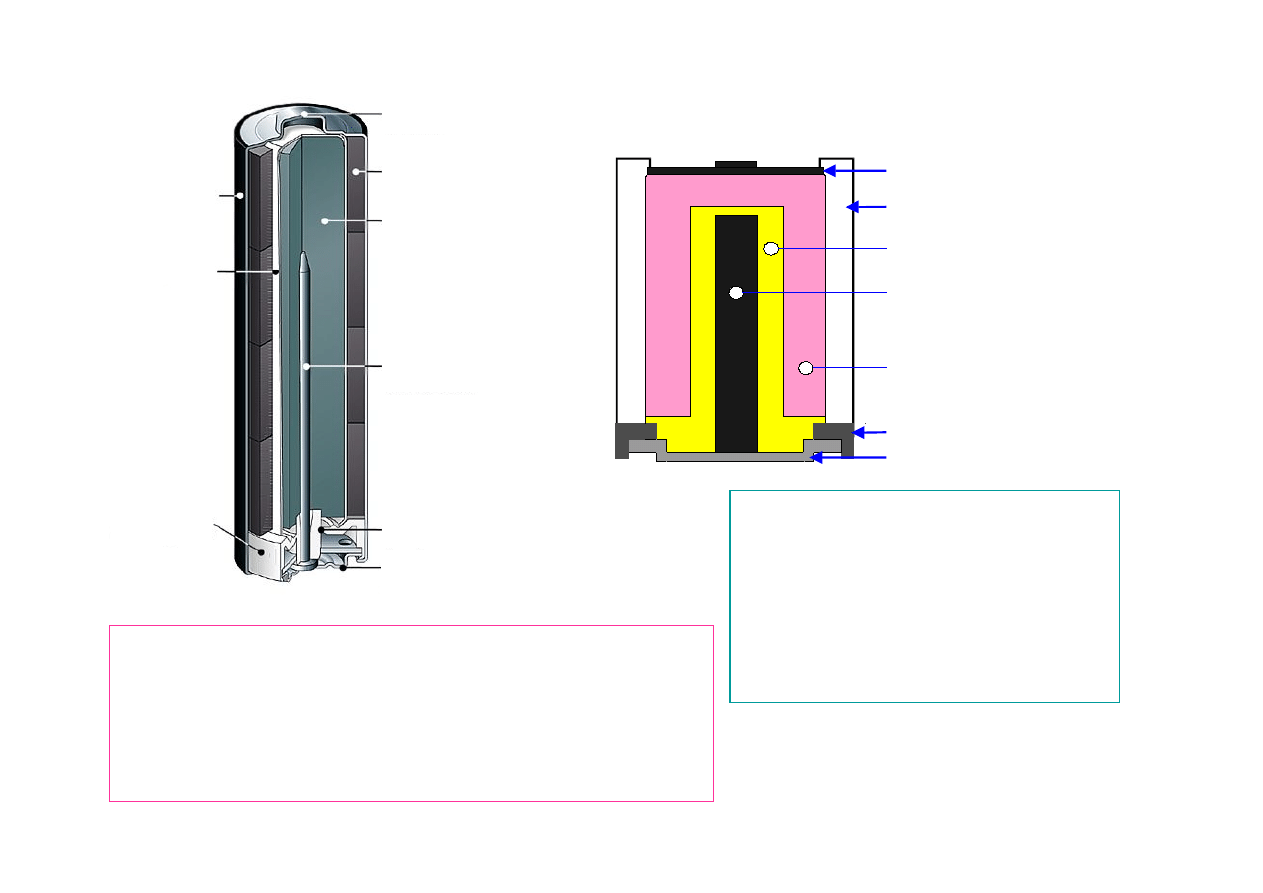
13
Dwutlenek manganu
MnO2
Obudowa(stal)
(+)
Elektrolit KOH
Biegun dodatni
Biegun ujemny
Izolacja
Katoda Zn
OGNIWO ALKALICZNE ZnMnO
OGNIWO ALKALICZNE ZnMnO
2
2
Zalety: przyjazne środowisku, nie wylewa się,
mają dłuższy czas pracy i wytrzymują
większy pobór prądu niż węglowe,
Wady: droższe od ogniwa węglowego
El. dodatnia
– MnO
2
El. ujemna
−Zn
Elektrolit
−KOH (wodo -
rotlenek potasu)
Napięcie
−1,5V
Anoda dwutlenek
manganu MnO2
Separator
Stalowy
kubek
Biegun
dodatni
Biegun
ujemny
Zawór
bezpieczeństwa
Katoda
Cynkowo-
żelowa (KOH)
Szpilka-
odprowadzenie
prądu
Plastykowa
uszczelka
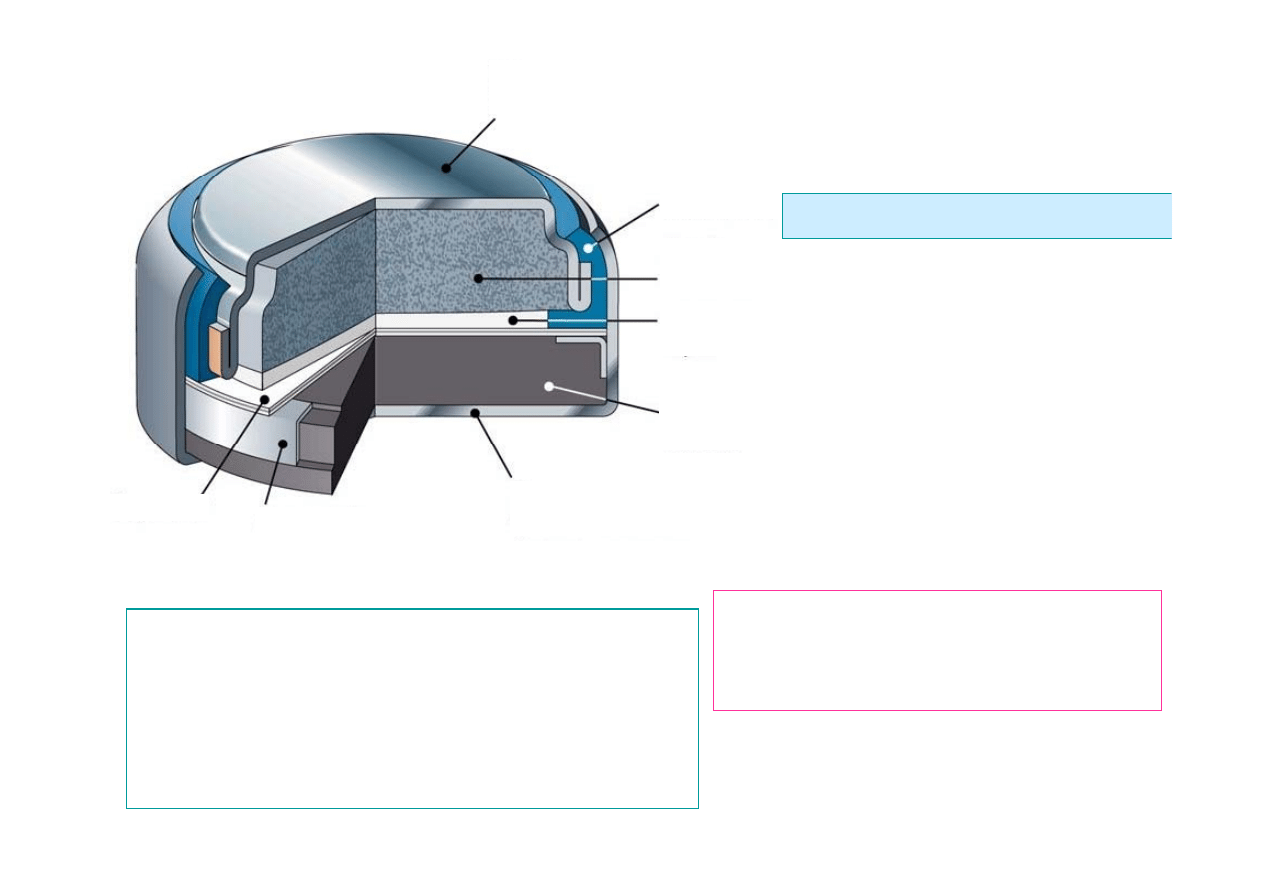
14
Biegun
ujemny
Biegun
dodatni
Separator
Pierścień wzmacniający
Plastykowa
uszczelka
Katoda Zn
sproszkowany
Anoda
tlenek metalu
Warstwa absorpcyjna
z elektrolitem KOH
OGNIWO SREBROWE
OGNIWO SREBROWE
AgZn
AgZn
El. dodatnia
− AgO tlenek srebra
El. ujemna
− Zn metaliczny lub
sproszkowany
Elektrolit
−(20 ÷ 40)% roztwór KOH
Napięcie
− 1,55 V
Zn + AgO
→ ZnO + Ag
Sumaryczna reakcja chemiczna
Zalety: stałe napięcie wyładowania
Wady: drogie
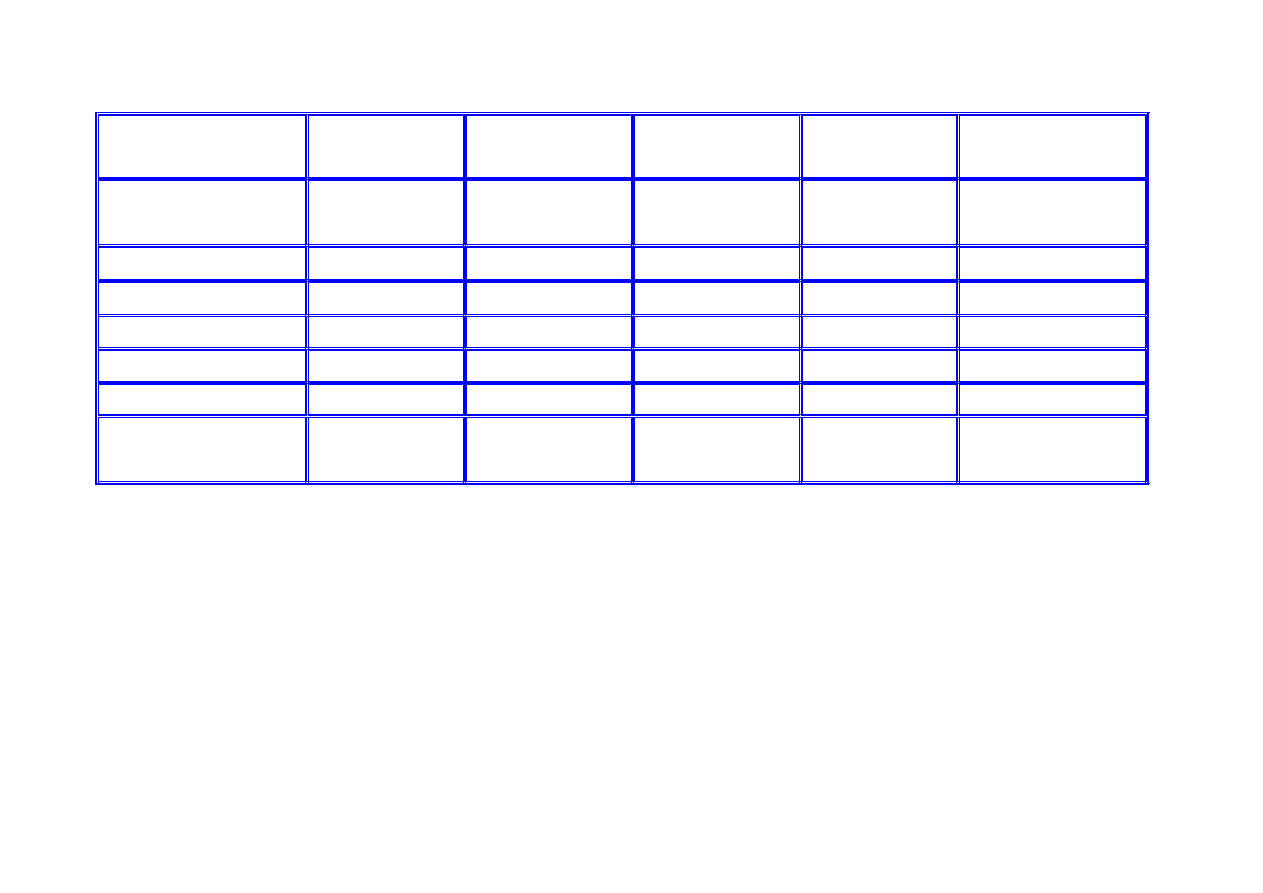
15
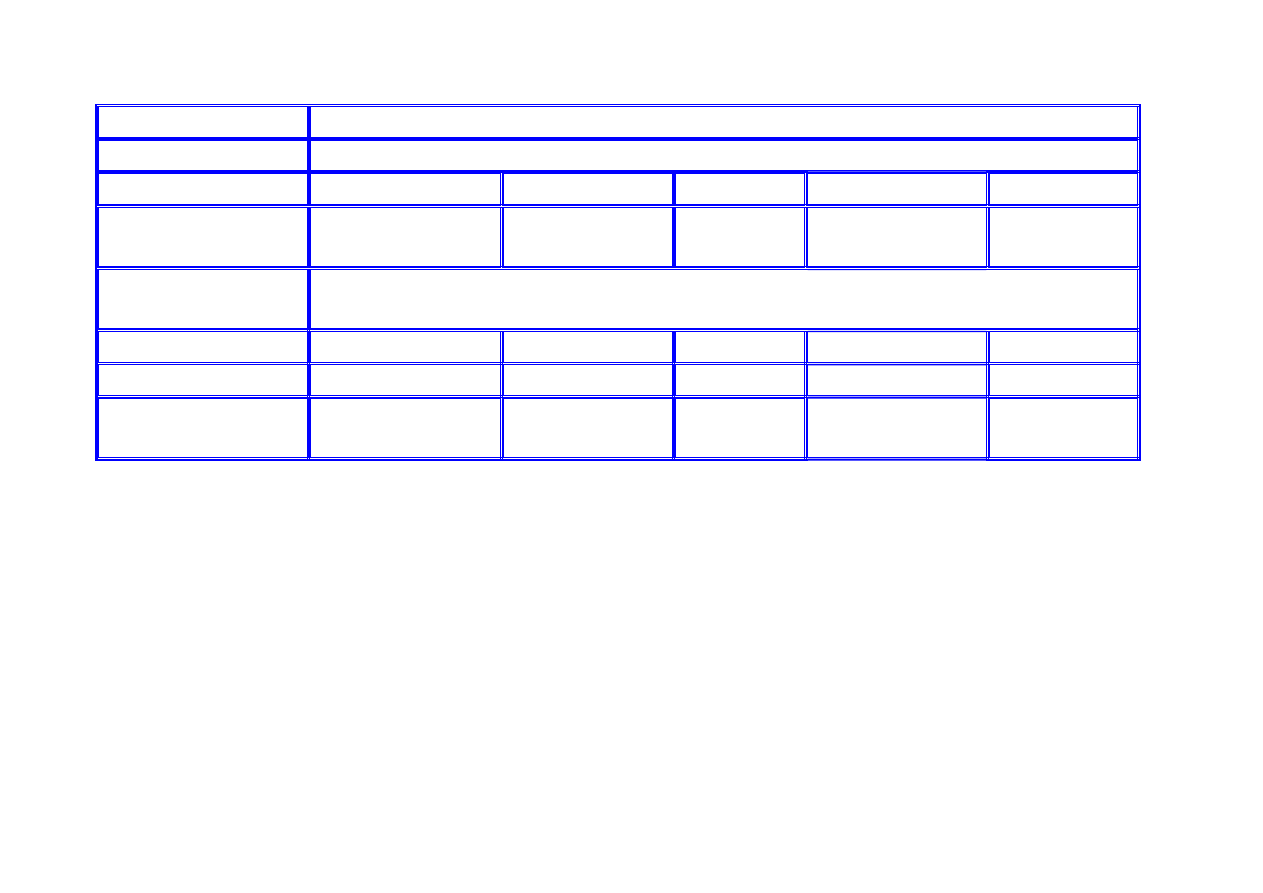
Rodzaj ogniwa
Cynkowo-
węglowe
Rtęciowe Manganowe
alkaliczne
Srebrowo-
cynkowe
Cynkowo-
powietrzne
Elektrolit NH
4
Cl
(35 ÷ 45)%
roztwór KOH
roztwór KOH (20 ÷ 40)%
roztwór KOH
KOH
Temp. pracy [°C]
−20÷55
−30÷70
−20 ÷+60
Elektroda dodatnia
MnO
2
HgO MnO
2
AgO
O
2
Elektroda ujemna
Zn
Zn
ZnO Zn Zn
Nap. znam. [V]
1,50
1,35-1,4
1,50
1,55
1,40
końc. nap. rozł[V] 0,8
0,9
0,8
0,9
1,0
Energia właściwa
(teoret.) [Wh/kg]
40÷70
80÷120
80÷100 130÷150
180÷250
PORÓWNANIE OGNIW PIERWOTNYCH
PORÓWNANIE OGNIW PIERWOTNYCH
16
Rodzaj ogniwa
Litowe alkaliczne
Elektrolit
zasadowy organiczny bądź nieorganiczny
Temp. Pracy [°C]
−20÷65
−40÷85
−35÷60
−40÷ 85
Elektroda dodatnia
Dwutlenek
manganu (MnO
2
)
Chlorek tionylu
(SOCl
2
)
Dwutlenek
siarki (SO
2
)
Polimonofluoro
węgiel (CF)
x
Jod (I
2
)
Elektroda ujemna Li - (metaliczny lit niesiony na cienką folię niklową) lub Li/Al.- stop litu z
aluminium lub Lit interkalowany w graficie (skupiska atomów litu w graficie)
Nap. znam. [V]
2,8
3,4
2,7
2,5
~3,6
Końc. nap. rozł.[V] 1,5
Energia właściwa
(teoret.) [Wh/kg]
(265÷420)
330 260 270
PORÓWNANIE OGNIW PIERWOTNYCH
PORÓWNANIE OGNIW PIERWOTNYCH
17
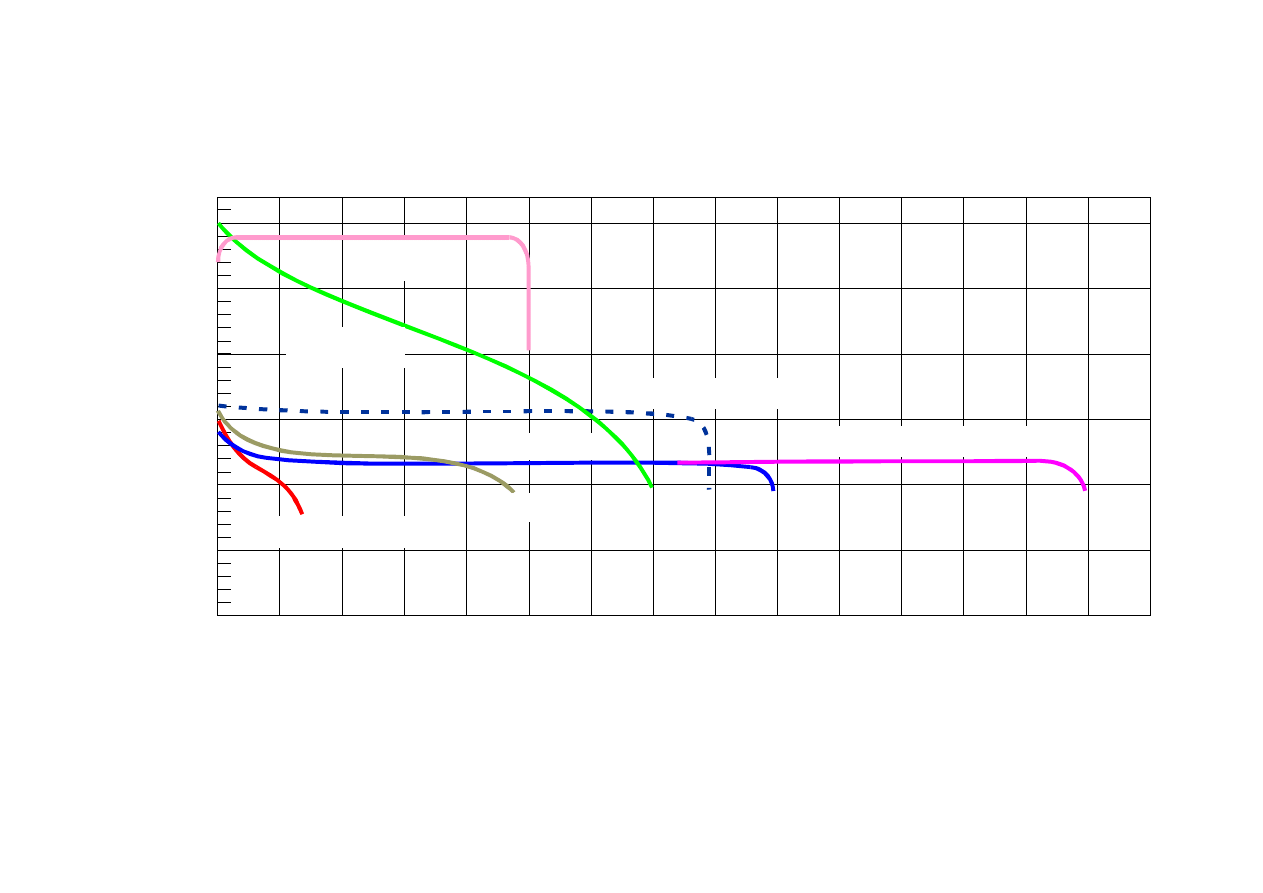
20
40
60
80
100
120
140
0
0
0,5
1,0
2,0
2,5
3.0
1,5
Nap
ię
ci
e og
niw
a
[V
]
Czas pracy (przy średnim obciążeniu)[h]
cynkowo-węglowe
alkaliczne
rtęciowe
tlenkowo-srebrowe
cynkowo-powietrzne
Lit-SO2
Lit-MnO2
CHARAKTERYSTYKI WYŁADOWANIA WYBRANYCH
CHARAKTERYSTYKI WYŁADOWANIA WYBRANYCH
OGNIW PIERWOTNYCH
OGNIW PIERWOTNYCH

18
bateria litowa(Li)
typu guzikowego
manganowa(ZnCl)
manganowa(ZnCl)
alkaliczna
srebrowa(AgO)
0
100
200
200
400
600
800
300
na objętość [Wh/l]
na mas
ę [
W
h/kg]
Gęstość energii
19
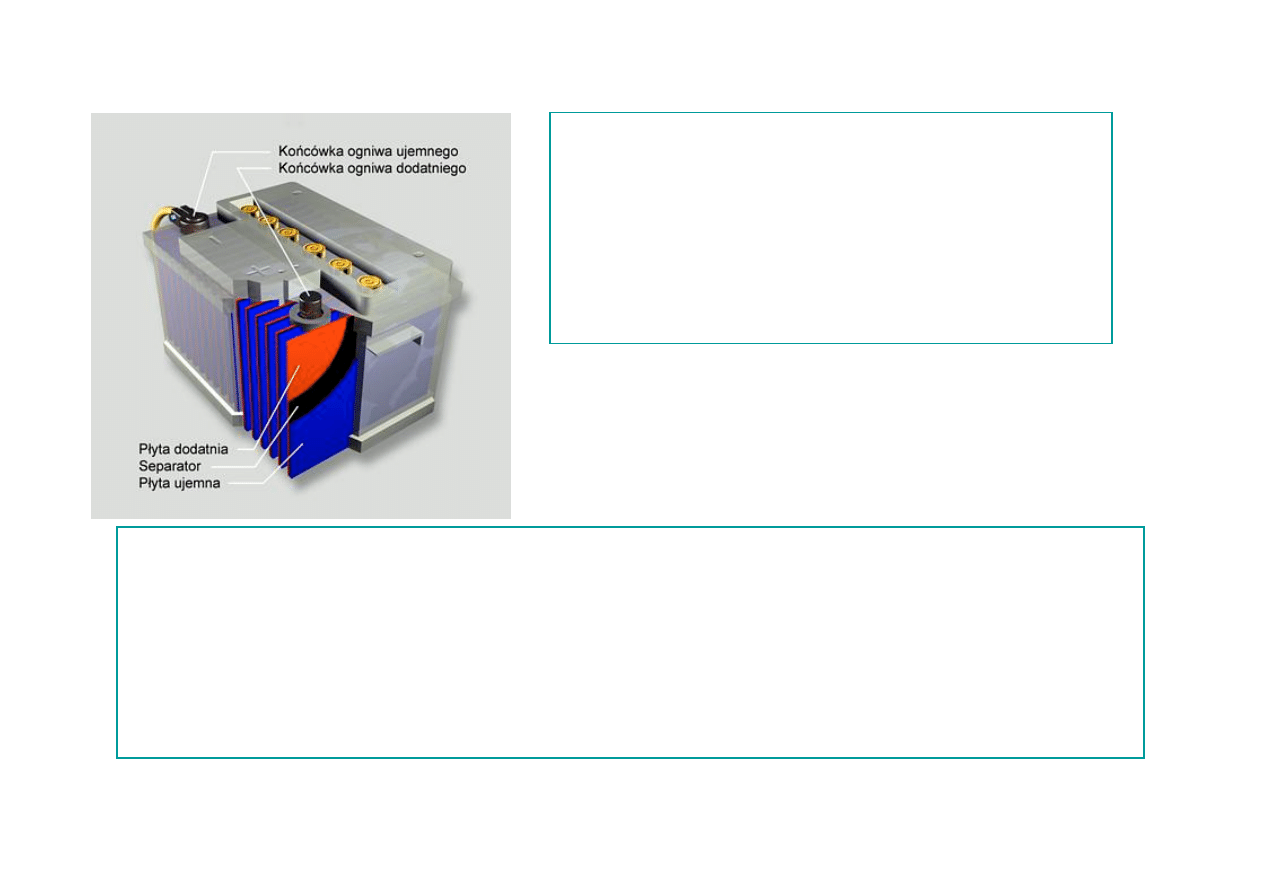
AKUMULATOR KWASOWO-OŁOWIOWY (TYPOWY)
AKUMULATOR KWASOWO-OŁOWIOWY (TYPOWY)
Elektroda dodatnia
−PbO
2
Elektroda ujemna
−Pb
Elektrolit
−roztwór wodny
H
2
SO
4
Napięcie
−2,0 V
Zalety: najniższy w stosunku do innych akumulatorów koszt jednej Ah pobieranego
prądu, duża odporność na skrajne warunki zewnętrzne, akumulator ołowiowy
jest zdecydowanie najlepszy jako źródło zasilania rozrusznika
samochodowego, lub źródło mocy rezerwowej, tania i prosta produkcja, proste
ładowanie, możliwość rozładowania dużymi prądami w krótkim czasie,
Wady: Nieprzyjazny dla środowiska (kwas), duży ciężar (ołów) w stosunku do
pojemności,
20
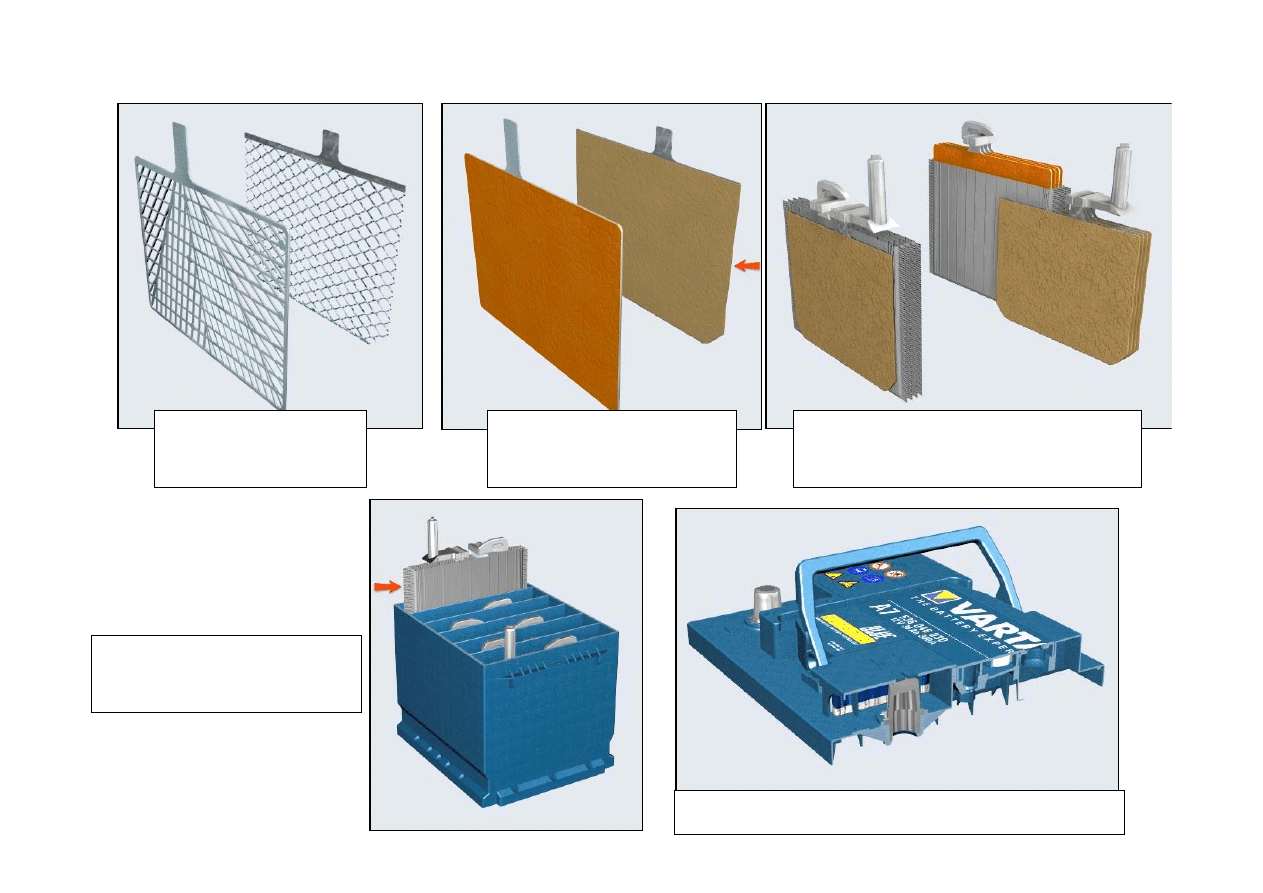
BUDOWA AKUMULATORA OŁOWIOWEGO
BUDOWA AKUMULATORA OŁOWIOWEGO
Szkielet elektrod
z antymonu
Elektrody ołowiowe
(spiekane)
Zespół elektrod pojedynczego
ogniwa
Górna pokrywa baterii akumulatorowej
Obudowa akumulatora
na 6 ogniw
21
AKUMULATOR KWASOWO-OŁOWIOWY
AKUMULATOR KWASOWO-OŁOWIOWY
PbO2 + 2H2SO4+Pb
PbSO4 + 2H2O+ PbSO4
Pb
O O
H
H
H
H
Pb
SO
4
SO
4
O
H
H
H
H
O
G
O
H
H
H
O
a
b
H
H
H
H
O
O
Pb
Pb
Pb
Pb
Pb
Pb
c
d
Pb
Pb
Pb
Pb
O
O
O
O
SO
4
SO
4
SO
4
SO
4
SO
4
SO
4
SO
4
SO
4
SO
4
SO
4
H
22
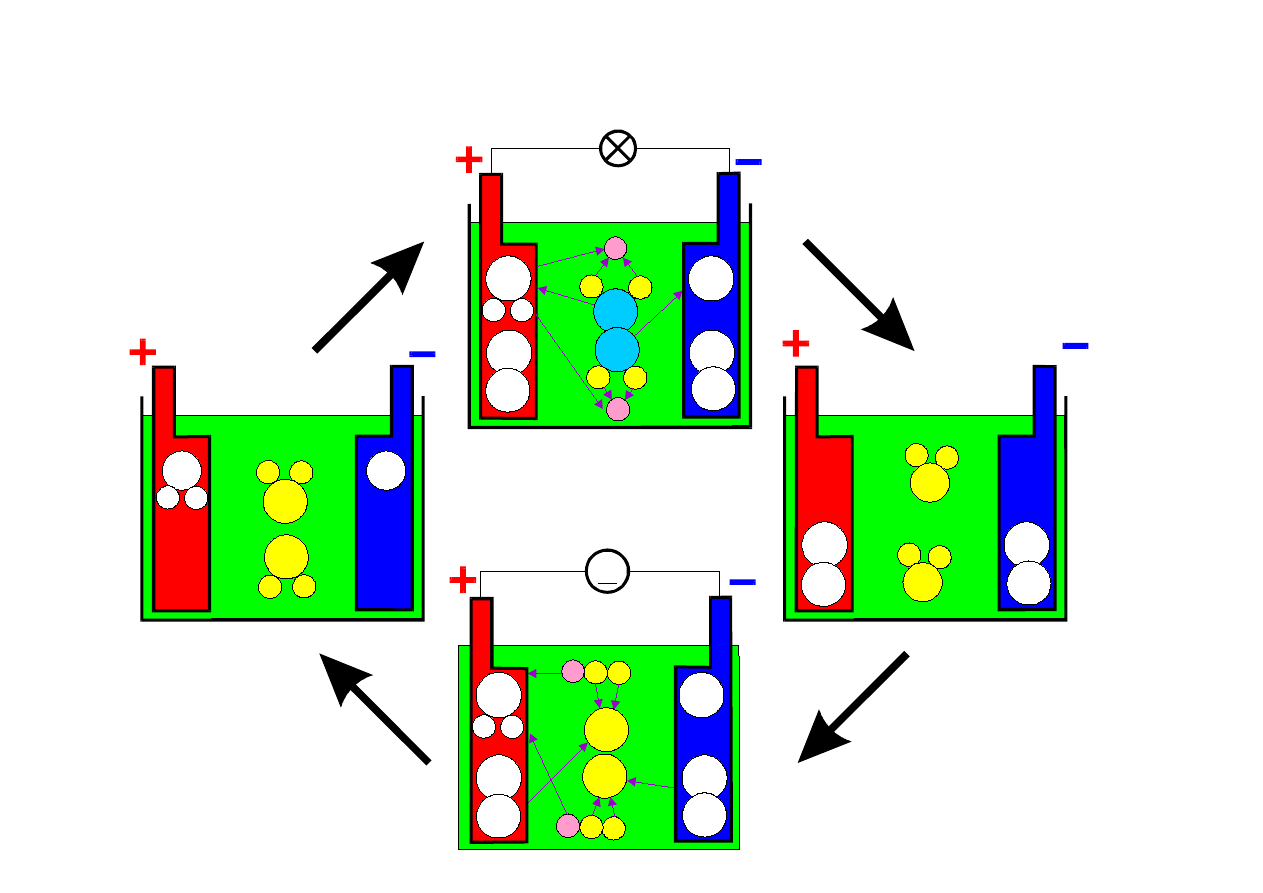
AKUMULATOR KWASOWO-OŁOWIOWY
AKUMULATOR KWASOWO-OŁOWIOWY
elektroda kwas elektroda elektroda woda elektroda
dodatnia ujemna WYŁADOWANIE dodatnia ujemna
PbO2 + 2H2SO4 + Pb PbSO4 + 2H2O + PbSO4
ŁADOWANIE
Charakterystyki ładowania
akumulatora kwasowego
napięcie
akumulatora
prąd
ładowania
czas ładowania
napięcie,
prąd
2,4V
0,1 C
1,89 V
tg
Nała-
dowany
Rozła-
dowany
Napięcie
[V]
2,1
1,89
Gęstość
Elektrolitu
[g/cm
3
]
1,28
1,05
tg -
czas rozpoczęcia gazowania elektrolitu (elektroliza wody), C- pojemność elektryczna akum.
Objawy zakończenia procesu ładowania:
• ustabilizowanie się prądu ładowania
• gazowanie elektrolitu
• ustalenie się gęstości elektrolitu
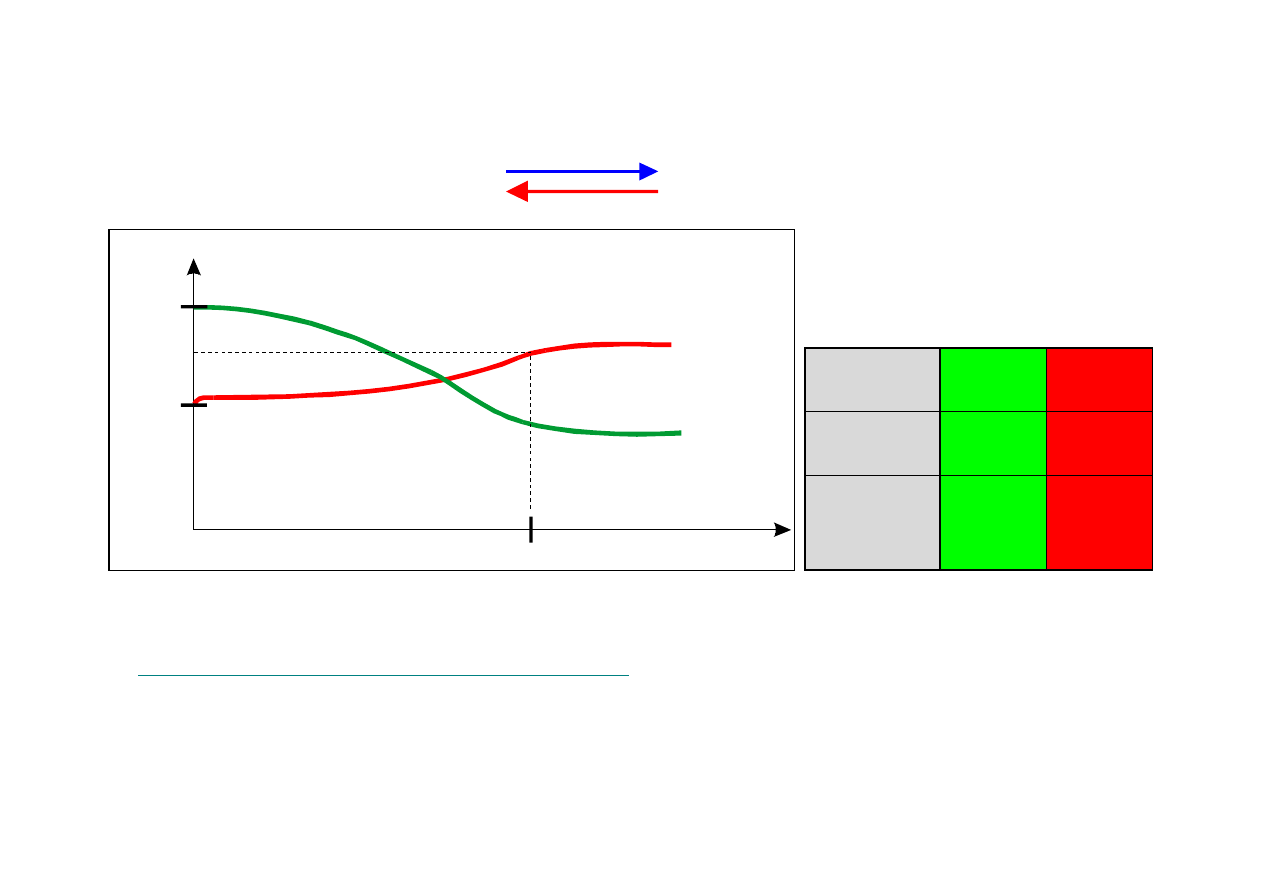
23
AKUMULATOR KWASOWO-OŁOWIOWY
AKUMULATOR KWASOWO-OŁOWIOWY
1
2
2
4
4
6
6
8
8
10
10
20
20
40 60
8
9
10
11
12
13
minuty
godziny
Napi
ęc
ie na
zac
is
kach
(d
la
ak
um
.
12V)
przy 25 C
O
2C
1C
0,6C
0,1C
0,05C
X
0,4C
3C
0,2C
Rys.1 Charakterystyki rozładowania akumulatora ołowiowego
w funkcji prądu i czasu rozładowania
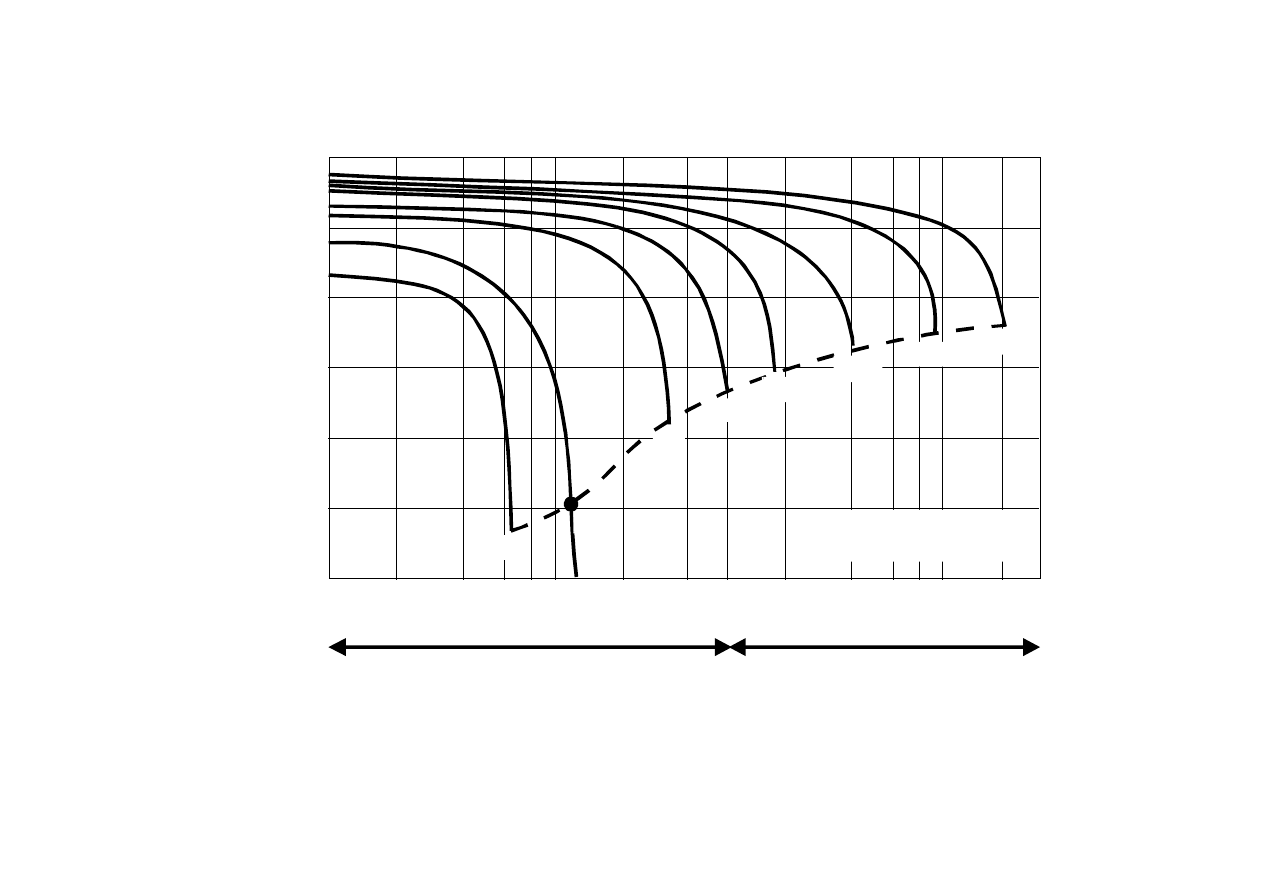
24
AKUMULATOR KWASOWO-OŁOWIOWY
AKUMULATOR KWASOWO-OŁOWIOWY
U
żyt
ec
zna p
oj
em
no
ść
ak
um
ul
at
or
a
[
/
]
O
O
2C
1C
0,1C
0,05C
3C
0,2C
-20
20
20
30
40
40
60
80
100
120
50
-10
10
0
0
Temperatura [ C]
O
Y
Rys. 2 Zależność pojemności od
temperatury
akumulatora ołowiowego
25
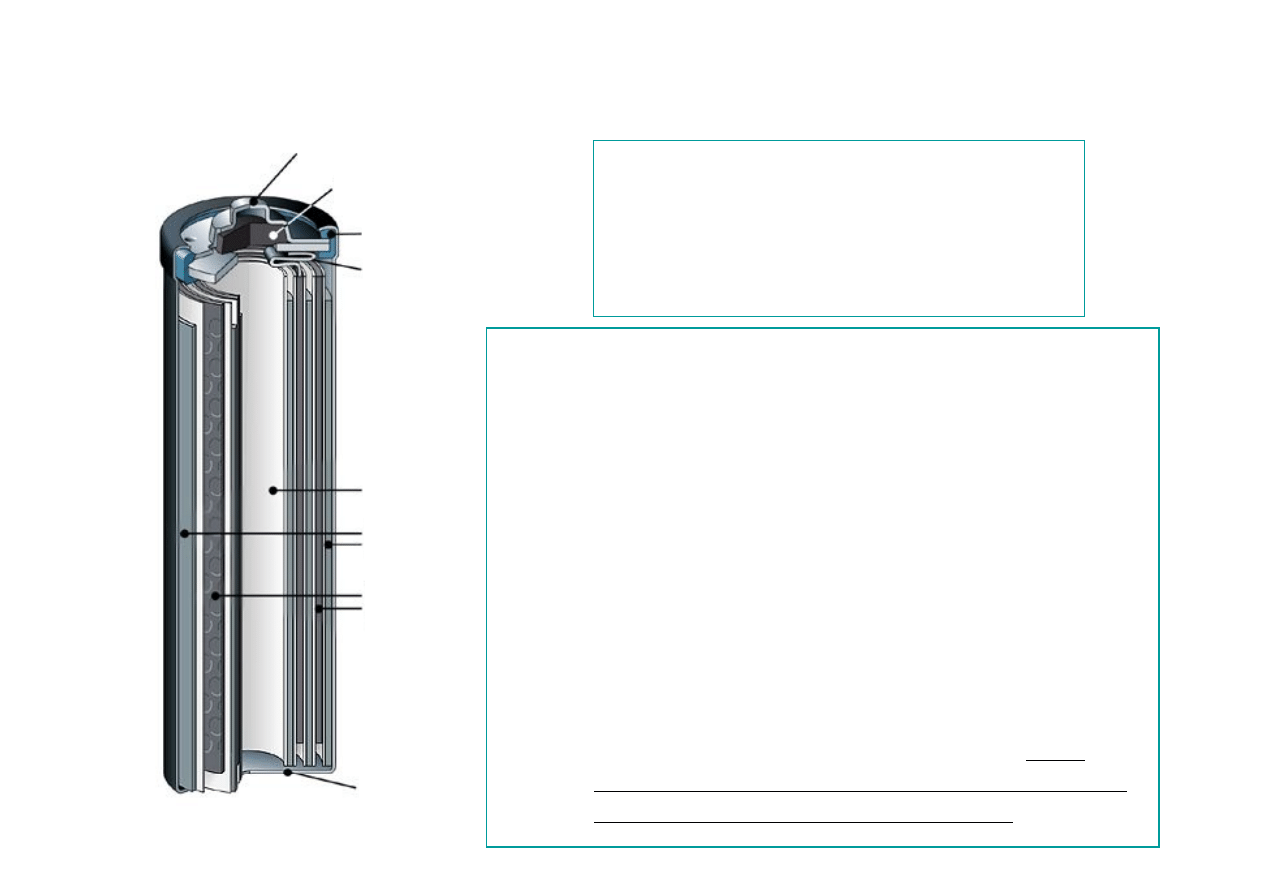
AKUMULATOR NIKLOWO-KADMOWY
AKUMULATOR NIKLOWO-KADMOWY
NiCd
NiCd
Separator
Elektroda
ujemna
Elektroda
dodatnia
Biegun dodatni
Biegun
ujemny
Połączenie
elektrody
dodatniej
Uszczelka gumowa
Uszczelka
El. dodatnia
– Ni(OH)
3
El. ujemna
− Cd gąbczasty kadm
Elektrolit
−roztwór KOH
Napięcie
−1,2V
Zalety: trwalsze od ołowiowych, bardziej odporne na
zwarcia, można je obciążać na bardzo krótko
prądem aż do 100 C, większa gęstość energii niż w
ołowiowych, NiCd mają większe prądy
rozładowania niż NiMH a poza tym przy niskich
temperaturach oferują te akumulatory więcej
energii niż NiMH,
Wady: droższe niż kwasowe, cięższe, mniejsza sprawność,
większa rezystancja wewnętrzna od ołowiowych,
efekt pamięciowy (rekrystalizacja materiału
elektrod) zmniejszający jej pojemność nawet do
60%, samorozładowanie ok. 1% na dzień większe
niż w ołowiowych, kadm jest szkodliwy dla
środowiska, przy silnym rozładowaniu, kiedy
napięcie ogniwa spada aż do 0,2 V, zdarza się, że
może nastąpić odwrócenie polaryzacji,

26
Separator
Elektroda
ujemna
Elektroda
dodatnia
Biegun dodatni
Biegun
ujemny
Połączenie
elektrody
dodatniej
Uszczelka gumowa
Uszczelka
AKUMULATOR NIKLOWO-WODORKOWY
AKUMULATOR NIKLOWO-WODORKOWY
NiMH
NiMH
El. dodatnia
– Ni(OH)
3
El. ujemna
−
stop metali silnie
absorbujący wodór
Elektrolit
−roztwór KOH
Napięcie
−1,2-1,3 V
Zalety: Przyjazne dla środowiska, długi czas
eksploatacji za umiarkowaną cenę, NiMH mają
dwa razy większą energię niż NiCd, krótki czas
ładowania (1,2–1,6 godz.) ale dłuższy niż nowe
NiCd,
Wady: powinny być całkowicie naładowanie, procesu
ładowania pod żadnym pozorem nie wolno
przerywać, podczas eksploatacji powinny być
rozładowywane do końca (podlegają efektowi
pamięciowemu lecz znacznie mniejszemu niż
ak. NiCd), samorozładowanie 1,5% na dzień
wieksze niż dla NiCd, małe prądy rozładowania,
zwykle nie zaleca się prądów rozładowania
większych od 3 do 5 C.

27
Separator
Elektroda
ujemna
Elektroda
dodatnia
Biegun dodatni
Biegun
ujemny
Połączenie
elektrody
dodatniej
Uszczelka gumowa
Uszczelka
AKUMULATOR LITOWO JONOWY (Li-
AKUMULATOR LITOWO JONOWY (Li-
Ion
Ion
)
)
El. dodatnia
– metalotlenki litu, Li
X
Mn
2
O
4
, Li
X
CoO
2
,
Li
X
NiO
2
, mieszanina MnO
2
i Li
2
MnO
3
El. ujemna
− specjalny grafit lub elektroda wykonana na
bazie amorficznego tlenku cyny, stosuje si
też stopy Li-Al, Li-Si, Li
4
Ti
5
O
12
,
Elektrolit
− sól litu rozpuszczona w organicznych środkac
rozpuszczających np.: nadchloran litu
(LiClO
4
), dioksolan (C
3
H
6
O
2
).
Napięcie
− 3,6 ÷ 3,8 V
Zalety: brak efektu pamięciowego, lekkie, dwukrotnie
większa energia od NiMH, Li-Ion nie muszą być
ładowane do pełna i rozładowywane do końca jak
NiMH gdyż mają one własne układy elektroniczne
kontrolujące proces ładowania i rozładowywania,,
nie używane przechowywać w stanie naładowanym
Wady: drogie, jednym z powodów uszkodzenia
akumulatorów Li-Ion może być przeładowanie,
przegrzewanie akumulatorów prowadzi do trwałej
utraty ich pojemności.
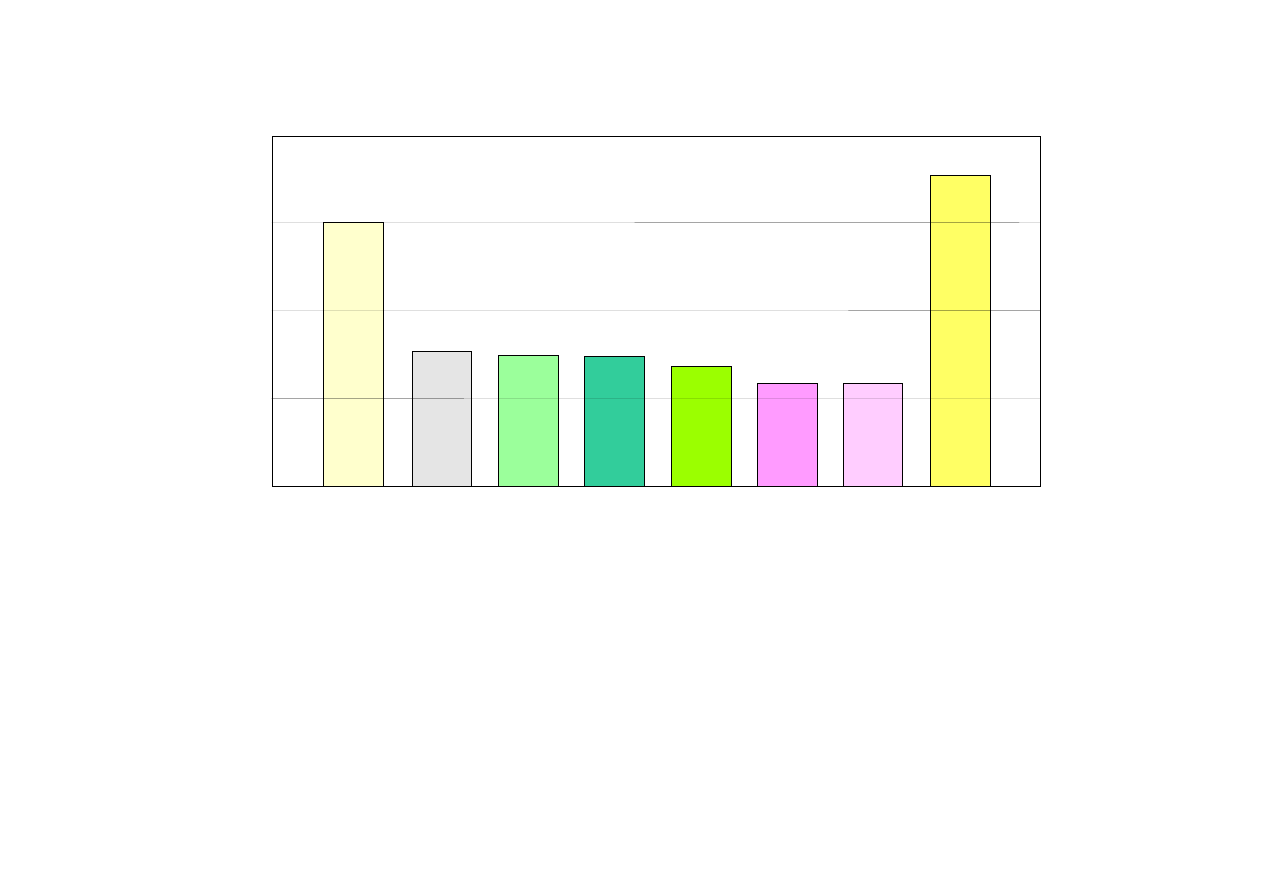
28
3,0
1,55
1,50
1,50
1,40
1,2
1,2
3,6
ogniwo litowe
(Li)
ogniwo manganowe
(ZnCl)
ogniwo cynkowo
-powietrzne (ZnAir)
ogniwo manganowe
alkaliczne (ZnCl)
ogniwo srebrowe
(AgO)
akumulator (NiCd)
niklowo-kadmowy
akumulator (NiMH)
niklowo-wodorkowy
akumulator (LiIon)
litowo-jonowy
0
1
2
3
4
Napi
ęcie [V]
PORÓWNANIE NAPIĘĆ OGNIW PIERWOTNYCH I WTÓRNYCH
PORÓWNANIE NAPIĘĆ OGNIW PIERWOTNYCH I WTÓRNYCH
29
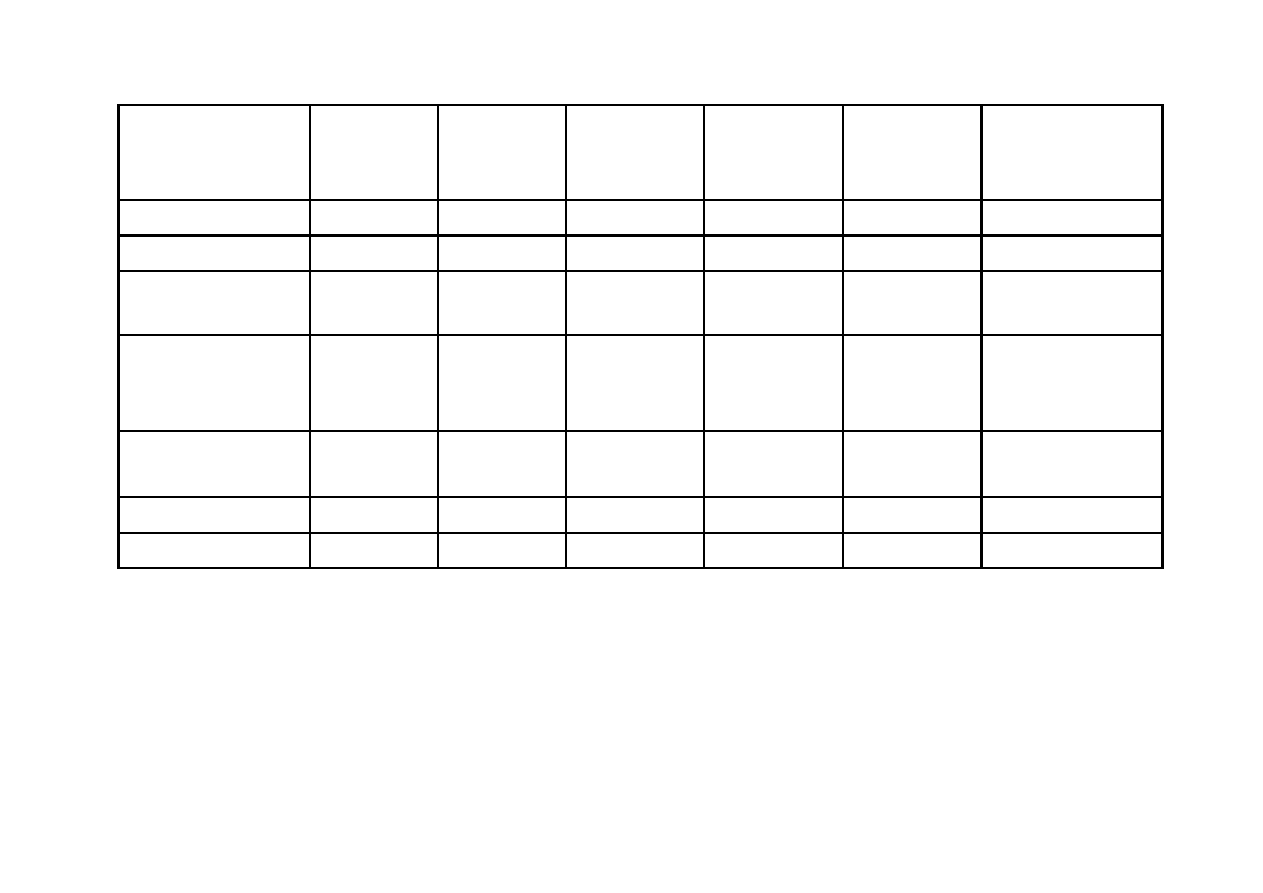
Rodzaj
akumulatora
Ołowiowy Niklowo-
kadmowy
NiCd
Niklowo-
wodorkowy
NiMH
Srebrowo-
cynkowo-
AgZn
LiMnO
2
(SANYO)
Litowo-jonowy
LiIon
Temp.pracy [
°C]
−40 ÷+45 −20 ÷ +50
−20 ÷ +60
−20 ÷ +55
Nap. znam. [V]
2,06
1,3
1,2
÷1,3
1,86
~ 3,0
~ 3,8
Gęstość energii
(teoret.)[Wh/kg]
167
244
278
478
750
Gęstość energii
przy rozł. 1h i 5h
[Wh/kg]
40;
35
35;
32
~ 65
100
÷120;
80
÷100
80
÷90
Liczba cykli
ład/rozł.
300
÷1500 do 3000
300
÷1000
< 100
500
÷20
000
400
÷1200
Sprawność [%]
70
÷80
65
-
Cena 1 kWh(zł)
1,20
÷2
1,50
÷3,00
-
150
18000
PORÓWNANIE AKUMULATORÓW
PORÓWNANIE AKUMULATORÓW
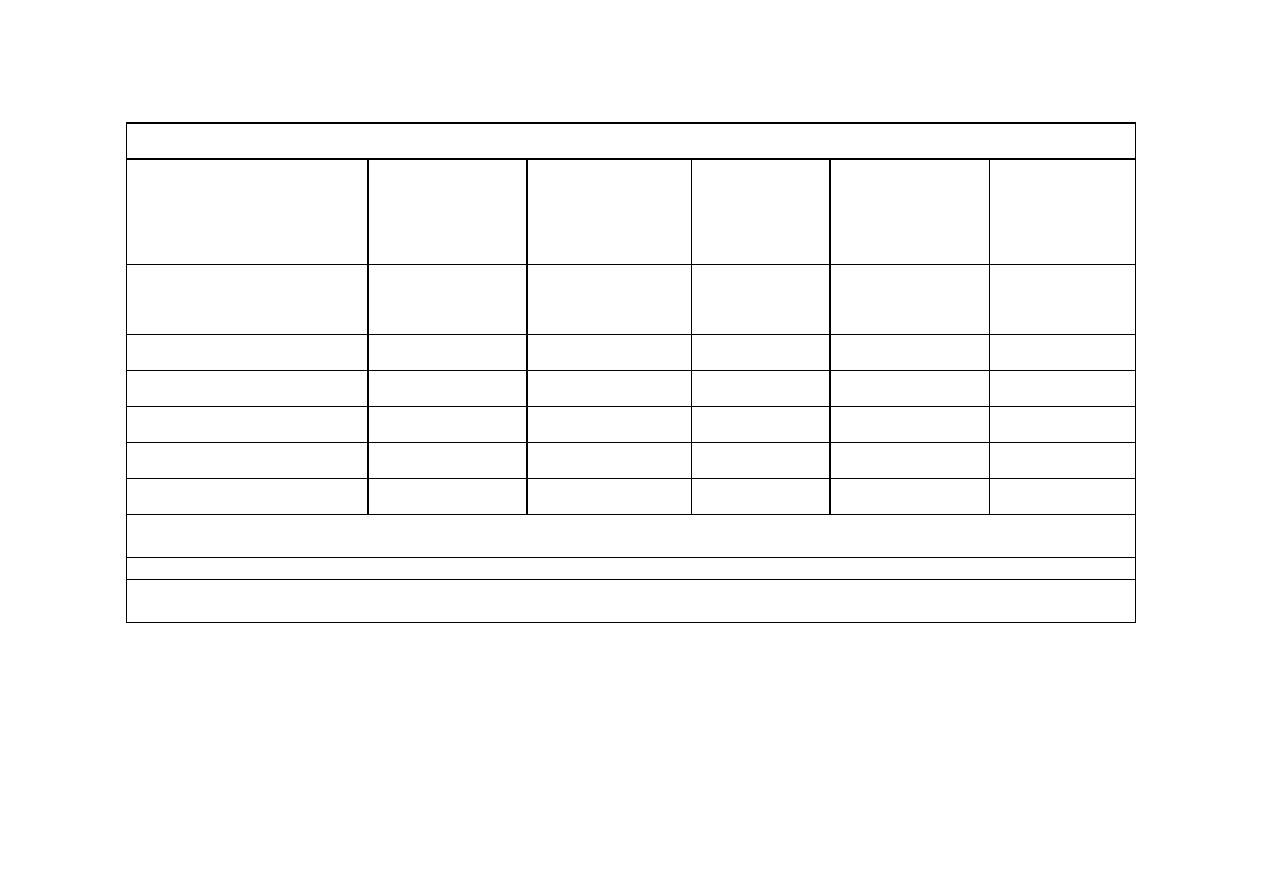
30
CHARAKTERYSTYKA PODSTAWOWYCH TYPÓW AKUMULATORÓW
Rodzaj
akumulatora
Napięcie celi
[V]
Energia
właściwa
[Wh/kg]
Liczba
cykli
ład/rozład
1
Samorozład.
[%/ miesiąc]
Dostępne
na rynku
Pb (typowy)
2.0
33
300- 400
25-30
pocz. XX
w.
Pb (bezobsług.)
2.0
42
800
5
1970
Ni-Cd
1.25
40-60
1500
2
20
3
około 1920
Ni-MH
1.25
60- >80
500-1000
30
1990
Li-Ion (typowy)
3.6
100
400-1200
10
1991
Li-Ion (Fuji)
3.4
135
500
10
1997
1
Liczba cykli ładowanie-rozładowanie, jakie można przeprowadzić, zanim pojemność baterii nie spadnie do 80%
pojemności początkowej.
2
Tylko przy całkowitym rozładowaniu w każdym cyklu. W przeciwnym razie, nie więcej niż 500.
3
W ciągu pierwszej doby po naładowaniu pojemność szybko spada o 10%, następnie co 30 dni spada po dalsze
10%. Tak więc w pierwszym miesiącu wynosi 20%, a w każdym następnym po 10%.
PORÓWNANIE AKUMULATORÓW
PORÓWNANIE AKUMULATORÓW
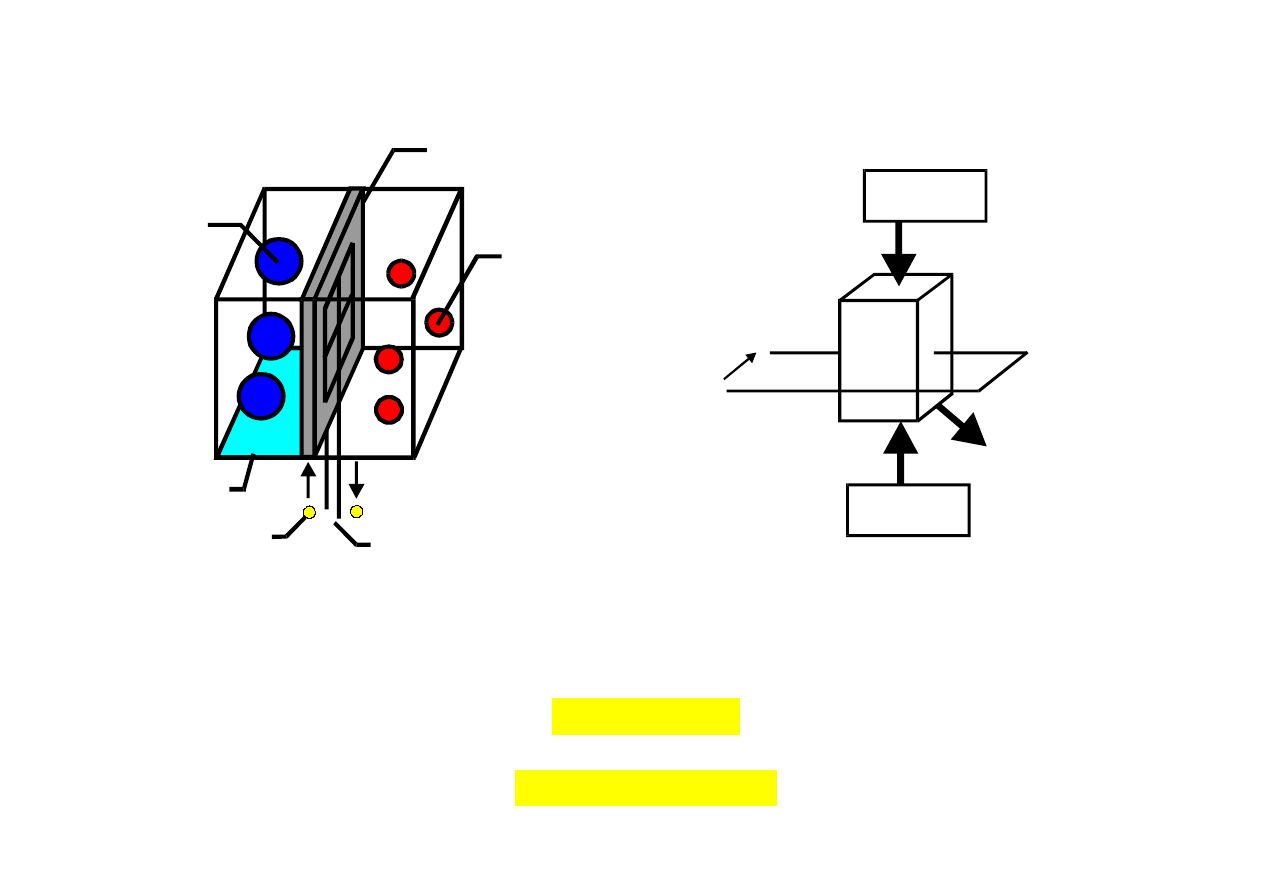
31
woda
wodór
tlen
membrana
elektron
elektrody
z obydwu
stron
woda
tlen
wodór
Uwy
OGNIWO PALIWOWE WODOROTLENOWE
OGNIWO PALIWOWE WODOROTLENOWE
Paliwo - wodór i utleniacz – tlen
Reakcje w ogniwie paliwowym:
1) na elektrodzie wodorowej z cząsteczki wodoru zostają uwolnione dwa elektrony :
H
2
→ 2H
+
- 2e
−
2) jony wodoru wiążą się z grupami OH- pochodzącymi z elektrolitu
2H
+
+ 2OH
−
→ 2H
2
O
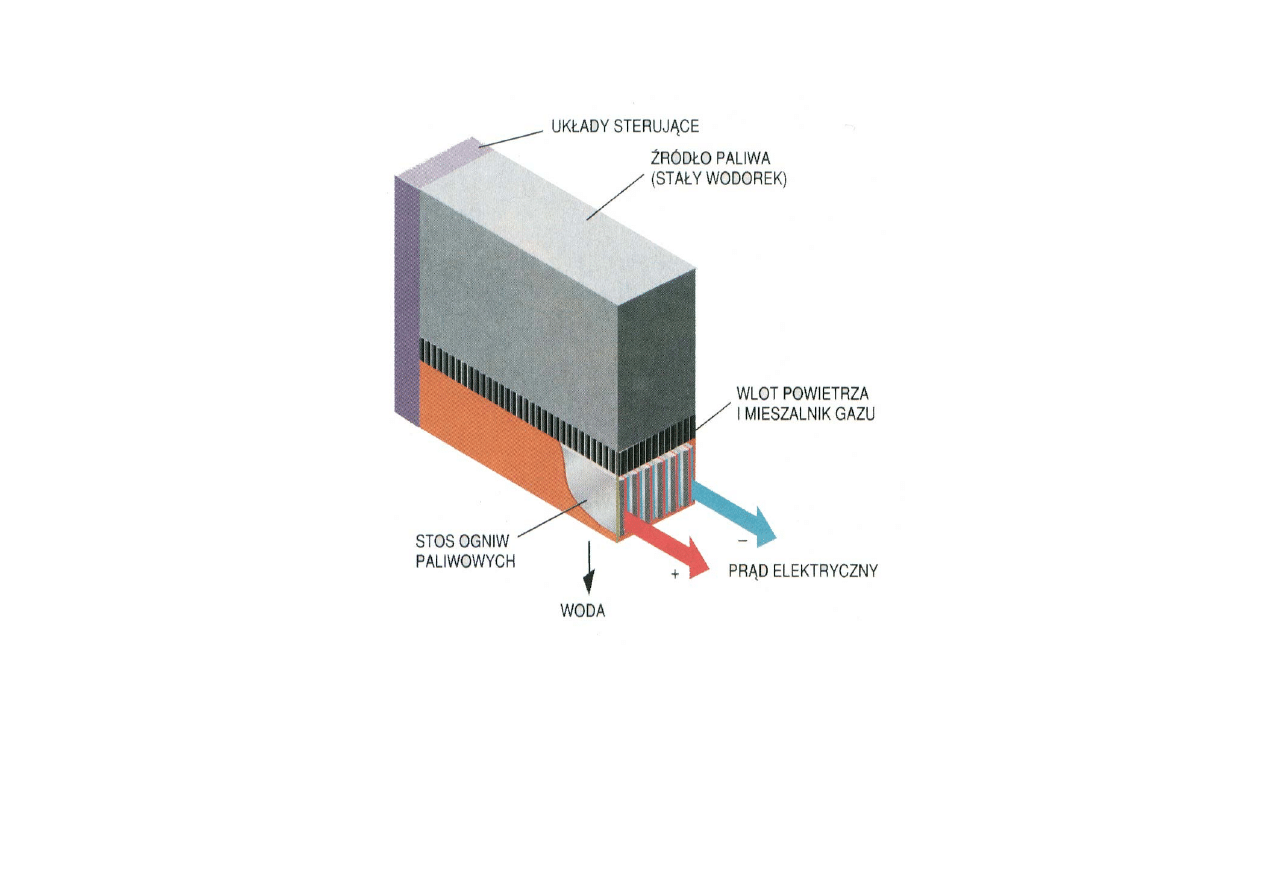
32
Zalety: Sprawność wysoka (50- 70%) niezależna od rozmiarów ogniwa,
łatwość dostosowania się do zmiennego obciążenia, prostota obsługi, duża
niezawodność działania, stosunkowo duża wydajność energetyczna
Wady: Drogie
OGNIWO PALIWOWE WODOROTLENOWE
OGNIWO PALIWOWE WODOROTLENOWE

33
Wyszukiwarka
Podobne podstrony:
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
Chemiczne źródła energii elektrycznej
Prymitywne źródła energii elektrycznej, Elektryczność!!!!
Elektrownie wiatrowe, Odnawialne źródla energi, Elektrownie wiatrowe
Metody poprawy jakości energii elektrycznej kształtowanie prądu źródła
Odnawialne zrodla energii do wytwarzania energii elektrycznej mirowski
Konwencjonalne zrodla energii elektrycznej
Zamiana sygnału chemicznego na elektryczny w błonie postsynaptycznej
Sposoby oszczędzania energii elektrycznej i cieplnej domy zeroemisyjne
Analizowanie pracy odbiorników energii elektrycznej
Gdzie leży klucz do poprawy efektywności wykorzystania energii elektrycznej w Polsce
PRZESYŁANIE ENERGII ELEKTRYCZNEJ
Zadania na energię elektronów w przeskokach
Dz U 2008 r Nr 90 poz 548 budowa nowych mocy wytwórczych energii elektrycznej
Projekt zasilania energią elektryczną oddziału nr 1
Elektrownie geotermalne – alternatywa w produkcji energii elektrycznej
więcej podobnych podstron