
Politechnika Wrocławska
Wydział Chemiczny
WYKŁAD
PODSTAWY CHEMII NIEORGANICZNEJ
Kurs WPC2002w
Wykładowca:
prof. dr hab. in
ż
. Władysław WALKOWIAK
p. 121, budynek A-3
email:
wladysław.walkowiak@pwr.wroc.pl
Strona internetowa:
www.ch.pwr.wroc.pl
-
link do studportu
Wrocław, 20 lutego 2008 r.
OPIS KURSU
•
Kod kursu:
WPC2002w poniedziałek 11
15
- 13
00
sala 220 A-3
•
Nazwa kursu:
CHEMIA OGÓLNA
•
J
ę
zyk wykładowy:
polski
Forma kursu
Wykład
Tygodniowa liczba godzin ZZU *
2
Semestralna liczba godzin ZZU*
30
Forma zaliczenia
egzamin
Punkty ECTS
3
Liczba godzin CNPS
60

Wydział Chemiczny Politechniki Wrocławskiej
Wykład: Podstawy Chemii Nieorganicznej
Kurs wydziałowy (wszystkie kierunki)
Kod kursu: WPC2002w
Program wykładu:
1.
Równowagi w wodnych i niewodnych roztworach elektrolitów. Kwasy i zasady (4 godz.)
o
siła jonowa roztworu, aktywność, współczynnik aktywności,
o
wpływ elektrolitów mocnych na dysocjację elektrolitów słabych, dysocjacja kwasów
wieloprotonowych (np. kwas fosforowy i siarkowodorowy),
o
właściwości roztworów wodnych: osmoza, ciśnienie osmotyczne, dyfuzja, efekty krio-
i ebulioskopowe, dyfuzja,
o
reakcje kwasowo-zasadowe w rozpuszczalnikach niewodnych,
o
teoria Bronsteda i Lawry’ego, teoria Lewisa, teoria twardych i miękkich kwasów oraz
zasad,
o
super kwasy i stopione sole,
o
reguła faz Gibbsa, wykres fazowy wody, ciecze superkrytyczne (np. dwutlenek węgla).
2.
Elektrochemia (3 godz.)
o
definicja półogniwa (elektrody), wzór Nernsta,
o
szereg napięciowy układów re-dox pierwiastków,
o
definicja ogniwa, SEM ogniwa, ogniwa użyteczne, w tym paliwowe,
o
korozja (na przykładzie żelaza) i sposoby jej zapobiegania,
o
elektroliza, produkty elektrolizy, prawa elektrolizy.
3. Symetria w chemii (2 godz.)
o
pojęcie symetrii, elementy i operacje symetrii punktowej,
o
symetria cząsteczek typu : BF
3
, CCl
4
, H
2
O, NH
3
i SF
6.
4.
Budowa ciała stałego (5 godz.)
o
ciała izotropowe i anizotropowe,
o
ciekłe kryształy,
o
sieć przestrzenna, komórki elementarne,
o
sieci metaliczne typu A
1
, A
2
i A
3
,
o
sieci jonowe (NaCl, CsCl, CaF
2
,
αααα
-ZnS),
o
sieci kowalencyjne (diament),
o
sieci molekularne (CO
2
),
o
inne sieci (K
2
PtCl
6
, CaCO
3
),
o
zestawienie typów sieci,
o
izomorfizm i polimorfizm,
o
defekty sieci krystalicznej - defekty Schottky'egoi Frenkla, centra barwne, dyslokacje,
o
badania struktury kryształów – rentgenografia, równanie Braggów, metoda obracanego
kryształu i metoda proszkowa.
5.
Teoria pasmowa ciała stałego (2 godz.)
o
pasma energetyczne metali,
o
metale, półprzewodniki i izolatory,
o
półprzewodniki samoistne oraz domieszkowe typu n i p.
6.
Związki kompleksowe (4 godz.)
o
pojęcia podstawowe,
o
nazewnictwo związków kompleksowych,
o
izomeria związków kompleksowych,
o
równowagi w roztworach wodnych związków kompleksowych,
o
teoria pola krystalicznego w chemii koordynacyjnej.
7.
Metale (2 godz.)
o
metody otrzymywania metali: piro-, -hydro- i biometalurgia,
o
roztwarzanie metali w kwasach, zasadach i w wodzie,
o
stopy i materiały kompozytowe.
8.
Przegląd podstawowych klas związków nieorganicznych pierwiastków grup głównych
( 3 godz.)
Na podstawie położenia pierwiastków w układzie okresowym oraz ich elektroujemności
omówić:

o
wodorki,
o
tlenki,
o
kwasy i wodorotlenki,
o
właściwości kwasowo-zasadowe, amfoteryczność,
o
sole: azotany, siarczany, chlorki, fosforany, siarczki,
o
zdolności kompleksotwórcze pierwiastków grup głównych.
9.
Przegląd podstawowych klas związków nieorganicznych pierwiastków grup pobocznych
( 3 godz.)
o
formy jonowe w roztworach wodnych: proste kationy, oksoaniony, oksokationy, jony izo- i
heterpolikwasów,
o
tlenki, azotki, węgliki, borki, fosforki,
o
karbonylki metali przejściowych,
o
kompleksy cyjankowe i nitrozylowe, kompleksy chlorkowe,
o
klastery metaliczne,
o
kompleksy metali przejściowych z węglowodorami.

10.
Zadania (problemy obliczeniowe) (2 godz.)
Rozwiązanie na wykładzie kilku zadań dot. zagadnień:
o
stechiometrii połączonej z reakcją utleniająco-redukcyjną,
o
elektrochemii,
o
równowag w wodnych roztworach elektrolitów,
o
związków kompleksowych.
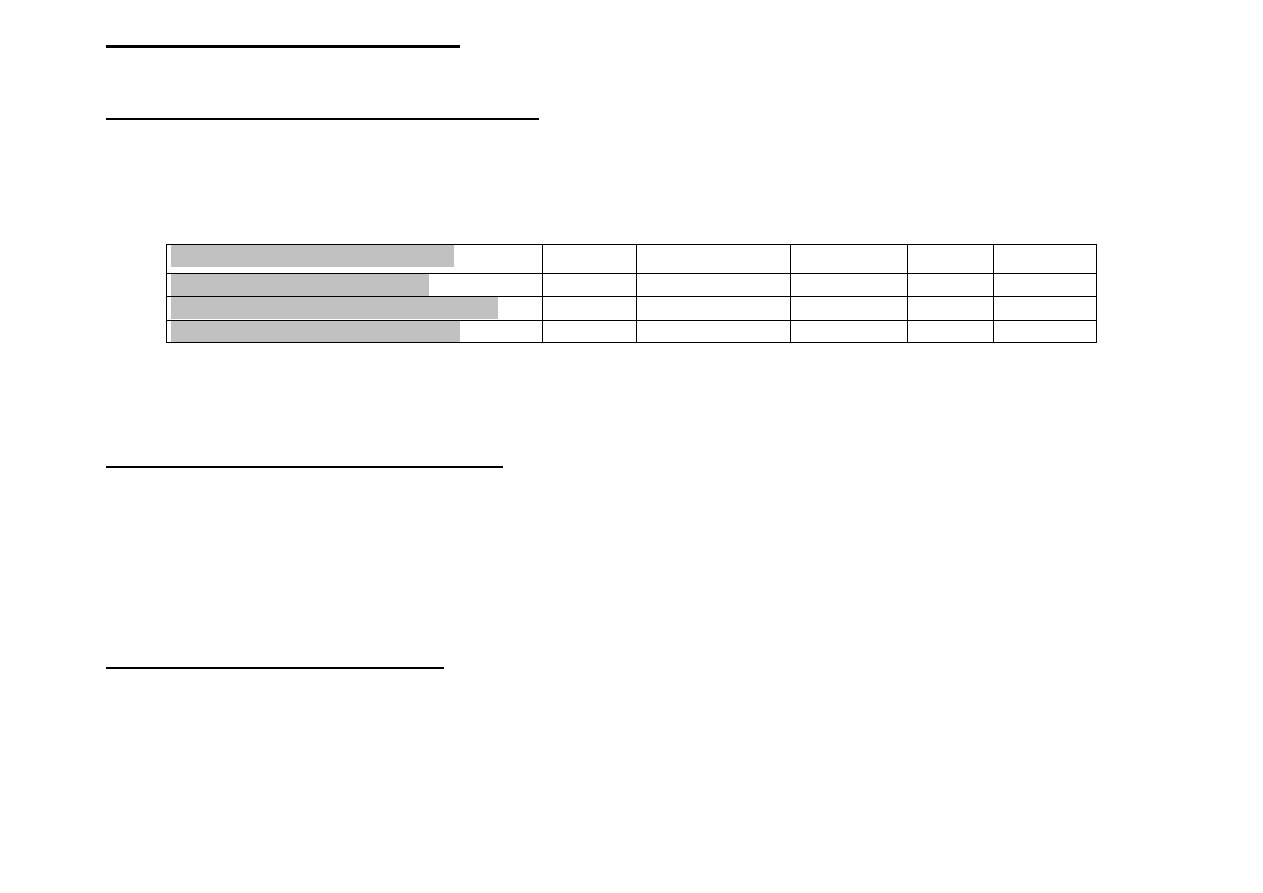
SPRAWY ORGANIZACYJNE
1) Wykład: Podstawy Chemii Nieorganicznej
•
2 godz./tydzie
ń
- 30 godz./semestr
•
Prowadz
ą
cy wykład: prof. Maria Cie
ś
lak-Golonka, prof. Piotr Dro
ż
d
ż
ewski, dr hab. Leszek Rycerz i
prof. Władysław Walkowiak
Pro Prof. W. Walkowiak
PN
11.15-13.00
A3
220
150
Dr ha Dr hab. L. Rycerz
PN
13.15-15.00
A3
220
150
Prof. Prof. M. Cieślak-Golonka
CZ
9.15-11.00
A3
220
150
Prof. Prof.. P. Drożdżewski
CZ
11.15-13.00
A3
220
150
•
kod kursu:
WPC2002w
2) Warunki zaliczenia kursu
WPC2002w
:
W czasie sesji egzaminacyjnej odb
ę
d
ą
si
ę
:
-
2 egzaminy pisemne obejmuj
ą
ce wyło
ż
on
ą
teori
ę
i od 1 do 2 zada
ń
.
Studenci powinni zna
ć
i rozumie
ć
cały układ okresowy pierwiastków!
3) Pomoce naukowe do WYKŁADU
- układ okresowy,
- podr
ę
czniki - patrz wykaz,
- konspekt wykładu,

- konsultacje:
2 razy w tygodniu – wtorki i
ś
rody w godz. 10.15 -12.00 w p. 121 A-3

P O D R Ę C Z N I K I
1) Literatura podstawowa do kursu „Podstawy Chemia Nieorganicznej”- wykład
1.
A. Bielański, Podstawy chemii nieorganicznej, PWN, Warszawa, 2004 (2002, 1998, 1994).
2) Literatura uzupełniająca do kursu ”Podstawy Chemii Nieorganicznej”- wykład
1.
P. Mastalerz, Elementarna chemia nieorganiczna, Wyd. Chemiczne, Wrocław, 1997.
2.
I. Barycka, K. Skudlarski, Podstawy chemii, Wyd. Pol. Wrocławskiej, Wrocław, 2001.
3.
P.A. Cox, Chemia nieorganiczna – krótkie wykłady, Wyd. Naukowe PWN, Warszawa, 2003.
4.
F.A. Cotton, G. Wilkinson, P.L. Gaus, Chemia nieorganiczna – podstawy, Wyd. Naukowe PWN, Warszawa, 1995.
5.
J.E. Brady, General Chemistry, Principles and Structure, John Wiley & Sons, New York, 1990.
Wyszukiwarka
Podobne podstrony:
00 program wykladu i literatura
Program wykladow, Studja, Chemia Organiczna
Organizacje Mnd PROGRAM WYKŁADÓW Z OM
ramowy program wykładów z chemii organicznej dla studentów, biologia, Chemia organiczna UŁ mikrobiol
Podstawy programowania (wykład III)
Program wykładów 1 sem
Program wykładu Fizyka II
Biomechanika sprawy organizacyj Nieznany (2)
wykład 7.1, I rok, Nauka o organizacji
Wykład (5), Studia - administracja, Organizacja i zarządzanie
zasady zaliczeń PP IG, Politechnika Białostocka, ZiIP (PB), Semestr 1, Podstawy programowania, Progr
Wskaźniki w C, Programowanie, wykłady C++
Wykład (8), Studia - administracja, Organizacja i zarządzanie
Program Wykładów I Semestru (30h) Starożytność str 1
Wykład II Ekonomika i Organizacja Przedsiębiorstw, sggw - finanse i rachunkowość, studia, III semss
program wykladow
Programowanie - wykłady, UE IiE ISIZ, programowanie
PROGRAMY I DYSKUSJE LITERACKIE OKRESU POZYTYWIZMU
więcej podobnych podstron