
Acta Haematologica Polonica 2009, 40, Nr 3, str. 705–715
PRACA ORYGINALNA – Original Article
KRZYSZTOF ILNICKI, ELśBIETA URBANOWSKA
1
Wpływ temperatury długotrwałego przechowywania komó-
rek jądrowych krwi pępowinowej na ich przeżycie i potencjał
proliferacyjny
Impact of the long term storage temperature on survival and pro-
liferative potential of the cord blood nuclear cells
Z Zakładu Genetyki, Centrum Zdrowia Dziecka w Warszawie
Kierownik: Prof. dr hab. Małgorzata Krajewska-Walasek
1
Z Katedry i Kliniki Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersyte-
tu Medycznego
Kierownik: Prof. dr hab. W.W. Jędrzejczak
STRESZCZENIE
Tematem pracy jest ocena przechowywania przez okres 4 lat komórek jądrowych krwi pę-
powinowej w ogólnie dostępnej zamrażarce mechanicznej (–80ºC) i fazie ciekłej ciekłego azotu
(–196ºC) oraz wpływ takiego sposobu przechowywania na ich właściwości klonogenne. Wydaje
się, że główną przyczyną zmniejszania liczby żywych komórek obdarzonych zdolnością tworze-
nia kolonii krwiotwórczych jest temperatura przechowywania komórek, a dopiero następną w
kolejności zmniejszanie się liczby komórek jądrowych wskutek aglutynacji, w zależności od ich
początkowego stężenia w próbce. Nie stwierdzono jednak, by zamrażanie komórek jądrowych
krwi pępowinowej w wysokich stężeniach oddziaływało wybiórczo na odzysk komórek tworzą-
cych kolonie krwiotwórcze w obrębie komórek jądrowych pozostających w zawiesinie użytej po
rozmrożeniu do hodowli. Przechowywanie zamrożonych komórek jądrowych w stabilnej tempe-
raturze –196ºC fazy ciekłej, ciekłego azotu jest znacząco bardziej wydajne niż przechowywanie
w zamrażarce udostępnionej do ogólnego użytku.
SŁOWA KLUCZOWE: Krew pępowinowa – Kriokonserwacja – Potencjał proliferacyjny komórek
jądrowych
SUMMARY
The aim of this work was to evaluate the result of the 4 years period of the umbilical cord blood
nuclear cells in the general purpose laboratory mechanical freezer (–80ºC) as well as in the liquid
phase of the liquid nitrogen (–196ºC). It was detected the impact of such storage conditions on
survival and proliferative potential of these cells. It seems probable, that the main reason of
diminution of the pool of clonogenic cells is the temperature of storage. The secondary reason is
agglutination of these cells as a consequence of their initial concentration in the freezed probe.
However, it was not observed, that the freezing process of the nuclear cells have had some
effect
on the enrichment or specific diminution of the pool of CFC that remain in the suspension after
thawing. Storage of the cryopreserved nuclear cells in the stable temperature of liquid phase of

K. ILNICKI i wsp.
706
liquid nitrogen (-196ºC) seems to be significantly more effective than the storage in the general
purpose mechanical freezer.
KEY WORDS: Cord blood – Cryopreservation – Proliferative potential of nuclear cells
WSTĘP
Pierwsze udane zabiegi przeszczepienia krwi pępowinowej wykazały, że pojedyn-
cza jednostka takiej krwi zawiera wystarczającą liczbę komórek krwiotwórczych, po-
zwalającą na odnowę krwiotworzenia biorcy. Czynniki takie, jak wyższa aktywność
proliferacyjna komórek krwiotwórczych krwi pępowinowej w porównaniu do komórek
szpiku, ich odpornościowa niedojrzałość, łatwiejszy dobór dawcy i biorcy
oraz prak-
tycznie nieograniczony dostęp do niej spowodowały wzrost zainteresowania tym
ź
ródłem komórek krwiotwórczych do przeszczepienia.
Procedurę pozyskiwania i preparowania komórek krwiotwórczych krwi pępowi-
nowej można podzielić na następujące etapy: pobranie krwi pępowinowej, oddzielenie
komórek jądrowych od erytrocytów, granulocytów i płytek krwi, zagęszczenie zawie-
siny komórek jądrowych, wśród których są obecne komórki krwiotwórcze, kriopre-
zerwację tych komórek, ich przechowywanie oraz rozmrożenie z ewentualnym usunię-
ciem krioprotektora.
Od momentu zamrożenia krwi pępowinowej do wydania do przeszczepienia, musi
być ona przechowywana w temperaturze kriogenicznej. Klasycznie, temperaturą do
przechowywania zamrożonego materiału komórkowego jest temperatura ciekłego azo-
tu (–196°C), która pozwala na wieloletnie przechowywanie takiego materiału i pozo-
staje bez ujemnego wpływu na aktywność proliferacyjną komórek krwiotwórczych [1].
Komórki krwiotwórcze mogą być również przechowywane w temperaturze
zamrażarki mechanicznej (–80°C) [2], co nie wymaga stałego uzupełniania odparowa-
nego ciekłego azotu, tak jak musi to być dokonywane w metodzie poprzedniej. Dodat-
kowo, zewnętrzne powierzchnie pojemników krioochronnych nie są obmywane przez
ciekły azot, który może ułatwiać rozprzestrzenianie zakażeń (np. wirusowych) pomię-
dzy pojemnikami.
Przed przeszczepieniem biorcy krew pępowinowa dotychczas przechowywana w
zamrożeniu musi zostać rozmrożona. Regułą jest bardzo szybkie rozmrożenie porcji
zawiesiny komórek poprzez krótkotrwałe (minuty) ogrzanie w łaźni wodnej o tempera-
turze 36°–38°C [3, 4] Spowolnienie takiego tempa rozmrażania przez np. kilkugodzin-
ne rozmrażanie w temperaturze +4°C obniża żywotność komórek jądrowych i liczbę
tworzonych przez nie kolonii krwiotwórczych.
Czynnikami branymi pod uwagę w kwalifikacji jednostki krwi pępowinowej do
przeszczepienia jest nie tylko liczba komórek jądrowych, ale także liczba kolonii
krwiotwórczych wskazujące na wielkość potencjału proliferacyjnego komórek hema-
topoetycznych . Nie ma jednak wystarczającej liczby badań porównujących wpływ
długotrwałego (wieloletniego) przechowywania komórek krwiotwórczych krwi pępo-
winowej w ciekłym azocie i w zamrażarce mechanicznej na właściwości klonogenne
tych komórek. Dlatego celem naszej pracy było porównanie przechowywania przez
okres 4 lat wyizolowanych i zamrożonych komórek krwiotwórczych krwi pępowino-

Wpływ temperatury długotrwałego przechowywania
707
wej w temperaturze fazy ciekłej ciekłego azotu (–196
0
C) i w ogólnie dostępnej labora-
toryjnej, pionowej zamrażarce mechanicznej (–80
0
C).
MATERIAŁ I METODY
Pracę wykonano na 60 porcjach krwi pępowinowej pobranej w trakcie porodów
rozwiązywanych siłami natury. Określano objętość zebranej krwi oraz liczono bez-
względną liczbę komórek jądrowych (za pomocą analizatora hematologicznego Cell
Dyna 1700 firmy Abbott).
Izolacja, zamrażanie i rozmrażanie komórek jądrowych krwi pępowinowej
Na Gradisol L nawarstwiano krew pępowinową i wirowano przy 1000 g. przez 20
minut, a następnie zbierano frakcję leukocytarną. Otrzymane komórki płukano, zawie-
szano w podłożu Iscove’a, liczono oraz określano ich żywotność metodą wchłaniania
błękitu trypanu oceniając odsetek komórek, które nie wchłonęły barwnika. Otrzymane
w wyniku rozdziału komórki jądrowe zawieszano w płodowej surowicy cielęcej w
stężeniach 50; 20; 10 i 5 mln/ml i przenoszono do fiolek do krioprezerwacji (Nalge
Nunc Int.), a następnie dodawano podłoże do mrożenia, tak aby końcowe stężenie
DMSO wynosiło 7,5%. Zamrażanie prowadzono zgodnie ze schematem zamrażania
komórek jądrowych krwi. Połowę zamrożonych próbek z każdej grupy przenoszono do
ogólnie dostępnej laboratoryjnej, pionowej zamrażarki mechanicznej firmy Revco
(temp –80°C), Pozostały materiał komórkowy przenoszono do kriostatu firmy Taylor-
Wharton i umieszczano w fazie ciekłej, ciekłego azotu (temp. –196°C). Czas przecho-
wywania wynosił 4 lata. Po upływie tego czasu, próbkę po wyjęciu z ciekłego azotu
lub zamrażarki, rozmrażano w łaźni wodnej w temp. 37°C nieustannie mieszając. Po
rozmrożeniu, do ampułki dodawano kroplami podłoże Iscove’a z dodatkiem 10% pło-
dowej surowicy cielęcej (Gibco Ltd). W rozmrożonej zawiesinie określano liczbę ko-
mórek jądrowych oraz ich żywotność.
Badanie liczby komórek krwiotwórczych tworzących kolonie in vitro
Do podłoża z metylcelulozą (MethoCult H 4433 Stem Cell Technologies) dodawa-
no zawiesinę komórek w podłożu Iscove’a z dodatkiem płodowej surowicy cielęcej.
Otrzymaną mieszaninę rozlewano do dwóch płytek testowych (Nalge Nunc). Po inku-
bacji odczytywano liczbę wyrośniętych kolonii krwiotwórczych na 100 000 nasadzo-
nych komórek. Kolonie krwiotwórcze klasyfikowano według kryteriów opracowanych
przez Sutherland i wsp. [5]. Wynik był średnią z odczytu z 2 płytek.
Otrzymane wartości przedstawiano jako średnie ± odchylenie standardowe. Po-
równania pomiędzy grupami przeprowadzano stosując test t Studenta, a wartości p po-
niżej 0,05 uznawano za znamienne statystycznie.
K. ILNICKI i wsp.
708
WYNIKI
1. Wpływ przechowywania komórek jądrowych krwi pępowinowej w temperaturze
ciekłego azotu (–196°C) i zamrażarki mechanicznej (–80°C) na parametry fizjologicz-
ne tych komórek.
a. żywotność komórek
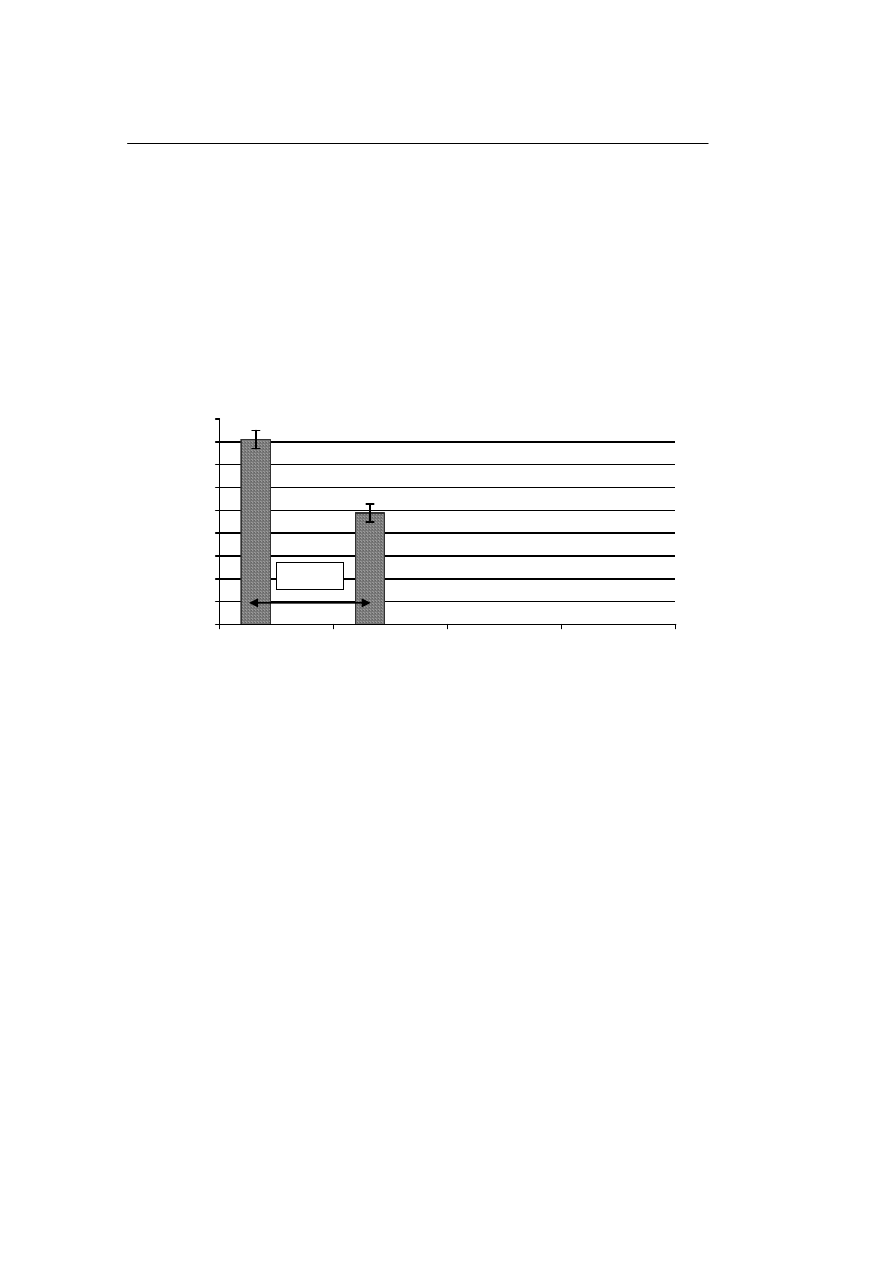
Po przechowywaniu komórek jądrowych w ciekłym azocie i ich rozmrożeniu, ży-
wotność tych komórek wynosiła 82,5±7%, natomiast po przechowywaniu w zamrażar-
ce i rozmrożeniu żywotność wynosiła 48,9 ±15%. Różnica w odsetku przeżycia tych
komórek w zależności od temperatury przechowywania (między grupami (–196°C i –
80°C) była statystycznie znamienna. Rycina 1 ilustruje wpływ temperatury przecho-
wywania na żywotność komórek jądrowych po ich rozmrożeniu.
0
10
20
30
40
50
60
70
80
90
- 196°C
- 80°C
temperatura
ś
y
w
o
tn
o
ść
(
%
)
Ryc. 1. Wpływ temperatury przechowywania na żywotność komórek jądrowych
Fig. 1. Influence of the storage temperature on the viability of the nuclear cells
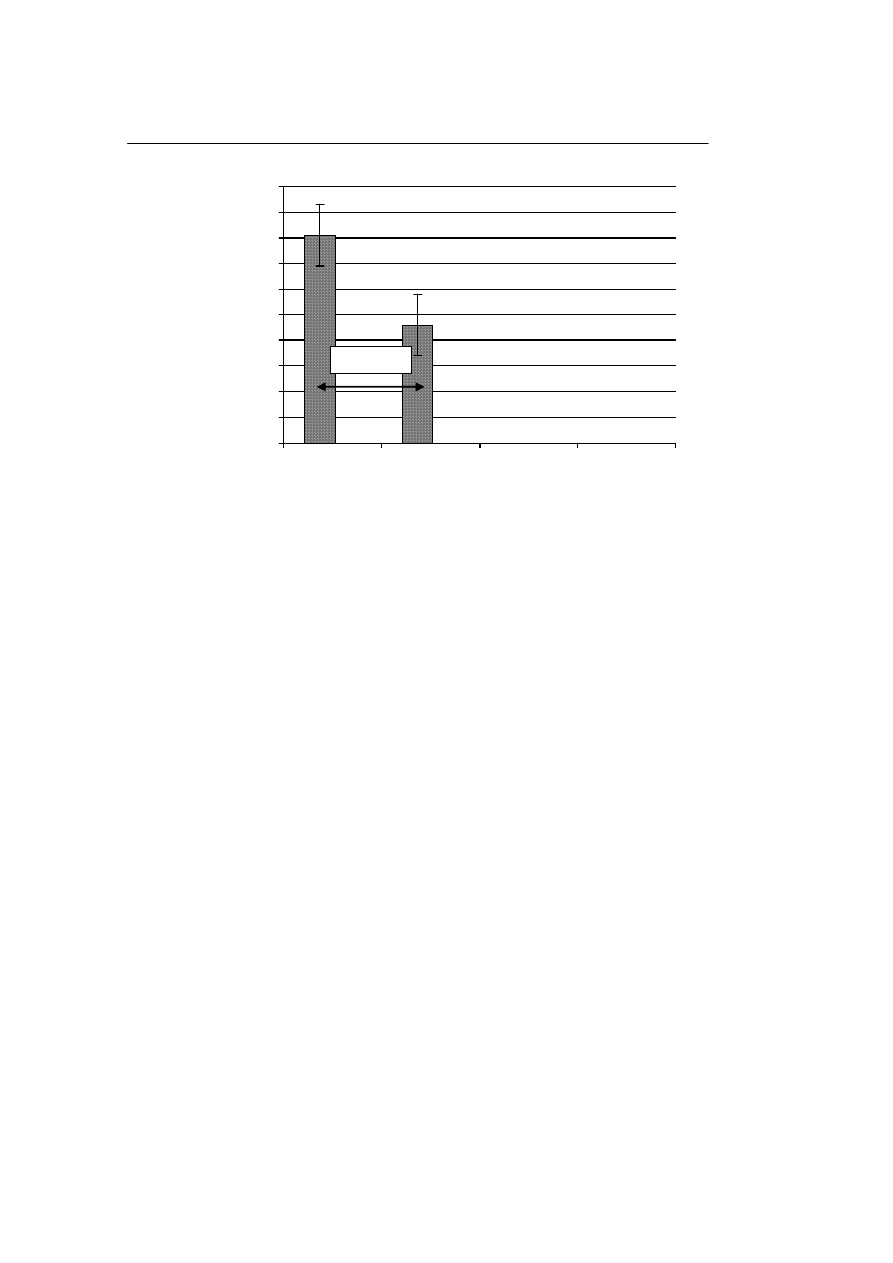
b. Odsetek odzysku komórek tworzących kolonie krwiotwórcze
Liczba komórek tworzących kolonie krwiotwórcze w próbkach przechowywanych
w ciekłym azocie, po rozmrożeniu wyniosła 82 ± 15% w stosunku do liczby tych ko-
mórek w materiale nie poddanym krioprezerwacji, natomiast liczba komórek tworzą-
cych kolonie krwiotwórcze w próbkach przechowywanych w zamrażarce wyniosła 45
± 16%. Różnica w odsetku odzysku komórek w zależności od temperatury przecho-
wywania jest statystycznie znamienna. Na Rycinie 2 przedstawiono wpływ temperatu-
ry przechowywania na odzysk komórek tworzących kolonie krwiotwórcze po rozmro-
ż
eniu.
p= 0,0134
Wpływ temperatury długotrwałego przechowywania
709
Ryc. 2. Wpływ temperatury przechowywania na tworzenie kolonii przez komórki tworzące kolonie hema-
topoetyczne
Fig. 2. Influence of storage temperature on the colonies formation by the hematopoietic colony forming
cells
2. Wpływ temperatury –196
0
C i –80
0
C na odsetek odzysku rozmrażanych komó-
rek jądrowych uprzednio zamrożonych w różnych stężeniach.
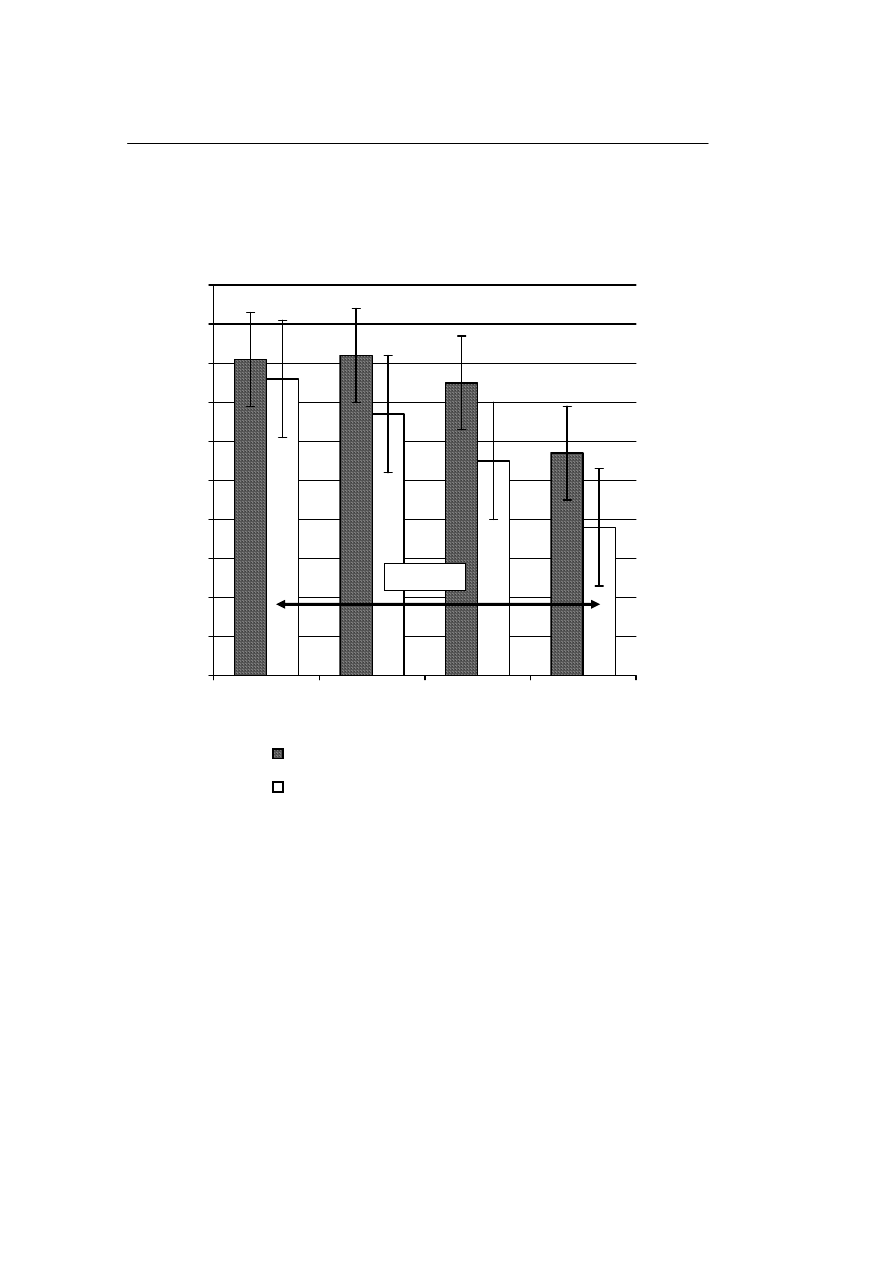
Odsetek odzysku komórek jądrowych po rozmrożeniu zmniejszał się wraz ze
wzrostem stężenia tych komórek przechowywanych zarówno w ciekłym azocie jak i w
zamrażarce. Różnice w odzysku pomiędzy grupą I (5 mln/ml) i IV (50 mln/ml) były
znamienne statystycznie w odniesieniu do materiału przechowywanego w zamrażarce
(Rycina 3).
3. Wpływ temperatur –196
0
C i –80
0
C na odsetek odzysku komórek tworzących
kolonie krwiotwórcze.
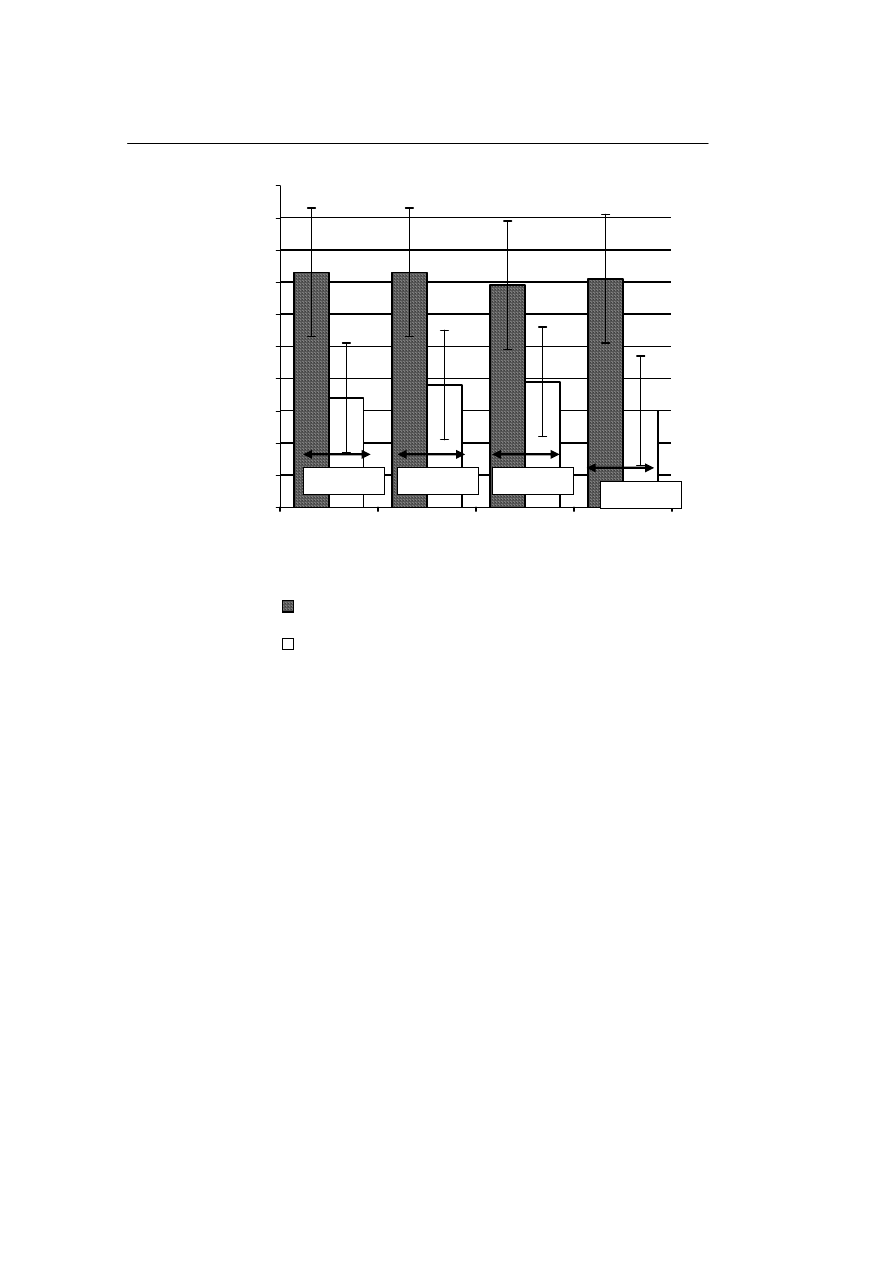
Populacje rozmrożonych komórek jądrowych, które były przechowywane w cie-
kłym azocie prezentują zbliżone wartości odsetka odzysku komórek tworzących kolo-
nie krwiotwórcze na 100 000 hodowanych komórek, niezależnie od ich stężenia
w próbce. Podobna zbieżność wyników dotyczy również populacji komórek przecho-
wywanych w zamrażarce. Rycina 4 ilustruje wpływ stężenia izolowanych komórek
jądrowych krwi pępowinowej, krioprezerwowanych i przechowywanych w ciekłym
azocie lub zamrażarce po rozmrożeniu, na odzysk komórek tworzących kolonie krwio-
twórcze
.
Jednakże, odsetek odzysku liczby komórek tworzących kolonie krwiotwórcze
w populacji przechowywanej w temperaturze ciekłego azotu był znamiennie wyższy
niż odsetek odzysku tych komórek w populacji przechowywanej w zamrażarce, nieza-
leżnie od stężenia komórek w próbce. Wyjściowa liczba komórek tworzących kolonie
krwiotwórcze wynosiła 140±85 na 100 000 komórek jądrowych i 15 000 ± 8000 na
0
10
20
30
40
50
60
70
80
90
100
- 196°C
- 80°C
temperatura
o
d
se
te
k
l
ic
zb
y
k
o
m
ó
re
k
t
w
o
rz
ą
cy
ch
k
o
lo
n
ie
k
rw
io
tw
ó
rc
ze
p = 0,0344
K. ILNICKI i wsp.
710
1 ml zawiesiny tych komórek. Obserwowano ponad dwukrotny spadek liczby komórek
tworzących kolonie krwiotwórcze na 100 000 komórek jądrowych pozostających
w zawiesinie, w próbkach przechowywanych w zamrażarce, w porównaniu do próbek
przechowywanych w ciekłym azocie.
0
10
20
30
40
50
60
70
80
90
100
5mln/ml
10 mln/ml
20mln/ml
50mln/ml
stężenie
komórek
o
d
se
te
k
l
ic
zb
y
k
o
m
ó
re
k
j
ą
d
ro
w
y
ch
Komórki przechowywane w temp. - 196°C
Komórki przechowywane w temp. - 80°C
Ryc. 3.
Wpływ temperatury –196
°
C i –80
°
C na odsetek odzysku rozmrażanych komórek jądrowych,
zamrażanych w różnych stężeniach
Fig. 3.
Influence of the temperatures –196
°
C and –80
°
C on the percentage of recuperation of thawed
nuclear cells, frozen in different concentrations
P=0,0387
Wpływ temperatury długotrwałego przechowywania
711
Ryc. 4.
Wpływ stężenia krioprezerwowanych komórek jądrowych przechowywanych w ciekłym azocie
lub w zamrażarce na odsetek odzysku komórek tworzących kolonie krwiotwórcze po ich rozmrożeniu (na
100 000 komórek pozostających w zawiesinie).
Fig. 4.
Influence of concentrations of the cryopreserved nuclear cells stored in liquid nitrogen and freezer
on the percentage of recuperation of the colony forming cells after thawing (per 100 000 cells that remain
in the suspension).
OMÓWIENIE WYNIKÓW
Krew pępowinowa przechowywana w bankach krwi pępowinowej stanowi cenne
uzupełnienie rejestrów szpiku. Do efektywnego przeszczepienia krwi pępowinowej
zapewniającej trwałą odnowę układu krwiotwórczego wymagana jest infuzja co naj-
mniej 3 × 10
7
/kg m.c. biorcy komórek jądrowych, wśród których są obecne komórki
krwiotwórcze [6]. Czynności, które obejmują wyizolowanie komórek jądrowych
z krwi pępowinowej, ich przechowywanie i rozmrażanie muszą być wykonywane w ta-
ki sposób, aby gwarantowały najmniejsze ich straty, zarówno w czasie obróbki, jak też
i wieloletniego przechowywania. Jest to o tyle istotne, że zwykle pobiera się niewielką
0
10
20
30
40
50
60
70
80
90
100
5mln/ml
10mln/ml
20mln/ml
50mln/ml
stężenie
komórek
o
d
se
te
k
l
ic
zb
y
k
o
m
ó
re
k
t
w
o
rz
a
cy
ch
k
o
lo
n
ie
k
rw
io
tw
ó
rc
ze
Komórki przechowywane w temp. - 196°C
Komórki przechowywane w temp. - 80°C
P=0,05384
p = 0,0441
P= 0,0485
P= 0,0362

K. ILNICKI i wsp.
712
objętość krwi pępowinowej (ok. 80 do 150 ml), zawierającą ograniczoną liczbę komó-
rek krwiotwórczych, która wystarcza do ustanowienia krwiotworzenia u dzieci, ale jest
niewystarczającą do odtworzenia układu krwiotwórczego u biorców dorosłych. W tym
ostatnim przypadku dokonuje się przeszczepienia dwóch lub więcej jednostek krwi
pępowinowej [7]. Konieczne jest więc zastosowanie nie tylko wydajnych metod prepa-
rowania krwi pępowinowej, ale także takich sposobów krioprezerwacji i przechowy-
wania wyizolowanych komórek jądrowych, aby ich odzysk i potencjał proliferacyjny
do celów przeszczepienia był jak najwyższy.
Warunki krioprezerwacji komórek jądrowych krwi pępowinowej.
W obecnej pracy użyto dwumetylosulfotlenku (DMSO) jako krioprotektora w stę-
ż
eniu 7,5% w podłożu zawierającym 80% surowicy cielęcej płodowej. Almici i wsp.
[8] i wielu innych autorów stosuje wyższe (10%) stężenie DMSO, natomiast Galmes i
wsp. [9] stosowali niższe (5%) stężenie DMSO. Ahmed i wsp. [10] stosowali miesza-
ninę 5% DMSO i 6% HES. Ballint i wsp. [11] wykazali, że wyższe stężenie DMSO
jest optymalne dla krioprezerwacji bardziej niedojrzałych komórek krwiotwórczych,
natomiast niższe dla komórek już zróżnicowanych (CFU-GM).
Wpływ temperatury długotrwałego przechowywania komórek jądrowych krwi pę-
powinowej na ich przeżycie.
Krioprezerwowany materiał przechowywano w ciekłym azocie w temp. -196°C
oraz w zamrażarce w temp. –80°C. śywotność komórek jądrowych mierzona pochła-
nianiem błękitu trypanu wynosiła po przechowywaniu w ciekłym azocie ponad 80%,
natomiast po przechowywaniu w zamrażarce niecałe 50%. Simon i wsp. (12) uzyskali
wyższe wyniki przeżycia (ok. 80%) krioprezerwowanych limfocytów przechowywa-
nych w zamrażarce. Stiff i wsp. [13] uzyskali wynik przeżycia 70% komórek szpiku
zamrożonych w mieszaninie DMSO i HES po 14 miesiącach przechowywania w tem-
peraturze –80°C. Był to wynik lepszy od wyniku przeżycia (50%) komórek szpiku
zamrożonych w tych samych warunkach i przechowywanych w temp. –170°C przez
okres sześciu miesięcy.
Makino i wsp. [14] uzyskali 90% przeżycia komórek krwiotwórczych pobranych
drogą aferezy z krwi obwodowej a następnie zamrożonych w mieszaninie DMSO i
HES, które przechowywano przez okres 3 miesięcy w temp. -80°C. Feremans i wsp.
[15] uzyskali 75% przeżycia komórek z krwi obwodowej, zamrożonych w obecności
mieszanimy DMSO i HES, przechowywanych do 65 dni w -80°C. Galmes i wsp. [9]
uzyskali 90% przeżycia komórek krwi obwodowej pozyskanych w powyższy sposób,
zamrożonych w obecności 10% DMSO i przechowywanych przez jeden miesiąc. Ra-
tajczak i wsp. [16] uzyskali 84% przeżycie komórek szpiku mrożonych w obecności
10% DMSO, przechowywanych w temp. –80°C. Był to wynik lepszy od wartości od-
setka przeżycia (76%) tych komórek mrożonych w identyczny sposób, lecz przecho-
wywanych w ciekłym azocie.
Przytoczone powyżej wyniki nie są zgodne z wynikami uzyskanymi w obecnej
pracy. Jeszcze wyraźniej ta niezgodność jest zaakcentowana w przypadkach, w których

Wpływ temperatury długotrwałego przechowywania
713
porównywane jest przechowywanie materiału komórkowego w ciekłym azocie i za-
mrażarce (9; 16). Wytłumaczeniem tej niezgodności może być sposób przechowywa-
nia zamrożonego materiału. Autorzy poniższej pracy wykorzystywali do tych celów
pionową zamrażarkę firmy Revco przeznaczoną do ogólnego użytku w laboratorium.
Zamrażarka pionowa tym zasadniczo różni się od zamrażarki poziomej (z klapą po-
ziomą umieszczoną na szczycie), że w momencie otwarcia całe, bardziej gęste i zimne
powietrze wypływa z niej i jest zastępowane powietrzem ciepłym, o mniejszej gęsto-
ś
ci. Niewiele w tym względzie pomocny jest podział wnętrza komory na indywidualnie
zamykane sekcje. Umieszczony w takiej komorze materiał komórkowy podlega kilka-
krotnie w ciągu dnia krótkotrwałym wahaniom temperatury, które wynikają z użytko-
wania zamrażarki., a wahania takie mogą sięgać nawet kilkudziesięciu stopni Celsju-
sza. Nie są one rejestrowane przez urządzenia pomiarowo-kontrolne zamrażarki wyka-
zujące dużą bezwładność. Przechowywany materiał podlega więc wielu cyklom zmian
termicznych, zachodzących, co prawda w temperaturach poniżej 0°C, ale mogących
mieć destrukcyjny wpływ na zamrożone struktury biologiczne komórek jądrowych.
Rowley [17] również zwraca uwagę na destrukcyjny wpływ zmian termicznych zacho-
dzących w kriostatach napełnionych ciekłym azotem, w których materiał umiejscowio-
ny jest w fazie gazowej tego chłodziwa. Dobrym rozwiązaniem problemu zmian ter-
micznych wydaje się być umieszczenie zamrożonych próbek w pudełku ze styropianu
lub poliuretanu przed jego umieszczeniem w zamrażarce.
Wpływ przechowywania krioprezerwowanego materiału w ciekłym azocie i za-
mrażarce na liczbę tworzonych kolonii krwiotwórczych.
Wyjściowa liczby komórek tworzących kolonie krwiotwórcze wynosiła średnio:
142 ± 85 na 100 000 komórek jądrowych. Jest to zgodne z wynikami uzyskanymi
przez Briddella i wsp. [18]. Wpływ na ten znaczny rozrzut mogą mieć, poza zmienno-
ś
cią osobniczą, nawet niewielkie różnice w terminie porodu, chwili przecięcia naczyń
pępowinowych w momencie pobrania krwi, dlatego że wahaniom ulega liczba komó-
rek ukierunkowanych w krwi pępowinowej oraz w krwi noworodka. Liczba komórek
tworzących kolonie krwiotwórcze zmienia się w tym okresie raptownie, na co wskazu-
ją wyniki Broxmeyera i wsp. [1]. Briddell i wsp. [18] określili pojęciem “0 day cultu-
re” hodowlę komórek krwiotwórczych zainicjowaną w dniu wypreparowania frakcji
komórek jądrowych, której wynik służył następnie jako odniesienie do dalszych ekspe-
rymentów.
Przechowywanie zamrożonego materiału w ciekłym azocie i zamrażarce powodo-
wało zmniejszenie liczby komórek tworzących kolonie krwiotwórcze. Odzysk tych
komórek wyniósł od 63 do 81% dla materiału przechowywanego w ciekłym azocie i
od 20 do 45% dla materiału przechowywanego w zamrażarce. Występowała duża
zmienność wyników, ale różnice są statystycznie znamienne. W niektórych indywidu-
alnych przypadkach stwierdzono w obecnej pracy większą liczbę kolonii w hodowlach
z materiału rozmrożonego po przechowywaniu w ciekłym azocie, niż w materiale
wyjściowym nie mrożonym – nigdy nie miało to miejsca w przypadku materiału prze-
chowywanego w zamrażarce.

K. ILNICKI i wsp.
714
Beaujean i wsp. [19] sugeruje możliwość eliminacji poprzez proces krioprezerwa-
cji, komórek supresorowych i w konsekwencji zwiększenie potencjału klonogennego
komórek macierzystych. Ale jednocześnie Nicol i wsp. [20] stwierdzili obniżenie ak-
tywności receptorów dla czynnika wzrostu (GM-CSF) w żywych komórkach macie-
rzystych bezpośrednio po rozmrożeniu. Na tak dużą, obserwowaną zmienność wyni-
ków miała więc z pewnością wpływ duża zmienność wyjściowa liczby kolonii w ho-
dowlach zainicjowanych z materiału nie krioprezerwowanego, a ponadto nakładać się
mogły inne, wzmiankowane wyżej czynniki nie związane bezpośrednio z żywotnością
komórki. Można przypuszczać, że czynniki te dotyczą materiału po krioprezerwacji .
Wpływ metody rozmrażania na liczbę, żywotność i zdolność tworzenia kolonii
krwiotwórczych przez komórki jądrowe krwi pępowinowej.
Materiał przechowywany równolegle w ciekłym azocie w temperaturze -196°C
oraz w zamrażarce w temperaturze -80°C był rozmrażany metodą klasyczną. Liczba
komórek jądrowych po rozmrożeniu była niższa, niż przed zamrożeniem. Wyraźnie
widoczny był wprost proporcjonalny wpływ wzrostu stężenia komórek poddanych
krioprezerwacji na wielkość strat powstających przy rozmrażaniu tą metodą (21). Ob-
serwowane zjawisko dotyczyło w takim samym zakresie komórek przechowywanych
w ciekłym azocie jak i w zamrażarce.
Podsumowując można stwierdzić, że głównym czynnikiem sprawczym zmniejsza-
nia liczby żywych komórek jądrowych zdolnych do tworzenia kolonii krwiotwórczych
jest temperatura przechowywania komórek, a następnym w kolejności czynnikiem jest
zmniejszanie liczby komórek jądrowych wskutek aglutynacji, w zależności od począt-
kowego stężenia tych komórek w zamrożonej próbce. Ponadto, proces zamrażania
komórek jądrowych krwi pępowinowej w różnych stężeniach nie wpływa wybiórczo
na odzysk komórek tworzących kolonie krwiotwórcze w obrębie puli komórek pozo-
stających w zawiesinie użytej do hodowli.
PIŚMIENNICTWO
1.
Broxmeyer HE, Cooper S. High-efficiency recovery of immature hemopoietic progenitor cells with
extensive proliferative capacity from human cord blood cryopreserved for 10 years. Clinical and Ex-
perimental Immunology 1997; 107 Suppl. 1: 45-53.
2.
Paczkowska E. Freezing of umbilical cord blood cells in mechanical freezer (–80ºC) Ann. Acad.
Med Stettin. 2002; 48: 117-133.
3.
Rowley S.D, Bensinger WI, Gooley TA, Buckner C.D. Effect of cell concentration on bone marrow
and peripheral blood stem cell cryopreservation. Blood 1994; 83: 2731-2736.
4.
Mikołajek W. Optimalisation for preparation and expansion of ex vivo human Umbilical Cord Blood
cells for transplantation. Ann. Acad. Med Stettin. 2002; 48: 117 – 133.
5.
Sutherland HJ, Eaves AC, Eaves C.J. Quantitative assays for human hematopoietic progenitor cella.
Bone Marrow Processing and Purging. A Practical Guide Wyd: A.P.Gee, CRC Press Inc. 1991; 155-
171.
6.
Larghero J, Garcia J, Gluckmann E. Sources of procurement of stem cells In Haematopoietic Stem
Cell Transplantation. The EBMT Handbook, 5-th Edition, p. 113-127.
7.
Jędrzejczak W.W, Rokicka M, Urbanowska E, Torosian T, Graczyk-Pol E, Tomaszewska A, Król
M,Paluszewska M, Jołkowska J, Witt M. Simultaneous transplantation of two allogenic unit of cord

Wpływ temperatury długotrwałego przechowywania
715
blood in an adult patient with acute myeloblastic leukemia. A case report. Arch. Immunol. Ther. Exp.
2005; 53: 364–368.
8.
Almici C, Carlo-Stella C, Wagner J.E, Mangoni L, Garau D, Re A, Giachetti R,Cesana C, Rizzoli V.
Clonogenic capacity and ex vivo expansion potential of umbilical cord blood progenitor cells are not
impaired by cryopreservation. Bone Marrow Transplantation 1997; 19: 1079-1084.
9.
Galmes A, Besalduch J, Bargay J, Matamoros N, Morey M, Novo A, Sampol A. A simplified method
for cryopreservation of hematopoietic stem cells with –80°C mechanical freezer with dimethyl sulfox-
ide as the sole cryoprotectant. Leukemia and Lymphoma 1995; 17: 181-184 .
10.
Ahmed T, Wuest D, Ciavarella D, Ayello J, Feldman E.J, Biguzzi S, Gulati S, Hussain F, Mittelman
A, Ascensao J.L, Arlin Z.A. Marrow storage techniques: A clinical comparison of refrigeration versus
cryopreservation. Acta Haematologica 1991; 85: 173-178.
11.
Ballint B, Ivanovic Z, Petakov M, Taseki J, Jovcic G, Stojanovic N, Milenkovic P. The cryopreserva-
tion protocol optimal for progenitor recovery is not optimal for preservation of marrow repopulating
ability. Bone Marrow Transplantation 1999; 23: 613-619.
12.
Simon J.D.; Flinton L.J.; Albala M.M. A simple method for the cryopreservation of human lympho-
cytes at -80
°
C. Transfusion 1977; 17: 23-28.
13.
Stiff P.J, Koestner A.R, Weidner M.K, Dvorak K, Fisher R.I. Autologous bone marrow transplanta-
tion using unfractionated cells cryopreserved in Dimethylsulfoxid and Hydroxyethyl starch without
controlled-rate freezing. Blood 1987; 70: 974-978.
14.
Makino S, Harada M, Akashi K, Taniguchi S, Schibuya T, Inaba S. A simplified method for cryopre-
servation of peripheral blood stem cells at -80°C without rate controlled freezing. Bone Marrow
Transplantation 1991; 8: 239-244.
15.
Feremans WW, Bastin G, Le moine F, Ravoet C, Delville C, Pradier O, Wallef G, Dupont E, Capel P,
Lambermont M. Simplification of the blood stem cell transplantation (BSCT) procedure: large vol-
ume apheresis and uncontrolled rate cryopreservation at -80°C. European Journal of Hematology
1996; 56: 278-282.
16.
Ratajczak M.Z.; Ratajczak J.; Kregenov D.A.; Kuczyński W.; Skórski T.;Gewirtz A.M. Cytokine
stimulation of CD34+ bone marrow cells prior to cryopreservation enhances their post-thawing pro-
liferative potential. Folia Histochemica et Cytobiologica 1994; 32: 149-153.
17.
Rowley S.D. Hematopoietic stem cell cryopreservation. Hematopoietic Stem Cell Transplantation II
Edition 1994; 481-492.
18.
Briddell R, Kern B.P, Zilm KL, Stoney G.B, McNiece IK. Purification of CD34+ cells is essential for
optimal ex vivo expansion of umbilical cord blood cells. Journal of Hematotherapy 1997; 6: 145-
150.
19.
Beaujean F, Bourhis J-H, Bayle C, Jouault H, Divine M, Rieux C, Janvier M, Le Forestier C, Pico
J.L. Successful cryopreservation of purified autologous CD34+ cells: influence of freezing parameters
on cell recovery and engraftment. Bone Marrow Transplantation 1998; 22: 1091-1096.
20.
Nicol A, Nieda M, Donaldson C, Denning-Kendall P. Analysis of cord blood CD34+ cells after
cryopreservation. Experimental Hematology 1995; 23: 1589-1594.
21.
Ilnicki K, Urbanowska E. Występowanie zjawiska spontanicznej agregacji w preparatach kriokon-
serwowanych komórek jądrowych krwi pępowinowej. Acta Haematologica Polonica 2006; 37: 361-
371.
Praca wpłynęła do Redakcji 17.12.2008 r. i została zakwalifikowana do druku 26.06.2009 r.
Adres Autora:
Krzysztof Ilnicki
ul. Augustyna Kordeckiego 75/5
04-355 Warszawa
Tel. 0- 609-407- 300
Wyszukiwarka
Podobne podstrony:
8 6 kwietnia 2011 Wplyw temper Nieznany (2)
145 Wplyw temperatury na organizm drogi oddawania ciepla
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
zadania3-wplyw temperatury na szybkosc reakcji
Wpływ temperatury na organizm
Folie Złącze-PDF F-10 Wpływ temperatury
wpływ temperatury na szybkość przenikania olejków eterycznych
WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI, NAUKA, chemia, lab
Wpływ temperatury
Omówić wpływ temperatury na właściwości diody
Wpływ temperatury i wieku osadu na beztlenową stabilizację
Wpływ temperatury
Wpływ temperamentu na wybory zawodowe, pedagogika psychologia coaching doradztwo
Wpływ temperatury na drobnoustroje, mikrobiologia
Wpływ temperatury na opornosc elektr 12
Wpływ temperatury hartowania na strukturę i właściwości stali 40H, Nauka o materialach
Omówić wpływ temperatury na charakterystyki tranzystora MOS
Wpływ temperatury na parametry wulkanizacji I Właściwości Usieciowanych Mieszanek Kauczukowychx
cw 5 wplyw temperatury na oddychanie tkanek roslinnych
więcej podobnych podstron