
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jacek Hoffman
Stosowanie metali i stopów 311[26].Z1.02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Marian Cymerys
mgr inż. Ryszard Łoin
Opracowanie redakcyjne:
mgr inż. Andrzej Żelasko
Konsultacja:
dr inż. Bożena Zając
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[26].Z1.02
„Stosowanie metali i stopów”, zawartego w modułowym programie nauczania dla zawodu
technik odlewnik.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
4
3. Cele kształcenia
5
4. Materiał nauczania
6
4.1. Struktura krystaliczna metali. Krystalizacja
6
4.1.1. Materiał nauczania
4.1.2. Pytania sprawdzające
4.1.3. Ćwiczenia
4.1.4. Sprawdzian postępów
6
10
10
11
4.2. Struktura stopów. Układy równowagi fazowej
12
4.2.1. Materiał nauczania
4.2.2. Pytania sprawdzające
4.2.3. Ćwiczenia
4.2.4. Sprawdzian postępów
12
17
17
19
4.3. Budowa wykresu żelazo – cementyt. Składniki strukturalne stopów żelaza
z węglem
20
4.3.1. Materiał nauczania
4.3.2. Pytania sprawdzające
4.3.3. Ćwiczenia
4.3.4. Sprawdzian postępów
20
22
22
23
4.4. Charakterystyka stopów żelaza z węglem. Wpływ pierwiastków
stopowych na strukturę i właściwości stali
24
4.4.1. Materiał nauczania
4.4.2. Pytania sprawdzające
4.4.3. Ćwiczenia
4.4.4. Sprawdzian postępów
24
29
29
30
4.5. Klasyfikacja stali węglowych i stopowych, żeliwa i staliwa. Znakowanie
i zastosowanie stopów żelaza z węglem
31
4.5.1. Materiał nauczania
4.5.2. Pytania sprawdzające
4.5.3. Ćwiczenia
4.5.4. Sprawdzian postępów
31
34
34
35
4.6. Metale nieżelazne i ich stopy. Znakowanie i zastosowanie stopów metali
nieżelaznych
36
4.6.1. Materiał nauczania
4.6.2. Pytania sprawdzające
4.6.3. Ćwiczenia
4.6.4. Sprawdzian postępów
36
39
39
40
5. Sprawdzian osiągnięć
41
6. Literatura
46
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik ten będzie Ci pomocny w przyswajaniu wiedzy o stosowaniu metali i stopów.
W poradniku znajdziesz:
−
wymagania wstępne określające umiejętności, jakie powinieneś posiadać, abyś mógł bez
problemów rozpocząć pracę z poradnikiem,
−
cele kształcenia czyli wykaz umiejętności, jakie opanujesz w wyniku kształcenia
w ramach tej jednostki modułowej,
−
materiał nauczania, czyli wiadomości teoretyczne konieczne do opanowania treści
jednostki modułowej,
−
zestaw pytań sprawdzających, czy opanowałeś już podane treści,
−
ćwiczenia zawierające polecenia, Sposób wykonania ćwiczenia oraz wyposażenie
stanowiska pracy, które pozwolą Ci ukształtować określone umiejętności praktyczne,
−
sprawdzian postępów pozwalający sprawdzić Twój poziom wiedzy po wykonaniu
ćwiczeń,
−
sprawdzian osiągnięć opracowany w postaci testu, który umożliwi Ci sprawdzenie
Twoich wiadomości i umiejętności opanowanych podczas realizacji programu danej
jednostki modułowej,
−
literaturę związaną z programem jednostki modułowej umożliwiającą pogłębienie Twej
wiedzy z zakresu programu tej jednostki.
Życzę owocnego korzystania z tego Poradnika.
Schemat układu jednostek modułowych
311[26].Z1
Podstawy technologii odlewniczej
311[26].Z1.01
Stosowanie materia
łów
niemetalowych
311[26].Z1.02
Stosowanie metali
i stopów
311[26].Z1.03
Badanie metali
i stopów
311[26].Z1.04
Wykonywanie obróbki
cieplnej i cieplno-
chemicznej

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
korzystać z różnych źródeł informacji,
−
korzystać z poradników i norm,
−
odczytywać informacje podane na rysunku wykonawczym i złożeniowym,
−
stosować umiejętności opanowane we wcześniejszych jednostkach modułowych,
−
analizować treść zadania, dobierać metody i plan rozwiązania,
−
komunikować się i pracować w zespole,
−
samodzielnie podejmować decyzje,
−
dokonywać oceny swoich umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
scharakteryzować budowę krystaliczną metali,
−
wyjaśnić przebieg studzenia czystego metalu,
−
wyjaśnić przebieg krzepnięcia wlewka,
−
określić czynniki wpływające na przebieg krystalizacji,
−
określić strukturę stopów metali,
−
rozróżnić cechy charakterystyczne mieszaniny faz, związku chemicznego i roztworu
stałego,
−
wyjaśnić pojęcia: likwidus, solidus, punkt eutektyczny oraz przemiana eutektyczna,
perytektyczna, eutoktoidalna,
−
sporządzić wykres równowagi stopów podwójnych na podstawie krzywych chłodzenia,
−
dokonać analizy przemian zachodzących podczas topienia i krzepnięcia stopu
dwuskładnikowego o dowolnie wybranym składzie procentowym,
−
sporządzić krzywe chłodzenia i schematy struktur stopu podwójnego o dowolnie
wybranym składzie procentowym obu składników na podstawie wykresów równowagi,
−
zanalizować wykres żelazo-cementyt,
−
określić składniki i przemiany w stałej temperaturze oraz scharakteryzować fazy
występujące w stopach żelaza,
−
określić wpływ zawartości węgla na właściwości stopów żelaza z węglem,
−
ocenić wpływ składu chemicznego stopów żelaza na ich właściwości technologiczne
i wytrzymałościowe,
−
scharakteryzować wpływ pierwiastków stopowych na właściwości stali, staliwa i żeliwa,
−
rozróżnić gatunki stali, staliwa i żeliwa,
−
przewidzieć zastosowanie stali i żeliw,
−
zidentyfikować gatunek stopu żelaza z węglem na podstawie oznaczenia,
−
sklasyfikować stopy metali nieżelaznych,
−
określić właściwości i zastosowanie stopów metali nieżelaznych,
−
skorzystać z norm, katalogów i poradników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
4. MATERIAŁ NAUCZANIA
4.1. Struktura krystaliczna metali. Krystalizacja
4.1.1. Materiał nauczania
Każdy pierwiastek, w zależności od temperatury i ciśnienia może występować w stanie:
gazowym, ciekłym, stałym.
Pierwiastki w stanie stałym, w zależności od ułożenia atomów mogą występować jako:
−
bezpostaciowe (szkliste),
−
krystaliczne,
Między atomami a także cząsteczkami występują elektrostatyczne siły przyciągania
i odpychania które się równoważą w pewnych warunkach. Ta równowaga warunkuje
ustalenie się odległości między atomami lub cząsteczkami. Siły elektrostatyczne wiążące
atomy lub cząsteczki, zależą od budowy zewnętrznych powłok elektronowych i mogą to być
wiązania:
−
jonowe (heteropolarne, elektrostatyczne),
−
atomowe (kowalencyjne, homopolarne),
−
Van der Waalsa (wiązania międzycząsteczkowe),
−
metaliczne.
Jeżeli pierwiastek ma budowę krystaliczną, to w zależności od wiązania może mieć
kryształy: jonowe, walencyjne, molekularne, metaliczne.
Metale w temperaturze otoczenia (oprócz rtęci) mają budowę krystaliczną , a między
atomami występują wiązania metaliczne tzn. atomy pozbawione pewnych elektronów,
stanowią jony dodatnie i są umiejscowione w węzłach sieci krystalicznej, zaś pewna liczba
elektronów wartościowości porusza się swobodnie między jonami. Te elektrony stanowią
jakby wspólną własność wszystkich atomów i tworzą tzw. gaz elektronowy. Stąd wynikają
charakterystyczne własności metali:
−
dobre przewodnictwo elektryczne,
−
dobra przewodność cieplna,
−
plastyczność,
−
połysk,
−
dobre własności wytrzymałościowe.
Krystaliczna budowa. Atomy metali umieszczone są w węzłach sieci i tworzą komórki
strukturalne. Liczba możliwych kombinacji wzajemnego rozmieszczenia atomów
w przestrzeni, czyli liczba sieci jest ograniczona do 14. Ale większość metali krystalizuje
w trzech podstawowych sieciach (rys. 1):
A1 – sieć płasko- centrowana układu regularnego,
A2 – sieć przestrzennie- centrowana układu regularnego,
A3 – sieć heksagonalna zwarta.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
Rys. 1. Elementarne sieci przestrzenne metali : A1- komórka regularna płasko –centrowana,
A2 – regularna przestrzennie – centrowana, A3 – heksagonalna zwarta [7, s.22].
Tabela. 1.Pierwiastki krystalizujące w sieciach A1, A2, A3, oraz w innych sieciach [7, s.23]
Typy sieci przestrzennych
A1
A2
A3
Inne
Al
Ag
Au
Cu
γFe
βCo
Ni
βCr
Pb
γMn
Ir
Pt
Rh
Pd
Th
αCa
Sr
βCe
Pr
Yb
αFe
αCr
δFe
Mo
W
V
Nb
βZr
Ta
δMn
βTi
Li
Na
K
Rb
Cs
Ba
Eu
βHf
βTl
βU
γLa
βPr
βNd
Zn
Mg
Cd
αBe
αTi
αCo
αZr
Sc
Y
Tc
Ru
αLa
αCe
Nd
Gd
Pb
Dy
Ho
Er
Tm
Lu
Re
Os
αTl
αMn
βMn
Ge
As
Sb
Bi
βSn
αSn
C
Si
Ga
Se
In
Te
Po
Pa
Np
αPr
αNd
W tabeli.1. podano przynależność metali do poszczególnych typów A1, A2, A3, oraz
zestawiono metale krystalizujące w innych sieciach. Niektóre metale z zależności od
warunków fizycznych jak temperatura i ciśnienie, wykazują zdolność przegrupowania swoich
atomów, tworząc odmienne sieci przestrzenne. Zjawisko to nosi nazwę alotropii lub
polimorfizmu. I tak na przykład Feα istniejące w temperaturze otoczenia, krystalizuje w sieci
A2. Natomiast w temperaturze od 906
0
C do 1400
0
C krystalizuje w sieci A1. Powyżej
1400
0
C powraca do sieci A2 formie Feδ. Podczas przejścia metalu z jednej odmiany
alotropowej w drugą, zachodzi skokowa zmiana energii wewnętrznej metalu. Następuje
wydzielanie ciepła przy ochładzaniu i pochłanianie przy ogrzewaniu. Ta ilość ciepła
potrzebna lub wydzielona podczas przemiany nazywa się ciepłem przemiany alotropowej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Krystalizacja jest to przejście metalu ze stanu ciekłego w stan stały, wtedy
nieuporządkowany układ atomów zamienia się w uporządkowany układ sieci krystalicznych.
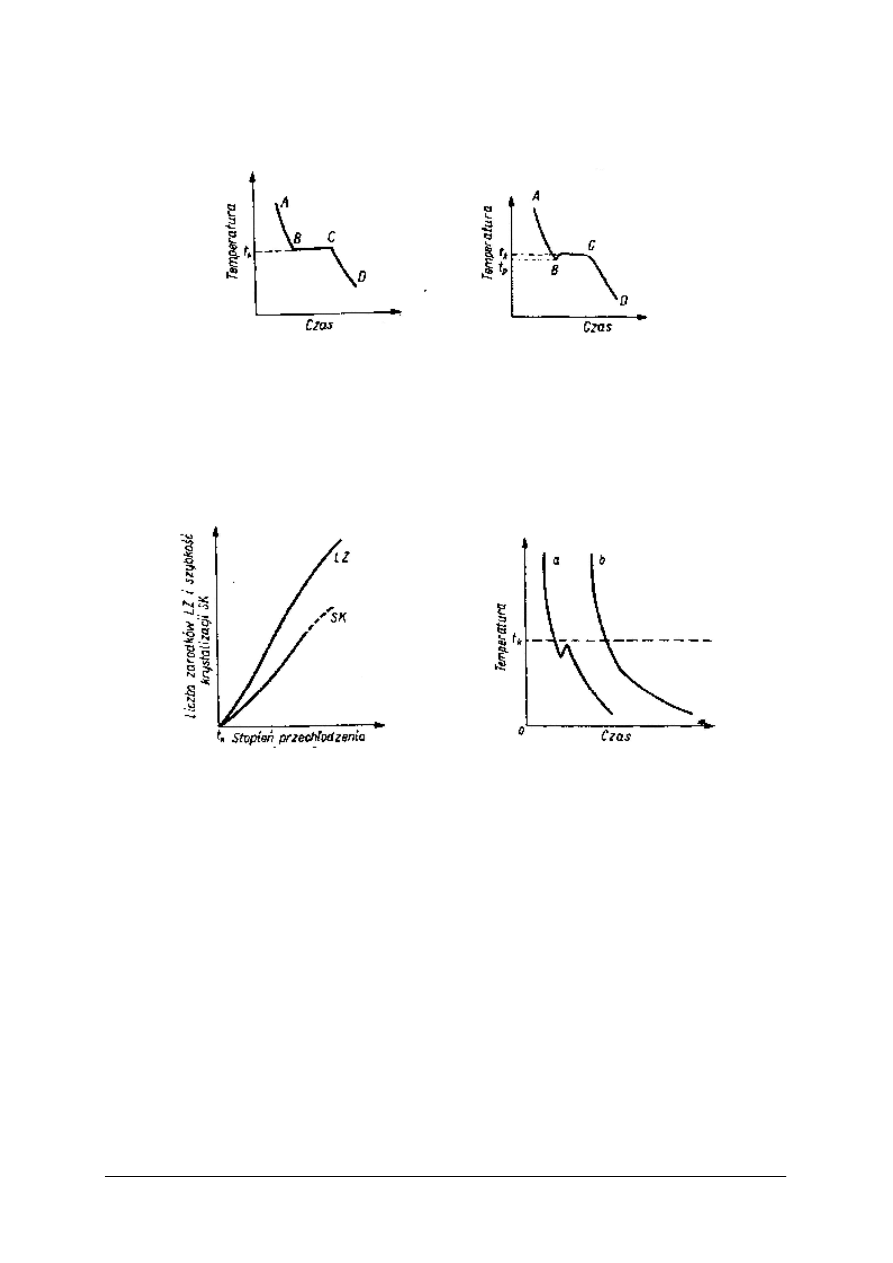
Rys. 2. Teoretyczny przebieg studzenia ciekłego
metalu [8, s. 24]
Rys. 3. Rzeczywisty przebieg studzenia ciekłego
metalu [8, s. 24]
Na rys.2. jest teoretyczny przebieg krzepnięcia czystego metalu. Odcinek AB – stygnięcie
ciekłego metalu, BC – krystalizacja, CD – stygnięcie metalu zestalonego. Rzeczywisty
przebieg krzepnięcia rys. 3, wymaga pewnego przechłodzenia. Im większy jest stopień
przechłodzenia, tym większa jest szybkość krystalizacji SK i większa liczba zarodków LZ
rys.4.
Rys. 4. Wpływ stopnia przechłodzenia metali na liczbę
zarodków LZ i szybkość krystalizacji SK [8, s. 25]
Rys. 5. Rzeczywisty przebieg krystalizacji przy
małej ilości metalu [8, s. 25]
Jeżeli mamy małą ilość metalu, w warunkach laboratoryjnych, to ilość wydzielonego ciepła
może być niewystarczająca do podniesienia temperatury t
p
do t
k
, wtedy przebieg krzepnięcia
przebiega jak na rys.5
Reasumując, na przebieg krzepnięcia i otrzymaną strukturę wpływa:
1. Stopień przechłodzenia
2. Stopień czystości ciekłego metalu
3. Nie rozpuszczone resztki krystaliczne zawarte w ciekłym metalu
4. Wstrząsy mechaniczne (ultradźwięki)
5. Warunki odlewania
Zanieczyszczenia: największy wpływ mają wtrącenia niemetaliczne, które nie rozpuszczają
się w ciekłym metalu. Tworzą one zarodki krystalizacji i otrzymuje się wtedy strukturę
drobnoziarnistą. Takie samo działanie mają gazy pochłonięte przez ciekły metal, wydzielając
się podczas krzepnięcia, lub w wyniku reakcji chemicznej tworzą zarodki krystalizacji. Nie
rozpuszczone resztki kryształów, w stopach żelaza są to grafit, węgliki, azotki, wpływają
podobnie jak zanieczyszczenia na tworzenie się struktury drobnoziarnistej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Wstrząsy mechaniczne również ultradźwięki sprzyjają wydzielaniu się z cieczy gazów
i wtrąceń niemetalicznych, co umożliwia przechłodzenie i powstawanie struktury
drobnoziarnistej.
Krzepnięcie wlewka stalowego
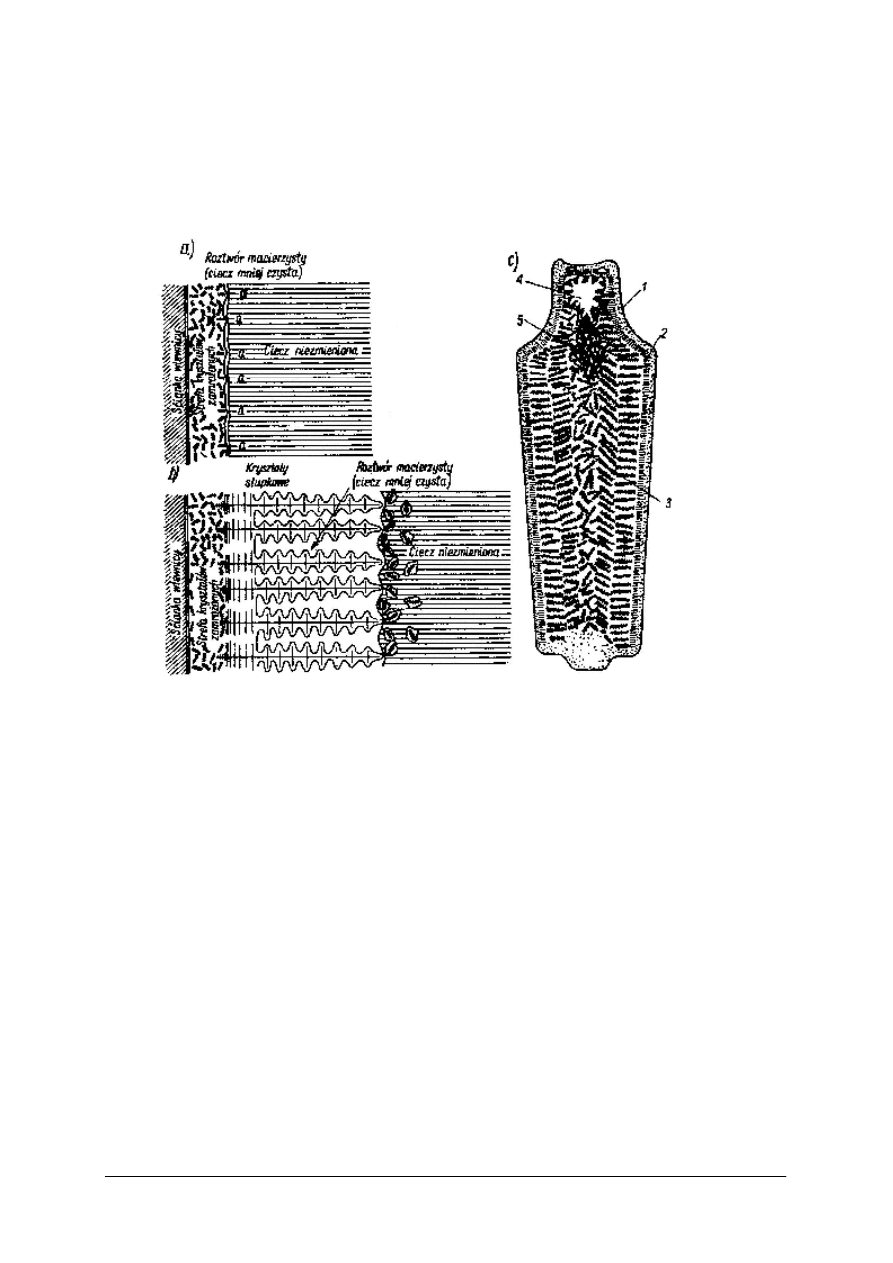
Rys. 6. Krystalizacja stali uspokojonej odlanej do formy: a), b) schemat przebiegu krystalizacji
stali uspokojonej, c) makrografia wzdłużnego przekroju wlewka z tej stali
1 – strefa kryształów zamrożonych, 2 – strefa kryształów słupkowych (transkrystalizacji) , 3 – strefa
kryształów wolnych, 4 – jama usadowa, 5 – pęcherzyki gazowe [8, s. 32]
1. strefa kryształów zamrożonych, na skutek silnego odprowadzania ciepła przez zimne
ścianki formy, metal ulega silnemu przechłodzeniu. Powstaje bardzo wąska, najbardziej
drobnoziarnista strefa we wlewku. Skład odpowiada składowi cieczy.
2. strefa transkrystalizacji, w tej strefie odpływ ciepła jest wyraźnie jednokierunkowy
w stronę ścian formy. Kryształy które są ukierunkowane zgodnie z kierunkiem odpływu
ciepła, narastają najszybciej i w rezultacie otrzymuje się kryształy iglaste skierowane
prostopadle do ścianek formy. Szerokość tej strefy zależy od temperatury odlewania
i szybkości chłodzenia.
3. strefa kryształów wolnych, nie ma tutaj określonego kierunku odpływu ciepła, więc
kryształu rosną najwolniej, mają orientacje chaotyczną, zaś kształt jest równo
wymiarowy.
W czystym metalu, jest mało prawdopodobne występowanie tej strefy z braku
przechłodzenia i zarodków krystalizacji, i kryształy iglaste wyrastają do samego środka.
Kryształy mając większą gęstość od cieczy, opadają na dół, a zanieczyszczenia wypływają ku
górze tworząc tam jamy usadowe 4 i pęcherze powietrza 5.
Zróżnicowanie w składzie chemicznym we wlewku nosi nazwę likwacji lub segregacja
„makro”, w odróżnieniu od segregacji „mikro” która występuje w poszczególnych ziarnach.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Rys.6 przedstawia wlewek ze stali uspokojonej, która jest dobrze odtleniona
i odgazowana, przez co ma bardzo mało pęcherzy gazowych, przeważnie skupionych w jamie
skurczowej. Odtlenienie powoduje zwiększona zawartość krzemu lub aluminium, które wiążą
tlen w postaci tlenków występujących jako wtrącenia niemetaliczne.
W przypadku stali nieuspokojonej, tylko częściowo odtlenionej manganem, podczas
krzepnięcia, bardzo intensywnie wydziela się gaz, powodując jakby wrzenie metalu. Po
zakrzepnięciu, w całej masie występuje duża ilość pęcherzy gazowych i struktura jest
podziurkowana. Jama skurczowa nie tworzy się. Po dalszej obróbce plastycznej pęcherze
ulegają zgrzewaniu oprócz pęcherzy przypowierzchniowych, które otwierając się stanowią
poważną wadę materiału.
W stali półuspokojonej zachodzą podobne zjawiska jak w stali nieuspokojonej, tylko w dużo
mniejszym stopniu. W strukturze jest już dużo mniej pęcherzy powietrza i powstaje niewielka
jama skurczowa.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń
1. Co to jest alotropia?
2. Od czego zależy proces krzepnięcia?
3. Co to są kryształy zamrożone i gdzie one występują?
4. Co to jest strefa transkrystalizacji?
5. Jaką strukturę ma wlewek ze stali nieuspokojonej?
6. W jakiej temperaturze krzepnie badany metal wg tablic temperatur topnienia metali?
7. Na czym polega zjawisko przechłodzenia?
8. Od jakich czynników zależy zapoczątkowanie krzepnięcia?
9. Gdzie występują kryształy zamrożone?
10. Czym się charakteryzuje stal nieuspokojona?
11. Czym się charakteryzuje stal uspokojona?
4.1.3. Ćwiczenia
Ćwiczenie 1
Na podstawie pomiaru temperatury krzepnięcia czystego metalu, narysuj wykres
krzepnięcia dla tego metalu.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) włożyć do pieca tygiel z badanym metalem, rozgrzać do stopienia metalu,
2) włożyć termoelement podłączony do miliwoltomierza do zasklepionej z jednej strony
stalowej rurki,
3) włożyć rurkę z termoelementem (termoelement nie może dotykać dna rurki) do wyjętego
tygla z roztopionym metalem,
4) zapisywać co 10 sekund temperaturę krzepnięcia,
5) po skrzepnięciu metalu, stopić go powtórnie,
6) na podstawie otrzymanych wyników spadków temperatury, wykreślić krzywą chłodzenia
w układzie współrzędnych temperatura – czas.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Wyposażenie stanowiska:
−
piec elektryczny do topienia metali,
−
tygiel,
−
badany metal,
−
urządzenie do pomiaru temperatury (termoelement Ni-NiCr),
−
rurka do termoelementu,
−
miliwoltomierz,
−
stoper,
−
papier milimetrowy.
Ćwiczenie 2
Na podstawie obserwacji makroskopowej, określ strukturę wlewka stalowego.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zaobserwować badane próbki gołym okiem i za pomocą szkła powiększającego,
2) narysować strukturę obserwowanej próbki, określić strukturę i rodzaj stali,
3) zaobserwować badane próbki pod mikroskopem metalograficznym przy niewielkim
powiększeniu od 30x do 100x (pod tym powiększeniem bada się wielkość ziarna),
4) narysować obserwowane próbki, określić rodzaj ziaren, porównać z atlasem
mikrostruktur.
Wyposażenie stanowiska:
−
przygotowane próbki wlewka stalowego ze stali nieuspokojonej i uspokojonej,
−
szkło powiększające,
−
mikroskop metalograficzny o powiększeniu do 100X,
−
atlas mikrostruktur, katalog stali, normy PN dot. stali.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować
pojęcia:
alotropia,
sieć
krystaliczna,
wiązanie
metaliczne?
2) zdefiniować własności metali?
3) rozróżnić strefę kryształów zamrożonych, transkrystalizacji?
4) rozróżnić stal uspokojoną i nieuspokojoną?
5) określić czynniki wpływające na strukturę podczas krystalizacji?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
4.2. Struktura stopów. Układy równowagi fazowej
4.2.1 Materiał nauczania
Stop metali, lub metali z niemetalami (jeżeli posiada cechy metaliczne), otrzymuje się
poprzez stopienie metali, ich wymieszanie i odlanie.
Metale w stanie ciekłym mogą tworzyć:
−
roztwór ciekły, gdy metale rozpuszczają się w sobie całkowicie,
−
roztwór ciekły nasycony, gdy metale rozpuszczają się w sobie częściowo, tworzą wtedy
dwie warstwy: górna, nasycony roztwór metalu cięższego w lżejszym, dolna nasycony
roztwór metalu lżejszego w cięższym,
−
nie rozpuszczają się w sobie, tworzą wtedy dwie warstwy cięższego i lżejszego metalu.
Metale w stanie stałym występują jako:
−
mieszanina czystych składników, gdy nie rozpuszczają się w sobie,
−
roztwory stałe, gdy rozpuszczają się w sobie całkowicie,
−
roztwory stałe ograniczone, lub mieszaniny roztworów stałych nasyconych, gdy
rozpuszczają się w sobie częściowo.
Dwa metale, lub metale z niemetalami, mogą tworzyć inne struktury, takie jak:
−
faza międzymetaliczna, dwa metale tworzą nową sieć, która różni się od sieci obydwu
składników,
−
związek międzymetaliczny, gdy faza metaliczna ma ściśle określony skład i odrębne
własności, różne od własności składników,
−
związek chemiczny, posiada wiązania jonowe zamiast metalicznych i ma wtedy
własności niemetaliczne.
Liczba faz i stopni swobody, przy analizowaniu krzepnięcia stopów metali ma
zastosowanie reguła faz Gibbsa:
S = n – f + 1 gdzie:
S – liczba stopni swobody, ilość czynników które można zmieniać, niezależnie od siebie, bez
zmiany równowagi układu np. temperatura, stężenie poszczególnych faz,
n – liczba składników w stopie,
f – liczba faz, jednakowe części układu które można oddzielić od reszty powierzchniami
rozdziału, mają taki sam skład i strukturę.
Fazy występujące w stopie mogą być jako:
−
metal czysty ciekły, metal czysty stały, odmiany alotropowe, roztwór ciekły, roztwór
stały, fazy międzymetaliczne.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
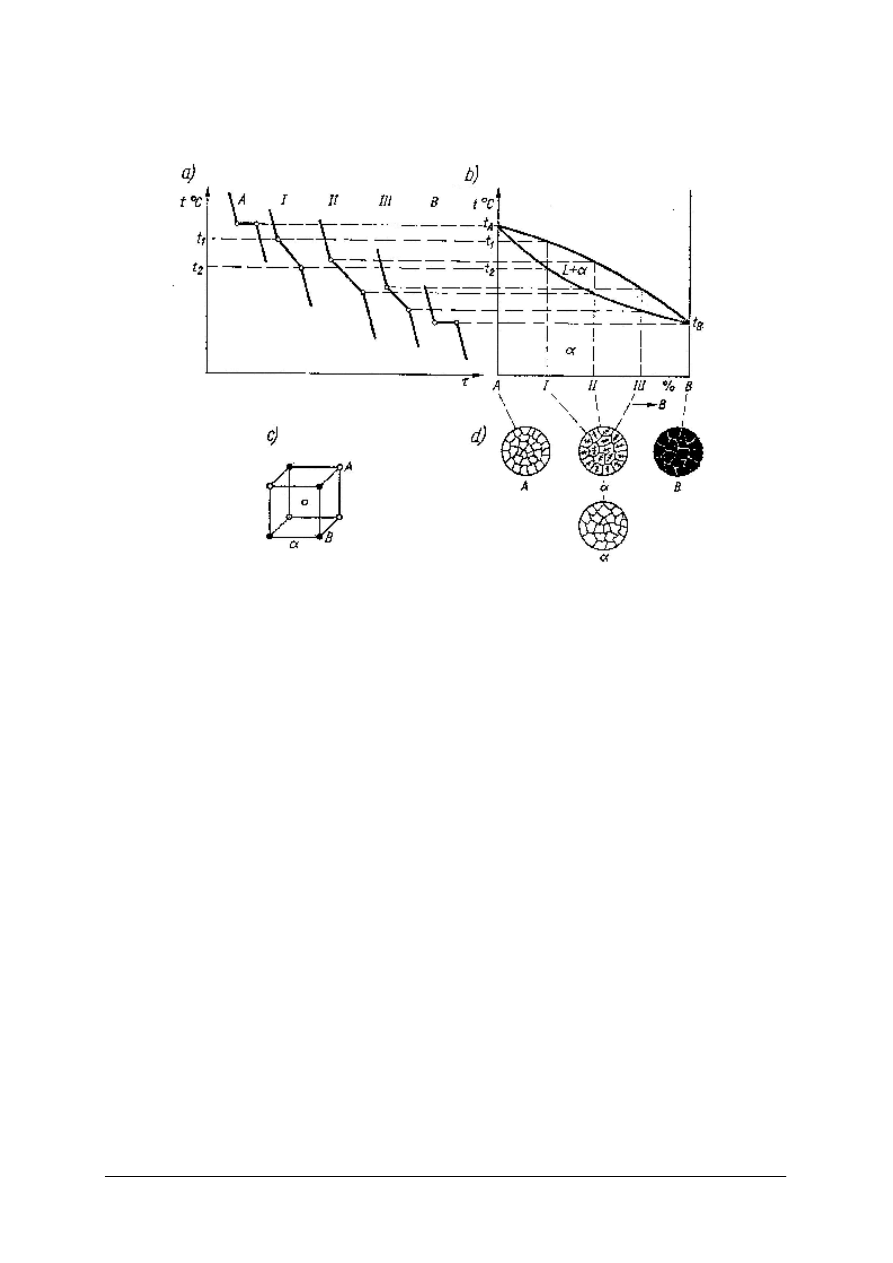
Układ dwuskładnikowy metali z nieograniczoną rozpuszczalnością.
Rys. 7. Układ dwuskładnikowy z nieograniczoną rozpuszczalnością: a) krzywe chłodzenia,
b) układ równowagi fazowej, c) sieć przestrzenna roztworu różnowęzłowego, d) schematy struktur [7, s. 110]
Na rys.7a przedstawione są krzywe chłodzenia metalu A (temperatura topnienia t
A
), metalu B
(temperatura topnienia t
B
), stopu I (75% metalu A i 25% metalu B), który zaczyna krzepnąć
w temperaturze t
1
, a koniec krzepnięcia jest w temperaturze t
2
, łagodniejszy spadek w tym
zakresie spowodowany jest wydzielającym się ciepłem krzepnięcia. Podobnie przebiega
krzepnięcie stopu II (50% A i 50% B), i stopu III (25% A i 75% B). Na podstawie krzywych
chłodzenia powstał wykres równowagi fazowej dwóch metali, które rozpuszczają się w sobie
całkowicie w stanie stałym rys.7b.
Linia górna wykresu, która łączy temperatury początków krzepnięcia wszystkich stopów
nazywa się likwidus, a dolna łącząca temperatury końców krzepnięcia nazywa się solidus.
Reguła faz Gibbsa zastosowana do układu roztworu stałego nieograniczonego.
Nad linią likwidusu jest n=2 (2 składniki, metal A i metal B) i f=1 (roztwór ciekły)
S = n – f + 1 = 2 – 1 + 1 = 2, a więc można zmienić temperaturę i skład ciekłego roztworu,
a równowaga nie zostanie zachwiana, roztwór ciekły będzie trwale istniał.
Podobnie jest pod linią solidusu: n = 2, f =1, więc S = 2 – 1 +1 = 2, można zmieniać
temperaturę i skład roztworu stałego przez dyfuzję, a równowaga układu będzie stała.
Pomiędzy linią likwidusu i solidusu jest n =2, f =2 (roztwór ciekły i roztwór stały)
S = 2 – 2 + 1 = 1, można zmienić tylko jeden czynnik np. temperaturę, a drugi np. skład
roztworu ciekłego lub stałego, zmieni się samorzutnie. W tym polu, zmiana temperatury
powoduje samorzutną zmianę składu poszczególnych faz.
W tabeli2. podano wykaz stopów które tworzą ze sobą roztwory stałe nieograniczone,
a rys.9 pokazuje układ równowagi fazowej roztworów stałych nieograniczonych
z minimum.
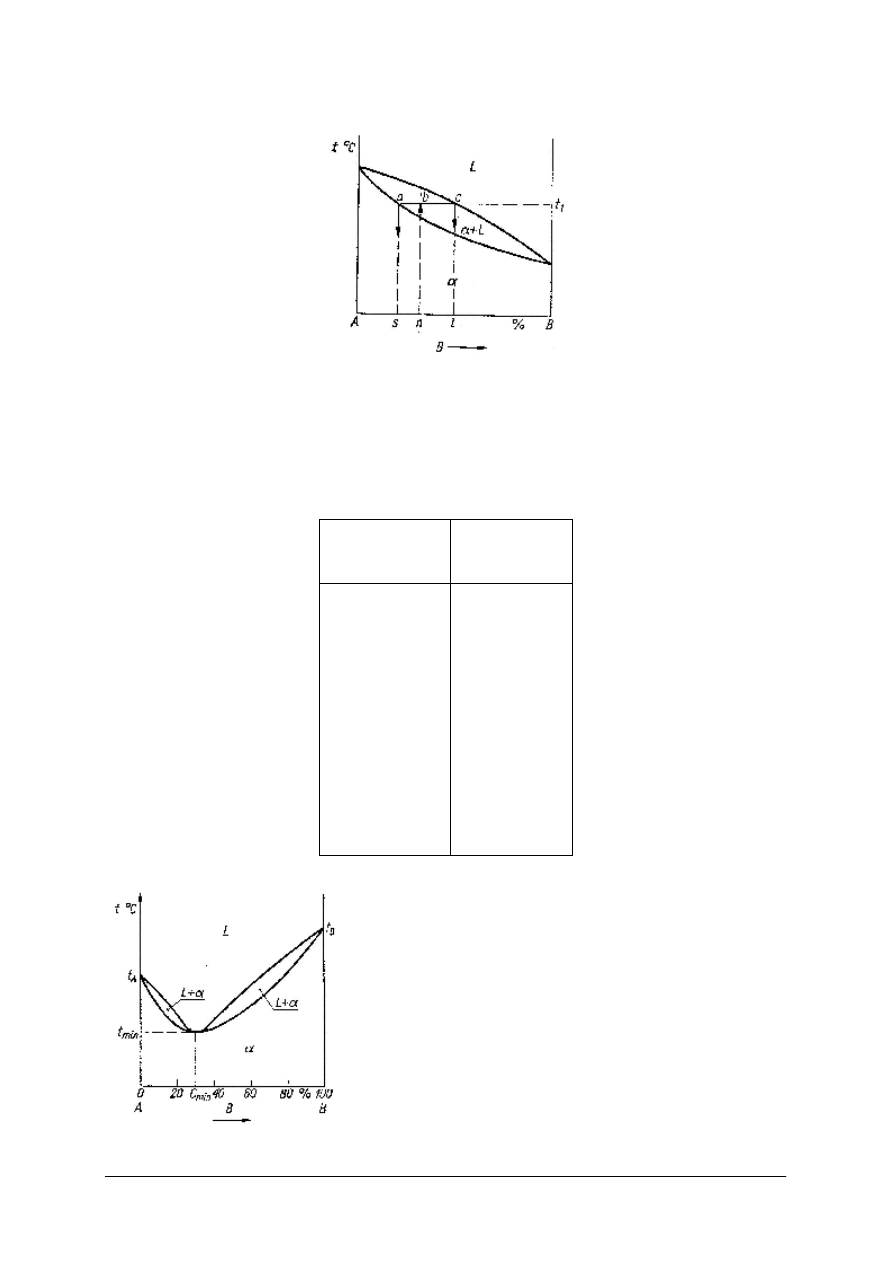
Reguła dźwigni; pozwala określić w danej temperaturze stosunek ilości poszczególnych
faz, czyli ilość roztworu stałego do ilości roztworu ciekłego lub do całości stopu (rys.8).
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Rys. 8. Reguła dźwigni; oznaczanie ilości poszczególnych faz [7, s. 114]
W temperaturze t
1
dla stopu o składzie n istnieją dwie fazy: kryształy roztworu stałego
o składzie s i roztwór ciekły o składzie l. Ilość roztworu ciekłego do roztworu stałego maja się
tak do siebie jak odcinki ab/bc
Tabela. 2. Układy dwuskładnikowe roztworów stałych nieograniczonych [7. s. 115]
Roztwory stałe
nieograniczone
zwykłe
Roztwory stałe
nieograniczone z
minimum
Fe— Cr
Cu— Au
Cu — Mn
Ni— Au
Ni— Pd
Ni— Pt
Cr— Mo
Cr— Ti
Co— Ir
Co— Rh
Sb— As
K— Cs
Rb— Cs
K— Rb
Au— Ag
Au— Pd
Cu— Ni
Cu— Pt '
Cu— Pd
Cd— Mg
Bi— Sb
Ge— Si
Ti— Mo
Ti— Nb
Ti— V
W— Mo
W— Ta
Pt— Ir
Ca— Sr
Rys. 9. Układ dwuskładnikowy z rozpuszczalnością
nieograniczoną, z minimum [7, s. 114]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
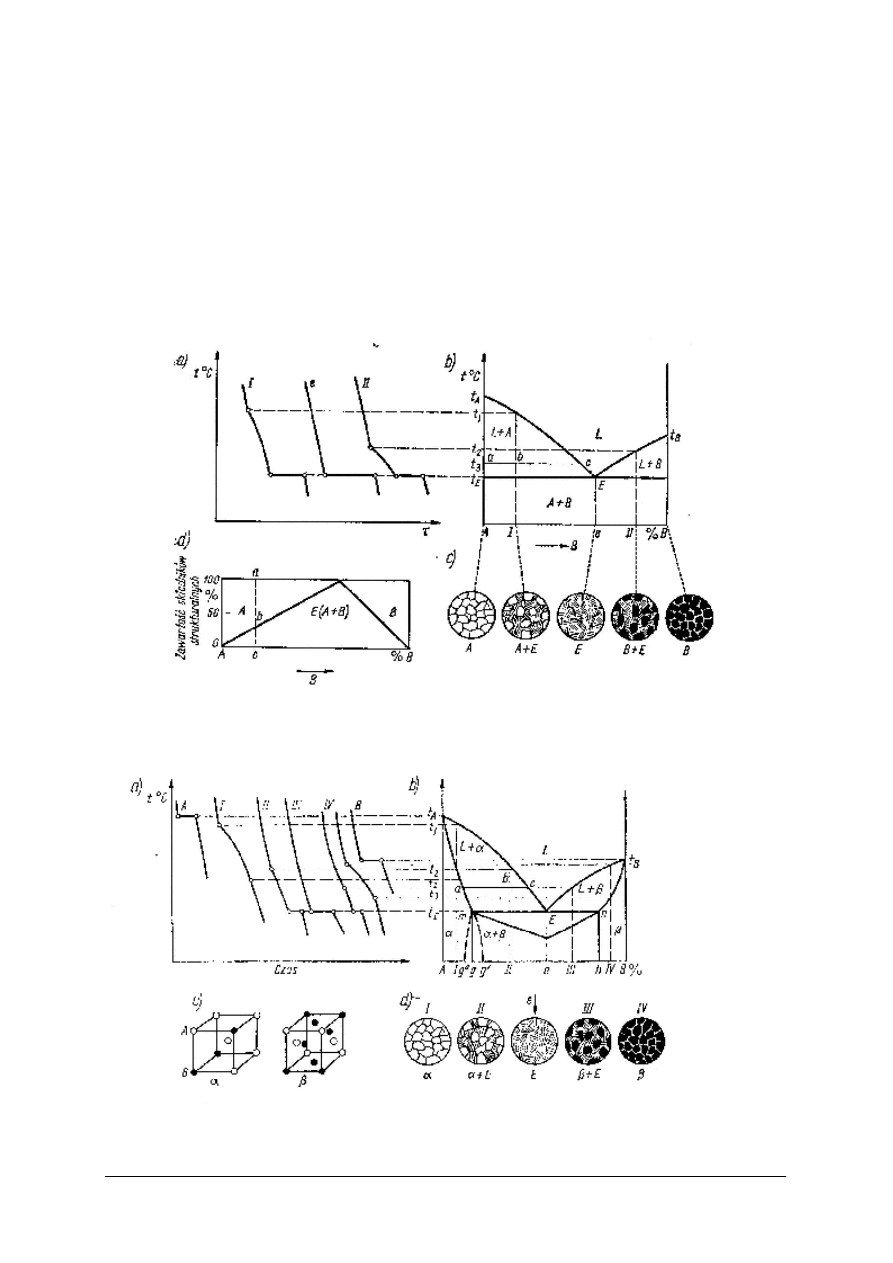
Układ fazowy z eutektyką czystych metali. Jeżeli dwa metale rozpuszczają się w stanie
ciekłym, ale przy krzepnięciu każdy z metali krystalizuje osobno, tworząc ziarna czystego
metalu, to stop wtedy nie jest jednorodny, lecz jest mieszaniną dwóch czystych metali.
Mieszaniny takie wykazują dla pewnego, określonego składu, najniższa i stałą temperaturę
krzepnięcia, zwaną temperaturą eutektyczną, a skład taki nazywa się mieszaniną eutektyczną
lub eutektyką. Jest to najbardziej drobnoziarnista mieszanina, rys.10. Stop I w stanie stałym
składa się z ziaren metalu A rozłożonych w eutektyce E, stop E to drobnoziarnista mieszanina
ziaren metalu A i metalu B, a stop II to ziarna metalu B rozłożone w eutektyce E. Stopy które
leżą po lewej stronie od punktu e nazywa się stopami podeutektycznymi, a po prawej stronie
od e, stopami nadeutektycznymi.
Rys. 10. Układ dwuskładnikowy metali nie rozpuszczających się w sobie; a) krzywe chłodzenia,
b) układ równowagi fazowej, c) schematy struktur, d) zawartość składników strukturalnych [7, s. 116]
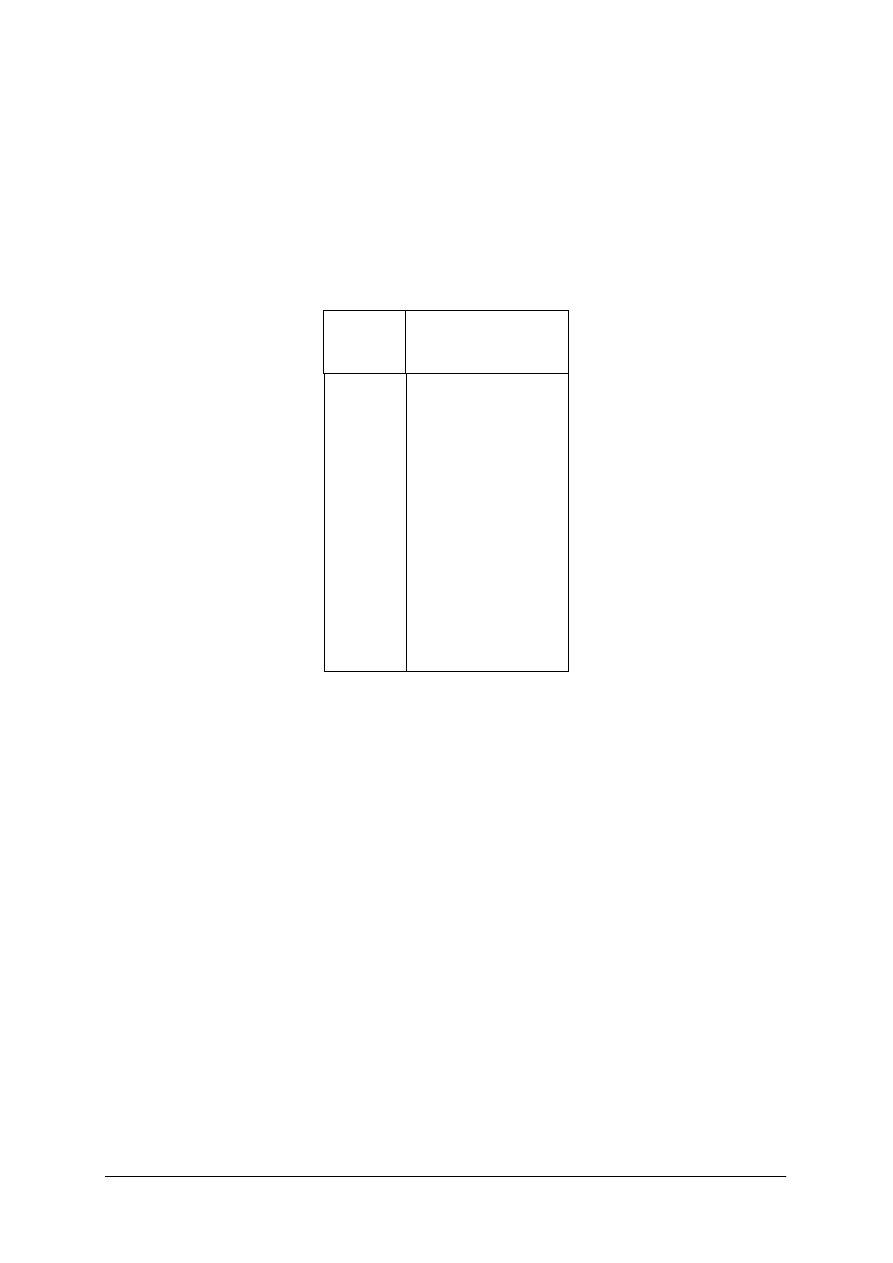
Układ dwuskładnikowy metali z ograniczoną rozpuszczalnością i eutektyką
Rys. 11. Układ dwuskładnikowy metali z ograniczoną rozpuszczalnością i eutektyką: a) krzywe chłodzenia, b)
układ fazowy, c) przykładowe sieci przestrzenne, d) schematy struktur [7, s. 122]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Stop I, w temperaturze otoczenia składa się ziaren roztworu stałego metalu B w metalu A
i posiada siatkę krystaliczną metalu A. Analogicznie jest ze stopem IV, jest to roztwór stały
metalu A w metalu B i siatka jest metalu B. Stop e, to eutektyka, składająca się z drobnych
ziaren roztworu stałego α i β. Stop II to ziarna roztworu α równomiernie rozłożone
w eutektyce. Rozpuszczalność metalu B w A może wzrastać w stanie stałym zgodnie z linią
mg’ lub maleć zgodnie z linią mg” ,co jest częstszym przypadkiem.
W tabeli 3. podano przykłady stopów metali z ograniczoną rozpuszczalnością i z eutektyką.
Tabela. 3. Przykłady układów podwójnych z ograniczoną rozpuszczalnością i z eutektyką [7. s. 122]
Układ
Skład eutektyki w
procentach składnika
drugiego
Ag- Cu
28,1
Ag -Ge
19,0
Ag - Pb
97,5
Ag-- Si
4,5
Al— Be
0,6
Al— Ge
54,0
Al— Si
11,6
Al— Zn
95,0
Au— Bi
82,0
Au — Ge
12,0
Bi— Cd
40,0
Bi— Pb
45,50
Bi— Sn
43,00
Cd— Pb
82,50
Cd— Sn
32,25
Cd— Zn
17,50
Pb— Sb
11,20
Pb— Sn
61,90
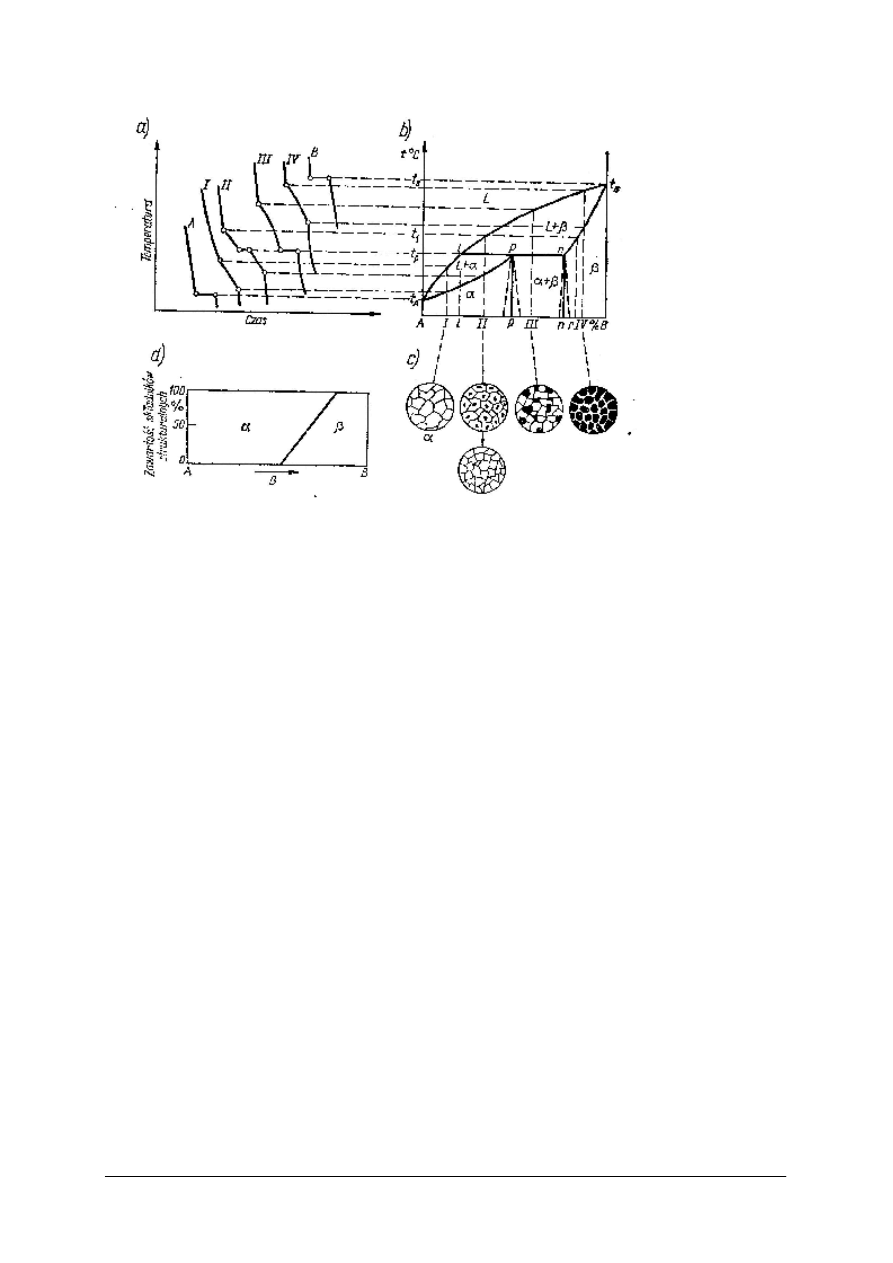
Układ dwuskładnikowy metali z ograniczoną rozpuszczalnością i z perytetyką rys.12
W tym przypadku, rozpuszczalność metalu B w metalu A jest dość duża i dochodzi do składu
p. W stopie II zaczynają krzepnąć kryształy roztworu β, zmieniając swój skład od r do n.
W stałej temperaturze przemiany perytektycznej t
p
zachodzi przebudowa kryształów β
n
w kryształy α
p
wg schematu:
Ll + βn = αp + L
Przemiana perytektyczna zachodzi na granicy dwóch faz, cieczy L i kryształów β. Najpierw
wyczerpują się kryształy β, a pozostała ciecz krzepnie i powstają kryształy α. Przy wolnym
chłodzeniu otrzymuje się jednorodny stop roztworu stałego α. Przy szybkim chłodzeniu
przemiana β w α nie zdąży się zakończyć i otrzymamy wtedy ziarna składające się
z kryształów β otoczonych przez kryształy α. Z racji budowy ziarna perytetyka pochodzi od
słowa „peri” co oznacza po grecku dookoła. Przemiany pozostałych stopów można łatwo
wyjaśnić na podstawie znajomości poprzednich układów dwuskładnikowych.
Układy podwójne w których występuje przemiana perytektyczna to: Al-Mn, Al.-Ti,
Al-Ni, Cd-Sn, Co-Fe, Cu-Sn, Cu-Ti, Cu-Zn, Fe-Mn, Fe-Ni, Mg-Mn, Ni-Zn, Sb-Sn.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Rys. 12. Układ dwuskładnikowy z ograniczoną rozpuszczalnością i z perytetyką: a) krzywe
chłodzenia , b) układ fazowy, c) schematy struktur, d) zawartość składników strukturalnych [7, s. 125]
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń
1. Jak się otrzymuje stopy metali?
2. Jaka jest struktura gdy dwa metale tworzą roztwór stały nieograniczony?
3. Co to jest eutektyka?
4. Co to jest perytetyka?
5. Co określa reguła faz Gibbsa?
6. Co określa reguła dźwigni?
7. W jakiej temperaturze krzepnie Ni i Cu wg tablic temperatur topnienia metali?
8. Co to jest solidus?
9. Co to jest likwidus?
4.2.3. Ćwiczenia
Ćwiczenie 1
Na podstawie pomiaru temperatury krzepnięcia kilku stopów Ni-Cu, narysuj krzywe
chłodzenia dla tych stopów i wykres fazowy.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) włożyć do pieca tygle z badanymi stopami, rozgrzać do stopienia, do zasklepionej
z jednej strony stalowej rurki, włożyć termoelement podłączony do miliwoltomierza,
2) włożyć rurkę z termoelementem (termoelement nie może dotykać dna rurki) do wyjętego
tygla z roztopionym stopem (wykonać te czynności do każdego stopu),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
3) zapisać co 10 sekund temperaturę krzepnięcia dla każdego stopu, po skrzepnięciu stopów
i wykonaniu pomiarów, stopić je powtórnie,
4) wykreślić krzywe chłodzenia w układzie współrzędnych temperatura – czas dla
poszczególnych stopów na podstawie otrzymanych wyników spadków temperatury,
5) narysować wykres fazowy na podstawie krzywych chłodzenia,
6) odczytać z tablic fizycznych temperatury topnienia czystych metali.
Wyposażenie stanowiska:
−
piec elektryczny do topienia metali,
−
tygle,
−
badane stopy: I (25%Cu-75%Ni), II (50%Cu-50%Ni), III (75%Cu-25%Ni),
−
urządzenie do pomiaru temperatury (termoelement Ni- NiCr),
−
rurki do termoelementu,
−
miliwoltomierz,
−
stoper,
−
papier milimetrowy, tablice fizyczne dla metali.
Ćwiczenie 2
Na podstawie pomiaru temperatury krzepnięcia kilku stopów Pb-Sb, narysuj krzywe
chłodzenia dla tych stopów i wykres fazowy.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) włożyć do pieca tygle z badanymi stopami i rozgrzać stop do stopienia,
2) do zasklepionej z jednej strony stalowej rurki, włożyć termoelement podłączony do
miliwoltomierza,
3) włożyć rurkę z termoelementem (termoelement nie może dotykać dna rurki) do wyjętego
tygla z roztopionym stopem (wykonać to do każdego stopu),
4) zapisać temperaturę krzepnięcia co 10 sekund dla każdego stopu,
5) po skrzepnięciu stopów i wykonaniu pomiarów, stopić je powtórnie,
6) wykreślić krzywe chłodzenia w układzie współrzędnych temperatura – czas dla
poszczególnych stopów na podstawie otrzymanych wyników spadków temperatury,
7) narysować wykres fazowy na podstawie krzywych chłodzenia,
8) odczytać z tablic fizycznych temperatury topnienia czystych metali.
Wyposażenie stanowiska:
−
piec elektryczny do topienia metali,
−
tygiel,
−
badane stopy: I (20%Sb-80%Pb), II (40%Sb-60%Pb), III (60%Sb-40%Pb), IV (80%Sb-
20%Pb),
−
urządzenie do pomiaru temperatury (termoelement Ni- NiCr),
−
rurki do termoelementu,
−
miliwoltomierz,
−
stoper,
−
papier milimetrowy, tablice fizyczne dla metali.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4.2.4. Sprawdzian postępów
Czy potrafisz
Tak
Nie
1) zdefiniować pojęcia: likwidus, solidus, eutektyka, perytetyka?
2) zdefiniować fazy występujące w stopach podwójnych?
3) określić ilość i skład faz dla określonego stopu i przyjętej temperatury?
4) rozróżnić eutektykę, perytetykę?
5) rozróżnić stopy podeutektyczne i nadeutektyczne?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.3 Budowa wykresu żelazo – cementyt. Składniki strukturalne
stopów żelaza z węglem
4.3.1 Materiał nauczania
Wykres żelazo – cementyt (węgiel)
Rys. 13. Układ żelazo – cementyt (linia ciągła) i żelazo – grafit (linia przerywana) [7, s. 234]
Układ żelazo – cementyt ma praktyczne zastosowanie do zawartości 2%C (stal), natomiast
układ żelazo – grafit do stopów powyżej 2%C (żeliwa).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Składniki strukturalne stopów żelazo – węgiel.
1. Ferryt; jest to roztwór stały węgla w żelazie α krystalizujący w sieci przestrzennie
centrowanej. Największa rozpuszczalność w temperaturze eutektoidalnej (723
o
C) wynosi
0,02% C, w temperaturze otoczenia zmniejsza się do 0,008% C. W wyższych
temperaturach istnieje ferryt δ o nieco większych parametrach sieci w stosunku do
ferrytu.
2. Austenit; jest to roztwór stały węgla w żelazie γ , krystalizujący w sieci regularnej płasko
centrowanej. Maksymalna rozpuszczalność wynosi 2.06% C w temperaturze 1147
o
C
i maleje wraz z temperaturą do 0,8 % C (w 723
o
C), i jest on trwały powyżej tej
temperatury.
3. Cementyt; związek chemiczny Fe
3
C który krystalizuje z roztworu ciekłego wg linii DC
i jest to cementyt pierwotny. Wydzielający się w stanie stałym z austenitu według linii
ES, jest to cementyt wtórny i wydzielający się z ferrytu, cementyt trzeciorzędowy.
4. Perlit; jest to eutektoidalna mieszanina ferrytu i cementytu, zawierająca 0,8% C węgla
(87% ferrytu i 13% cementytu). Powstaje z rozkładu austenitu w temperaturze 723
o
C.
W stalach wolno chłodzonych ma budowę pasemkową w postaci na przemian ułożonych
płytek ferrytu i cementytu.
5. Ledeburyt; jest to eutektyczna mieszanina austenitu i cementytu, zawierająca 4,3% C
i krzepnie w stałej temperaturze 1147
o
C. Po ochłodzeniu do temperatury 723
o
C
przemienia się w perlit. Poniżej tej temperatury występuje mieszanina perlitu
i cementytu, ale zachowuje charakter ledeburytu i nazywa się ledeburytem
przemienionym
Własności poszczególnych składników podane są w tabeli 4.
Tabela. 4. Własności składników strukturalnych stopów żelaza z węglem [3. str.176]
Rodzaj składnika
Wytrzymałość
na rozciąganie
R m [MPa]
WydłużenieA
[%]
Twardość HB
Ferryt
295
40
80
Austenit (stopowy)
740
50
200
Cementyt
29,5
700
Perlit
800
8-10
200 - 260
Ledeburyt
przemieniony
-------------
-----------
450

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń
1. Jaka może być struktura stali w temperaturze otoczenia?
2. Jaka może być struktura żeliwa w temperaturze otoczenia?
3. W jakiej temperaturze zachodzi przemiana eutektyczna na wykresie Fe- Fe3C?
4. W jakiej temperaturze zachodzi przemiana eutektoidalna na wykresie Fe- Fe3C?
5. Jaka jest temperatura przemiany eutektoidalnej na wykresie Fe- Fe3C i jaki proces
zachodzi w przebudowie struktur?
6. Co to są stopy eutektyczne?
7. Co to są stopy eutektoidalne?
8. Co to są stopy podeutektoidalne?
9. Co to są stopy nadeutektoidalne?
10. Co to jest austenit?
11. Co to jest perlit?
12. Co to jest ferryt?
13. Co to jest cementyt i cementyt wtórny?
4.3.3. Ćwiczenia
Ćwiczenie 1
Opracuj na podstawie wykresu żelazo – cementyt, schemat przemian fazowych
zachodzących podczas chłodzenia dla stopu o zawartości węgla np. 0,04%C; 0,8%C; 1,2%C
3,5%C.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) dla zadanej zawartości węgla w stopie żelaza, na wykresie żelazo-cementyt,
przeanalizować przemiany zachodzące podczas chłodzenia,
2) narysować wykres krzywej chłodzenia dla wskazanego stopu,
3) określić ilość faz i strukturę podczas chłodzenia i w temperaturze otoczenia,
4) znaleźć strukturę danego stopu w zestawie zdjęć typowych struktur.
Wyposażenie stanowiska:
−
wykres układu równowagi fazowej żelazo- cementyt,
−
zestaw zdjęć typowych struktur stopów żelaza.
Ćwiczenie 2
Przygotuj mikroskop, przeprowadź obserwacje, i rozpoznaj badane próbki.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przygotować mikroskop metalograficzny do obserwacji próbek stopów przy
powiększeniu 100X i 500X,
2) przeprowadzić obserwację i wyróżnić fazy oraz strukturę badanej próbki,
3) uszeregować próbki wg wzrastającej zawartości węgla w stopach,
4) określić próbki podeutektoidalne i nadeutektoidalne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Wyposażenie stanowiska:
−
mikroskop metalograficzny,
−
komplet wytrawionych próbek (zgłady) ze stali i żeliwa,
−
zestaw zdjęć typowych struktur,
−
wykres układu równowagi fazowej żelazo-cementyt.
4.3.4.Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: ferryt, austenit, perlit, cementyt, ledeburyt?
2) zdefiniować przemianę eutektyczną i eutektoidalną?
3) określić fazy i zachodzące przemiany dla danego stopu?
4) rozróżnić struktury: ferryt, austenit, perlit, cementyt, ledeburyt?
5) rozróżnić stal podeutektoidalną i nadeutektoidalną?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
4.4. Charakterystyka stopów żelaza z węglem. Wpływ pierwiastków
stopowych na strukturę i właściwości stali
4.4.1. Materiał nauczania
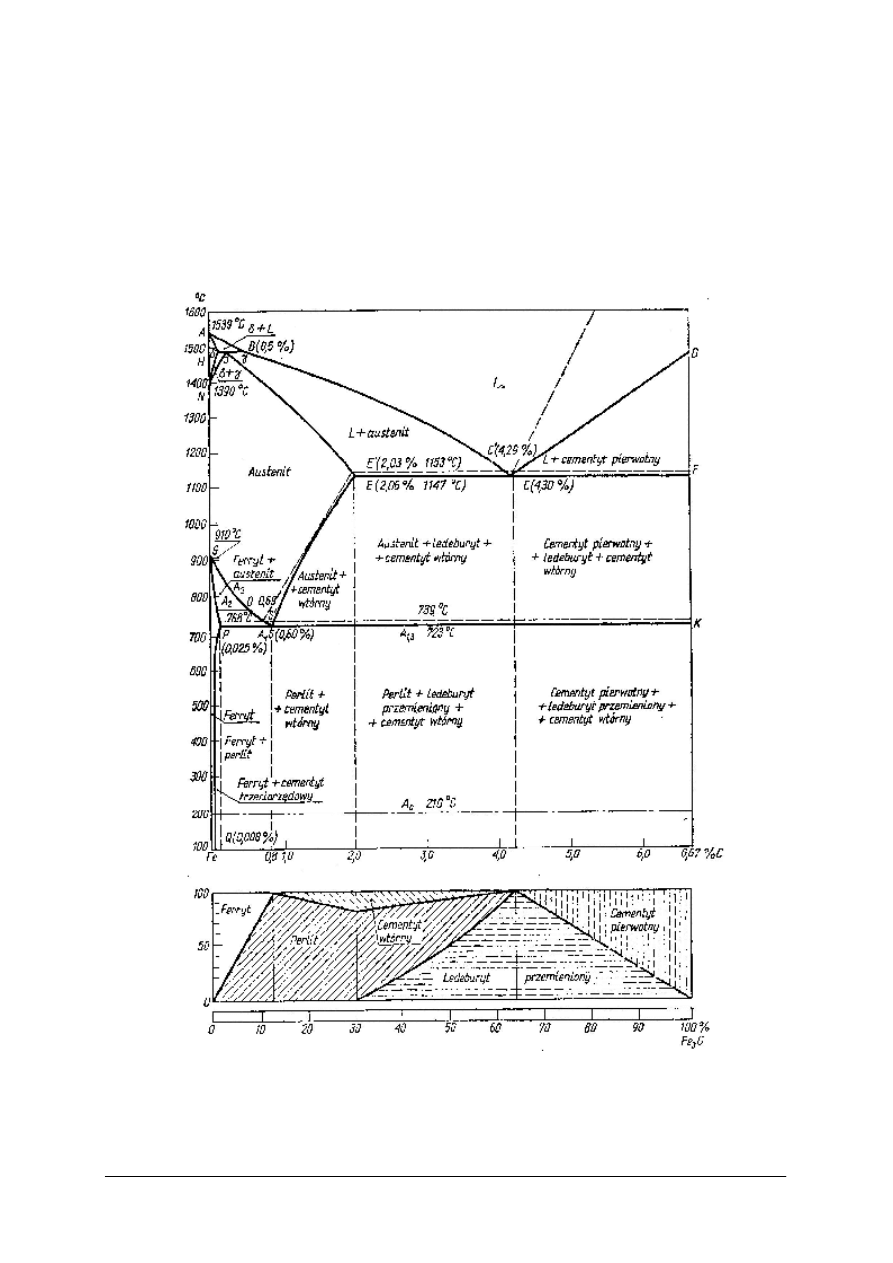
Stal. Rysunek 14 przedstawia własności mechaniczne w zależności od zawartości węgla
w stali. Wraz ze wzrostem zawartości węgla rośnie twardość HB, ponieważ zwiększa się
udział twardego perlitu i cementytu w stopie, natomiast maleje udział miękkiego ferrytu.
Wytrzymałość na rozciąganie R
m
wzrasta do momentu gdy pojawia się nadmiar kruchego
cementytu który zmniejsza wytrzymałość. Wysoka udarność U, wysokie wydłużenie A,
i przewężenie Z, zależą od dużej zawartości ferrytu który występuje przy niskiej zawartości
węgla.
Rys.14. Wpływ węgla na własności mechaniczne stali [7, s. 267]
W stalach węglowych istnieją jeszcze inne pierwiastki, które w różny sposób wpływają
na własności mechaniczne stali. Dopuszczalna zawartość tych składników dla stali węglowej
nie może przekraczać ilości przedstawionej w tabeli 5.
Tabela. 5.Maksymalna zawartość składników stopowych w stalach węglowych [7.str.266]
Maksymalna zawartość %
Mn
Si
Ni
Cr
W
Co
Cu
Al
Mo
V
Ti
0,8
0,4
0,3
0,3
0,2
0,2
0,2
0,1 0,05 0,05 0,05
Podstawowymi składnikami występującymi w każdej stali są:
Mangan Mn, odtlenia i odsiarcza stal, część manganu występuje w postaci siarczków MnS.
Mangan rozpuszcza się w ferrycie dając roztwory różnowęzłowe i w cementycie dając
(FeMn)
3
C. Nie uwidacznia się w postaci oddzielnych faz. Zniekształca sieć, co powoduje
zwiększenie wytrzymałości.
Krzem Si, odtlenia stal. Rozpuszcza się w ferrycie dając roztwór rożnowęzłowy. Podnosi
wytrzymałość i twardość.
Fosfor, Cała ilość rozpuszcza się w ferrycie, zwiększa wytrzymałość i twardość, ale
powoduje w stali tzw. „kruchość na zimno”. Ułatwia obrabialność stali.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Siarka występuje w postaci wtrąceń siarczkowych, otacza ziarna austenitu w postaci
siatki i powoduje tzw. „ kruchość na gorąco” co uniemożliwia obróbkę plastyczną stali
w wyższych temperaturach. Natomiast ułatwia obróbkę mechaniczną (stal automatowa).
Stal stopowa, jeżeli któryś ze składników w tabeli 5. przekracza wartości tam
wymienione, wtedy otrzymujemy stal stopową. Poszczególne składniki stopowe działają:
Chrom zwiększa twardość i wytrzymałość stali, podnosi temperaturę hartowania i sprzyja
hartowaniu głębokiemu. Stal chromowa jest odporna na ścieranie. Stale o zawartości chromu
ponad 13-18% mają zwiększoną odporność na korozję atmosferyczną (stale nierdzewne)
Chrom jest podstawowym dodatkiem stali żaroodpornych,
Mangan zwiększa wytrzymałość i sprężystość stali i sprzyja hartowaniu głębokiemu.
Stale manganowe o zawartości 10 do 15% manganu są odporne na uderzenia i ścieranie. Po
hartowaniu nie zmieniają wymiarów
Krzem wpływa na zwiększenie sprężystości stali Stale krzemowe o zawartości 0,5–1,8%
krzemu stosuje się na sprężyny i resory.
Wolfram zwiększa twardość stali. Stale wolframowe o zawartości 8–22% wolframu są
odporne na zużycie w wysokich temperaturach. Temperatura topnienia wolframu około
3410
0
C jest najwyższą dla wszystkich pierwiastków (z wyjątkiem węgla).
Molibden sprzyja głębokiemu hartowaniu, jego działanie jest prawie dwukrotnie
silniejsze niż chromu i utrzymuje dużą, wytrzymałość stali w wysokich temperaturach.
Kobalt zwiększa twardość i wytrzymałość stali oraz odporność na wysokie temperatury.
Wanad wpływa na zwiększenie hartowności stali, tworzy trwałe i liczne węgliki. Jest
składnikiem stali sprężynowych najwyższej jakości, stali stopowych narzędziowych do pracy
na zimno i na gorąco.
Tytan jest silnie węglikotwórczy, dodaje, się go do stali kwasoodpornych.
Aluminium dodaje się jako składnik stali przeznaczonej do azotowania.
Bor wybitnie zwiększa hartowność stali (260 razy większy wpływ niż wpływ niklu, 90
razy większy niż chromu, 70 razy większy niż molibdenu, 40 razy większy niż manganu).
Dodaje się go zaledwie około 0,003%.
Staliwo jest to stal stosowana w stanie lanym w postaci gotowych przedmiotów
w odróżnieniu od stali którą otrzymuje się w wyniku obróbki plastycznej.
Własności mechaniczne odlewów staliwnych zależą w dużym stopniu od grubości ścianek.
Zarówno R
m
jak i Z maleją wraz ze wzrostem grubości ścianki Wytrzymałość staliwa jest
wyższa niż żeliwa, a cechy plastyczne znacznie wyższe, tak że obecnie staliwa po obróbce
cieplnej często dorównują własnościom stali kutej lub walcowanej. Staliwo nie ma takiej
zdolności pochłaniania drgań jak żeliwo i ma większą wrażliwość na karby.
Staliwa niskowęglowe (C = 0,12–0,25%) są dobrze spawalne i ciągliwe, stosuje się je na
części mało obciążone, jak: podstawy, pokrywy, kadłuby silników elektrycznych, części
taboru kolejowego, mało obciążone części samochodów, niektóre części do nawęglania i inne.
Staliwa ze średnimi zawartościami węgla (C = 0,22–0,45%) są spawalne, lecz po spawaniu
wymagają obróbki cieplnej. Stosuje się je na części bardziej obciążone jak: koła biegowe,
łańcuchowe, liniowe, podstawy maszyn i inne.
Staliwa wysokowęglowe (C = 0,42–0,60%) są trudno spawalne, natomiast odporne na
ścieranie. Stosuje się na części maszyn, odporne na ścieranie i silnie obciążone, jak koła
zębate i inne.
Żeliwo jest to stop żelaza z węglem o zawartości powyżej 2%C Węgiel może
występować w postaci związanej z żelazem lub w postaci nie związanej. W połączeniu
z żelazem tworzy on cementyt, który nadaje żeliwu w przełomie barwę białą, błyszczącą.
Z tego powodu żeliwo zawierające węgiel w postaci związanej nazywamy żeliwem białym.
Węgiel nie związany występuje w żeliwie w postaci grafitu. Nadaje on żeliwu w przełomie
barwę szarą. Dlatego żeliwo zawierające węgiel w postaci nie związanej nazywamy żeliwem

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
szarym. Jeżeli w żeliwie szarym cała zawartość węgla występuje w postaci nie związanej
z żelazem, to takie żelazo ma budowę ferrytyczną, to znaczy, że składnikami takiego żeliwa
są ferryt i grafit. Bardzo często tylko część węgla w żeliwie jest związana z żelazem.
Wówczas powstaje struktura żeliwa szarego ferrytyczno-perlitycznego. Składnikami struktury
takiego żeliwa będą ferryt, perlit i grafit. Ilość związanego węgla może w pewnych
przypadkach osiągnąć wartość odpowiadającą ilości węgla w strukturze perlitycznej.
Wówczas powstaje żeliwo perlityczne, którego strukturę tworzą perlit i grafit.
Jeżeli w żeliwie obok miejsc o budowie żeliwa szarego występują miejsca o budowie żeliwa
białego, wówczas nazywamy je żeliwem połowicznym lub pstrym.
Żeliwa zawierające znaczne ilości składników stopowych mogą mieć budowę martenzytyczną
lub austeniczną.
Struktura żeliwa jest zależna głównie od składu chemicznego oraz od szybkości chłodzenia.
Żeliwa zawierające małe ilości krzemu oraz żeliwa szybko chłodzące uzyskują strukturę
żeliwa białego. Wzrost zawartości krzemu w żeliwie sprzyja wydzielaniu się grafitu, czyli
grafityzacji. Podobnie wpływają również i inne domieszki, np. aluminium i nikiel. Mangan
i siarka, wpływają odmiennie niż krzem na rodzaj struktury żeliw. Domieszki te utrudniają
grafityzację, czyli sprzyjają powstawaniu cementytu, wskutek czego przy dostatecznej ilości
tych domieszek można otrzymać żeliwo białe.
Grafit w żeliwie przybiera różne kształty. Na szlifie metalograficznym można wyróżnić kilka
typowych odmian grafitu, np.: iglasty, gwiazdkowy, pasemkowy oraz sferoidalny.
Żeliwo szare występuje w nim grafit w postaci iglastej lub pasemkowej. Takie kształty
grafitu w znacznym stopniu zmniejszają wytrzymałość żeliwa wskutek działania karbu
i osłabienia przekroju. Z tego powodu w celu zmniejszenia szkodliwego wpływu grafitu na
wytrzymałość żeliwa staramy się rozdrobnić płytki grafitu. Osiąga się to przez modyfikację
żeliwa.
Żeliwo szare modyfikowane jest to odmiana żeliwa szarego otrzymana przez
wprowadzenie do ciekłego żeliwa pewnych dodatków, zwanych modyfikatorami. Najczęściej
do tego celu stosuje się rozdrobniony żelazokrzem, stopy wapnia z krzemem lub stopy
aluminium, krzemu i żelaza. Modyfikacja powodująca rozdrobnienie grafitu wpływa na
poprawę własności wytrzymałościowych żeliwa, zwłaszcza wytrzymałości na rozciąganie.
Rozdrobnienie grafitu w żeliwie szarym przyczynia się do znacznego wzrostu wytrzymałości
na rozciąganie tego materiału. Żeliwo modyfikowane odznacza się nie tylko dobrymi
własnościami wytrzymałościowymi, lecz ponadto ma zdolność tłumienia drgań. Z tego
powodu ma ono zastosowanie tam, gdzie konstrukcje są narażone na różnego rodzaju
wstrząsy. Żeliwo modyfikowane stosuje się na koła zębate, części maszyn pracujące przy
zmiennych obciążeniach itp.
Żeliwo szare sferoidalne. Przez odpowiednią modyfikację żeliwa szarego w stanie
ciekłym można uzyskać grafit kulisty. Osiąga się to przez dodanie do ciekłego żeliwa stopu
magnezu z niklem lub stopu magnezu z miedzią i niekiedy żelazokrzemu. Żeliwo takie ze
względu na sferyczny kształt grafitu nazywa się sferoidalnym. Grafit sferoidalny (ziarnisty)
może występować na podłożu perlitycznym lub ferrytycznym.
Żeliwem sferoidalnym perlitycznym nazywamy takie żeliwo szare, w którym grafit ma kształt
sferoidalny, a osnowę stanowi w przeważającej części perlit. Zależnie od zawartości fosforu
w żeliwie rozróżniamy żeliwo sferoidalne perlityczne o normalnej zawartości fosforu
(poniżej 0,15%) oraz żeliwo sferoidalne perlityczne o zwiększonej zawartości fosforu (zwykle
0,20–0,30% fosforu). Z żeliwa sferoidalnego wyrabia się obecnie koła zębate, wały
wykorbione, wałki rozrządcze, korpusy maszyn, cylindry silników spalinowych, pierścienie
tłokowe itp. części maszyn i urządzeń.
Przy doborze gatunku żeliwa sferoidalnego kierujemy się zasadą, że żeliwo sferoidalne
ferrytyczne stosujemy tam, gdzie części maszyn powinny wykazywać pewną plastyczność

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
i odporność na uderzenia, a żeliwo sferoidalne perlityczne tam, gdzie części maszyn powinny
się odznaczać wytrzymałością na rozciąganie, twardością i odpornością na ścieranie.
Żeliwo ciągliwe powstaje przez obróbkę cieplną żeliwa białego. Obróbka cieplna
przeprowadzona w celu zmiany żeliwa białego na żeliwo ciągliwe polega na długotrwałym
wyżarzaniu odlewu w temperaturze 800–1000
0
C. Zależnie od rodzaju atmosfery, w której
przeprowadza się wyżarzanie, powstaje żeliwo ciągliwe białe lub czarne.
Żeliwo ciągliwe białe powstaje podczas wyżarzania w atmosferze utleniającej. Przełom
powstałego w takich warunkach żeliwa jest jasny, a materiał uzyskuje pewne, niewielkie
zresztą, własności plastyczne.
Żeliwo ciągliwe czarne powstaje podczas wyżarzania żeliwa białego w atmosferze
obojętnej. Charakteryzuje je w przełomie ciemna barwa, spowodowana rozkładem cementytu
i wydzielaniem się węgla żarzenia, który może przybierać różne kształty.
Żeliwa stopowe. Największy wpływ na budowę surówek i żeliw mają: skład chemiczny
i szybkość chłodzenia. Pewne składniki, jak krzem, nikiel, aluminium, sprzyjają wydzielaniu
się grafitu, a przez to powstawaniu surówki lub żeliwa szarego, natomiast inne, jak mangan,
siarka, sprzyjają wydzielaniu się cementytu, a przez to powstawaniu surówki lub żeliwa
białego. Poza tym powolne studzenie sprzyja wydzielaniu się grafitu, czyli powstawaniu
surówki lub żeliwa szarego, natomiast szybkie sprzyja wydzielaniu się cementytu, czyli
powstawaniu surówki lub żeliwa białego. Wpływ dodatków stopowych na wytrzymałość
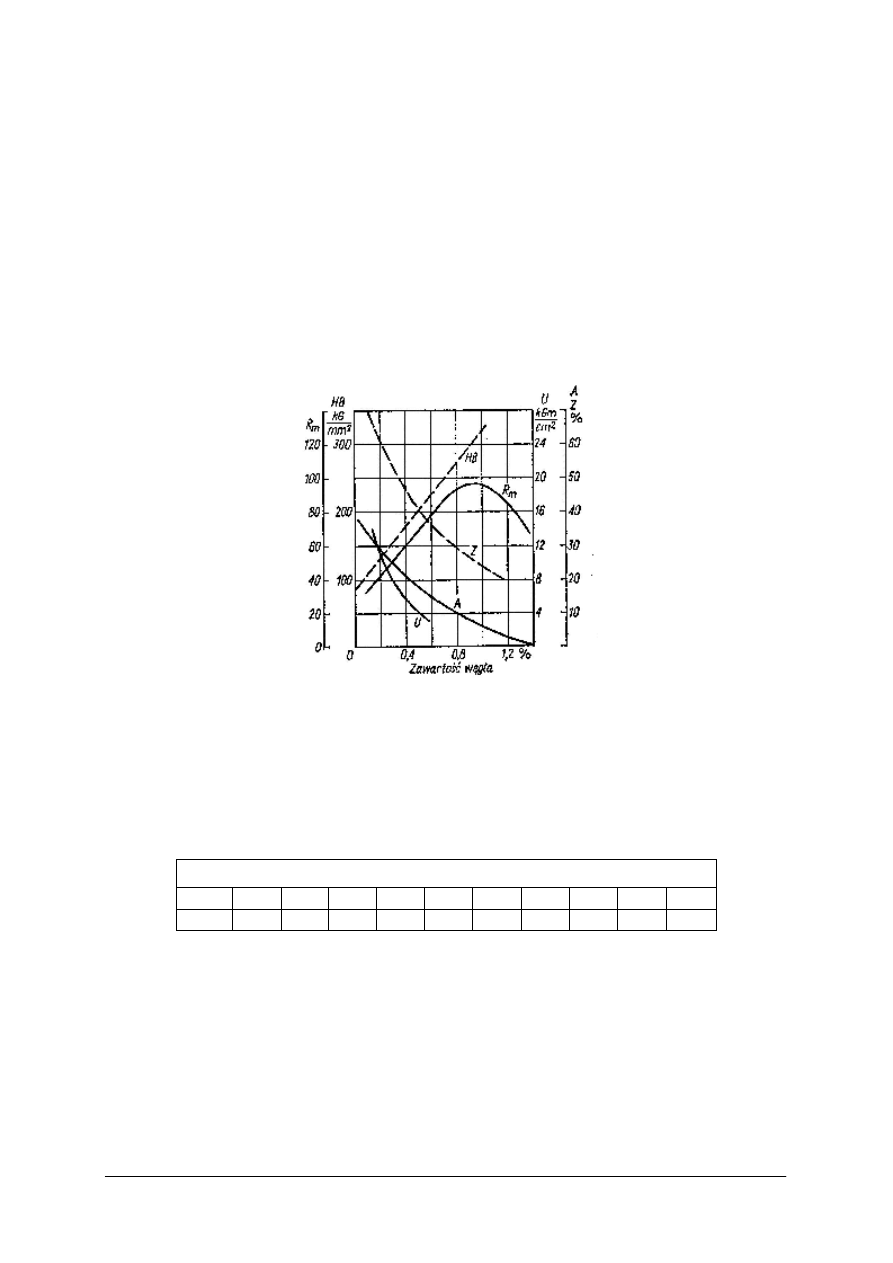
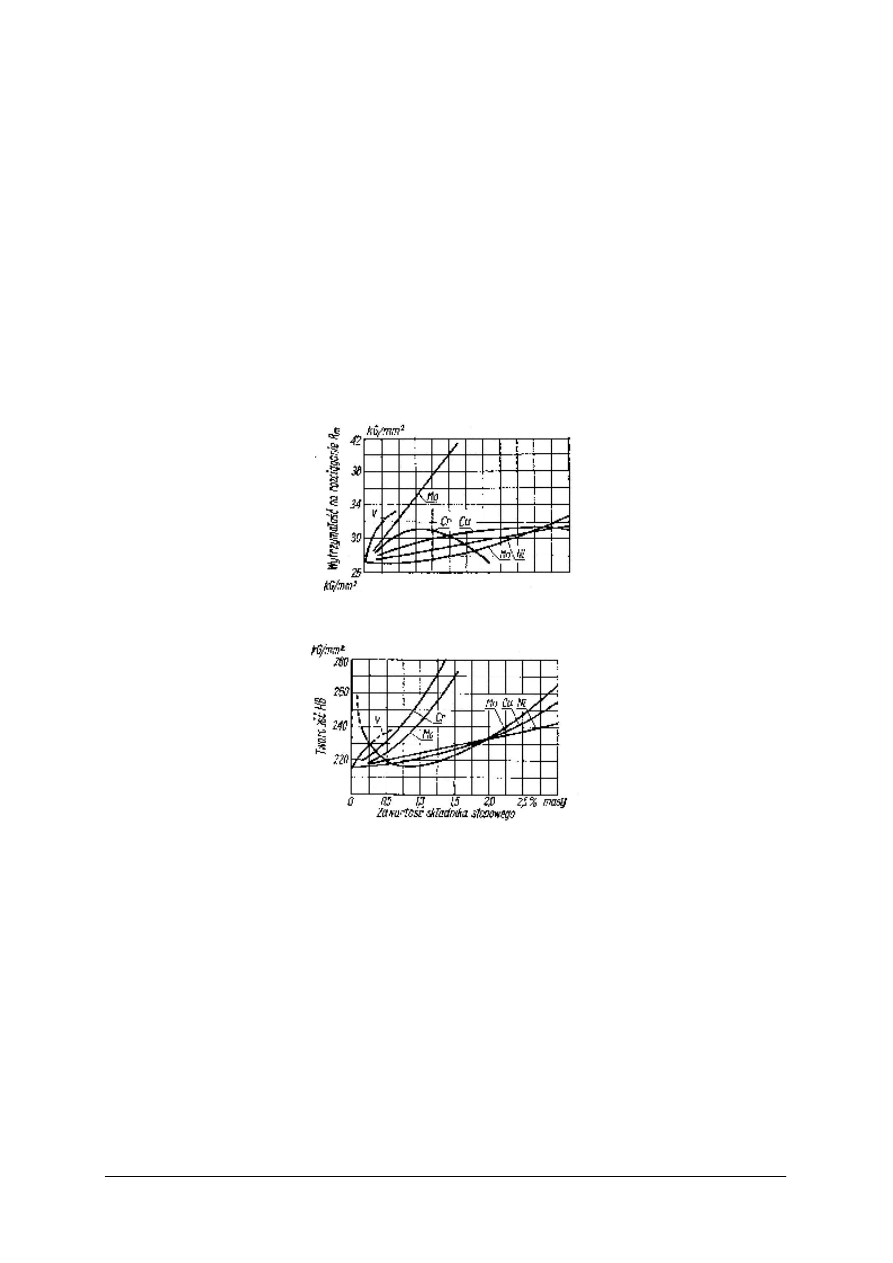
żeliwa i twardość obrazuje Rys. 15 i Rys. 16.
Krzem najczęściej występuje w surówkach i żeliwach w ilości 0,3–3%, chociaż
w specjalnych żeliwach kwasoodpornych jego zawartość może dochodzić nawet do 18%.
Sprzyja on wydzielaniu się grafitu i powstawaniu surówki lub żeliwa szarego, przy. czym od
stosunku węgla do krzemu zależy czy osnowa składa się z samego perlitu, czy z perlitu
i ferrytu, czy nawet z samego ferrytu. Sam krzem rozpuszcza się w pewnym stopniu
w ferrycie, tworząc roztwór stały, zwany ferrytem krzemowym. Budowa żeliwa zależy
również od grubości ścianek odlewu. W odlewach o cienkich ściankach, na skutek szybkiego
chłodzenia, otrzymuje się żeliwo białe, w odlewach o nieco grubszych ściankach, a więc
również przy nieco powolniejszym chłodzeniu − żeliwa pstre, a w odlewach o jeszcze
grubszych ściankach, więc i powolnym, chłodzeniu − żeliwo szare z tym, że wzrost grubości
ścianek odlewu sprzyja skłonności do tworzenia się surówki szarej o osnowie ferrytycznej.
Mangan występuje w żeliwie zwykle w ilościach 0,3–1,2%, a w żeliwie utwardzonym
również w większej ilości. Wpływa na wydzielanie się węgla pod postacią cementytu.
Mangan znajdujący się w żeliwie ciekłym działa odsiarczające, przy czym utworzone siarczki
manganu częściowo wypływają na powierzchnię jeszcze ciekłego żeliwa i tam łączą się
z innymi składnikami żużla, częściowo zaś pozostają w żeliwie pod postacią zaokrąglonych
wtrąceń niemetalicznych, mniej jednak szkodliwych. niż siarczki żelaza. Większe zawartości
manganu, szczególnie w obecności innych pierwiastków stopowych, jak np. niklu, wpływają
na tworzenie się żeliwa o budowie martenzytycznej, a jeszcze większe − austenitycznej.
Fosfor występuje w żeliwie najczęściej w ilości 0,1–0,6%. Większa zawartość fosforu
(0,6–0,7–1,8%) zwiększa rzadkopłynność (potrzebną do uzyskania odlewów cienkościennych
lub o zwiększonej odporności na ścieranie), wpływa jednak na kruchość żeliwa.
Siarka w ilości do 0,12% nie jest jeszcze szkodliwa, zwłaszcza gdy w żeliwie znajduje się
dosyć dużo manganu, aby ją związać pod postacią siarczku manganu. Większe zawartości
siarki powodują jednak kruchość żeliwa oraz zwiększają skłonność do wydzielania się
pęcherzy gazowych i tworzenia jam skurczowym. Poza tym siarka zmniejsza rzadkopłynność
ciekłego żeliwa.
Nikiel sprzyja częściowo wydzielaniu się węgla pod postacią grafitu, lecz w stopniu
znacznie słabszym niż krzem. Przy większych zawartościach niklu (3–6%) i normalnym
chłodzeniu żeliwo uzyskuje budowę martenzytyczną, a przy jeszcze większych austenityczną.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Chrom w żeliwie tworzy węgliki. Zależnie od rodzaju żeliwa zawartość w nim chromu
wynosi od 0,3%, w celu podwyższenia twardości, aż do 30% w celu zwiększenia
kwasoodporności i żaroodporności. Stosuje się go często łącznie z niklem.
Wolfram zwiększa własności wytrzymałościowe żeliwa i z tego powodu jest stosowany
w ilości 0,25-10%, zazwyczaj obok chromu, wanadu i niklu.
Molibden tworzy węgliki i wpływa na zmniejszenie ziarna, co z kolei polepsza własności
wytrzymałościowe.
Wanad działa odtleniająco. Wpływa na zmniejszenie ziarna i uzyskanie lepszych
własności mechanicznych.
Tytan działa odtleniająco i odazotowująco. Sprzyja powstawaniu drobnoziarnistej
struktury i wpływa na polepszenie własności wytrzymałościowych.
Miedź zwiększa odporność żeliwa na korozję i skraca czas wygrzewania odlewów
z żeliwa białego.
Aluminium działa odtleniająco, sprzyja wydzielaniu się grafitu w procesie grafityzacji.
Rys. 15. Wpływ składników stopowych na
wytrzymałość żeliwa o zawartości 3,2%C
[8, s. 141]
Rys. 16. Wpływ składników stopowych na
twardość żeliwa o zawartości 3,2%C [8, s. 141]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak wpływa wzrastająca zawartość węgla w stali na: twardość, wytrzymałość na
rozciąganie, wydłużenie?
2. Jak wpływa fosfor na właściwości stali?
3. Jak wpływa siarka na właściwości stali?
4. Co to jest staliwo?
5. Jakie staliwo ma zalety i wady w stosunku do żeliwa?
6. Co to jest żeliwo?
7. Co to jest żeliwo białe?
8. Co to jest żeliwo szare?
9. Co to jest żeliwo modyfikowane?
10. Co to jest żeliwo sferoidalne?
11. Co to jest ferryt?
12. Co to jest perlit?
13. W jaki sposób dodatki stopowe zmieniają strukturę stali?
14. Jak dodatki stopowe zmieniają własności stali?
15. Co to jest cementyt?
16. W jakiej postaci występuje węgiel w żeliwach?
17. W jakiej postaci występuje węgiel w żeliwie białym?
18. W jakiej postaci występuje węgiel w żeliwie szarym?
19. W jakiej postaci występuje węgiel w żeliwie sferoidalnym?
4.4.3. Ćwiczenia
Ćwiczenie 1
Określ strukturę, własności i rodzaj stali na podstawie badań metalograficznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) przeprowadzić obserwację struktur próbek stalowych, zwracając uwagę na kształt
i rozmiar ziaren ferrytu i perlitu oraz wtrąceń niemetalicznych,
2) naszkicować odręcznie oglądane struktury,
3) porównać badaną próbkę z atlasem mikrostruktur, zaklasyfikować badaną stal,
4) opisać, jak wpływa struktura na własności badanej stali.
Wyposażenie stanowiska:
−
komplet próbek stali węglowych,
−
mikroskop metalograficzny z wyposażeniem,
−
atlas mikrostruktur,
−
katalog stali, normy PN dot. stali.
Ćwiczenie 2
Określ strukturę, własności i rodzaj żeliwa na podstawie badań metalograficznych.
Sposób wykonania ćwiczenia ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) przeprowadzić obserwację struktur próbek żeliwnych, zwracając uwagę na postać
występującego węgla,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
2) naszkicować odręcznie, oglądane struktury,
3) porównać badaną próbkę z atlasem mikrostruktur, zaklasyfikować badane żeliwo,
4) opisać, jak wpływa struktura na własności badanego żeliwa.
Wyposażenie stanowiska:
−
komplet próbek żeliwnych,
−
mikroskop metalograficzny z wyposażeniem,
−
atlas mikrostruktur,
−
katalog żeliw, normy PN dot. żeliwa.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: stal, staliwo, żeliwo?
2) zdefiniować: żeliwo modyfikowane, sferoidalne, ciągliwe?
3) określić wpływ dodatków stopowych na własności stali, żeliwa?
4) rozróżnić
strukturę
żeliwa białego, szarego, sferoidalnego,
ciągliwego?
5) rozróżnić stal o różnej zawartości węgla?
6) określić własności stali na podstawie obserwowanej struktury?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
4.5. Klasyfikacja stali węglowych i stopowych, żeliwa i staliwa.
Znakowanie i zastosowanie stopów żelaza z węglem.
4.5.1. Materiał nauczania
Podział stali węglowej i stopowej przedstawiony jest w tabeli 6.
Tabela. 6. Klasyfikacja stali [9, s.70-85]
Spawalna
Z określoną zawartością C, Mn, Si.
Konstrukcyjna
Z obniżoną zawartością F i S
Jakościowe
Do ulepszania cieplnego
Specjalna
Do nawęglania
Stal
Niestopowa
(węglowa)
Odporna na korozje
---------------------------------
O podwyższonej wytrzymałości
Do ulepszania cieplnego
Do azotowania
Do nawęglania
Sprężynowe
Łożyskowe
Odporne na korozję
Kwasoodporne
Żaroodporne i żarowytrzymałe
Stal
stopowa
Niskostopowa
Średniostopowa
Wysokostopowa
O szczególnych własnościach
Biorąc pod uwagę zawartość węgla, dzielimy stale na: niskowęglowe do 0,25%C,
średniowęglowe o zawartości 0,25 – 0,6%C i wysokowęglowe powyżej 0,6%C. W tablicy 7
podano oznaczenia i zastosowanie stali węglowej konstrukcyjnej:
Tabela. 7. Oznaczenia i zastosowanie stali węglowej konstrukcyjnej [9.str.70-72]
Rodzaj stali
konstrukcyjnej
Oznaczenie
Zastosowanie
S185 (St0S)
Części małe, najmniej odpowiedzialne, bez obróbki
cieplnej
S235JR ( St3S)
S275J0 (St3V) S275J2G3
Najczęściej stosowana w konstrukcjach
budowlanych, mosty, hale, suwnice, kratownice.
Niestopowa
PN-EN 10020:
2003
PN-EN 10027-1
2007
E295 (MSt5)
E335 (MSt6)
Mniej odpowiedzialne części w środkach transportu,
nie spawalna
C10E (10), C22 (15), C22R (20),
Drobne części rowerowe, maszyn do szycia, małe
koła zębate, tuleje, sworznie. Do nawęglania i
hartowania
C25R (25), C30E (30), C35 (35), C40
(40), C45 (45), C50 (45G)
Wały wykorbione, korbowody, kliny, śruby,
wrzeciona. Normalizowane lub ulepszone cieplnie
Niestopowa
specjalne
PN-EN 10083-1
2006
PN-EN 10083-2
2006
C60 (55, 60), C65D (65G)
Części o większej wytrzymałości i odporności na
ścieranie, koła zębate, ślimaki, mimośrody.
Hartowane powierzchniowo
(…) W nawiasie podano oznaczenia według starej normy

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Stale konstrukcyjne stopowa
W oznaczeniach stali konstrukcyjnych stopowych wg starszej normy, stosuje się na
początku liczby, które oznaczają zawartość węgla w setnych częściach procentu i dalej
symbole literowe oznaczają zawartość składnika stopowego, jeżeli za tym symbolem jest
liczba, oznacza ona zawartość procentową tego składnika w stopie. Stosuje się symbole:
G- mangan, H- chrom, N- nikiel, M- molibden, T- tytan, S- krzem, F- wanad, B- bor,
W- wolfram, J- aluminium, K- kobalt A- stal wyższej jakości
Oznaczenie i zastosowanie w/w stali podaje tabela.8. W nawiasie podane jest oznaczenie stali
wg starej normy.
Staliwo PN-ISO 3755:1994
Stosuje się na drobne części w postaci odlewów, co jest bardziej ekonomiczne, zwłaszcza
przy skomplikowanych kształtach części. Ma dobre właściwości mechaniczne i przy małej
zawartości węgla, dobrą spawalność, co umożliwia regenerację części poprzez napawanie.
W porównaniu do żeliwa, ma gorsze właściwości odlewnicze i wysoką temperaturę topnienia.
Oznaczenie: 200-400, 200-400W, 230-450, 230-450W,.....350-550W, pierwsza liczba
oznaczają granicę plastyczności w [MPa], druga wytrzymałość na rozciąganie w [MPa], na
końcu „W” oznacza określoną maksymalną zawartość pierwiastków.
Żeliwo
Stop odlewniczy szeroko stosowany w produkcji części maszyn ze względu na niskie
koszty wytwarzania skomplikowanych części, zdolność tłumienia drgań, małą wrażliwość na
działanie karbu, dobrą obrabialność. Stosuje się w częściach które nie wymagają dużej
wytrzymałości. W bardziej obciążonych elementach stosuje się żeliwa sferoidalne i ciągliwe.
Przykłady oznakowań i zastosowania podano w tabeli 9.
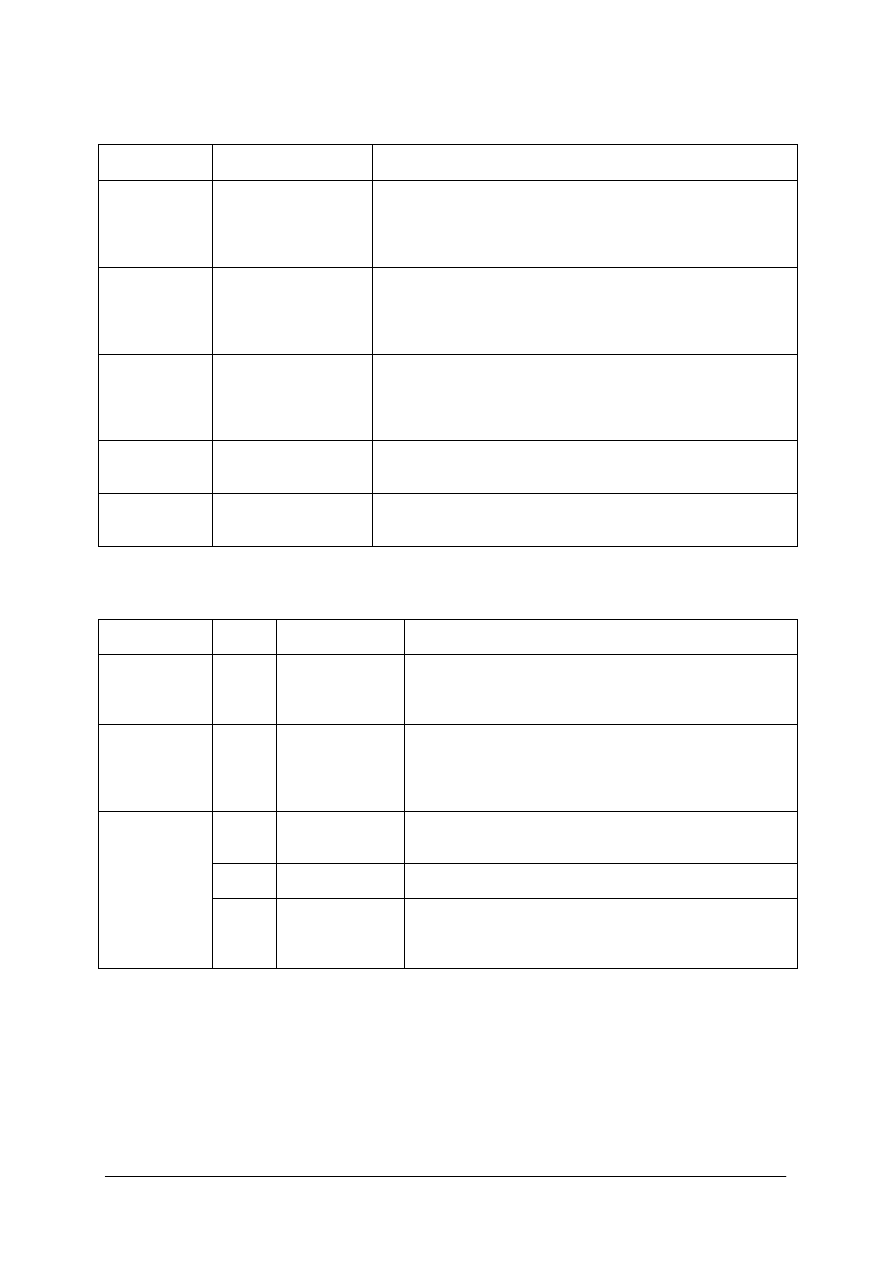
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Tabela 8. Oznaczenia i zastosowanie stali stopowej konstrukcyjnej [9. str.75-82]
Stal stopowa
konstrukcyjna
Oznaczenie
Wymagania i zastosowanie
niskostopowa o
podwyższonej
wytrzymałości
PN-EN 10025-
-1,3,4:2005
S275M (09G2)
P355NL1 (5G2ANb)
P460N (18G2ACu)
(18G2AV)
Części które nie wymagają obróbki cieplnej, stosuje się w stanie
normalizowanym; części z podwyższoną granicą plastyczności
Do nawęglania
PN-EN 10084:
2002
20Cr4 (20H)
16MnCr5 (16HG)
18CrMo4 (18HGM)
20NiCrMo2-2
20HNM
Drobne części o małych przekrojach od których wymaga się dużej
twardości powierzchni, przy plastycznym rdzeniu lub o małej
wytrzymałości rdzenia. Dodatki stopowe zmniejszają naprężenia
hartownicze i skłonność do odkształceń.
Do ulepszania
cieplnego
PN-EN 10083-1
2006
34Cr4 (30H),
42CrMo4 (30HN),
34CrNiMo4 (37HNM)
41Cr4 (40H)
25CrMo4 (30HGS)
Części maszyn podlegające dużym obciążeniom. Po ulepszaniu
cieplnym tj. hartowaniu i odpuszczaniu wysokim, uzyskuje się
wysoką wytrzymałość, plastyczność i sprężystość, także dużą
ciągliwość i udarność. Części maszyn o średnich przekrojach i
dużej wytrzymałości.
Sprężynowe
PN-EN10132-4
2004
60Si7 (85, 65G, 45S),
51CrV2 (50HSA,
50HFA)
Od tych stali wymaga się wysokiej granicy sprężystości oraz
znaczną wytrzymałość zmęczeniową. Podstawowym składnikiem
jest krzem.
Łożyskowe
(ŁH15)
(Łh15SG)
Elementy łożysk tocznych jak, kulki, wałki, pierścienie, wymagają
dużej twardości, odporności na ścieranie i wytrzymałości na
ściskanie. Zawartość węgla wynosi około 1%, Cr 1,3-1,65%
Tabela 9. Oznaczenie i zastosowanie żeliw wg normy PN-88/H-83144. [5.str.179-183]
Żeliwo
Oznacz
enie
Gatunek
Własności i zastosowanie
Szare
Zl
100
1)
, 150,
200, 250,
300, 350
Najszersze zastosowanie na korpusy, obudowy, bloki
cylindrów, łoża obrabiarek. Tanie, łatwo obrabialne, dobrze
tłumi drgania.
W tej grupie są żeliwa modyfikowane.
Sferoidalne
Zs
350-22
2)
, 400-18,
400-15, 450-10,
500-7, 600-3,
700-2, 800-2,
900- 2
Posiada dobre własności wytrzymałościowe i plastyczne.
Stosowana na bardziej obciążone części maszyn jak: wały
korbowe, korbowody, wałki rozrządu
Zcb
W35-04
3)
,
W38-12,
W40-05, W40-07
Cienkościenne odlewy, dobrze spawalne, gorsza obrabialność
Zcc
B30-06, B32-12,
B35-10.
Ma największe wartości wydłużenia, dobra skrawalność. Na
mniejsze elementy maszyn rolniczych, maszyn do szycia.
Ciągliwe
Białe-W
Czarne-B
Perlityczne- P
Zcp
P45-06, P50-05,
P55-04, P60-03,
P65-02, P70-02
P80-01
Podobne własności jak żeliwo ciągliwe czarne, zastosowanie
w częściach wymagających większej wytrzymałości
1) minimalna wytrzymałość na rozciąganie w [MPa]; 2) minimalna wytrzymałość na rozciąganie w [MPa]
i minimalne wydłużenie w %; 3) minimalna wytrzymałość na rozciąganie w [MPa] podzielona przez 10
i minimalne wydłużenie w %. Dla żeliw stopowych obowiązują normy: PN-EN 13835:2005, PN-EN 12513:2003

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do ćwiczeń
1. Od czego zależy podział stali?
2. Jakie jest kryterium zaklasyfikowania stali do stali stopowych?
3. Co oznacza symbol cyfrowy w oznakowaniu staliwa?
4. Co oznacza liczba w oznakowaniu stali węglowej wyższej jakości?
5. W jaki sposób oznacza się żeliwa sferoidalne?
6. Jak wpływa drobnoziarnistość struktury na własności stali?
7. Jakie dodatki stopowe wpływają na poprawę własności mechanicznych po obróbce
cieplnej?
8. Jaki symbol mają: molibden, mangan, chrom, w oznakowaniu stali stopowej
konstrukcyjnej?
9. Jaka struktura charakteryzuje żeliwo o dobrych własnościach plastycznych?
10. Co oznaczają symbole cyfrowe w oznakowaniu żeliw?
11. Jak różnica w wytrzymałości na rozciąganie jest, między żeliwem szarym
a sferoidalnym?
4.5.3. Ćwiczenia
Ćwiczenie 1
Określ rodzaj, własności, zastosowanie stali stopowej na podstawie oznakowania, określ
strukturę na podstawie badań metalograficznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) na podstawie oznakowani danej próbki, określć rodzaj, własności, zastosowanie
i obróbkę cieplną,
2) przeprowadzić obserwację struktur próbek stalowych w stanie normalizowanym i po
obróbce cieplnej,
3) naszkicować odręcznie, oglądane struktury,
4) porównać badane próbki z atlasem mikrostruktur, określić różnice w strukturze,
5) opisać, jak wpływa obróbka cieplna na zmianę struktury i na własności badanej stali.
Wyposażenie stanowiska:
−
komplet próbek stali stopowych normalizowanych i po obróbce cieplnej,
−
mikroskop metalograficzny z wyposażeniem,
−
atlas mikrostruktur,
−
katalog stali,
−
normy PN dotyczące stali.
Ćwiczenie 2
Określ rodzaj, własności, zastosowanie żeliwa na podstawie oznakowania, określ
strukturę na podstawie badań metalograficznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) na podstawie oznakowania danej próbki, określić rodzaj, własności i zastosowanie
żeliwa,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
2) przeprowadzić obserwację struktur próbek żeliwnych,
3) naszkicować odręcznie, oglądane struktury,
4) porównać badane próbki z atlasem mikrostruktur, określić różnice w strukturze,
5) opisać, jak wpływa struktura na własności badanej próbki żeliwnej.
Wyposażenie stanowiska:
−
komplet próbek żeliwnych,
−
mikroskop metalograficzny z wyposażeniem,
−
atlas mikrostruktur,
−
katalog żeliw, normy PN dot. żeliwa.
4.5.4. Sprawdzian postępów.
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: stal stopowa, żeliwo stopowe?
2) zdefiniować: symbole w oznakowaniu stali stopowych ?
3) określić pływ dodatków stopowych na właściwości żeliwa?
4) rozróżnić strukturę różnego rodzaju stali i żeliw stopowych?
5) określić wpływ obróbki cieplnej na własności stali?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
4.6. Metale nieżelazne i ich stopy. Znakowanie i zastosowanie
stopów metali nieżelaznych
4.6.1. Materiał nauczania
Miedź, ma dobre własności plastyczne ale niską twardość i wytrzymałość na rozciąganie.
Jest barwy czerwonawej. Ma bardzo dobrą przewodność elektryczną i odporność na korozję.
W stanie czystym stosowana jest w elektrotechnice i przemyśle chemicznym.
Stopy miedzi:
Mosiądz, stop miedzi z cynkiem do 45% Zn. Większość stopów metali nieżelaznych
dzielą się na stopy: przerabiane plastycznie lub odlewnicze.
Mosiądz przerabiany plastycznie, najczęściej CuZn5, CuZn10 jest odporny na czynniki
atmosferyczne oraz ma dobrą przewodność cieplną, stąd zastosowanie na chłodnice silników
spalinowych. CuZn15 (tombak), ze względu na złocistą barwę i odporność na czynniki
atmosferyczne stosowany jest na wyroby jubilerskie i złotnicze.
Mosiądz odlewniczy, dla polepszenia własności odlewniczych zawiera dodatki ołowiu
i krzemu. Najczęściej stosowany CuZn39Pb2, ze względu na dużą odporność na korozję
i ścieranie stosowany na armaturę wodną pracującą do 200
o
C.
Mosiądz wysokoniklowy, nowe srebro, jest bardzo plastyczne i posiada piękne srebrzyste
zabarwienie, stosuje się go na nakrycia stołowe, części aparatów pomiarowych, urządzenia
sanitarne.
Brąz, stop miedzi z cyną do 16 – 20% Sn, dość drogie stopy ze względu na deficytową
cynę.
Brąz przerabiany plastycznie, często stosowane CuSn4 lub CuSn8, mają dobre własności
plastyczne i wytrzymałościowe. Obróbka plastyczna (zgniot) powoduje zwiększenie
twardości i wytrzymałości . Stop CuSn5 dawniej stosowany był do produkcji monet, medali.
Brązy odlewnicze np. CuSn10 ma dobre własności cierne i jest stosowany na panewki.
Brąz wieloskładnikowy CuSn5Zn5Pb5 stosuje się na przewody armatury wodnej i parowej.
Stop miedzi z innym składnikiem niż cyna, jest też brązem z dodaną nazwą drugiego
składnika:
Brąz aluminiowy do 11% Al, do przeróbki plastycznej, CuAl5 jest obecnie stopem
monetowym; CuAl8 na części sprężynujące aparatów i urządzeń.
Brąz aluminiowy odlewniczy jest trudno odlewalny, stąd stosuje się brązy
wieloskładnikowe (PN-91/H-87026), np. CuAl9Fe3 który posiada dużą odporność na korozje,
także wody morskiej, dobra odporność na ścieranie, może pracować w podwyższonej
temperaturze. Ma zastosowanie na śruby okrętowe, osprzęt okrętowy, armaturę parową,
elementy turbin parowych, w przemyśle papierniczym i naftowym.
Brąz krzemowy, do 5%Si, CuSi3Mn1 ma dużą wytrzymałość zmęczeniową, odporność
na korozję, nie iskrzy stąd zastosowanie w przemyśle materiałów wybuchowych,
spożywczym, papierniczym. Oznakowanie stopów miedzi podane są w tabeli 10 i 11.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Tabela. 10. Brązy, skład chemiczny i oznaczenie stopu [9. str. 90]
Brązy do przeróbki plastycznej
Brązy na odlewy PN-EN 1982:2002
Znak (skład stopu)
Cecha
Znak (skład stopu)
Cecha
Wg PN-EN 12451:2002
CuSn2
CuAl8Fe
CuSn4 Pb4Zn3
Wg PN-92/H-87050
CuSn4P
CuSn4Zn3
CuSi3Mn1
CuNi3Si1
CuMn5
CuAl10Fe3Ni4A
CuAl9Fe3A
CuAl5
CuAl7
CuAl9Mn2A
CuNi6Al2
B2
B6
B8
B443
BK31
BN31
BM5
BA1032
BA19044A
BA94A
BA5
BA7
BA92A
BN62
BB2
CuSn10-C
CuSn10P-C
CuSn10Zn2-C
CuSn6Zn6Pb5-C
CuSn10Pb10-C
CuSi3Zn3Mn1-C
CuAl10Fe3Mn2-C
CuAl10Fe4Ni4B-C
CuAl9Fe3B-C
B10
B101
B102
B555
B1010
BK331
BA1032
BA1044
BA93
Aluminium, bardzo miękkie, plastyczne, bardzo lekkie, dobra przewodność ciepła i
prądu. Odporne na działanie czynników atmosferycznych. Ma zastosowanie w przemyśle
chemiczno-spożywczym. Powszechnie stosowana jest folia aluminiowa na opakowania
środków spożywczych.
Stopy aluminium mają dość szerokie zastosowanie ze względu na lekkość stopu,
odporność na korozję, dobrą przewodność ciepła i dobre własności technologiczne. Tworzy
stopy:
a) z krzemem, do 15%Si
b) z miedzią, do35%Cu
c) z magnezem, do 40%Mg
d) z cynkiem
Stopy aluminium dzielą się na stopy odlewnicze lub do przeróbki plastycznej.
Stopy aluminium odlewnicze, najczęściej stosowane z krzemem o 11-14%Si (silumin),
dość dobre własności wytrzymałościowe, dobra własności odlewnicze, stąd stosuje się na
skomplikowane odlewy kadłubów silników, różnego rodzaje obudowy, w przemyśle
elektrotechnicznym, okrętownictwie. Stop AlSi13Mg1CuNi jest materiałem na tłoki silników
spalinowych, jest bardzo lekki o dobrych własnościach mechanicznych.
Stopy aluminium do przeróbki plastycznej, są to stopy lekkie, odporne na korozję. Stop
AlCu4Mg1 (duraluminium, dural) ma dość dużą wytrzymałość i jest często stosowany na
części maszyn bardziej obciążone. Niestety, ten stop jest mało odporny na korozję.
Oznakowanie stopów aluminium podane jest w tabeli 12
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Tabela 11. Mosiądze, skład chemiczny i oznaczenie stopu. [9. str. 88]
Mosiądze do przeróbki plastycznej PN-92/H87025
Mosiądze na odlewy PN-EN 1982:2002
Znak (skład stopu)
Cecha
Znak (skład stopu)
Cecha
CuZn4
CuZn10
CuZn15
CuZn20
CuZn30
CuZn32
CuZn37
CuZn40
CuZn40Pb2
CuZn39Pb1
CuZn39Pb
CuZn36Pb1
CuZn34Pb3
CuZn10Sn
CuZn28Sn1
CuZn38Sn1
CuZn21Al2
CuZn36Al3Ni2
CuZn38Al2MnFe
CuZn40Mn
CuZn40FeMnSnAl
CuZn39Mn3Al
M96
M90
M85
M80
M70
M68
M63
M60
MO58
MO59
MO60
MO63
MO64
MC90
MC70
MC62
MA77
MA59
MA58
MM59
MM57
MM56
CuZn33Pb2-B
CuZn33Pb2-C
CuZn33Pb2Si-B
CuZn33Pb2Si-C
CuZn35Pb2Al-B
CuZn35Pb2Al-C
CuZn39Pb1Al-B
CuZn39Pb1Al-C
CuZn15As-B
CuZn15As-C
CuZn35Mn2Al1Fe1-B
CuZn35Mn2Al1Fe1-C
CB750S
CC750S
CB751S
CC751S
CB752S
CC752S
CB754S
CC754S
CB760S
CC760S
CB765S
CC765S
Tabela 12. Stopy aluminium, oznakowanie
Stopy aluminium odlewnicze
PN-EN 1706:2001
Stopy aluminium do przeróbki plastycznej
PN-EN 573-3:2005
Grupa stopu
Cecha
Znak (skład stopu)
Cecha
AlCu
AlSiMgTi
AlSi7Mg
AlSi10Mg
AlSi
AlSiCu
EN AC-21000
EN AC-21100
EN AC-41000
EN AC-42000
EN AC-42100
EN AC-42200
EN AC-43000
EN AC-43100
EN AC-43200
EN AC-43300
EN AC-44000
EN AC-44100
EN AC-44200
EN AC-45000
EN AC-45100
EN AC-45200
EN AC-45300
EN AW-AlMg4Mn
EN AW-AlMg1Si1Mn06
EN AW-AlCu4MgSi
EN AW-AlCu4Mg2
EN AW-AlZn6Mg2Cu2
5083
6082
2017
2024
7075
Magnez, bardzo lekki, kruchy, mało trwały. Czysty magnez nie ma praktycznego
zastosowania. Głównymi składnikami stopów magnezu są aluminium, cynk, mangan i krzem.
Stopy magnezu z aluminium i cynkiem (elektrony) są najlżejszymi ze znanych stopów, są
odporne na działanie czynników atmosferycznych, także acetonu, benzyny; nie są odporne na
działanie kwasów. W czasie skrawania nie wolno chłodzić wodą, ponieważ w połączeniu
z tlenem tworzy substancję wybuchową. Ze względu na mały ciężar właściwy, stopy magnezu
znalazły zastosowanie w budowie środków transportu, zwłaszcza w lotnictwie, także

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
w urządzeniach, w których zależy na zmniejszeniu ciężaru. Skład i oznakowanie stopów
magnezu obejmują normy: PN-EN 1753:2001 i PN-EN 1754:2002
Cynk, odporny na działanie powietrza i wilgoci, rozpuszcza się w kwasach i alkaliach.
Plastyczny, ma dobre własności odlewnicze. Czysty metal ma zastosowanie do cynkowania
wyrobów stalowych, w przemyśle chemicznym do wyrobu tzw. bieli cynkowej.
Cynk tworzy stopy z aluminium i miedzią (znale). Stopy odlewnicze maja większą ilość tych
składników, do28%Al i 5%Cu, są oznaczone symbolem: Z61, Z82, Z105, Z284.
Stopy do przeróbki plastycznej maja oznaczenie; Z40, Z41, Z43. Stopy cynku mają
zastosowanie produkcji małych, skomplikowanych odlewów o dużej precyzji wykonania,
części samochodów, maszyn drukarskich, odkurzaczy, zabawki.
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczenia.
1. Jakie cechy charakterystyczne ma miedź?
2. Jakie cechy charakterystyczne ma aluminium?
3. Jakie cechy charakterystyczne mają stopy miedzi?
4. Jakie cechy charakterystyczne mają stopy aluminium?
5. W jakich przypadkach stosuje się stopy miedzi?
6. W jakich przypadkach stosuje się stopy aluminium?
7. Jakie cechy zewnętrzne ma miedź?
8. Jakie cechy zewnętrzne ma cynk?
9. Co to jest za stop mosiądz?
10. Jakie cechy zewnętrzne ma mosiądz?
11. Jakie cechy zewnętrzne ma aluminium?
12. Jakie cechy zewnętrzne będą miały stopy aluminium?
4.6.3. Ćwiczenia
Ćwiczenie 1
Określ rodzaj, własności, zastosowanie stopów metali nieżelaznych na podstawie
oznakowania, określ strukturę na podstawie badań metalograficznych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) na podstawie oznakowania danej próbki, określić rodzaj i własności, danego stopu,
przeprowadzić obserwację struktur próbek stopów metali nieżelaznych,
2) naszkicować odręcznie, oglądane struktury,
3) porównać badane próbki z atlasem mikrostruktur.
Wyposażenie stanowiska:
−
komplet próbek stopów metali nieżelaznych,
−
mikroskop metalograficzny z wyposażeniem,
−
atlas mikrostruktur, katalog stopów metali nieżelaznych,
−
normy PN dot. tych stopów

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
4.6.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcia: mosiądz, brąz, silumin, elektron?
2) zdefiniować cechy charakterystyczne miedzi, aluminium, cynku,
cyny, magnezu, niklu?
3) określić własności stopów miedzi, aluminium, magnezu?
4) rozróżnić stopy miedzi, aluminium, magnezu, cyny, niklu?
5) rozróżnić fazy w strukturze stopów metali nieżelaznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj dokładnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Odpowiedzi udzielaj wyłącznie na karcie odpowiedzi.
4. Zapoznaj się z zestawem zadań testowych.
5. Test zawiera 25 zadań. Do każdego zadania podane są cztery odpowiedzi, z których tylko
jedna jest prawidłowa.
6. Zaznacz prawidłową według Ciebie odpowiedź wstawiając literę X w odpowiednim
miejscu na karcie odpowiedzi.
7. W przypadku pomyłki zaznacz błędną odpowiedź kółkiem, a następnie literą X zaznacz
odpowiedź prawidłową.
8. Za każde poprawne rozwiązanie zadania otrzymujesz jeden punkt.
9. Za udzielenie błędnej odpowiedzi, jej brak lub zakreślenie więcej niż jednej odpowiedzi -
otrzymujesz zero punktów.
10. Uważnie czytaj treść zadań i proponowane warianty odpowiedzi.
11. Nie odpowiadaj bez zastanowienia; jeśli któreś z pytań sprawi Ci trudność – przejdź do
następnego. Do zadań, na które nie udzieliłeś odpowiedzi możesz wrócić później.
12. Pamiętaj, że odpowiedzi masz udzielać samodzielnie.
13. Na rozwiązanie testu masz 45 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1
Który z metali w temperaturze otoczenia nie ma budowy krystalicznej
a) żelazo.
b) magnez.
c) rtęć.
d) cyna.
2
Która właściwość nie jest cechą metali
a) dobre własności elektroizolacyjne.
b) dobre własności plastyczne.
c) dobra przewodność cieplna.
d) połysk
3
Ile atomów posiada elementarna sieć A3
a) 9.
b) 12.
c) 14.
d) 17.
4
Przemiana alotropowa żelaza zachodzi w temperaturze
a) 26
o
C.
b) 506
o
C.
c) 721
o
C.
d) 906
o
C.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
5
Aby otrzymać strukturę gruboziarnistą należy metal
a) mocno przechłodzić.
b) poddać wstrząsom.
c) maksymalnie oczyścić z zanieczyszczeń.
d) dodać dodatki stopowe.
6
Przekrój wlewka ze stali nieuspokojonej ma
a) nierównomierną strukturę ze strefą transkrystalizacji.
b) równomierną strukturę z pęcherzykami powietrza.
c) równomierną strukturę bez pęcherzyków powietrza.
d) wyraźną jamę usadową.
7
Gdy dwa metale rozpuszczają się w sobie całkowicie w stanie stałym to otrzymujemy
a) mieszaninę.
b) roztwór stały.
c) mieszaninę roztworów stałych.
d) roztwór stały ograniczony.
8
Eutektyka dwóch metali A i B jest to
a) drobnoziarnisty roztwór stały metalu a w b.
b) drobnoziarnisty roztwór stały metalu b w a.
c) mieszanina faz międzymetalicznych metalu a i b.
d) drobnoziarnista mieszanina metalu a i b.
9
Linia likwidus jest to linia
a) początku topnienia.
b) początku krzepnięcia.
c) przemiany eutektycznej.
d) końca krzepnięcia.
10 Cementyt to
a) mieszanina żelaza Fe i węgla C.
b) roztwór stały węgla w żelazie.
c) roztwór ograniczony węgla w żelazie o zawartości 6,67%C.
d) związek chemiczny Fe
3
C.
11 Najbardziej miękkim składnikiem stali jest
a) ferryt.
b) perlit.
c) cementyt.
d) ledeburyt.
12 Najbardziej twardym składnikiem stali jest
a) ferryt.
b) perlit.
c) cementyt.
d) ledeburyt.
13 Ledeburyt jest to
a) eutektyczna mieszanina ferrytu i cementytu.
b) eutektoidalna mieszanina ferrytu i cementytu.
c) eutektoidalna mieszanina ferrytu i ledeburytu.
d) eutektyczna mieszanina austenitu i cementytu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
14 Perlit jest to
a) eutektyczna mieszanina ferrytu i cementytu.
b) eutektoidalna mieszanina ferrytu i cementytu.
c) eutektoidalna mieszanina ferrytu i ledeburytu.
d) eutektyczna mieszanina austenitu i cementytu.
15 Przemiana eutektoidalna zachodzi w temperaturze
a) 723
o
C.
b) 910
o
C.
c) 1147
o
C.
d) 1539
o
C.
16 Który ze składników w stali powoduje „kruchość na gorąco”
a) mangan.
b) krzem.
c) fosfor.
d) siarka.
17 W żeliwie szarym węgiel występuje w postaci
a) ledeburytu.
b) cementytu.
c) grafitu.
d) austenitu.
18 Żeliwo białe otrzymuje się gdy
a) szybko chłodzimy.
b) dodamy większą ilość krzemu.
c) dodamy aluminium i nikiel.
d) ograniczymy do minimum mangan i siarkę.
19 Stal niestopowa z określoną zawartością C Mn Si należy do stali
a) narzędziowej niskostopowej.
b) specjalnej.
c) konstrukcyjnej.
d) odpornej na korozję.
20 Symbol cyfrowy w stali niestopowej specjalnej np. C40, oznacza
a) rodzaj stali.
b) zawartość węgla w setnych częściach %.
c) minimalną wytrzymałość na rozciąganie w mpa.
d) wydłużenie względne w %.
21 Stal 18CrMo4 jest to stal stopowa konstrukcyjna
a) o zawartości 18% chromu.
b) do ulepszania cieplnego.
c) sprężynowa do azotowania.
d) stopowa do nawęglania.
22 Symbol cyfrowy w oznaczeniu żeliwa sferoidalnego Zs500-7, oznacza
a) minimalną wytrzymałość na rozciąganie w mpa i minimalne wydłużenie w %.
b) maksymalną wytrzymałość na rozciąganie w mpa i maksymalne wydłużenie w %.
c) średnią wytrzymałość na rozciąganie w mpa i średnie wydłużenie w %.
d) zakodowany symbol gatunku i przeznaczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
23 Do stopów lekkich zalicza się stopy
a) miedzi z cynkiem.
b) miedzi z niklem.
c) aluminium z krzemem.
d) ołowiu, cynku i cyny.
24 Na małe precyzyjne odlewy najlepiej zastosować
a) mosiądz.
b) silumin.
c) znal.
d) elektron.
25 Bardzo dobrym ale drogim składnikiem w stopach łożyskowych jest
a) miedź.
b) cynk.
c) ołów.
d) cyna.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
KARTA ODPOWIEDZI
Imię i nazwisko …………………………………………………………………………………
Stosowanie metali i stopów
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
21
a
b
c
d
22
a
b
c
d
23
a
b
c
d
24
a
b
c
d
25
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
6. LITERATURA
1. Bylica A. (red.): Materiałoznawstwo – laboratorium. Wyd. Wyższej Szkoły Pedagogicznej,
Rzeszów 2000
2. Czerwiński W.: Materiałoznawstwo. WSiP 1978
3. Marciniak J. (red.): Ćwiczenia laboratoryjne z metaloznawstwa. Wyd. Politechniki
Śląskiej, Gliwice 1998
4. Okoniewski S.: Materiały konstrukcyjne. PWSZ, Warszawa 1973
5. Rudnik S.: Metaloznawstwo. Wyd. Naukowe PWN, Warszawa 1996
6. Struzik Cz.: Pracownia techniczna. WSiP, Warszawa 1972
7. Wendorff Z.: Metaloznawstwo. Wyd. Naukowo- Techniczne, Warszawa 1976
8. Wesołowski K.: Metaloznawstwo i obróbka cieplna z ćwiczeniami. WSiP, Wrocław 1977
9. Zawora J.: Podstawy technologii maszyn. WSiP, Warszawa 2007
Wyszukiwarka
Podobne podstrony:
14 Korozja metali i stopów
02 Stosowanie przepisów prawa i zasad ekonomiki
Badania makro i mikrostruktury metali i stopów, WIP zarządzanie i inżynieria produkcji, sesja 1, Mat
14a Korozja metali i stopów (PPTminimizer)
Ćwiczenie 4 Właściwości magnetyczne metali i stopów
Mikroskopowe obserwacje metali i stopów, Elektrotechnika, dc pobierane, pnom wimir, PNOM, Materiałki
Budowa metali i stopów oraz ich właściwości, Techniki wytwarzania z materiałoznawstwem
02 Stosowanie sprzętu i urządzeń w produkcji telewizyjnej
Ćwiczenie 3 Przewodnictwo elektryczne metali i stopów
02 Stosowanie przepisow prawa i Nieznany (2)
Próba udarności Charp'ego, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Własnośći mech. metali i sto
Odkształcenie plastyczne metali i stopów, Wytrzymałość materiałów(1)
Filtry porowate wykonuje się ze spieków proszków różnych metali i stopów np
Badanie właściwości fizycznych niektórych metali, stopów i kamieni szlachetnych ćw 1
2 Sprawozdanie Cwiczenie 2 Makro mikrostruktura metali i stopow
14 Korozja metali i stopów
02 Stosowanie przepisów prawa i zasad ekonomiki
więcej podobnych podstron