
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Sylwia Rajca
Wykonywanie badań mikrobiologicznych
311[02].Z2.02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Barbara Przedlacka
mgr Zbigniew Piotr Rawluk
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą
programu jednostki modułowej 311[02].Z2.02,
„Wykonywanie badań mikrobiologicznych”, zawartego w modułowym programie nauczania
dla zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1.
Technika pracy w laboratorium mikrobiologicznym
7
4.1.1.
Materiał nauczania
7
4.1.2. Pytania sprawdzające
11
4.1.3. Ćwiczenia
11
4.1.4. Sprawdzian postępów
12
4.2. Morfologia i fizjologia drobnoustrojów
13
4.2.1. Materiał nauczania
13
4.2.2. Pytania sprawdzające
20
4.2.3. Ćwiczenia
20
4.2.4. Sprawdzian postępów
22
4.3. Metody badania drobnoustrojów
23
4.3.1. Materiał nauczania
23
4.3.2. Pytania sprawdzające
27
4.3.3. Ćwiczenia
28
4.3.4. Sprawdzian postępów
30
4.4. Wpływ środowiska na wzrost i rozwój drobnoustrojów
31
4.4.1. Materiał nauczania
31
4.4.2. Pytania sprawdzające
33
4.4.3. Ćwiczenia
34
4.4.4. Sprawdzian postępów
35
4.5. Rola drobnoustrojów w przyrodzie, gospodarce i życiu człowieka
36
4.5.1. Materiał nauczania
36
4.5.2. Pytania sprawdzające
46
4.5.3. Ćwiczenia
47
4.5.4. Sprawdzian postępów
49
5.
Sprawdzian osiągnięć
50
6.
Literatura
55

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o budowie, czynnościach
ż
yciowych i roli drobnoustrojów oraz w nabywaniu umiejętności praktycznych z zakresu
badań mikrobiologicznych.
W poradniku zamieszczono:
−
wymagania wstępne, czyli wykaz wiadomości i umiejętności, jakie powinieneś posiadać
przed przystąpieniem do nauki,
−
cele kształcenia, jakie powinieneś osiągnąć w czasie zajęć edukacyjnych tej jednostki
modułowej,
−
materiał nauczania, który zawiera niezbędne wiadomości teoretyczne, umożliwiające
przygotowanie się do wykonania ćwiczeń i zaliczenia sprawdzianu,
−
zestaw pytań, które pomogą Ci sprawdzić, w jakim stopniu opanowałeś treści
przedstawione w materiale nauczania,
−
ć
wiczenia, które pomogą Ci nabyć umiejętności praktyczne,
−
sprawdzian postępów, przy pomocy którego będziesz mógł ocenić stopień opanowania
materiału teoretycznego i umiejętności praktycznych,
−
zestaw pytań sprawdzających Twoje opanowanie wiedzy i umiejętności z zakresu całej
jednostki modułowej,
−
literaturę.
Korzystając z materiału nauczania zamieszczonego w poradniku, będziesz mógł
zapoznać się z podstawowymi zagadnieniami dotyczącymi budowy i czynności życiowych
drobnoustrojów – bakterii, wirusów i grzybów. Poznasz wpływ czynników chemicznych
i fizycznych na życie mikroorganizmów, ich rolę w przyrodzie oraz wykorzystanie przez
człowieka w różnych gałęziach przemysłu i biotechnologii.
Materiał nauczania zawiera również opis technik badań mikrobiologicznych i zasad pracy
laboratoryjnej w pracowni mikrobiologicznej. Wymaga ona użycia specyficznego sprzętu
laboratoryjnego, odczynników i pożywek hodowlanych, a wszystkie czynności muszą być
wykonywane z zachowaniem jałowości.
Wykonując ćwiczenia zamieszczone w poradniku opanujesz podstawowe techniki badań
mikrobiologicznych, takie jak badania mikroskopowe, badania ilościowe i jakościowe
mikroorganizmów.
Poziom swoich postępów możesz sprawdzić odpowiadając na pytania sprawdzające po
wykonaniu ćwiczeń z kolejnych rozdziałów jednostki modułowej. Stopień opanowania
materiału nauczania z całej jednostki modułowej pomoże Ci ocenić sprawdzian osiągnięć,
zamieszczony w końcowej części poradnika.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
311[02].Z2
Podstawy badań bioanalitycznych
311[02].Z2.01
Wykonywanie badań biochemicznych
311[02].Z2.02
Wykonywanie badań mikrobiologicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
korzystać z różnych źródeł informacji,
−
rozróżniać składniki chemiczne komórki,
−
określać budowę i funkcje składników chemicznych komórki,
−
posługiwać się nomenklaturą związków nieorganicznych i organicznych,
−
określać strukturę i funkcje komórki roślinnej i zwierzęcej,
−
określać właściwości, budowę i mechanizm działania enzymów,
−
określać znaczenie i zastosowanie enzymów w biotechnologii i przemyśle spożywczym,
−
charakteryzować oddychanie tlenowe i beztlenowe,
−
rozróżniać produkty oddychania tlenowego i beztlenowego,
−
charakteryzować proces fotosyntezy, jej fazy i czynniki wpływające na przebieg procesu,
−
charakteryzować proces chemosyntezy,
−
sporządzać roztwory o określonym stężeniu,
−
przestrzegać przepisów bezpiecznej i higienicznej pracy, ochrony przeciwpożarowej oraz
ochrony środowiska.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
–
zastosować przepisy bezpieczeństwa i higieny pracy obowiązujące w laboratorium
mikrobiologicznym,
–
posłużyć się sprzętem laboratoryjnym do analiz mikrobiologicznych, dobrać sprzęt
i przyrządy do badań,
–
zastosować
techniki
pracy
laboratoryjnej
obowiązujące
w
laboratorium
mikrobiologicznym,
–
scharakteryzować oraz przygotować różne rodzaje podłoży mikrobiologicznych,
–
scharakteryzować metody barwienia bakterii oraz przygotować preparat mikroskopowy,
–
zastosować normy mikrobiologiczne,
–
scharakteryzować morfologię i fizjologię określonych bakterii, grzybów i wirusów,
–
określić wpływ fizycznych i chemicznych czynników środowiska na wzrost i rozwój
drobnoustrojów,
–
dobrać metody badań drobnoustrojów,
–
przeprowadzić badania drobnoustrojów różnymi metodami,
–
określić miano coli oraz zinterpretować wyniki obserwacji i badań,
–
określić znaczenie drobnoustrojów w przyrodzie,
–
określić udział mikroorganizmów w obiegu podstawowych pierwiastków na podstawie
schematów,
–
określić udział drobnoustrojów w syntezie i rozkładzie związków organicznych
warunkujących żyzność gleb,
–
scharakteryzować sposób wykorzystania drobnoustrojów w biotechnologii oraz określić
możliwość ich zastosowania,
–
scharakteryzować udział drobnoustrojów w określonych procesach spożywczych oraz
określić możliwość ich zastosowania,
–
scharakteryzować negatywne działanie bakterii na produkty spożywcze, ustalić sposoby
przeciwdziałania,
–
określić znaczenie drobnoustrojów w produkcji żywności i medycynie oraz możliwości
ich zastosowania,
–
scharakteryzować rodzaje zatruć pokarmowych wywołanych przez drobnoustroje oraz
określić sposoby przeciwdziałania zatruciom.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1. Technika pracy w laboratorium mikrobiologicznym
4.1.1. Materiał nauczania
Zasady pracy w pracowni mikrobiologicznej
Podstawowym wymaganiem badań analitycznych stosowanych w mikrobiologii jest
zachowanie jałowości, polegającej na zabezpieczeniu badanego materiału przez dostaniem się
do niego mikroorganizmów ze środowiska, które mogłyby się rozwinąć i zmienić wyniki
badań.
Niektóre grupy bakterii, z którymi pracuje się w laboratorium mikrobiologicznym, jest
dla człowieka szkodliwa i mogą wywołać choroby. Dlatego prowadząc hodowle i badania
analityczne z żywymi drobnoustrojami należy ściśle przestrzegać pewnych zasad,
określonych w regulaminie pracowni.
Najważniejsze zasady pracy w pracowni mikrobiologicznej to:
−
szkiełka przedmiotowe z rozmazem kultur bakteryjnych i używane szkiełka nakrywkowe
należy przechowywać w zamkniętym naczyniu wypełnionym środkiem dezynfekującym
(np. lizolem, sterinolem lub alkoholem),
−
pipety pasteurowskie używa się jednorazowo, a po wykorzystaniu pipety umieszcza się ją
w naczyniu ze środkiem dezynfekującym,
−
płytki lub probówki z hodowlami drobnoustrojów należy zawsze trzymać zamknięte,
a odkrywać tylko na czas niezbędny do pobrania materiału do badań,
−
probówki z hodowlami na podłożu płynnym trzeba ustawiać pionowo w statywach, aby
zapobiec wyciekowi i zakażeniu miejsca pracy,
−
metalowy sprzęt laboratoryjny, używany do badań (np. ezy, igły, skalpele, pipety) należy
wyjaławiać przed użyciem oraz po ich użyciu,
−
hodowle bakteryjne, po wykonaniu badań, przed myciem należy zniszczyć przez
wyjałowienie w autoklawie, a następnie (po usunięciu zawartości) przez gotowanie szkła
w roztworze węglanu sodu,
−
w pracowni należy stosować ubranie ochronne, po zakończeniu pracy należy starannie
umyć ręce i zdjąć ubranie robocze, w pracowni nie wolno spożywać posiłków ani pić
napojów.
Wyposażenie pracowni mikrobiologicznej:
a)
aparatura:
−
autoklaw oraz aparat Kocha do wyjaławiania pożywek i niszczenia drobnoustrojów,
−
sterylizator na suche gorące powietrze,
−
suszarka do suszenia szkła laboratoryjnego,
−
cieplarka do hodowli drobnoustrojów,
−
chłodziarka do przechowywania szczepów i pożywek,
−
mikroskop z obiektywem imersyjnym,
−
lupy,
−
waga techniczna i analityczna,
−
pehametr,
b)
sprzęt laboratoryjny:
−
oprawione druciki proste i ezy, pincety, skalpele, szczypce Corneta, nożyczki,
−
palniki, siatki laboratoryjne, trójnogi,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
−
statywy do probówek, puszki metalowe do pipet i płytek,
−
termometry,
c)
szkło laboratoryjne:
−
probówki bakteriologiczne duże i małe – służą do przechowywania pożywek,
płynów do rozcieńczeń i do hodowli bakterii; zamyka się je korkami z waty w celu
ochrony zawartości probówek przed zakażeniem z zewnątrz, jednocześnie
umożliwiając wymianę gazową,
−
płytki Petriego – są naczyniami do hodowli na pożywkach stałych, składają się
z dwóch nakładających się na siebie płaskodennych szklanych miseczek; zapewniają
dostęp powietrza do hodowli, a jednocześnie chronią pożywkę przed zakażeniem
zewnętrznym,
−
pipety bakteriologiczne z podziałką (pojemność 1 cm
3
, 2 cm
3
i 10 cm
3
) – służą do
odmierzania cieczy oraz do posiewów, czyli przenoszenia badanego materiału
zawierającego drobnoustroje,
−
kolby i butelki do pożywek i odczynników – zamyka się je korkami z waty,
−
cylindry miarowe,
−
szkiełka przedmiotowe i nakrywkowe do preparatów mikroskopowych,
−
bagietki szklane, łyżeczki porcelanowe.
Przygotowanie sprzętu i szkła laboratoryjnego do prac mikrobiologicznych:
−
szkło laboratoryjne musi być dobrze umyte z użyciem detergentów, a następnie
wypłukane i wysuszone,
−
szkło używane do badań mikrobiologicznych musi być wyjałowione,
−
butelki, kolby i probówki zamyka się korkami z waty,
−
pipety i płytki umieszcza się w futerałach lub owija w papier bądź folię aluminiową,
−
szkło sterylizuje się w suszarce lub w sterylizatorze na suche gorące powietrze,
−
sprzęt laboratoryjny posiadający metalowe nakrętki, podkładki gumowe itp., oraz
pożywki muszą być wyjaławiane w aparacie Kocha (w parze bieżącej) lub w autoklawie
(w parze pod ciśnieniem).
Budowa mikroskopu. Rodzaje preparatów mikroskopowych i sposób ich wykonania
Mikroskop świetlny stanowi podstawowy przyrząd do badania drobnoustrojów. Przy jego
pomocy można w preparacie mikroskopowym określić obecność i liczbę drobnoustrojów,
cechy morfologiczne obserwowanych komórek, sposób rozmnażania, zdolność ruchu,
obecność zarodników lub kształt zarodni u grzybów.
Mikroskop świetlny składa się z dwóch zasadniczych układów: mechanicznego
i optycznego.
a)
części mechaniczne to:
−
statyw – przymocowany jest do niego stolik i tubus,
−
tubus – posiada w górnej części okular, a w dolnej urządzenie rewolwerowe
z obiektywami,
−
ś
ruba makrometryczna i mikrometryczna – służą do podnoszenia i opuszczania
tubusa, co umożliwia ustawienie ostrości obrazu,
b)
części optyczne to:
−
obiektywy – składają się z zespołu soczewek powiększających, umożliwiają tworzenie
obrazu,
−
okular – powiększa wytworzony obraz, całkowite powiększenie, uzyskane
w mikroskopie, oblicza się mnożąc powiększenie obiektywu przez powiększenie
okularu,
−
kondensor – jest zespołem soczewek, skupia światło,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
−
przesłona – umożliwia regulację dopływu światła,
−
lusterko – kieruje światło do aparatu; może być zastąpione światłem elektrycznym
umieszczonym w podstawie statywu.
Przy powiększeniach do 60x preparat ogląda się w tzw. systemie suchym, czyli
przestrzeń między preparatem a soczewką obiektywu jest pusta. Przy powiększeniu 100x
stosuje się system imersyjny, w którym na preparat nanosi się kroplę olejku imersyjnego
(zwykle olejek cedrowy), w którym zanurza się obiektyw. Poprawia to jasność obrazu na
skutek nierozpraszania promieni.
Rodzaje preparatów mikroskopowych:
a)
preparaty przeżyciowe – do obserwacji żywych drobnoustrojów:
−
preparat w kropli spłaszczonej – przygotowuje się go na szkiełku przedmiotowym;
jeśli materiał badany jest płynny, przenosi się kroplę na szkiełko i przykrywa
szkiełkiem nakrywkowym; jeśli badany materiał jest stały, najpierw należy nanieść
na szkiełko przedmiotowe kroplę płynu (wody destylowanej lub soli fizjologicznej),
a następnie wprowadza się badany materiał i miesza go z wodą,
−
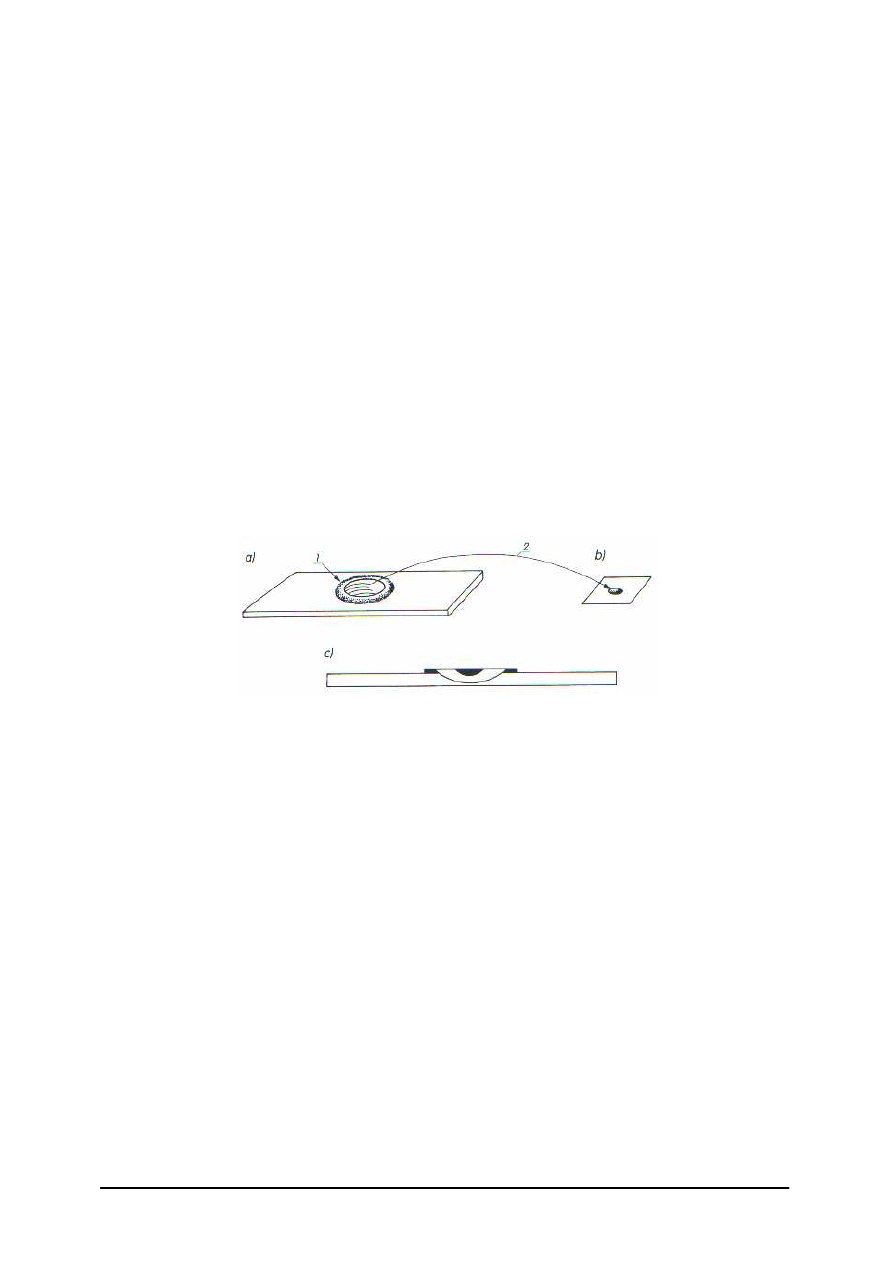
preparat w tzw. kropli wiszącej – służy do obserwacji ruchu drobnoustrojów;
preparat wykonuje się na szkiełku przedmiotowym z zagłębieniem: kroplę badanej
hodowli umieszcza się na szkiełku nakrywkowym, następnie szkiełko to umieszcza
się na szkiełku przedmiotowym tak, aby kropla swobodnie wisiała nad zagłębieniem,
Rys. 1. Schemat wykonania „kropli wiszącej”: a) szkiełko podstawowe z wgłębieniem otoczonym wazeliną,
b) szkiełko nakrywkowe z kropelką badanego materiału, c) schematyczny przekrój przez „kroplę wiszącą”;
1 – krążek wazeliny, 2 – szkiełko podstawowe, z wgłębieniem nakładane na szkiełko nakrywkowe
z kropelką badanego materiału [2, s. 27]
b)
preparaty utrwalone i barwione – służą do obserwacji drobnoustrojów martwych, ale
umożliwiają dokładniejszą obserwację komórek; w przygotowaniu takiego preparatu
wyróżnia się etapy:
−
przygotowanie preparatu mazanego lub odciskowego; preparat mazany przygotowuje
się przez równomierne rozprowadzenie na części szkiełka przedmiotowego kropli
hodowli płynnej; preparat odciskowy sporządza się w ten sposób, że badany materiał
przyciska się do szkiełka przedmiotowego,
−
suszenie i utrwalenie wykonanego preparatu przez przesuwanie nad płomieniem
palnika,
−
barwienie preparatu – umożliwia wykrycie cech biochemicznych komórek;
w barwieniu prostym stosuje się jeden barwnik (błękit metylenowy lub fuksynę
zasadową), w barwieniu złożonym stosuje się co najmniej dwa barwniki
(np. barwienie metodą Grama).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Zasady wykonania posiewów drobnoustrojów na pożywki hodowlane
Wszystkie czynności mikrobiologiczne należy wykonywać w sposób jałowy. W technice
mikrobiologicznej stosujemy:
−
posiew – wprowadzenie badanego materiału do odpowiedniej pożywki,
−
przesiew – przenoszenie drobnoustrojów z jednej pożywki na drugą.
Do posiewów i przesiewów stosujemy ezy i pipety pasteurowskie (do posiewów
z pożywki płynnej do płynnej lub z płynnej na stałą), igły preparacyjne (do posiewów w głąb
pożywki stałej). Na rysunku przedstawiono kolejne czynności podczas jałowego pobierania
hodowli.
Rys. 2. Pobieranie hodowli do badań mikroskopowych: A) wyjaławianie ezy w płomieniu,
B) otwarcie probówki, C) opalanie brzegu probówki, D) pobieranie materiału (przez dotknięcie
ezą wzrostu drobnoustrojów), E) ponowne opalanie brzegu probówki, F) zamknięcie probówki
pod osłoną płomienia, G) przeniesienie materiału do kropli wody na szkiełku przedmiotowym
(lub do innej probówki), H) wyjaławianie ezy w płomieniu po zakończeniu manipulacji [2, s. 33]
Przy posiewie do pożywki płynnej należy zanurzyć w niej ezę. Przy posiewie do pożywki
stałej wykonuje się:
a)
posiew rysowy – w przypadku pożywki w postaci skosu,
b)
posiew kłuty – w przypadku pożywki w postaci słupka,
c)
posiewając badany materiał na powierzchnię pożywki w płytce Petriego wykonuje się ezą
rysę w sposób pokazany na rysunku.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Rys. 3. Przykłady posiewu rysowego [2, s. 34]
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Dlaczego ważne jest zachowanie jałowości w trakcie pracy w pracowni
mikrobiologicznej?
2.
Jakie są podstawowe zasady pracy w pracowni mikrobiologicznej umożliwiające
zachowanie jałowości?
3.
Z jakich części składa się mikroskop świetlny?
4.
Jak obliczyć powiększenie całkowite mikroskopu?
5.
W jaki sposób przygotowuje się sprzęt i szkło laboratoryjne do prac mikrobiologicznych?
6.
W jakim celu wykonuje się mikroskopowe preparaty przeżyciowe?
7.
Jakie są etapy wykonania preparatu utrwalonego barwionego?
8.
Co to jest posiew?
4.1.3. Ćwiczenia
Ćwiczenie 1
Dokonaj obserwacji mikroskopowej ziaren skrobi w miąższu bulwy ziemniaka. Wykonaj
rysunek obrazu mikroskopowego z opisem.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
ś
ciąć możliwie najcieńszy skrawek miąższu bulwy ziemniaka i ułożyć go na szkiełku
przedmiotowym,
2)
dodać kroplę płynu Lugola do preparatu, nakryć szkiełkiem nakrywkowym,
3)
przygotować mikroskop do obserwacji – włączyć elektryczne źródło światła lub
manipulując lusterkiem oświetlić równomiernie pole widzenia,
4)
umieścić preparat mikroskopowy na stoliku przedmiotowym,
5)
obserwować obraz preparatu (zabarwione ziarna skrobi), zaczynając od najmniejszego
powiększenia, a potem stosować coraz większe,
6)
wykonać rysunki obserwowanych obrazów mikroskopowych wraz z opisem.
Wyposażenie stanowiska pracy:
−
mikroskop,
−
szkiełka przedmiotowe i nakrywkowe,
−
ziemniak,
−
płyn Lugola,
−
skalpel.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Ćwiczenie 2
Dokonaj obserwacji mikroskopowej preparatu bakteryjnego pod imersją.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować mikroskop do obserwacji – włączyć elektryczne źródło światła lub
manipulując lusterkiem oświetlić równomiernie pole widzenia,
2)
umieścić preparat mikroskopowy na stoliku przedmiotowym,
3)
ustawić obiektyw o najmniejszym powiększeniu nad preparatem mikroskopowym,
4)
ustawić ostrość obserwowanego obrazu (patrząc jednocześnie przez okular) przy pomocy
ś
ruby makrometrycznej, a następnie śruby mikrometrycznej,
5)
oglądać preparat w kilku polach widzenia,
6)
przestawić obiektyw o silniejszym powiększeniu i powtórzyć czynności,
7)
obejrzeć preparat z użyciem obiektywu o powiększeniu 100x:
−
po wyszukaniu interesującego szczegółu w preparacie pod słabszym powiększeniem
podnieść tubus do góry i ustawić obiektyw 100x,
−
na preparat nanieść kroplę olejku immersyjnego,
−
obserwując z zewnątrz opuścić tubus aż do zetknięcia się soczewki obiektywu
z olejkiem,
−
patrząc przez okular obniżyć tubus aż ukaże się obraz w polu widzenia,
−
ustawić ostrość obrazu i dokonać obserwacji preparatu,
8)
podnieść obiektyw i zdjąć preparat po zakończeniu obserwacji,
9)
wyczyścić obiektyw imersyjny szmatką zwilżoną w benzynie, a potem szmatką
zanurzoną w alkoholu etylowym,
10)
ustawić w osi optycznej mikroskopu obiektyw o najmniejszym powiększeniu i wyłączyć
ź
ródło światła.
Wyposażenie stanowiska pracy:
−
mikroskop z obiektywem imersyjnym,
−
gotowy preparat bakteryjny,
−
olejek imersyjny,
−
benzyna,
−
alkohol etylowy,
−
szmatka.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wymienić zasady pracy w pracowni mikrobiologicznej?
2)
rozróżnić szkło laboratoryjne i sprzęt używany w pracowni
mikrobiologicznej?
3)
przygotować sprzęt i szkło do pracy laboratoryjnej?
4)
rozróżnić w mikroskopie świetlnym jego części mechaniczne
i optyczne?
5)
wykonać mikroskopowy preparat przeżyciowy?
6)
wykonać mikroskopowy preparat utrwalony barwiony?
7)
wykonać posiew na powierzchnię pożywki w płytce Petriego?
8)
dokonać obserwacji mikroskopowej bakterii pod obiektywem
imersyjnym?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.2. Morfologia i fizjologia drobnoustrojów
4.2.1. Materiał nauczania
Budowa i cykle rozwojowe wirusów
Wirusy – to twory organiczne składające się z jednego rodzaju kwasu nukleinowego
(DNA lub RNA) oraz białka. Nie wykazują budowy komórkowej i nie przeprowadzają
samodzielnie żadnych procesów metabolicznych, a poza żywymi komórkami nie wykazują
ż
adnych funkcji życiowych.
Klasyfikacje wirusów:
a)
rodzaj wirusa:
−
wirusy roślinne – zawierają RNA (wielkość 30–3000 nm),
−
wirusy zwierzęce – zawierają DNA lub RNA (wielkość 10–275 nm),
−
bakteriofagi – zawierają DNA (wielkość 40–100 nm),
b)
forma wirusa:
−
wirusy bryłowe (wielościenne),
−
wirusy spiralne,
−
bakteriofagi.
Budowa wirusów.
wirion = kapsyd + kwas nukleinowy
wirion – to cząsteczka wirusa
kapsyd – to otoczka białkowa zbudowana z podjednostek zwanych kapsomerami.
U niektórych wirusów kapsyd może być dodatkowo okryty białkowo-lipidową otoczką
(osłonką), która jest utworzona z elementów błony komórkowej gospodarza z dodatkiem
glikoprotein wirusa. U wielu wirusów, w trakcie namnażania w komórkach gospodarza,
dochodzi do powstawania drobnych zmian m.in. w budowie kapsydu, czego skutkiem jest
duża zmienność tych form wirusów i trudności w ich zwalczaniu.
Rys. 4. Schemat budowy wirionu: a) glikoproteina, b) osłonka, c) materiał genetyczny, d) kapsyd. [1, s. 43]
Namnażanie się wirusów
Wirusy posiadają informację genetyczną, ale z powodu braku układów enzymatycznych
nie mają możliwości samodzielnie z niej korzystać. Aby przekazać informację genetyczną
kolejnym pokoleniom wirusów i syntetyzować białka muszą korzystać z żywych komórek
(zarówno Procaryota jak i Eucaryota). Po wniknięciu do komórki gospodarza narzucają jej
własną informację genetyczną i przestawiają metabolizm na syntezę nowych cząstek
wirusowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Przebieg infekcji wirusowej:
a)
wniknięcie wirusa do komórki (lub wprowadzenie samego kwasu nukleinowego),
b)
wytwarzanie przez zainfekowaną komórkę białek kapsydowych oraz powielanie kwasu
nukleinowego wirusa,
c)
łączenie kapsydów z kwasami nukleinowymi w kompletne cząsteczki wirionów,
d)
uwolnienie potomnych wirionów.
Namnażanie wirusa kończy się zniszczeniem komórki gospodarza (liza komórki), dlatego
cykl ten nazywamy litycznym.
Niekiedy wirusowy DNA po wniknięciu do komórki gospodarza zostaje przyłączony do
jego DNA, powiela się razem z nim i jest przekazywany w czasie podziałów komórkom
potomnym. Nie następuje liza komórki. Taka forma powielania się wirusa nazywana jest
cyklem lizogenicznym.
Prowirus – to komórka gospodarza z przyłączonym materiałem genetycznym wirusa.
Budowa i czynności życiowe bakterii
Bakterie są najmniejszymi, jednokomórkowymi istotami żywymi. Należą do grupy
organizmów Procaryota, czyli bezjądrowych.
Rys. 5. Kształty bakterii: a) ziarniak, b) dwoinka, c) czwórniak, d) paciorkowiec, e) pakietowiec,
f) gronkowiec, g) pałeczka, h) laseczka, i) przecinkowiec, k) śrubowiec, l) krętek. [2, s. 42]
Najczęściej występujące formy morfologiczne komórek bakteryjnych to:
−
bakterie kuliste – ziarenkowce,
−
bakterie cylindryczne – pałeczki i laseczki,
−
bakterie spiralne – przecinkowce, śrubowce i krętki.
Bakterie kuliste mogą tworzyć układy komórek:
−
dwoinki – połączone po dwie,
−
czwórniaki – połączone po cztery,
−
paciorkowce – ułożone w łańcuszki,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
−
gronkowce — ułożone w formie gron,
−
pakietowce — w postaci pakietów.
W budowie wewnętrznej wszystkich komórek bakteryjnych możemy wyróżnić:
−
ś
cianę komórkową – jest sztywna i elastyczna, głównym składnikiem szkieletowym jest
mureina (mukopeptyd). Chroni komórkę przed szkodliwymi wpływami środowiska oraz
nadaje jej określony kształt. U bakterii gram (-) jest dość cienka, a u gram (+) znacznie
grubsza, co powoduje różnice we właściwościach fizjologicznych tych grup bakterii,
−
błonę komórkową – ma budowę białkowo-fosfolipidową, jest półprzepuszczalna,
uczestniczy więc w transporcie substancji do wnętrza i na zewnątrz komórki, zawiera
enzymy oddechowe,
−
nukleoid – to długa nić DNA, zamknięta w kolisty twór, zawiera geny bakterii,
−
cytoplazmę – to galaretowata substancja, wypełniająca wnętrze komórki,
−
rybosomy – odgrywają zasadniczą rolę w biosyntezie białka,
−
mezosomy – to błoniaste twory, powstające przez wpuklenie błony cytoplazmatycznej,
odpowiedzialne są za oddychanie i produkcję ATP,
−
ciała zapasowe – zawierają glikogen, tłuszcze, białka, wolutynę.
Rys. 6. Schemat budowy komórki bakteryjnej: 1 – rzęska, 2 – ciałko podstawowe rzęski,
3 – błona komórkowa, 4 – fimbrie, 5 – mezosom, 6 – otoczka, 7 – ściana komórkowa,
8 – przestrzeń między ścianą a błoną komórkową, 9 – wgłębienie błony komórkowej,
10 – nukleoid, 11 – skupiska cytoplazmy, 12 i 12’ – materiały zapasowe, 13 – rybosomy,
14 – skupisko rybosomów, 15 – plazmid, 16 – przetrwalnik,
17 – zgrupowanie błon wewnątrz cytoplazmy. [2, s. 43]
Niektóre bakterie posiadają dodatkowe organelle komórkowe takie jak:
−
otoczka śluzowa – pokrywa ścianę komórkową, chroni przed wysychaniem
i szkodliwymi czynnikami środowiska,
−
rzęski – to organ ruchu,
−
plazmidy – to dodatkowe, koliste cząsteczki DNA, zawierające informacje genetyczne
o cechach przystosowawczych komórek bakteryjnych takich jak: oporność na działanie
czynników chemicznych, zdolność produkowania toksyn, a także cechy wyznaczające
płeć bakterii. Nie są niezbędne do życia komórki,
−
ciała chromatoforowe – występują u bakterii autotroficznych, zawierają bakteriochlorofil,
są centrami procesów fotosyntezy,
−
fimbrie – to wypustki cytoplazmatyczne, ułatwiają przyczepianie się komórek
bakteryjnych do podłoża,
−
fimbrie płciowe – to wypustki cytoplazmatyczne służące do łączenia dwóch komórek
bakteryjnych podczas procesu koniugacji,
−
endospory – to twory umożliwiające przetrwanie szkodliwych czynników środowiska,
składają się z nukleoidu otoczonego grubą ścianą komórkową.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Czynności życiowe bakterii.
odżywianie
autotroficzne
heterotroficzne
•
fotosyntetyzujące
•
saprofity
•
chemosyntetyzujące
•
pasożyty
•
symbionty
Rys. 7. Sposoby odżywiania bakterii
Bakterie autotroficzne wytwarzają związki organiczne ze związków nieorganicznych
(CO
2
i H
2
O) przy udziale energii pochodzącej z różnych źródeł:
a)
fotoautotrofy – przy udziale energii świetlnej (bakterie purpurowe i zielone),
b)
chemoautotrofy – przy udziale energii uzyskanej z utleniania związków nieorganicznych:
−
bakterie nitryfikacyjne — utleniają NH
3
do NO
2
-
(np. Nitrosomonas, Nitrosospira),
oraz NO
2
-
do NO
3
-
(np. Nitrobacter),
−
bakterie siarkowe – utleniają siarkowodór, siarkę pierwiastkową, tiosiarczany
(np. Thiobacillus),
−
bakterie wodorowe – utleniają wodór (np. Hydrogenomonas),
−
bakterie żelazowe – utleniają sole żelaza (np. Thiobacillus ferrooxidans).
Bakterie heterotroficzne syntetyzują własne związki organiczne z gotowych substancji
organicznych pobranych ze środowiska:
a)
saprofity – rozkładają i odżywiają się martwą materią organiczną, odgrywają bardzo
ważną rolę w procesach mineralizacji,
b)
pasożyty – czerpią substancje organiczne z żywych organizmów, należą tu wszystkie
bakterie chorobotwórcze,
c)
symbionty – żyją z określonymi organizmami w symbiozie, dzięki której obie strony
uzyskują korzyści pokarmowe.
Niektóre bakterie posiadają szczególną zdolność do asymilacji wolnego azotu
z atmosfery i redukowania go do NH
3
. Proces ten wymaga dużych nakładów energetycznych
oraz złożonego aparatu enzymatycznego. Asymilację N
2
przeprowadzają bakterie z rodzaju
Rhizobium (żyją w symbiozie z korzeniami roślin motylkowych), Azotobakter chroococcum,
Clostridium pasteurianum (bakterie glebowe).
Oddychanie – to procesy biochemiczne, w wyniku których następuje rozkład złożonych
substancji organicznych na proste, z wydzieleniem energii w formie użytkowej (ATP).
Większość bakterii wykorzystuje w oddychaniu tlen atmosferyczny – są to bakterie
tlenowe (aeroby). Bakterie, które utleniają związki organiczne bez udziału tlenu – to bakterie
beztlenowe (anaeroby).
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Tabela 1. Porównanie procesu oddychania tlenowego i beztlenowego bakterii
Porównywana cecha
Oddychanie tlenowe
Oddychanie beztlenowe
substrat oddechowy
glukoza
glukoza
stopień utlenienia substratu
całkowity
częściowy
produkty końcowe
CO
2
, H
2
O
kwas mlekowy, kwas octowy, kwas
masłowy, etanol
akceptor elektronów
tlen atmosferyczny
związek organiczny lub utleniony
związek nieorganiczny
zysk energetyczny z 1 cząsteczki glukozy
32 – 36 ATP
2 ATP
przykład bakterii
Azotobacter
Clostridium, Lactobacillus
Rozmnażanie się bakterii
Bakterie rozmnażają się bezpłciowo przez podział komórki. U niektórych bakterii
występuje proces płciowy, tzw. koniugacja. Polega on na czasowym połączeniu się dwóch
komórek bakteryjnych przy pomocy fimbrii płciowych i wymianie między nimi fragmentu
DNA, najczęściej plazmidowego. W wyniku koniugacji powstają komórki zrekombinowane.
Systematyka bakterii (wybrane jednostki taksonomiczne).
Tabela 2. Bakterie bytujące w środowiskach naturalnych i żywności (podział bakterii wg Bergey’a 1984 r.)
[2, s. 36]
Grupa
Rodzina
Rodzaj
Gatunek
Pseudomonadaceae
Pseudomonas
Pseudomonas fluorescens
Gram-ujemne
tlenowe, pałeczki i
ziarniaki
Acetobacteriaceae
Acetobacter
Acetobacter curvum
Acetobacter orleanense
Acetobacter xylinum
Escherichia
Escherichia coli
Shigella
Shigella dysenteriae
Salmonella
Salmonella typhi
Serratia
Serratia marcescens
Względnie
beztlenowe, Gram-
ujemne, pałeczki
Enterobacteriaceae
Proteus
Proteusz vulgaris
Micrococcus
Micrococcus caseolyticus
Staphylococcus
Staphylococcus aureus
Streptococcus
Streptococcus puogenes
Streptococcus faecalis
Streptococcus lactis
Streptococcus cremoris
Gram-dodatnie
ziarniaki
Micrococcaceae
Leuconostoc
Leuconostoc citrovorum
Bacillus
Bacillus subtilis
Bacillus cereus
Bacillus anthracis
Gram-dodatnie
pałeczki
wytwarzające
przetrwalniki
Clostridium
Clostridium butyricum
Clostridium botulinum
Clostridium tetani
Clostridium perfringens
Gram-dodatnie
regularne pałeczki,
nie wytwarzające
przetrwalników i
ziarniaki
Lactobacillus
Lactobacillus plantarum
Lactobacillus lactis
Lactobacillus helveticus
Microbacterium
Gram-dodatnie,
nieregularne
pałeczki, nie
wytwarzające
przetrwalników
Propionibacterium
Propionibacterium shermanii
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Budowa i czynności życiowe grzybów
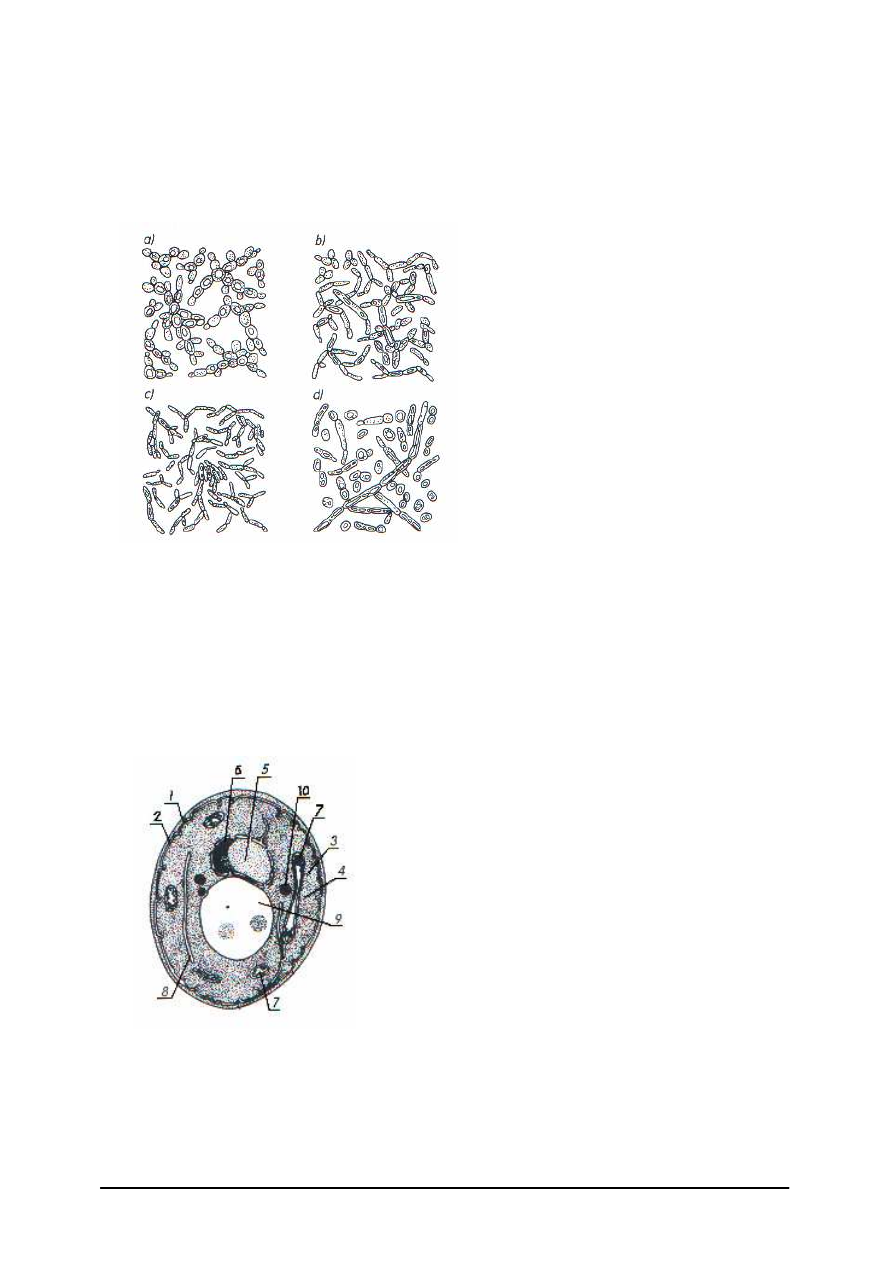
Do drobnoustrojów zaliczamy grzyby mikroskopowe, czyli drożdże i pleśnie.
Drożdże (rodzina Saccharomycetaceae) to jednokomórkowe grzyby. Komórki drożdży
mają kształty kuliste, elipsoidalne, mniej lub bardziej wydłużone, dodatkowo mogą się one
zmieniać w zależności od wieku i warunków hodowli.
Rys. 8. Różne kształty komórek drożdży:
a) Saccharomyces cerevisiae, b) Candida
mycoderma, c) Pichia membranaefaciens,
d) Hansenula anomala [2, s. 47]
Komórka drożdży zawiera:
−
ś
cianę komórkową – zawiera chitynę, mannan i glukan, otoczona jest warstwą śluzu,
−
błonę cytoplazmatyczną,
−
cytoplazmę,
−
jądro – zawiera materiał genetyczny komórki (DNA),
−
retikulum endoplazmatyczne,
−
mitochondria – służą do oddychania,
−
rybosomy,
−
wodniczki,
−
substancje zapasowe – wolutyna, glikogen, tłuszcze.
Rys. 9. Schemat budowy komórki drożdży: 1 – ściana komórkowa,
2 – błona cytoplazmatyczna, 3 – cytoplazma, 4 – rybosomy, 5 –
jąderko, 6 – jadro, 7 – mitochondria, 8 – retikulum
endoplazmatyczne, 9 – wodniczki, 10 – krople lipidów [2, s. 48]
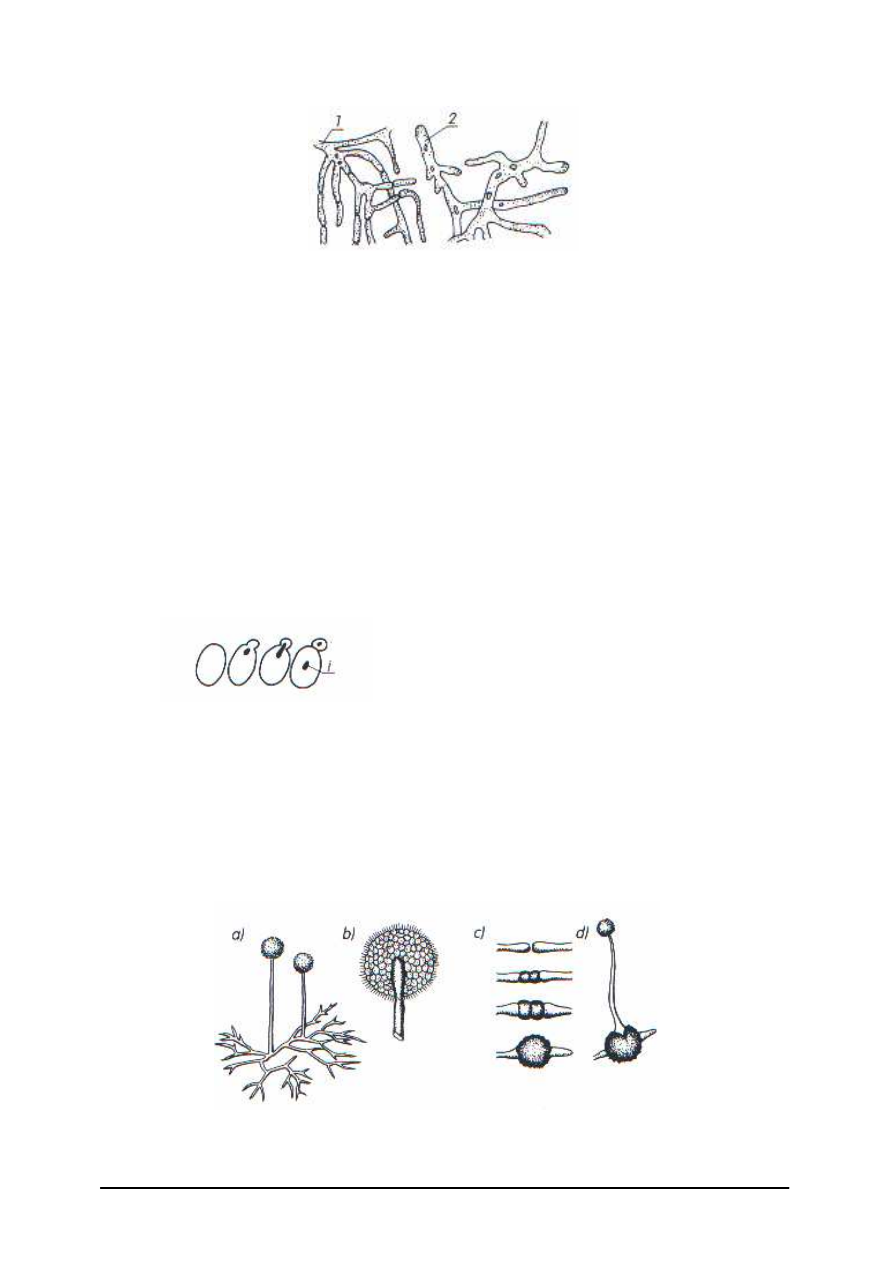
Pleśnie są grzybami jedno- lub wielokomórkowymi. Pleśń tworzy grzybnię, składającą
się z nitkowatych tworów, zwanych strzępkami. Strzępki mogą być komórczakami –
pojedynczymi komórkami o wielu jądrach, lub posiadają poprzeczne przegrody, dzielące
strzępkę na wiele komórek.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Rys. 10. Fragment grzybni pleśni : 1 – wielokomórkowej, 2 – jednokomórkowej [2, s. 49]
Wszystkie grzyby są heterotrofami:
−
saprofity – większość drożdży i pleśni rozwija się kosztem martwej materii organicznej,
−
pasożyty – żywią się kosztem żywych organizmów.
Sposób oddychania zależy od wyposażenia enzymatycznego komórek, tak więc drożdże
oddychają tlenowo i beztlenowo, a pleśnie są organizmami tlenowymi.
Sposoby rozmnażania się grzybów:
a)
drożdże:
−
pączkowanie – polega na tworzeniu przez komórkę macierzystą uwypuklenia, które
stopniowo się powiększa. Jednocześnie następuje podział jądra komórkowego i jego
część przechodzi do tworzącej się komórki potomnej. Może ona oddzielić się od
komórki macierzystej lub pozostać z nią połączona, w wyniku czego powstają
charakterystyczne łańcuszki komórek drożdży,
−
rozmnażanie płciowe – polega na łączeniu się dwóch komórek i powstaniu zygoty,
wewnątrz której tworzą się zarodniki (zwykle 4 lub 8). Zarodniki mają charakter
przetrwalnikowy, wykazują większą odporność na niekorzystne czynniki zewnętrzne
niż komórki wegetatywne drożdży,
Rys. 11. Kolejne stadia pączkowania komórki drożdży;
j – jądro komórkowe [2, s. 61]
b)
pleśnie:
−
zarodniki – u pleśni z rodzaju pleśniaka (Mucor) tworzą się wewnątrz zarodni
(endospory); dojrzałe zarodniki wysypują się na zewnątrz zarodni i trafiając na
odpowiednie podłoże kiełkują,
−
zarodniki konidialne – występują u pleśni z rodzaju pędzlak (Penicillium) i kropidlak
(Aspergillus); są to zarodniki zewnętrzne (egzospory), które tworzą się przez
odcięcie końcowych fragmentów strzępek grzybni,
−
rozmnażanie płciowe – najczęściej ma postać gametangiogamii, czyli zlania się
gametangiów dwóch osobników i wytworzenia w ten sposób tzw. zygospory.
Rys.12. Pleśń z rodzaju Mucor: a) grzybnia z zarodnikami, b) przekrój przez zarodnię,
c) kolejne stadia tworzenia się zygospory, d) kiełkująca zygospora [2, s. 63]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jaka jest budowa wirusów?
2.
Czym różni się cykl lityczny namnażania wirusa od cyklu lizogenicznego?
3.
Jakie są formy morfologiczne i układy komórek bakteryjnych?
4.
Jakie elementy komórkowe występują w każdej komórce bakteryjnej i jakie są ich
funkcje?
5.
Jaka jest rola endospor wytwarzanych przez niektóre bakterie?
6.
Na czym polegają autotroficzne i heterotroficzne sposoby odżywiania się bakterii?
7.
Czym różni się proces oddychania tlenowego od oddychania beztlenowego?
8.
Na czym polega proces koniugacji bakterii?
9.
Z jakich organelli zbudowana jest komórka drożdży?
10.
Jak odżywiają się grzyby?
11.
Na czym polega proces pączkowania drożdży?
12.
Jakie rodzaje zarodników wytwarzają pleśnie?
4.2.3. Ćwiczenia
Ćwiczenie 1
Scharakteryzuj formy morfologiczne i układy komórek bakteryjnych w gotowych
preparatach mikroskopowych. Wykonaj rysunki oglądanych obrazów mikroskopowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować mikroskop do obserwacji preparatów,
2)
obejrzeć pod obiektywem imersyjnym gotowe barwione preparaty bakterii,
3)
porównać formy morfologiczne i układy komórek bakteryjnych w oglądanych obrazach
mikroskopowych,
4)
nazwać obserwowane formy morfologiczne i układy komórek bakteryjnych,
5)
wykonać rysunki obserwowanych obrazów mikroskopowych.
Wyposażenie stanowiska pracy:
−
mikroskopy z obiektywami imersyjnymi,
−
trwałe barwione preparaty bakterii o różnych formach morfologicznych i układach
komórek,
−
olejek imersyjny,
−
szmatki, benzyna, alkohol etylowy.
Ćwiczenie 2
Sporządź preparat z hodowli drożdży i przeprowadź obserwację mikroskopową. Wykonaj
rysunek oglądanego obrazu mikroskopowego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować hodowlę drożdży piekarskich:
−
do zlewki wlać 100 cm
3
przegotowanej wody,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
−
dodać łyżeczkę cukru (glukoza lub sacharoza),
−
dodać około 10–20 g drożdży piekarskich, wszystko zamieszać,
−
pozostawić hodowlę w temperaturze 20–25°C na około 20 minut,
2)
przygotować mikroskop do obserwacji preparatu,
3)
nanieść pipetą kroplę hodowli drożdży na szkiełko przedmiotowe,
4)
nakryć przygotowany materiał szkiełkiem nakrywkowym,
5)
umieścić gotowy preparat na stoliku przedmiotowym mikroskopu,
6)
obserwować obraz preparatu, zaczynając od najmniejszego powiększenia, a potem
stosować coraz większe,
7)
wykonać rysunki obserwowanych obrazów mikroskopowych spod różnych powiększeń.
Wyposażenie stanowiska pracy:
−
drożdże piekarskie,
−
zlewka,
−
cukier (glukoza lub sacharoza),
−
woda przegotowana,
−
mikroskop,
−
szkiełka przedmiotowe i nakrywkowe,
−
bagietka, pipeta.
Ćwiczenie 3
Sporządź preparat pleśni i przeprowadź obserwację mikroskopową. Wykonaj rysunek
oglądanego obrazu mikroskopowego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przygotować mikroskop do obserwacji preparatu,
2)
nanieść kroplę wody destylowanej na czyste szkiełko przedmiotowe,
3)
pobrać igłą preparacyjną odrobinę pleśni z powierzchni spleśniałego chleba,
4)
rozprowadzić pobraną pleśń w kropli wody,
5)
nakryć przygotowany materiał szkiełkiem nakrywkowym,
6)
umieścić gotowy preparat na stoliku przedmiotowym mikroskopu,
7)
obserwować obraz preparatu, zaczynając od najmniejszego powiększenia, a potem
stosować coraz większe,
8)
narysować obserwowany obraz – fragment grzybni i kształt zarodni pleśni.
Wyposażenie stanowiska pracy:
−
spleśniały chleb,
−
woda destylowana,
−
mikroskop,
−
szkiełka przedmiotowe i nakrywkowe,
−
igła preparacyjna, pipeta.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
opisać budowę wirusów?
2)
omówić etapy litycznego cyklu namnażania wirusów?
3)
rozpoznać formy morfologiczne komórek bakteryjnych?
4)
wymienić elementy budowy komórki bakteryjnej?
5)
porównać oddychanie tlenowe z beztlenowym?
6)
zdefiniować sposoby odżywiania się bakterii?
7)
opisać budowę grzybów?
8)
wymienić sposoby rozmnażania się grzybów?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
4.3. Metody badania drobnoustrojów
4.3.1. Materiał nauczania
Metody hodowli mikroorganizmów
W celu dokładnej identyfikacji badanych drobnoustrojów, poza badaniami
mikroskopowymi, stosuje się metody hodowli drobnoustrojów na specjalnych podłożach,
czyli pożywkach, naśladujących naturalne warunki życiowe organizmów. Możemy w ten
sposób rozpoznać procesy fizjologiczne badanych drobnoustrojów, co ułatwia dokonanie ich
klasyfikacji taksonomicznej.
Rodzaje hodowli bakterii:
a)
okresowe – drobnoustroje wysiane na pożywkę rozwijają się do momentu wyczerpania
się składników odżywczych i zatrucia się produktami przemiany materii,
b)
ciągłe – dzięki dostarczaniu składników odżywczych i odprowadzaniu produktów
metabolizmu z podłoża, zapewniony jest ciągły rozwój organizmów.
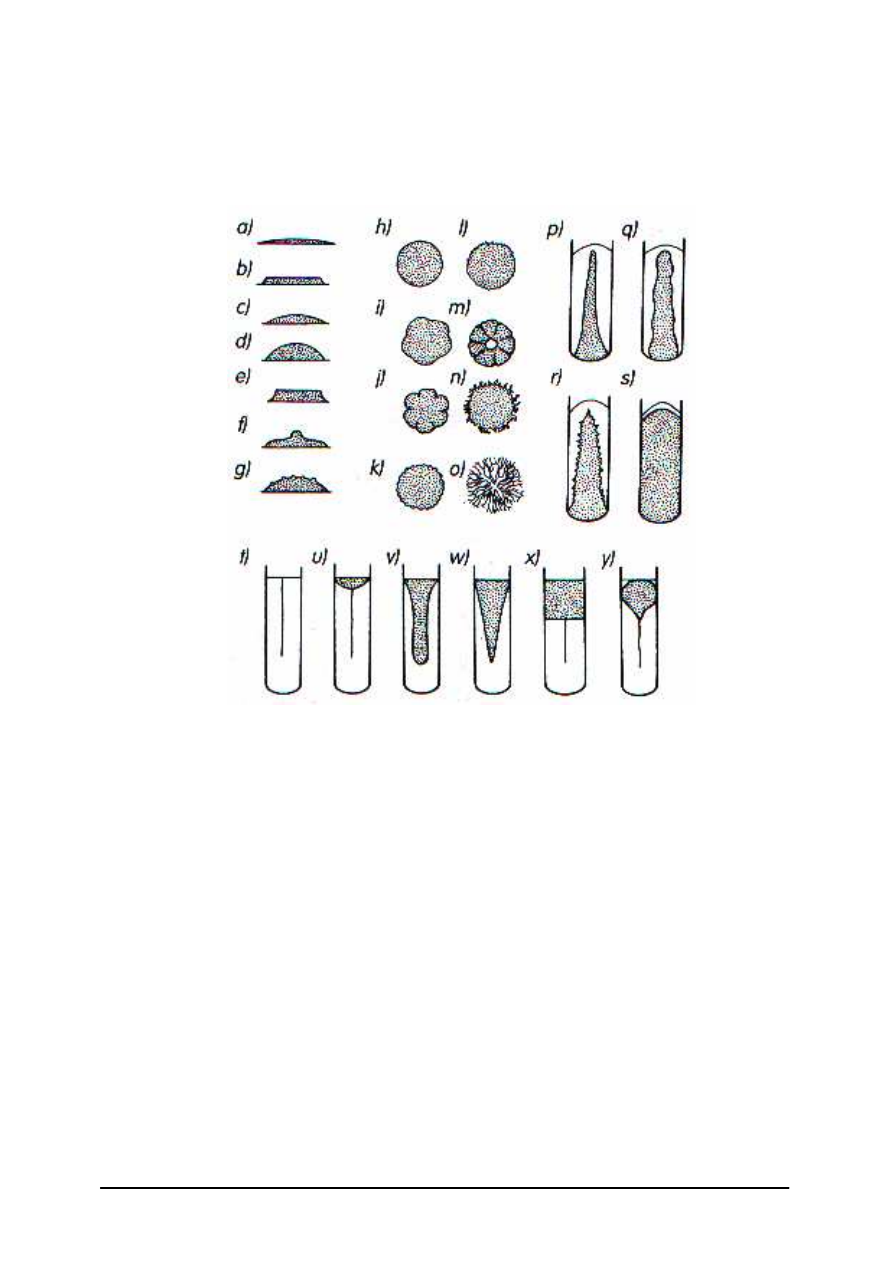
W hodowli okresowej można wyróżnić charakterystyczne fazy wzrostu hodowli (czyli
przyrostu ilości komórek bakteryjnych), tworzących tzw. krzywą wzrostu populacji
bakteryjnej.
Rys. 13. Krzywa wzrostu populacji bakteryjnej [7, s. 254]
−
faza przygotowawcza (I) – ilość bakterii nie wzrasta, organizmy przystosowują się do
nowego środowiska,
−
faza logarytmicznego wzrostu (II i III) – to okres głównego wzrostu hodowli bakterii,
−
faza równowagi (IV) – następuje równowaga między przyrostem komórek a ich
zamieraniem, liczba żywych komórek pozostaje na stałym poziomie,
−
faza zamierania (V i VI) – podziały komórek stają się bardzo rzadkie i ustają zupełnie,
w rezultacie liczba żywych komórek maleje.
Posiewy mikroorganizmów wykonuje się na pożywki płynne lub stałe. W zależności od
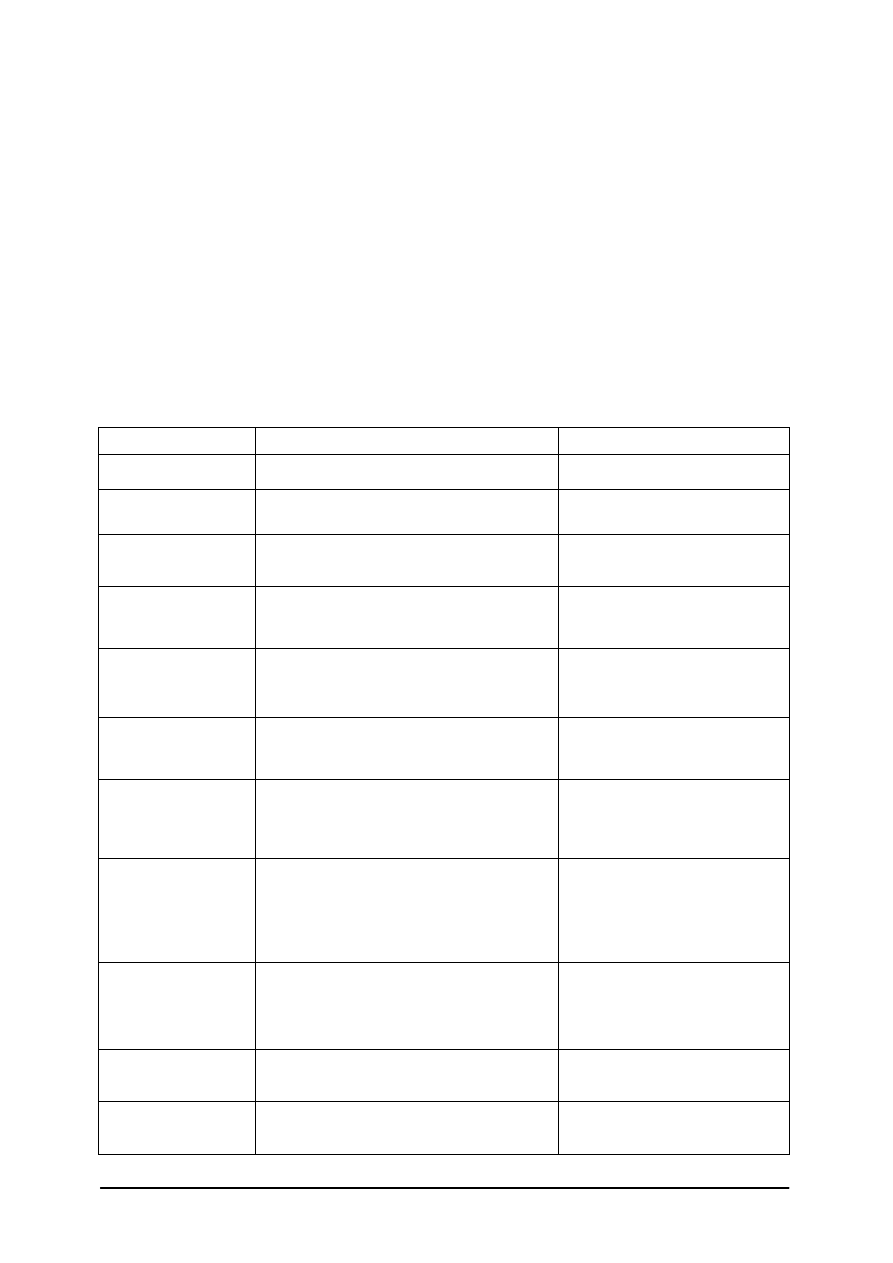
rodzaju podłoża obserwuje się:
a)
na pożywce płynnej – zmiany pożywki typu: zmętnienie, tworzenie się osadu, zmiana
zapachu, wytwarzanie gazów,
b)
na pożywce stałej – określa się cechy wyglądu kolonii bakterii:
−
wielkość – średnica kolonii podana w mm,
−
kształt – okrągły, nieregularny, rozgałęziony, nitkowaty,
−
stopień wzniesienia – płaski, wypukły, soczewkowaty niski, soczewkowaty wysoki,
pępkowaty,
−
powierzchnię – gładka i pomarszczona, może być lśniąca lub matowa,
−
strukturę – zwarta, drobnoziarnista, gruboziarnista, luźna,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
−
brzegi – gładki, falisty regularny lub nieregularny, płatowaty regularny lub
nieregularny, ząbkowany regularny lub nieregularny, nitkowaty,
−
barwę kolonii i jej przejrzystość – przeźroczysta, mętna, opalizująca,
nieprzeźroczysta oraz zabarwione, niezabarwione.
Rys. 14. Charakter wzrostu drobnoustrojów na pożywkach stałych: a-g) wzniesienia kolonii
(a – płaska, b – wzniesiona, c – lekko soczewkowata, d – wypukła, e – wzniesiona ze
ś
ciętym wierzchołkiem, f – z wzniesionym środkiem, g – brodawkowata); h-o) brzegi kolonii
(h – równy, i – falisty, j – płatowaty, k – karbowany, l – ząbkowany, m – promienisty
z brzegiem płatowatym, n – rozgałęziony, o – korzonkowaty); p-s) wzrost na agarze skośnym
(p – nitkowaty, q – lekko rozprzestrzeniający się z brzegiem falistym, r -rozprzestrzeniający się
z brzegiem ząbkowanym, s - rozprzestrzeniający się); t-y) wzrost na żelatynie kłutej (t – bez upłynnienia,
u – kraterowe upłynnienie, v – workowate, w – lejkowate, x – walcowate, y – kielichowate) [2, s. 126]
Podłoża (pożywki) mikrobiologiczne i ich zastosowanie
Pożywki stosowane do hodowli drobnoustrojów muszą spełniać następujące warunki:
a)
posiadać w podłożu określoną ilość wody, co najmniej 30%,
b)
zawierać łatwo dostępne źródło węgla i azotu:
−
ź
ródło węgla – związki organiczne dla heterotrofów, CO
2
dla autotrofów,
−
ź
ródło azotu – związki organiczne dla heterotrofów, sole amonowe i azotany,
c)
zawierać sole nieorganiczne będące źródłem pierwiastków takich jak.: fosfor, siarka,
magnez, potas, żelazo,
d)
wykazywać odpowiedni odczyn (pH) i odpowiednią wielkość ciśnienia osmotycznego,
e)
muszą być sterylne i możliwie klarowne.
Pożywki ze względu na ich kład chemiczny dzielimy na:
−
pożywki naturalne – zawierają składniki pochodzenia naturalnego: ziemniaki, mleko
odtłuszczone, jaja, surowicę krwi, wyciąg z mięsa (bulion),
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
−
pożywki syntetyczne – posiadają znany i ściśle określony skład chemiczny, zależny od
wymagań odżywczych i fizjologicznych badanych grup organizmów. Podłoża te mają
szerokie zastosowanie przy badaniu właściwości biochemicznych drobnoustrojów.
W zależności od funkcji, jakie podłoża mają spełnić w prowadzonych hodowlach,
dzielimy je na:
−
podłoża zwykłe podstawowe – pozwalają na wzrost większości badanych
mikroorganizmów, o małych wymaganiach pokarmowych,
−
podłoża wzbogacone – uzyskujemy przez dodanie do pożywki podstawowej
odpowiednich składników stymulujących wzrost organizmów o określonych
wymaganiach odżywczych,
−
podłoża różnicujące – (identyfikacyjne) służą do wykrywania cech biochemicznych
badanych mikroorganizmów; zawierają poza składnikami odżywczymi substrat
diagnostyczny, który może być enzymatycznie rozłożony tylko przez niektóre gatunki
bakterii.
Tabela 3. Przykłady pożywek stosowanych w mikrobiologii, ich skład i zastosowanie
Pożywka
Skład
Zastosowanie
bulion odżywczy
wyciąg mięsny (1 dm
3
), pepton (10 g),
chlorek sodu (5 g)
zastosowanie ogólne
agar odżywczy
agar (15 g),
bulion odżywczy (1000 cm
3
)
zastosowanie ogólne, identyfikacja
bakterii gatunku Escherichia coli
pożywka Endo
bulion agarowy (100 cm
3
), laktoza
(1,0 g), fuksyna zasadowa roztwór 3% (1 cm
3
),
Na
2
SO
3
roztwór 10% (2 cm
3
)
identyfikacja bakterii grupy coli
pożywka z laktozą,
ż
ółcią i zielenią
brylantową
pepton (10,0 g), laktoza (10,0 g), żółć wołowa
sucha (20,0 g), zieleń brylantowa (0,0133 g),
woda destylowana (1000,0 cm
3
)
identyfikacja bakterii grupy coli
podłoże Eijkmana
pepton (10,0g), NaCl – chlorek sodu (5,0g),
laktoza (5,0g), 1% roztwór błękitu
bromotymolowego (1cm
3
), woda destylowana
(1000,0cm
3
)
identyfikacja bakterii grupy coli
pożywka Clarka
pepton (5,0 g), glukoza (5,0 g), K
2
HPO
4
–
wodorofosforan (V) potasu (0,5 g), woda
destylowana (1000 cm
3
)
identyfikacja bakterii gatunku
Escherichia coli (wykrywanie typu
fermentacji)
pożywka Simonsa
NaCl (5,0 g), NH
4
H
2
PO
4
(1,0 g),
siedmiowodny siarczan (VI) magnezu (0,2 g),
cytrynian sodu (5,0 g), woda destylowana
(1000 cm
3
), agar (20,0 g)
identyfikacja bakterii gatunku
Escherichia coli (wykorzystanie
cytrynianów jako jedynego źródła
węgla)
pożywka Wilson-
Blaira
wyciąg mięsny (3,0 g), agar (25,0 g), cytrynian
bizmutowoamonowy (6,0 g), siarczan (VI)
sodu (15,0 g), wodorofosforan (V) sodu (10,0),
glukoza (10,0), cytrynian żelazowy (0,5 g),
wodny 1% roztwór zieleni brylantowej (12,0
g), woda destylowana (1270 cm
3
)
do hodowli bakterii beztlenowych
pożywka Chapmanna
agar (15,0 g), suchy wyciąg wołowy (3,0 g),
pepton (5,0 g), NaCl (75,0 g), mannitol (10,0
g), czerwień fenolowa (12,5 cm
3
), woda
destylowana
(950,0 cm
3
)
wykrywanie gronkowców
bulion zwykły z saletrą
potasową
ekstrakt mięsny (0,6 g), woda wodociągowa
(1000 cm
3
),
pepton (2,0 g), KNO
3
(1,0 g)
oznaczanie bakterii
denitryfikujących
pożywka Sabourauda
pepton (10,0 g), glukoza (40,0 g),
agar (15,0 g), woda destylowana
(1000 cm
3
),
hodowla drożdżaków
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
W podłożach stosuje się:
−
pepton – otrzymuje się z częściowej hydrolizy enzymatycznej białek, zawiera dużą ilość
wolnych aminokwasów i krótkich łańcuchów peptydowych, łatwo przyswajalnych przez
większość bakterii,
−
ż
elatynę – jest produktem białkowym pochodzenia zwierzęcego otrzymanym z chrząstek,
rozpuszcza się w wodzie w temperaturze około 40°C, krzepnie w temperaturze 20–23°C,
jako substrat białkowy jest łatwo hydrolizowana przez liczne bakterie,
−
agar – jest polisacharydem występującym w krasnorostach morskich, składa się z agarozy
(90%) i agaropektyny (10%); rozpuszcza się w temperaturze 100°C, a krzepnie po
ostudzeniu do 42–50°C; służy do zestalania podłoży, a nie jest składnikiem
pokarmowym.
Hodowanie bakterii beztlenowych wymaga stworzenia specjalnych warunków. W celu
usunięcia tlenu ze środowiska stosuje się:
−
dodawanie do pożywek substancji pochłaniających tlen,
−
dodawanie do pożywek substancji redukujących (np. kwas askorbinowy),
−
zabezpieczenie pożywek przed dostaniem się do nich tlenu przez pokrycie ich
powierzchni warstwą jałowego oleju parafinowego,
−
prowadzenie hodowli z bakteriami tlenowymi (posiewa się je na połowie płytki),
−
hodowanie w specjalnych aparatach – anaerostatach.
Metody oznaczania ogólnej liczby drobnoustrojów
Powszechnie stosowane metody oznaczania ilości drobnoustrojów dzielą się na:
a)
metody bezpośrednie – opierają się na obserwacjach mikroskopowych badanego
materiału, służą do oznaczania sumy żywych i martwych komórek,
b)
metody pośrednie (hodowlane) – opierają się na obserwacji wzrostu żywych komórek.
W przypadku oznaczenia liczby drobnoustrojów metodami pośrednimi w pierwszej
kolejności wykonuje się posiew ilościowy, z zastosowaniem metody kolejnych rozcieńczeń.
W tym celu należy odważyć lub odmierzyć określoną ilość produktu (1 lub 10 cm
3
/g), po
ewentualnym rozdrobnieniu umieścić w naczyniu i zalać 9 lub 90 cm
3
roztworu
rozcieńczalnika. Po dokładnym wymieszaniu uzyskuje się rozcieńczenie wyjściowe 10
-1
(1:10). Kolejne rozcieńczenie 10
-2
(1:100) sporządza się przenosząc 1 cm
3
zawiesiny do
kolejnej probówki z 9 cm
3
rozcieńczalnika. Sposób wykonania kolejnych rozcieńczeń jest
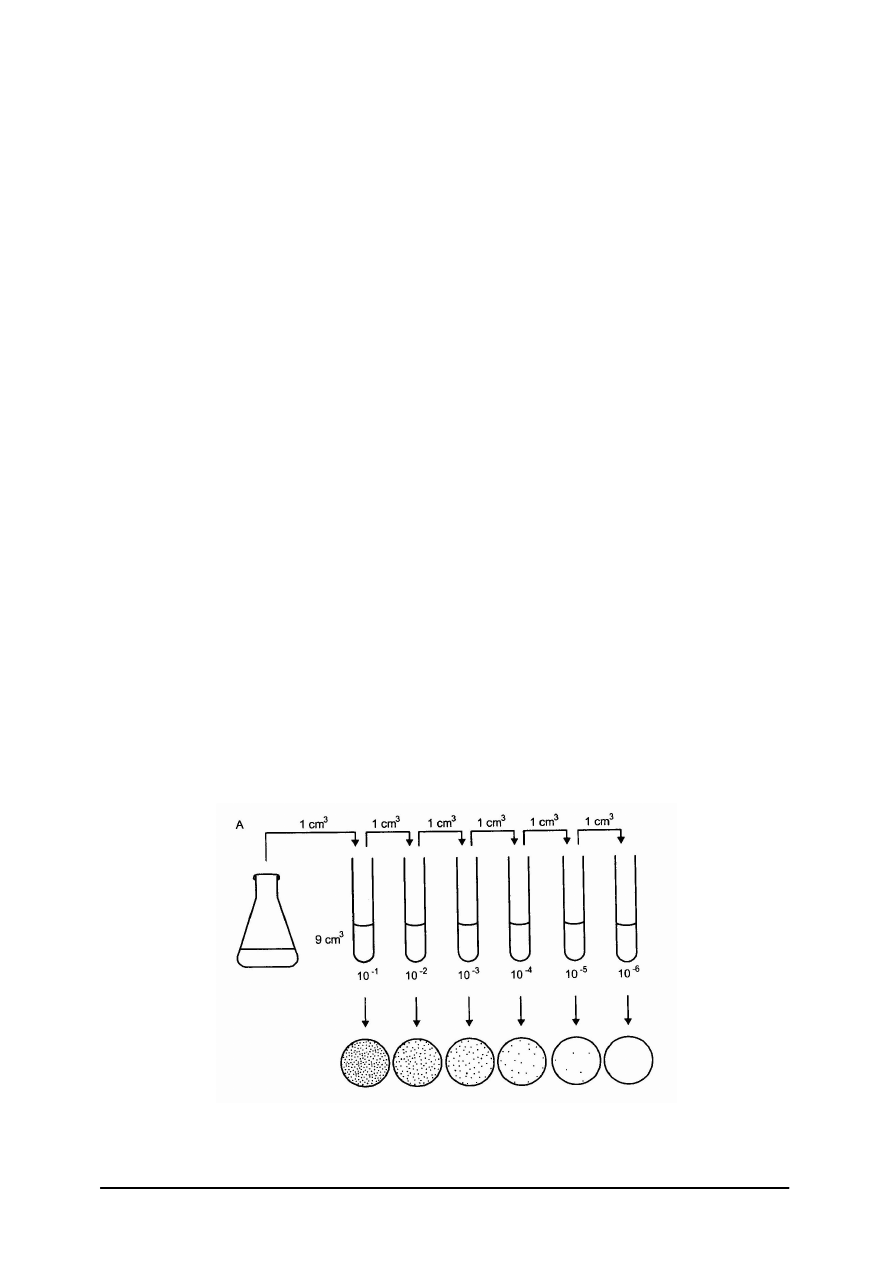
identyczny, a ich liczba zależy od rodzaju badanego materiału.
Rys. 15. Wykonanie serii rozcieńczeń [12]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Do oznaczania ogólnej liczby drobnoustrojów powszechnie stosowana jest metoda
płytkowa Kocha. W metodzie tej zakłada się, że z każdej pojedynczej komórki bakterii
przeniesionej na stałe podłoże wyrasta kolonia. Polega ona na posiewie do płytek Petriego
określonych ilości badanego materiału (po 1 cm
3
z kolejnych rozcieńczeń) i zalaniu
odpowiednią pożywką (posiew wgłębny, zalewowy).
Po zestaleniu podłoża całość się
inkubuje, po czym liczy się wyrosłe kolonie. Można również stosować posiew
powierzchniowy, czyli rozprowadzić głaszczką badany materiał na powierzchni zestalonego
już podłoża.
Liczbę organizmów oblicza się wg wzoru:
Z = A x stopień rozcieńczenia;
gdzie: A = liczba kolonii na płytce, Z = liczba organizmów.
Wynik podaje się w postaci potęgi dla liczb zawartych między 1,0 a 9,9 pomnożonych
przez 10
x
– gdzie x jest odpowiednią potęgą. Np. w posiewie 1 cm
3
z rozcieńczenia 10
-3
(1:1000) stwierdzono, że ilość wyrosłych koloni wynosi 240, co w przeliczeniu na 1 cm
3
badanej próbki wynosi 240 x 1000 = 240 000. Wynik w postaci potęgi wynosi 2,4 x 10
5
.
Barwienie preparatów mikroskopowych
Ponieważ preparaty mikroskopowe oglądane są w mikroskopach świetlnych, a większość
bakterii jest bezbarwna i promienie świetlne przenikają przez ich komórki, dlatego najczęściej
przed obserwacją mikroskopową barwimy bakterie w celu ich lepszego uwidocznienia.
Wyróżnia się dwie główne metody barwienia:
a)
barwienie proste – polega na barwieniu preparatu tylko jednym barwnikiem; wykorzystuje
się głównie barwniki zasadowe: błękit metylenowy, fuksynę zasadową, fiolet
krystaliczny,
b)
barwienie złożone – używa się w nim kilku barwników; najczęściej stosowaną
w badaniach bakteriologicznych metodą barwienia złożonego jest metoda Grama.
W metodzie Grama wykorzystuje się zjawisko powstawania w komórkach niektórych
bakterii pod wpływem roztworu fioletu krystalicznego i płynu Lugola trwałych związków
o barwie fioletowej, nierozpuszczalnych w alkoholu. Bakterie takie określamy jako Gram–
dodatnie (Gram+). Inne bakterie pod wpływem alkoholu tracą zabarwienie, a następnie
barwią się na czerwono pod wpływem fuksyny. Są to bakterie Gram-ujemne (Gram-).
Barwienie drobnoustrojów metodą Grama ma zastosowanie przy ich rozpoznawaniu, jako
metoda pomocnicza.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
W jakim celu hoduje się drobnoustroje na pożywkach?
2.
Jakie cechy wyglądu koloni bakteryjnych obserwuje się na podłożu stałym, a jakie na
płynnym?
3.
Jakie wyróżniamy fazy wzrostu populacji bakterii w trakcie hodowli okresowej?
4.
Jakie składniki odżywcze muszą zawierać pożywki stosowane do hodowli bakteryjnych?
5.
W jakim celu stosuje się podłoża różnicujące?
6.
W jakim celu stosuje się agar przy sporządzaniu podłoży?
7.
W jaki sposób wykonuje się posiew ilościowy metodą rozcieńczeń?
8.
Na czym polega barwienie bakterii metodą Grama?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
4.3.3. Ćwiczenia
Ćwiczenie 1
Wykorzystując metodę hodowlaną oblicz ogólną liczbę drobnoustrojów w 1 cm
3
gleby
oraz dokonaj obserwacji cech morfologicznych uzyskanych kolonii bakteryjnych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odważyć 1 g gleby i wytrząsać go w 9 cm
3
roztworu soli fizjologicznej,
2)
wykonać serię rozcieńczeń:
−
pobrać jałową pipetą 1 cm
3
uzyskanego roztworu i przenieść go do probówki z 9 cm
3
soli fizjologicznej, nie zanurzając pipety w roztworze,
−
wykonać tą samą metodą kolejne rozcieńczenia do uzyskania rozcieńczenia 10
-4
,
3)
nanieść pipetą 0,1 cm
3
badanego materiału z rozcieńczenia na powierzchnię pożywki,
4)
wyjałowić głaszczkę przez kilkakrotne zanurzenie jej w alkoholu i opalenie w płomieniu
palnika,
5)
rozprowadzić delikatnie głaszczką naniesiony materiał po całej powierzchni pożywki,
6)
zamknąć płytkę i odwrócić do góry dnem, umieścić w termostacie o temperaturze 20–
27°C na czas 96 godzin,
7)
policzyć wyrosłe kolonie po upływie czasu inkubacji; policzone kolonie zaznaczać
dermatografem na zewnętrznej stronie płytki,
8)
obliczyć ilość bakterii w 1 cm
3
badanego materiału według wzoru:
Z = A x stopień rozcieńczenia;
gdzie: A = liczba kolonii na płytce, Z = liczba organizmów,
(otrzymaną wartość należy pomnożyć przez 10, ponieważ oblicza się ilość bakterii w 1 cm
3
badanego
materiału, a do posiewu na podłoże stałe pobiera się 0,1 cm
3
materiału),
9)
przeprowadzić obserwację cech morfologicznych uzyskanych kolonii, uzupełniając
tabelę:
cechy
morfologiczne
kolonia 1
kolonia 2
kolonia 3
............
wielkość w mm
kształt
powierzchnia
stopień wzniesienia
brzegi
barwa i
przejrzystość
Wyposażenie stanowiska pracy:
−
gleba,
−
waga techniczna lub analityczna,
−
roztwór soli fizjologicznej,
−
pipety 1 cm
3
lub 2 cm
3
,
−
głaszczki,
−
probówki,
−
płytki Petriego z pożywką (bulion agarowy),
−
alkohol etylowy,
−
palniki,
−
karta pracy z tabelą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Ćwiczenie 2
Dokonaj obserwacji mikroskopowej preparatu barwionego metodą Grama.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odtłuścić szkiełko przedmiotowe,
2)
pobrać kroplę soli fizjologicznej wyżarzoną w płomieniu palnika ezą i umieścić ją na
szkiełku przedmiotowym,
3)
pobrać za pomocą wyprażonej ezy próbkę materiału z wyrosłej na podłożu agarowym
kolonii i rozprowadzić ją po powierzchni szkiełka przedmiotowego (może być użyty
materiał z ćwiczenia 1),
4)
utrwalić preparat w płomieniu palnika, przeprowadzając szkiełko 2–3 razy przez płomień
palnika,
5)
umieścić szkiełko z preparatem na prętach wanienki do barwienia i preparat zalać
fioletem krystalicznym na 2 minuty, po czym spłukać wodą,
6)
zalać preparat płynem Lugola na 2 minuty, spłukać wodą,
7)
odbarwić alkoholem, po 30 sekundach spłukać wodą, osuszyć bibułą,
8)
barwić preparat fuksyną przez 1 minutę, spłukać wodą,
9)
wysuszyć preparat bibułą,
10)
nanieść na preparat kroplę olejku cedrowego i oglądać w mikroskopie pod obiektywem
imersyjnym,
11)
określić zabarwienie bakterii oglądanych pod mikroskopem.
Wyposażenie stanowiska pracy:
−
kolonie bakterii wyrosłe na podłożu agarowym,
−
roztwór soli fizjologicznej,
−
eza,
−
szczypce Corneta,
−
wanienka do barwienia,
−
szkiełko przedmiotowe
−
alkohol etylowy,
−
fiolet krystaliczny,
−
płyn Lugola,
−
roztwór fuksyny,
−
bibuła,
−
palniki,
−
olejek cedrowy,
−
mikroskopy z obiektywem imersyjnym.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
przeprowadzić
obserwację
cech
morfologicznych
kolonii
bakteryjnych wyhodowanych na różnych podłożach ?
2)
opisać fazy wzrostu hodowli bakteryjnej?
3)
wymienić podstawowe składniki pożywek stosowanych w hodowlach
drobnoustrojów?
4)
rozróżnić pożywki w zależności od funkcji jaką mają pełnić
w prowadzonych hodowlach?
5)
wykonać dziesiętne rozcieńczenia badanego materiału?
6)
oznaczyć ogólną liczbę drobnoustrojów metodą płytkową?
7)
wykonać barwienie preparatu mikroskopowego metodą Grama?
8)
oznaczyć miano coli w badanym materiale?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
4.4. Wpływ środowiska na wzrost i rozwój drobnoustrojów
4.4.1. Materiał nauczania
Działalność życiowa drobnoustrojów w naturalnych warunkach uzależniona jest od
szeregu czynników środowiskowych. Każdy z tych czynników, w pewnym zakresie natężenia
swego działania, umożliwia normalny rozwój bakterii. Przekroczenie granic natężenia
działania któregokolwiek czynnika zewnętrznego spowoduje ograniczenie lub wstrzymanie
wzrostu i rozwoju drobnoustrojów.
Podstawowe czynniki, mające wpływ na rozwój mikroorganizmów, dzielimy na:
a)
fizyczne:
−
ciśnienie osmotyczne i zawartość wody,
−
temperatura,
−
ciśnienie hydrostatyczne (mechaniczne),
−
promieniowanie,
−
ultradźwięki,
b)
chemiczne:
−
zawartość tlenu w podłożu,
−
odczyn środowiska (pH),
−
obecność metabolitów własnych i obcych,
−
antybiotyki,
−
antyseptyki,
c)
biologiczne:
−
wpływ jednych drobnoustrojów na drugie,
−
obecność wirusów (fagów).
Wpływ wybranych czynników fizycznych i chemicznych na drobnoustroje
1)
Woda i ciśnienie osmotyczne.
Rola wody w komórkach bakteryjnych:
−
jest rozpuszczalnikiem związków chemicznych,
−
tworzy środowisko reakcji chemicznych,
−
umożliwia pobieranie w formie roztworów składników odżywczych,
−
umożliwia wydalanie szkodliwych produktów przemiany materii,
−
nadaje komórce turgor (jędrność, prężność).
Odpowiednia ilość wody w pożywce jest niezbędnym czynnikiem rozwoju
mikroorganizmów. Minimalna ilość wody w podłożu do wzrostu bakterii wynosi ok. 30%,
a dla pleśni około 15%.
Obecność wody decyduje o ciśnieniu osmotycznym w środowisku. Wewnątrz komórki
panuje stosunkowo wysokie ciśnienie osmotyczne. Zmieniające się ciśnienie osmotyczne
w środowisku, może wywołać negatywne skutki dla komórki:
−
zwiększenie ciśnienia osmotycznego w środowisku (czyli umieszczenie komórki
w roztworze hipertonicznym) wywołuje zjawisko plazmolizy – odciągania wody
z komórki, prowadzące do jej śmierci,
−
zmniejszenie ciśnienia osmotycznego w środowisku (czyli umieszczenie komórki
w roztworze hipotonicznym) powoduje plazmoptyzę – czyli gwałtowne przenikanie
wody do wnętrza komórki, prowadzące do jej pęcznienia i rozerwania błony
komórkowej.
Istnieją bakterie, które mogą żyć w środowisku o wysokim ciśnieniu osmotycznym – są
to halofile, żyjące w środowisku o wysokim stężeniu soli. Dużą odporność na brak wody
wykazują przetrwalniki, zarodniki pleśni i drożdży oraz bakterie z otoczkami śluzowymi.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
2)
Temperatura.
Temperatura ma wpływ na szybkość reakcji chemicznych (a więc metabolizm
komórkowy) oraz strukturę cząsteczek białkowych i nukleinowych. Dlatego działalność
ż
yciowa mikroorganizmów może zachodzić tylko w pewnych określonych granicach, różnych
dla różnych gatunków.
Dla każdego drobnoustroju możemy wyróżnić trzy poziomy temperatury:
−
minimalną – poniżej której rozwój jest hamowany,
−
optymalną – w której mikroorganizm rośnie najszybciej,
−
maksymalną – powyżej której rozwój jest także hamowany.
Ze względu na różnice w optimum, minimum i maksimum wzrostu, bakterie dzielimy na
grupy:
−
bakterie psychrofilne – zimnolubne,
−
bakterie mezofile – rosnące w średnich temperaturach,
−
bakterie termofilne – ciepłolubne.
Charakterystyczne temperatury wzrostu dla poszczególnych grup bakterii, przykłady
mikroorganizmów i miejsce ich występowania przedstawia tabela 4.
Tabela 4. Charakterystyczne temperatury wzrostu dla bakterii
Temperatura w °C
Bakterie
minimalna
optymalna
maksymalna
Przykłady
Występowanie
Psychrofile
-7
10
20
25
30
Pseudomonas,
Alcaligenes,
Flavobacterium
zimne źródła, głębokie
jeziora, morza
Mezofile
15
25
40
ok. 45
krętki blade,
gonokoki
większość saprofitów,
bakterie pasożytnicze
Termofile
25
45
45
60
70
80
Pyrodictium,
Pyrococcus,
Thermus, Bacillus
caldolyticus
gorące źródła, nawóz,
gleba, fermentujące
resztki roślinne, jelita
niektórych zwierząt
Odporność mikroorganizmów na niską temperaturę jest znacznie wyższa niż na działanie
wysokiej temperatury. Temperatura niska działa hamująco na rozwój bakterii, nie powodując
zwykle ich wyginięcia – jest to działanie bakteriostatyczne.
Wysoką temperaturę wykorzystuje się do niszczenia drobnoustrojów (działanie
bakteriobójcze). Powszechnie stosuje się jedną z metod:
−
pasteryzację – zabieg ten polega na stosowaniu temperatury poniżej 100°C, zwykle
w granicach od 70 do 90°C; zależnie od zastosowanej temperatury zabieg należy
prowadzić przez dłuższy lub krótszy czas; proces pasteryzacji daje częściowe
wyjałowienia środowiska, niszcząc większość wegetatywnych form drobnoustrojów,
−
sterylizację – polega na ogrzewaniu produktu w parze w temperaturze 117°C lub 121°C;
uzyskuje się pełną jałowość produktu.
3)
Ciśnienia hydrostatyczne (mechaniczne).
Bakterie są niewrażliwe na znaczne nawet podwyższenie ciśnienia mechanicznego.
Wzrost większości bakterii ustaje dopiero przy ciśnieniu większym niż 600 atmosfer (bakterie
morskie – barofile – wytrzymują znacznie wyższe wartości ciśnienia).
4)
Promieniowanie.
Dla mikroorganizmów szczególnie szkodliwe jest promieniowanie ultrafioletowe,
zwłaszcza w zakresie długości fal 260-268 nm. Promieniowanie ma silne działanie
mutagenne, prowadzące do śmierci komórek. Przy zastosowaniu odpowiednio dobranego
czasu i natężenia promieniowania dochodzi do całkowitego wyjałowienia naświetlanego
ś
rodowiska, co wykorzystuje się praktycznie do wyjaławiania różnych pomieszczeń. Silnie
bakteriobójczo działają również promienie X (Roentgena).

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
5)
Odczyn środowiska (pH).
Drobnoustroje są wrażliwe na odczyn środowiska i poszczególne gatunki zwykle
rozwijają się w ściśle określonych granicach pH. Wyróżnia się wartości pH minimalne,
optymalne i maksymalne. Większość bakterii najlepiej rozwija się przy obojętnym lub słabo
zasadowym odczynie środowiska. Drożdże i inne grzyby wykazują lepszy wzrost przy
kwaśnym odczynie podłoża (od 4 do 6). Bakterie fermentacji octowej i mlekowej, niektóre
laseczki, prawie wszystkie gatunki rodzaju Thiobacillus oraz Sulfolobus, rozwijają się
w silnie kwaśnym środowisku (pH 0,8). Środowisko alkaliczne jest natomiast optymalne dla
rozwoju przecinkowca cholery i paciorkowca zapalenia płuc.
Tabela 5. Minimalne, optymalne i maksymalne pH dla bakterii [7, s. 374]
Gatunek
Minimum
Optimum
Maksimum
Mycobacterium tuberculosis
4,0 – 4,5
7,3 – 7,9
7,9 – 8,6
Thiobacillus thiixidans
0,0
2,0 – 2,8
4,0 – 4,6
Lactobacillus bifidus
3,8 – 4,4
5,4 – 6,4
7,2
Escherichia coli
4,4
6,0 – 7,0
9,0
Vibrio cholerae
5,6
6,2 – 8,0
9,6
Streptococcus pneumoniae
7,2
7,8
8,2
6)
Związki chemiczne.
Związki chemiczne działają na drobnoustroje bakteriobójczo (niszczą nieodwracalnie
komórki drobnoustrojów) lub bakteriostatycznie (hamują procesy życiowe komórek).
Do substancji bakteriobójczych należą:
a)
ś
rodki dezynfekcyjne:
−
kwasy, np. kwas siarkowy (VI), fluorokrzemowy, salicylowy,
−
wodorotlenki, zwłaszcza wodorotlenek sodu,
−
ś
rodki utleniające – woda utleniona, manganian /VII/potasu,
−
chlor i jego sole – chloramina, chloran (I) sodu lub wapnia,
−
alkohol etylowy, alkohol amylowy,
−
formalina,
−
fenol, lizol,
−
sole metali ciężkich, np. sole miedzi, srebra,
b)
ś
rodki czyszczące i myjące – mydła i detergenty.
Do substancji bakteriostatycznych należą: sulfanilamidy, sulfony.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie czynniki fizyczne i chemiczne mają wpływ na wzrost mikroorganizmów?
2.
Jaka jest rola wody w żywych komórkach?
3.
Na czym polega zjawisko plazmolizy i plazmoptyzy?
4.
W jaki sposób temperatura wpływa na funkcjonowanie żywych komórek?
5.
Jaka jest zależność wzrostu i rozwoju bakterii od temperatury?
6.
W jakich środowiskach naturalnych występują bakterie psychrofilne, mezofile
i termofilne?
7.
Jak na mikroorganizmy działa promieniowanie ultrafioletowe?
8.
Jaka jest różnica w działaniu między środkami bakteriobójczymi a bakteriostatycznymi?
9.
Jakie związki chemiczne stosuje się do dezynfekcji?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
4.4.3. Ćwiczenia
Ćwiczenie 1
Przeprowadź obserwację wzrostu drobnoustrojów w różnych temperaturach.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wykonać 3 posiewy z mleka ukwaszonego (po 1 ml) na płytki Petriego i zalać pożywką
agarową,
2)
hodować płytki z posiewami w różnych temperaturach: w cieplarce w temp. 30°C,
w lodówce w temp. 3–5°C, w temp. pokojowej 18–20°C,
3)
prowadzić hodowlę przez 72 godziny,
4)
przeprowadzić obserwację wzrostu drobnoustrojów na poszczególnych płytkach,
5)
zestawić w tabeli wyniki obserwacji i wyciągnąć wnioski dotyczące wpływu temperatury
na szybkość wzrostu bakterii.
Wyposażenie stanowiska pracy:
−
mleko ukwaszone,
−
pożywka agarowa,
−
płytki Petriego,
−
pipety 1 lub 2 cm
3
,
−
cieplarka, lodówka.
Ćwiczenie 2
Przeprowadź obserwację wpływu środków chemicznych na wzrost mikroorganizmów.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
nasączyć krążki bibuły środkami dezynfekcyjnymi: 70% etanolem, sterinolem i chloran
(I) sodu oraz wodą destylowaną (próba kontrolna),
2)
nałożyć (w równych odstępach) za pomocą pincety nasączone krążki bibuły na
powierzchnię podłoża z hodowlą bakterii,
3)
umieścić hodowlę w cieplarce w temp. 37°C na 24 godziny,
4)
określić w mm średnicę strefy zahamowania wzrostu bakterii wokół krążków bibuły po
zakończonej inkubacji,
5)
zanotować wyniki obserwacji w tabeli:
6)
wyciągnąć wnioski z obserwacji.
Rodzaj środka dezynfekcyjnego
Strefy zahamowania
wzrostu (Ø w mm)
1. 70% etanol
2. sterinol
3. chloran (I) sodu
4. woda destylowana

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Wyposażenie stanowiska pracy:
−
hodowle bakterii na płytkach Petriego,
−
krążki bibuły,
−
ś
rodki dezynfekcyjne: 70% etanol, sterinol, chloran (I) sodu,
−
woda destylowana,
−
pinceta,
−
cieplarka.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wymienić czynniki środowiska wpływające na wzrost
mikroorganizmów?
2)
opisać rolę wody w żywych komórkach?
3)
scharakteryzować działanie czynników fizycznych na wzrost i rozwój
mikroorganizmów?
4)
opisać wpływ temperatury na wzrost drobnoustrojów?
5)
wyróżnić grupy bakterii w zależności od optimum temperatury,
w jakiej się rozwijają?
6)
podać przykłady bakterii rozwijających się w środowiskach
naturalnych o różnych wartościach pH?
7)
wymienić środki chemiczne stosowane do dezynfekcji?
8)
rozróżnić środki bakteriobójcze od bakteriostatycznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
4.5. Rola drobnoustrojów w przyrodzie, gospodarce i życiu
człowieka
4.5.1. Materiał nauczania
Rola bakterii w kształtowaniu biosfery
Biosferą nazywamy powierzchniowe warstwy skorupy ziemskiej, łącznie z wodami
i okrywającą je atmosferą. Bakterie występują niemal wszędzie, zamieszkują różne
ś
rodowiska i warunki ekologiczne. Każde środowisko zamieszkałe jest przez właściwe sobie
drobnoustroje, tworzące specyficzną dla niego mikroflorę, choć niektóre formy bakterii
występować mogą w kilku różnych środowiskach.
Bakterie pełnią w przyrodzie bardzo istotne funkcje:
−
powodują rozkład i gnicie martwej materii organicznej (są saprobiontami, reducentami),
−
włączają w obieg materii niektóre pierwiastki, np. C, S, N, P,
−
odgrywają istotną rolę w procesach glebotwórczych,
−
mineralizują glebę,
−
jako organizmy symbiotyczne umożliwiają przeżuwaczom trawienie celulozy lub
u innych zwierząt są źródłem witamin B i K.
Gleba jest miejscem występowania największej ilości mikroorganizmów (bakterii
i grzybów). Ich ilość w glebie zależy od struktury, wilgotności i zawartości substancji
organicznej w glebie (od kilku mln do kilku mld mikroorganizmów na 1 gram suchej masy).
Najwięcej bakterii znajduje się w warstwie gleby uprawnej.
Wśród bakterii glebowych można wyróżnić dwa typy:
a)
mikroflorę autochtoniczną – to bakterie zawsze występujące w glebie, nawet
nieuprawianej; obejmuje przede wszystkim liczne gramdodatnie, nieprzetrwalnikujące
pałeczki (Arthobacter, Corynebacterium, Mycobacterium), część promieniowców,
bakterie autotroficzne, bakterie śluzowe,
b)
mikroflorę zymogenną – należą do niej bakterie rozwijające się w glebie po
wprowadzeniu do niej substancji organicznej; należą tu liczne gatunki Pseudomonas,
gramujemne pałeczki, przetrwalnikujące laseczki tlenowe i beztlenowe.
Drobnoustroje, przeprowadzając procesy mineralizacji i humifikacji, odpowiedzialne są
za przemiany związków organicznych w glebie. Mineralizacja polega na całkowitym
rozkładzie związków organicznych. Proces ten przebiega stopniowo. Rozpoczyna się od
hydrolizy i rozkładu białek, amonifikacji, rozkładu węglowodanów, a prowadzi do całkowitej
mineralizacji związków organicznych. Równocześnie z mineralizacją przebiega humifikacja.
Jest to proces syntezy związków organicznych w wyniku czego tworzy się humus
(próchnica), czyli bezpostaciowa substancja organiczna o bardzo zmiennym składzie. Tworzą
ją odporne na rozkład resztki tkanek roślin i zwierząt, ciał mikroorganizmów i produktów ich
działalności. Próchnica jest poważnym źródłem azotu dla roślin, dlatego zapasy humusu są
bardzo ważne dla zachowania struktury i żyzności gleby.
Krążenie pierwiastków w przyrodzie
Podstawą funkcjonowania świata przyrody jest przepływ energii i obieg materii. Obieg
materii dotyczy naturalnego krążenia pierwiastków chemicznych między środowiskiem
ożywionym i nieożywionym, a głównym źródłem energii umożliwiającym te przemiany, jest
promieniowanie słoneczne. W regulowaniu intensywności obiegu materii bardzo istotną rolę
odgrywają drobnoustroje, zwłaszcza bakterie.
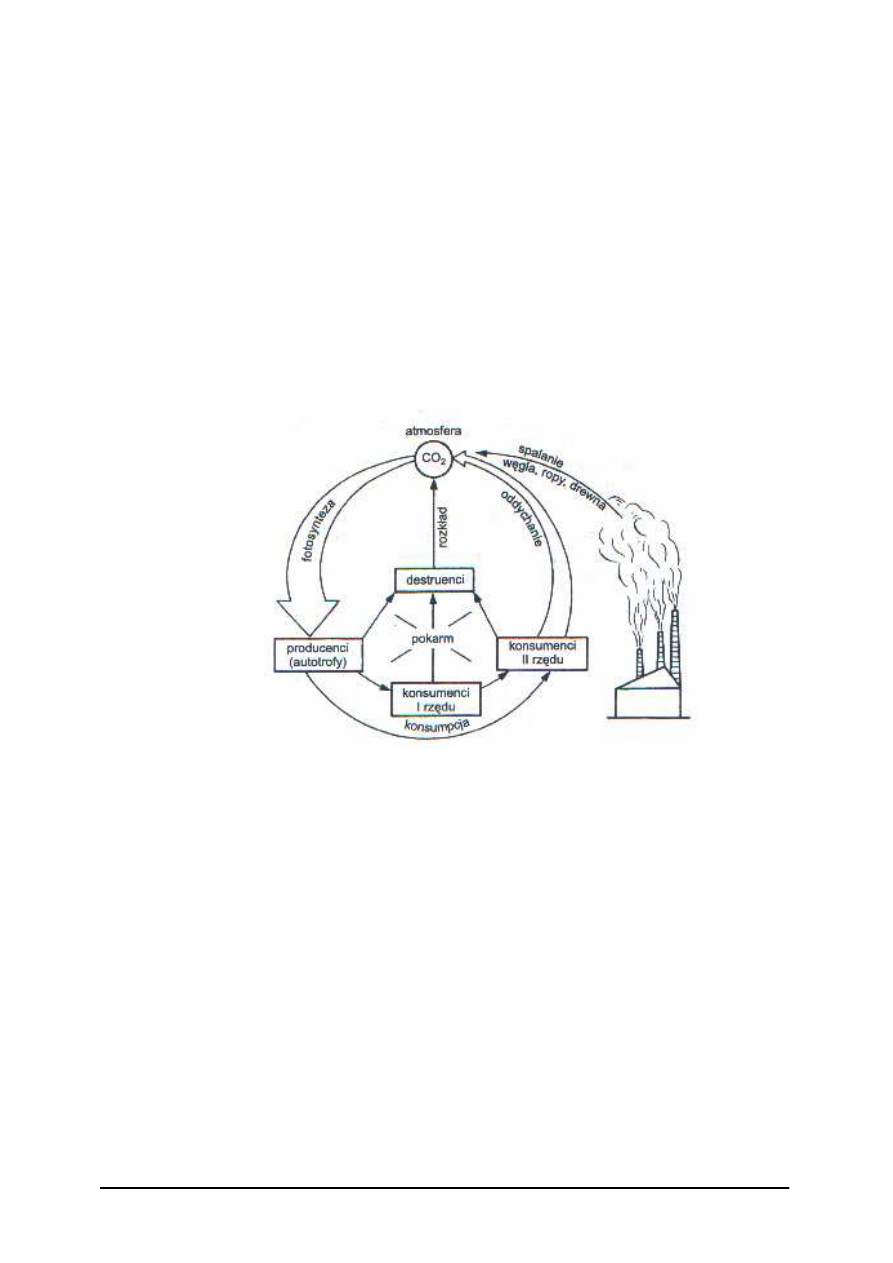
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Krążenie węgla w przyrodzie
Węgiel to podstawowy pierwiastek budulcowy, wchodzący w skład związków
organicznych żywych organizmów. Głównym rezerwuarem węgla w przyrodzie jest CO
2
. Jest
on włączany do obiegu dzięki asymilacji prowadzonej przez organizmy fotosyntetyzujące
(rośliny zielone, bakterie autotroficzne), które wbudowują go we własne związki organiczne.
Dzięki istniejącym w przyrodzie łańcuchom pokarmowym węgiel przechodzi od autotrofów,
przez roślinożerców – konsumentów I rzędu, do zwierząt mięsożernych – konsumentów II
rzędu. Węgiel wraca do atmosfery jako CO
2
powstający w procesie oddychania wszystkich
organizmów. Rośliny i zwierzęta, które obumarły, są źródłem węgla dla reducentów, głównie
bakterii i grzybów saprofitycznych. Odżywiając się martwą materią organiczną reducenci
wbudowują w swoje ciała węgiel, ale jednocześnie powodują rozkład materii organicznej do
nieorganicznej i uzupełniają tym samym zapas CO
2
w środowisku. Do bakterii
rozkładających martwą materię organiczną w glebie należą m.in.: Achromobacter, Bacillus,
Pseudomonas, Flavobacterium, Micrococcus, Streptomyces.
Rys. 16. Obieg węgla w przyrodzie [9, s. 58]
Krążenie azotu w przyrodzie
Azot jest pierwiastkiem wchodzącym w skład białek i kwasów nukleinowych.
Pierwotnymi źródłami azotu dla organizmów są sole mineralne (azotany i sole amonowe)
oraz azot atmosferyczny.
Przyswajanie azotu atmosferycznego możliwe jest dzięki działalności bakterii
symbiotycznych i glebowych. Bakterie brodawkowe z rodzaju Rhizobium, które mają
zdolność wiązania azotu cząsteczkowego i redukowania go do NH
3
,
ż
yją w symbiozie
z korzeniami roślin motylkowych (np. łubin, koniczyna, wyka) i dostarczają roślinom gotowe
związki azotowe. Podobną właściwość mają bakterie glebowe wolnożyjące – Azotobacter
i Clostridium.
Rośliny czerpią azot z gleby i wody, głównie w postaci jonów amonowych (NH
4
+
) lub
jonów azotanowych (V) NO
3
-
. Azotany pochodzą głównie z procesu nitryfikacji,
prowadzonego przez bakterie nitryfikacyjne. Składa się on z dwóch etapów:
−
utleniania amoniaku do azotanów (III) – proces ten przeprowadzają bakterie
Nitrosomonas,
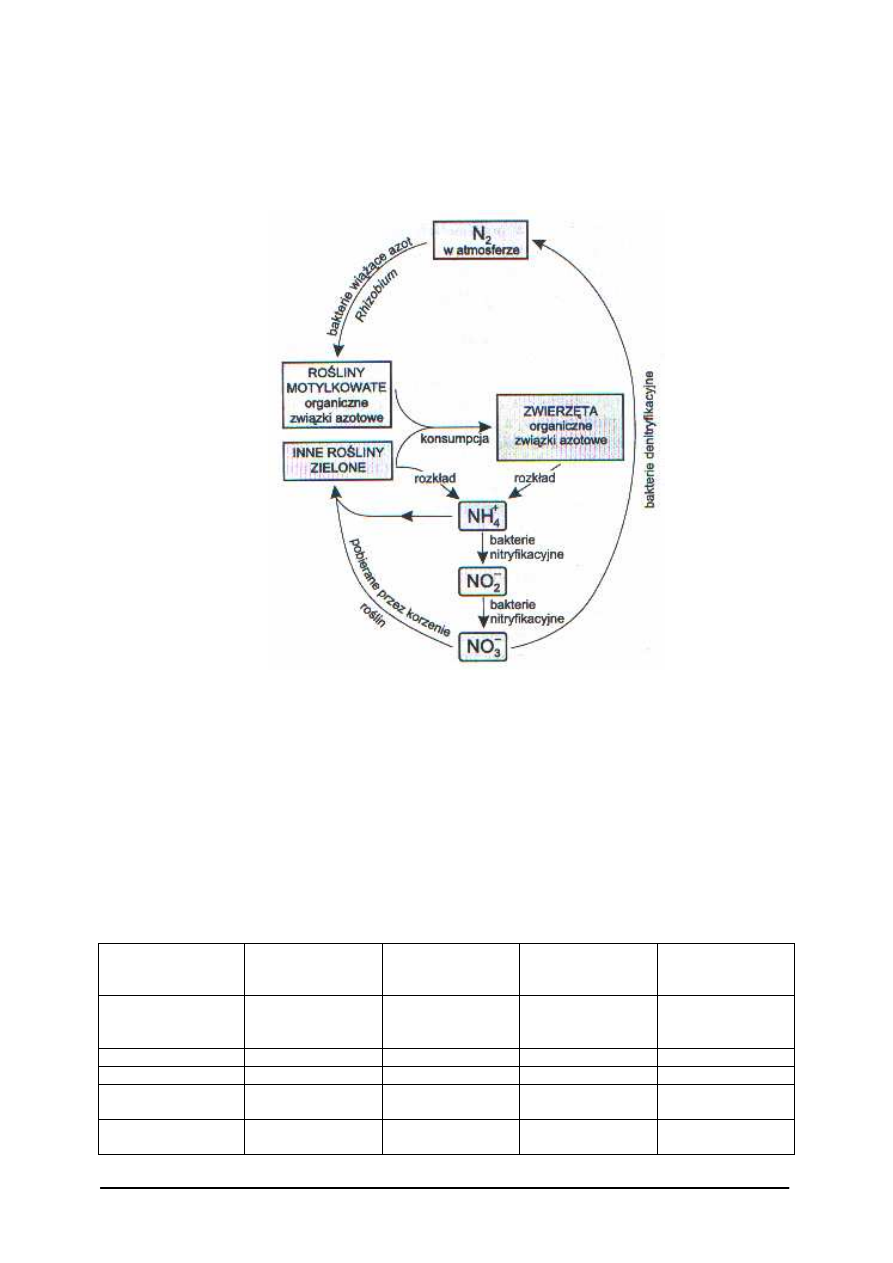
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
−
utleniania azotanów (III) do azotanów (V) – przeprowadzanego przez bakterie
Nitrobacter.
Procesem zubażającym glebę w związki azotowe jest proces denitryfikacji, czyli redukcja
azotanów (III) lub azotanów (V) do azotu cząsteczkowego, który uwalniany jest do atmosfery
(Pseudomonas fluorescens).
Rys. 17. Obieg azotu w przyrodzie [9, s. 60]
Zastosowanie mikroorganizmów w procesach spożywczych i produkcji żywności
W niektórych gałęziach przemysłu spożywczego wykorzystuje się działalność życiową
mikroorganizmów – bakterii i grzybów (drożdży i pleśni) do otrzymywania niektórych
produktów spożywczych. Najszersze zastosowanie mają prowadzone przez mikroorganizmy
procesy fermentacyjne.
Bakterie wykorzystywane w przemyśle możemy podzielić na:
–
bakterie fermentacji mlekowej,
–
bakterie fermentacji octowej,
–
bakterie fermentacji propionowej,
–
bakterie fermentacji masłowej.
Tabela 6. Charakterystyczne cechy poszczególnych grup bakterii fermentacyjnych
Cecha
charakterystyczna
Bakterie
fermentacji
mlekowej
Bakterie
fermentacji
octowej
Bakterie
fermentacji
propionowej
Bakterie
fermentacji
masłowej
produkty fermentacji
kwas mlekowy
kwas octowy
kwas propionowy,
kwas octowy, CO
2
,
H
2
O
kwas masłowy,
CO
2
, H
2
O
typ morfologiczny
ziarniaki, pałeczki
pałeczki
pałeczki
laseczki
barwienie Grama
Gram-dodatnie
Gram-ujemne
Gram-dodatnie
Gram-dodatnie
optymalna
temperatura wzrostu
mezofile lub
termofile
mezofile
mezofile
mezofile
tworzenie
przetrwalników
—
—
—
+

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
Bakterie fermentacji mlekowej
Bakterie właściwej fermentacji mlekowej dzielimy na:
−
bakterie homofermentatywne – fermentując wytwarzają głównie kwas mlekowy oraz
ś
ladowe ilości produktów ubocznych (Streptococcus lactis, Streptococcus cremoris,
Lactobacillus),
−
bakterie heterofermentatywne – oprócz kwasu mlekowego wytwarzają z cukrów
produkty uboczne, takie jak: kwas octowy, CO
2
i inne (Leuconostoc, Lactobacillus).
Fermentację mlekową możemy podzielić na:
−
właściwą fermentację mlekową – jest wywoływana przez bakterie homofermentatywne
i jest praktycznie wykorzystywana w przemyśle. Jej przebieg można przedstawić za
pomocą równania sumarycznego:
C
6
H
12
O
6
2 CH
3
· CHOH · COOH + 94 kJ (22,5 kcal)
−
fermentację niewłaściwą (pseudomlekową) — wywołana jest przez różne rodzaje
bakterii, np. Escherichia, Micrococcus, Microbacterium, prowadzi do wytworzenia kwasu
mlekowego, kwasu octowego, alkoholu etylowego, CO2 i innych produktów końcowych.
Ten rodzaj fermentacji jest niepożądany w przemyśle, gdyż powoduje obniżenie wartości
końcowej produktu.
Bakterie mlekowe wykorzystuje się m.in.:
a)
w przemyśle mleczarskim – do produkcji napojów mlecznych fermentowanych, takich
jak: mleko ukwaszone, kefir, jogurt, mleko jogurtowe, mleko acidofilne, do ukwaszania
ś
mietanki spożywczej, do ukwaszania śmietanki przeznaczonej od produkcji masła, do
dojrzewania serów podpuszczkowych, do ukwaszania mleka do produkcji serów
twarogowych,
b)
w przetwórstwie warzywnym – do kwaszenia kapusty, ogórków i innych warzyw;
kwaszenie warzyw przy wykorzystaniu fermentacji mlekowej umożliwia przetworzenie
produktów roślinnych, a jednocześnie ich zakonserwowanie,
c)
w przemyśle mięsnym – bakterie mlekowe biorą udział w przemianach
mikrobiologicznych zachodzących w wędlinach surowych (metka, salami) podczas ich
produkcji i przechowywania, mają wpływ na barwę, konsystencję, smak i zapach wędlin
surowych,
d)
w przemyśle piekarskim – bakterie mlekowe wchodzą w skład zakwasów chlebowych
(zakwaszają ciasto żytnie).
Bakterie fermentacji octowej
Bakterie octowe należą do rodzaju Acetobacter. W przemyśle wykorzystuje się ich
zdolność do utleniania alkoholu etylowego do kwasu octowego (przy udziale tlenu
atmosferycznego). Chemizm tej fermentacji można przedstawić za pomocą równania
sumarycznego:
CH
3
CH
2
OH + O
2
CH
3
COOH + H
2
O + 490 kJ (118 kcal)
Oprócz kwasu octowego w czasie fermentacji powstają jako produkty uboczne różne
substancje aromatyczne, których ilość i rodzaj zależą od gatunku bakterii i rodzaju użytego
surowca.
Fermentacja octowa jest wykorzystywana na skalę przemysłową do produkcji octu, czyli
wodnego roztworu kwasu octowego.
Bakterie fermentacji propionowej
Bakterie propionowe należą do rodzaju Propionibacterium, przeprowadzają proces
beztlenowego rozkładu kwasu mlekowego (lub cukru) na kwas propionowy i kwas octowy
z wydzieleniem dwutlenku węgla i wody. Przebieg tej fermentacji można przedstawić za
pomocą równania sumarycznego:
3 CH
3
CHOH · COOH
2 CH
3
CH
2
COOH + CH
3
COOH + CO
2
+ H
2
O + wolna energia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Bakterie propionowe są wykorzystywane w przemyśle mleczarskim do dojrzewania
serów podpuszczkowych (zwłaszcza twardych), a także towarzyszą bateriom mlekowym
w zakwasach chlebowych i niekiedy w kiszonkach.
Bakterie fermentacji masłowej
Bakterie masłowe należą do rodzaju Clostridium. Mają zdolność beztlenowego rozkładu
cukrów na kwas masłowy, dwutlenek węgla i wodę zgodnie z sumarycznym równaniem:
C
6
H
12
O
6
CH
3
CH
2
CH
2
COOH + 2 CO
2
+ 2 H
2
+ wolna energia.
Oprócz kwasu masłowego powstają liczne produkty uboczne, np. kwas octowy, alkohol
metylowy, metan, aceton, alkohol butylowy. Przebieg fermentacji zależy od gatunku bakterii
i odczynu środowiska. W środowisku obojętnym głównym produktem tej fermentacji jest
kwas masłowy, produktów ubocznych jest niewiele. Natomiast w środowisku kwaśnym
bakterie wywołują fermentację acetobutanolową, w której powstają duże ilości alkoholu
butylowego i acetonu.
Bakterie masłowe wykorzystuje się w procesie moczenia łodyg lnu i konopi, gdyż
fermentując błonnik, umożliwiają oddzielenie włókien przędnych od tkanki korowej
i zdrewniałej.
Fermentacja alkoholowa drożdży szlachetnych
Drożdże szlachetne należą do rodzaju Saccharomyces i dzieli się je na: piekarskie,
piwowarskie, winiarskie i gorzelnicze. Przeprowadzana przez nie fermentacja alkoholowa
polega na beztlenowym rozkładzie cukrów prostych na alkohol etylowy i dwutlenek węgla,
co można przedstawić równaniem sumarycznym:
C
6
H
12
O
6
2 CH
3
CH
2
OH + 2 CO
2
+ 117 kJ (28 kcal)
W procesie tym powstają także produkty uboczne (nieuwzględnione w zapisie).
Cechy charakterystyczne drożdży szlachetnych:
−
fermentują cukry proste z wytworzeniem do 12% alkoholu,
−
optymalne stężenie cukrów w pożywce wynosi do 20%,
−
optymalna temperatura fermentacji wynosi 28–32°C,
−
optymalne pH podłoża w granicach od 3 do 6.
Drożdże szlachetne dzieli się na dwie grupy:
−
drożdże fermentacji dolnej – po zakończonej fermentacji opadają na dno kadzi
fermentacyjnej,
−
drożdże fermentacji górnej – po zakończonym procesie zbierają się na powierzchni
płynu.
Drożdże szlachetne wykorzystywane są w przemyśle:
a)
piekarskim – do rośnięcia ciasta pszennego oraz w zakwasach chlebowych; spulchnianie
ciasta następuje dzięki wydzielaniu się CO
2
podczas fermentacji alkoholowej w cieście,
b)
piwowarskim – do produkcji piwa; proces ten przebiega w dwóch etapach:
−
fermentacja główna – następuje tu przemiana cukrów brzeczki (wyciąg ze słodu
jęczmiennego) na alkohol etylowy i CO
2
, powstaje tzw. młode piwo,
−
fermentacja leżakowa – następuje powolne dofermentowanie pozostałych cukrów,
w wyniku czego otrzymuje się gotowe piwo,
c)
winiarskim – do produkcji wina; używa się drożdży fermentacji dolnej, a proces
fermentacji ma trzy fazy:
−
zafermentowanie – przygotowany moszcz (sok owocowy) zaszczepia się
odpowiednią kulturą drożdży, które rozmnażają się w obecności tlenu; fermentacja
prowadzi do wytworzenia dwutlenku węgla, który zbierając się nad moszczem
tworzy warstwę izolującą od dostępu powietrza,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
−
fermentacja główna – drożdże intensywnie przerabiają cukier na alkohol i CO
2
,
−
w trakcie wzrastania stężenia alkoholu drożdże zaczynają stopniowo opadać, a młode
wino ściągnięte znad drożdży poddaje się leżakowaniu (dojrzewaniu),
d)
gorzelniczym – do produkcji spirytusu; surowcami do produkcji spirytusu mogą być
ziemniaki, melasa, żyto lub owoce,
e)
mleczarskim – do produkcji kefiru, który jest napojem otrzymywanym w wyniku
fermentacji mlekowej i alkoholowej.
Pleśnie wykorzystywane są w przemyśle spożywczym do:
a)
produkcji kwasu cytrynowego – uzyskuje się go w procesie fermentacji cytrynowej przy
wykorzystaniu czystych kultur pleśni Aspergillus niger (kropidlak czarny),
b)
otrzymywania preparatów enzymatycznych:
−
preparaty pektynolityczne – stosowane są w przetwórstwie owocowo-warzywnym do
hydrolizy związków pektynowych,
−
preparaty
amylolityczne – rozkładają skrobię, stosowane w przemyśle
ziemniaczanym, piekarskim, gorzelniczym, paszowym,
−
preparaty proteolityczne – hydrolizują białka, znajdują zastosowanie w przemyśle
mięsnym i rybnym, piwowarskim, paszowym i w dojrzewaniu serów,
c)
dojrzewania serów pleśniowych – wykorzystuje się różne gatunki pleśni: Penicillium
candidum i Penicillium camembert (brie, camembert), Penicillium roqueforti (rokpol).
Negatywna rola bakterii w przemyśle spożywczym
Ujemna rola bakterii polega na tym, że niektóre gatunki powodują psucie się
niezabezpieczonych odpowiednio surowców i gotowych produktów. Bakterie mogą też
zakłócać prawidłowy przebieg procesów fermentacyjnych.
Do szkodliwych bakterii należą:
a)
bakterie mlekowe – niektóre gatunki wywołują wady mleka, masła i serów (zmieniają
smak i zapach produktów), hamują działalność drożdży w trakcie fermentacji
alkoholowej (powodują mętnienie, kwaśnienie piwa), powodują psucie podrobów
mięsnych, marynat owocowych, przetworów warzywnych,
b)
bakterie pseudomlekowe – wytwarzają w trakcie fermentacji mlekowej nie tylko kwas
mlekowy, ale także kwas octowy, alkohol etylowy, dwutlenek węgla, powodując tym
samym wady mleka i jego przetworów,
c)
bakterie masłowe – powodują psucie się serów podpuszczkowych, konserw warzywnych
i owocowych oraz kiszonych pasz,
d)
bakterie octowe – są szkodliwe w przemyśle fermentacyjnym (gorzelnictwo,
piwowarstwo, winiarstwo) oraz powodują psucie się marynat owocowych i warzywnych,
e)
bakterie gnilne – wywołują wady wielu artykułów żywnościowych, zwłaszcza mięsa
i jego przetworów.
Sposoby przeciwdziałania negatywnemu wpływowi bakterii na produkty spożywcze
Surowce, półprodukty i gotowe wyroby przemysłu spożywczego są bardzo dobrą
pożywką dla wielu szkodliwych mikroorganizmów i mogą być przez nie tak zmienione, że
nie nadają się do wykorzystania w celach spożywczych. Należy więc podejmować działania
zapobiegające rozwojowi szkodliwej mikroflory bakteryjnej oraz ochraniać gotowe produkty
przed zepsuciem poprzez ich odpowiednią konserwację.
Najważniejsze metody konserwowania żywności to:
−
chłodzenie lub zamrażanie produktów spożywczych,
−
produkowanie konserw (mięsnych, warzywnych, owocowych, rybnych),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
−
suszenie (grzyby, owoce, warzywa),
−
solenie (ryby, tłuszcze),
−
marynowanie (śledzie, grzyby, warzywa),
−
dodawanie cukrów (owoce, dżemy),
−
wędzenie (mięsa, ryby),
−
kwaszenie (kapusta, ogórki),
−
dodawanie chemicznych środków konserwujących.
Wykorzystanie mikroorganizmów w przemyśle farmaceutycznym
Przemysł farmaceutyczny wykorzystuje procesy mikrobiologiczne do otrzymywania
prawie wszystkich stosowanych dziś antybiotyków. Są one produktami metabolizmu
promieniowców (głównie z rodzaju Streptomyces), grzybów (Aspergillus, Penicillium,
Cephalosporium) i bakterii właściwych (głównie z rodzaju Bacillus). Substancje te znalazły
szerokie zastosowanie w medycynie, ponieważ działają wybiórczo, w niskich stężeniach,
bakteriobójczo lub bakteriostatycznie na drobnoustroje chorobotwórcze. Antybiotyki znalazły
również zastosowanie w biochemii i biotechnologii, w przemyśle spożywczym do
konserwowania żywności, są aktywatorami wzrostu zwierząt hodowlanych.
Stosowane w medycynie antybiotyki stanowią niewielki odsetek substancji
antybiotycznych wytwarzanych przez drobnoustroje, muszą one być nietoksyczne lub mało
toksyczne dla organizmu ludzkiego. Działają na bakterie hamując wybrane funkcje
metaboliczne ich komórek.
Najszersze zastosowanie w lecznictwie znalazły antybiotyki wytwarzane przez
promieniowce, głównie przez rodzaj Streptomyces:
−
streptomycyna – wytwarzana jest przez Streptomyces griseus, działa głównie na bakterie
Gram-ujemne i prątki gruźlicy; hamuje syntezę białek,
−
chloramfenikol – działa na wiele bakterii Gram-dodatnich, Gram-ujemnych i riketsje,
hamuje biosyntezę białek i lipidów w komórkach bakteryjnych, wytwarzana przez
Streptomyces venezuelae,
−
tetracykliny – to grupa antybiotyków o szerokim zastosowaniu na bakterie Gram-
dodatnie, Gram-ujemne i riketsje; ich działanie polega na hamowaniu biosyntezy białka
i procesów energetycznych (przyłączania fosforu) w komórkach bakteryjnych; do grupy
tej należy: chlorotetracyklina (wytwarzana przez Streptomyces aureofaciens),
oksytetracyklina (produkowana przez Streptomycesrimosus), tetracyklina (wytwarzana
przez kilka gatunków Streptomyces),
−
erytromycyna, oleandomycyna, karbomycyna – to grupa antybiotyków makrolidowych
(zawierają pierścień laktonowy), hamują syntezę białek w komórkach bakterii Gram-
dodatnich i Gram-ujemnych; erytromycyna wytwarzana jest przez Streptomyces
erythraeus,
−
neomycyna – stosowana głównie na bakterie Gram-ujemne, hamuje syntezę białek
w komórkach bakteryjnych, wytwarzana przez bakterie Streptomyces fradiae.
Największe znaczenie wśród antybiotyków pochodzenia grzybowego ma penicylina,
wytwarzana przez grzyby z rodzaju Penicillium (głównie Penicillium chrysogenum). Działa
na bakterie Gram-dodatnie i niektóre Gram-ujemne. Penicylina jest pojęciem zbiorowym dla
kilku związków o podobnej budowie chemicznej i sposobie działania – hamują one
biosyntezę ściany komórki bakteryjnej, co prowadzi do jej rozpadu.
Wykorzystanie mikroorganizmów w biotechnologii
Biotechnologia to dyscyplina naukowa, która stosuje różnorodne zabiegi w celu
uzyskania użytecznych, żywych organizmów lub pochodzących z nich produktów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
W biotechnologii praktyczne zastosowanie mają osiągnięcia biologii molekularnej i inżynierii
genetycznej, cytologii i embriologii. Najważniejszymi dziedzinami zastosowań współczesnej
biotechnologii są rolnictwo i medycyna, a stosowane przez nią procesy biologiczne
wykorzystuje się są na skalę przemysłową.
Przykłady wykorzystania drobnoustrojów w biotechnologii:
a)
produkcja preparatów enzymatycznych:
−
amylazy – to enzymy rozkładające skrobię, produkowane przez grzyby Aspergillus
oryzae, Aspergillus niger i bakterie Bacillus subtilis, Bacillus cereus, Bacillus
polymyxa;
wykorzystywane
są
w
przemyśle
spożywczym
(gorzelnictwo,
piwowarstwo, piekarnictwo, przemysł ziemniaczany, przetwórstwo warzyw
i owoców), przemyśle kosmetycznym,
−
proteazy – hydrolizują wiązania peptydowe w białkach, produkowane przez Bacillus
licheniformis, Bacillus firmus, Bacillus pumilis, Bacillus subtilis, Pseudomonas
aeruginosa, Streptomyces griseus, Streptomyces lactis, Aspergillus niger; stosowane
są w przemyśle kosmetycznym (kremy, proszki do prania), farmaceutycznym,
skórzanym, spożywczym (mleczarstwo, produkcja koncentratów spożywczych),
−
pektynazy – rozkładają pektyny, wytwarzane przez Aspergillus niger, Aspergillus
flavus, Aspergillus oryzae, Sclerotina; używane są do klarowania soków i win,
w produkcji wódek i likierów, kawy i koncentratów kawowych,
b)
wytwarzanie białek człowieka przez bakterie – bakterie z wprowadzonymi ludzkimi
genami syntetyzują białka człowieka które można wykorzystać w celach
terapeutycznych, np.:
−
insulinę – hormon regulujący poziom cukru we krwi, stosowany w leczeniu cukrzycy,
−
czynnik VIII – białko uczestniczące w krzepnięciu krwi, stosowane w leczeniu
hemofilii,
−
hormon wzrostu człowieka – białko stosowane w leczeniu zaburzeń rozwoju,
−
erytropoetynę – białko stymulujące dojrzewanie erytrocytów, stosowane w leczeniu
anemii,
−
aktywator plazminogenu – białko wspomagające rozpuszczanie zakrzepów, stosowane
w leczeniu chorób serca i układu krążenia,
c)
wytwarzanie szczepionek – bakterie produkują białka wirusowe, wykorzystywane
w produkcji szczepionek (m.in. na wirusowe zapalenie wątroby typu B),
d)
stosowanie genów bakteryjnych w biotechnologii roślin – przykładem jest kukurydza BT
zawierająca gen pochodzący z bakterii Baccillus thuringiensis odpowiedzialny za
produkcję białka, które jest toksyczne dla szkodników; rolnicy uprawiający kukurydzę
BT nie muszą w związku z tym stosować w uprawie środków owadobójczych.
Rodzaje zatruć pokarmowych i sposoby przeciwdziałania im
Drobnoustroje chorobotwórcze, zaliczane do pasożytów, wywołują choroby, a nawet
ś
mierć swojego żywiciela. Miarą zjadliwości drobnoustroju jest wytwarzanie przez niego
toksyn oraz zdolność umiejscowienia i namnażania się w organizmie. Toksyny bakteryjne
mogą być wydzielane na zewnątrz komórki (egzotoksyny) lub tworzą się wewnątrz bakterii
(endotoksyny). Zakażenie następuje po wtargnięciu drobnoustroju do wnętrza organizmu
człowieka (roślin, zwierząt) i pokonaniu mechanizmów obronnych. Choroby zakaźne szerzą
się różnymi drogami: przez bezpośredni kontakt z chorym osobnikiem, drogą kropelkowo-
powietrzną, drogą wodno-pokarmową, przez ziemię, produkty spożywcze, przedmioty
codziennego użytku, mogą być przenoszone przez owady lub gryzonie.
Zatrucia pokarmowe to ostre schorzenia przewodu pokarmowego, występujące na skutek
spożycia produktów zawierających chorobotwórcze bakterie lub ich toksyny.
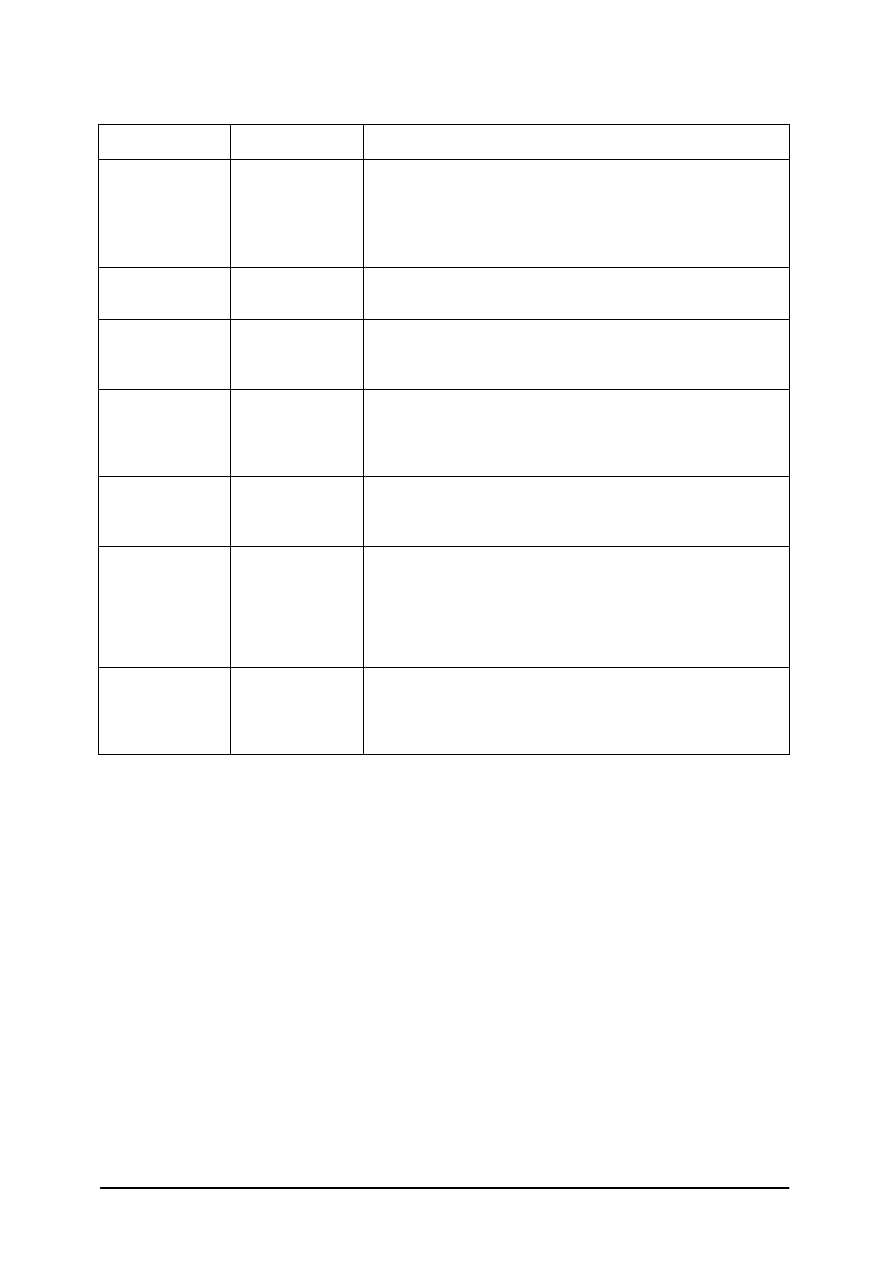
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
Tabela 7. Charakterystyka najczęstszych zatruć pokarmowych człowieka
Jednostka
chorobowa
Bakterie
Źródło zakażenia i przebieg kliniczny
dur brzuszny
(tyfus)
Salmonella typki
(pałeczka durowa)
−
spożycie zakażonej wody lub pokarmu,
−
okres wylęgania choroby trwa zwykle 10-14 dni,
−
wzrost temperatury ciała (do 39-40
°
C), ból brzucha
i głowy, brak apetytu, kaszel, nieżyt oskrzeli, na skórze brzucha
i dolnej części klatki piersiowej pojawia się wysypka, język
suchy pokryty brunatnym nalotem, może wystąpić biegunka
dur rzekomy
Salmonella
paratyphi
−
spożycie zakażonej wody lub pokarmu,
−
objawy podobne jak w durze brzusznym, ale przebieg choroby
łagodniejszy
zakaźne zatrucia
pokarmowe
Salmonella
typhomurium,
S. enteritidis,
S. dublin
−
spożycie zakażonego pokarmu,
−
okres wylęgania choroby trwa zwykle od 2 do 48 h,
−
nagłe objawy: bóle brzucha, nudności, biegunka, wymioty, bóle
i zwroty głowy, gorączka, osłabienie i odwodnienie organizmu,
czerwonka
bakteryjna
Shigella (pałeczki
czerwonkowe)
−
spożycie zakażonej wody lub pokarmu,
−
okres wylęgania choroby trwa zwykle 2–5 dni,
−
dreszcze, wysoka gorączka, ból brzucha, biegunka, stolce
z domieszka krwi, odwodnienie, apatia, senność, bóle
mięśniowe
zatrucia
gronkowcowe
Staphylococcus
aureus
−
spożycie zakażonego pokarmu: wędliny, mięso, sałatki, ciasta,
lody,
−
objawy chorobowe pojawiają się po około 2 godz.
−
wymioty, biegunka, spadek ciśnienia krwi, zapaść
botulizm (zatrucie
jadem
kiełbasianym)
Clostridium
botulinum
(laseczka jadu
kiełbasianego)
−
spożycie zakażonego pokarmu: konserwy mięsne, rybne
i warzywne, surowe wędliny, ryby solone lub wędzone,
−
okres wylęgania choroby trwa od kilku do 48 h,
−
toksyna botulinowa działa na układ nerwowy: podwójne
widzenie, trudności w mówieniu i połykaniu, zawroty głowy,
osłabienie, suchość w jamie ustnej, wzdęcie brzucha i zaparcia,
utrudnione oddychanie (śmiertelność duża — około 65%)
cholera
Vibrio cholerae
(pałeczka podobna
do przecinka)
−
spożycie zakażonego pokarmu i wody,
−
okres wylęgania choroby od kilku godzin do 5 dni,
−
biegunka,
wymioty,
osłabienie,
utrata
łaknienia,
bóle
mięśniowe, silne odwodnienie, suchość błon śluzowych i skóry,
może doprowadzić do bezmoczu, zapaści i śmierci.
Zapobieganie zatruciom pokarmowym polega na:
−
kontroli weterynaryjnej zwierząt rzeźnych i mięsa,
−
stałej kontroli nosicielstwa wśród pracowników zatrudnionych w zakładach przemysłu
spożywczego,
−
przestrzeganiu
odpowiednich
warunków
sanitarno-higienicznych
produkcji
i magazynowania produktów spożywczych,
−
przestrzeganiu obowiązujących parametrów obróbki termicznej przy produkcji artykułów
spożywczych,
−
używaniu wody zdatnej do picia,
−
zwalczaniu gryzoni i much.
Normy mikrobiologiczne
Możliwość zakażenia ludzi przez bakterie chorobotwórcze znajdujące się w wodzie,
glebie lub powietrzu zmusza do prowadzenia stałej kontroli higieniczno-sanitarnej tych
ś
rodowisk:
a)
Ocena sanitarna wody
Ocena sanitarna wody polega na pośrednim wnioskowaniu o obecności form
patogennych, opartym na tzw. bakteriach wskaźnikowych, które stale żyją jako saprofity

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
w przewodzie pokarmowym człowieka i zwierząt wyższych. Ich obecność w wodzie
ś
wiadczy o jej zanieczyszczeniu kałowym, a zatem również o niebezpieczeństwie zakażenia
wody mikroorganizmami chorobotwórczymi. Kontroli sanitarnej podlega woda pitna, wody
w basenach kąpielowych i zbiornikach wód powierzchniowych. Mikroflora saprofityczna
jelita grubego człowieka o znaczeniu wskaźnikowym obejmuje bakterie: Escherichia coli,
Streptococcus faecalis i Clostridium perfringens. Praktycznie uniwersalnym wskaźnikiem
zanieczyszczenia wody odchodami ludzkimi i zwierzęcymi stały się pałeczki grupy coli.
Na stopień zakażenia wskazuje tzw. miano coli – jest to najmniejsza objętość badanej wody,
w której stwierdza się obecność bakterii grupy coli. Index (wskaźnik) coli jest to liczba
pałeczek okrężnicy stwierdzona w 100 cm
3
wody.
b)
Ocena sanitarna gleby
Gleba jest systematycznie zanieczyszczana różnymi substancjami powstającymi
w wyniku działalności gospodarczej człowieka. Mikroorganizmy chorobotwórcze dostają się
do gleby z powietrza i wód powierzchniowych lub są wprowadzane przez człowieka wraz ze
ś
ciekami bytowo-gospodarczymi i odchodami ludzkimi i zwierzęcymi (z szamba lub
gnojówki). Wśród bakterii patogennych wykrywanych w powierzchniowych warstwach gleby
najbardziej niebezpieczne dla człowieka są: Clostridium tetani (laseczki tężca), Clostridium
botulinum, Bacillus anthracis (laseczki wąglika), Mycobakterium tuberculosis (prątki
gruźlicy), Salmonella (pałeczki duru brzusznego), Shigella (pałeczki czerwonki).
Sanitarno-mikrobiologiczna analiza gleby obejmuje kilka wskaźników, najważniejsze to:
miano coli (bakterii grupy coli), miano Escherichia coli (jako wskaźnik świeżego
zanieczyszczenia fekalnego), miano Clostridium perfringens (jako wskaźnik odległego
w czasie skażenia gleb fekaliami) oraz ogólna liczba bakterii wegetatywnych
i przetrwalnikujących (stosunek ogólnej liczby bakterii do bakterii prztrwalnikujących
ś
wiadczy o stopniu rozkładu w glebie związków organicznych; w końcowych etapach
mineralizacji wzrasta ilość przetrwalników bakteryjnych).
Tabela 8. Ocena sanitarno-bakteriologiczna gleby (wg Gorbowej W.A.) [8, s. 224]
Oznaczenia
Stan gleby
Liczba bakterii saprofitycznych
w 1g gleby
Miano coli
Miano bakterii Clostridium
perfringens
Czysta
1 – 2,5 x 10
6
1,0
0,1
Umiarkowanie
zanieczyszczona
1 – 2,5 x 10
6
1,0 – 0,01
0,1 – 0,001
Zanieczyszczona
>
2,5 x 10
6
0,01 – 0,001
0,001 – 0,0001
Silnie
zanieczyszczona
>
10 x 10
6
0,001
0,0001
c)
Ocena sanitarna powietrza
Powietrze jest drogą przenoszenia mikroorganizmów, bakterie i zarodniki grzybów
w nim występujące powiązane są z cząsteczkami stałymi lub kroplami cieczy w postaci
aerozolu lub pyłu bakteryjnego. Na liczebność mikroorganizmów w powietrzu mają wpływ:
opady atmosferyczne, nasłonecznienie, temperatura, pora roku i dnia, ruch powietrza,
wilgotność, ciśnienie atmosferyczne oraz ilość zanieczyszczeń.
Wśród mikroflory powietrza spotykane są organizmy saprofityczne i chorobotwórcze,
przeważają bakterie Gram-dodatnie (gronkowce, pakietowce i paciorkowce), z grzybów
najczęściej
obecne
są
rodzaje
Aspergillus,
Penicillium,
Mucor,
Cladosporium
i Saccharomyces. W pomieszczeniach użytkowych człowiek może być źródłem
zanieczyszczenia mikrobiologicznego, zwłaszcza bakteriami chorobotwórczymi.
Mikroorganizmy
wskaźnikowe,
stosowane
w
badaniach
powietrza,
nie
są
chorobotwórcze, ale świadczą o możliwości występowania bakterii chorobotwórczych. Do
bakterii wskaźnikowych należą m.in.: Streptococcus salivarius, Streptococcus viridans.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
Tabela 9. Dopuszczalny stopień mikrobiologicznego zanieczyszczenia powietrza pomieszczeń użytkowych
(wg B. Krzysztofika) [8, s. 228]
Dopuszczalna liczba mikroorganizmów
w 1m
3
powietrza
L.p.
Rodzaj pomieszczenia
użytkowego
Liczebność mikroorg.
na agarze
odżywczym
Liczebność
mikroorg.
hemolizujących na
agarze z krwią
Liczebność
grzybów na
podłożu
Sabourauda
I
Powietrze zewnętrzne –
atmosferyczne
3000
100
1000
II
Pomieszczenia służby zdrowia
1
Sala operacyjna
100
0
0
2
Sala opatrunkowa
150
0
50
3
Sala z chorymi
1000
50
200
III
Pomieszczenia domów
mieszkalnych
1
Kuchnia i jadalnia
2000
100
300
2
Pokój – salon
1500
50
200
3
Sypialnia
1000
50
100
IV
Pomieszczenia szkolne
1
Sale wykładowe
1500
50
200
2
Sale do ćwiczeń
2000
100
200
3
Sale gimnastyczne
3000
150
300
V
Pomieszczenia produkcyjne
1
Przemysł spożywczy
600
0
0
2
Przemysł mięsny
500
0
50
3
Przemysł fermentacyjny
600
50
0
4.5.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie funkcje pełnią mikroorganizmy w przyrodzie?
2.
Na czym polegają procesy mineralizacji i humifikacji?
3.
Jaka jest rola mikroorganizmów w obiegu węgla w przyrodzie?
4.
Jaka jest rola bakterii w obiegu azotu w przyrodzie?
5.
Jakie rodzaje mikroorganizmów wykorzystujemy w przemyśle spożywczym?
6.
Czym różni się fermentacja mlekowa od pseudomlekowej?
7.
W jakich gałęziach przemysłu spożywczego wykorzystujemy procesy fermentacyjne
bakterii i drożdży?
8.
Jakie jest zastosowanie pleśni w przemyśle spożywczym?
9.
Na czym polega ujemna rola bakterii przemyśle spożywczym?
10.
Jakie są sposoby konserwowania produktów spożywczych?
11.
W jaki sposób działają antybiotyki i jakie jest ich zastosowanie?
12.
Jak wykorzystuje się bakterie w biotechnologii?
13.
Jakie są rodzaje zatruć pokarmowych?
14.
Co oznacza wskaźnik „miano coli” i jakie jest jego zastosowanie w kontroli sanitarnej
wody i gleby?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
4.5.3. Ćwiczenia
Ćwiczenie 1
Wykryj obecność bakterii denitryfikacyjnych w glebie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
rozcieńczyć badaną próbkę gleby w roztworze soli fizjologicznej od 10
-1
do 10
-9
,
2)
posiać 1cm
3
z każdego rozcieńczenia do probówek z pożywką ciekłą,
3)
prowadzić hodowlę przez 7 dni w temperaturze 27°C,
4)
sprawdzić obecność związków azotowych w probówkach zmętnianych po okresie
hodowlanym:
−
nanieść po 1 cm
3
hodowli do wgłębień na płytce porcelanowej, dodać około 0,5 cm
3
roztworu kwasu sulfanilowego i około 0,5 cm
3
roztworu
α
-naftyloaminy – czerwone
zabarwienie próbki świadczyć będzie o obecności azotynów (NO
2
-
),
−
nanieść po 0,5cm
3
hodowli do wgłębień na płytce porcelanowej i około 0,2 cm
3
dwufenyloaminy – niebieskie zabarwienie próbki świadczyć będzie o obecności
azotanów (NO
3
-
),
−
nanieść po 0,2 cm
3
odczynnika Nesslera do wgłębień na płytce, a następnie dodać
około 2 cm
3
badanej hodowli – intensywnie żółte zabarwienie próbki świadczyć
będzie o obecności azotu amonowego (NH
4
+
),
5)
zestawić wyniki obserwacji w tabeli:
Dodany odczynnik
Wynik (zabarwienie)
Wykryty związek
kwas
sulfanilowy,
α
-naftyloamina
dwufenyloamina
odczynnik Nesslera
6)
wyciągnąć wnioski z przeprowadzonych obserwacji.
Wyposażenie stanowiska pracy:
−
gleba,
−
probówki z pożywką (bulion zwykły z saletrą potasową),
−
pipety na 1,0 lub 2,0 cm
3
,
−
płytki porcelanowe białe z 12 wgłębieniami,
−
odczynniki: kwas sulfanilowy,
α
-naftyloamina, dwufenyloamina, odczynnik Nesslera,
−
sól fizjologiczna,
−
cieplarka.
Ćwiczenie 2
Oznacz miano bakterii grupy coli metodą fermentacyjną probówkową.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wykonać szereg rozcieńczeń próbki wody powierzchniowej (od 10
-1
do 10
-6
),
2)
posiać 1 cm
3
próbki z rozcieńczeń na płynne podłoże Eijkmana z błękitem
bromotymolowym w probówkach Dürhama,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
3)
inkubować posiewy w temperaturze 37°C przez 24 godziny,
4)
oczytać wyniki: za wynik dodatni uznaje się zmianę barwy podłoża z zielonej na żółtą,
obecność gazu w rurkach Dürhama oraz zmętnienie pożywki (zmiany takie świadczą
o wzroście w pożywce bakterii fermentujących laktozę z wytworzeniem kwasu i gazu),
5)
wykonać badania potwierdzające: z dodatnich próbek posiać przy pomocy jałowej ezy
niewielką ilość materiału na płytki z podłożem Endo,
6)
inkubować posiewy w temperaturze 37°C przez 24 godziny,
7)
odczytać wyniki: za wynik dodatni przyjmuje się wzrost kolonii gładkich,
ciemnoczerwonych z metalicznym połyskiem,
8)
ustalić miano coli, czyli podać najmniejsze rozcieńczenie próby, w której wykryto
bakterie coli (np. jeśli bakterie coli zostały wykryte w rozcieńczeniu 10
-5
,
a w rozcieńczeniu 10
-6
już nie wykryto ich obecności, to miano coli wynosi 10
-5
).
Rysunek do ćwiczenia 2. Probówki z pożywką i probówkami Dürhama:
a) probówka Dürhama wypełniona pożywką (bez gazu), b) probówka Dürhama
wypełniona gazem. [2, s.123]
Wyposażenie stanowiska pracy:
−
woda ze zbiornika powierzchniowego,
−
probówki Dürhama z pożywką (płynne podłoże Eijkmana z błękitem bromotymolowym),
−
płytki Petriego z podłożem Endo,
−
pipety na 1,0 lub 2,0 cm
3
,
−
eza,
−
sól fizjologiczna,
−
cieplarka.
Ćwiczenie 3
Oznacz ilość drobnoustrojów w 10 m
3
powietrza metodą sedymentacyjną.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
otworzyć 2 płytki Petriego z pożywką w badanym pomieszczeniu na okres 15 minut (lub
10 minut),
2)
zamknąć płytki po upływie czasu sedymentacji, odwrócić do góry dnem i wstawić do
termostatu,
3)
inkubować płytki w temperaturze 27°C przez 7 dni,
4)
policzyć wyrosłe kolonie po zakończonej inkubacji,
5)
przeliczyć ilość kolonii na 10 dm
3
powietrza wg wzoru:
x =
k
b
a
⋅
⋅
100

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
gdzie: a – średnia arytmetyczna z liczby kolonii wyrosłych na dwóch płytkach,
b – powierzchnia płytki w cm
2
(dla płytki o średnicy 10 cm powierzchnia wynosi
78,5 cm
2
),
k – współczynnik czasu otwarcia płytki (dla 5 minut k=1, dla 10 minut k=2 itd.),
100 – przeliczenie powierzchni płytki na 100 cm
2
,
6)
określić na podstawie otrzymanego wyniku stopień czystości powietrza wykorzystując
dane z tabeli 9.
Wyposażenie stanowiska pracy:
−
płytki Petriego z bulionem agarowym,
−
cieplarka.
4.5.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
opisać rolę drobnoustrojów w przyrodzie?
2)
opisać rolę mikroorganizmów w obiegu pierwiastków w przyrodzie?
3)
podać przykłady wykorzystania mikroorganizmów w przemyśle
spożywczym?
4)
scharakteryzować negatywny wpływ bakterii na produkty
spożywcze?
5)
wymienić sposoby konserwacji produktów spożywczych?
6)
opisać sposoby wykorzystania bakterii w przemyśle
farmaceutycznym i biotechnologii?
7)
scharakteryzować rodzaje zatruć pokarmowych człowieka?
8)
oznaczyć miano coli?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem
a następnie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 25 zadań. Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko
jedna jest prawdziwa.
6.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8.
Na rozwiązanie testu masz 45 min.
Powodzenia
ZESTAW ZADAŃ TESTOWYCH
1. Do posiewu drobnoustrojów na powierzchnię pożywki stałej w płytce Petriego używa się
a)
ezy.
b)
bagietki szklanej.
c)
pipety pasteurowskiej.
d)
igły preparacyjnej.
2.
Powiększenie okularu wynosi 10x, powiększeni obiektywu – 40x. Całkowite
powiększenie uzyskane w mikroskopie wynosi
a)
50x.
b)
500x.
c)
40x.
d)
400x.
3.
Pod względem chemicznym wirusy zbudowane są z
a)
DNA i RNA.
b)
DNA i RNA oraz białek.
c)
DNA lub RNA oraz białek.
d)
DNA i RNA oraz lipidów.
4.
W lizogenicznym cyklu rozwoju wirusa następuje
a)
powielenie cząstek wirusa i rozpad komórki gospodarza.
b)
powielenie cząstek wirusa i uwolnienie ich przez błonę komórki gospodarza.
c)
przyłączenie DNA wirusowego do DNA materiału genetycznego komórki
gospodarza.
d)
przyłączenie RNA wirusa do DNA komórki gospodarza i jej rozpad.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
5.
Przedstawione na rysunkach układy komórek bakteryjnych to
a)
A – dwoinki, B – pakietowce, C – gronkowce.
b)
A – paciorkowce, B – pakietowce, C – gronkowce.
c)
A – czwórniaki, B – dwoinki, C – gronkowce.
d)
A – paciorkowce, B – czwórniaki, C – gronkowce.
6.
Każda komórka bakteryjna posiada
a)
błonę komórkową, cytoplazmę, plazmidy.
b)
ś
cianę komórkową, rzęski, ciała chromatoforowe.
c)
mezosomy, nukleoid, ścianę komórkową.
d)
otoczkę śluzową, ciała zapasowe, fimbrie.
7.
Mezosomy to struktury komórki bakteryjnej odpowiedzialne za
a)
oddychanie komórkowe.
b)
biosyntezę białek.
c)
trawienie wewnątrzkomórkowe.
d)
rozmnażanie płciowe.
8.
Bakterie chemoautotroficzne uzyskują energię potrzebną do wytwarzania związków
organicznych z
a)
utleniania węglowodanów.
b)
utleniania związków mineralnych.
c)
redukcji związków mineralnych.
d)
energii słonecznej.
9.
Asymilację azotu atmosferycznego przeprowadzają bakterie
a)
Rhizobium, Lactobacillus.
b)
Rhizobium. Azotobacter chroococcum.
c)
Clostridium pasteurianum, Acetobacter.
d)
Escherichia coli, Azotobakter.
10.
Ś
ciana komórkowa drożdży zawiera w swoim składzie
a)
celulozę.
b)
fosfolipidy.
c)
białka.
d)
chitynę.
11.
Zarodniki konidialne pędzlaka i kropidlaka tworzą się
a)
na drodze mejozy.
b)
w kulistych zarodniach.
c)
w workach po 8 zarodników.
d)
przez odcięcie komórki na końcu strzępki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
12.
Faza równowagi, występująca w trakcie hodowli okresowej bakterii, świadczy o tym, że
a)
więcej bakterii dzieli się niż wymiera.
b)
więcej bakterii wymiera, niż powstaje z podziałów.
c)
tyle samo bakterii powstaje w wyniku podziałów co wymiera.
d)
ilość bakterii nie zmienia się, gdyż nie obserwuje się podziałów komórkowych.
13.
Bulion odżywczy jest przykładem podłoża
a)
podstawowego.
b)
wzbogaconego.
c)
identyfikacyjnego.
d)
różnicującego.
14.
Do oznaczania bakterii grupy coli metodą fermentacyjną probówkową stosuje się
a)
podłoże Eijkmana w probówkach Dürhama.
b)
pożywkę Chapmana.
c)
bulion zwykły z saletrą potasową.
d)
pożywkę Sabourauda.
15.
Do czynników fizycznych wpływających na rozwój mikroorganizmów zalicza się
a)
ciśnienie osmotyczne, temperaturę, pH.
b)
temperaturę, promieniowanie, ciśnienie osmotyczne.
c)
antybiotyki, temperaturę, obecność fagów.
d)
ciśnienie hydrostatyczne, ultradźwięki, pH.
16.
Zjawisko plazmolizy zachodzi po umieszczeniu komórki w roztworze
a)
hipotonicznym.
b)
hipertonicznym.
c)
izotonicznym.
d)
o niższym ciśnieniu osmotycznym niż ciśnienie w komórce.
17.
Chorobotwórcze bakterie pasożytnicze należą do grupy bakterii
a)
psychrofilnych.
b)
termofilnych.
c)
mezofilnych.
d)
stenotermofilnych.
18.
Niska temperatura działa na większość bakterii
a)
bakteriobójczo, niszcząc komórki bakteryjne.
b)
bakteriobójczo niszcząc przetrwalniki bakteryjne.
c)
bakteriostatycznie, niszcząc ścianę komórkową bakterii.
d)
bakteriostatycznie, hamując procesy życiowe bakterii.
19.
W glebie występują liczne bakterie zaliczane do grupy reducentów. Ich rola w obiegu
materii w przyrodzie polega na
a)
syntezie związków organicznych z nieorganicznych.
b)
rozkładzie martwej materii organicznej.
c)
wytwarzaniu związków organicznych w procesie fotosyntezy.
d)
wytwarzaniu związków organicznych w procesie chemosyntezy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
20.
W cyklu obiegu azotu w przyrodzie uczestniczą różne grupy bakterii. Utlenianie
amoniaku do azotanów (III) przeprowadzają bakterie
a)
Nitrosomonas.
b)
Nitrobacter.
c)
Azotobacter.
d)
Rhizobium.
21.
Rola bakterii denitryfikacyjnych w przyrodzie jest
a)
pozytywna, gdyż wzbogacają glebę w związki azotowe.
b)
negatywna, gdyż zwiększają zawartość N
2
w glebie.
c)
negatywna, gdyż zmniejszają zawartość związków azotowych w glebie.
d)
pozytywna, gdyż wiążą azot atmosferyczny.
22.
Mikroorganizmy, dzięki swoim właściwościom fermentacyjnym, wykorzystywane są
w przemyśle spożywczym. Do wytwarzania kefiru należy użyć
a)
bakterii fermentacji octowej.
b)
bakterii fermentacji mlekowej.
c)
bakterii fermentacji mlekowej i drożdży szlachetnych.
d)
bakterii fermentacji propionowej.
23.
Antybiotyki hamują wybrane funkcje metaboliczne bakterii. Streptomycyna powoduje
a)
zahamowanie syntezy białek komórkowych.
b)
rozpad ściany komórkowej bakterii.
c)
uszkodzenie DNA komórki bakteryjnej.
d)
zahamowanie syntezy lipidów komórkowych.
24.
Bakterie chorobotwórcze mogą wywołać różne dolegliwości. Groźne dla życia człowieka
działanie na układ nerwowy wykazuje
a)
pałeczka czerwonki.
b)
laseczka jadu kiełbasianego.
c)
pałeczka durowa.
d)
pałeczka cholery.
25.
Do oceny stanu sanitarnego wód służy wskaźnik
a)
kwasowość wody.
b)
zasadowość wody.
c)
miano coli.
d)
miano Streptococcus salivarius.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie badań mikrobiologicznych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
21.
a
b
c
d
22.
a
b
c
d
23.
a
b
c
d
24.
a
b
c
d
25.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
6.
LITERATURA
1.
Balerstet J., Lewiński W.: Biologia 1. Zakres rozszerzony. Podręcznik dla liceum
ogólnokształcącego. Wydawnictwo Pedagogiczne OPERON, Rumia 2002
2.
Długoński J.(red.): Biotechnologia mikrobiologiczna. Ćwiczenia i pracownie
specjalistyczne. Wydawnictwo Uniwersytetu Łódzkiego, Łódź 1997
3.
Drewniak E., Drewniak T.: Mikrobiologia żywności. WSiP, Warszawa 1999
4.
Jawetz E..: Przegląd mikrobiologii lekarskiej. PZWL, Warszawa 1974
5.
Kędzia W.: Diagnostyka mikrobiologiczna w medycynie. PZWL, Warszawa 1990
6.
Kosewska L.: Analiza mikrobiologiczna w przemyśle spożywczym. WSiP, Warszawa
1986
7.
Kowalczyk R.: Mikroskop, budowa i użytkowanie. WNT, Warszawa 1966
8.
Kunicki-Goldfinger W.: śycie bakterii. PWN, Warszawa 1994
9.
Mrozowska J. (red): Laboratorium z mikrobiologii ogólnej i środowiskowej.
Wydawnictwo Politechniki Śląskiej, Gliwice 1999
10.
Pyłka-Gutowska E.: Ekologia z ochroną środowiska. Wydawnictwo Oświata, Warszawa
2004
11.
Salyers A., Whitt D.: Mikrobiologia. Różnorodność, chorobotwórczość i środowisko.
PWN, Warszawa 2003
12.
Villee C.A.: Biologia. PWRiL, Warszawa 1990
13.
www.kbpr.wm.tu.koszalin.pl/czerwewa.htm
Wyszukiwarka
Podobne podstrony:
06 Wykonywanie badan mikrobiolo Nieznany
06 Wykonywanie badań mikrobiologicznych
06 Wykonywanie badań mikrobiologicznych
06 Wykonywanie podstawowych robót ślusarskich
pobieranie i przesyłanie materiałów do badań mikrobiologicznych, mikrobiologia
1. Metodyka badań mikrobiologicznych - 3, 1. Metodyka badań mikrobiologicznych
Podstawowa aparatura i metody badań mikrobiologicznych
713[05] Z1 06 Wykonywanie posad Nieznany (2)
06 Wykonywanie prac z zakresu obróbki mechanicznej metali
POBIERANIE MATERIALOW DO BADAN MIKROBIOLOGICZNYCH ppt
06 Wykonywanie prac przygotowawczo zakończeniowych
05 Wykonywanie badań biochemicznych
06 Wykonywanie prostych prac z Nieznany
06 Wykonywanie ćwiczeń słuchowo głosowych
04 Wykonywanie badan i pomiarow Nieznany (2)
06 WYKONYWANIE CZYNNOSCI W SPRAWACH O WYKROCZENIA
7 2010 11 23 21 11 06 Projekt badan, Studia
więcej podobnych podstron