
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Robert Rochel
Wykonywanie badań biochemicznych 311[02].Z2.01
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji
–
Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Barbara Przedlacka
mgr Urszula Ciosk-Rawluk
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą
programu jednostki modułowej 311[02].Z2.01,
„Wykonywanie badań biochemicznych”, zawartego w modułowym programie nauczania dla
zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Przykładowe scenariusze zajęć
7
5.
Ćwiczenia
12
5.1.
Komórka - podstawowy element morfologiczny i czynnościowy organizmu
12
5.1.1. Ćwiczenia
12
5.2.
Znaczenie enzymów i kwasów nukleinowych
15
5.2.1. Ćwiczenia
15
5.3.
Rola i znaczenie biologiczne węglowodanów, białek i lipidów
18
5.3.1. Ćwiczenia
18
5.4.
Znaczenie badań bioanalitycznych w biochemii
21
5.4.1. Ćwiczenia
21
6.
Ewaluacja osiągnięć ucznia
24
7. Literatura
38

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu poradnik dla nauczyciela, który będzie pomocny w prowadzeniu
zajęć dydaktycznych w szkole kształcącej w zawodzie technik analityk. Posłuży on
przygotowaniu ucznia do przyszłej pracy na stanowisku technika analityka w laboratorium
chemicznym, analitycznym lub biotechnologicznym.
W poradniku zamieszczono:
−
wymagania wstępne zawierające wykaz wiedzy jaką uczeń powinien przyswoić,
−
cele kształcenia grupujące wykaz umiejętności, które powinny zostać ukształtowane
w trakcie przyswajania przez ucznia materiału zawartego w poradniku,
−
przykładowe scenariusze zajęć,
−
propozycje ćwiczeń dla uczniów, które umożliwią im nabycie umiejętności praktycznych,
−
ewaluację osiągnięć ucznia w postaci testów sprawdzających stan wiedzy uczniów,
−
spis literatury.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem aktywizujących metod nauczania, np. samokształcenia
kierowanego, tekstu przewodniego, gier dydaktycznych, metody projektów, ćwiczeń
laboratoryjnych oraz dyskusji dydaktycznej.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej. Praca zespołowa, w szczególności
w małych zespołach pozwoli na przedyskutowanie w grupie problemów, które przedstawił
nauczyciel. Ponadto niezwykle ważnym w tej formie pracy jest umiejętność dyskusji w grupie
oraz wzajemne uzupełnianie informacji.
Ewaluację osiągnięć ucznia można przeprowadzić za pomocą zaproponowanych
zestawów zadań testowych.
Wskazane jest zwrócenie uwagi na aspekty bezpieczeństwa i higieny pracy. W trakcie
zajęć laboratoryjnych zachowanie bezpieczeństwa i higieny jest szczególnie ważne.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
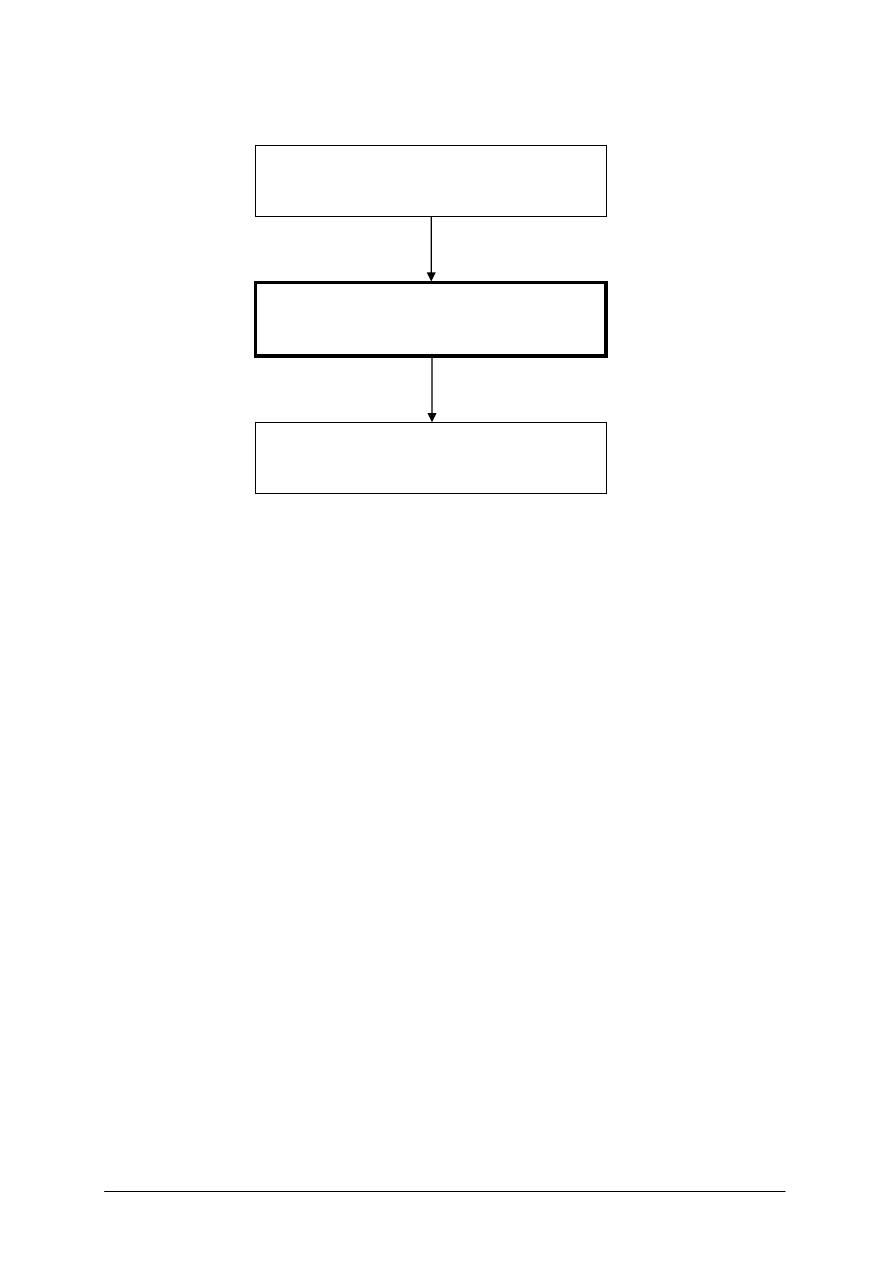
311[02].Z2
Podstawy badań bioanalitycznych
311[02].Z2.01
Wykonywanie badań biochemicznych
311[02].Z2.02
Wykonywanie badań mikrobiologicznych
Schemat układu jednostek modułowych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
−
przestrzegać przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
przestrzegać zasad dobrej techniki laboratoryjnej,
−
przestrzegać zasad bezpieczeństwa podczas badania analitycznego w szczególności
w trakcie kontaktu z substancjami uznanymi za niebezpieczne oraz z truciznami,
−
posługiwać się w prawidłowy sposób nomenklaturą związków chemicznych zarówno
organicznych jak i nieorganicznych,
−
określać właściwości fizykochemiczne substancji,
−
prawidłowo oceniać na podstawie informacji zawartych na etykietach szkodliwe
i toksyczne działanie narkotyków i używek,
−
stosować obowiązujące jednostki układu SI,
−
sporządzać wykresy interpretować wyniki,
−
sporządzać roztwory o określonym stężeniu,
−
przygotowywać próbki materiału do analizy,
−
przygotowywać sprzęt laboratoryjny, aparaturę i odczynniki do analizy,
−
korzystać z norm, przepisów, procedur i dostępnych instrukcji,
−
właściwie rozpoznawać objawy zatruć substancjami niebezpiecznymi,
−
udzielać pierwszej pomocy oraz w razie konieczności organizować akcję ratowniczą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
−
posłużyć się terminologią z zakresu biochemii,
−
określić skład chemiczny, strukturę oraz funkcje komórki roślinnej i zwierzęcej,
−
określić właściwości i budowę enzymów oraz wyjaśnić mechanizmy działania,
−
scharakteryzować budowę kwasów nukleinowych oraz określić ich rolę w replikacji
i transkrypcji,
−
określić znaczenie i zastosowanie enzymów i drobnoustrojów w przemyśle spożywczym,
biotechnologii i bioanalityce,
−
scharakteryzować ważniejsze metabolizmy zachodzące w przyrodzie,
−
określić rolę i znaczenie biologiczne cukrów, białek, tłuszczów, enzymów, kwasów
nukleinowych, wody,
−
scharakteryzować zaburzenia gospodarki węglowodanowej i lipidowej oraz określić
sposoby przeciwdziałania,
−
scharakteryzować oddychanie tlenowe i rolę enzymów w transporcie wodoru
i elektrolitów,
−
scharakteryzować proces fotosyntezy, fazy i czynniki wpływające na jego przebieg,
−
dokonać klasyfikacji biosensorów,
−
określić zastosowanie biosensorów w analizie żywności, ochronie środowiska, kontroli
biotechnologicznej,
−
scharakteryzować podstawowe metody badań bioanalitycznych,
−
zorganizować stanowisko pracy zgodnie z wymaganiami ergonomii,
−
dobrać sprzęt laboratoryjny i przyrządy do badań biochemicznych,
−
zastosować techniki pracy laboratoryjnej specyficzne dla analizy biochemicznej,
−
przygotować materiał biologiczny do analizy, w tym: krew, mocz, płyny ustrojowe,
−
wykonać jakościowe i ilościowe oznaczenia cukrów, białek, tłuszczów, enzymów
i kwasów nukleinowych we krwi, moczu i płynach ustrojowych,
−
zastosować metody immobilizacji enzymów,
−
dokonać oceny materiału biologicznego na podstawie badań,
−
zinterpretować wyniki badań w formie opisowej i graficznej,
−
porównać wyniki badań z obowiązującymi normami i literaturą źródłową.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca:
…………………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawy badań biochemicznych 311[02].Z2
Jednostka modułowa:
Wykonywanie badań biochemicznych 311[02].Z2.01
Temat: Organizacja pracy laboratorium analitycznego. Zadania i obowiązki technika
analityka.
Cel ogólny: Zapoznanie się z zadaniami i obowiązkami technika analityka w pracy
w laboratorium
analitycznym.
Organizowanie
pracy
z
materiałem
biologicznym.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
ocenić specyfikę pracy w laboratorium,
−
scharakteryzować obowiązki i zadania w przyszłej pracy,
−
umiejętnie opisać sposób pobierania i przechowywania materiału biologicznego,
−
określić źródła ewentualnych błędów w pracy laboratoryjnej.
Metody nauczania–uczenia się:
−
pogadanka z elementami wykładu,
−
burza mózgów,
−
sesja posterowa.
Środki dydaktyczne:
−
foliogramy,
−
rzutnik pisma,
−
akty prawne i rozporządzenia dotyczące pracy w laboratorium,
−
plansze przygotowane i używane w czasie burzy mózgów,
−
postery przygotowane przez uczniów.
Formy organizacyjne pracy uczniów:
−
zajęcia grupowe – burza mózgów,
−
praca zespołowa – projekt realizacji pracy dotyczący organizacji pracy laboratorium
w formie posteru.
Czas: 4 godziny dydaktyczne.
Uczestnicy zajęć:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.
Przebieg zajęć:
1.
Faza wprowadzająca:
−
nauczyciel podaje temat lekcji i prosi uczniów o zapisanie tematu w zeszycie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
2.
Faza realizacyjna:
−
nauczyciel omawia cel zajęć,
−
nauczyciel w formie pogadanki z elementami wykładu przedstawia opis wzorców
pracy laboratoryjnej korzystając z aktów prawnych i rozporządzeń dotyczących pracy
w laboratorium a także z przygotowanych foliogramów,
−
nauczyciel inicjuje dyskusję na temat organizacji pracy laboratorium analitycznego
oraz zadań i obowiązków technika analityka w pracy laboratoryjnej – burza mózgów,
−
nauczyciel dzieli uczniów na kilka grup w zależności od liczebności klasy, każda
grupa otrzymuje za zadanie przygotowanie projektu organizacji pracy laboratorium
analitycznego – zajęcia w grupach, prosi o skorzystanie z przygotowanych wcześniej
materiałów,
−
nauczyciel prosi sprawozdawców z poszczególnych grup o prezentację wyników
pracy i zachęca do dyskusji na forum klasy.
3.
Faza podsumowująca
−
nauczyciel zachęca uczniów do dokonania selekcji przygotowanych materiałów
w celu wypracowania uniwersalnych zasad organizacji pracy laboratorium
analitycznego.
Zakończenie zajęć
−
ocena projektów pracy przez nauczyciela i wspólne omówienie z uczniami.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
karta ewaluacyjna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca:
…………………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawy badań biochemicznych 311[02].Z2
Jednostka modułowa:
Wykonywanie badań biochemicznych 311[02].Z2.01
Temat: Wpływ czynników fizycznych i chemicznych na aktywność wybranych enzymów.
Cel ogólny: Kształtowanie umiejętności oceny wpływu różnych czynników na aktywność
enzymów. Określanie znaczenia tych czynników. Określanie aktywności
wybranych enzymów.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
określić znaczenie enzymów w życiu organizmów żywych,
−
wymienić czynniki fizyczne i chemiczne mające wpływ na aktywność wybranych
enzymów,
−
scharakteryzować metody badań aktywności enzymów na przykładzie amylazy ślinowej,
−
umiejętnie interpretować wyniki doświadczeń.
Metody nauczania–uczenia się:
−
dyskusja w grupach,
−
ć
wiczenie praktyczne.
Środki dydaktyczne:
−
prezentacja multimedialna,
−
foliogramy,
−
karty pracy laboratoryjnej,
−
instrukcje do ćwiczeń,
−
odczynniki chemiczne,
−
1% roztwór kleiku skrobiowego,
−
0,02 mol/dm
3
roztwór jodu w jodku potasowym,
−
amylaza ślinowa,
−
bufor cytrynianowo - fosforanowy o pH = 6,6,
−
aparatura laboratoryjna.
Formy organizacyjne pracy uczniów:
−
dyskusja w zespole,
−
praca laboratoryjna w sekcjach kilkuosobowych.
Czas: 5 godzin dydaktycznych.
Uczestnicy zajęć:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.
Przebieg zajęć:
1.
Wprowadzenie.
2.
Omówienie celu zajęć.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
3.
Prezentacja multimedialna dotycząca klasyfikacji i znaczenia enzymów.
4.
Dyskusja grupowa na temat diagnostyki enzymologicznej.
5.
Wykonanie przez uczniów ćwiczeń praktycznych (ćwiczenie 1 punkt 5.2.1.).
Ć
wiczenie praktyczne
Temat: Oznaczanie wpływu temperatury na aktywność amylazy ślinowej.
Ć
wiczenie dotyczy określenia wpływu temperatury na amylazę ślinową występującą w jamie
ustnej produkowaną przez ślinianki. Enzym ten należy do endoamylaz, które wytwarzają
dekstryny. Powstanie achrodekstryn w reakcji z jodem jest informacją, że reakcja osiągnęła
oczekiwany efekt.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia:
1)
dokonać wstępnego oznaczenia stężenia amylazy w ślinie. W tym celu przepłukać usta
wodą i zebrać ślinę,
2)
rozcieńczyć ją czterokrotnie i przesączyć przez watę,
3)
przygotować cztery próbówki w celu określenia stężenia amylazy ślinowej,
4)
odmierzyć do nich kolejno: 2; 1; 0,5 i 0,2 cm
3
roztworu śliny a następnie dopełnić wodą
do 2 cm
3
,
5)
dodać do każdej z nich 2 cm
3
buforu o pH = 6,6,
6)
wstawić probówki do łaźni i ogrzewać w temperaturze 37°C przez 5 minut,
7)
dodać do każdej z nich 2 cm
3
kleiku ogrzanego do tej samej temperatury,
8)
ogrzewać probówki przez kolejne 5 minut na łaźni w tej samej temperaturze,
9)
dodać jodku potasu i obserwować zmianę zabarwienia na wskutek reakcji z jodkiem
potasu,
10)
wybrać tę probówkę, która zawiera jak najmniejszą ilość roztworu śliny powodującą
reakcję hydrolizy skrobi,
11)
oznaczyć czas potrzebny do zhydrolizowania skrobi do achrodekstryn w temp. 20°C,
40°C, 60°C i 80°C,
12)
przygotować statyw z probówkami w których znajduje się 1 cm
3
jodu w jodku potasu,
13)
równolegle przygotować mieszaniny 2 cm
3
kleiku i 2 cm
3
buforu o pH = 6,6,
14)
ogrzać przygotowaną mieszaninę kleiku i buforu na łaźni,
15)
dodać ogrzaną ślinę, w objętości wybranej w etapie wstępnym, do tak przygotowanej
mieszaniny i dopełnić wodą do 2 cm
3
,
16)
rozpocząć pomiar czasu i co minutę dodawać 0,2 cm
3
mieszaniny kleiku i buforu do
przygotowanych uprzednio probówek,
17)
przerwać inkubację w chwili utworzenia achrodekstryn, które nie barwią się z jodem,
notując czas jaki upłynął,
18)
sporządzić po wykonaniu prób we wszystkich temperaturach, wykres zależności
szybkości od temperatury,
19)
wskazać temperaturę optymalną dla amylazy ślinowej.
Wyposażenie stanowiska pracy:
−
probówki,
−
łaźnia wodna,
−
pipety o różnej pojemności,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
−
tryskawka,
−
odczynniki:
-
1% roztwór kleiku skrobiowego,
-
0,02 mol/dm
3
roztwór jodu w jodku potasowym,
-
amylaza ślinowa,
-
bufor cytrynianowo-fosforanowy o pH = 6,6 (zmieszać 14,55 cm
3
0,2 mol/dm
3
roztworu fosforanu dwusodowego z 5,45 cm
3
0,1 mol/dm
3
roztworu kwasu
cytrynowego).
6.
Interpretacja otrzymanych wyników.
Zakończenie zajęć
Podsumowanie poznanych zagadnień dotyczących enzymologii.
Praca domowa
Praca z literaturą w celu interpretacji otrzymanych wyników badań.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
karta ewaluacji,
−
sprawozdania z ćwiczenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5. ĆWICZENIA
5.1.
Komórka - podstawowy element morfologiczny
i czynnościowy organizmu
5.1.1. Ćwiczenia
Ćwiczenie 1
Oznacz zawartość chlorofilu w ekstraktach z liści roślin zielonych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ekstrakcję chlorofilu mającą na celu wyodrębnienie chlorofilu a oraz chlorofilu b
przeprowadza się z tkanek roślinnych za pomocą acetonu. Następnie w otrzymanym
ekstrakcie mierzymy absorbancję przy długościach fal: 645 nm, 652 nm i 663 nm. Przy
uwzględnieniu specyficznych współczynników absorpcji obliczmy zawartość chlorofilów.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
odważyć 1,0 g liści lub igieł i homogenizować je w moździerzu porcelanowym do
otrzymania zawiesiny rozmiażdżonej tkanki roślinnej z 50 cm
3
acetonu, który został
wstępnie ochłodzony do 0°C w lodowce,
2)
przesączyć tak otrzymany roztwór przez lejek Schotta G-2,
3)
przemyć osad małymi porcjami oziębionego acetonu do momentu, aż nie będzie
obserwowana zmiana barwy co oznacza, że chlorofil został wyekstrahowany,
4)
odmierzyć ilość otrzymanego ekstraktu i wprowadzać do niego wodę w celu otrzymania
roztworu o stężeniu 80%,
5)
przeprowadzić wszystkie czynności w pomieszczeniu zaciemnionym i w temperaturze
około 4°C,
6)
odczytać absorbancję otrzymanego ekstraktu przy długościach fal 645 nm, 652 nm
i 663 nm,
7)
zastosować 80% wodny roztwór acetonu jako odnośnik,
8)
obliczyć zawartości chlorofilów a i b oraz a + b z zastosowaniem następujących wzorów:
Zawartość chlorofilu a
C
a
= 12,7 A
663
– 2,7 A
645
Zawartość chlorofilu b
C
b
= 22,9 A
645
– 4,7 A
663
Zawartość chlorofilu a + b
C
a
+ C
b
= 20,2 A
645
+ 8,0 A
663
= A
652
9)
podać wyniki zawartości chlorofilów w [mg/dm
3
] roztworu.
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Ś
rodki dydaktyczne:
−
spekol,
−
zlewka,
−
cylinder miarowy,
−
statyw do sączenia,
−
moździerz porcelanowy,
−
kalkulator elektroniczny,
−
liście lub igły roślin zielonych,
−
odczynniki:
-
aceton cz.d.a.,
-
woda destylowana.
Ćwiczenie 2
Przeprowadź chromatograficzny rozdział barwników asymilacyjnych.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
rozetrzeć liście dowolnie zebranej rośliny w moździerzu porcelanowym dodając alkohol
etylowy w celu uzyskania półpłynnej konsystencji,
2)
dodać kilka kropel acetonu i po wymieszaniu przesączyć przez bibułę filtracyjną,
3)
chronić przed światłem otrzymany ekstrakt,
4)
wyciąć z bibuły filtracyjnej pasek o wymiarach 2 x 20 cm, na który za pomocą
mikropipety kroplami nanieść otrzymany wcześniej ekstrakt uzyskując plamkę o średnicy
około 0,5 cm,
5)
wysuszyć pasek bibuły po naniesieniu każdej kropli,
6)
przygotować mieszaninę rozpuszczalników organicznych składającą się z benzenu, eteru
i acetonu w proporcjach 10 : 2,5 : 2,
7)
umieścić pasek bibuły w komorze chromatograficznej i zanurzyć w roztworze
rozpuszczalników,
8)
wyjąć po 30 minutach chromatogram,
9)
wysuszyć suszarką,
10)
zaznaczyć czoło chromatogramu,
11)
opisać co jest fazą ruchomą a co stacjonarną,
12)
zidentyfikować chlorofil b, chlorofil a, ksantofile i karotenoidy,
13)
sformułować i zanotować wniosek.
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
moździerz porcelanowy,
−
szklana bagietka,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
−
liście dowolnej rośliny,
−
bibuła filtracyjna,
−
statyw do sączenia,
−
zlewka,
−
mikropipeta,
−
suszarka do włosów,
−
komora chromatograficzna,
−
odczynniki:
-
aceton,
-
alkohol etylowy 96%,
-
benzen,
-
eter.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.2.
Znaczenie enzymów i kwasów nukleinowych
5.2.1.
Ćwiczenia
Ćwiczenie 1
Oznacz wpływ temperatury na aktywność amylazy ślinowej.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie polega na określeniu wpływu temperatury na amylazę ślinową występującą
w jamie ustnej produkowaną przez ślinianki. Enzym ten należy do endoamylaz, które
wytwarzają dekstryny. Powstanie achrodekstryn w reakcji z jodem jest informacją, że reakcja
osiągnęła oczekiwany efekt.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
dokonać wstępnego oznaczenia stężenia amylazy w ślinie. W tym celu przepłukać usta
wodą i zebrać ślinę do probówki,
2)
rozcieńczyć ją czterokrotnie i przesączyć przez watę,
3)
przygotować cztery próbówki w celu określenia stężenia amylazy ślinowej,
4)
odmierzyć do nich kolejno: 2; 1; 0,5 i 0,2 cm
3
roztworu śliny a następnie dopełnić wodą
destylowaną do 2 cm
3
,
5)
dodać do każdej z nich 2 cm
3
buforu o pH = 6,6,
6)
wstawić probówki do łaźni i ogrzewać w temperaturze 37°C przez 5 minut,
7)
dodać do każdej z nich 2 cm
3
kleiku ogrzanego do tej samej temperatury,
8)
ogrzewać probówki przez kolejne 5 minut na łaźni w tej samej temperaturze,
9)
dodać 0,5 cm
3
jodku potasu i obserwować zmianę zabarwienia na wskutek reakcji
z jodkiem potasu,
10)
wybrać tę probówkę, która zawiera jak najmniejszą ilość roztworu śliny powodującą
reakcję hydrolizy skrobi,
11)
oznaczyć czasu potrzebny do zhydrolizowania skrobi do achrodekstryn w temp. 20°C,
40°C, 60°C i 80°C,
12)
przygotować statyw z probówkami w których znajduje się 1 cm
3
jodu w jodku potasu,
13)
równolegle przygotować mieszaniny 2 cm
3
kleiku i 2 cm
3
buforu o pH = 6,6,
14)
ogrzać przygotowaną mieszaninę kleiku i buforu na łaźni,
15)
dodać ogrzaną ślinę, w objętości wybranej w etapie wstępnym, do tak przygotowanej
mieszaniny i dopełnić wodą do 2 cm
3
,
16)
rozpocząć pomiar czasu i co minutę dodawać 0,2 cm
3
mieszaniny kleiku i buforu do
przygotowanych uprzednio probówek,
17)
przerwać inkubację w chwili utworzenia achrodekstryn, które nie barwią się z jodem,
notując czas jaki upłynął,
18)
sporządzić po wykonaniu prób we wszystkich temperaturach, wykres zależności
szybkości od temperatury,
19)
wskazać temperaturę optymalną dla amylazy ślinowej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
probówki,
−
zestaw do sączenia,
−
lejek,
−
zlewki,
−
łaźnia wodna,
−
pipety o różnej pojemności,
−
tryskawka,
−
odczynniki:
-
1% roztwór kleiku skrobiowego,
-
0,02 mol/dm
3
roztwór jodu w jodku potasu,
-
amylaza ślinowa,
-
bufor cytrynianowo - fosforanowy o pH = 6,6 (zmieszać 14,55 cm
3
0,2 mol/dm
3
roztworu fosforanu dwusodowego z 5,45 cm
3
0,1 mol/dm
3
roztworu kwasu
cytrynowego).
Ćwiczenie 2
Wykryj obecność enzymów z grupy oksydaz w ziemniaku.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Ć
wiczenie to ma na celu pokazanie obecności oksydaz zawartych w ziemniaku.
Substratem reakcji w których biorą udział oksydazy są związki fenolu, które utleniają się
tworząc barwne pochodne.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
sporządzić wyciąg ziemniaczany, umyć i obrać ziemniak a następnie utrzeć go na tarce,
2)
włożyć do woreczka płóciennego miazgę ziemniaczaną,
3)
zanurzyć w zlewce z około 200 cm
3
wody,
4)
wymieszać łagodnie zawartość zlewki, uzyskany w ten sposób wodny ekstrakt zawiera
enzymy i skrobię,
5)
odczekać, aż skrobia opadnie na dno,
6)
zdekantować supernatant i przesączyć,
7)
dodać kilka kropel toluenu do przesaczu,
8)
wlać do 2 probówek po 5 cm
3
wyciągu ziemniaczanego,
9)
dodać do pierwszej 10 kropli 1% roztworu fenolu, do drugiej 10 kropli 1% roztworu
pirokatechiny,
10)
wymieszać zawartość probówek,
11)
obserwować zmianę zabarwienia, zachodzi reakcja barwna analogiczna do ciemnienia
obranego ziemniaka lub do ciemnienia skórek uzyskanych z obranego jabłka.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
surowy ziemniak,
−
tarka do ziemniaków,
−
woreczek płócienny,
−
zlewka szklana,
−
lejek szklany,
−
sączki papierowe,
−
odczynniki:
-
cz.d.a. toluen,
-
1% roztwór wodny fenolu,
-
1% roztwór wodny pirokatechiny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
5.3.
Rola i znaczenie biologiczne węglowodanów, białek i lipidów
5.3.1.
Ćwiczenia
Ćwiczenie 1
Oznacz średnią masę cząsteczkową kwasów tłuszczowych w tłuszczach. Określ liczbę
zmydlania.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Liczba zmydlania jest to ilość mg wodorotlenku potasowego zobojętniająca kwasy
tłuszczowe powstające z rozkładu 1 g tłuszczu. Liczba ta zmienia się odwrotnie
proporcjonalnie do średniej masy cząsteczkowej kwasów tłuszczowych wchodzących w skład
danego tłuszczu. Hydrolizę tłuszczu przeprowadza się w środowisku zasadowym.
Odszczepione kwasy tłuszczowe zobojętniają dodaną zasadę. Nadmiar pozostałej, nie
związanej zasady określa się przez miareczkowanie HCl.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
przygotować dwie kolby stożkowe, do jednej wprowadzić 2 g tłuszczu – próba badana,
druga kolba stanowić będzie próbę ślepą,
2)
dodać do obu kolb po 20 cm
3
alkoholowego roztworu KOH o stężeniu 0,5 mol/dm
3
i zatkać korkiem,
3)
ogrzewać we wrzącej łaźni wodnej po uprzednim połączeniu z chłodnicą powietrzną,
4)
oziębić zawartość obu kolb stożkowych i przenieść ją ilościowo z użyciem wody
i etanolu do kolb miarowych o pojemności 100 cm
3
,
5)
pobrać z kolby miarowej 20 cm
3
roztworu i przenieść do zlewek,
6)
miareczkować roztworem HCl wobec fenoloftaleiny,
7)
obliczyć ilość mmoli KOH w 20 cm
3
alkoholowego roztworu, na podstawie ilości HCl
użytego do miareczkowania próby ślepej,
8)
obliczyć ilość mmoli KOH pozostającego po zhydrolizowaniu całej ilości tłuszczu,
9)
obliczyć ilość mmoli KOH zużytych do zobojętnienia kwasów tłuszczowych powstałych
z 2 g tłuszczu,
10)
obliczyć liczbę zmydlania, czyli ilość KOH zużytą do zobojętnienia 1 g tłuszczu,
11)
obliczyć ilość mg tłuszczu, która zostaje zobojętniona przez 3 mmole KOH, ilość ta
odpowiada 1 mmol oznaczonych triglicerydów, zakładając, że w reszcie kwasowej może
znajdować się tylko jedno wiązanie podwójne,
12)
obliczyć średnią masę kwasów tłuszczowych wchodzących w skład średniej masy
triglicerydów, uwzględniając masę glicerolu i wody,
13)
ocenić i podać na podstawie obliczeń wzór półstrukturalny badanego tłuszczu.
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Ś
rodki dydaktyczne:
–
kolby stożkowe 2 sztuki o pojemności 100 cm
3
,
–
łaźnia wodna,
–
chłodnica powietrzna 2 sztuki,
–
kolby miarowe o pojemności 100 cm
3
2 sztuki,
–
biureta szklana,
–
kalkulator elektroniczny,
–
odczynniki:
-
tłuszcz,
-
alkoholowy roztwór KOH o stężeniu 0,5 mol/dm
3
,
-
alkohol etylowy,
-
roztwór HCl o stężeniu 0,1 mol/ dm
3
,
-
0,1% alkoholowy roztwór fenoloftaleiny.
Ćwiczenie 2
Porównaj właściwości skrobi nierozłożonej i produktów jej hydrolizy.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
sporządzić 2% koloidalny kleik skrobiowy: zmieszać 0,2 g wysuszonej skrobi z 10 cm
3
zimnej wody,
2)
umieścić w zlewce około 75 cm
3
wody i zagotować,
3)
wlać do wrzącej wody przygotowaną zawiesinę skrobi, mieszać przez 1 minutę,
4)
dodać 4 cm
3
stężonego HCl do 25 cm
3
2% kleiku skrobiowego (roztwór A),
5)
podgrzać roztwór A do wrzenia i utrzymywać we wrzeniu 5 minut,
6)
ochłodzić roztwór i zobojętnić go dodając stopniowo NaOH, obserwując jednocześnie
zabarwienie papierka z fenoloftaleiną na różowo,
7)
dodać 5% roztwór CH
3
COOH tak długo aż papierek z fenoloftaleiną odbarwi się, w ten
sposób otrzymać zobojętniony hydrolizat skrobi (roztwór B),
8)
wykonać próbę redukcyjną stosując odczynnik Benedicta, używając równolegle roztwór
A i B, dodać po kilka kropli roztworu A i roztworu B do probówek zawierających
1,5 cm
3
odczynnika Benedicta, umieścić próbówki na 2 minuty we wrzącej łaźni wodnej,
roztwór może przyjmować zabarwienie od pomarańczowego do zielonego,
9)
wykonać próbę jodową używając roztwór Lugola, dodać 1 kroplę roztworu Jugola do
1 ml roztworu A i B, obecność skrobi powoduje zabarwienie roztworu na
ciemnoniebiesko,
10)
ocenić otrzymane wyniki i wyciągnąć wnioski dotyczące skrobi i produktów jej
hydrolizy.
Zalecane metody nauczania–uczenia się:
–
pokaz z objaśnieniem,
–
ć
wiczenie laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Ś
rodki dydaktyczne:
−
zlewka do przygotowywania kleiku skrobiowego,
−
papierek z fenoloftaleiną,
−
probówki,
−
cylinder miarowy,
−
pipety,
−
palnik gazowy lub grzejnik elektryczny,
−
trójnóg, siatka,
−
łaźnia wodna,
−
waga techniczna lub analityczna,
−
odczynniki:
-
2% kleik skrobiowy,
-
HCl stężony,
-
30% roztwór NaOH,
-
5% roztwór CH
3
COOH,
-
odczynnik Benedicta wykonać rozpuszczając 173 g bezwodnego cytrynianu
trisodowego i 90 g bezwodnego węglanu sodowego w 600 cm
3
gorącej wodzie,
następnie przesącz roztwór a do przesączu dodaj 100 cm
3
17,3% roztworu
CuSO
4
·5 H
2
O, uzupełnij wodą do 100 cm
3
,
-
roztwór Lugola sporządzić wykonując 0,05% roztwór jodu w 2% roztworze jodku
potasowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
5.4.
Znaczenie badań bioanalitycznych w biochemii
5.4.1.
Ćwiczenia
Ćwiczenie 1
Określ zadania i obowiązki związane z pracą technika analityka w laboratorium
klinicznym. Przedstaw je w formie posteru.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
określić na czym polega specyfika pracy w laboratorium klinicznym,
2)
ustalić harmonogram pracy w laboratorium ze szczególnym uwzględnieniem
poszczególnych stanowisk,
3)
określić strategiczne punkty w laboratorium ze szczególnym uwzględnieniem miejsca
poboru prób biologicznych, stanowisk diagnostycznych, miejsc w których znajdują się
pojemniki na materiał i odczynniki przeznaczone do utylizacji, punkty sanitarne a także
punkt wydawania wyników badań,
4)
określić optymalne metody badań uwzględniające zakres pracy laboratorium,
5)
dokonać dokładnego opisu zastosowanych metod, dbać aby metody te były ściśle
przestrzegane,
6)
umiejętnie dobrać sprzęt laboratoryjny niezbędny do wykonania każdej z wybranych
metod,
7)
określić zasady ergonomii w poszczególnych pracowniach laboratorium i zgodnie z nimi
zorganizować pracę w każdej pracowni,
8)
zaprojektować w laboratorium system kontroli wewnętrznej, ściśle związany z kontrolą
poszczególnych etapów wykonywanych analiz. Ma to szczególne znaczenie w pracy
analityka klinicysty, gdyż pomyłki na tym etapie diagnozowania mogą prowadzić do
zniekształcenia procesu leczenia pacjenta,
9)
dbać o prawidłową organizację pracy szczególne w punkcie pobierania materiału do
badań a także w punkcie wydawania wyników, zwrócić uwagę na kompetencję,
ż
yczliwość oraz organizację pracy prowadzącą do wykluczenia ewentualnych pomyłek na
etapie przyjmowania materiału i wydawania wyników,
10)
zaprojektować sposób przygotowania i magazynowania materiału biologicznego w tym
krwi, moczu i płynów ustrojowych w laboratorium z uwzględnieniem jego zakaźności,
11)
podsumować zadania i obowiązki technika analityka pracującego w laboratorium
analitycznym,
12)
zaprezentować projekt w formie posteru.
Zalecane metody nauczania–uczenia się:
–
prezentacja multimedialna,
–
pokaz z objaśnieniem,
–
metoda projektów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Ś
rodki dydaktyczne:
−
literatura źródłowa,
−
arkusze papieru pakowego,
−
kolorowe pisaki,
−
magnesy,
−
tablica do prezentacji.
Ćwiczenie 2
Scharakteryzuj i oceń źródła błędów w pracy laboratorium klinicznego.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wskazać źródła błędów w diagnostyce klinicznej,
2)
wybrać miejsca najczęściej popełnianych błędów w diagnostyce klinicznej,
3)
sklasyfikować błędy uwzględniając najbardziej możliwe miejsca gdzie są one popełniane,
pierwsza kategoria to błędy związane z pobieraniem i przechowywaniem materiału
biologicznego, druga kategoria to błędy popełniane w czasie procedur analitycznych,
4)
szczegółowo omówić i przedstawić w formie prezentacji źródła błędów kategorii
pierwszej,
5)
szczegółowo omówić i przedstawić w formie prezentacji źródła błędów kategorii drugiej,
6)
opracować projekt zapobiegania ewentualnym źródłom błędów.
Zalecane metody nauczania–uczenia się:
–
prezentacja multimedialna,
–
pokaz z objaśnieniem,
–
metoda projektów.
Ś
rodki dydaktyczne:
–
literatura,
–
tablica magnetyczna,
–
magnesy,
–
arkusze papieru,
–
pisaki.
Ćwiczenie 3
Zinterpretuj i opisz lub przedstaw w formie graficznej wyniki badań oznaczania glukozy
metodą oksydazową.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
dokonać analizy wyniku oznaczania glukozy metodą oksydazową u pacjenta laboratorium
przychodni, w metodzie oksydazowej, krew pobiera się z żyły łokciowej lub z opuszki
palca, odbiałcza a następnie wykonuje oznaczenie,
2)
zebrać informację na temat metody oksydazowej korzystając z literatury źródłowej,
3)
ocenić zgodność postępowania analitycznego oznaczania glukozy metodą oksydazową
z danymi literaturowymi,
4)
porównać otrzymany wynik z wartościami prawidłowymi dla zastosowanej metody,
wartości prawidłowe dla krwi: 3,33–5,27 mmol/l, dla osocza: 4,16–5,83 mmol/l,
otrzymany wynik 7,5 mmol/l,
5)
zinterpretować otrzymane wyniki i ocenić czy wynik nie wskazuje na wartości
patologiczne,
6)
przedstawić wnioski w formie opisowej lub graficznej.
Zalecane metody nauczania–uczenia się:
–
prezentacja multimedialna,
–
pokaz z objaśnieniem,
–
metoda projektów.
Ś
rodki dydaktyczne:
−
literatura źródłowa,
−
wynik badania glukozy,
−
wartości prawidłowe do użytej metody,
−
kalkulator elektroniczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test 1
Test dwustopniowy do jednostki modułowej „Wykonywanie badań
biochemicznych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 3, 4, 5, 6, 8, 9, 11, 12, 13, 14, 15, 17, 19, 20 są z poziomu podstawowego,
−
zadania 2, 7, 10, 16, 18 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za odpowiedź złą lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 9 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 5 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. d, 2. b, 3. b, 4. b, 5. b, 6. d, 7. d, 8. b, 9. c, 10. c, 11. d,
12. c, 13. b, 14. d, 15. c, 16. b, 17. d, 18. d, 19. b, 20. b
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Scharakteryzować kształty komórek
w organizmach żywych
B
P
d
2
Podać nazwę transporterów
komórkowych
A
PP
b
3
Wybrać prawidłową nazwę organelli
komórkowych
C
P
b
4
Sklasyfikować twory komórkowe do
właściwej grupy
C
P
b
5
Wybrać barwniki o charakterystycznej
budowie chemicznej
C
P
b
6
Wskazać plastydy zawierające chlorofil
A
P
d
7
Określić barwę barwników
fotosyntetycznych
C
PP
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
8
Sklasyfikować przynależność do
określonej klasy enzymów
C
P
b
9
Określić rodzaj substratu dla glikolizy
C
P
c
10 Wskazać niebiałkową cześć enzymu
A
PP
c
11
Przewidzieć wpływ czynników na
szybkość reakcji enzymatycznej
D
P
d
12
Rozróżnić rodzaje zasad azotowych
wchodzących w skład DNA
B
P
c
13
Wybrać rodzaj kwasu RNA tworzącego
kompleks a aminokwasami
C
P
b
14 Sklasyfikować zalety biosensorów
C
P
d
15 Rozróżnić rodzaj struktury białkowej
B
P
c
16
Rozróżnić aminokwasy dostarczane
wraz z dietą
B
PP
b
17
Określić czynniki powodujące
denaturację
C
P
d
18
Sklasyfikować glukozę ze względu na
właściwości chemiczne
C
PP
d
19
Wybrać rodzaj cukru zapasowego
w organizmach zwierzęcych
A
P
b
20 Podać składniki fosfolipidów
A
P
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj materiały testowe dla ucznia.
3.
Dopilnuj aby uczniowie pracowali samodzielnie.
4.
Przed rozpoczęciem testu zapoznaj uczniów z instrukcją dla ucznia i upewnij się, że jest
dla wszystkich zrozumiała.
5.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Na rozwiązanie testu masz 45 minut.
4.
Zapoznaj się z zestawem zadań testowych.
5.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi stawiając znak x.
6.
W przypadku pomyłki odpowiedź błędną zaznacz kółkiem i wybierz odpowiedź
poprawną.
7.
Test zawiera 20 zadań w tym 15 z poziomu podstawowego i 5 z poziomu ponadpodstawowego.
8.
Masz do wyboru cztery odpowiedzi, w tym jedna jest prawidłowa.
9.
Pamiętaj, że twoja odpowiedź powinna być samodzielna.
10.
Do zadań, które sprawiają ci szczególną trudność wróć później.
Powodzenia
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1. Komórki w organizmach żywych mogą przyjmować kształty
a)
tylko kuliste, owalne i wieloboczne.
b)
tylko wieloboczne, wrzecionowate i gwiaździste.
c)
tylko kuliste, wieloboczne i gwiaździste.
d)
kuliste, owalne, wieloboczne, wrzecionowate, gwiaździste.
2.
Specjalne transportery przenoszące przez błonę komórkową substancje odżywcze to
a)
mezosomy.
b)
permeazy.
c)
tylakoidy.
d)
fagosomy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
3.
Siatkę śródplazmatyczną szorstką nazywamy
a)
hialoplazmą.
b)
ergastoplazmą.
c)
karioplazmą.
d)
cytoplazmą.
4.
Tonofibryle, miofibryle i neurofibryle zaliczane są do
a)
tworów paraplazmatycznych.
b)
tworów metaplazmatycznych.
c)
tworów euplazmatycznych.
d)
tworów deutoplazmatycznych.
5.
Wybierz grupę barwników zawierających pierścień pirolowy
a)
lipofuscyny i melanina.
b)
hemosyderyna i bilirubina.
c)
melanina i fuscyna.
d)
rodopsyna i melanina.
6.
Plastydy zawierające chromatofor zwany chlorofilem nazywamy
a)
feoplastami.
b)
chromoplastami.
c)
rodoplastami.
d)
chloroplastami.
7.
Chlorofil jest barwnikiem barwy zielonej. Natomiast jego odmiana nazywana
„chlorofilem a” ma barwę
a)
ż
ółtozieloną.
b)
czerwoną.
c)
niebieską.
d)
niebieskozieloną.
8.
Enzymy katalizujące reakcje oksydoredukcyjne zaliczane są do klasy
a)
transferaz.
b)
oksydoreduktaz.
c)
hydrolaz.
d)
ligaz.
9.
Glikoliza jest ważnym szlakiem metabolicznym, w którym substratem jest
a)
glikogen.
b)
skrobia.
c)
glukoza.
d)
fruktoza.
10.
Część niebiałkową enzymu nazywamy
a)
holoenzymem.
b)
apoenzymem.
c)
koenzymem.
d)
enzymem właściwym.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
11.
Szybkość reakcji enzymatycznej zależy bezpośrednio od
a)
tylko stężenia substratu.
b)
tylko temperatury.
c)
tylko pH.
d)
stężenia substratu, temperatury, pH.
12.
W skład kwasu DNA wchodzą
a)
adenina i uracyl.
b)
guanina i uracyl.
c)
adenina i cytozyna.
d)
tymina i uracyl.
13.
Kompleks aminoacylo-tRNA wraz a aminokwasami tworzy
a)
mRNA.
b)
tRNA.
c)
rRNA.
d)
RNA.
14.
Znaczącą zaletą biosensorów jest
a)
tylko duża szybkość pomiaru.
b)
tylko możliwość wykorzystania w biomonitoringu.
c)
tylko selektywność.
d)
duża szybkość pomiaru, możliwość wykorzystania w biomonitoringu, selektywność.
15.
Połączenie dwóch aminokwasów za pomocą wiązania peptydowego nazywamy
a)
oligopeptydem.
b)
białkiem.
c)
dipeptydem.
d)
polipeptydem.
16.
Do grupy aminokwasów egzogennych dostarczanych wraz z dietą zaliczamy
a)
argininę i glutaminę.
b)
lizynę i metioninę.
c)
glicynę i tyrozynę.
d)
kwas asparaginowy i kwas glutaminowy.
17.
Denaturacja, czyli niszczenie struktury III i IV rzędowej białek zachodzi pod wpływem
a)
tylko promieniowania jonizującego.
b)
tylko wysokiej temperatury.
c)
tylko stężonych kwasów.
d)
promieniowania jonizującego, wysokiej temperatury, stężonych kwasów.
18.
Glukoza jest
a)
ketotetrozą.
b)
ketoheksozą.
c)
aldopentozą.
d)
aldoheksozą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
19.
W organizmach zwierzęcych cukrem zapasowym jest
a)
skrobia.
b)
glikogen.
c)
celuloza.
d)
sacharoza.
20.
Synteza fosfolipidów odbywa się przy współudziale
a)
glicerolu i kwasu siarkowego.
b)
glicerolu i kwasu fosforowego.
c)
glikolu i kwasu siarkowego.
d)
glikolu i kwasu fosforowego.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie badań biochemicznych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Test 2
Test dwustopniowy do jednostki modułowej „Wykonywanie badań
biochemicznych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, 4, 5, 8, 9, 11, 12, 13, 14, 15, 18, 19, 20 są z poziomu podstawowego,
−
zadania 6, 7, 10, 16, 17 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za odpowiedź złą lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 9 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 5 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. c, 2. c, 3. b, 4. b, 5. b, 6. b, 7. a, 8. d, 9. c, 10. b, 11. b,
12. c, 13. b, 14. c, 15. d, 16. c, 17. b, 18. d, 19. b, 20. d
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Określić charakter chemiczny
aminokwasów
C
P
c
2
Rozróżnić w jakiej strukturze
przestrzennej białka występują
kłębuszki
B
P
c
3
Wyjaśnić budowę sacharozy
B
P
b
4
Sklasyfikować glikogen do
odpowiedniej grupy węglowodanów
C
P
b
5
Określić rodzaj wiązań występujący
w cukrach
C
P
b
6
Przewidzieć skutek wystąpienia wiązań
podwójnych w lipidach
D
PP
b
7
Sklasyfikować lecytyny do
odpowiedniej grupy związków
C
PP
a
8
Podać przykłady związków
przeciwkrzepliwych
A
P
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
9
Nazwać twór zastępujący jądro
u prokariontów
A
P
c
10
Nazwać barwniki starzenia
w komórkach
A
PP
b
11
Podać nazwę tworów jądrowych
komórki
A
P
b
12
Określić gdzie występuje RNA i DNA
w komórce
C
P
c
13 Nazwać procesy rozpadu w komórce
A
P
b
14
Określić cechę charakterystyczna
komórki roślinnej
C
P
c
15
Wybrać czynniki ograniczające proces
fotosyntezy
C
P
d
16
Określić przynależność enzymów do
odpowiedniej klasy
C
PP
c
17
Określić podobieństwo biochemiczne
koenzymów
C
PP
b
18
Wybrać czynniki mające wpływ na
szybkość reakcji
B
P
d
19
Rozróżnić zjawisko, któremu ulegają
enzymy w podwyższonej temperaturze
B
P
b
20 Określić kształt cząsteczki DNA
C
P
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj materiały testowe dla ucznia.
3.
Dopilnuj aby uczniowie pracowali samodzielnie.
4.
Przed rozpoczęciem testu zapoznaj uczniów z instrukcją dla ucznia i upewnij się, że jest
dla wszystkich zrozumiała.
5.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Na rozwiązanie testu masz 45 minut
4.
Zapoznaj się z zestawem zadań testowych.
5.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi stawiając znak x.
6.
W przypadku pomyłki odpowiedź błędną zaznacz kółkiem i wybierz odpowiedź
poprawną.
7.
Test zawiera 20 zadań w tym 15 z poziomu podstawowego i 5 z poziomu ponadpodstawowego.
8.
Masz do wyboru cztery odpowiedzi, w tym jedną jest prawidłowa.
9.
Pamiętaj, że Twoja odpowiedź powinna być samodzielna.
10.
Do zadań, które sprawiają Ci szczególną trudność wróć później.
Powodzenia
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Aminokwasy występują w organizmach żywych pod postacią jonów obojnaczych.
Wskazuje to na ich
a)
charakter kwasowy.
b)
charakter zasadowy.
c)
charakter amfoteryczny.
d)
charakter obojętny.
2.
Charakterystyczna konfiguracja przestrzenna w postaci kłębuszków występuję w
a)
strukturze pierwszorzędowej białka.
b)
strukturze drugorzędowej białka.
c)
strukturze trzeciorzędowej białka.
d)
strukturze czwartorzędowej białka.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
3.
Sacharoza to dwucukier składający się z
a)
glukozy i glukozy.
b)
glukozy i fruktozy.
c)
glukozy i mannozy.
d)
glukozy i rybozy.
4.
Glikogen będący materiałem zapasowym występującym w organizmach zwierzęcych
należy do
a)
oligosacharydów.
b)
polisacharydów.
c)
cukrów prostych.
d)
monosacharydów.
5.
Wiązania wytwarzające się pomiędzy dwoma cząsteczkami monosacharydów nazywamy
a)
wiązaniem peptydowym.
b)
wiązaniem glikozydowym.
c)
wiązaniem wielokrotnym.
d)
wiązaniem wodorowym.
6.
Występowanie wiązań podwójnych w cząsteczkach nienasyconych kwasów tłuszczowych
powoduje
a)
podwyższenie temperatury topnienia.
b)
spadek temperatury topnienia.
c)
podwyższenie temperatury wrzenia.
d)
spadek temperatury wrzenia.
7.
Lecytyny biorące udział w wybiórczym transporcie przez błony należą do
a)
fosfolipidów.
b)
sterydów.
c)
sfingolipidów.
d)
glikolipidów.
8.
Przed badaniami klinicznymi krew traktowana jest czynnikiem przeciwkrzepliwym.
Przykładem takiego związku jest
a)
tylko heparyna.
b)
tylko cytrynian sodu.
c)
tylko szczawian potasu.
d)
heparyna, cytrynian sodu, szczawian potasu.
9.
U organizmów prokariotycznych rolę jądra pełni
a)
rybosom.
b)
mezonom.
c)
genofor.
d)
centrosom.
10.
W starzejących się komórkach pojawiają się barwniki charakterystyczne. Przykładem są
a)
melanina.
b)
lipofuscyny.
c)
rodopsyna.
d)
bilirubina.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
11.
Obszar jądra, w którym znajduje się chromatyna i jąderko nazywamy
a)
hialoplazmą.
b)
karioplazmą.
c)
protoplazmą.
d)
cytoplazmą.
12.
Kwasy nukleinowe: DNA i RNA występują w komórce na terenie
a)
lizosomów i mitochondrium.
b)
jądra i cytoplazmy.
c)
jądra i mitochondrium.
d)
aparatu Golgiego i lizosomów.
13.
Procesy energetyczne w komórce prowadzące do wytworzenia energii nazywamy
a)
anabolizmem.
b)
katabolizmem.
c)
metabolizmem.
d)
fosforylacją oksydacyjną.
14.
Cechą charakterystyczną komórki roślinnej jest brak
a)
plastydów.
b)
mitochondrium.
c)
lizosomów.
d)
aparatu Golgiego.
15.
Do czynników ograniczających proces fotosyntezy zaliczyć można
a)
tylko światło słoneczne.
b)
tylko dwutlenek węgla.
c)
tylko temperaturę.
d)
ś
wiatło słoneczne, dwutlenek węgla, temperaturę.
16.
Do enzymów z klasy liaz zaliczamy
a)
oksydazy i oksydenazy.
b)
karboksylazy i syntetazy.
c)
deaminazy i dekarboksylazy.
d)
dehydrogenazy i esterazy.
17.
Koenzymy wykazują niezwykle często podobieństwo do
a)
hormonów.
b)
witamin.
c)
węglowodanów.
d)
lipidów.
18.
Do czynników mogących mieć wpływ na szybkość reakcji, która jest katalizowana przez
określony enzym zaliczamy
a)
tylko wzajemne zbliżanie się substratów do siebie.
b)
tylko deformowanie się cząsteczek substratów.
c)
tylko oddziaływanie grup funkcyjnych.
d)
wzajemne zbliżanie się substratów do siebie, deformowanie się cząsteczek
substratów, oddziaływanie grup funkcyjnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
19.
Wpływ temperatury 50°C na większość enzymów polega na
a)
aktywacji.
b)
dezaktywacji.
c)
temperatura nie ma wpływu.
d)
jest to temperatura optymalna.
20.
Cząsteczka kwasu DNA przyjmuje kształt
a)
pojedynczej nici.
b)
podwójnej nici.
c)
pojedynczej nici skręconej w spiralę.
d)
podwójnej nici skręconej w spiralę.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie badań biochemicznych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
7.
LITERATURA
1.
Kączkowski J.: Podstawy biochemii. WNT, Warszawa 1999
2.
Angielski S.: Biochemia kliniczna i analityka. PZWL, Warszawa 1990
3.
Kłyszejko-Stefanowicz L.: Ćwiczenia z biochemii. PWN, Warszawa-Poznań 1982
4.
Ostrowski W., Gumińska M., Krawczyk A.: Ćwiczenia z chemii ogólnej i fizjologicznej.
PZWL, Warszawa 1986
5.
Holak E., Lewiński W.: Biologia cz. 2. Podręcznik dla liceum ogólnokształcącego.
Operon, Gdynia 2005
6.
Karlson P.: Zarys biochemii część I i II. PWN, Warszawa 1987
7.
Witwicki J., Ardelt W.: Elementy enzymologii. PWN, Warszawa 1989
8.
Stryer L.: Biochemia. PWN, Warszawa 1986
9.
Trojanowski J.: Biochemia dla biologów. PWN, Warszawa 1978
10.
Holak E., Hoppe L., Lewiński W., Lipka I., Ruda-Groborz B.: Biologia. Vademecum
maturalne. Operon, Gdynia 2006
11.
http://portalwiedzy.onet.pl/80412
12.
http://biosensor.webpark.pl
13.
http://biotechnolog.pl
Literatura metodyczna:
1.
Jeruszka U., Niemierko B.: Zastosowania pomiaru sprawdzającego w kształceniu
zawodowym. MEN, Warszawa 1994
2.
Niemierko B.: Pomiar wyników kształcenia zawodowego. Biuro Koordynacji Kształcenia
Kadr , Fundusz Współpracy, Warszawa 1997
Wyszukiwarka
Podobne podstrony:
05 Wykonywanie badan biochemicz Nieznany (2)
05 Wykonywanie badań biochemicznych
05 Wykonywanie podstawowych operacji ślusarskich
05 Wykonywanie, odczytywanie i Nieznany
05 Wykonywanie zabiegow agrotec Nieznany (2)
05 Wykonywanie ręczne dzianin
Biochemia - exam stoma - 30.05.2007, Prywatne, biochemia, biochemia 1, biochemia
311[10] Z2 05 Wykonywanie pomia Nieznany (2)
06 Wykonywanie badan mikrobiolo Nieznany
05 Wykonywanie podstawowych robót malarskich
06 Wykonywanie badań mikrobiologicznych
05 Wykonywanie połączeń rozłącznych i nierozłącznych
04 Wykonywanie badan i pomiarow Nieznany (2)
05 Wykonywanie operacji obrobki Nieznany
05 Wykonywanie czynności przygotowawczych związanych z produkcją
05 Wykonywanie podstawowych operacji
więcej podobnych podstron