
1
Ćwiczenie 3
Przedmiot: Biotechnologia żywności (2012),
Studia stacjonarne I stopnia
Temat: Oznaczanie aktywności pektynoesterazy oraz amylolitycznej w preparatach
o przemysłowym zastosowaniu.
Pektynazy są enzymami powszechnie występującymi w tkankach roślin wyższych.
Mogą być również syntezowanie przez grzyby należące do rodzaju Aspergillus, Penicilium,
Botritis i Fusarium, a także przez bakterie z rodzaju Bacillus, Clostridium i Erwinia oraz
drożdże z rodzaju Saccharomyces. O efektywności ich akcji katalitycznej wobec
niejednorodnego substratu, jakim są substancje pektynowe decyduje współpraca co najmniej
czterech pektynaz należących do dwóch różnych klas: pektynoesterazy (pektohydrolaza
pektyn, E.C. 3.1.1.11) i poligalakturonazy (poli 1,4-
-D-galakturonian glukanohydrolaza)
będących hydrolazami oraz liazy pektynianowej (transeliminaza pektynianowa, E.C. 4.2.2.10)
i liazy kwasu pektynowego (transeliminaza kwasu pektynowego, E.C. 4.2.2.2.) należących do
klasy liaz. Według niektórych autorów do enzymów pektynolitycznych należy zaliczyć
również arabanazy, głównie
-L-arabinofuranozydazę (E.C. 3.2.1.55). Ich udział jest bowiem
konieczny do hydrolizy krótkich łańcuchów bocznych pektyny składających się z arabanów,
arabanogalaktanów, ramnogalaktanów i mannanów. Mechanizm działania pektynaz polega na
degradacji łańcucha pektynowego do fragmentów o mniejszych rozmiarach, kwasu
galakturonowego i alkoholu metylowego. Długie, liniowe łańcuchy pektyny zbudowane
z jednostek kwasu D-galakturonowego o różnym stopniu metylacji połączonych wiązaniami
-1,4-glikozydowymi są atakowane przez enzymy depolimeryzujące: liazę pektynianową
i liazę kwasu pektynowego. Pierwsza rozszczepia wiązanie glikozydowe tylko w sąsiedztwie
estryfikowanych metanolem grup karboksylowych, druga wykazuje specyficzność
w stosunku do wiązań glikozydowych w pobliżu wolnych grup karboksylowych. W obu
przypadkach katalizowany proces nosi nazwę
-eliminacji i polega na transeliminowaniu
jednego protonu połączonego z węglem piątym na tlen wiązania glikozydowego
z utworzeniem podwójnego wiązania między atomami węgli 4 i 5 kwasu galakturonowego na
nowo powstałym nieredukującym końcu łańcucha. Jednocześnie pektynoesteraza katalizując
hydrolizę wiązań estrowych występujących między grupami metylowymi i karboksylowymi
reszt kwasu galakturonowego pektyny powoduje jej demetylację umożliwiając tym samym
działanie enzymom endopoligalakturonazie (E.C. 3.2.1.15) i egzopoligalakturonazie
(E.C.3.2.1.67). Enzymy te, ze względu na rozmiary swoich cząsteczek są hamowane przez
2
grupy metylowe i mogą działać dopiero od momentu zredukowania stopnia metylacji pektyny
poniżej 60%. Endopoligalakturonazy w sposób przypadkowy hydrolizują łańcuch pektyny od
wewnątrz, zaś egzopoligalakturonazy rozrywają wiązania od końca łańcucha. Produktem
końcowym działania poligalakturonaz są cząsteczki kwasu
-D-galakturonowego.
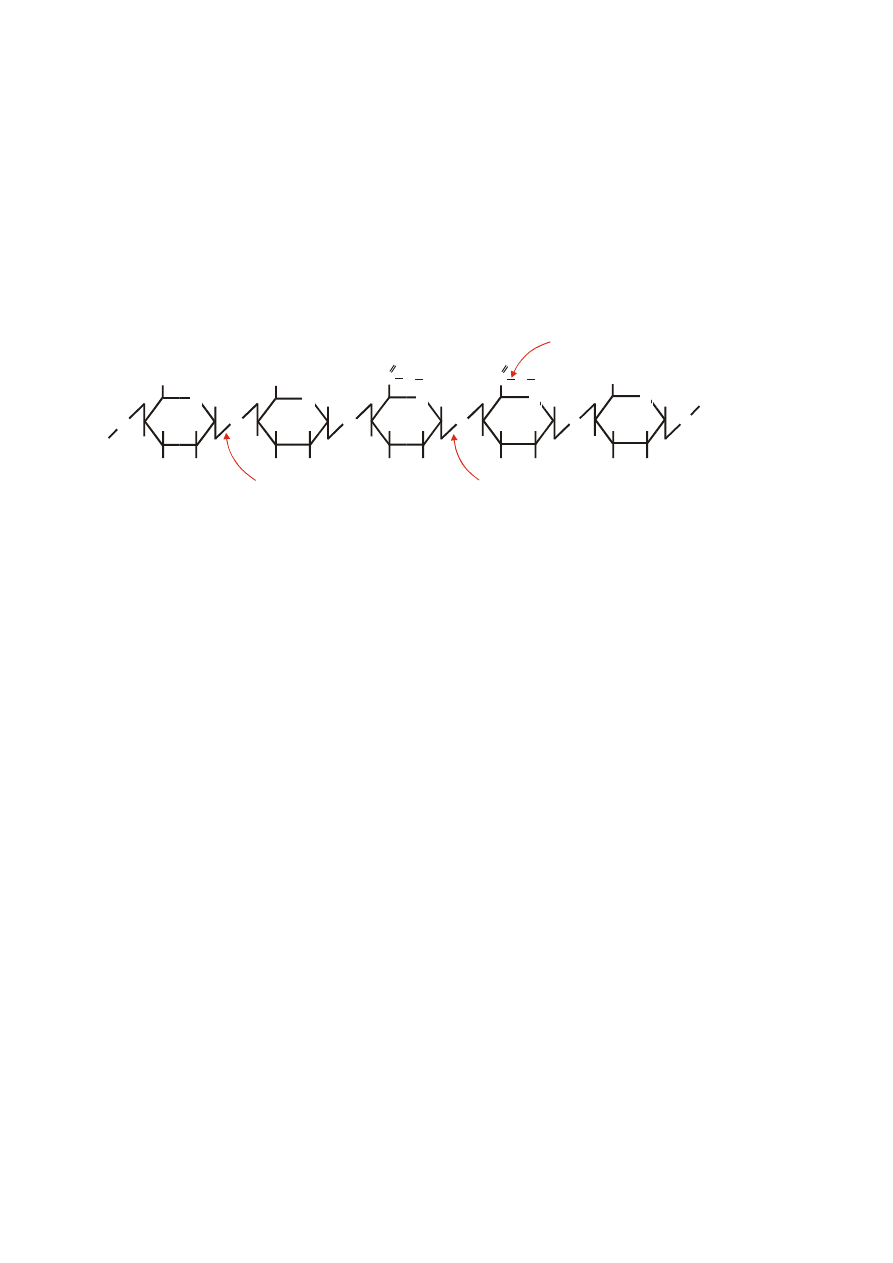
Specyficzność akcji katalitycznej poszczególnych enzymów pektynolitycznych wobec
łańcucha pektyny przedstawiono na rysunku.
O
O
O
O
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
O
COOH
COOH
COOH
O
pektynoesteraza
poligalakturonaza i
liaza poli- -1,4-galakturonianu
liaza poli- 1,4-metylogalakturonianu
-
O
C
CH
3
O
O
C
CH
3
O
O
O
O
O
O
Preparaty pektynolityczne znalazły zastosowanie w przemyśle winiarskim
i owocowo-warzywnym. Wykorzystuje się je do maceracji miazgi owocowo-warzywnej, do
obniżania lepkości soków i ich klarowania. Stosowane są również w procesie fermentacji
tytoniu i herbaty oraz podczas oczyszczania ziaren kawy i kakao. W przemyśle
kosmetycznym służą do ekstrakcji olejków eterycznych, zaś w farmaceutycznym do
otrzymywania witaminy C.
W Polsce produkcja preparatów pektynolitycznych została uruchomiona na skalę
przemysłową w 1963 roku w ZPOW–Jasło. Obecnie dostępne są 4 rodzaje preparatów
pektynolitycznych produkowanych tym zakładzie: Pektopol PT 400 (preparat płynny
termostabilny o ogólnej aktywności pektynolitycznej co najmniej 400 000
o
PM, uboczne
aktywności proteazowa i fitazowa), Pektopol PS 150 (preparat płynny), Pektopol PM 200
(preparat płynny) oraz Pektopol PA (preparat płynny o podwyższonej aktywności
amylolitycznej do klarowania soków jabłkowych preparatów podwyższonej zawartości
skrobi). Większość preparatów pektynolitycznych, oprócz deklarowanych przez producentów
aktywności odpowiedzialnych za depolimeryzację substancji pektynowych, zawiera
domieszki innych enzymów, najczęściej celulaz, amylaz, arabanaz i proteaz. Podnosi to ich
skuteczność w procesie obróbki tkanki roślinnej i stwarza szansę szerszego zastosowania.
Preparaty pektynowe otrzymuje się głównie z odpadów surowców roślinnych
bogatych w protopektyny, jak np. wytłoki jabłkowe, albedo owoców cytrusowych, wytłoki

3
buraczane, łuski słonecznika itp. Przez ogrzewanie i ekstrakcję tych surowców w środowisku
kwaśnym powoduje się przechodzenie rozpuszczalnych pektyn z protopektyn do roztworu.
Podczas ekstrakcji dąży się do osiągnięcia jak najmniejszej depolimeryzacji łańcucha kwasu
pektynowego, gdyż im większa jest masa cząsteczkowa otrzymanych pektyn, tym lepszą
wykazują one zdolność żelowania. Inna cenna właściwość pektyn, a mianowicie szybkość
żelowania, jest uzależniona od stopnia estryfikacji grup karboksylowych metanolem, czyli od
procentowej zawartości grup metoksylowych. Ze względu na zawartość tych grup, pektyny
podzielono na wysokometylowane o stopniu estryfikacji wyższym od 50% wszystkich grup
karboksylowych i na niskometylowane o estryfikacji poniżej 50%.
Proces żelowania pektyn wysokometylowanych przebiega winny sposób
niskometylowanych. Uważa się, że mechanizm przemian zoli w żele u pektyn
wysokometylowanych jest oparty w głównej mierze na pobocznych wiązaniach wodorowych.
Pektyny te są zdolne do tworzenia żeli w środowisku bogatym w cukry i kwaśnym.
Optymalne galaretowacenie przy użyciu tych pektyn następuje przy zawartości cukru ok.
65%, pH ok. 3 i stężeniu pektyn 0,3-1,0 %.
Szybkość żelowania pektyn wysokometylowanych jest na ogół tym większa, im
wyższa jest w nich zawartość grup metoksylowych, np. pektyny o stopniu zestryfikowania
powyżej 72% odznaczają się krótkim czasem żelowania (poniżej 3 minut) , a zestryfikowane
w 60-65% żelują wolno (powyżej 20 minut). Stwierdzono jednak, że ze stopniem estryfikacji
wyższym od 80-82% nie zawsze wiąże się skrócenie czasu żelowania. Również obniżenie
estryfikacji poniżej 65% niekoniecznie wpływa na przedłużenie czasu żelowania. Jest to
związane z obecnością soli buforowych w układzie żelującym.
Pektyny niskometylowane są zdolne do tworzenia żeli niskocukrowych lub
bezcukrowych w obecności jonów wapnia. Mechanizm tworzenia żelu przez te pektyny ma
polegać na wytworzeniu siatki przestrzennej z ujemnie naładowanych reszt
poligalakturonidów, połączonych jonami metali wielowartościowych. Ostatnio stwierdzono,
ze im większa jest liczba wolnych grup karboksylowych w pektynach niskometylowanych,
tym mniejsza dawka wapnia jest konieczna do optymalnego żelowania. Stąd sugeruje się, że
w siatce przestrzennej żelu występują nie wiązania jonowe, ale chelatowe wapnia.
Jak dotąd większe zastosowanie w przemyśle spożywczym mają pektyny
wysokometylowane niż niskometylowane. Spowodowane to jest dużą wrażliwością pektyn
niskometylowanych na stężenie jonów wapnia oraz gorszymi cechami reologicznymi żeli,
spowodowanymi głównie mniejszą masą cząsteczkową tych pektyn. Pektyny
niskometylowane otrzymuje się z pektyn wysokometylowanych, gdyż tylko te ostatnie
występują w surowcach roślinnych. W procesie deestryfikacji pektyn wysokometylowanych,

4
prowadzonym metodą chemiczną (przy działaniu kwasem lub ługiem) lub enzymatyczną
(użycie metyloesterazy pektynowej) występują również niepożądane zjawiska
depolimeryzacji.
W krajach anglosaskich produkuje się na szeroką skalę galaretki pomarańczowo-
cytrynowe z zawieszonymi w nich drobno pokrajanymi skórkami pomarańczy. Produkt ten
popularnie nazywa się dżemem pomarańczowym.
1. Oznaczanie aktywności pektynoesterazy
Zasada metody: Pektynoesteraza katalizuje hydrolizę wiązania estrowego pomiędzy grupami
karboksylowymi kwasu poligalakturonowego i metanolem. Oznaczenie aktywności enzymu
opiera się na uwalnianiu grup karboksylowych przy stałym pH 7,2-7,3, optymalnym dla
działania enzymu. Nie można przekroczyć pH 7,3, ponieważ następuje w tych warunkach
samorzutny rozpad estrów.
Wykonanie
1. Przygotowanie wyciągu z owoców :
10 g rozdrobnionych owoców (pomidory, pomarańcze, bakłażan) zalać w zlewce 20 ml 12 %
NaCl (w 0,1 M octanie sodu), rozetrzeć dokładnie w moździerzu, pozostawić na 15 minut,
odcisnąć przez gazę, następnie przesączyć przez sączek z bibuły miękkiej (lub - w przypadku
pomarańczy – odwirować*). Przed analizą uregulować pH ekstraktu na 7,2.
*wyciąg rozpipetować po 0,5ml do probówek typu eppendorf i odwirować przez 5 min.
2. Wykonanie pomiarów aktywności enzymatycznej:
Do zlewki z mieszadłem odmierzyć 50 ml roztworu pektyny [0,5% roztwór (w/v) pektyny w
0,1M NaCl], poczekać na wyrównanie się temperatury. Bezpośrednio przed oznaczeniem
uregulować pH roztworu pektyny do 7,1-7,2, przy pomocy 0,lM NaOH.
Następnie do roztworu pektyny dodać 0,5 ml (wyciąg z pomidora) lub 1 ml (bakłażan,
pomarańcze) roztworu enzymu (o uregulowanym pH!) i natychmiast mieszaninę
miareczkować 0,01N NaOH, tak aby pH utrzymywało się w granicach 7,2. Co l minutę
(przez około 20 minut) zapisywać ilość zużytego NaOH.
Odrzucić wartości skrajne i wyliczyć średnie zużycie ml NaOH na minutę.
Obliczenia:
Obliczyć aktywności pektynoesterazy dla poszczególnych ekstraktów z owoców / warzyw.
5
Jednostkę aktywności pektynoesterazy (PE) zdefiniowano jako ilość μM metanolu
uwolnionych przez enzym w czasie 1 minuty. Ilość moli zużytego NaOH jest wprost
proporcjonalna do ilości uwolnionego metanolu.
Obliczyć aktywności przypadające na 1 gram suchej masy badanego materiału. Do obliczeń
przyjąć sucha masę próbek: pomarańcze – 29%, bakłażan 7,2 %, pomidor 6,4%.
Opracowanie wyników:
Dane zestawić na wykresie słupkowym, wyrażając aktywność PE / gram suchej masy. Porównać
i skomentować uzyskane wyniki.
2. Oznaczanie aktywności amylaz metodą z kwasem dwunitrosalicylowym
(DNS)
Zasada oznaczania aktywności amylaz metodą z kwasem 3,5-dwunitrosalicynowym polega na
utlenieniu grup redukujących w produktach uwolnionych w wyniku enzymatycznej degradacji
skrobi i spektrofotometrycznym oznaczeniu powstającego kompleksu przy długości fali 550 nm.
COOH
OH
NO
2
O N
2
+
C-H
O
R
4
COOH
OH
NH
H N
2
2
+
4 C-OH
O
R
kwas 3,5 dwunitrosalicylowy
kwas 3,5 dwuaminosalicylowy
żółtopomarańczowy czerwonobrunatny
Odczynniki:
Substrat: 2% roztwór skrobi o pH 4,5 (90 ml roztworu skrobi + 10 ml 1M buforu
octanowego o pH 4,5)
Roztwór kwasu dwunitrosalicylowego (DNS):
przygotowano wg. przepisu: 30 g winianu sodowo-
potasowego rozpuścić na gorąco w jak najmniejszej ilości wody, do ciepłego winianu wlać wodną
zawiesinę 1g DNS (rozcierając grudki i popłukując zlewkę) dodać 20 ml 2 n NaOH (na ciepło nie powinno
być osadu). Ostudzić roztwór i uzupełnić do objętości 100 ml. Jeśli po ostudzeniu wytrąci się osad należy
zdekantować płyn. Przechowywać w temperaturze pokojowej.
Preparaty enzymatyczne: Wybrać z listy dostępnych preparatów: Rapidase Liq+, Rapidase
Pomaliq 2F, Ultrazym AFP-L, Econase CE., Rapidase Pomalique, Pektopol PT 200 dwa
enzymy i przygotować rozcieńczenia 1:50, 1:200, 1: 500.
Dla pierwszego rozcieńczenia pobrać 0,5 ml wyjściowego preparatu i dopełnić do 5 ml wodą
destylowaną. Rozcieńczenia wykonać w systemie 2-3 etapowym w probówkach, za każdym
razem dokładnie mieszając (wstrząsacz mechaniczny, „vortex”).
Oznaczenie wykonać w dwóch powtórzeniach - czyli dla każdego rozcieńczenia wykonać 2 próby
właściwe i 2 próby kontrolne.

6
Próby właściwe:
Do krótkich szklanych probówek pobrać 0,2 ml substratu i umieścić w łaźni wodnej (30
o
C) na
2-3 minuty. Następnie dodawać 0,2 ml enzymu (odpowiednio rozcieńczony preparat
enzymatyczny) do probówek z substratem (pipetować ze stoperem co 30 sekund do kolejnych
probówek). Po 15 minutach inkubacji w łaźni wodnej (30
o
C) dodawać 0,4 ml DNS do
kolejnych probówek (początek: 15 minuta na stoperze, pipetować w odstępach 30
sekundowych w identycznej kolejności jak poprzednio). Po zamieszaniu probówki wyjąć z
łaźni wodnej.
Następnie probówki umieścić na wrzącej łaźni wodnej i gotować dokładnie przez 5 minut,
natychmiast schłodzić i dopełnić do 4 ml.
Próby kontrolne:
Do krótkich szklanych probówek pobrać 0,2 ml substratu. Dodać 0,4 ml DNS, wymieszać i
dodać 0,2 ml enzymu.
Następnie probówki umieścić na wrzącej łaźni wodnej i gotować dokładnie przez 5 minut,
natychmiast schłodzić i dopełnić do 4 ml.
Wzorce:
Krzywa wzorcowa:
Odmierzyć do krótkich szklanych probówek zgodnie z tabelą:
wzorzec – 120mg% glukoza [µl] H
2
O [µl] glukoza [
M]
1
0
400
0,000
2
34
366
1,1326
3
66
334
2,1986
4
134
266
4,4689
5
200
200
6,6626
6
266
134
8,8613
7
334
66
11,1265
8
400
0
13,3252
Do tak przygotowanych roztworów wzorcowych dodać 0,4 ml DNS. Następnie probówki
umieścić na wrzącej łaźni wodnej i gotować dokładnie przez 5 minut, natychmiast schłodzić i
dopełnić do 4 ml.
Pomiar:
Pobrać po 300 ul roztworów próbek właściwych, kontrolnych oraz wzorców do studzienek
mikropłytki zgodnie z poniższym schematem.
W – wzorce, PK – próby kontrolne, PW – próby właściwe.
Wiersze C-D-E = preparat enzymatyczny I, wiersze E-F-G = preparat enzymatyczny II.
1
2
3
4
5
6
7
8
9
A
B
W1
W1
W2
W3
W4
W5
W6
W7
W8
C
PK1:50
PK1:50
PW1:50
PW1:50
D
PK1:200 PK1:200 PW1:200 PW1:200
E
PK1:500 PK1:500 PW1:500 PW1:500
F
PK1:50
PK1:50
PW1:50
PW1:50
G
PK1:200 PK1:200 PW1:200 PW1:200
H
PK1:500 PK1:500 PW1:500 PW1:500

7
Odczytać ekstynkcję na czytniku mikropłytek Bio-Rad przy długości fali 540 nm. Barwa
stabilna 45 minut po dopełnieniu.
Obliczenia:
Jednostkę aktywności amylolitycznej (AmU) zdefiniowano jako ilość mikromoli
glukozy uwolnionych przez 1 ml enzymu w czasie 1 minuty w warunkach analizy.
R
K
W
ml
AmU
15
)
(
/
gdzie: W =
M glukozy dla próby właściwej, K=
M glukozy dla próby kontrolnej, R =
rozcieńczenie enzymu.
Obliczyć aktywność testowanych preparatów, wybierając średnią wartość z odpowiednich
rozcieńczeń (dla których uzyskano odczyty mieszczące się w krzywej wzorcowej).
Literatura uzupełniająca:
1. Kujawski M., Żyła K. 1999. Stosowanie preparatów enzymatycznych w wybranych
gałęziach przemysłu spożywczego. Biotechnologia 45(2): 38-46.
2. Cavalitto S.F., Hours R.A., Mignone C.F., 1999. Quantification of protopectinase SE,
an endopolygalacturonase with pectin-releasing activity from Geotrichum klebahnii.
Biotechnology Techniques 13: 385-390.
3. Specyfikacja preparatów handlowych Pektopol PS 150 oraz Pektopol PT 400 (ZPOW
Pektowin, Jasło).
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 6 Oznaczanie aktywności katalazy
Ćwiczenie 6 Oznaczanie aktywności katalazy
9) Oznaczanie aktywności enzymów amylolitycznych
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Oznaczanie aktywności enzymów lipolitycznych
Kraking katalityczny – oznaczanie aktywności katalizatorów metodą UOP
chemia zywnosci wyklady mini sciaga, Dietetyka 2012,2013, Chemia żywności
Analizy - Gleba cwiczenia, OZNACZENIE SKŁADU GRANULOMETRYCZNEGO GLEBY
Ćwiczenie 5, Oznaczanie kapilarności czynnej w gruntach
Ćwiczenie 1, Oznaczanie współczynnika filtracji na podstawie krzywej uziarnienia
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
Ćwiczenie 1 Oznaczanie współczynnika filtracji na podstawie krzywej uziarnienia
TEST ZALICZENIOWY DIETETYKA WIEKUDOJRZAŁEGO, Dietetyka 2012,2013, Dietetyka wieku dojrzałego, egzami
SKJZ Z1 CW 29.09, Dietetyka 2012,2013, Systemy kontroli jakości żywności
dietetyka wieku dojrzalego sciaga nr 1, Dietetyka 2012,2013, Dietetyka wieku dojrzałego, egzamin
więcej podobnych podstron