
1
Oznaczanie aktywności enzymów amylolitycznych.
Zajęcia 3 godzinne – część A, zajęcia 4 godzinne część A i B.
Cel ćwiczenia
Ćwiczenie poświęcone jest zapoznaniu się z metodami oznaczania aktywności
enzymów amylolitycznych, na podstawie pomiaru przyrostu redukcyjności mieszaniny
reakcyjnej oraz na podstawie zmiany zabarwienia skrobi z jodem – metoda SKB (Sandstedta,
Kneena i Blisha).
Wprowadzenie
Enzymy amylolityczne
występują w roślinach, zwierzętach oraz w organizmie
człowieka. Rozkładają one skrobię, glikogen oraz pokrewne im oligo- i polisacharydy. Są
jednymi z najwcześniej poznanych enzymów, zaliczamy je do hydrolaz, podklasy
α
-
glukanaz. Najważniejsze z nich to: α-amylaza (EC 3.2.1.1), β-amylaza (EC 3.2.1.2) oraz
glukoamylaza (EC 3.2.1.3).
Wykorzystywany na ćwiczeniach substrat - skrobia jest polisacharydem zbudowanym
z reszt sześciowęglowego, redukującego cukru α-D-glukozy. Cząsteczki glukozy połączone
są wiązaniami α-1,4- i α-1,6-glikozydowymi. Wskutek polimeryzacji glukozy w cząsteczce
skrobi dochodzi do wytworzenia jej dwóch frakcji: amylozy i amylopektyny. Amyloza
zbudowana jest z nierozgałęzionych łańcuchów połączonych wiązaniami α-1,4-
glikozydowymi, podczas gdy cząsteczki amylopektyny są rozgałęzione, a rozgałęzienia w
łańcuchach utworzone są przez wiązania α-1,6glikozydowe.
W katabolizmie skrobi w układzie pokarmowym ludzi i zwierząt oraz w roślinach
obok α- i β-amylaz bierze udział wiele innych enzymów rozkładających węglowodany.
α
-
glukanazy są typowymi enzymami katabolicznymi występującymi powszechnie w
organizmach zwierzęcych, w roślinach i drobnoustrojach. Szczególnie duże ilości α- i β-
amylazy znajdują się w skiełkowanych ziarniakach zbóż (słód pszenny lub jęczmienny),
natomiast sok z ssaczej trzustki składa się głównie z
α
-amylazy, niewielkiej ilości
glukoamylazy, natomiast nie występuje w nim
β
-amylaza.
α-amylaza katalizuje rozrywanie wyłącznie wiązań α-1,4-glikozydowych wewnątrz
cząsteczki substratu (endoamylaza), działa dość szybko na substrat, a produktami jej działania
są dekstryny, maltotrioza, izomaltoza, maltoza i glukoza. Uwalniane reszty glukozylowe mają
konfigurację przy węglu C1 α i stąd pochodzi symbol α przy nazwie enzymu. W wyniku
działania α-amylazy następuje początkowo szybki spadek lepkości substratu, zmiana
zabarwienia kompleksu z jodem i stosunkowo powolny przyrost redukcyjności w mieszaninie
reakcyjnej. α-amylazy różnego pochodzenia wykazują optimum aktywności w zakresie pH
4,5–7,0, chociaż znane są enzymy pochodzenia bakteryjnego, dla których wartość ta wynosi
10,0–10,5; w przypadku α-amylazy słodowej optimum pH wynosi 5,3. Dla amylazy
trzustkowej optimum pH wynosi 6,7-7,0. Optymalna temperatura działania α-amylaz mieści
się w granicach 30–50°C, a tylko dla niektórych termostabilnych enzymów bakteryjnych
(Bacillus licheniformis) jest wyższa i wynosi 90–100°C.
β-amylaza działa na substrat od strony nieredukującego końca łańcucha i dlatego
nazywana jest egzoamylazą. Hydrolizuje co drugie wiązanie α-1,4-glikozydowe, odrywając
jednostki β-maltozy. Podczas hydrolizy występuje przegrupowanie Waldena i dlatego
uwalniana maltoza jest β-anomerem. β-amylaza nie działa na wiązanie α-1,6-glikozydowe i
nie jest w stanie go ominąć jak α-amylaza, działanie jej zatrzymuje się więc po dojściu do
tego wiązania. W wyniku działania β-amylazy na substraty rozgałęzione (zawierające
wiązanie α-1,6-glikozydowe np. skrobia) produktami są β-maltoza i wysokocząsteczkowa
2
dekstryna graniczna. W mieszaninie reakcyjnej β-amylazy ze skrobią obserwuje się szybki
przyrost redukcyjności, natomiast nie występuje szybki spadek lepkości i obserwowana jest
powolna zmiana zabarwienia skrobi z jodem, gdyż jednym z produktów jest wyżej
wspomniana wysokocząsteczkowa dekstryna graniczna. β-amylazy pochodzenia roślinnego
wykazują optymalną aktywność w zakresie pH 4,0–5,5 i przypisuje im się kluczową rolę w
degradacji skrobi syntetyzowanej w chloroplastach. Zakres temperatur optymalnych dla
działania β-amylaz bakteryjnych obejmuje 40–55°C, a optymalne pH dla ich działania wynosi
6,0–7,0. W budowie centrum aktywnego tych enzymów występują reszty cysteinowe (grupy –
SH), natomiast brak jonów metali, powoduje to szybką inaktywację
β
-amylaz w obecności
takich związków jak np. HgCl
2
, AgNO
3
, czy też jodu.
Glukoamylaza nazywana także
γ
-amylazą jest wytwarzana głównie przez
drobnoustroje oraz grzyby, występuje także we krwi, mięśniach i wątrobie u zwierząt.
Końcowym produktem działania glukoamylazy na substrat (skrobia, dekstryny,
oligosacharydy) jest glukoza z konfiguracją przy węglu C1
β
. Preparaty techniczne tego
enzymu wykorzystywane są do produkcji glukozy w przemyśle spożywczym. Enzym ten
katalizuje głównie hydrolizę wiązań α-1,4-glikozydowych w skrobi, odrywając kolejno
jednostki glukozy od nieredukującego końca cząsteczek polisacharydu. Znacznie wolniej
hydrolizuje wiązania α-1,6-glikozydowe, obecne w amylopektynie. Ze względu na sposób
działania glukoamylaza określana jest, podobnie jak β-amylaza, jako egzoamylaza. W
początkowej fazie działania glukoamylazy na skrobię obserwuje się szybki przyrost
redukcyjności oraz powolną zmianę barwy z jodem, a także powolny spadek lepkości w
mieszaninie reakcyjnej. Optymalne pH dla tego enzymu mieści sie w zakresie od 4,0 do 5,6, a
optymalna temperatura w przedziale 40-65ºC. Charakterystyczne dla tego enzymu jest
również hamujące dzianie jonów Ca
2+
na aktywność hydrolityczną glukoamylazy, w
przeciwieństwie do
α
-amylazy, dla której to jony wapnia często powodują zwiększenie
szybkości reakcji hydrolizy skrobi.
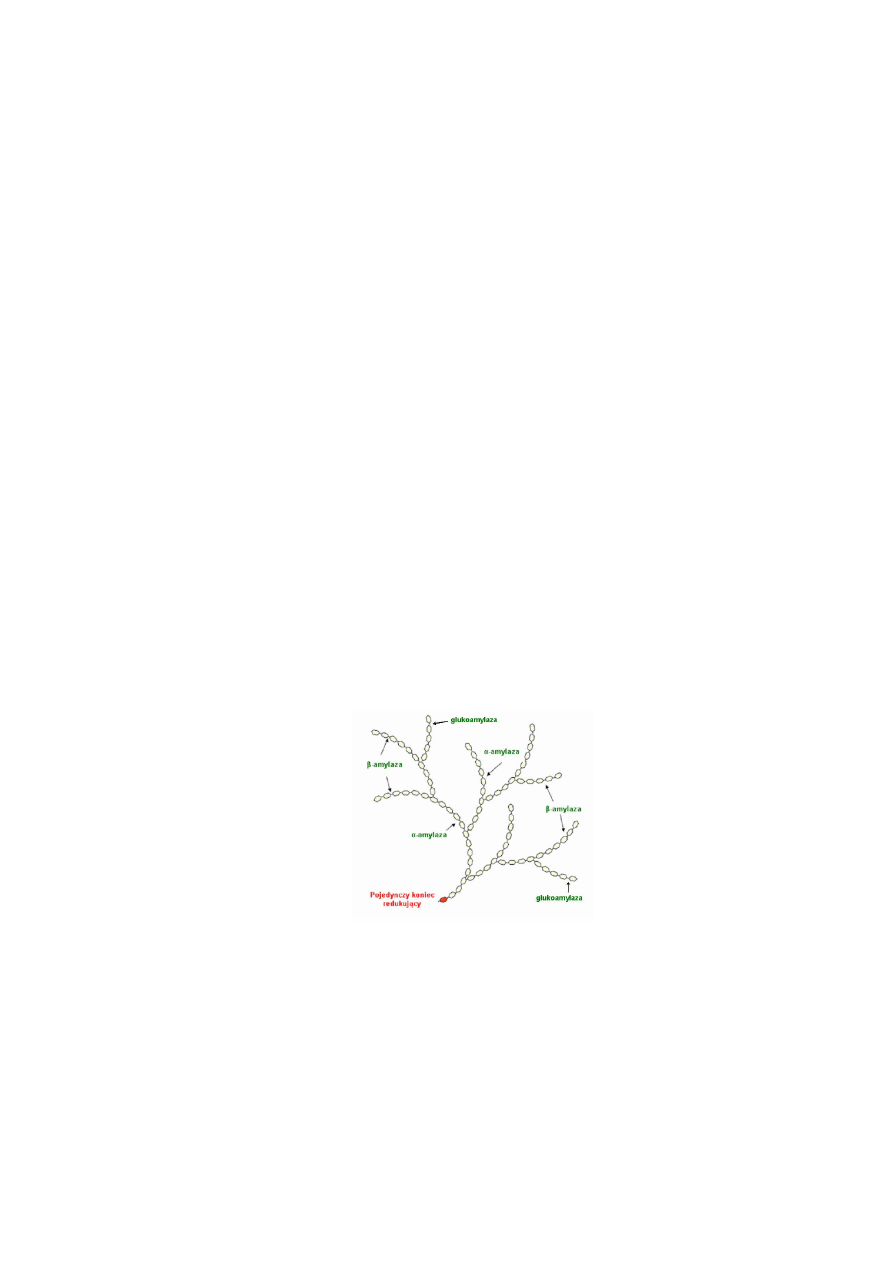
Mechanizm i sposób działania amylaz. Amylazy działając na substrat niezależnie od
długości jego łańcucha i stopnia rozgałęzienia rozrywają wiązanie glikozydowe pomiędzy
węglem glikozydowym a tlenem wiązania glikozydowego (Rys. 1.).
Rys. 1. Schemat działania amylaz na amylopektynę.
Poszczególne enzymy amylolityczne mają określone wymagania co do położenia
wiązania podatnego na hydrolizę oraz określoną kolejność rozrywania wiązań. Sposób
działania amylaz uwarunkowany jest budową ich centrum aktywnego i substratu, a także
zależy od pH, temperatury i obecności inhibitorów i aktywatorów.
W budowie centrum aktywnego amylaz wyróżnia się region katalityczny i region
wiążący substrat. Pierwszy z nich bierze bezpośredni udział w rozrywaniu wiązania
glikozydowego. Natomiast region wiążący jest to odcinek łańcucha polipetydowego białka,
który musi połączyć się z określoną liczbą reszt glukozy w łańcuchu substratu, aby centrum
katalityczne mogło spełnić swoją funkcję, tzn. aby nastąpiło rozerwanie wiązania.

3
Metody oznaczania aktywności enzymów amylolitycznych. Oznaczanie aktywności
enzymów amylolitycznych można przeprowadzić na podstawie pomiaru:
1) przyrostu redukcyjności w mieszaninie reakcyjnej,
2) zmian zabarwienia skrobi z jodem,
3) szybkości rozkładu substratów syntetycznych – p-nitrofenylomaltotriozy – PNP
β
-
G3 (substrat specyficzny dla
β
-amylazy, zbyt mała ilość reszt glukozy dla
α
-amylazy) oraz
zablokowanej nitrofenylomaltoheptaozy - BPNPG7 (substrat specyficzny dla
α
-amylazy,
blokada uniemożliwia działanie
β
-amylazie),
4) zmian natężenia barwy mierzonej przy długości fali 595 nm, po reakcji ze
zmodyfikowaną skrobią (starch azure, Sigma),
5)
zmiany
lepkości
roztworu
jako
efektu
spadku
masy
cząsteczkowej
hydrolizowanego substratu,
6) natężenia światła rozproszonego przez zawiesinę lub roztwór koloidalny, miarą
rozproszenia światła jest turbidancja, która proporcjonalna jest do stężenia cząstek zawiesiny,
które to z kolei spada w miarę postępu hydrolizy skrobi.
Ze względu na niską specyficzność substratową enzymów amylolitycznych w
stosunku do skrobi, w nieoczyszczonych homogenatach (np. wyciągu słodowym) występuje
współdziałanie różnych amylaz i efekt końcowy tj. powstawanie dekstryn oligosacharydów
oraz glukozy jest wypadkową działania poszczególnych enzymów.
A.
Metody wykorzystujące przyrost redukcyjności w mieszaninie reakcyjnej.
Metoda z heksacyjanożelazianem (III) potasu. W tej metodzie podobnie jak w
metodzie Bernfelda, wykorzystuje się właściwości redukujące cukrów uwalnianych w trakcie
hydrolizy polisacharydów przez enzymy amylolityczne, które reagują z alkalicznym
roztworem heksacyjanożelazianu (III) potasu - K
3
Fe(CN)
6
(Robyt i wsp. 1972, Kidder i wsp.
1972). Heksacyjanożelazian (III) potasu posiada żółty kolor, który po zredukowaniu przez
uwalniane w trakcie hydrolizy skrobi dekstryny, oligosacharydy oraz glukozę przekształca się
w bezbarwny heksacyjanożelazian (II) potasu – K
4
Fe(CN)
6
. Stopień osłabienia intensywności
zabarwienia alkalicznego roztworu heksacyjanożelazianu (III) potasu jest zależny od ilości
uwalnianych cukrów redukujących i może być miarą aktywności enzymów amylolitycznych.
Odczynniki.
1. Wyciąg enzymu do oznaczania aktywności enzymów amylolitycznych sporządza
się z 1 g trzustki zhomogenizowanej w 1000 ml 0.9% NaCl. Ekstrakt po homogenizacji jest
wirowany i jeśli to konieczne dodatkowo sączony przez gazę.
2. 0,9% NaCl, odważyć 9 g NaCl, początkowo rozpuścić w 900 ml H
2
O destylowanej,
następnie uzupełnić do 1000ml.
3. 1-proc. roztwór skrobi rozpuszczalnej w 0,05 M buforze Tris-HCl o pH 7,0.
4. 3,5 g K
3
Fe(CN)
6
oraz 20,0 g węglanu sodowego (Na
2
CO
3
) rozpuścić w 800 ml
wody następnie po rozpuszczeniu uzupełnić wodą do 1000 ml, przechowywać w ciemnej
butelce 4ºC.
Wykonanie.
Otrzymany w kolbie miarowej na 10 ml wyciąg z trzustki wieprzowej (1) uzupełnić
0,9% NaCl (2) i wymieszać. W razie konieczności przelać do czystej próbówki, w celu
pobrania pipetą automatyczną do oznaczeń.
Do 3 enzymatycznie czystych probówek pobrać po 0,3 ml 1% zbuforowanego
roztworu skrobi (3) i wstawić na 5 min do łaźni wodnej o temp. 37°C. Po 5 minutach do 2
probówek dodać po 0,2 ml wyciągu enzymu z kolby na 10 ml (próby właściwe - P) i
4
przeprowadzić reakcję hydrolizy skrobi w ciągu 15 min w temp. 37°C. Następnie do
wszystkich 3 probówek dodać po 1,5 ml alkalicznego roztworu heksacyjanożelazianu (III)
potasu (4), a do trzeciej probówki zawierającej substrat i 1,5 ml alkalicznego roztworu
heksacyjanożelazianu (III) potasu dodać dodatkowo 0,2 ml enzymu (próba materiałowa - M).
Do czystej probówki dodać 0,5 ml wody destylowanej oraz 1,5 ml alkalicznego roztworu
heksacyjanożelazianu (III) potasu (próba odczynnikowa – O).
Po dokładnym wymieszaniu wszystkie 4 probówki wstawić do wrzącej łaźni wodnej,
ogrzewać 10 minut, a następnie schłodzić do temperatury pokojowej. Po schłodzeniu do
każdej probówki pobrać po 10 ml H
2
O wody destylowanej, dobrze wymieszać. Odczytu
wartości absorbancji dokonać w fotometrze przy długości fali 420 nm, zerując fotometr
względem wody destylowanej.
Przykładowe obliczenia.
Absorbancja
P1
Absorbancja
P2
Średnia
absorbancja
Absorbancja
M
Absorbancja
O
1,078
1,122
1,100
1,374
1,505
Od absorbancji dla próby odczynnikowej (O – jej wartość powinna być zbliżona u
wszystkich w grupie) odejmujemy absorbancję dla prób materiałowych i średnią dla pełnych
(niejednakowych wobec różnych stężeń otrzymanego wyciągu enzymu w zadaniu
kontrolnym):
1,505 – 1,374 = 0,131
1,505 – 1,100 = 0,405
Z różnicy tak obliczonych absorbancji: P – M, odpowiednio: 0,405 – 0,131 = 0,274
możemy wnioskować o aktywności amylolitycznej użytego do doświadczenia ekstraktu z
trzustki.
Dla obliczonej różnicy odczytujemy z krzywej wzorcowej, w której użyto
wzorcowych roztworów maltozy ilość maltozy, dla 0,274 było to 350
µ
g maltozy.
W 0,2 ml próby znajduje się 350 µg maltozy
Enzym w 10 ml, (w kolbce) – uwolniłby 17500
µ
g maltozy, czyli 17,5 mg maltozy
Do kolbki, przed dopełnieniem jej wodą do objętości 10 ml wlano np. 0,1 ml wyciągu
z trzustki (wartość tą poda prowadzący ćwiczenie, po zanotowaniu absorbancji średniej dla
zadania kontrolnego).
0,1 ml wyciągu z trzustki umożliwiłoby uwolnienie 17,5 mg maltozy, zatem 1000 ml:
17,5 mg maltozy x 1000/0,1 = 175000 mg maltozy, czyli 175 g maltozy, masa cząsteczkowa
maltozy wynosi 342g, zatem aktywność enzymów amylolitycznych wyrażona w µmolach
uwolnionej maltozy na 1 g trzustki i na 1 min. w tym wypadku wynosi:
175 g maltozy/ 342 g/mol= 0,512 mola maltozy = 512 mmola
512/ 15 min = 17,466 mmola maltozy x 1 min
-1
17,466 mmola maltozy x 1 min
-1
/ 1 g trzustki = 17,466 mmola uwolnionej maltozy x 1 min
-1
x 1 g trzustki
-1
Opracowanie wyników
Prowadzącemu ćwiczenia podać różnicę średnią wartość absorbancji z równoległych
prób pełnych po odjęciu absorbancji dla próby materiałowej.
Na podstawie uzyskanej różnicy absorbancji odczytać z krzywej wzorcowej
odpowiednią wartość maltozy w µg. Krzywą wzorcową dla maltozy z alkalicznym roztworem
heksacyjanożelazianu (III) potasu przygotowuje się stosując roztwór maltozy o stężeniach od
0 do 1600
µ
g na 1 ml. Uwzględniając rozcieńczenia obliczyć aktywność amylaz z trzustki i
wyrazić ją w mmolach uwolnionej maltozy na 1 g trzustki i na 1 min.
5
Inne metody wykorzystujące przyrost redukcyjności w mieszaninie reakcyjnej.
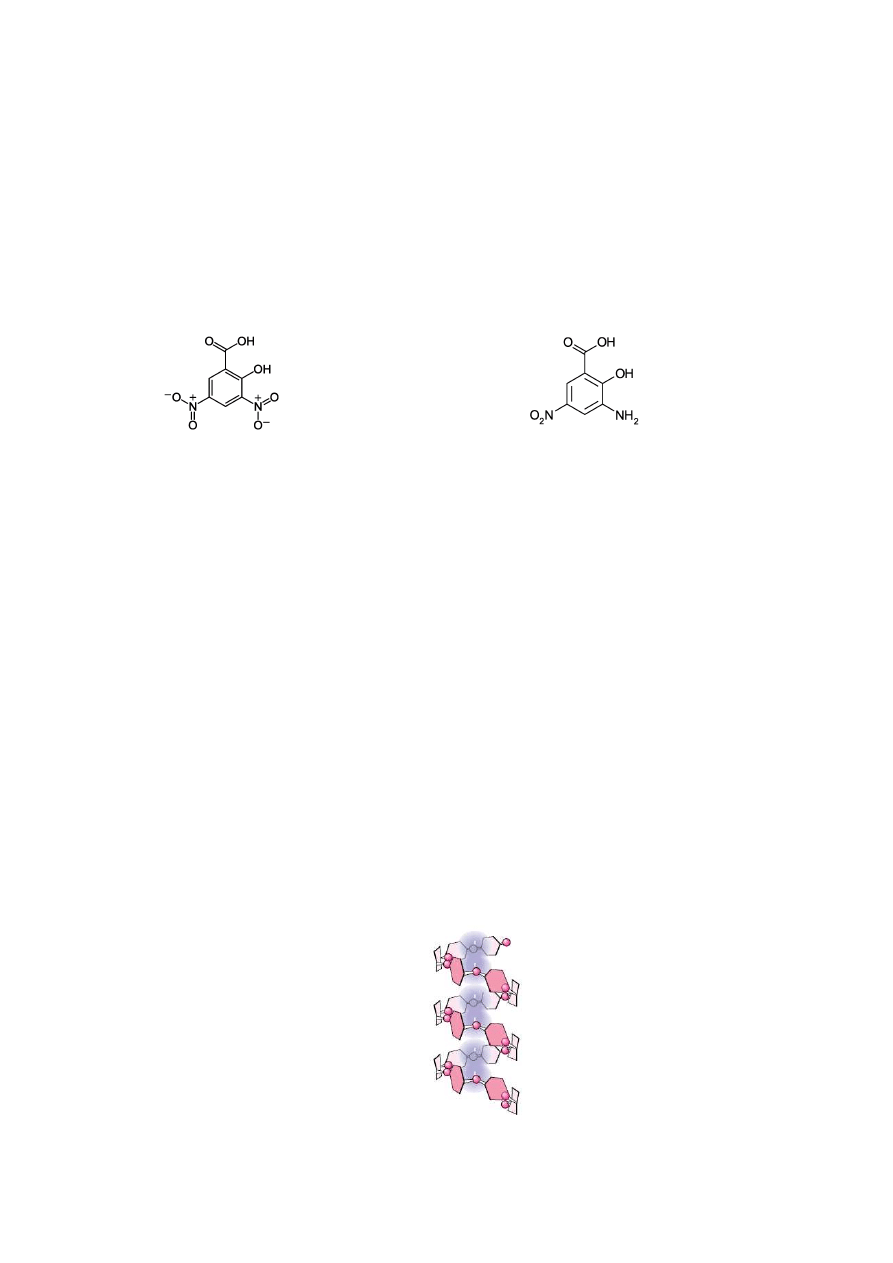
Metoda Bernfelda. W metodzie Bernfelda (1958), zmodyfikowanej przez Jamiesona i
współpracowników (1968) wykorzystuje się właściwości redukujące maltozy i innych
cukrów, które w środowisku zasadowym redukują grupę nitrową soli sodowej kwasu 3,5-
dinitrosalicylowego (DNS) w pozycji 3 do grupy aminowej (Rys. 2.). Powstałe pochodne
aminowe mają barwę pomarańczową, silnie absorbują świtało przy długości fali w zakresie od
450-540 nm. Intensywność powstałej barwy zależy od ilości w próbie cukrów redukujących
uwalnianych podczas działania enzymów, dlatego reakcja ta może stanowić podstawę do ich
oznaczenia fotometrycznego.
kwas 3,5-dinitrosalicylowy
kwas 3-amino-5-nitrosalicylowy
Rys. 2. Wzory kwasu 3,5-dinitrosalicylowego (DNS) oraz kwasu 3-amino-5-
nitrosalicylowego.
Metoda Somogyi i Nelsona. W tej metodzie (Somogyi, 1952) podobnie jak w
poprzednio opisanych metodach, wykorzystuje się właściwości redukujące sacharydów
(głównie mono- i disacharydów), które w środowisku zasadowym redukują jony miedzi (II)
do jonów miedzi (I) w obecności winianu sodowopotasowego z wytworzeniem tlenku miedzi
CuO w postaci ceglastego osadu. Po dodaniu kwasu arsenomolibdenowego do utworzonego
tlenku miedzi zachodzi redukcja tego kwasu do odpowiedniego barwnika o kolorze
błękitnym, intensywność otrzymanej barwy można mierzyć w zakresie od 500 do 620 nm i
jest ona proporcjonalna do ilości utworzonych cukrów redukujących w czasie działania
enzymów amylolitycznych. Metoda Somogyi i Nelsona stosowana jest najczęściej do
oznaczania aktywności egzoamylaz.
B.
Reakcja skrobi z jodem. Metoda Sandstedta, Kneena i Blisha (SKB).
Cząsteczki skrobi zależnie od ilości zawartej w nich amylozy i amylopektyny
adsorbują jod na swojej powierzchni, dając zabarwienie niebieskie lub niebieskofioletowe
(Rys. 3). Natomiast produkty częściowej degradacji skrobi zależnie od wielkości ich
cząsteczek dają zabarwienie fioletowe (dekstryny wysokocząsteczkowe), czerwone i
czerwonobrunatne
(dekstryny
o
średniej
masie
cząsteczkowej),
a
dekstryny
niskocząsteczkowe nie dają zabarwienia z jodem.
Rys. 3. Tworzenie się kompleksu amylozy z jodem.
6
Metoda Sandstedta, Kneena i Blisha (SKB, 1939) oznaczania aktywności amylaz
polega na pomiarze ilości rozłożonej skrobi, na podstawie zmiany intensywności zabarwienia
w mieszaninie reakcyjnej z jodem po określonym czasie działania enzymu np. w pH 7,0 i w
temp. 37°C. Stosowana w ćwiczeniu jako substrat skrobia ziemniaczana daje z jodem
zabarwienie niebieskie (ze względu na znaczną zawartość w niej amylozy – ok. 20%).
Po przerwaniu reakcji enzymatycznej i wprowadzeniu jodu w próbie materiałowej
(bez enzymu) oznacza się pochłanianie barwnego kompleksu powstałego z całą ilością skrobi
wprowadzonej do reakcji, natomiast w próbie z udziałem enzymu oznacza się absorbancję
kompleksu skrobi nie rozłożonej i dekstryn. Ilość rozłożonej skrobi znajduje się z różnicy
pomiarów tych dwóch prób.
Odczynniki.
1. Wyciąg enzymu do oznaczania aktywności enzymów amylolitycznych sporządza
się z 1 g trzustki zhomogenizowanej w 1000 ml 0.9% NaCl. Ekstrakt po homogenizacji jest
wirowany i jeśli to konieczne dodatkowo sączony przez gazę.
2. 0,9% NaCl, odważyć 9 g NaCl, początkowo rozpuścić w 900 ml H
2
O destylowanej,
następnie uzupełnić do 1000ml.
3. 1-proc. roztwór skrobi rozpuszczalnej w 0,05 M buforze Tris-HCl o pH 7,0.
5. 0,5-molowy kwas solny.
6. Roztwór jodu a) podstawowy: 0,6 g jodku potasowego rozpuścić w 0,5 ml wody,
dodać 0,6 g krystalicznego jodu i mieszać do całkowitego rozpuszczenia, uzupełnić wodą do
200 ml. Przenieść do ciemnej butli ze szlifem; roztwór jest trwały przez kilka tygodni; b)
roboczy: 10 ml roztworu podstawowego przenieść do kolby miarowej na 500 ml, uzupełnić
wodą, a następnie sprawdzić absorbancję przy długości fali 470 nm i ustalić na wartość równą
0,160 Abs za pomocą stężonego roztworu jodu lub wody.
Wykonanie.
Otrzymany w kolbie miarowej na 10 ml wyciąg enzymów (1) amylolitycznych
trzustki uzupełnić 0,9% NaCl (2) do kreski i wymieszać. Do 3 enzymatycznie czystych
probówek pobrać po 1 ml 1% zbuforowanego roztworu skrobi (3), wstawić na 5 min do łaźni
wodnej o temp. 37°C, następnie do dwu z nich dodać po 1,0 ml roztworu enzymu z kolby na
10 ml (próby właściwe - P), a do trzeciej 1 ml wody (próba materiałowa - M). Po dokładnym
wymieszaniu próby inkubować 15 min w temp. 37°C. Reakcję enzymatyczną przerwać w
łaźni dodając 5 ml 0,5M kwasu solnego (5). Następnie pobrać po 0,25 ml mieszaniny
reakcyjnej i dodać do 5 ml roztworu jodu (6). Po dokładnym wymieszaniu odczytu dla próby
właściwej i materiałowej dokonać przy długości fali 670 nm w fotometrze nastawionym na
zero wobec wody.
Przykładowe obliczenia.
Absorbancja
próby pełnej
1
Absorbancja
próby pełnej
2
Średnia
absorbancja
próby pełnej
Absorbancja
próby
materiałowej
Różnica Absorbancja
materiałowa – Absorbancja
pełne
0,416
0,424
0,420
0,746
0,326
Różnica absorbancji 0,326
Abs
670
– dla próby materiałowej wynosiła 0,746 co odpowiadało 10 mg skrobi
Spadek Abs
670
o 0,326 oznacza rozłożenie 3,48 mg skrobi przez 1 ml roztworu słodu
pobranego z 10 ml kolbki.
Dla 10 ml, (w kolbce) mamy odpowiednio 34,80 mg rozłożonej skrobi

7
Do kolbki, przed dopełnieniem jej wodą do objętości 10 ml wlano np. 0,1 ml wyciągu z
trzustki (wartość tą poda prowadzący ćwiczenie, po zanotowaniu absorbancji średniej dla
zadania kontrolnego).
0,1 ml wyciągu z trzustki umożliwiłoby spadek absorbancji roztworu skrobi z jodem o 3,260,
zatem 1000 ml: 34,80 x 1000/0,1 = 348000,00 mg skrobi, czyli 348 g skrobi, zatem
aktywność enzymów amylolitycznych wyrażona w g rozłożonej skrobi na 1 g trzustki i na
1 min. w tym wypadku wynosi:
348 g skrobi/ 15 min = 23,2 g skrobi x 1 min
-1
23,2 mg skrobi x 1 min
-1
/ 1 g trzustki = 23,2 g rozłożonej skrobi x 1 min
-1
x 1 g trzustki
-1
Opracowanie wyników.
Absorbancja próby materiałowej odpowiada tej ilości skrobi, która została
wprowadzona do reakcji (1 ml 1% roztworu – 10 mg). Absorbancja próby pełnej odpowiada
ilości skrobi pozostałej po hydrolizie enzymami amylolitycznymi. Z różnicy między
absorbancją próby materiałowej i pełnej wnioskujemy o ilości rozłożonej skrobi.
Prowadzącemu ćwiczenia należy podać różnicę między absorbancją próby
materiałowej i pełnej. Uwzględniając rozcieńczenia obliczyć aktywność α-amylazy w mg
rozłożonej skrobi w czasie 1 minuty w przeliczeniu na enzym wyekstrahowany z 1 g trzustki.
Pytania
1.
Do jakiej klasy enzymatycznej należą amylazy? Jakie reakcje katalizują?
2.
Narysować fragment łańcucha amylopektyny i wskazać na nim miejsca działania
poszczególnych amylaz.
3.
Na czym polega różnica w sposobie działania na skrobię pomiędzy α- i β-amylazą?
Które enzymy określa się jako endoamylazy, a które jako egzoamylazy i dlaczego?
4.
Na czym polegają metody oznaczania aktywności amylaz?
5.
Wymienić typy organizmów, w których występują α-, β- i glukoamylazy. Jakie
funkcje pełnią w nich te enzymy?
6.
Uzasadnić celowość wykonywania prób materiałowych w metodzie wykorzystującej
przyrost redukcyjności w mieszaninie reakcyjnej. Czy odczyty absorbancji będą w
nich większe czy mniejsze niż w próbach pełnych (z działającymi enzymami
amylolitycznymi) odpowiedź uzasadnij.
7.
Podaj nazwę i napisz wzór produktu reakcji cukrów redukujących z DNS (kwasem ,5-
dinitrosalicylowym). W jakiej metodzie wykorzystywany jest ten substrat?
Aktywności których amylaz (egzo-, czy endoamylaz) częściej oznaczane są z
wykorzystaniem DNS, odpowiedź uzasadnij.
8.
Wyjaśnić, na czym polega zasada metody SKB oznaczania aktywności enzymów
amylolitycznych?
9.
Wyjaśnić, na czym polega zasada metody z wykorzystaniem alkalicznego roztworu
heksacyjanożelazianu
(III)
potasu
do
oznaczania
aktywności
enzymów
amylolitycznych?
Literatura.
1.
Bernfeld, P. (1955) Amylases, alpha and beta. Methods in enzymology I: 149-158,
2.
Jamieson A. D., Pruitt K. M. Caldwell R. C. (1969) An Improved Amylase Assay J Dent Res; 48; 483,
3.
Kidder, D. E., Hill F.W.G., Stevens J. A. (1972) Automatic measurement of some mucosal carbohydrases. Clin. Chim. Acta
37:491.
4.
Robyt, J. F., Ackerman R. J., Keng J. G. (1972) Reducing value methods for maltodextrins: II. Automated methods and
chainlength independence of alkaline ferricyanide. Anal.Biochem. 45: 517.
5.
Sanstedt, R. M., Kneen, E., Blish, M. J. (1939) A standardized Wohlgemuth procedure for alpha-amylase activity. Cereal
Chem., 16, 712-723.
6.
Somogyi, M., (1952) Determination of reducing sugars by Nelson-Somogyi method. J. Biol. Chem., 200: 245-245.
Wyszukiwarka
Podobne podstrony:
Oznaczanie aktywności enzymów lipolitycznych
oznaczanie aktywności enzymów, Biotechnologia, laborki
Ćwiczenie 3 Oznaczanie aktywności amylolitycznej ora z pektynoesterazy Dietetyka 2012
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Kraking katalityczny – oznaczanie aktywności katalizatorów metodą UOP
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
Spektrofotometryczna metoda oznaczania aktywności peroksydazy
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
biochemia III, Czynniki warunkujące aktywność enzymów
Aktywność enzymów przy niedoborze żelaza
Ćwiczenie 6 Oznaczanie aktywności katalazy
cwiczenie 1 oksydoreduktazy i transferazy wykrywanie aktywnosci enzymow w materiale biologicznym 05
3-Aktywność-enzymów-materiały, Biotechnologia SGGW
IG.6 - Oznaczanie aktywności enzymatycznej metaloproteinaz komórkowych, Genetyka, Inżynieria genetyc
więcej podobnych podstron