Ćwiczenie 1
Oznaczanie aktywności enzymów
Prowadzący: dr inż. Gabriela PASTUCH-GAWOŁEK
Miejsce ćwiczenia: sala 7
CEL ĆWICZENIA
Celem ćwiczenia jest oznaczanie aktywności -amylazy w ślinie oraz badanie wpływu na aktywność amylazy różnych czynników, takich jak: temperatura, obecność jonów chlorkowych, silnych kwasów i zasad.
WSTĘP
Hydrolazy glikozydowe to grupa enzymów powodujących hydrolizę wiązań glikozydowych. Do najpowszechniej występujących enzymów w tej podgrupie należą amylazy. Przeprowadzają one hydrolizę skrobi, wielocukru złożonego z jednostek D-glukozy, połączonych wiązaniem glikozydowym. -amylazy rozrywają wiązania położone wewnątrz cząsteczki.
Przebieg procesu degradacji skrobi można śledzić obserwując zmianę barwy roztworu skrobi traktowanego jodem od niebieskiej (kompleks ze skrobią), poprzez fiołkową, czerwoną (kompleks z erytrodekstrynami) do bezbarwnej (utworzenie cukrów o niskim ciężarze cząsteczkowym). W czasie procesu rośnie zawartość cukrów redukujących, produktów hydrolizy skrobi i określając ich zawartość można śledzić przebieg reakcji.
Obecność cukrów redukujących można również stwierdzić wobec odczynnika Benedicta. Próba Benedicta należy do najbardziej swoistych i czułych prób redukcyjnych na cukry. Już 0,1% stężenie cukru redukującego powoduje zmianę barwy z niebieskiej na zieloną. W zależności od ilości glukozy powstaje albo tylko zielone zabarwienie, albo osad żółty, pomarańczowy czy czerwony.
U człowieka enzym -amylaza występuje w ślinie, trzustce, surowicy krwi i moczu. Amylaza śliny i trzustki wykazuje aktywność w roztworach lekko zasadowych, obojętnych i słabo kwasowych. Optymalne pH działania: 6,6. Bardzo duży wpływ na działanie amylazy śliny wywierają elektrolity (Cl-, Br-).
PODSTAWY TEORETYCZNE
Skrobia jest polisacharydem zbudowanym z cząsteczek D-glukozy, które są połączone wiązaniami α-glikozydowymi. Jest ona obecna w roślinach, gdzie pełni rolę nośnika energii niezbędnego w większości procesów metabolicznych.
Skrobia jest zbudowana z dwóch składników strukturalnych amylozy i amylopektyny.
Amyloza tworzy proste, długie łańcuchy o masie cząsteczkowej od 4000 do 15000 Da. Reszty glukozylowe są przyłączane w niej wyłącznie wiązaniami 1→4-α-glikozydowymi.
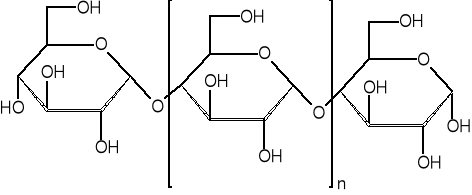
Natomiast amylopektyna jest tworem rozgałęzionym zbudowanym z krótkich, prostych łańcuchów, złożonych z około 30 jednostek glukozy połączonych wiązaniami 1→4-α-glikozydowymi, a między sobą powiązanych wiązaniami 1→6-α-glikozydowymi. Dzięki obecności tych wiązań jednym z produktów hydrolizy amylopektyny jest izomaltoza. Masa cząsteczkowa amylopektyny jest znacznie większa niż amylozy i przekracza 500 kDa, a sięga nawet do 100000 kDa.
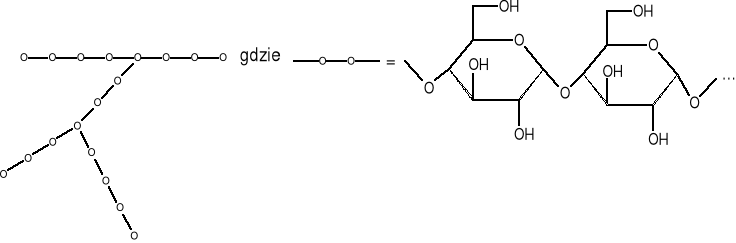
Skrobia jest typowym polisacharydem zapasowym, roślinnym i występuje w ziemniakach, ziarnie zbóż i nasionach wielu innych roślin. Tworzy różnego rodzaju granulki różniące się w zależności od źródła pochodzenia oraz sposobu wydzielania. Większość granulek składa się z kolejnych warstw, które ulegają asocjacji mając postać ziarenek widocznych pod mikroskopem. Stosunek amylozy i amylopektyny jest zasadniczą cechą poszczególnych gatunków skrobi. W tablicy podano niektóre własności skrobi.
Źródło |
Kształt |
Wielkość [μm] |
Amyloza [%] |
Algi |
kulisty |
15 |
1 |
Owies |
kulisty |
25 |
27 |
Kukurydza |
kulisty |
25 |
52 |
Jęczmień |
kulisty |
20 |
22 |
Pszenica |
kulisty |
30 |
28 |
Ziemniaki |
owalny |
40 |
23 |
Groch |
owalny |
40 |
66 |
Z przytoczonego zestawienia widać, że jedynie dla pewnych odmian kukurydzy i grochu wartość amylozy przekracza 50%. Ma to istotny wpływ na zdolność hydrolizy skrobi przez enzymy i w konsekwencji na zdolność przyswajania skrobi przez organizmy.
W procesie metabolizmu skrobi pierwszym stadium jest rozkład enzymatyczny na mniejsze fragmenty. Typowymi enzymami trawiennymi, występującymi w ślinie i wydzielinie trzustki kręgowców są amylazy, które katalizują rozkład skrobi i glikogenu do maltozy lub glukozy. Są one również obecne w roślinach, zwłaszcza w zarodkach ziarna zbóż, gdzie w procesie kiełkowania następuje ich gwałtowna synteza, mająca na celu szybkie uruchomienie energetycznego materiału zapasowego; znalazło to zastosowanie przy otrzymywaniu słodu.
Znane są trzy rodzaje amylaz: α-amylaza zaliczana do endoamylaz oraz β-amylaza i glukoamylaza zaliczane do grupy egzoamylaz.
Wszystkie rodzaje amylaz katalizują hydrolizę wiązań 1-4-α-glikozydowych, a zgodnie z nazwą endoamylazy, α-amylaza atakuje wiązania znajdujące się wewnątrz łańcucha, natomiast β-amylaza i glukoamylaza, jako egzoamylazy, rozrywają odpowiednio co drugie lub kolejne wiązania glikozydowe, poczynając od nieredukującego końca łańcucha.
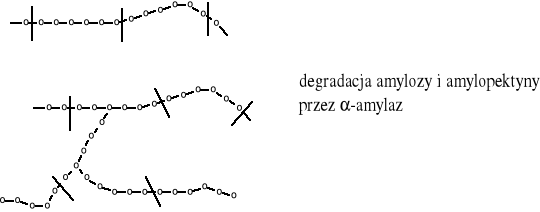
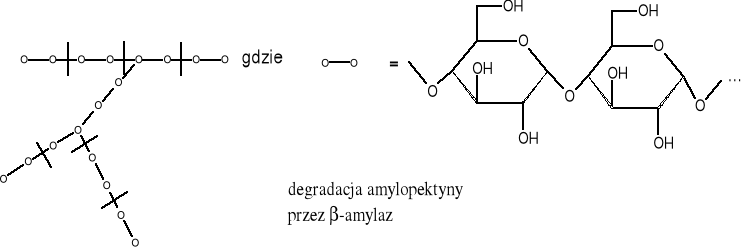
Skrobia zawiera obok frakcji amylozy, również frakcję amylopektyny, złożoną z łańcuchów rozgałęzionych. Ponieważ wiązania 1-6-α-glikozydowe, występujące przy rozgałęzieniach w amylopektynie, stanowią barierę dla działania β-amylazy, rozkład tej frakcji skrobi jest inny: boczne łańcuchy są rozkładane przez β-amylazę do maltozy, podobnie jak prosty łańcuch amylozy, po czym reakcja zatrzymuje się na rozgałęzionych wiązaniach 1→6. Powstaje więc nierozłożona, wielkocząsteczkowa dekstryna graniczna, która stanowi około 40-45% masy amylopektyny i wykazuje znaczną lepkość w roztworze i fioletową barwę z jodem. Rozkładowi ulega ona dopiero przy łącznym działaniu obu enzymów, gdyż α-amylaza przeskakuje przez wiązania 1→6-α-, tworząc nowe, proste łańcuchy, które mogą już być rozkładane przez β-amylazę.
Tak więc, w wyniku działania α- i β-amylaz skrobia ulega hydrolizie do maltozy i izomaltozy, czyli α-D-glukozylo-1→6-glukozy, oraz niewielkiej ilości wolnej glukozy. Zarówno sok jelitowy, jak i ziarna zbóż zawierają również 1→4-α-glukozydazę i 1→6-α-glukozydazę (izomaltazę), enzymy te rozkładają wytworzone disacharydy do cząsteczek glukozy, która jest końcowym produktem rozkładu enzymatycznego skrobi. Najlepiej radzi sobie z amylopektyną (i glikogenem) glukoamylaza występująca w grzybach oraz u zwierząt. Rozkłada ona zarówno wiązania 1→4-α-, jak i 1→6-α-glikozydowe i dlatego przy jej udziale amylopektyna i glikogen ulegają rozkładowi do glukozy.
Liczne grzyby nitkowate, bytujące w środowiskach bogatych w polisacharydy, są zdolne do syntezy i wydzielania znacznych ilości amylaz; jest to wykorzystywane przy technicznym ich otrzymywaniu.
WYKONANIE ĆWICZENIA
Sprzęt:
statyw z probówkami,
pipety,
łaźnie wodne o temperaturze 0oC, 18 oC, 37 oC, 45 oC, 60 oC.
Materiał i odczynniki:
0,5% roztwór skrobi,
bufor fosforanowy pH 6,6,
1% roztwór NaCl,
odczynnik Lugola (roztwór I2 w KI)
1M HCl,
1M NaOH.
Wykonanie ćwiczenia:
Zadanie 1. Oznaczanie aktywności -amylazy w ślinie.
Przygotować statyw z probówkami zawierającymi po 0,5 ml odczynnika Lugola i 0,5 ml 1M HCl.
W kalibrowanej probówce (1) zebrać około 2 ml śliny i rozcieńczyć ją wodą do objętości 20 ml, wymieszać i odstawić do łaźni wodnej o temperaturze 37oC.
Do zwykłej probówki (2) odmierzyć: 5 ml skrobi, 2 ml 1% roztworu NaCl, 2 ml buforu fosforanowego, zamieszać i umieścić w łaźni wodnej o temperaturze 37oC na 5 minut.
Po 5 minutach do probówki (2) dodać pipetą 1 ml roztworu śliny, zamieszać, zanotować czas i ponownie wstawić do łaźni wodnej. W krótkich odstępach czasu (od 30s do 3 min) do probówek w statywie, zawierających płyn Lugola, wprowadzać pipetą próbki hydrolizatu z probówki (2). Obserwować przebieg reakcji barwnej z jodem. Zanotować czas, po którym pobrana próbka nie zmienia barwy jodu- punkt achromowy.
Podać aktywność amylazy w ślinie w jednostkach / ml. W tym ćwiczeniu za jednostkę aktywności amylazy przyjmujemy taką ilość enzymu, która hydrolizuje 25 mg skrobi w czasie 10 minut w temperaturze 37oC, w pH 6,6 w obecności jonów chlorkowych do produktów nie dających barwy z jodem - punkt achromowy.
Przykład obliczenia:
Jeśli do oznaczenie pobrano 1 ml stokrotnie rozcieńczonej śliny, a punkt achromowy osiągnięto po 8 minutach to aktywność amylazy wynosi: 10/8 x 100 = 125 jednostek / ml.
Zadanie 2. Wpływ jonów chlorkowych na aktywność -amylazy.
Jon chlorkowy jest aktywatorem -amylazy. Oznaczyć punkt achromowy jak w zadaniu 1 zastępując w probówce (2) chlorek sodu wodą destylowaną.
Zadanie 3. Wpływ temperatury na aktywność -amylazy.
Do czterech probówek odmierzyć po 5 ml skrobi, 2 ml buforu i 2 ml NaCl. Każdą probówkę umieścić w innej łaźni i po 5 minutach dodać do każdej po 1 ml roztworu śliny, zamieszać i oznaczyć punkty achromowe analogicznie jak w zadaniu 1.
Podać optymalna temperaturę dla -amylazy.
Zadanie 4. Wpływ silnych kwasów i zasad na aktywność -amylazy.
Do trzech probówek odmierzyć po 1 ml roztworu śliny. Do pierwszej dodać 1 ml wody, do drugiej 1 ml 1M HCl, do trzeciej 1 ml 1M NaOH, zamieszać i umieścić w łaźni wodnej o temperaturze 37 oC. Po 15 minutach zawartość probówek zobojętnić wobec papierka wskaźnikowego (odpowiednio zasadą sodową lub kwasem solnym) i uzupełnić objętość buforem do 5 ml. Do trzech następnych probówek odmierzyć po 2 ml skrobi, 1 ml NaCl, 1 ml buforu pH 6,6. Do pierwszej probówki dodać 1 ml śliny rozcieńczonej wodą, do drugiej 1 ml śliny traktowanej kwasem, a do trzeciej 1 ml śliny traktowanej zasadą. Probówki ponownie umieścić w łaźni wodnej i oznaczyć aktywność -amylazy.
Wyszukiwarka
Podobne podstrony:
9) Oznaczanie aktywności enzymów amylolitycznych
Oznaczanie aktywności enzymów lipolitycznych
Wykrywanie obecności enzymów, Biotechnologia, laborki
3-Aktywność-enzymów-materiały, Biotechnologia SGGW
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Oznaczanie Cu, Materiały - Biotechnologia
Kraking katalityczny – oznaczanie aktywności katalizatorów metodą UOP
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
Spektrofotometryczna metoda oznaczania aktywności peroksydazy
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
biochemia III, Czynniki warunkujące aktywność enzymów
Aktywność enzymów przy niedoborze żelaza
Ćwiczenie 6 Oznaczanie aktywności katalazy
więcej podobnych podstron