
Leki w leczeniu
chorób
neurologicznych
dr hab. med. Ivan Kocić, prof.
nzw.
Katedra i Zakład Farmakologii
AMG

Podział
Choroba Parkinsona
Padaczka
MS
Alzheimer

Leczenie choroby
Parkinsona
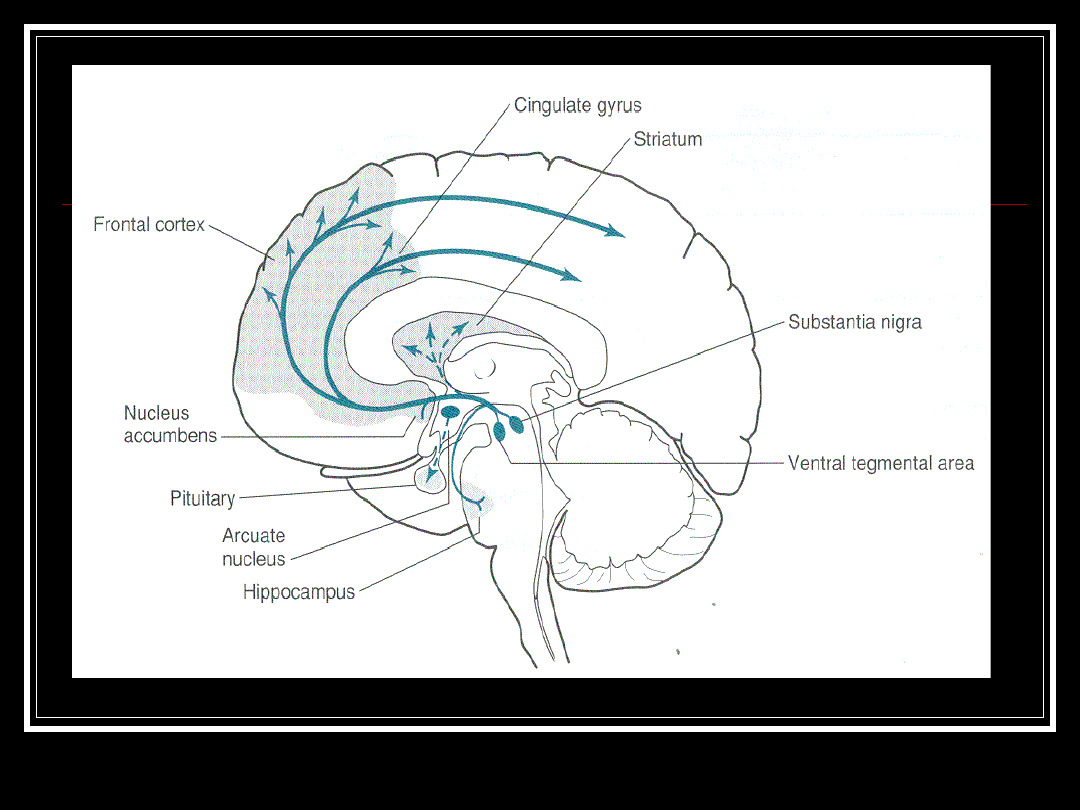
Zwyrodnienie neuronów dopaminergicznych
w obrębie istoty czarnej (3% osób>70r )
Zaburzenia motoryczne, wegetatywne,
psychiczne, typowa sylwetka, maskowata
twarz
Zaburzona równowaga pomiędzy DP (-
objawy negatywne), AcH (+ objawy
pozytywne) i GLT

Leczenie farmakologiczne
Dodawanie L-DOPY
Hamowanie metylacji DP i L-DOPA-COMT
inhibitory
Inhibitory MAO-II
Stymulacja receptorów D
Blokowanie receptorów NMDA (Amantadyna)
Blokowanie receptorów muskarynowych w
OUN

L-DOPA
MADOPAR, SINEMET
Crosses the brain-blood barrier, eners DA neurons and is
converted to DA
75% of PD patients have 50% reduction of symptoms
Only 1% of L-DOPA given orally reaches CNS!!(DOPA-
decarboxilase)
Addition of the inhibitors of L-DOPA degradation
peripheraly-increases amount of L-DOPA in brain by about
10-folds!

L-DOPA cont.
It is not first chois drug (MAO-inhibitors, amantadine,
stimulators of DA receptors)
Side effects:
GI: nausea, vomiting, abdominal pain,
CVS: arrhythmias, palpitation,
Retention of urin
Glaucome
Starting dose: 3x 125mg to 3x250mg gradually!!!
L-DOPA honeymoon (3-5 years of treatment)
Slow release L-DOPA: Madopar; Sinemet:

Late complications
A. Motor complications:
Fluctuations-”wearing-off”, „on-off”
Dyskinesia
B. Psychiatric complications
Treatment: Drug-holiday, adding COMT inhibitors, s.c.
Apomorphine, DA agonists

Bromocriptine
PARLODEL, MEDOCRIPTINE
D2 agonist+D1 partial antagonist, given only with L-DOPA
when „wearing-off” starts
Starting dose 1.25 mg 2-3x a day up to 30 mg a day!
Should be ingested during meals
Side effect: PLEURAL FIBROSIS

Pergolide
PERMEX
D1, D2 and D3 agonist, 10 fold more efficient then
bromocriptine, half-life 27h, starting dose 0.05mg up to 3
mg daily in 3 doses divided
Monotherapy anf ‘add-on” therapy of PD

Pramipexol
MIRAPEXIN
D2 and D3 stimulator
Monotherapy and „add=on” therapy
Well tolerated, only hypotension and insomnia
Doses: 0.125 mg twice daily up to 4.5 mg

MAO-B inhibitor
Selegiline (DEPRENYL, JUMEX)
Recommended for starting PD treatment, inhibition of DA
degradation and Da reuptake from synaptic cleft
Doses: 5 to 10 mg a day (monotherapy or as add to L-
DOPA)

COMT-inhibitors
TOLCAPONE (TASMAR)
ENTECAPONE (COMTAN)
Particularly active in intestine and blood vessels, prevented
DOPA-degradation and production of toxic metabolites!!
TASMAR removed from market because of hepatotoxicity!!
Optimal as addition to L-DOPA when reduction of its doses
is necessary!
SIDE EFFECTS: orange coloured urin, nausea, vertigo!

ANTICHOLINERGIC
AGENTS
Less effective than DA-drugs, but useful in patients without
benefit with DA-DRUGS
Improvement of about 20% in PD
Not recommended in patients over 65 years and with
mental deterioration
Reduces tremor
WARNING: Withdrawal of A-CH drugs must be graduall

Amantadine
PK-MERZ
Always effective against PD
Tablets (6 a day: 3-2-1) and infusion (500 ml)
Mechanism of action:
A)NMDA agonist
B) SRI
C) moderate A-Ch
D) change sensitivity of DA receptors
Affects rigidity and akinesia more than tremor

Leki przeciwpadaczkowe
Ujawnia się w sposób napadowy, ma
przebieg przewlekły, -zwiększona
pobudliwośc ośrodkowych neuronów,
obniżony próg drgawkowy.
0,5 do 1%, do 10r 50%, do 20 75% się
ujawnia (LQT?)
Przyczyny: defekty genetyczne, urazy
okołoporodowe, guzy mózgu, zatrucia i
zapalenia mózgu

Podział
Napady uogólnione (petit mal:
absence i impulsive, grand mal-fazy)
napady częściowe: proste i złożone

LEKI
Wprowadzenie leków powoli, monitorowanie
stanu klinicznego i stężenia leków w osoczu
-blokowanie kanałów sodowych zależnych
od potencjału
-nasilenie działania GABA
Blokowanie kanałów Ca2+
Zapobieganie uwalnianiu się pobudzajacych
AK, jak GLT i ASP
Hamowanie przekażnictwa
glutaminergicznego-receptor NMDA
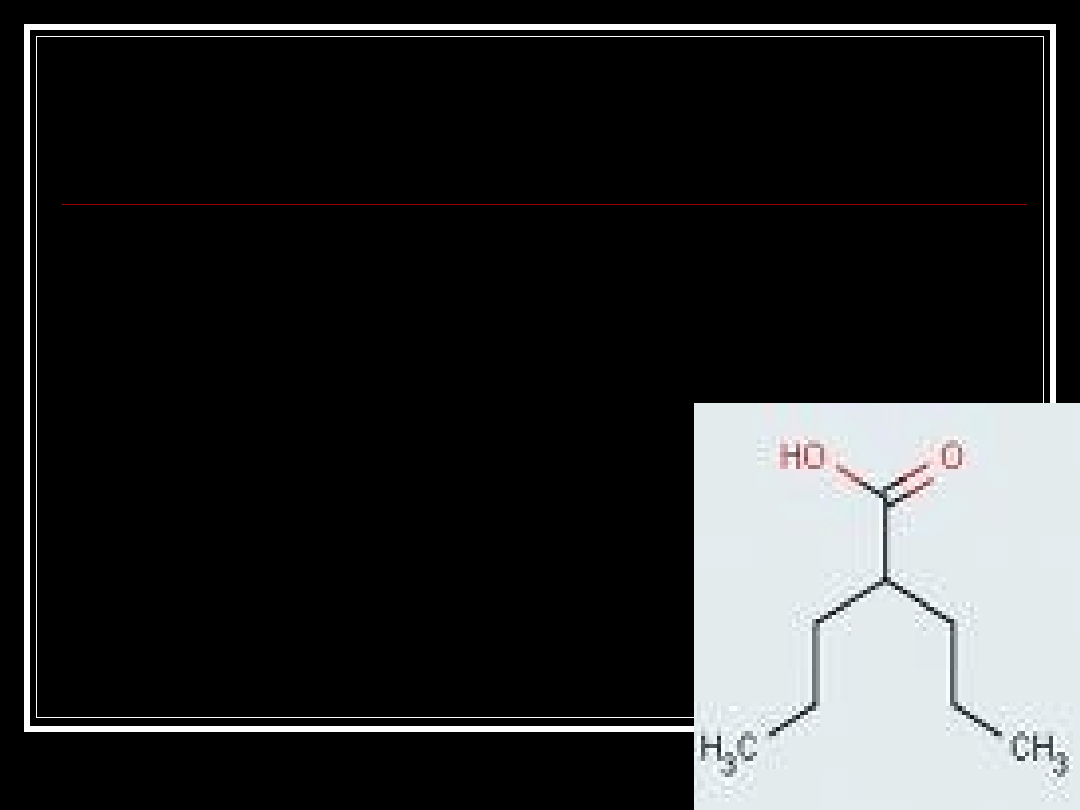
Kwas Walproinowy
Valproic acid, VALPORAL
Sól sodowa – APILEPSIN, DEPAKINE,
VUPRAL
Sól magnezowa – DIPROMAL
Amid - DEPOMIDE

Kwas Walproinowy
•
zwiększa stężenie GABA w mózgu,
zwiększając stężenie dekarboksylazy
glutaminowej oraz hamując aktywność
transaminazy GABA i dekarboksylazy
aldehydu bursztynowego;
•
nie indukuje enzymów i w odróżnieniu
od fenobarbitalu i fenytoiny nie wpływa
na metabolizm innych leków;

Kwas Walproinowy
•
jest metabolizowany w wątrobie;
•
czas połowicznej eliminacji wynosi ok.
15h (może być zredukowany przy
jednoczesnym podaniu innych środków
przeciwpadaczkowych);
•
w terapii padaczki poziom
terapeutyczny wynosi 30-100 µg/l;

Kwas Walproinowy –
Działania
niepożądane
•
jego interakcje z innymi lekami mogą
być związane z konkurencją o wiązanie
z białkami np. przyjmowanie fenytoiny i
dodatkowe leczenie kwasem
walproinowym może prowadzić do
efektów toksycznych.
•
w porównaniu z fenytoiną,
w porównaniu z fenytoiną,
fenobarbitalem i benzenodiazepinami
fenobarbitalem i benzenodiazepinami
wykazuje względny brak działania
wykazuje względny brak działania
uspokajającego oraz wpływu na
uspokajającego oraz wpływu na
świadomość i zachowanie;
świadomość i zachowanie;

Kwas Walproinowy –
Działania
niepożądane
•
może pojawić się senność, niepokój,
rozdrażnienie, przemijające drżenie
pozycyjne;
•
przyrost masy ciała;
•
nudności i uczucie dyskomfortu w
przełyku (można usunąć stosując
tabletki rozpuszczalne w jelitach);
•
zdarza się wypadanie włosów (mogą
odrosnąć loki);
•
zmniejszenie liczby płytek krwi i ich
agregacja, może dojść do łagodnych
krwawień;

Kwas Walproinowy –
Działania
niepożądane
•
rzadkie przypadki idiosynkrazji, gdy
reakcje metaboliczne prowadzą do
uszkodzenia wątroby lub rzadziej –
zapalenia trzustki (dotyczy dzieci
poniżej 3 r.ż. z zaburzeniami
metabolicznymi, uszkodzeniami mózgu,
chorobami wątroby);
•
w terapii pochodnymi kwasu
walproinowego może dojść do
hiperamonemii (zatrucie amonowe), co
prowadzi do utraty świadomości,
wymiotów i ataksji.

Kwas Walproinowy
Kwas Walproinowy
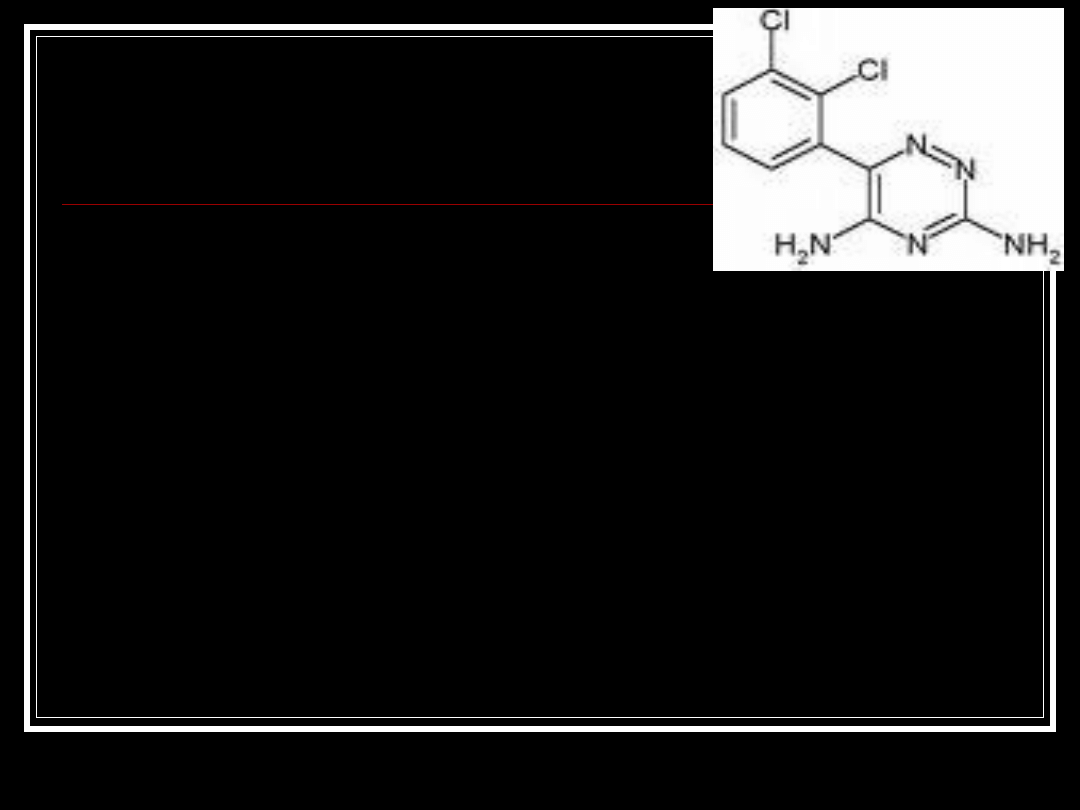
Lamotrygina
Lamotrygina
•
Lamotrygine, LAMICTAL;
•
hamuje uwalnianie glutaminianu,
blokując kanał sodowy, zależny od
potencjału błony presynaptycznej;
•
nie ma wpływu na kanały potasowe;
•
uważa się, że wpływa też na kanały
wapniowe,
•
po podaniu doustnym resorbuje się
szybko i całkowicie bez efektu
pierwszego przejścia;

Lamotrygina
Lamotrygina
•
maksymalne stężenie w osoczu po 2-3
h;
•
biodostępność: 98%, a wiązanie z
białkami: 55%;
•
7% dawki wydalane jest z moczem w
postaci niezmienionej;
•
w wątrobie powoli metabolizuje;
•
główny metabolit: 2-N-glukoronid (80%
dawki), wydalany przez nerki;

Lamotrygina
Lamotrygina
•
okres połowicznej eliminacji: 24-30 h (w
przypadku monoterapii);
•
fenytoina i karbamezapina skracają
czas eliminacji i indukują metabolizm
lamotryginy;
•
kwas walproinowy hamuje metabolizm
lamotryginy;

Zalety lamotryginy:
Zalety lamotryginy:
•
szybka i całkowita biodostępność po
podaniu doustnym;
•
liniowa kinetyka;
•
nie hamuje i nie indukuje metabolizmu
wątrobowego;
•
jest oceniana jako obiecujący lek
przeciwpadaczkowy o niewielkiej
toksyczności i nieistotnym działaniu
uspokajająco – nasennym.

Lamotrygina
Lamotrygina
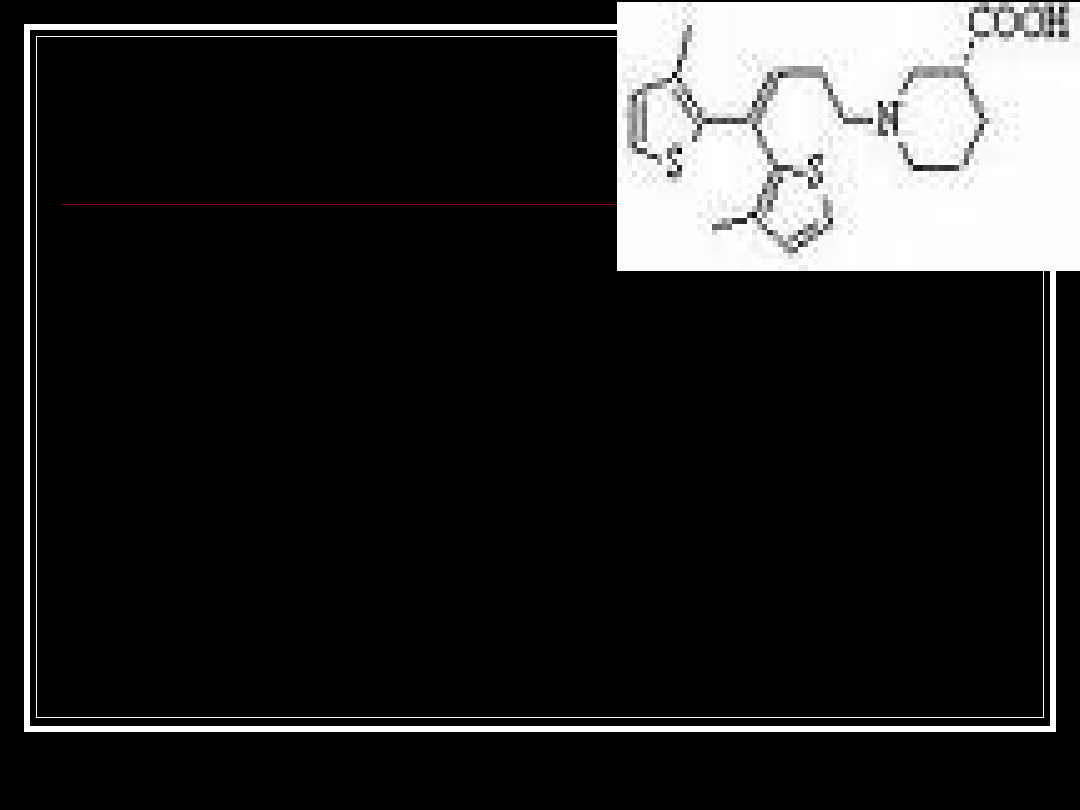
Tiagabina
Tiagabina
•
Tiagabine, GABITRIL,
•
hamuje specyficzne wychwytywanie
zwrotne GABA w neuronach i
komórkach glejowych, wiążąc się z
przenośnikiem GABA; przy czym sama
nie jest substratem dla GABA;
•
po podaniu doustnym resorbuje się
szybko i całkowicie;

Tiagabina
Tiagabina
•
Biodostępność wynosi 89%;
•
Wykazuje wysokie wiązanie z białkiem
(96%);
•
W wątrobie ulega biotransformacji pod
wpływem cytochromu P450-3A;
•
Jej metabolity wydalane są z moczem;
•
Okres półtrwania w osoczu wynosi 7-
9h.

Tiagabina-
Tiagabina-
działania
działania
niepożądane
niepożądane
zawroty głowy
senność i astenia
labilność emocjonalna
drżenie
biegunka
wybroczyny na skórze
przeciwwskazana w ciężkich
zaburzeniach pracy wątroby

Tiagabina
Tiagabina
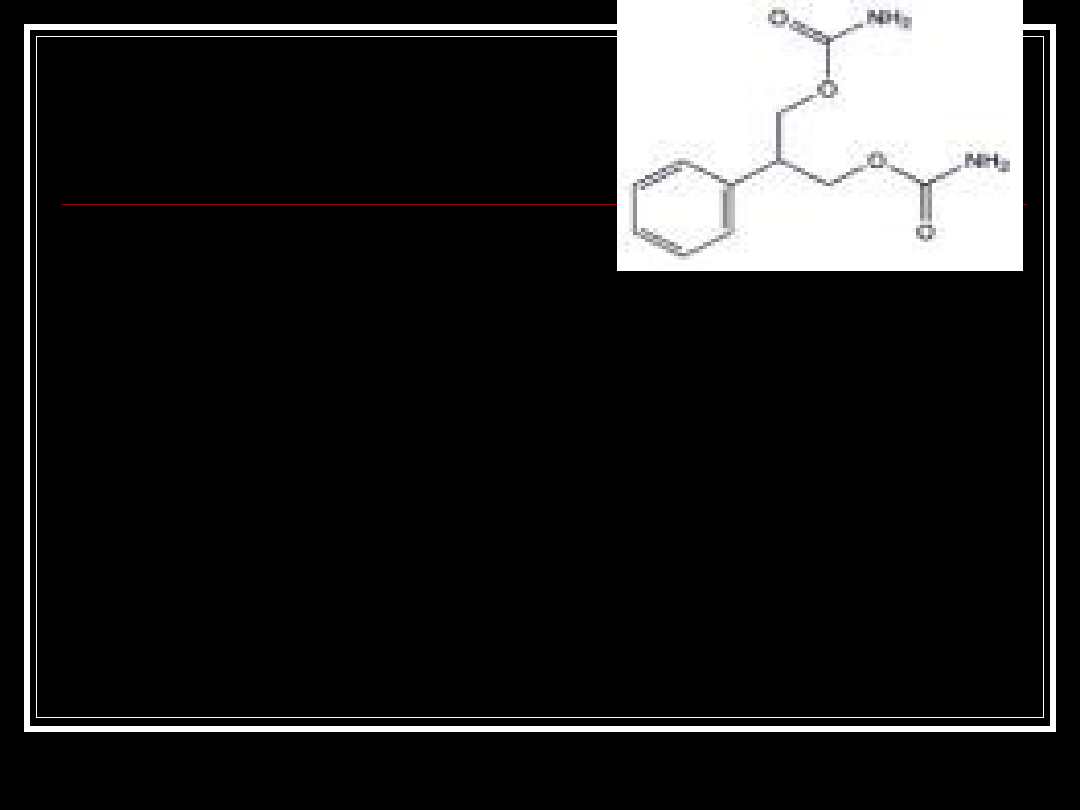
Felbamat
Felbamat
Felbamate, TALOXA
jest lekiem p/padaczkowym II rzutu,
stosowanym przy braku leczenia
alternatywnego
dokładny mechanizm działania –
nieznany
lek uzupełniający u chorych z
zespołem Lennoxa-Gastauta

Felbamat –
działania
niepożądane
hepatotoksyczność i niedokrwistość
plastyczna (w 30% kończą się zgonem)
znużenie
zawroty i bóle głowy
ataksja
zaburzenia snu
przed i w trakcie leczenia należy
kontrolować obraz krwi i czynność
wątroby
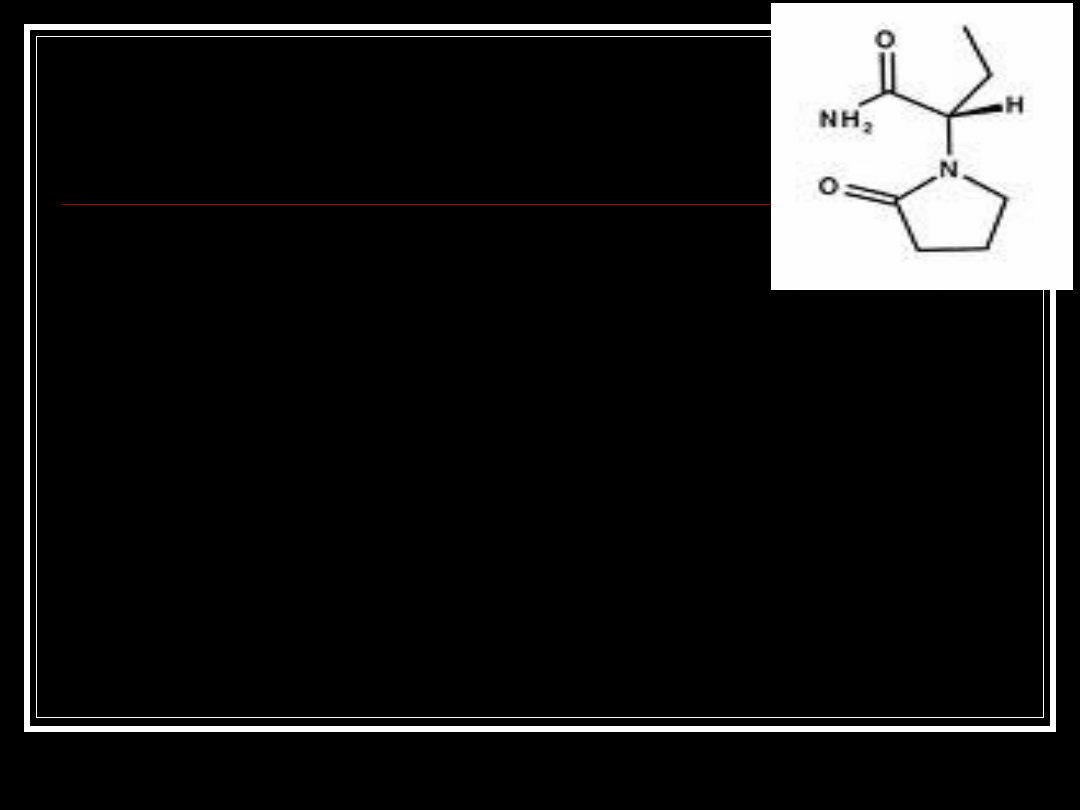
Lewetiracetam
Lewetiracetam
Levetiracetam, KEPPRA
pochodna piracetamu
przeznaczony do terapii uzupełniającej
częściowych ataków epileptycznych u
dorosłych
mechanizm działania nieznany
nie jest metabolizowany przez
wątrobowy układ CYP-450
Lewetiracetam
Lewetiracetam

Influence on Hepatic
Metabolism
1st Generation antiepileptic drugs
Inducers
Phenobarbital
Phenytoin
Carbamazepine
Inhibitor
Valproate

Newer Formulations of 1
st
Generation AEDs
Phenytoin
Phenytek
Carbamazepine
Carbatrol
Tegretol XR
Valproic Acid
Depakote ER
Diazepam
Diastat

Desirable AED Properties
Desirable AED Properties
Specific MOA
Simple
Pharmacokinetics
Broad Spectrum
Excellent
Tolerability
No Tolerance
and/or Withdrawal
effects
No Therapeutic
Monitoring
No Drug
Interactions
Parenteral Form
Low Cost

Topiramate (TPM,
Topamax
®
)
Mechanisms - many
Na
+
Channels, Glutamate, GABA, CAI
Dose (200 to 400 mg/day [BID - QD
renal
])
Side Effects
Sedation, Difficulty Concentrating, Kidney Stones,
Glaucoma
Drug Interactions
“one way street”
Clinical Pearl
ceiling dose, fluids, visual changes, use outside of
epilepsy

Tiagabine (TGB, Gabitril
®
)
Mechanism
Blocks re-uptake of pre-synaptic GABA
Dose (32 to 56 mg/day [BID to QID])
Side Effects
Fatigue, Dizziness, Weakness
Drug Interactions
“one-way street”
Clinical Pearl
different mechanism of action
take with food to decrease side effects (same AUC)

Zonisamide (ZNS,
Zonegran
®
)
Mechanism
Na+ and T-calcium channels, CAI
Dose: 100 to 600 mg/day (BID or QD)
Side Effects:
somnolence, dizziness, nausea, headache,
agitation/irritation, kidney stones, weight loss
Drug Interactions
No effect on others
Clinical Pearl
Appr. Japan & Korea ‘89, Sulfonamide
Use outside of epilepsy

Summary of 2
nd
Generation
AEDs
Safer
More expensive
May help with intractable partial
seizures
Not profoundly more potent
Less drug interactions

Effects of AEDs on Hormonal
Contraception
Decreased
Hormone
Concentration
Carbamazepine
Felbamate
Oxcarbazepine
Phenobarbital
Phenytoin
Primidone
Topiramate
High > Low dose
No Effect on
Hormone
Concentration
Gabapentin
Lamotrigine
Levetiracetam
Tiagabine
Valproic Acid
Zonisamide(?)

AEDs usage
A. Generalized tonic-clonic
PHT, CBZ, VA
B. Absence seizures
ETH, VA
C. Myoclonic syndromes
VA
D Status epilepticus
Diazepam, lorazepam,phenytoin, phenobarbital

Pearls for this Case
Pearls for this Case
Treat the patient, not the lab
Women’s Issues
Drug interaction with OCs
Teratogenicity/Folic acid
Dosing interval can be key
Previous AED history is important
Factor in patient’s quality of life

Treatment of Alzheimer’s
Disease
Improving Symptoms
Cholinesterase inhibitors
Aricept, Exelon, Reminyl
Memantine
(submitted to FDA)
Psychotropic drugs for
behavior
Behavioral management
Family support
Slowing Progression
Anti-oxidants
(vitamin E)
Anti-inflammatory drugs
(Viox)
Hormones
(estrogen)
Neuroprotective agents
(NGF)
Reducing vascular risk
statins, homocysteine
reduction
Delaying AD in MCI
Cholinesterase inhibitors
Aricept, Exelon, Reminyl
Antioxidants
(Vitamin E)
Anti-inflammatory drugs
(Viox)
Prevention
Antioxidants
(Ginkgo biloba)
Anti-inflammatory drugs
(ADAPT)
-amyloid antagonists
secretase inhibitors
anti-aggregation compounds
amyloid vaccines
Anti-neurofibrillar drugs
Genetic engineering
(Ferris, 8/03)

Cholinesterase Inhibitors for
AD
FDA
Approved
Current
trials
Cognex
(Parke-Davis)
Aricept(Eisai/Pfizer)
Exelon (Novartis)
Reminyl
(Janssen)
Phenserine (Axonyx)
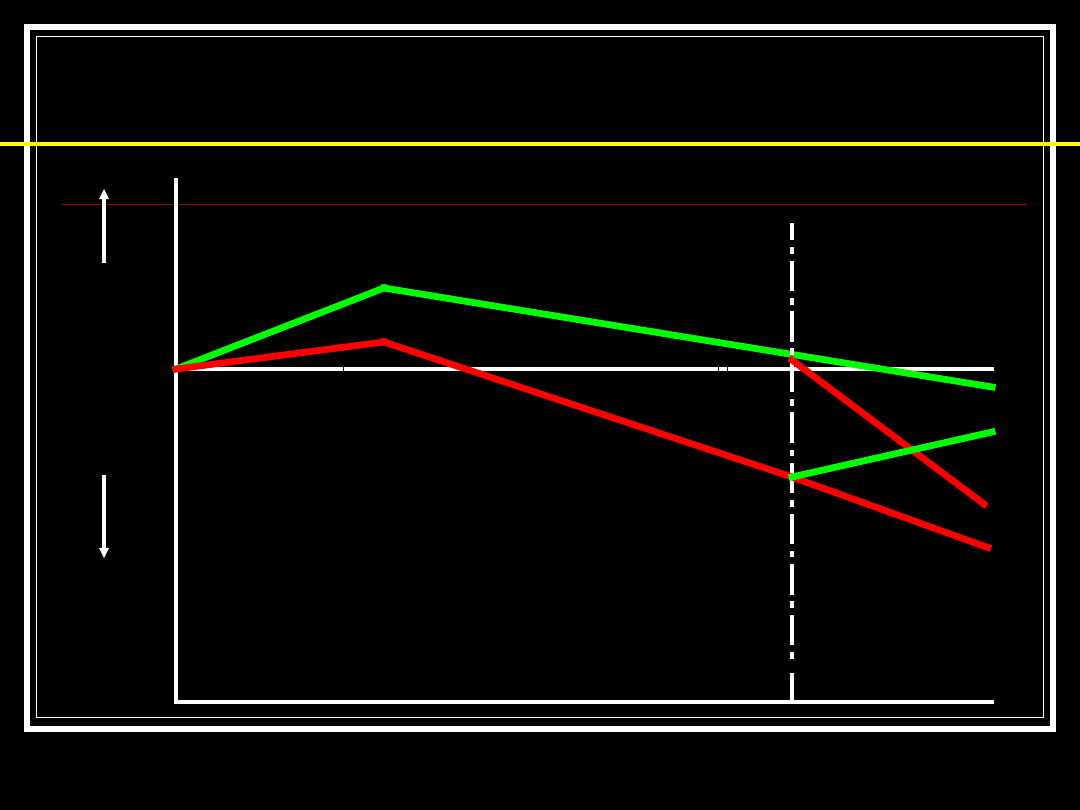
Benefit of Cholinesterase
Inhibitors
6 months
Improv
ed
Wors
e
Cognition
Global
change
Functionin
g
Behavior
AChEI
Placebo

Memantine
A new mechanism: inhibits glutamate
neurotransmitter system (NMDA
receptor)
Large positive U.S. trial coordinated by
NYU ADRC
Approved in Europe for moderate to
severe Alzheimer’s disease
Effective in combination with Aricept
Approval for AD by FDA is pending
Current trials in mild-moderate AD

MS Therapy: Decades of
Achievement
1960s
Ø
1970s
ACTH and Steroids Established
1980s
Trials of Immunosuppressants
Cyclophosphamide (IV & oral)
Cyclosporine
Azathioprine (Imuran)
Methotrexate
Early trials of interferons and glatiramer acetate
1980s-90sImmunomodulation
Beta interferon
Glatiramer acetate
Mitoxantrone

What Do We Know Now?
Most common neurological disease of
young adults
2/3 women
Mostly Caucasian
Autoimmune process
Demyelination and axonal loss

Assembling the Evidence
• 50% of individuals
with RR MS will be
SP after 10 years
• 90% + become SP
after 20 years
• 15 years after
diagnosis most
patients will
require
ambulatory
assistance
• 60% of MS
patients are
cognitively
impaired
• High MRI lesion at
onset leads to
earlier disability
• In CIS with MRI
lesion load >1.23
cc: 90%
developed
CDMS
52% EDSS
3.0

Recommendations for
DMDs
For relapsing-remitting multiple
sclerosis
Interferons
Type A recommendation
Glatiramer acetate
Type A recommendation

Comparative Studies
Comparative Studies

The Independent Comparison of
Interferon
(INCOMIN) Trial
The Independent Comparison of
Interferon
(INCOMIN) Trial
Durelli et al. Annual Meeting of the American Academy of Neurology. 2001.
Durelli et al. Annual Meeting of the American Academy of Neurology. 2001.
Study Design
•
Multicenter
•
Open-label-clinical
evaluations
•
Blinded MRI evaluations
•
2 arm, randomized
–
Betaseron
®
250 mcg
(8 MIU) SC QOD
(n=96)
–
Avonex
®
30 mcg (6
MIU) IM once weekly
(n=92)
Primary Outcome
Measures
Relapse-free patients
Patients without new
T2 lesions
Independent study
funded by the Multiple
Sclerosis Foundation of
Italy and the Italian
Ministry of Health

INCOMIN Trial
Clinical Results: 0-24 Months
INCOMIN Trial
Clinical Results: 0-24 Months
Avonex
®
Betaseron
®
Relative
(n=92)
(n=96)
Difference
p
No. relapse free
33 (36%)
49 (51%)
+29%
0.036
No. with relapses
59 (64%)
47 (49%)
-23%
0.036
No. with sustained
28 (30%)
13 (14%)
-53%
0.005
EDSS progression
No. without progression 64 (70%)
83 (86%)
+19%
0.005
Avonex
®
Betaseron
®
Relative
(n=92)
(n=96)
Difference
p
No. relapse free
33 (36%)
49 (51%)
+29%
0.036
No. with relapses
59 (64%)
47 (49%)
-23%
0.036
No. with sustained
28 (30%)
13 (14%)
-53%
0.005
EDSS progression
No. without progression 64 (70%)
83 (86%)
+19%
0.005
Durelli et al. 17th Congress of the European Committee for Treatment and Research in
Multiple Sclerosis, 2001.
Durelli et al. 17th Congress of the European Committee for Treatment and Research in
Multiple Sclerosis, 2001.

INCOMIN Trial
MRI Results: 0-24 Months
INCOMIN Trial
MRI Results: 0-24 Months
Avonex
®
Betaseron
®
Relative
(n=73)
(n=76)
Difference
p
No. new lesion free (T2)*19 (26%) 42 (55%)
+53%
0.0003
No. MRI activity free
18 (25%)
39 (51%)
+51%
0.0008
(Gd-enhancing and T2)*
Avonex
®
Betaseron
®
Relative
(n=73)
(n=76)
Difference
p
No. new lesion free (T2)*19 (26%) 42 (55%)
+53%
0.0003
No. MRI activity free
18 (25%)
39 (51%)
+51%
0.0008
(Gd-enhancing and T2)*
*Scans performed at 1 and 2 years.
Durelli et al. 17th Congress of the European Committee for Treatment and Research in
Multiple Sclerosis, 2001.
*Scans performed at 1 and 2 years.
Durelli et al. 17th Congress of the European Committee for Treatment and Research in
Multiple Sclerosis, 2001.

EVIDENCE Trial
Rebif
®
vs Avonex
®
EVIDENCE Trial
Rebif
®
vs Avonex
®
Serono press release. June 2001.
Serono press release. June 2001.
Study Design
677 patients with
RR MS
Rebif
®
44 mcg (8.8
MIU) 3 times
weekly or
Avonex
®
30 mcg (6
MIU) once weekly
for 6 months
Outcome Measures
Primary: relapse-
free patients
Secondary:
combined unique
lesion activity,
relapse rate, and T2
MRI activity

Proportion with relapses
-32%
0.0005
Relapse rate
-27%
0.022
Steroid use for relapses
-47%
0.004
Time to first relapse
-37% HR
0.001
Proportion with relapses
-32%
0.0005
Relapse rate
-27%
0.022
Steroid use for relapses
-47%
0.004
Time to first relapse
-37% HR
0.001
EVIDENCE Trial
Clinical Results: 6 Months
EVIDENCE Trial
Clinical Results: 6 Months
Relative
Difference
p value
Relative
Difference
p value

Comparing Immunotherapies
Treatment vs No Treatment
Comparing Immunotherapies
Treatment vs No Treatment
Study Design
• Prospective, controlled, open label
• 156 patients, choice of therapy
– No treatment (control)
– Avonex
®
30 mcg (6 MIU) once weekly
– Betaseron
®
250 mcg (8 MIU) every other day
– Copaxone
®
20 mg daily
• Study duration 12 months
Study Design
• Prospective, controlled, open label
• 156 patients, choice of therapy
– No treatment (control)
– Avonex
®
30 mcg (6 MIU) once weekly
– Betaseron
®
250 mcg (8 MIU) every other day
– Copaxone
®
20 mg daily
• Study duration 12 months
Khan et al. Eur J Neurol. 2001;8:141-148.
Khan et al. Eur J Neurol. 2001;8:141-148.
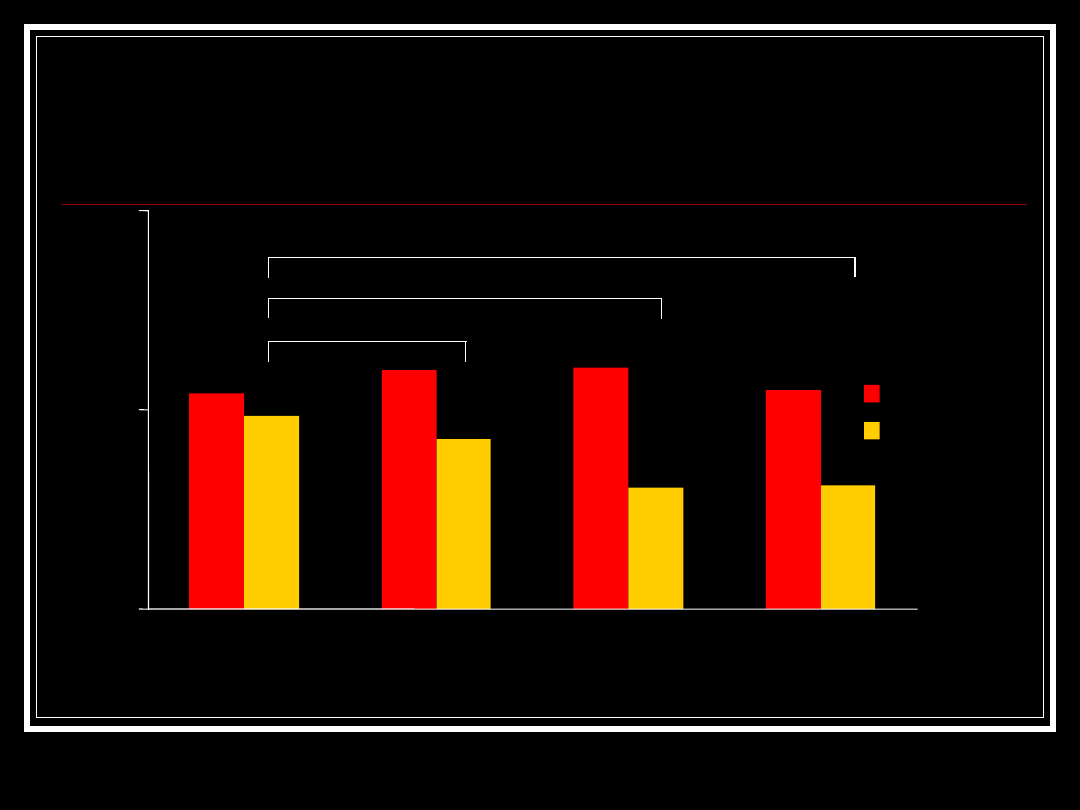
Comparing Immunotherapies
Treatment vs No Treatment
Khan et al. Eur J Neurol. 2001;8:141-148.
Khan et al. Eur J Neurol. 2001;8:141-148.
0.0
1.0
2.0
No Rx
Avonex
®
Betaseron
®
Copaxone
®
Baseline
12 months
n=33
n=40
n=41
n=42
p=0.309
p=0.002
p=0.003
Relapse Rates for 12 Months
Relapse Rates for 12 Months
M
e
a
n
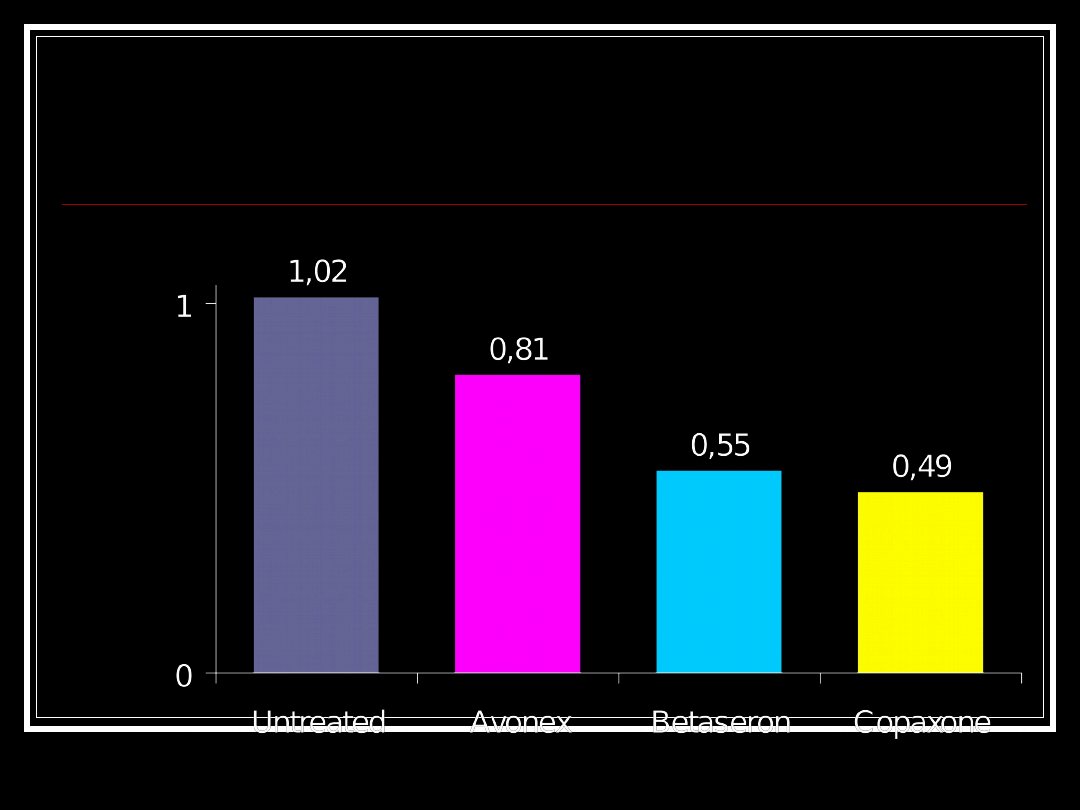
Wayne State Prospective Open Label
Comparative Trial:
Observed Relapses at 18 Months
Observation:
Treated vs Untreated
N
u
m
b
e
r
o
f
R
e
la
p
se
s
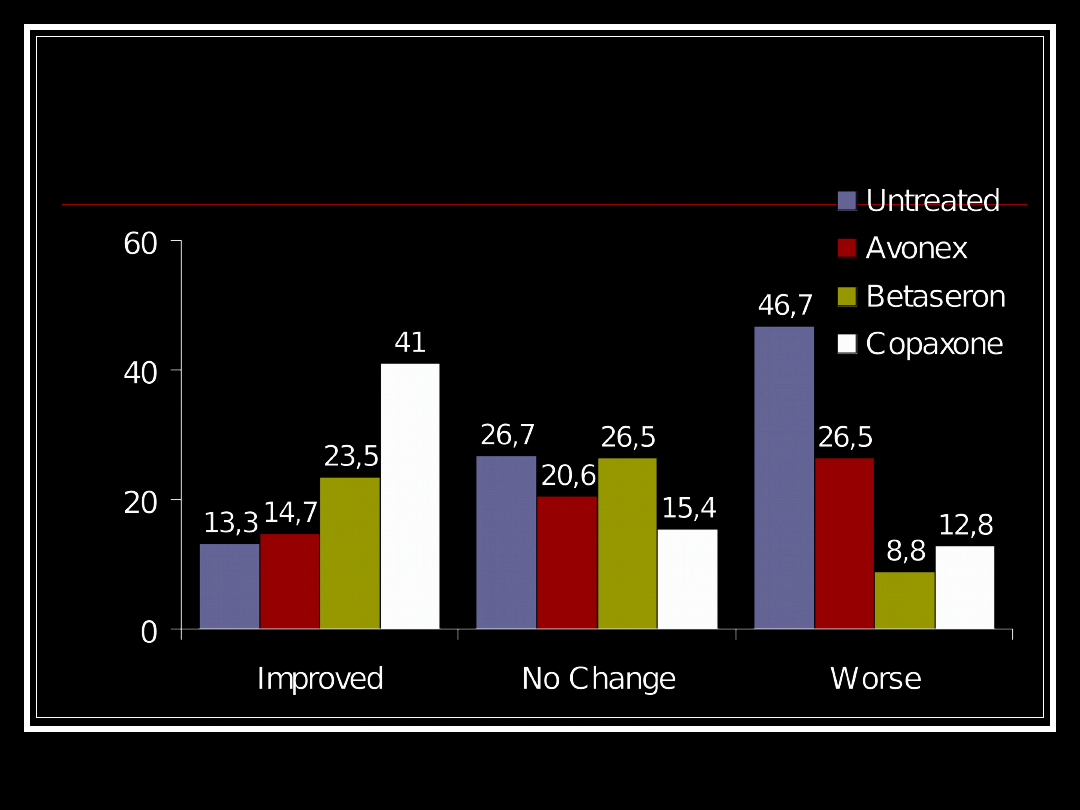
Wayne State Prospective Open Label
Comparative Trial:
Categorical Change in EDSS (Pre-
treatment to 18 Months)
Pe
rc
e
n
t
o
f
Pa
ti
e
n
ts
(B
a
se
lin
e
C
o
n
cl
u
si
o
n
)
Change in EDSS 1.0
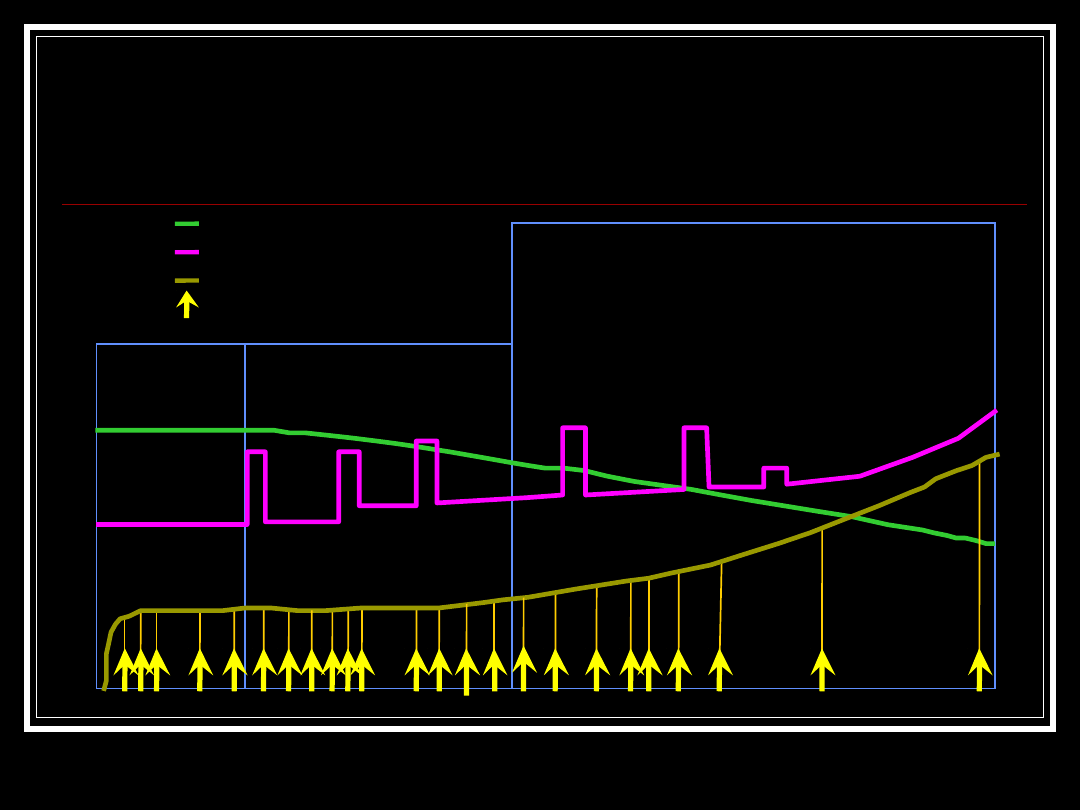
Natural History of MS
Relapsing-remitting
Relapsing-remitting
Secondary-progressive
Secondary-progressive
Preclinical
Preclinical
Time
Time
Measures of brain volume
Measures of brain volume
Relapses and impairment
Relapses and impairment
MRI burden of disease
MRI burden of disease
MRI activity
MRI activity
Adapted from DE Goodkin, MD. UCSF MS Curriculum. January 1999.
Adapted from DE Goodkin, MD. UCSF MS Curriculum. January 1999.

Interferon beta
Injection site reactions
Flu like symptoms
Elevation in liver enzymes
Anemia/Thrombocytopenia
Alteration in thyroid function
Depression
NAbs
Pregnancy category C
Adequate, well-controlled human studies are lacking and animal
studies have shown a risk to the fetus or are lacking as well. There is
a chance of fetal harm if the drug is administered during pregnancy,
but the potential benefits may outweigh the potential risk.

Glatiramer Acetate for Injection
Injection site reactions
Post-injection reaction
No long term toxicity
Pregnancy category B
No evidence of risk in humans. Adequate, well-
controlled studies in pregnant women have not shown
increased risk of fetal abnormalities despite adverse
findings in animals, or, in the absence of adequate
human studies, animal studies show no fetal risk. The
chance of fetal harm is remote, but remains a
possibility
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
Wyszukiwarka
Podobne podstrony:
Leki bilogiczne nowe możliwości leczenia chorób skóry
Leki stosowane w leczeniu chorób reumatycznych, farmakologia
WYKLAD 6 Leki roslinne stosowane w leczeniu chorob zoladka, jelit
WYKŁAD 6 Leki roślinne stosowane w leczeniu chorób żołądka, jelit
Leczenie chorób reumatycznych, Farmakologia, Farmakologia-leki stosowane w fizykoterapii
LEKI ROŚLINNE STOSOWANE W LECZENIU CHORÓB UKŁADU POKARMOWEGO
W25 SL W11 Leki stosowane w leczeniu chorób błon śluzowych jamy ustnej i przyzębia (Maja)
W06 SZ W06 Leki stosowane w leczeniu choroby wieńcowej (Marta E )
więcej podobnych podstron