
Kwasy karboksylowe
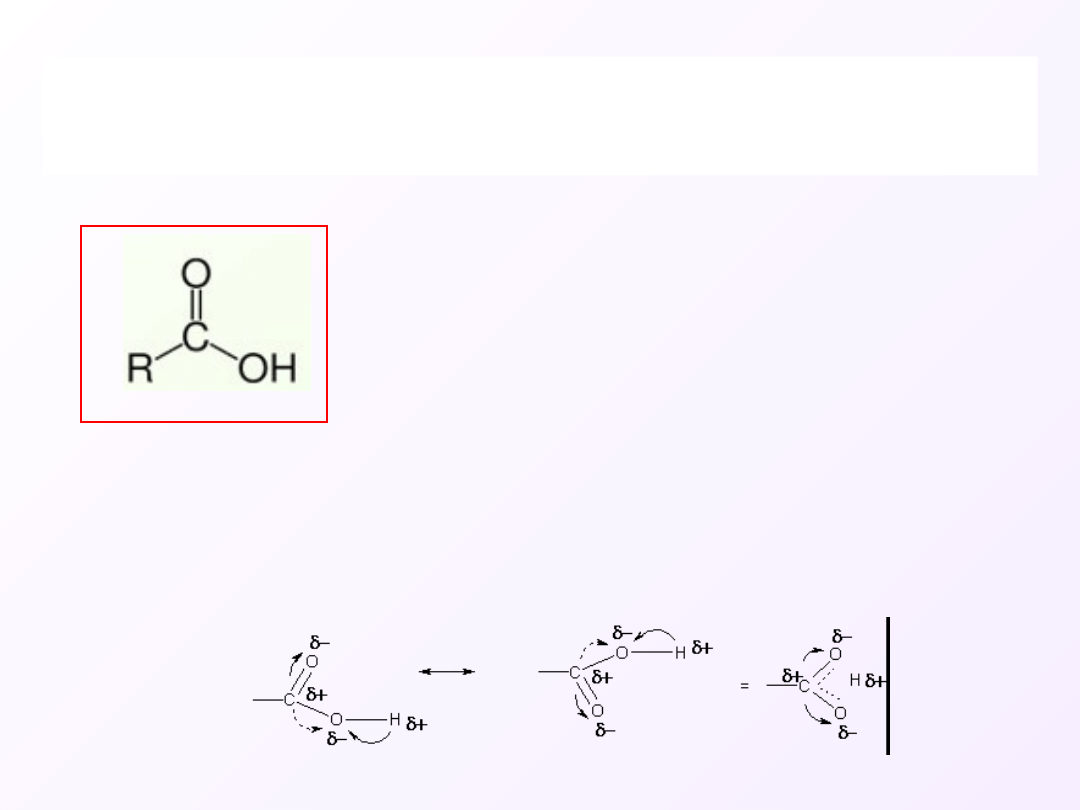
Kwasy karboksylowe to jednofunkcyjne pochodne
węglowodorów o grupie funkcyjnej -C
OOH
zwanej grupą
karboksylową
W skład grupy funkcyjnej -COOH
wchodzą: grupa karbonylowa C=O
i hydroksylowa -OH.
Własności kwasów karboksylowych wynikają w
znacznym stopniu z polarnego charakteru
grupy karbonylowej, co ułatwia dysocjację
układu O-H.
Wskutek bliskiego sąsiedztwa i
wzajemnego oddziaływania żadna z tych grup
nie zachowuje jednak swych niezależnych
cech.
Duża różnica elektroujemności atomów tlenu z jednej strony, a węgla i
wodoru z drugiej, powoduje powstanie polaryzacji wiązania O–H, dzięki
której nabiera ono w znacznym stopniu charakteru wiązania jonowego.

Podział kwasów
karboksylowych
1. Ze względu na ilość grup karboksylowych:
• kwasy jednokarboksylowe
• kwasy wielokarboksylowe
2. Ze względu na charakter i typ łańcucha węglowego:
• kwasy jednokarboksylowe alifatyczne
- kwasy alifatyczne nasycone
- kwasy alifatyczne nienasycone
• kwasy jednokarboksylowe cykliczne
- kwasy aromatyczne
- kwasy niearomatyczne
Tworzenie nazw polega na dodaniu do nazwy węglowodoru końcówki –
owy
i słowa kwas.
Szeroko stosowane są też tradycyjne nazwy zwyczajowe tych związków.
W nazewnictwie zwyczajowym kolejne atomy węgla sąsiadujące z
węglem grupy karboksylowej oznacza się kolejnymi literami greckimi
(α, β, γ itd.).
Atom węgla α w nazwie zwyczajowej odpowiada atomowi C-2 w nazwie
systematycznej.
C
C
C
C
C
C
O
OH
C
6
5
4
3
2
1
Jeśli zachodzi konieczność numeracji łańcucha, to grupa karboksylowa
otrzymuje zawsze lokant l, np.:
CH
3
CH(CH
3
)COOH - kwas 2-metylopropanowy (izomasłowy)
CH
3
CH=CHCOOH - kwas but-2-enowy
Na
z
ewnictwo

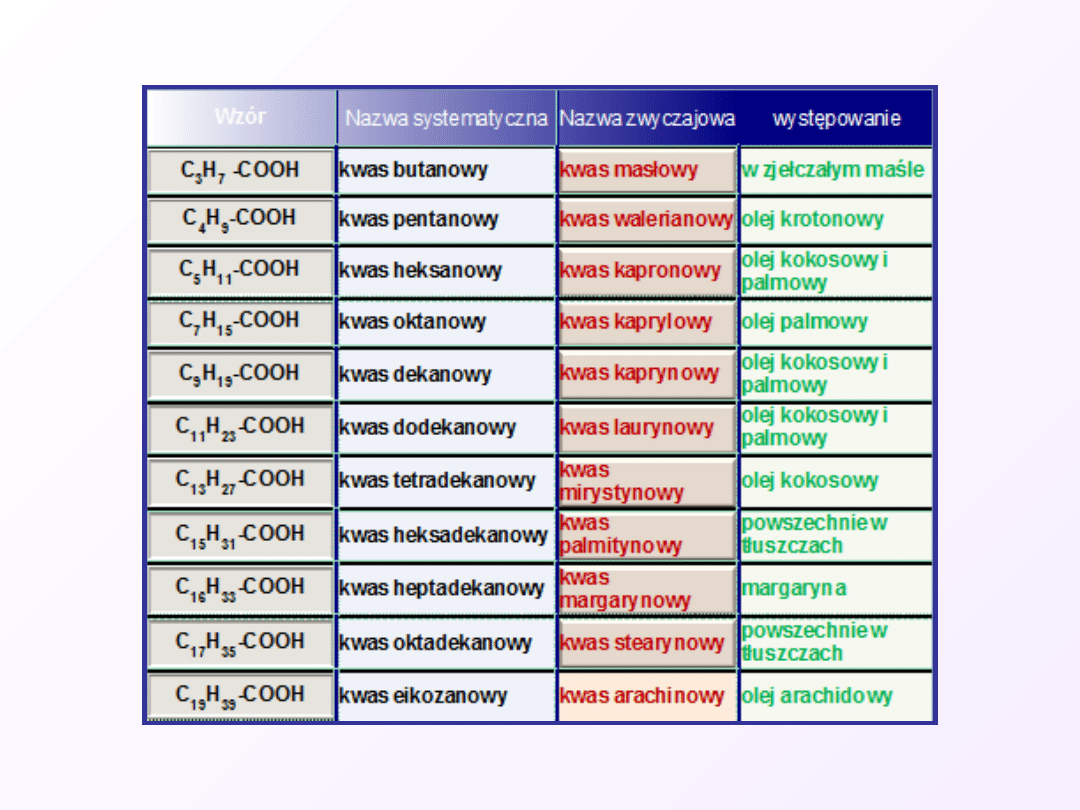
Najczęściej spotykane kwasy karboksylowe:
Wzór kwasu
Nazwa kwasu Wzór grupy acylowej Nazwa grupy acylowej
H-COOH
metanowy (mrówkowy) H-CO-
formyl
CH
3
-COOH
etanowy, (octowy)
CH
3
CO-
acetyl
C
2
H
5
COOH
propanowy, (propionowy) CH
3
CH
2
CO-
propionyl
CH3CH2CH2COOHbutanowy, (masłowy) CH3CH2CH2CO-
butyryl
C
OH
O
C
O
benzenokarboksylowy
(benzoesowy)
benzoil
C
OH
O
OH
2-hydroksybenzenokarboksylowy
(salicylowy)
Na
z
ewnictwo
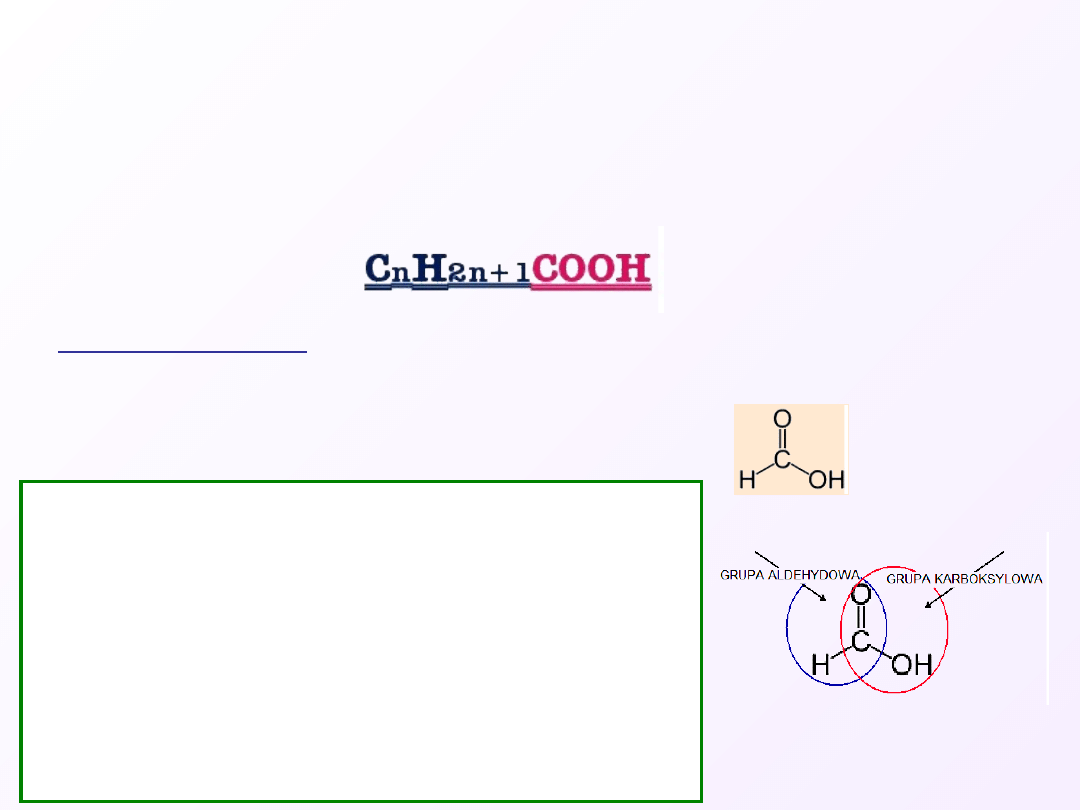
Są to kwasy w cząsteczkach których występuje jedna grupa funkcyjna –
COOH, a rodnik alkilowy jest nasycony.
Wzór ogólny
Kwas metanowy - mrówkowy
wzór sumaryczny: H
COOH
wzór strukturalny:
Zasługuje na szczególną uwagę, gdyż posiada
zarówno grupę karboksylową, jak i aldehydową.
Dzięki takiej budowie jest on jedynym kwasem
szeregu homologicznego wykazującym
właściwości redukujące.
( Daje pozytywny wynik próby Tollensa, z tym,
że srebro wytrąca się w postaci czarnego
osadu ,a kwas utlenia się do kwasu
węglowego(IV).
Kwasy monokarboksylowe alifatyczne
nasycone
Przykłady:

Cząsteczkę kwasu mrówkowego łatwo utlenić:
Silne środki odwadniające powodują rozpad na CO i H
2
O:
O
H
CO
HCOOH
2
2
[O]
O
H
CO
COOH
2
.)
(stęż
SO
H
4
2
Występowanie: w organizmach mrówek, w niektórych roślinach –
pokrzywa.
Otrzymywanie na skalę przemysłową:
Na sproszkowany wodorotlenek sodu działa się tlenkiem węgla (II) / pod
ciśnieniem i temp. 120 – 150
o
C/: NaOH + CO → HCOONa ( mrówczan
sodu)
Następnie na mrówczan działa się kwasem siarkowym(VI).
Kwas etanowy – octowy
wzór sumaryczny: CH
3
COOH
wzór strukturalny
:
Otrzymywanie:
Duże ilości otrzymuje się w wyniku suchej destylacji drewna.
Główna metoda: synteza kwasu z wody i acetylenu ( metoda
Kuczerowa).
Do celów spożywczych: w procesie fermentacji octowej
Wzór ogólny dla kwasów jednonienasyconych:
Kwas akrylowy (kwas prop-2-
enowy)
Ze względu na to, że łatwo polimeryzuje jest stosowany w
przemyśle do otrzymywania tworzyw sztucznych - poliakrylanów i
kwasu poliakrylowego oraz do produkcji żywic akrylowych.
C
2
H
3
COOH
CH
2
=CH
–COOH
Kwasy monokarboksylowe alifatyczne
nienasycone
Przykłady:
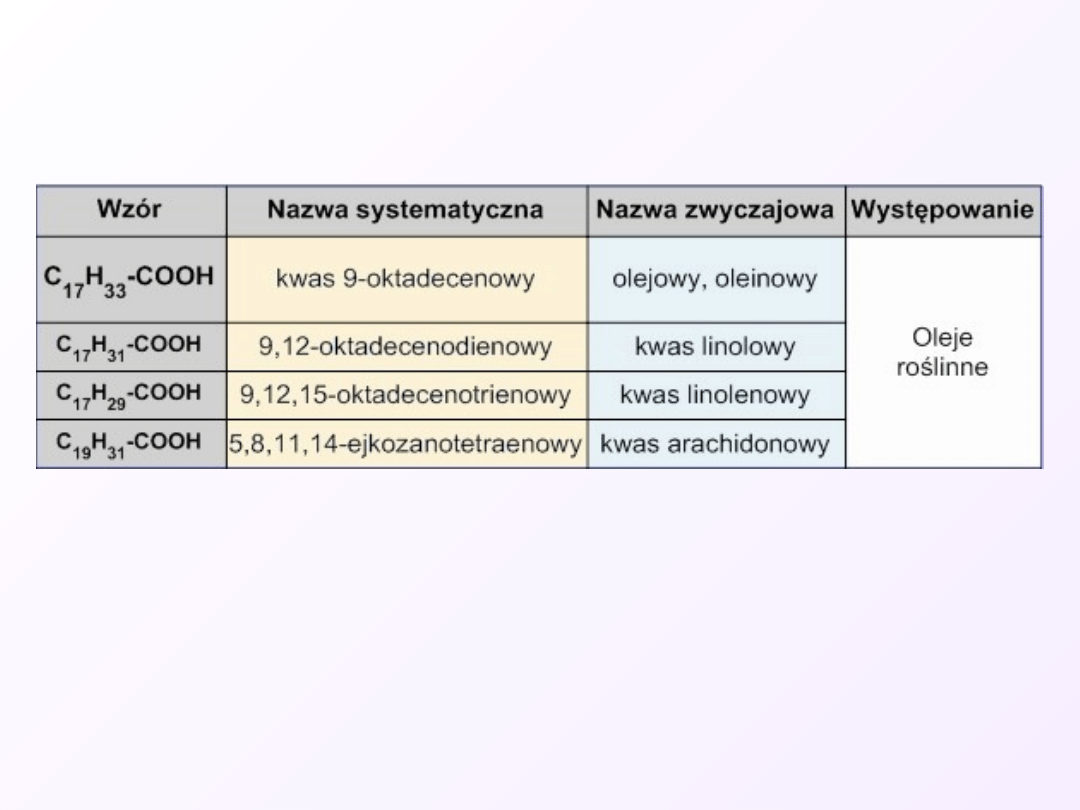
Ważniejsze nienasycone kwasy tłuszczowe
(NNKT)
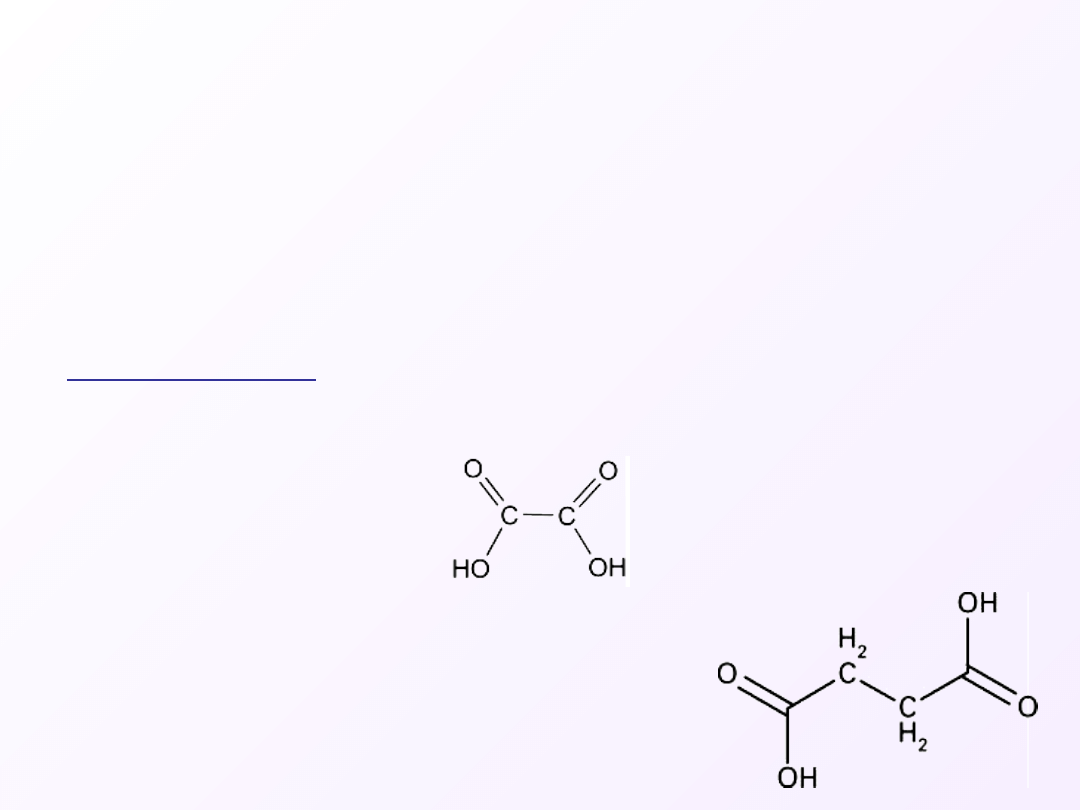
Są to kwasy karboksylowe zawierające dwie grupy karboksylowe (-
COOH).
Nazwy
systematyczne najprostszych kwasów tworzy się przez
dodanie końcówki
-odiowy
do nazwy alkanu zawierającego tyle
atomów węgla, co dany kwas.
Gdy grupy -COOH są połączone z pierścieniem - przyrostek -
dikarboksylowy
.
Kwas szczawiowy ( kwas etanodiowy)
najprostszy kwas
dikarboksylowy.
Wzór : C
2
H
2
O
4
; HCOO-COOH
Kwas bursztynowy (kwas 1,4-butanodiowy
)
Wzór:
(
CH
2
COOH)
2
Kwasy dikarboksylowe
Przykłady:
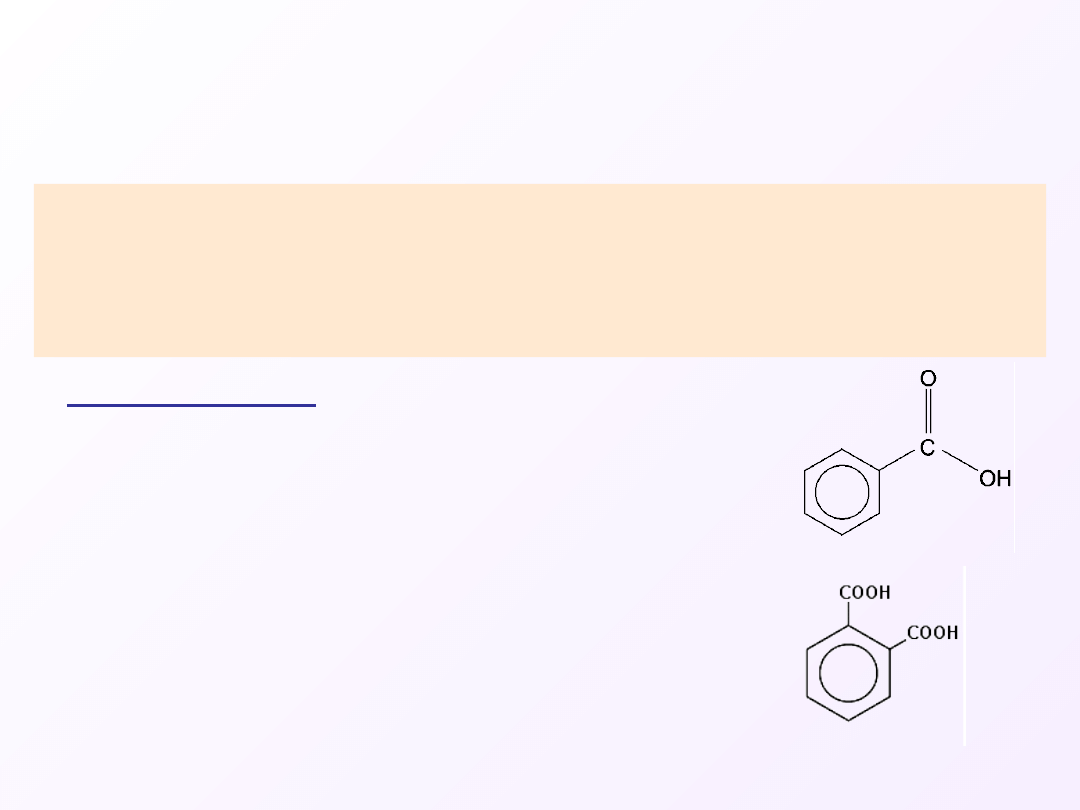
Są to kwasy w których grupa karboksylowa związana jest z
pierścieniem aromatycznym.
Kwas benzoesowy (kwas
benzenokarboksylowy)
C
6
H
5
COOH
Bezpośrednie przyłączenie grupy karboksylowej do pierścienia
aromatycznego modyfikuje własności grupy karboksylowej, a także
modyfikuje własności ugrupowania aromatycznego, co się przejawia
różną reaktywnością alifatycznych i aromatycznych kwasów
organicznych.
Kwas ftalowy ( benzeno -1,2–
dikarboksylowy)
C
6
H
4
(COOH)
2
Aromatyczne kwasy karboksylowe
Przykłady:
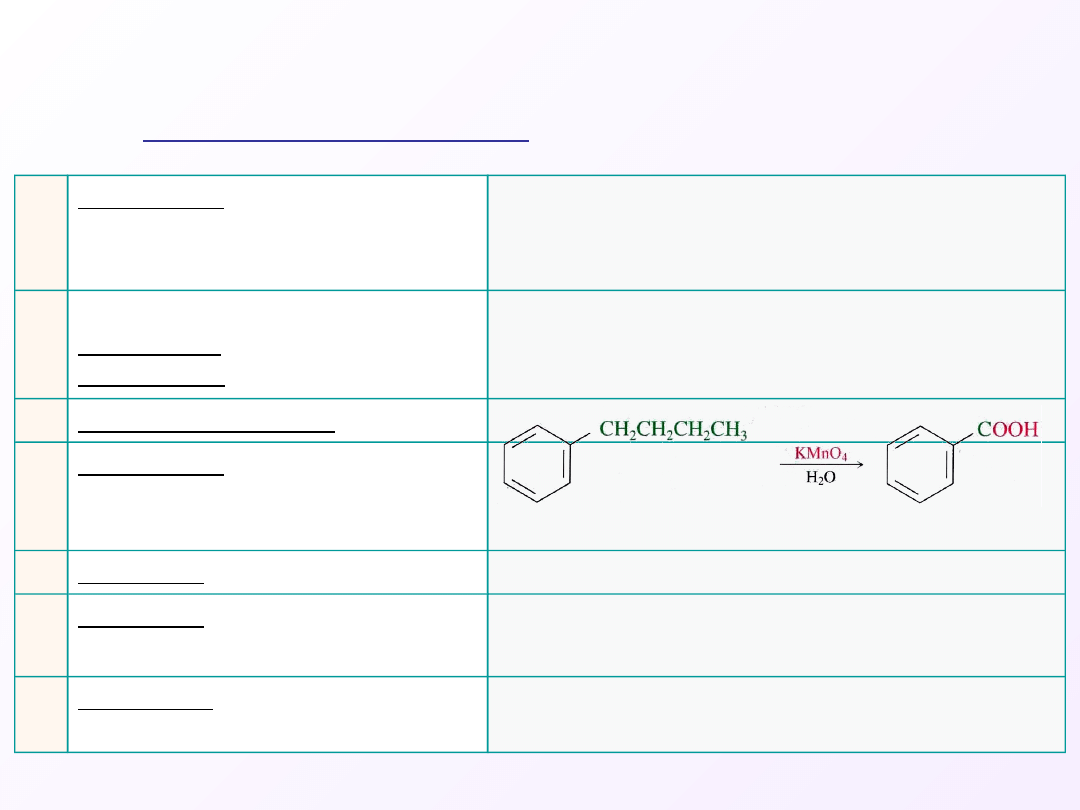
A
Utlenianie alkoholi I –
rzędowych
silnym utleniaczem
B
W wyniku łagodnego
utleniania odpowiednich
aldehydów
C
Utlenianie alkenów
D
Utlenianie węglowodorów
aromatycznych z łańcuchem
bocznym
E
Hydroliza estrów
F
Hydroliza amidów
G
Hydroliza bezwodników
kwasowych
kwas
utlenianie
alkohol
RCOOH
OH
RCH
]
[
2
kwas
aldehyd
RCOOH
O
RCHO
2
2
2
COOH
R
COOH
R
2O
CHR
CH
R
2
1
2
2
1
Na skalę przemysłową kwasy karboksylowe otrzymuje się w
wyniku katalitycznego utleniania odpowiednich węglowodorów.
OH
R
COOH
R
O
H
COOR
R
2
1
2
2
1
3
2
2
NH
RCOOH
O
H
RCONH
RCOOH
O
H
O
RCO
2
2
2
)
(
Otrzymywanie kwasów karboksylowych
O
7H
SO
K
)
(SO
Cr
3RCOOH
SO
4H
O
Cr
K
OH
3RCH
2
4
2
3
4
2
4
2
7
2
2
2
+ 2 Cu(OH)2
+ Cu2O + 2 H2O
granatowy osad
ceglasty osad
kwas octowy
/kwas karboksylowy/
etanal
/aldehyd/
C
H
3
C
O
H
C
H
3
C
O
OH
T.
A
B
+ Ag2O
kwas octowy
/kwas karboksylowy/
etanal
/aldehyd/
+ 2 Ag
C
H
3
C
O
H
NH3
C
H
3
C
O
OH
O
R
O
O
R
H
H
O
R
O
O
O
H
R
H
..
O
R
OH
O
O
H
R
:
..
C
C
O:
C
-
:
..
+
+
C
+
C
C
+
bezwodnik
kwas
G
Przykłady
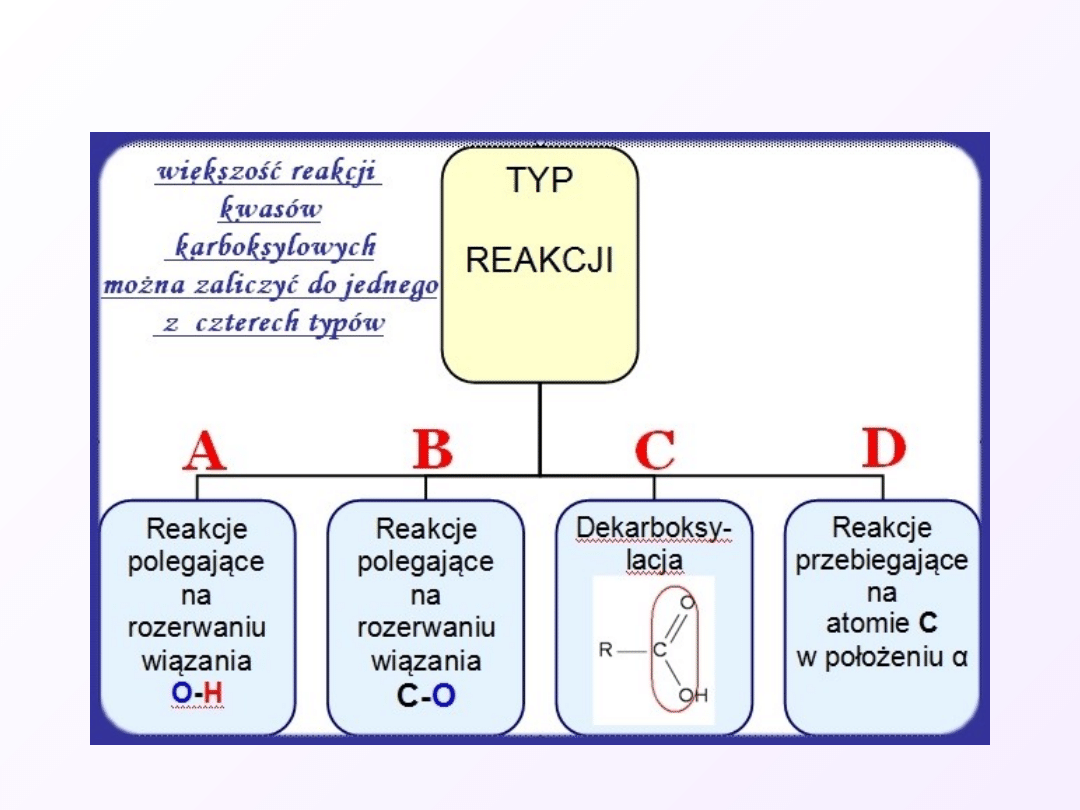
Właściwości chemiczne
A
Reakcje polegające na rozerwaniu wiązania
O
-
H
Przesunięcie elektronów wiązań H-O oraz O-C ułatwia oddzielenie
protonu i tym samym nadaje związkowi charakter kwasowy.
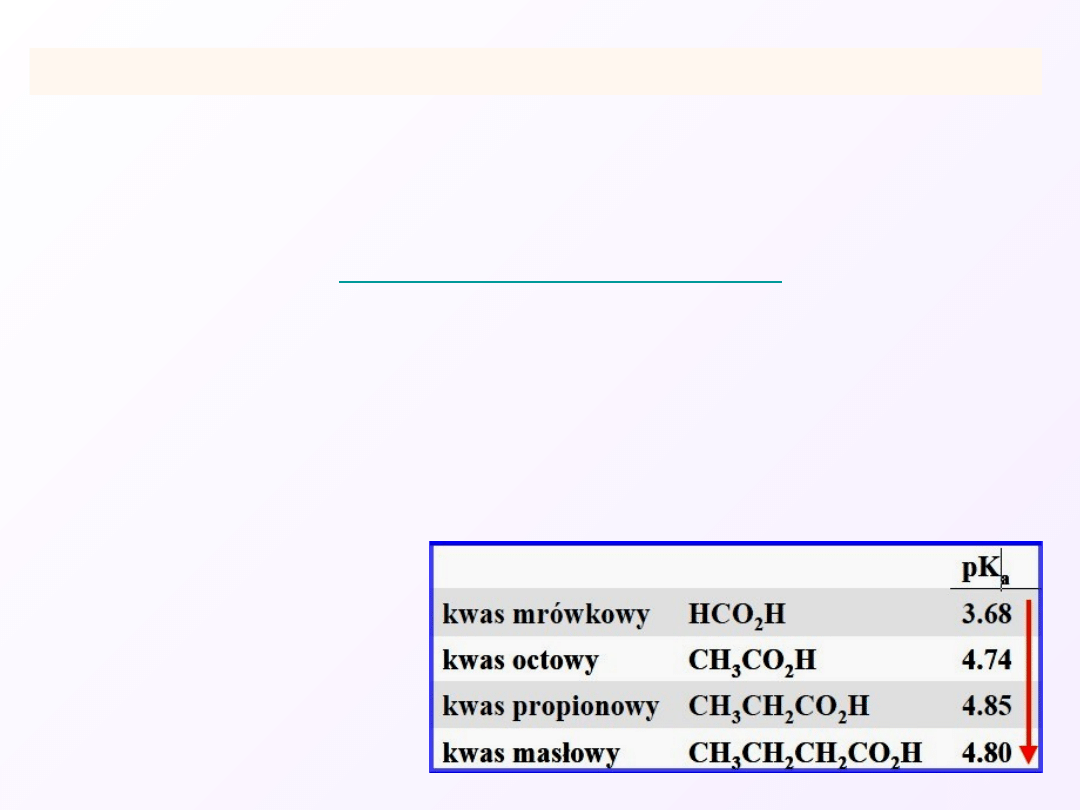
Na ogół kwasy karboksylowe są słabymi kwasami, ich stopień dysocjacji
jest niewielki i wraz ze wzrostem rodnika alkilowego zmniejsza się.
Najmocniejszym kwasem jest kwas mrówkowy > kwas benzoesowy >
kwas octowy
1. Dysocjacja elektrolityczna
H
RCOO
RCOOH
Kwasowość kwasów
alifatycznych maleje w miarę
wydłużania łańcucha
węglowego.

2
2
3
3
H
Zn
COO)
(CH
Zn
COOH
2CH
O
H
COONa
CH
NaOH
COOH
CH
2
3
3
O
H
COONH
CH
OH
NH
COOH
CH
2
4
3
4
3
O
H
Cu
COO)
(CH
CuO
COOH
2CH
2
2
3
3
2
2
2
3
3
3
CO
O
H
Ca
COO)
(CH
CaCO
COOH
2CH
Kwasy karboksylowe dają sole w reakcjach z:
aktywnymi metalami, tlenkami metali, wodorotlenkami, węglanami i
wodorowęglanami (kwas mrówkowy i octowy są mocniejsze od kwasu
węglowego(IV)).
2.
Tworzenie soli
Przykłady
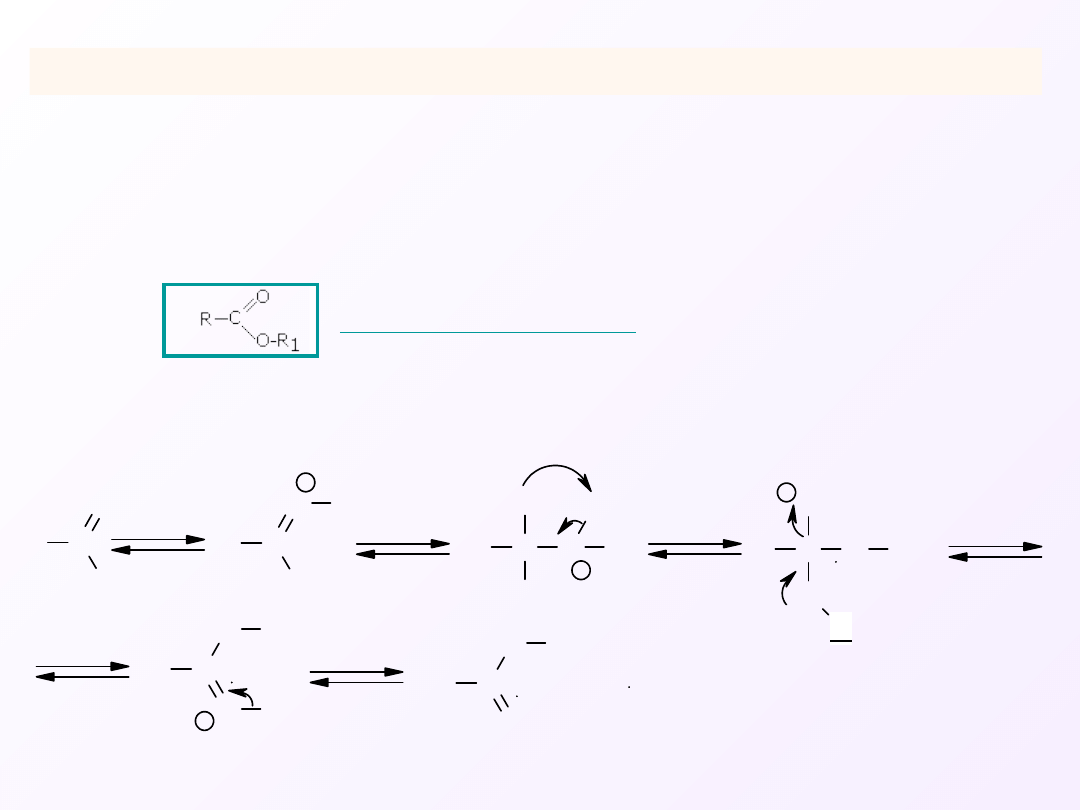
B
Reakcje polegające na rozerwaniu wiązania
C
-
O
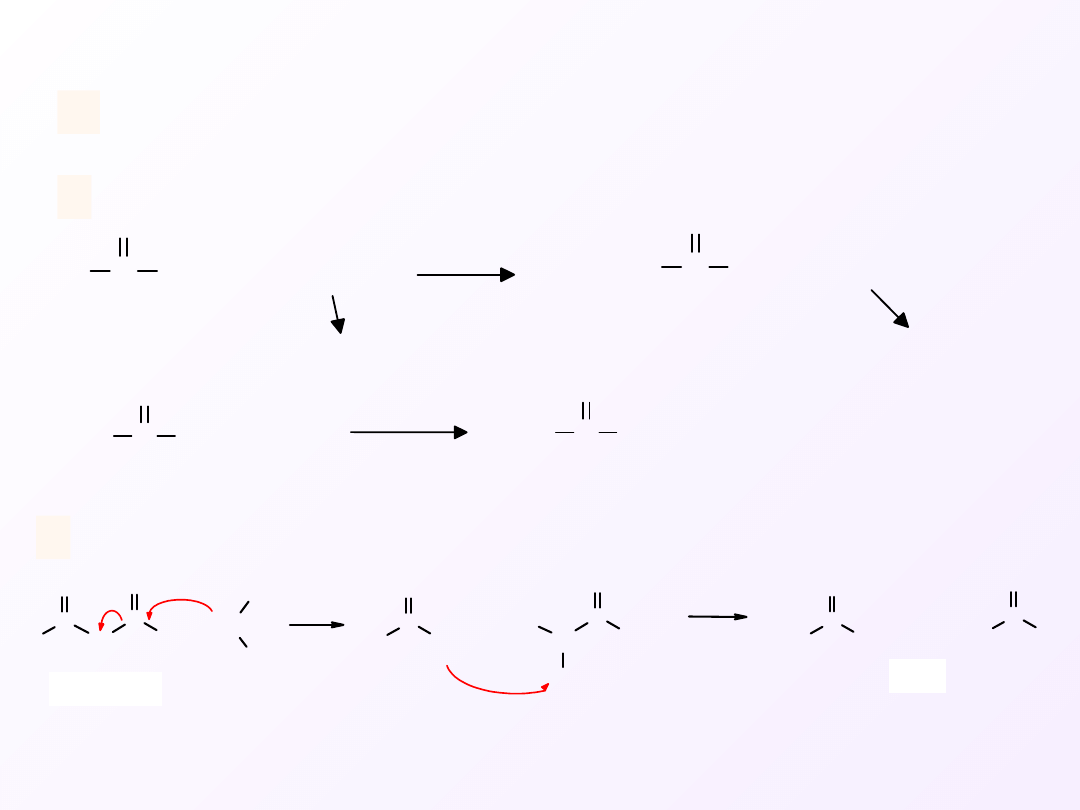
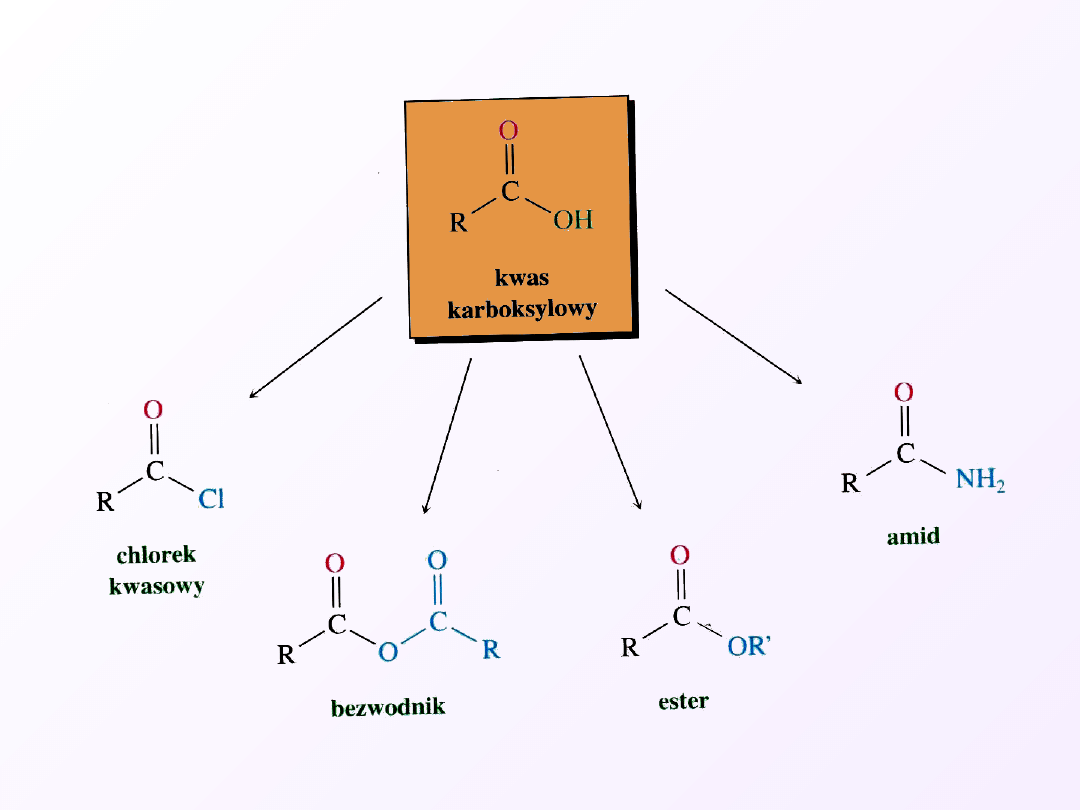
Grupa hydroksylowa karboksylu daje się dość łatwo zastąpić chlorem,
grupą aminową bądź resztą alkoholową dając chlorki kwasowe, amidy i
estry.
Reakcja polega na przyłączeniu czynnika nukleofilowego do atomu
węgla grupy karboksylowej, w dalszym zaś etapie na rozerwaniu
wiązania C-O.
1. Tworzenie estrów
Kwasy reagują z alkoholami dając estry, w których grupa
hydroksylowa kwasu zastąpiona jest rodnikiem alkoksylowym (-
OR
1
)
R C
OH
O
R C
OH
O H
+
R C
O
O R'
H
R C
O
O R'
R C
OH
OH
O R'
H
+
R C
O
OH
2
O R'
H
+
+
H-O-R'
+ H
+
- H
2
O
- H
+
..
:
..
.. :
O
H
CH
3
CH
3
OH
CH
2
C
O
CH
2
O
CH
3
CH
3
CH
2
C
O
CH
2
H
+
+
+
H
2
O
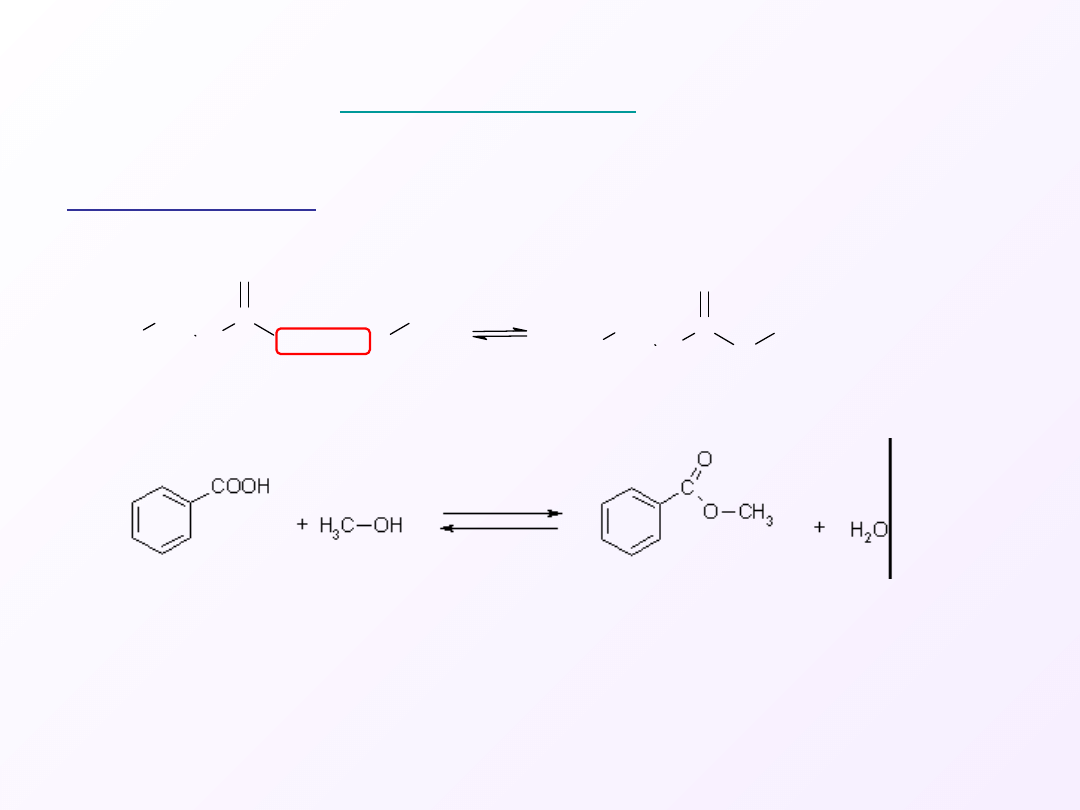
Przykłady:
1. Tworzenie estrów
Estryfikacja kwasów karboksylowych, kwaśna hydroliza estrów
przebiega wg identycznego mechanizmu.
Każdy etap reakcji
jest odwracalny.

• Estry
kwasów
karboksylowych
są
związkami
o charakterystycznym zapachu kwiatów lub owoców.
• Estry wyższych kwasów tłuszczowych (palmitynowego,
stearynowego lub oleinowego) i gliceryny tworzą grupę
związków zwanych tłuszczami.
• Estry nasyconych kwasów karboksylowych i alkoholi o długich,
prostych łańcuchach węglowych tworzą woski
Właściwości fizyczne estrów
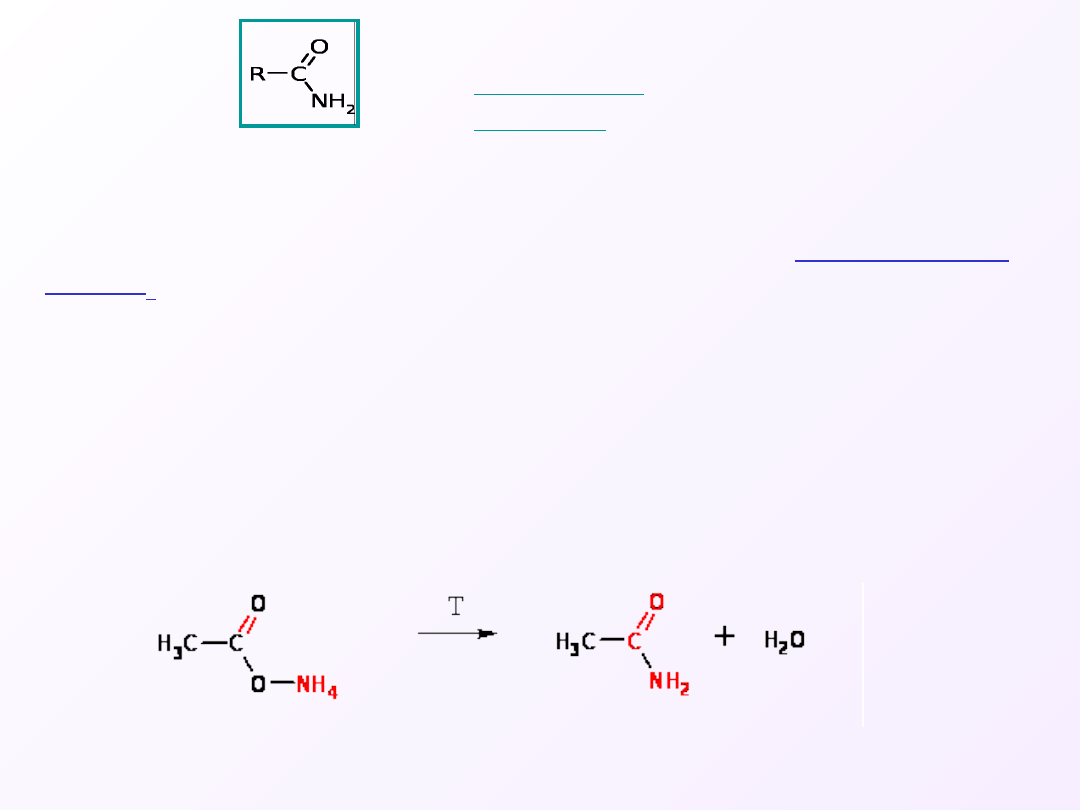
2.
Tworzenie
amidów
Amidy można zdefiniować jako pochodne kwasów, w których grupa
hydroksylowa została zastąpiona grupą –NH
2
1.W wyniku działania amoniaku na kwas otrzymujemy sól amonową R-
COONH
4
:
4
3(aq)
RCOONH
NH
RCOOH
2. Ogrzewanie soli amonowych wobec środków odwadniających
prowadzi do dehydratacji i powstania amidów kwasowych:
O
H
RCONH
RCOONH
2
2
T
4
2.
Tworzenie chlorków
kwasowych
CH
2
CH
2
C
OH
O
CH
3
CH
2
CH
2
C
Cl
O
CH
3
PCl
5
, PCl
3
lub SOCl
2
Działając na kwasy karboksylowe PCl
5,
PCl
3
lub chlorkiem tionylu SOCl
2
dochodzi do wymiany grupy –OH na fluorowiec i powstania chlorków
kwasowych
HCl
SO
RCOCl
SOCl
RCOOH
PO
H
3RCOCl
PCl
3RCOOH
HCl
POCl
RCOCl
PCl
RCOOH
2
2
3
3
3
3
5
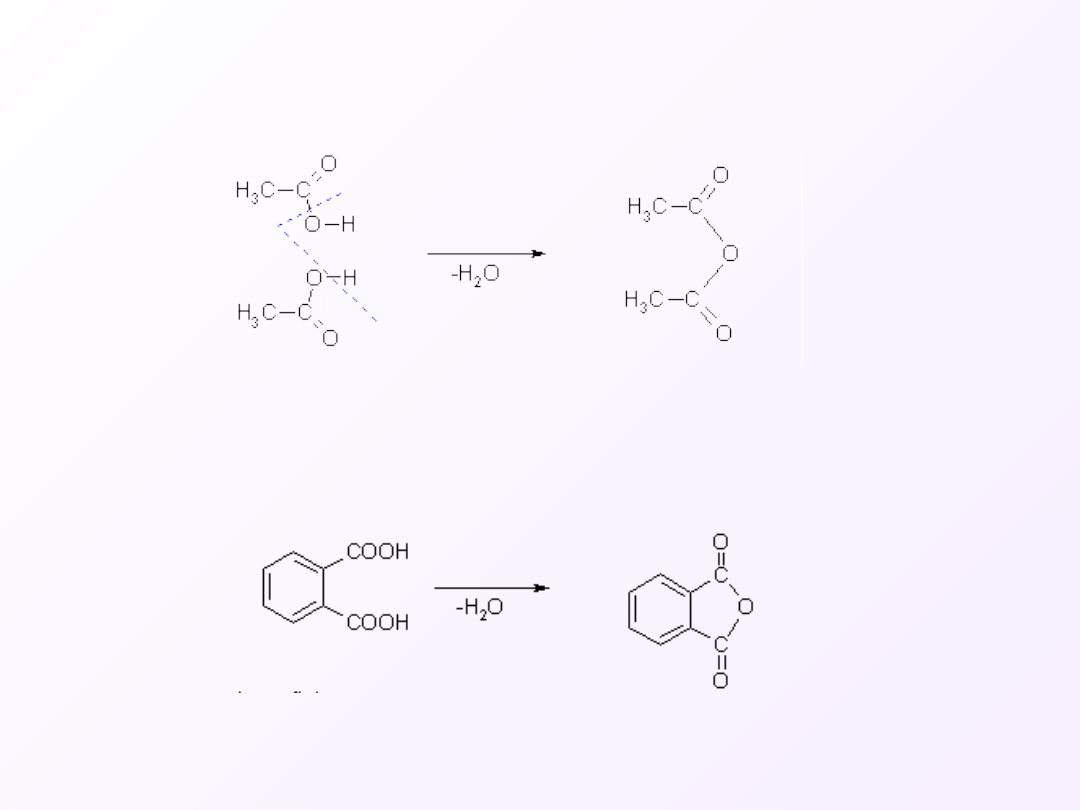
Łagodna dehydratacja kwasów karboksylowych prowadzi
do otrzymania bezwodników.
Szczególnie łatwo ulegają tej reakcji kwasy
dikarboksylowe.
C.
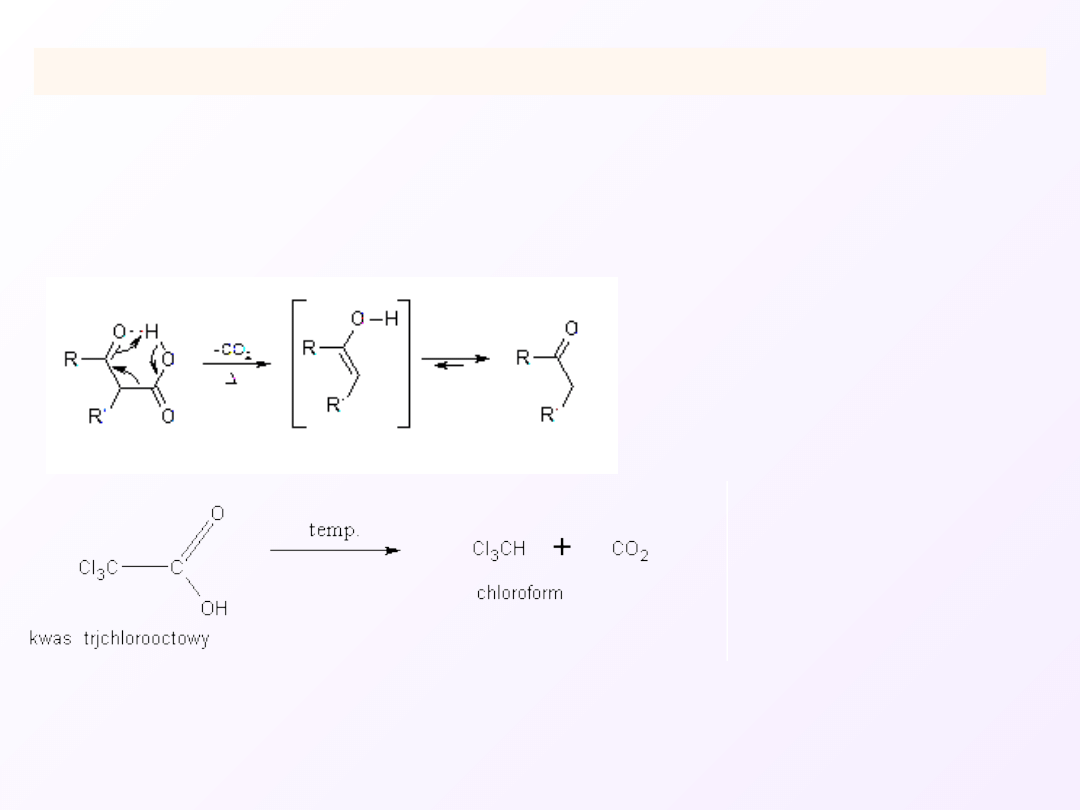
Dekarboksylacja
Cząsteczka kwasu rozkłada się z wydzieleniem dwutlenku węgla.
Dekarboksylacja kwasów zachodzi dość trudno.
H
R
CO
RCOOH
2
ΔT
W przypadku kwasów bardziej odpornych na temperaturę
dekarboksylację przeprowadza się prażąc sole sodowe kwasu z
alkaliami.

D.
Reakcje przebiegające na atomie C w położeniu α
Gdy na kwas karboksylowy podziałamy chlorem lub bromem, w
obecności niewielkiej ilości fosforu czerwonego, przy węglu α następuje
wymiana wodoru na fluorowiec.
HBr
CHBrCOOH
CH
Br
COOH
CH
CH
P
3
2
2
3
Wprowadzony fluorowiec łatwo daje się zastąpić takimi nukleofilowymi
podstawnikami jak:
-OH, -CN, -J, -NH
2

Redukcja kwasów karboksylowych do aldehydów i następnie do alkoholi
Redukcja kwasów do alkoholi ma znaczenie praktyczne ze względu na
dostępność niektórych kwasów w wyniku hydrolizy tłuszczów.
Doskonałym reduktorem jest LiAlH
4
(tetrahydroglinian litu )
RCOOH R CH
2
OH
Redukcja kwasów karboksylowych przebiega opornie.
Redukcja kwasów karboksylowych

R
C
O
H
R C
O
O
H
O
Silna polaryzacja wiązań w obrębie grupy karboksylowej powoduje, że
kwasy organiczne w nawet silnie rozcieńczonych roztworach występują w
postaci dimerów, powiązanych wiązaniami wodorowymi. Te silne
oddziaływania międzycząsteczkowe są powodem, że większość kwasów
organicznych jest krystalicznymi ciałami stałymi, mimo że formalna masa
molowa wskazywałaby raczej na stan ciekły oraz wykazują wysoką
temperaturę wrzenia.
Kwasy o niskich masach molowych są dobrze rozpuszczalne w wodzie,
natomiast wyższe kwasy są praktycznie w wodzie nierozpuszczalne
-asocjacja pomiędzy
cząsteczkami
kwasów karboksylowych
-asocjacja pomiędzy wodą i
kwasem
C
O
O
R
H
H
O
H
H
O
H
Właściwości fizyczne kwasów
karboksylowych
Dime
r
hydro-
fobowe
wnetrze
micelli
Na
+ -
OOC
Na
+ -
OOC
Na
+ -
OOC
Na
+ -
OOC
COO
-+
Na
COO
-+
Na
COO
-+
Na
COO
-+
Na
COO
-+
Na
Właściwości fizyczne kwasów
karboksylowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Chemia Kartkówka Kwasy karboksylowe
Kwasy Karboksylowe1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia organiczna
zadania z arkuszy maturalnych kwasy karboksylowe, Nauka, CHEMIA, Szkoła, Chemia Organiczna
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
Kwasy karboksylowe, chemia, GIMNAZJUM
Test Chemia kwasy karboksylowe alkohole estry wersja 1, Klasa III
Kwasy karboksylowe, Chemia(1)
Chemia 3 Kwasy karboksylowe
Chemia, Chemia - Kwasy karboksylowe (2)
OTRZYMYWANIE AMIDOW Z KWASOW KARBOKSYLOWYCH, Materiały, Chemiczne, Chemia organiczna
Estry kwasów karboksylowych, CHEMIA, organiczna
Instrukcja do prób barwnych II (kwasy, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
Chemia kwasy karboksylowe, estry, tłuszcze
pochodne kwasow karboksylowych, Chemia organiczna
ściągi chemia Kwasy karboksylowe
więcej podobnych podstron