Podstawy Chemii Nieorganicznej kod kursu:
CHC012001 l
Sprawozdanie
WYZNACZANIE STAŁEJ DYSOCJACJI SŁABEGO ELEKTROLITU
Nazwisko
Imię i nazwisko: Nr indeksu:
Ocena
prowadzącego kurs: Wyznaczanie stałej dysocjacji słabego kwasu (CH3COOH) 1. Stężenia roztworów używanych w doświadczeniu C0CH3OOH = 0,20 mol/dm3
C0CH3OONa = 0,20 mol/dm3
2. Pomiar pH serii roztworów buforowych Lp
V
śr
HA
VNaA
CHA
CNaA
pH
[H+]
Ka
Ka-Ka
[cm3]
[cm3]
[mol/dm3] [ mol/dm 3 ]
[pomiar]
[mol/dm3]
1
18,0
2,0
0,18
0,02
3,81
1,549*10-4 1,721*10-5
-5,5*10-7
2
16,0
4,0
0,16
0,04
4,17
6,761*10-5 1,690*10-5
-8,6*10-7
3
14,0
6,0
0,14
0,06
4,41
3,890*10-5 1,667*10-5 -1,09*10-6
4
12,0
8,0
0,12
0,08
4,59
2,570*10-5 1,713*10-5
-6,3*10-7
5
10,0
10,0
0,10
0,10
4,73
1,862*10-5 1,862*10-5
8,6*10-7
6
8,0
12,0
0,08
0,12
4,93
1,175*10-5 1,763*10-5
-1,3*10-7
7
6,0
14,0
0,06
0,14
5,12
7,586*10-6 1,770*10-5
-0,6*10-7
8
4,0
16,0
0,04
0,16
5,33
4,677*10-6 1,871*10-5
9,5*10-7
9
2,0
18,0
0,02
0,18
5,67
2,138*10-6 1,924*10-5
1,48*10-6
Średnia wartość Ka= 1,776*10-5
3. Do sprawozdania dołączamy obliczenia oraz wykres.
4. Wnioski:
Wyznaczona przez nas stała dysocjacji jest bliska stałej tablicowej dla kwasu octowego. Stała wyliczona z pKa odczytanej z wykresu również jest porównywalna. Stałe wynikające z obliczeń z danych związanych z poszczególnymi roztworami niewiele różnią się od średniej stałej. Wszelkie odchylenia wynikać mogą np. z naświetlenia danego roztworu (słońce tamtego dnia świeciło dosyć mocno więc roztwory mogły się minimalnie różnić temperaturą) bądź niezauważalnych gołym okiem różnic w objętościach. W przypadku stałej odczytanej z wykresu różnice wynikają prawdopodobnie z przybliżeń. Możemy zatem stwierdzić, że stała dysocjacji dla danej substancji jest niezależna od jego stężenia oraz od stężenia soli, z którą tworzy bufor.
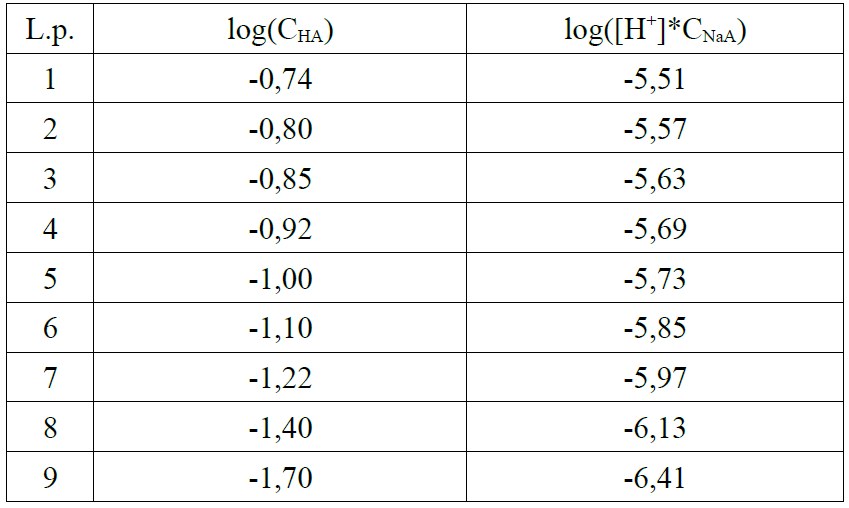
WYKRES
log([H]*CNaA) f(x)=0.94*x-4.82
-5.5
-5.7
-5.9
-6.1
-6.3
log(CHA)
-1.8
-1.7
-1.6
-1.5
-1.4
-1.3
-1.2
-1.1
-1
-0.9
-0.8
-0.7
pKa odczytana z wykresu: 4,82
zatem
Ka =10-pKa =1,513561 * 10-5 ≈ 1,51 * 10-5
Wyszukiwarka
Podobne podstrony:
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
sciaga egz nieorg, podstawy chemii nieorganicznej
Podstawy chemii nieorganicznej egzamin 13
3 0 Wyznaczanie stałej dysocjacji słabego elektrolitu
,podstawy chemii nieorganicznej L, Pojemność buforu
,podstawy chemii nieorganicznej L, Pojemność buforu
program, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
Podstawy chemii nieorganicznej egzamin id 366852
Stała dysocjacji słabego kwasu, Studia, Politechnika
sciaga egz nieorg2, podstawy chemii nieorganicznej
Bufory sprawko, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
jastrzab lomozik bregier jarzebowska podstawy chemii nieorg
Bufory sprawko, Biotechnologia PWR, Semestr 2, Podstawy chemii nieorganicznej Laboratorium, Instrukc
wyznaczanie stalej dysocjacji slabego elektrolitu
Stała dysocjacji słabego kwasu 1, Studia, Politechnika
więcej podobnych podstron