Materiały pomocnicze 14 Ochrona Środowiska 1. Gaz doskonały .
k = 3
,
1 8 ⋅10 2
− 3 J / K - stała Boltzmanna R = N k = 3
,
8 17 J / mol ⋅ K - stała gazowa
A
2. Równanie stanu gazu doskonałego:
N
n =
liczba moli gazu pV = nRT
N A
3. Przemiany gazowe:
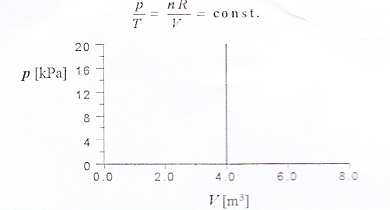
a. Izochoryczna
• przy stałej objętości: V = const
b. Izobaryczna
• przy stałym ciśnieniu: p = const
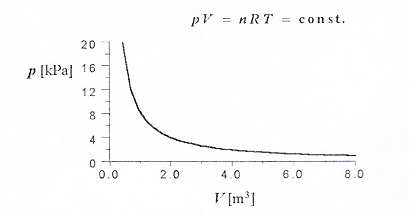
c. Izotermiczna
• w stałej temperaturze: T = const
d. Adiabatyczna
• bez wymiany ciepła: Q = 0
C
•
κ
p ⋅ V
= const gdzie : κ =
p > 1
Cv
4. Cieplo i praca
• ciepło – postać energii ( nie substancja) przenoszonej pomiędzy ciałami, na różne sposoby, dzięki różnicy temperatur;
• praca mechaniczna może w przemianach termodynamicznych zamieniać się na ciepło, i odwrotnie
• istnieje równoważność tych dwu form energii, odkryta w połowie XIX w. (Mayer, Joule, Helmholtz, Holding, Marnot)
Praca
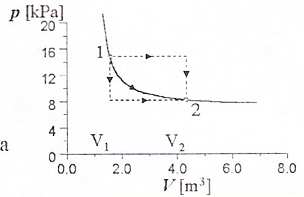
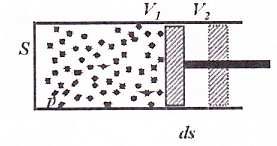
• rozpatrzmy gaz , w cylindrze z ruchomym tłokiem
• praca wykonana przez tłok(nad
gazem):
W
∆ = − F ⋅∆ s = − p ⋅ S ⋅ s
∆
W
∆ = − p V
∆
• praca zależy od wyboru drogi przejścia między stanami 1 i 2
• Energia wewnętrzna U – suma energii kinetycznej, potencjalnej cząsteczek tworzących ciało oprócz energii kinetycznej, potencjalnej ciała jako całości. Jest to funkcja stanu czyli zależy od stanu początkowego i końcowego.
5. I Zasada Termodynamiki
• praca - ∆ W zależy od drogi przejścia
• ciepło – ∆ Q zależy od drogi przejścia
• suma ∆ Q+ ∆ W zależy tylko od stanów początkowego i końcowego
•
U
∆ = Q
∆ + W
∆
• U – energia wewnętrzna – funkcja stanu (tak jak energia potencjalna)
• I Zasada Termodynamiki:
U
∆ = U − U = Q
∆ + W
∆ lub U
∆ = U − U = Q + W
k
p
k
p
• umowa: Q >0 – dostarczone do ciała lub układu, Q<0 - ciepło oddane przez układ W<0 – praca wykonana przez układ
W>0 - praca wykonana nad układem
• energia wewnętrzna gazu doskonałego : U = n⋅ C ⋅∆ T
V
Zmiana energii wewnętrznej.
U
∆ = n⋅ C ⋅ T
∆
V
8. Ilość ciepła i ciepło właściwe
• ciepło dopływa lub odpływa – zmiany w układzie: T,
• temperatura T wielkość fizyczna, która określa stan cieplny ciała
C
Q
c =
=
J/kgK,
m
m∆ T
Ciepło właściwe jest to ilość ciepła potrzebna do ogrzania 1 kg ciała o jeden stopień Kelvina.
• jest funkcją temperatury
• n.p. woda – 2300 J/kgK, Al. – 920 J/kgK, Pb – 63 J/kgK
Q
b) ciepła parowania, skraplania c =
J/kg
s
m
•
Q
topnienia, sublimacji c =
J/kg
T
m
6. Zasada bilansu cieplnego.
W układzie izolowanym ilość ciepła pobranego przez jedne ciała równa jest ilości ciepla oddanego przez inne ciała w tym układzie.
7. II Zasada Termodynamiki
Procesy odwracane i nieodwracalne
• zmiana stanu układu – zaburzenie stanu równowagi (ruch, zmiana T, zmiana fazy, reakcje chemiczne)
• proces idealny – odwracalny – ciągła równowaga w czasie procesu
Proces odwracalny może zachodzić w pewnym kierunku jak i w przeciwnym – bez zmian w otoczeniu np. ruch wahadła matematycznego w próżni, procesy kolowe, procesy quasi-statyczne (można to osiągnąć przez bardzo powolne zmiany)
procesy odwracalne: izotermiczny i adiabatyczny (nie zawsze)
Procesy nieodwracalne- procesy zachodzące samorzutnie w przyrodzie w kierunku zmniejszenia bodźców np. przewodnictwo cieplne, dyfuzja itd.
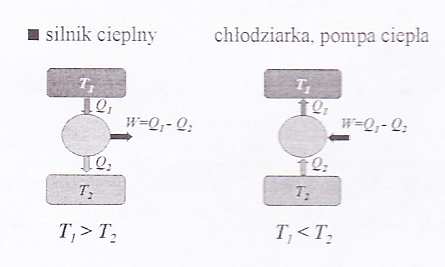
Maszyny cieplne
• silnik cieplny – urządzenie do zamiany energii cieplnej na mechaniczną w sposób cykliczny np. maszyna parowa, elektrownia, silnik spalinowy
• mogą działać tylko przy przepływie ciepła od temperatury wyższej ( T ) do niższej ( T ) 1
2
• inne maszyny cieplne przenoszą ciepło od temperatury niższej do wyższej kosztem pracy mechanicznej
II Zasada Termodynamiki
Niemożliwa jest przemiana, której jedynym wynikiem byłaby zamian na pracę ciepła pobranego ze źródła mającego wszędzie tą samą temperaturę (Kelvin).
śadna pracująca cyklicznie maszyna nie może, bez dodatkowych efektów, przenosić w sposób ciągły ciepła z jednego ciała do drugiego, mającego wyższą temperaturę (Clausius).
• ciepło Q zawsze musi występować
2
Zadania.
1. Podczas przemiany izochorycznej ciśnienie gazu wzrosło dwukrotne. Ile razy wzrosła średnia energia kinetyczna cząsteczek?
2. Oblicz objętość , jaką zajmuje w temperaturze t = 20 0 C pod ciśnieniem p = 106 Pa, 1 kg tlenu. Masa molowa tlenu µ = 32 g/mol.
3. Narysuj wykresy:
a) p(T), p(V), V(T) dla przemiany izochorycznej;
b) p(T), p(V), V(T) dla przemiany izobarycznej
c) p(T), p(V), V(T) dla przemiany izotermicznej
4. Do wody o masie m = 0.5 kg i temperaturze t = 20 0 C wlewamy wodę o masie m = 1 kg i 1
2
temperaturze t = 60 0 C. Oblicz temperaturę końcową wody po wyrównaniu się różnicy temperatur.
5. Do wody o masie m = 0.56 kg i temperaturze t = 16 0 C wrzucono kawałek lodu o masie 1
m =0,08 kg i temperaturze t = 0 0 C. Oblicz temperaturę końcową mieszaniny. Ciepło właściwe 2
wody c = 1
,
4 9 ⋅103 J /( kg ⋅ K ) , ciepło topnienia lodu L = .
3 35⋅105 J /( kg) .
w
6. W wodzie o masie m = 0.45 kg i temperaturze t = 17 0 C masę m = 0,015 kg pary wodnej o 1
2
temperaturze t = 100 0 C. Oblicz temperaturę końcową wody po wyrównaniu się różnicy temperatur. Ciepło parowania wody c = ,
2 26 ⋅106 J /( kg) .
p
7. Zapisz i wytłumacz pierwszą zasadę termodynamiki dla następujących przemian gazowych : izochorycznej, izobarycznej, izotermicznej i adiabatycznej.
Wyszukiwarka
Podobne podstrony:
Materiały pomocnicze 14
Materialy pomocnicze prezentacja maturalna
Materialy pomocnicze do cwiczen Statystyka cz I
obciazenia wiatr snieg materiały pomocnicze z budownictwa ogólnego
Materiał pomocniczy, Szkoła, wypracowania, ściągi
sciaga z ESP, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
Materiały pomocne przy nauce podsumowanie powyższych wykładów wersja mini
Materialy pomocnicze cardan AG Nieznany
Materialy pomocnicze 4 id 28534 Nieznany
więcej podobnych podstron