Przemiany mikrobiologiczne związków azotu (N) w glebie–
Część teoretyczna
N2 z atmosfery, w której stanowi 80% jej składu dostaje się do litosfery (gleby) dzięki działalności mikroorganizmów - jedynych organizmów zdolnych do wiązania N2.
Procesy fizyczne uruchamiania N2 atmosferycznego tj:
-dostawanie się z wodą deszczową połączeń N powstałych podczas wyładowań atmosferycznych,
-pobieranie przez liście roślin gazowego NH3,
-chemiczne wiązanie N2 atmosferycznego w glebach zasobnych w Fe w klimacie tropikalnym, mają zaledwie marginalne znaczenie.
Drobnoustroje symbiotyczne dostarczają 50-300 kg N/ha rocznie,
Drobnoustroje niesymbiotyczne dostarczają 30 kg N/ha rocznie
Symbiotyczne wiążą N2 głównie w klimacie umiarkowanym, chłodnym i wilgotnym,
Niesymbiotyczne wiążą N2 głównie w klimacie gorącym i suchym
Za wiązanie N2 odpowiedzialny jest układ enzymatyczny:
NITROGENAZA - kompleks białek kwaśnych, wrażliwych na temperaturę, inaktywowany O2
i przejawiający aktywność dzięki zredukowanym grupom –SH(sulfhydrylowych)
Złożony z :
MOLIBDENOFERRODOKSYNY (właściwa nitrogenaza) będącej tetramerem o Mcz 220 000
składającym się z 2 podjednostek A o Mcz 57 000 i 2 podjednostek B o Mcz 54 000 , 18 atomów Fe, 2 atomów Mo, 30 grup –SH i 18 mostków siarkowych.
Zachodzi tu redukcja N2 do NH3
(produktem ubocznym jest H2, który może przesuwać równowagę reakcji).
REDUKTAZA NITROGENAZOWA (AZOFERRODOKSYNA)
Jest dimerem złożonym z 2 podjednostek o Mcz 34 000, 4 atomów Fe, 12 grup –SH
Redukuje utlenioną nitrogenazę - przenosząc na nią elektrony.
FERRODOKSYNA (FLAWODOKSYNA)
Białko o Mcz 12000 zawierające 10 atomów Fe związanych niehemowo.
Jest dawcą elektronów, posiada silnie redukujące właściwości – potencjał E = -417 mV
ELEKTRONY pochodzą z fosforoklastycznego rozszczepienia fosfoenolopirogronianu (kwas pirogronowy wytworzony w beztlenowym etapie oddychania),
u bakterii tlenowych z redukcji przy współudziale NADH lub NADPH,
u sinic z niecyklicznego fosforylacji w czasie fotosyntezy,
u bakterii fotosyntetyzujących - z odwrotnego przepływu elektronów.
HAMUJĄCO DZIAŁA
O2 (optimum dla bakterii 0,04-0,05•105Pa, dla sinic 0,2•105Pa
ZABEZPIECZENIE PRZED O2:
U tlenowców (niesymbiotyczne np. Azotobacter) modyfikacja łańcucha oddechowego dająca większe zużycie O2,
u sinic wiązanie N2 w heterocystach,
u Rhizobium w tkankach zawierających bakterie – leghemoglobina.
HAMUJĄCO DZIAŁA RÓWNIEś:
Nadmiar H2, CO, NH3 (5-10 mg/l), N2O (na Azotobacter, Clostridium)
Na związanie 1 mola N2 zużywane jest 20 moli ATP, na 1g N2 50-100 kalorii.
1
MIKROORGANIZMY WIĄśĄCE N2 można podzielić na:
TLENOWCE – Azomonas, Derxia gumnosa, Achromobacter, Beijerinckia inolica
MIKROAEROFILE – Klebsiella, Bacillus polymyxa, Mycobacterium flavum, Alcaligenes, Pseudomonas BEZTLENOWCE – Clostridium
pasterianum,
Clostridium
butyricum,
Clostridium
pectinovorum,
Desulfovibrio, Desulfotomaculum
SYMBIONTY – Rhizobium, Bradyrhizobium, Frankia alni, Spirillum lipoferum
CHEMOLITOTROFY – Pseudomonas facilis, Thiobacillus ferrooxidans
FOTOAUTOTROFY – Chromatium, Chlorobium, Rhodospirillum, Rhodopseudomonas
SINICE – Nostoc, Anabena, Gleocapsa
Część bakterii symbiotycznych znajdujących się w brodawkach tworzy bakteroidy: Formy zmienione-inwolucyjne, nie rozmnażające się, ale aktywne, ok. 10 x większe od komórek macierzystych, o zdeformowanych bardzo charakterystycznych kształtach.
Ważniejsze gatunki Azotobacter:
Azotobacter chroococcum, Azotobacter vinelandii, Azotobacter beijerinkii.
W glebach Polski najczęściej występuje Azotobacter chroococcum (1,5 – 3 µm, urzęsiony peritrichalnie, starsze komórki otoczone śluzem, wytwarza formy przetrwalne – cysty. Wiąże 10-20 mg N na 1 g cukru Azotobacter vinelandii w glebach i wodach (0,8 - 3µm), w starszych hodowlach barwnik zielono fluoryzujący.
Wiąże 10 mg N na 1 g sacharozy
Rhizobium na związanie 1g N potrzebuje 15 g węglowodanów (teoretycznie 1,6 g glukozy) Beijerinkia, Clostridium, Azotobacter na 50 mg N zużywają 1 g glukozy
N2 atmosferyczny wiązany jest na drodze redukcji:
+H2
+H2
+H2
N2
NH=NH
NH2-NH2
2NH3
dwuimid
hydrazyna
amoniak
NH3
+
HOOC-C-CH2-CH2-COOH
HOOC-CH-CH2-CH2-COOH
+
H2O
O
NH2
kwas α-ketoglutarowy
kwas glutaminowy
lub
kwas szczawio-octowy
kwas asparaginowy
Nitrogenaza może aktywować też inne związki z potrójnymi wiązaniami:
azydki, N2O, HCN, acetylen (HC≡CH)
2
Białka są głównie składnikiem azotowym resztek roślinnych i nawozów organicznych.
Zawierają ok. 50% C i 16% N (13% mucyny, 30% prolamin) Mogą być wykorzystywane w procesach dysymilacji dopiero po rozbiciu na aminokwasy. Enzymy proteolityczne są egzoenzymami
1. Peptydohydrolazy (proteinazy, endopeptydazy) rozkładają białka do polipeptydów, głównie w środowisku alkalicznym
2. Hydrolazy aminokwasowe (peptydazy, egzopeptydazy) odszczepiają aminokwasy a.hydrolazy aminopeptydowe działają na wiązanie z grupą amonową na końcu łańcucha b.hydrolazy karboksylowe działają na wiązanie z grupą karboksylową na końcu łańcucha Doświadczalne potwierdzenie rozkładu białek do aminokwasów z użyciem kwasu pikrynowego pikrynien Na
redukcja
pikraminian Na
ONa
ONa
O
2N
NO2
O2N
NH2
NO2
NO
2
NO2
ROZKŁAD AMINOKWASÓW
Przeprowadzany przez dezaminazy – odszczepiające z aminokwasów grupy amidowe.
Procesowi temu towarzyszą: hybrydyzacja, redukcja, utlenianie, przenoszenie wewnątrz- cząsteczkowe, przegrupowanie, transaminacja
2 główne grupy dezaminacji
1. z dekarboksylacją
2. bez dekarboksylacji
Na skutek różnych typów dezaminacji poszczególnych aminokwasów powstają oprócz NH3: hydroksykwasy, ketokwasy, kwasy tłuszczowe.
Jeśli dezaminacja połączona jest z dekarboksylacją dodatkowo powstaje
CO2, alkohol lub węglowodór, H2S,
Dwuaminokwasy dają dwuaminy zwane jadami trupimi (z lizyny kadaweryna, z argininy putrescyna) Z aminokwasów aromatycznych powstaje kwas fenylooctowy (z fenyloalaniny) i dalej kwas benzoesowy, kwas indolilooctowy (z tryptofanu)
Doświadczalne potwierdzenie amonifikacji uzyskiwane za pomocą odczynnika Nesslera (KJ, J i metaliczna Hg –w środowisku NaOH)
Hg
2K2(HgJ4) + 3NaOH + NH4OH -----O
NH4J + 4KJ + 3NaJ + 3H2O
Hg
Jodek amidoksyrtęciowy (żółto zabarwiony)
ROZKŁAD MOCZNIKA
Drobnoustroje rozkładające mocznik są szeroko rozpowszechnione w przyrodzie. Proces rozkładu mocznika pod wpływem tej grupy mikroorganizmów jest ważnym etapem w procesie zwracania do obiegu ogromnych ilości azotu.
Rozkładany głównie przez właściwe bakterie mocznikowe, które wykorzystują mocznik jako źródło C i N oraz energii: Urobacillus, Urobacterium, Sarcina lutea, Micrococcus ureae, Sporosarcina ureae NH2
C=O
+
2H2O
2NH3 +
CO2
+
H2O
NH2
W glebie wytwarza się z cyjanoamidu Ca (azotniaku)
CaCN2 + 2H2O
H2CN2 +
Ca(OH)2
+H2O
CO(NH2)2,
a także z rozkładu kwasów nukleinowych, obornika, nawozów sztucznych.
Wysoki poziom mocznika w glebie można zapewnić przez dodatek kwaśnego torfu
Poszukuje się związków o przedłużonym okresie rozpadu np. oksamidu (lub połączenia mocznika z formaldehydem).
Doświadczalene potwierdzenie rozkładu mocznika na podstawie zmiany zabarwienia błękitu bromotylowego obecnego w podłożu pod wpływem zmiany pH (alkalizacji)
zabarwienie przy odczynie obojętnym (pH 6,8-7,0) -zielone
zabarwienie przy odczynie kwaśnym – żółte
zabarwienie przy odczynie alkalicznym -niebieskie
3
DENITRYFIKACJA
Proces na ogół niekorzystny. W glebach uprawnych rzadki, gdyż są one zwykle dobrze natlenione oraz zawierają stosunkowo mało substancji organicznej i azotanów.
Denitryfikacja całkowita w glebach uprawnych zachodzi jedynie wtedy, gdy podczas przesycenia wodą wprowadzi się jednocześnie substancje organiczną i saletrę.
Wyróżniamy:
1.
Denitryfikację właściwą – w warunkach beztlenowych azotany i azotyny redukowane są przez drobnoustroje do produktów gazowych
2.
Denitryfikacja do NH3 – w warunkach względnie beztlenowych NH3
może utlenić się lub ponownie wejść w obieg
3.
Zbiałczanie azotanów – NO3 zużywane do budowy drobnoustrojów
Produkty przejściowe nitryfikacji i denitryfikacji są jednakowe, a kluczowy związek to nitrohydroksylamina względnie beztlenowe
HNO2 +
NH2OH
NH3
O2N-NH-OH
ściśle beztlenowe
N2O
N2
Denitryfikacja właściwa prowadzona przez bakterie:
Bacillus, Pseudomonas, Achromobacter, Micrococcus, Spirillum
Nie prowadzą jej grzyby i promieniowce
Najsilniej przebiega w glebie przy pH 7-8,2
Drobnoustroje przeprowadzające denitryfikację nie są ściśle wyspecjalizowaną grupą.
Są bardzo różnorodne, przeważnie heterotroficzne, rzadziej litotroficzne.
Wszystkie są organizmami względnie beztlenowymi, które w warunkach tlenowych zdobywają energię przez utlenianie (O2) różnych związków organicznych i mineralnych.
W warunkach beztlenowych azotany lub azotyny są ostatecznymi akceptorami H2.
Do denitryfikatorów należą także niektóre bakterie utleniajace mineralne związki S – a więc litotroficzne: tj. Thiobacillus denitryficans i fakultatywny litotrof Paracoccus denitryficans oraz organotroficzny Paracoccus halodenitryficans (sololubny) utleniający sole alkoholi i kwasów organicznych.
Proces z punktu widzenia rolniczego niekorzystny:
Tworzenie N2 atmosferycznego powoduje straty N z gleby;
Tworzenie azotynów działa toksycznie podobnie jak CO hamując aktywność enzymatyczną; Proces zbiałczania azotanów można regulować przez dawkowanie nawozów organicznych: przy stosunku C/N>25 denitryfikacja na pewno nastąpi (np. przy nawożeniu słomą roślin zbożowych).
NH3 może być uwalniany na drodze chemicznej - w przesuszonej glebie przy nasłonecznieniu w krajach tropikalnych i śródziemnomorskich.
DENITRYFIKATORY
AERO
ANAERO
heterotroficzne
litotroficzne
fototroficzne
heterotroficzne
NITRYFIKATORY
AERO
ANAERO
litotroficzne
heterotroficzne
litotroficzne
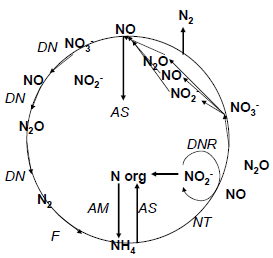
DN-denitryfikacja
NT-nitryfikacja
F-wiązanie N2
DNR-redukcja dysymilacyjna
AS-asymilacja
AM-amonifikacja
4
Przemiany mikrobiologiczne związków azotu (N) w glebie–
metody badania
Część praktyczna
Aktywność glebowych drobnoustrojów proteolitycznych
Odpowiednie rozcieńczenie badanej gleby wysiewamy na podłoże żelatynowe – agar Freziera (agar mleczny) metodą posiewu wgłębnego (płytek lanych).
Płytki po okresie inkubacji zalewamy „wywoływaczem” – 1% roztworem kwasu pikrynowego i odstawiamy na 5 –
10 minut. Następnie zlewamy roztwór wywoływacza.
Kolonie z aktywnością proteolityczną są otoczone przezroczystą strefą.
Aktywność glebowych mikroorganizmów amonifikacyjnych
Rozcieńczeniami gleby (10-1 do 10-8) szczepimy płynna pożywkę Pochona i Tardieux (zawierającą asparaginę) rozlaną po 5 ml do probówek. Wykonujemy posiew metodą NPL w układzie trójprobówkowym.
Po okresie inkubacji sprawdzamy wynik dodatni, czyli obecność amoniaku w pożywce za pomocą odczynnika Nesslera.
Intensywność zabarwienia wskazuje na ilość amoniaku.
śółta barwa -
0,1 – 0,5 µmola NH3 w ml
Pomarańczowo – żółta barwa
0,5 – 1,0 µmola NH3 w ml
Czerwono – brunatna barwa
powyżej 1,0 µmola NH3 w ml
Zanik amoniaku w kulturze wskazuje na jego utlenianie przez bakterie tylko wtedy, gdy równocześnie pojawia się produkt jego utleniania – kwas azotowy.
Aktywność glebowych drobnoustrojów mocznikowych
Liczebność drobnoustrojów ureolitycznych można określić przez posiewy wgłębne (metoda płytek lanych) na podłoże stałe i naliczenia wyrosłych kolonii mikroorganizmów rozkładających mocznik. Na podłoże z mocznikiem i glukozą zawierającym jako wskaźnik błękit bromotymolowy wysiewamy odpowiednie rozcieńczenie gleby. Na podłożu z mocznikiem i solami wapniowymi (kwasu organicznego) wokół kolonii tych bakterii wytrącają się kryształki CaCO3, CaHPO4 w postaci migotliwej błonki, co ułatwia ich rozpoznanie. Dodanie do podłoża wskaźnika ułatwia także rozpoznanie aktywnych ureolitycznie kolonii wskutek zmiany barwy podłoża wokół nich w następstwie jego zalkalizowania. Po inkubacji obserwujemy płytki. W przypadku obecności drobnoustrojów mocznikowych zielono –
oliwkowe zabarwienie podłoża przechodzi w niebieskie.
Aktywność glebowych drobnoustrojów denitryfikacyjnych
Proces denitryfikacji – redukcji azotanów do azotynów, amoniaku i dalej aż do molekularnego azotu jest zależny od warunków hodowli (środowiska), które powinny być uwzględnione przy rozpatrywaniu zagadnienia rozwoju drobnoustrojów denitryfikacyjnych. Jednym z czynników warunkujących energiczną działalność drobnoustrojów denitryfikacyjnych jest obniżona zawartość tlenu. Niezbędnym warunkiem do powstania tego procesu jest obecność azotanów, a także obecność substancji organicznych. Obecność drobnoustrojów denitryfikacyjnych można oznaczyć poprzez posiew na płynne pożywki selektywne lub metodą płytek lanych przy stosowaniu podłoża stałego.
Płynne podłoże Giltaya szczepimy odpowiednim rozcieńczeniem badanej gleby (stosując skrócony układ NPL) i inkubujemy w temperaturze 28oC. Po inkubacji obserwujemy zmianę odczynu środowiska (przy rozwoju denitryfikatorów pH silnie podwyższa się w kierunku zasadowym).
5
Wyszukiwarka
Podobne podstrony:
Zagrozenia zwiazane z przemieszczaniem sie ludzi
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
przemiennik 1
Przemienienie Jezusa
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
lato wedlug pieciu przemian fr
Czujniki przemieszczeń kątowych
PrzemianyPolityczne Sprawdzian TylkoGeografia
ćw 2 Pomiary przemieszczeń liniowych i grubości
Boże Narodzenie według Pięciu Przemian przepisy kulinarne
całość materiału test przemiany demograficzne
1. kulturalne przemiany po 89, Literaturoznawstwo, życie literackie po '89
Wyżarzanie bez przemiany, I Semestr - Materialoznawstwo - sprawozdania
PYTANIA Z PRZEMIAN, WYCHOWANIE FIZYCZNE
dyskusje - przemiana
08 PRZEMIANY KULTUROWE LECIA
więcej podobnych podstron