




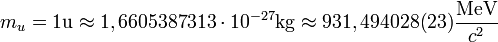
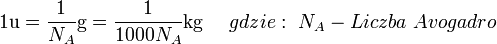


11-03-10
INSTYTUT TECHNIKI CIEPLNEJ
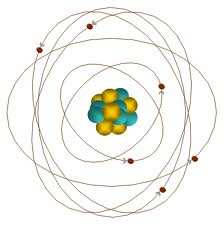
Budowa atomu
im. Bohdana Stefanowskiego
POLITECHNIKA WARSZAWSKA
Budowa: jadro, składające sie z protonów i neutronów, otoczone powłoka elektronowa.
Wymiary:
Ochrona radiologiczna
dj = 1,6÷15·10-15 m;
da = 2,3÷3,5·10-10 m.
dr inż. Grzegorz Maciej Niewiński Ochrona radiologiczna W1
Budowa atomu
Budowa atomu
Jednostka masy atomowej Proton:
unit (ang. jednostka), u
Symbol:
p
●
masa spoczynkowa:
1,6726×10-27kg=938,27MeV/c2
w przybliżeniu jest równa masie atomu wodoru
●
=1,00727646688 u
została zdefiniowana jako 1/12 masy atomu węgla 12C.
●
Ładunek elektryczny:
dodatni
1,60217653(14) × 10-19 C
Czas życia T :
> 2,1 × 1029 lat (?)
½
N = 6,02214179 ×10-23 mol-1
A
Neutron:
Symbol:
n
Energia elektronowolt eV
Masa spoczynkowa:
1,6748×10-27 kg =939,55 MeV/c2
(energia elektronu, poruszającego sie w polu o różnicy potencjałów 1 V)
=1,00866491578
1 eV = 1,60217653(14) × 10-19 J.
Ładunek elektryczny:
neutralny
(ładunek elementarny e = 1,60217653(14) Czas życia: T :
885,7 s
× 10-19 C)
½
Gęstość protonu:
p= 0,78 · 1018 kg/m3. (Dla porównania gęstość wody to ok. 103
kg/m3.)
1







11-03-10
Budowa atomu
Budowa atomu
Elektron
A
Symbol
e
Masa spoczynkowa:
9,10938
Z X
×10-
31kg=0.510998918(44)MeV/c²
N
=5.4857999(27)×10–4 u
Ładunek elektryczny:
ujemny
1.602176487(40)
X – symbol chemiczny pierwiastka
× 10-19 C
Czas życia T :
trwały
A – liczba masowa (liczba nukleonów w jądrze atomowym) ½
→ ang. mass number, atomic m.n., nucleon number Z – liczba atomowa (liczba protonów w jądrze atomowym)
→ ang. atomic number, proton number N = A-Z liczba neutronów w jądrze atomowym Budowa atomu
Budowa atomu
Izotopy – nuklidy o tym samym Z (liczba protonów) a różnym A Izotony – nuklidy o tym samym N (liczba neutronów) a różnym Z
(protony+neutrony), czyli różnią się liczbą neutronów w jądrze (protony),
1H (wodór), 2H (deuter), 3H (tryt)
•18 O (tlen), 19 F(fluor), 20 Ne(neon)
8
9
10
liczba izotopów ołowiu: 41 (łącznie z izomerami jądrowymi)
Izobary - nuklidy o tym samym A ale różnym Z, Własności chemiczne zależą od ładunku elektrycznego na zewnętrznej 28Si (Z=14), 28Al (Z=13), 28Mg (Z=12) orbicie, czyli od liczby elektronów na niej. Liczba ta zaś zależy od
●
całkowitej liczby elektronów w powłoce, równej liczbie protonów i liczbie Izomery - nuklidy o tym samym A i Z
atomowej Z.
różniące się masą jądra (długożyciowe stany wzbudzone jąder)
Inaczej mówiąc, wszystkie izotopy danego pierwiastka maja takie same własności chemiczne.
nuklidy o takiej samej liczbie protonów i neutronów, ale różniące się stanem energetycznym Własności fizyczne zależą od masy, czyli od liczby nukleonów, równej liczbie masowej A.
Izotopy danego pierwiastka maja równe własności fizyczne.
2



11-03-10
Budowa atomu
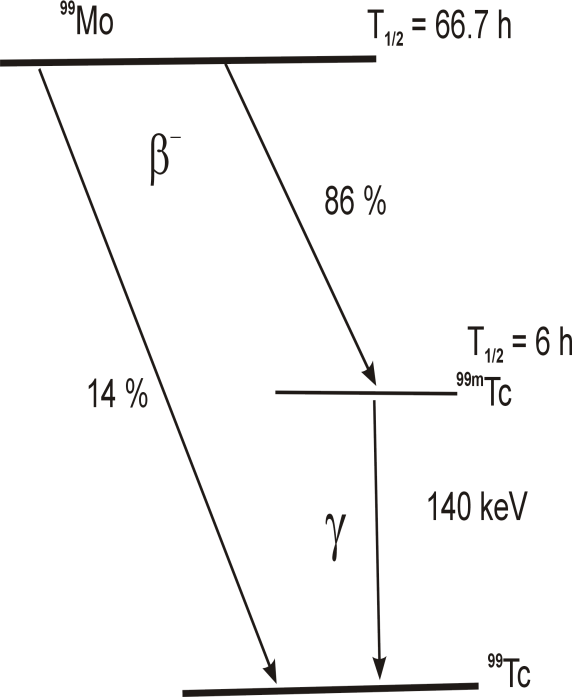
Izotopy niklu
Ni
Izotopy Uranu U
92
28
58Ni
234
→ 68.07 %
U → 0.0055 %
60Ni
235
→ 26.22 %
U → 0.7200 %
61Ni
238
→ 1.14 %
U → 99.2745 %
62Ni → 3.63 %
izotop
wyst.
o.p.r. [lat]
s.r
e.r. MeV
p.r.
64Ni
232
→ 0.92 %
U
{syn.}
68,9
α
5,414
228Th
DZIĘ KUJĘ ZA UWAGĘ !
izotop wyst.
o.p.r
s.r.
e.r. MeV
p.r.
233U
{syn.}
1,592×104
α
4,909
229T
56Ni
{syn.}
6,077 dni
w.e.
2,136
56Co
234U
0,006%
2,455×104
α
4,859
230Th
235U
0,72%
7,038×108
α
4,679
231Th
58Ni
68,077%
stabilny izotop z 30 neutronami 236U
{syn.}
2,342×107
α
4,572
232Th
59Ni
{syn.}
7,6×104 lat
w.e.
1,072
59Co
238U
99,275%
4,468×109
α
4,270
234Th
60Ni
26,233%
stabilny izotop z 32 neutronami wyst.=występowanie w przyrodzie, 61Ni
1,14%
stabilny izotop z 33 neutronami o.p.r.=okres połowicznego rozpadu, 62Ni
3,634%
stabilny izotop z 34 neutronami s.r.=sposób rozpadu,
63Ni
{syn.}
100,1 lat
β
2,137
60Cu
e.r.=energia rozpadu,
p.r.=produkt rozpadu
64Ni
0,926%
stabilny izotop z 36 neutronami w.e.=wychwyt elektronu
Ochrona radiologiczna W1
3
Wyszukiwarka
Podobne podstrony:
Farmakologia pokazy, Podstawy Farmakologii Ogólnej (W1)
W1 wprow
Przygotowanie PRODUKCJI 2009 w1
w1 czym jest psychologia
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
wde w1
Finanse W1
W1 ZLO
AM1 2005 W1
w1
SP dzienni w1
FOEM W1 Z
więcej podobnych podstron


