Robert Matera 23.10.2002
TRiL gr.II
24.Wyznaczanie ciepła topnienia lodu.
1.Cel.
Celem mojego ćwiczenia jest wyznaczenie ciepła topnienia lodu.
2.Wprowadzenie.
Topnienie jest przemianą fazową polegającą na przejściu ciała stałego w ciecz. Topnienie jest więc związane ze zmianą stanu skupienia substancji. Procesem odwrotnym do topnienia jest krzepnięcie. Topnienie ciał krystalicznych zachodzi zawsze w określonej temperaturze, zwanej temperaturą topnienia i równej temperaturze krzepnięcia. Temperatura topnienia zależy od ciśnienia. Dla większości ciał, które zwiększają swoją objętość podczas topnienia, ze wzrostem ciśnienia wzrasta temperatura topnienia. W przypadku ciał, które zmieniają swoją objętość podczas topnienia (np.lód) zależność ta ma przeciwstawny charakter.
Ogrzewanie kryształu powoduje wzrost prędkości drgań atomów uwięzionych w węzłach sieci, co oznacza wzrost temperatury ciała. Zatem dostarczaniu ciepła towarzyszy wzrost temperatury ogrzewanego ciała i to wprost proporcjonalnie do pobranego ciepła.
Proces topnienia związany jest z pobieraniem ciepła. Celem mojego ćwiczenia jest pomiar ciepła topnienia lodu. Ciepło topnienia jest to ilość ciepła jaką należy dostarczyć jednostce masy ciała stałego, znajdującego się w temperaturze topnienia, aby zmieniło się ono w cieczy o tej samej temperaturze. Jeśli w celu stopienia m kilogramów ciała dostarczono ciepło w ilości Q, to ciepło topnienia l można wyrazić wzorem:
![]()
(1)
Ponieważ w układzie SI ilość ciepła, jak każdy rodzaj energii, mierzymy w dżulach [J], więc jednostką ciepła topnienia jest J/kg.
Wyznaczanie ciepła topnienia za pomocą kolorymetru.
W celu wyznaczenia ciepła topnienia lodu wprowadzimy określoną ilość lodu, o temperaturze topnienia, do kalorymetru z wodą o temp. Początkowej To, nieco wyższej od temp. Otoczenia. Kolorymetr jest to naczynie o podwójnych, odizolowanych ścianach i małej pojemności cieplnej (pojemność cieplna jest to ilość masy ciała i jego ciepła właściwego). Kolorymetr powinien chronić ciało znajdujące się w nim przed wymianą ciepła z otoczeniem. Lód pobiera ciepło od wody i kolorymetru, co powoduje jego topnienie. Woda powstała z lodu, mająca w chwili początkowej temperaturę topnienia, również pobiera ciepło od kolorymetru i zawartej w nim wody. Procesy przepływu ciepła kończą się w chwili wyrównania się temperatur
--ustala się wówczas pewna temperatura końcowa Tk.
Aby otrzymać równanie, które posłuży do wyznaczenia ciepła topnienia, należy przeprowadzić bilans cieplny, czyli przeprowadzić rozliczenie strat i zysków ciepła. Przypomnijmy sobie wzór na ilość ciepła Q pobranego lub oddanego przez ciało przy zmianie jego temp. o ∆T:
Q=c*m*∆T (2)
gdzie:c-ciepło właściwe (jest to ilość ciepła potrzebna do ogrzania 1kg ciała o jednostkę temp.)
Gdy Q>0, to w przypadku ciepła pobranego przyjmujemy założenie: ∆T=Tk-To, natomiast gdy ciało ciepło oddaje to: ∆T=To-Tk. Ponieważ pomiędzy temp. T (w kelwinach) i t (w Celsjusza) zachodzi związek T==t+273,15, wartość liczbowa przyrostu temp. jest taka sama w jednej i drugiej skali, ∆T=∆t.
Bilans cieplny wymaga aby w układzie izolowanym ciepło pobrane Qp=Q1+Q2 było równe ciepłu oddanemu Qod=Q3+Q4, czyli:
Q1+Q2=Q3+Q4
gdzie:Q1-cieplo pobierane na stopienie m1, Q2-ciepło wody z lodu od temp. topnienia do temp. krzepnięcia, Q3-ciepło pochodzące od wody o masie mw, Q4-ciepło pochodzące od naczynia wewnętrznego kolorymetru.
Wykorzystując wzory (1) i (2), poszczególne ciepła możemy wyrazić następująco:
Q1=ml*l, Q2=ml*cw(tk-tt), Q3=mw*cW*(to-tk), Q4=mk*ck*(to-tk)
gdzie:cw -cieplo właściwe wody, które wynosi 4,19*103 J/kg*K, ck-ciepło właściwe kolorymetru wynosi 896 J/kg*K.
Wzór na ciepło właściwe:
![]()
W wykonywanym ćwiczeniu badane są zjawiska przechodzenia ciepła, czyli zagadnienia termodynamiczne. Taki przepływ ciepła, wraz z towarzyszącymi mu zmianami energii wewnętrznej ciał biorących udział w doświadczeniu, nazywamy procesem termodynamicznym. Istnieje funkcja, zwana entropią, która ujmuje ilościowo prawdopodobieństwo przejścia układu od jednego stanu do drugiego w tzw. procesach nieodwracalnych. W naszym przypadku jest to mieszanina wody z lodem zamknięta w kolorymetrze, uporządkowanie maleje i entropia wzrasta.
W układzie o stałej temperaturze zmianę entropii ∆S określa się jako stosunek ciepła ∆Q dostarczonego do układu do temp. bezwzględnej T (w kelwinach)
![]()
[J/K]
W moim doświadczeniu trzy ciała stanowią układ zamknięty. W układzie tym zmieniają one swoje stany termodynamiczne więc obliczamy pełną zmianę entropii układu przez zsumowanie zmian entropii poszczególnych składników:
∆S=∆S1+∆S2+∆S3
gdzie:∆S1-jest zmianą entropii lodu w procesie topnienia, ∆S2-zmianą entropii wody ze stopionego lodu, ∆S3-zmianą entropii kalorymetru wraz z tą ilością wody, która była w kalorymetrze przed wrzuceniem lodu.
Dla lodu T jest stała i wyznacza ją temp. topnienia Tt=273,15 K, natomiast ilość ciepła pobranego do stopienia wynosi ∆Q=Q1=ml*l, a wtedy ∆S1 równa się:
![]()
Dla wody z lodu temperatura ulega zmianie od Tt do Tk i elementarny przyrost ciepła wynosi dQ2=ml*cw*dT, a ∆S2 równe jest:
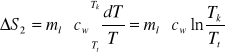
W trzecim przypadku, dQ3=(mwcw+mkck)dT oraz ∆S3:
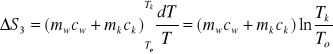
tutaj To to temp. początkowa układu.
3.Wykonanie ćwiczenia:
Ważę wewnętrzne naczynie kolorymetru (suche) wraz z pokrywką i mieszadełkiem- mk=0,0905kg
Napełniam kolorymetr (do około ½ objętości) ciepłą wodą destylowaną (25-30oC) i ważę- m1=0,28376kg, m1'=0,31205kg, m1''=0,28088kg.
Mierzę temperaturę początkową wody w kolorymetrze-to1=24,5oC, to2=23,1oC, to3=22,9oC.
Wrzucam do kolorymetru bryłkę lodu, doprowadzoną uprzednio do temp. topnienia i osuszoną ligniną (bezpośrednio przed wrzuceniem).
Mieszam zawartość kalorymetru mieszadełkiem i zapisuję najniższą temp. wody (w momencie całkowitego stopienia lodu)-tk1=16,3oC, tk2=14,1oC, tk3=10,1oC.
Ważę kalorymetr z całą zawartością-m2=0,2986kg, m2'=0,33517kg, m2''=0,31388kg.
Następnie obliczam masę wody, masę lodu jak i również ciepło topnienia lodu i średnią wartość ciepła topnienia lodu.
4.Obliczenia:
Obliczam masę wody wlanej do kalorymetru dla trzech pomiarów. Korzystam z następującego wzoru:
mw=m1-mk
Pomiar I
mw=0,42502-0,08285=0,34217kg
Pomiar II
mw=0,52515-0,08285=0,4423kg
Pomiar III
mw=0,38092-0,08285=0,29807kg
Obliczam masę lodu. Korzystam ze wzoru:
mL=m2-m1
Pomiar I
mL=0,44045-0,42502=0,01543kg
Pomiar II
mL=0,53251-0,52515=0,0736kg
Pomiar III
mL=0,38636-0,38092=0,0544kg
Obliczam ciepło topnienia lodu. Korzystam ze wzoru:
![]()
gdzie:ck i cw- ciepło właściwe wody i kalorymetru dla ck=896J/kg*K, dla cw=4,19*103J/kg*K, to=temp. początkowa, tk=temp. końcowa, mL=masa lodu, tt=temp. topnienia równa 273oC, mw=masa wody, mk=masa samego naczynia kalorymetru.
Pomiar I
l=(7304,9454-1013,52748)/0,01484=423949,9946 J/kg
Pomiar II
l=(9084,4425-1365,90648)/0,02312=333846,7128J/kg
Pomiar III
l=(11248,38656-1396,527)/0,033=298539,8352J/kg
Obliczam średni pomiar ciepła topnienia lodu.
lśr=(423949,9946+333846,7128+298539,8352)/3=352112,1809J/kg
Obliczam zmianę entropii układu. Korzystam z następujących wzorów:
Pomiar 1
∆S1=![]()
gdzie:∆Q-ciepło dostarczane do układu, T-temp.
l-ciepło topnienia lodu.
∆S1=(0,01484*423949,9946)/273=23,045J/K
∆S2=mLcwln![]()
gdzie:Tt-temp. topnienia, Tk-temp. końcowa
mL-masa lodu, cw-ciepło właściwe
∆S2=0,01484*4190*ln(289,3/273)=3,606J/K
∆S3=(mwcw+mkck)ln![]()
gdzie:To-temp początkowa
∆S3=890,847*ln(289,3/297,5)=-24,899J/K
∆S=∆S1+∆S2+∆S3=1,752 [J/K]
Pomiar 2
∆S1=(0,02312*333846,7128)/273=28,273J/K
∆S2=0,02312*4190*ln(287,1/273)=4,878J/K
∆S3=1009,3825*ln(287,1/296,1)=-31,156J/K
∆S=∆S1+∆S2+∆S3=1,995[J/K]
Pomiar 3
∆S1=(0,033*298539,8352)/273=36,087J/K
∆S2=0,033*4190*ln(283,3/273)=5,121J/K
∆S3=878,7802*ln(283,1/295,9)=-38,861J/K
∆S=∆S1+∆S2+∆S3=2,347[J/K]
WNIOSKI:
Ćwiczenie to pozwoliło mi na wyznaczenie ciepła topnienia lodu. W momencie wrzucenia lodu do kalorymetru lód pobiera ciepło od wody i ulega rozpuszczeniu. Temperatura spada do momentu rozpuszczenia całkowitego lodu, gdy lód ulegnie całkowitemu rozpuszczeniu temperatura zatrzymuje się, po czym znowu rośnie. Temperatura najniższa to temperatura końcowa. Przy obliczeniach i wykonaniu pomiarów pojawia się błąd który wynosi . Który mógł być spowodowany niedokładnym odczytaniem temperatury (początkowej, końcowej) jak i również nie dokładną wagą kalorymetru (która była spowodowana nie do końca suchym kalorymetrem z czego wynikają aż trzy różne wyniki masy kalorymetru.
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 24, Ćwiczenie 24 (6), Emilia Wieteska
Ćwiczenie 45, Ćwiczenie 45, Emilia Wieteska
moje24 - kędzier, Emilia Wieteska
Wyznaczanie ciepła topnienia lodu, Emilia Wieteska
Wyznaczanie sprawności grzejnika elektrycznego, Emilia Wieteska
Wyznaczanie współczynnika samoindukcji cewki i pojemności kondensatora, Emilia Wieteska
D19221008 Rozporządzenie Rady Ministrów z dnia 30 listopada 1922 r w przedmiocie dodatków dla wojsk
D19240846 Rozporządzenie Ministra Skarbu z dnia 30 września 1924 r o ustaleniu cen za spirytus odpę
D19240108 Rozporządzenie Ministra Skarbu z dnia 24 stycznia 1924 r w przedmiocie zmiany rozporządze
Prawo administracyjne - K. Wlaźlak ćwiczenia 4 2008-2009, Prawo administracyjne(30)
Prawo administracyjne - K. Wlaźlak ćwiczenia 2 2008-2009, Prawo administracyjne(30)
kpk, ART 50 KPK, I KZP 24/06 - postanowienie z dnia 26 października 2006 r
Prawo administracyjne - K. Wlaźlak ćwiczenia 7 2008-2009, Prawo administracyjne(30)
Ćwiczenia excell, SCENARIUSZ ZAJĘC dnia 6 Września 2010
Prawo administracyjne - K. Wlaźlak ćwiczenia 5 2008-2009, Prawo administracyjne(30)
Prawo administracyjne - K. Wlaźlak ćwiczenia 3 2008-2009, Prawo administracyjne(30)
Prawo administracyjne - K. Wlaźlak ćwiczenia 1 2008-2009, Prawo administracyjne(30)
Prawo administracyjne - K. Wlaźlak ćwiczenia 8 2008-2009, Prawo administracyjne(30)
więcej podobnych podstron