Sprawozdanie nr 13
Oznaczanie kompleksometryczne miedzi.
Celem doświadczenia jest kompleksometryczne oznaczenie miedzi.
Korzystałam z pipety, pompki, kolby stożkowej oraz z następujących odczynników: przygotowany roztwór, roztwór EDTA o stężeniu 0,01040 mol/dm3, amoniak ( NH·H2O ) o stężeniu 2 mol/dm3, kwas azotowy, woda destylowana oraz mureksyd.
PPRZYGOTOWANIE PRÓBY DO OZNACZEŃ:
Określoną naważkę próby zawierającą miedź rozpuściłam w kwasie azotowym, rozcieńczyłam wodą destylowaną i przeniosłam do kolby miarowej, po czym uzupełniłam ją woda destylowaną do stałej objętości.
KOMPLEKSOMETRYCZNE OZNACZANIE MIEDZI:
Z przygotowanego roztworu pobrałam 25 cm3 próby, dodałam 5 cm3 amoniaku o stężeniu 2 mol/dm3 ( NH3⋅H2O) i szczyptę mureksydu. Miareczkowałam mianowanym roztworem EDTA do zmiany barwy z brudno żółtoczerwonej do pierwszej fioletowej. Po zmiareczkowaniu do żądanej barwy, odczytałam zużytą ilość EDTA. Miareczkowanie powtórzyłam dwa razy.
WYNIKI Z MIARECZKOWANIA:
1 próba
Vp = cm3
Vk = cm3
Vk - Vp = = cm3
2 próba
Vp = cm3
Vk = cm3
Vk - Vp = = cm3
Przyjmuje wynik średni cm3
OBLICZENIA:
Dane: Szukane:
V ( EDTA ) = xCu2+ = ?
MCu2+ = 63,546 g/mol
cEDTA = 0,01040 mol/dm3
vpróby = 25 cm3 = 0,025 dm3
Cu2+ + H2Y2- → CuY2- +2H+
1mol Cu ( II ) reaguje z 1 molem EDTA ( H2Y2- )![]()
MCu g reaguje z 1 molem EDTA
xCu2+ g reaguje z cEDTA · vEDTA
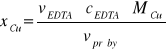
![]()
![]()
1
Wyszukiwarka
Podobne podstrony:
Spr.nr 10, Studia, Chemia, chemia7
Spr. nr 13(1), NAUKA, chemia, lab
Sprawozdanie nr 12, Studia, Chemia, chemia7
Chemia spraw.13, Studia, Chemia, chemia7
spr metale Zn, Studia, Chemia, chemia od Ines(1)
Sprawozdanie nr 11, Studia, Chemia, chemia7
cwiczenie nr 2 kamil, Studia, Chemia, chemia7
Spr. nr 12(1), NAUKA, chemia, lab
Ćwiczenie nr 13, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
elektrycznosć i magnetyzm nr 13, STUDIA, Polibuda - semestr I, Fizyka, zaliczenie
spr nr 13
Zestaw nr 6, Studia, chemia
chemia nr 4-sik, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
Spr. nr 1, NAUKA, chemia, lab
Chemia fizyczn - nr 10, Studia, Politechnika
Spr. nr 2(2), NAUKA, chemia, lab
Zestaw nr 5, Studia, chemia
więcej podobnych podstron