Metody oznaczenia liczebności mikroorganizmów
w środowiskach naturalnych:
Oznaczenie liczebności mikroorganizmów w badanym materiale metodami bezpośredniego liczenia
Wykonała:
Anna Ziółek
Gr. 21C
Wstęp.
Woda, gleba i organizmy żywe są środowiskami dogodnymi dla wzrostu różnych
mikroorganizmów. Mikroorganizmy znajdują się również w powietrzu, które nie jest jednak środowiskiem sprzyjającym ich rozwojowi. To właśnie mikroorganizmy wytyczają granice biosfery, a tak szerokie rozprzestrzenienie w przyrodzie zawdzięczają następującym cechom:
· małe rozmiary
· krótki czas generacji
· różnorodność metaboliczna (zdolność do wykorzystania wielu źródeł węgla, azotu, energii, różnych końcowych akceptorów elektronów)
· zdolność adaptacji do zmieniających się warunków środowiska
· zdolność do życia w warunkach ekstremalnych (dotyczy to temperatury, pH, potencjału oksydo-redukcyjnego, ciśnienia osmotycznego, ciśnienia hydrostatycznego i bardzo niskich stężeń substancji pokarmowych)
· wytwarzanie form przetrwalnych. Na ogół w danym środowisku występują różne mikroorganizmy.
Jeśli chcemy więc wyizolować określony gatunek, musimy zastosować odpowiednie podłoża i warunki hodowli, hamujące wzrost innych mikroorganizmów i prowadzące do selekcyjnego namnażania mikroorganizmu poszukiwanego. Z wyrosłych kolonii możemy następnie założyć czyste kultury, a po ich identyfikacji, uzyskać czystą kulturę poszukiwanego przez nas gatunku. Wysiewając ilościowo próbki pobrane ze środowisk naturalnych lub hodowli na podłoża stałe, można określić liczebność mikroorganizmów. Podstawowe pojęcia w mikrobiologii to hodowla, czysta kultura, kolonia, klon i szczep. Hodowla to podłoże z namnożonymi mikroorganizmami. Hodowle można prowadzić na podłożu płynnym bądź stałym. Hodowle mogą być jednogatunkowe (gdy na podłożu rośnie jeden gatunek bakterii) lub mieszane (gdy rosną w nich przynajmniej dwa gatunki). Kolonia to widoczne gołym okiem skupisko drobnoustrojów na podłożu stałym. Na ogół kolonia powstaje w wyniku podziałów pojedynczej komórki. Czystą kulturą nazywamy hodowlę, w której bakterie stanowią potomstwo jednej, pierwotnie wyosobnionej komórki bakteryjnej.
Określanie ogólnej liczby mikroorganizmów w środowisku naturalnym
Powietrze jest środowiskiem niesprzyjającym rozwojowi drobnoustrojów co nie oznacza, że mikroorganizmy tam nie występują.
Skład jakościowy i ilościowy mikroflory powietrza zależy od takich czynników, jak:
· obecność i liczebność organizmów żywych,
· stanu ich zdrowotności,
· temperatury,
· wilgotności,
· naświetlenia,
· ruchów powietrza,
· stopnia uprzemysłowienia terenu itp.
Drobnoustroje dostają się do powietrza z gleby, wody, powierzchni roślin, wydalin ludzi i zwierząt. W powietrzu spotyka się przedstawicieli wszystkich grup drobnoustrojów. Brak przyswajalnych składników pokarmowych w powietrzu ogranicza rozwój drobnoustrojów. Są przypadki, w których drobnoustroje mogą się odżywiać substancjami organicznymi rozpuszczonymi w kropelkach mgły zawieszonej w powietrzu i rozmnażać się. Niektóre komórki giną w wyniku wysuszenia lub działania promieni ultrafioletowych, inne są przenoszone z prądami powietrza. Liczba drobnoustrojów w powietrzu jest jednym z ważnych mierników zanieczyszczenia atmosfery w przestrzeni otwartej i w pomieszczeniach zamkniętych. Liczba drobnoustrojów w pomieszczeniach, szczególnie o dużym zagęszczeniu ludzi i sprzętów, jest wielokrotnie większa niż w powietrzu w miejscach odkrytych. W pomieszczeniach znajduje się szczególnie dużo drobnoustrojów chorobotwórczych wydzielanych ze śliną, przy kichaniu i kaszlu. Na podstawie wyniku badań nad zawartością drobnoustrojów w powietrzu służba zdrowia uzyskuje ocenę stanu sanitarnego atmosfery.
Jednak ze względu na prostotę wykonania bywa często stosowana w praktyce. Najpowszechniejszą, choć jedynie orientcyjną metodą oznaczania liczby drobnoustrojów w określonej objętości powietrza jest sedymentacyjna Kocha (nie jest metodą ilościową w ścisłym znaczeniu tego słowa). Wykorzystuje ona zjawisko opadania drobnoustrojów będących w powietrzu i osadzania się ich na przygotowanym podłożu hodowlanym. Żywe komórki drobnoustrojów, znajdują w podłożu warunki do życia, rozmnażają się i tworzą kolonie dostrzegalne przy użyciu niewielkich powiększeń, a nawet gołym okiem.
Przy określaniu liczby drobnoustrojów w powietrzu zakłada się, że każda kolonia pochodzi od jednej komórki bakteryjnej, fragmentu strzępki czy zarodnika grzyba lub promieniowca. Oznaczenie liczby drobnoustrojów w określonej objętości powietrza opiera się na obserwacjach z których wynika, że liczba kolonii, które wyrosły na 100 cm2 podłoża po 5-minutowym kontakcie podłoża z powietrzem równa jest w przybliżeniu liczbie drobnoustrojów zawartych w 10 dm3 powietrza.
Określanie ogólnej liczby drobnoustrojów w glebie
Określanie liczby drobnoustrojów w glebie należy do zabiegów często podejmowanych przez badaczy zajmujących się mikrobiologią gleby. Znajomość liczby drobnoustrojów w glebie ułatwia, w powiązaniu ze znajomością innych danych, poznanie kierunku procesów zachodzących w glebie i aktualnego stanu gleby. Liczba drobnoustrojów glebowych i ich skład jakościowy (występujące gatunki lub grupy fizjologiczne) określają poziom tzw. aktywności biologicznej gleby, jednego z czynników kształtujących w dużym stopniu żyzność gleby.
Praktyka mikrobiologiczna zna kilka metod oznaczania liczby drobnoustrojów w glebie. Wszystkie one dalekie są od doskonałości i umożliwiają uzyskanie wyników jedynie orientacyjnych. Na ćwiczeniach stosuje się tzw. metodę płytkową, często wykorzystywaną przez mikrobiologów glebowych. Jest to metoda pośrednia, oparta na liczeniu kolonii wyrosłych na podłożu hodowlanym, zaszczepionych znaną masą gleby. Metody bezpośrednie polegają na liczeniu drobnoustrojów bezpośrednio w próbkach gleby przy użyciu mikroskopu.
Metodą płytkową uzyskujemy wskaźnik, określany często jako ogólna liczba drobnoustrojów. Określenie to nie jest jednak ścisłe. Metodą płytkową określamy nie ogólną liczbę drobnoustrojów występujących w danej glebie w ogóle, ale jedynie przybliżoną liczbę drobnoustrojów zdolnych do rozwoju i rozmnażania się na zastosowanej w doświadczeniu pożywce. Posiewając próbkę tej samej gleby na różne podłoża (np. zawierające różne źródła węgla, różne źródła azotu, zróżnicowane pod względem odczynu), otrzymamy przy zastosowaniu metody płytkowej różniące się nieraz znacznie wyniki, stwierdzimy przy tym również wyraźne różnice jakościowe w składzie mikroflory. Niemniej w praktyce mikrobiologicznej metoda płytkowa, wykonana starannie i w dostatecznej liczbie powtórzeń, oddaje duże usługi. Należy jednak zawsze pamiętać o podaniu w opisie, jakie zastosowano podłoże oraz w jakich warunkach i jak długo prowadzono hodowlę.
W celu uzyskania wiarygodnych wyników konieczne jest określone postępowanie przy pobieraniu próbek gleby, a także przeprowadzenie kilku równoległych powtórzeń dla każdej próby.
W celu otrzymania próbki reprezentacyjnej pobiera się z badanego terenu kilka równoległych próbek gleby laską Egnera, najczęściej z głębokości 2-20 cm. Pobraną glebę umieszcza się w woreczkach z folii lub słoikach z odpowiednim zamknięciem. Przewiezienie próbek do laboratorium i nastawienie doświadczenia powinno nastąpić w zasadzie w dniu pobrania próby. Jednocześnie z nastawieniem doświadczenia określa się suchą masę gleby. Znajomość zawartości wody jest konieczna do późniejszych przeliczeń.
W laboratorium miesza się pobrane próbki i przesiewa przez sito o oczkach o średnicy 1 mm. Z przesianej gleby odważa się 2 próbki po 10 g każda i wsypuje do kolbek zawierających po 100 cm3 jałowej wody. Wszystkie opisane tu zabiegi, a także dalsze należy prowadzić w sposób maksymalnie zabezpieczający przed przypadkowym zakażeniem.
Zawiesinę gleby w wodzie przygotowuje się na wytrząsarce. Z wstępnego rozcieńczenia (10-1), którego 1 cm3 zawiera 0,1 g gleby przygotowuje się dalsze. Z rozcieńczenia wstępnego pobiera się jałową pipetą 1 cm3 zawiesiny i wprowadza do probówki zawierającej 9 cm3 wyjałowionej wody, uzyskując kolejne rozcieńczanie (10-2). W ten sposób postępujemy dalej aż do osiągnięcia wymaganego rozcieńczenia. Przygotowując każde rozcieńczenie, należy używać nowej jałowej pipety. Przed pobraniem zawiesiny do dalszego jej rozcieńczenia starannie ją mieszamy.
Konieczność przygotowania rozcieńczeń przed wysiewem gleby związana jest z bardzo dużą liczebnością drobnoustrojów w glebie.
Rozcieńczenie 1:10 zapisujemy w skrócie 10-1.
Określanie ogólnej liczby drobnoustrojów i miana coli w wodzie
Woda jako środowisko naturalne wykazuje dużą różnorodność mikroflory uwarunkowaną różnym pochodzeniem drobnoustrojów.
Drobnoustroje występujące w wodzie można podzielić na 2 grupy.
Drobnoustroje autochtoniczne, czyli tubylcze, dla których woda jest naturalnym środowiskiem bytowania i rozwoju.
Drobnoustroje allochtoniczne, czyli naniesione. Drobnoustroje dostają się do wody z gleby, powietrza, z przewodu pokarmowego ludzi, zwierząt oraz w niektórych wypadkach ze ścieków przemysłowych. Określenie liczby drobnoustrojów w wodzie i ujawnienie poszczególnych grup mikroflory jest jednym z podstawowych elementów badań przy ocenie przydatności wody do codziennego użytku, a także w różnych dziedzinach przemysłu, zwłaszcza spożywczego.
Badania sanitarno-epidemiologiczne, jakim poddawana jest woda do picia, obejmują m.in. określenie ogólnej liczby drobnoustrojów oraz ilościowe oznaczenie występowania bakterii pałeczki okrężnicy (Escherichia coli). Bakterie z tej grupy znajdują się w przewodzie pokarmowym ludzi oraz zwierząt i są wydalane z kałem. Obecność ich jest wskaźnikiem bezpośredniego lub pośredniego zakażenia wody odchodami. Na podstawie znajomości liczby bakterii z grupy pałeczki okrężnicy można wyciągnąć wnioski o stopniu zanieczyszczenia wody i jej przydatności do spożycia. Liczbę tych bakterii w wodzie określa się przez oznaczenie tzw. miana coli.
Przez miano coli rozumiemy najmniejszą ilość wody, w której stwierdza się jeszcze obecność pałeczki okrężnicy. Jeżeli np. stwierdzimy obecność pałeczek okrężnicy w 100 cm3 wody a nie ujawnimy ich występowania w 75 cm3, to przyjmujemy miano coli badanej wody za 100.
Przy określaniu miana coli wykorzystuje się zdolność pałeczki okrężnicy do fermentowania laktozy z wytworzeniem kwasu i gazu. W stacjach sanitarno-epidemiologicznych stosuje się do określenia miana coli pożywkę Ejkmana zawierającą pepton, 2 % laktozy i purpurę bromokrezolową jako wskaźnik pH. Po wprowadzeniu określonej objętości wody do pożywki inkubację prowadzi się w temp. 37oC. Wynik odczytuje się po 24 i 48 godzinach. O obecności pałeczki okrężnicy świadczy zmiana zabarwienia z czerwonego na żółte wskutek zakwaszenia środowiska i pojawianie się pęcherzyków gazu w rurkach Durhama.
Normy Polskie przewidują, że dla wody z wodociągów obsługujących co najmniej 50 tys. mieszkańców miano coli powinno mieć wartość powyżej 100, a ogólna liczba drobnoustrojów oznaczonych na agarze odżywczym nie powinna przekraczać 5. Dla wodociągów obsługujących poniżej 50 tys. mieszkańców oraz dla wody studziennej miano coli nie powinno być niższe niż 50 a ogólna liczba drobnoustrojów oznaczona na agarze odżywczym nie większa niż 20. Jeżeli nie zostaną spełnione powyższe warunki, to woda zostaje pod wzglądem sanitarnym zdyskwalifikowana.
W celu pobrania próby wody z kranu wodociągowego należy końcówkę zmyć tamponem umoczonym w 70 % alkoholu etylowym lub denaturacie i opalić, następnie pozostawić na 10 minut kran odkręcony, aby spłynęły pierwsze partie wody, a następnie pobrać próby do jałowych naczyń.
Analizę mikrobiologiczną wykonujemy jak najszybciej po pobraniu wody (do 2 godz.).
Określanie ogólnej liczby mikroorganizmów poza środowiskiem naturalnym
W ocenie surowców, półproduktów, produktów oraz w ocenie prawidłowości prowadzonych procesów technologicznych w przemyśle spożywczym niezbędna jest znajomość zawartości mikroflory w środowisku, czyli ocena stopnia zakażenia. Duża zawartość mikroflory niepożądanej może być oznaką zepsucia i złego stanu sanitarnego, np. podczas produkcji wędlin, lub też może wskazywać na prawidłowy przebieg procesu, np. duża liczba drożdży szlachetnych w fermentującym moszczu owocowym. Sposoby oznaczania różnych drobnoustrojów w poszczególnych produktach oznaczają normy. Podają one w jaki sposób pobierać próbki do oznaczeń, w jaki sposób przygotowywać je do analizy i na jakich podłożach je analizować. Pobrana próbka powinna być reprezentatywna dla całej partii badanego materiału. Drobnoustroje są rozmieszczone w środowisku przypadkowo, w sposób nieregularny. Pobierając próbkę nie mamy pewności czy znajdują się w niej wszystkie obecne w całym środowisku, w wyniku niedokładności oznaczeń i przy małej liczbie powtórzeń błąd w uzyskanym wyniku może być duży. Zakłada się iż błąd oznaczeń nie powinien być większy niż 10-15% w praktyce laboratoryjnej i nie większy niż 3-5% w badaniach naukowych. Liczbę drobnoustrojów podaje się w przeliczeniu na jednostkę masy (zwykle na 1 gram) lub na jednostkę objętości (zwykle 1 cm3).
Wyróżnia się trzy podstawowe grupy metod oznaczania liczebności mikroorganizmów:
1. bezpośredniego liczenia (mikroskopowa).
2. pośredniego liczenie (hodowlana)
3. wskaźnikowa
Oznaczenie liczebności mikroorganizmów w badanym materiale metodami bezpośredniego liczenia
Metody te polegają na bezpośrednim liczeniu drobnoustrojów pod mikroskopem. Różnice pomiędzy poszczególnymi mikroskopowymi metodami liczenia sprowadzają się do różnych sposobów przeliczania liczby komórek widzianych w polu widzenia mikroskopu na jednostkę masy lub objętości badanego materiału.
Rozróżniamy dwa główne sposoby bezpośredniego oznaczania liczebności mikroorganizmów:
- Liczenie przy użyciu komór.
- Technika bezpośredniej epifluorescencji
Liczenie przy użyciu komór
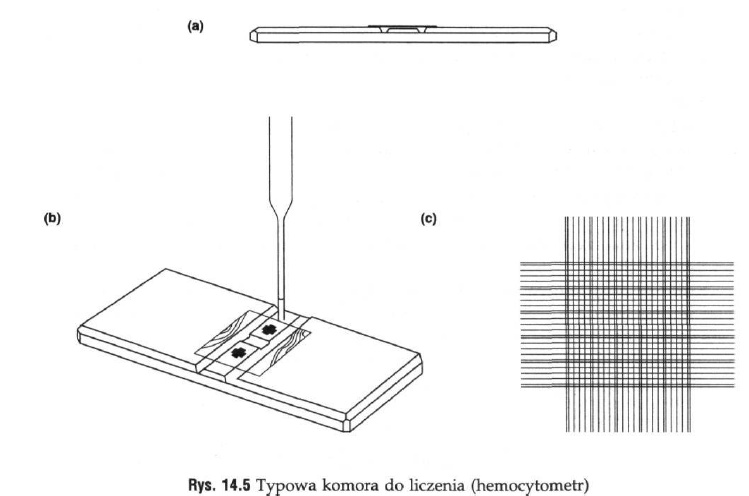
Komory do liczenia drobnoustrojów pod mikroskopem mają postać szklanych płytek z wyciętym wgłębieniem, podzielonym na kwadraty lub prostokąty o znanej powierzchni.
Używane są komory Thoma (hemocytometr), Howarda, Biirkera, Fuch Rosenthala i inne. Różnią się one wymiarami powierzchni, na których liczy się drobnoustroje. Dane dotyczące powierzchni i głębokości podane są na komorach.
W komorach można głównie liczyć tylko większe komórki drobnoustrojów, takie jak drożdże, zarodniki i strzępki grzybów. Ograniczenia te wynikają po pierwsze stąd, że grubość i głębokość komory nie pozwalają na użycie obiektywów o dużej sile powiększenia, a więc tym samym o małej odległości roboczej, i po drugie - przy dużej głębokości komory (100 mikrometrów = 0,1 mm) małe drobnoustroje, np. bakterie o średnicy 5 mikrometrów (firn), mogą układać się w wielu płaszczyznach i przy użyciu silniejszych obiektywów o małej głębi ostrości część komórek położona nad i pod płaszczyzną pola widzenia będzie niewidoczna.
Komora Thoma
Jest to grube szkiełko przedmiotowe z wyciętymi wgłębieniami o głębokości 0,1 mm (100 (μm). Wgłębienia te widoczne są gołym okiem po obydwu stronach środkowego kanalika jako równomierne krzyże, powstałe z przecięcia linii wyznaczających regularne, kwadratowe i prostokątne powierzchnie. Bok kwadratu wynosi 1/20 mm (50 μm). Powierzchnia kwadracika wynosi więc 1/400 mm2 (2500 μm2). W każdej siatce znajduje się 400 kwadracików. Po przykryciu komory szkiełkiem przykrywkowym nad każdym kwadracikiem powstaje prostopadłościan o objętości 1/400 mm2 x 0,1 mm = 1/4000 mm3 (2500 μm2 x 100 μm = 25 000 μm3). Co piąty kwadrat w obu kierunkach podzielony jest na pół dodatkową linią, w wyniku czego część kwadratów ma powierzchnię o połowę mniejszą, a cała komora podzielona jest w ten sposób na 16 dużych kwadratów, z których każdy składa się z 16 małych kwadracików. Na przecięciu dodatkowych linii powstają maleńkie kwadraciki o czterokrotnie mniejszej powierzchni równej l/1600 mm2.
Na powierzchni komory Thoma wyżłobione są trzy kanaliki tworzące literę H, dwa poprzeczne i jeden środkowy - łączący je. Mają one za zadanie zatrzymywać nadmiar płynu naniesionego na komorę.
Oznaczanie liczby drobnoustrojów przy użyciu komory Thoma wykonuje się następująco. Zawiesinę komórek drożdży mających tendencję do zlepiania się rozcieńcza się, biorąc 3 objętości zawiesiny i l objętość kwasu siarkowego rozcieńczonego wodą w stosunku 1:10, wytrząsa się kilka minut, przenosi szybko do komory Thoma, przykrywa szkiełkiem przykrywkowym i przystępuje do liczenia.
Po ustawieniu oświetlenia, należy znaleźć siatkę komory najpierw przy obiektywie 10x, a następnie przy obiektywie 40x. Jeśli stwierdzi się zbyt duże zagęszczenie drobnoustrojów, to należy próbę rozcieńczyć ilościowo, np. 10-krotnie, i powtórzyć oznaczenie. Oblicza się średnią liczbę drobnoustrojów z około 40 małych kwadracików (o pow. 1/400 mm2). W sumie należy policzyć około 700 komórek, by błąd nie przekroczył 10%. Komórki rozmieszczone są nierównomiernie, w jednych kwadracikach może być ich kilka, a w innych - kilkanaście.
Przy średniej liczbie komórek w jednym kwadraciku (a) i rozcieńczeniu (n), zawartość komórek (L) w l cm3 wynosi:
L = 4 • 106 • a • n
Opis działania:
Instrument pokazany na górze (a), składa się z prostokątnej płytki szklanej, w której centralna płaszczyzna leży dokładnie 0, 1 mm niżej niż części boczne. Płaska część centralna jest oddzielona od części bocznych rowkami, a sama podzielona jest na dwie części dodatkowym płytszym rowkiem (widocznym w b). Na powierzchni każdej z tych części wyryta jest siateczka (c) tworząca kwadrat podzielony na 400 małych części o wielkości 1/400 mm2. Szkiełko nakrywkowe nakłada się jak w części(b) i silnie przyciska do części bocznych. By zapewnić właściwe przyleganie, podczas przyciskania szkiełko można lekko przesunąć. O dobrym przyleganiu szkiełka świadczy pojawienie się barwnego wzoru (pierścienie Newtona) pokazanego w postaci czarnych linii w(b).
Stosowanie komory:
Pipetą pasterowską pobiera się małą objętość płynu (nie więcej niż do wysokości 10 mm), a następnie dotyka się nią centralnej płaszczyzny, tak by brzegiem dotykała szkiełka nakrywkowego. W tej pozycji, płyn na zasadzie sił kapilarnych przechodzi z pipety pod szkiełko nakrywkowe. Płyn nie powinien przelewać się do rowków (czasem konieczne jest lekkie stuknięcie końcem pipety, by płyn zaczął się przesuwać). Jeśli jest taka potrzeba, w drugiej części komory doliczenia można zbadać kolejną próbkę. Komorę zostawia się na 30 minut, by komórki osiadły na dnie, a następnie pod mikroskopem liczy się je. Ostrość nastawia się na siatkę. Dokładnie znana objętość między siateczką a szkiełkiem nakrywkowym pozwala na precyzyjne obliczenie komórek w jednostce objętości.
Przykład liczenia:
Ponieważ każda mała kratka utworzona przez siateczkę ma wymiary 1/400 mm2, a odległość między siateczką a szkiełkiem nakrywkowym wynosi 1/10 mm, objętość cieczy na każdą kratkę jest 1/4000 mm3 tj. 1/4000000 ml. Przypuśćmy np., że po przejrzeniu wszystkich 400 kratek znaleziono 500 komórek. Dałoby to średnią 1, 25 na kratkę, tzn. 1, 25 komórki w 1/4000000 ml. Próbka musiała zatem zawierać1, 25x4 000 000 komórek w ml, czyli 5 x 106 komórek w ml. Można w ten sposób zbadać kilka powtórzeń próbek i wyliczyć średnią. Jeśli próbka była rozcieńczona przed zbadaniem (gdyż była zbyt gęsta), otrzymaną liczbę komórek należy pomnożyć przez współczynnik rozcieńczenia; np., jeśli została rozcieńczona dziesięciokrotnie, liczba komórek powinna być pomnożona przez 10.
W komorze Helbera odległość między powierzchnią a szkiełkiem nakrywkowym wynosi 0, 02 mm.
Komora Bürkera
Opis rysunku: Cover slip-szkiełko nakrywowe, Rule grid- siatka, Cavity with suspension 0,1 mm depth- wgłębienie głębokości 0,1 mm.
Komora Bürkera ma, podobnie jak komora Thoma, głębokość 0,1 mm, natomiast podzielona jest na większe kwadraciki. Bok podstawowego kwadracika wynosi 0,2 mm, czyli powierzchnia wynosi 0,04 mm2, a objętość prostopadłościanu pod szkiełkiem przykrywkowym 0,004 mm3. Podczas korzystania z komory Bürkera należy zwrócić uwagę na to, czy odmierzono poprawne objętości materiału badanego oraz barwnika, przed dokonaniem nałożenia preparatu należy pamiętać o dokładnym umyciu komory i usunięciu poprzednio badanej próbki, po nałożeniu próbek do obydwu części komory zliczeniowej, należy przykryć je specjalnym szkiełkiem nakrywkowym dołączonym do komory.
W celu prawidłowego wykonania badania w użyciem komory Bürkera i otrzymania poprawnych wyników, (oraz poprawnego oznaczenia ilości komórek martwych i żywych) wymieszania zawiesiny z barwnikiem należy dokonać na jak najkrótszy czas przed dokonaniem obserwacji pod mikroskopem.
Wyróżniamy następujące możliwości barwienia:
· barwienie za pomocą roztworu błękitu trypanowego
Po użyciu błękitu trypanowego do wybarwiania komórek niemożliwe jest dokładne odróżnienie komórek żywych od martwych podczas obserwacji pod mikroskopem, w takim przypadku policzyć wszystkie komórki bez uwzględniania podziału na żywe i martwe.
· barwienie za pomocą roztworu erytrozny
Liczenie metodą Breeda.
Na znanej powierzchni szkiełka przedmiotowego dokładnie odtłuszczonego rozprowadza się znaną objętość zawiesiny pobraną pipetką Breeda (0,01 cm3 ) lub oczkiem Burriego (0,001 cm3 ). Po wykonaniu rozmazu, utrwaleniu i zabarwieniu preparatu liczy się pod mikroskopem średnią liczbę komórek w trzech preparatach przygotowanych z tej samej zawiesiny, a w każdym preparacie oblicza się średnią z 20 przypadkowo wybranych pól widzenia. Z otrzymanych wyników oblicza się średnią arytmetyczną liczby komórek w polu widzenia (a). Mikrometrem okularowym lub komorą Thoma mierzy się promień pola widzenia (r) danego układu optycznego i oblicza się powierzchnię pola widzenia (∏r2). Znając powierzchnię rozmazu preparatu na szkiełku przedmiotowym (A), oblicza się zawartość mikroflory (L) w objętości zawiesiny naniesionej na szkiełko:
L = A / ∏r2 · a
Uwzględniając rozcieńczenie i mnożnik do przeliczenia pobranej do rozmazu objętości na l cm3 (100 dla pipetki Breeda i 1000 dla oczka Burriego), oblicza się zawartość mikroflory w l cm3. Aby błąd w tej metodzie nie przekroczył 10%, należy policzyć ok. 150 komórek.
Technika bezpośredniej epifluorescencji (Metoda DEFT z oranżem akrydyny)
Barwnik oranż akrydyny jest zalecany do stosowania w wykrywaniu drobnoustrojów w rozmazach bezpośrednich próbek pochodzenia klinicznego i nieklinicznego z zastosowaniem mikroskopii fluorescencyjnej. Jest on szczególnie przydatny w szybkich testach przesiewowych fizjologicznie sterylnych próbek, takich jak płyn mózgowo-rdzeniowy, w których może występować niewiele drobnoustrojów, oraz w szybkim badaniu rozmazów krwi lub rozmazów zawierających materiał białkowy, w przypadku których odróżnienie drobnoustrojów od materiału tła może być trudniejsze.
Fluorochromatyczne barwienie drobnoustrojów przy użyciu oranżu akrydyny zostało po raz pierwszy opisane przez Struggera i Hilbricha w roku 1942. Od tego czasu jest ono powszechnie wykorzystywane w badaniach gleby i wody pod kątem występowania drobnoustrojów. W roku 1975 Jones i Simon dokonali oceny metod epifluorescencyjnych stosowanych do bezpośredniego liczenia bakterii wodnych i ustalili, że przy użyciu oranżu akrydyny uzyskano najlepszy szacunek liczebności bakterii w próbkach wody z jeziora, rzeki oraz wody morskiej. Metodologia bezpośredniego liczenia z wykorzystaniem oranżu akrydyny (AODC, ang. acridine
orange direct count) znalazła zastosowanie w liczeniu bakterii w składowiskach odpadów. Heidelberg i in. zastosowali AODC w badaniu sezonowych zmian liczebności bakterii morskich i ustalili, że barwienie oranżem akrydyny dało lepsze wyniki niż procedury bezpośredniego liczenia z wykorzystaniem oligonukleotydów fluorescencyjnych (FODC, ang. fluorescent oligonucleotide direct counting).
Technika bezpośredniej epifluorescencji (DEFT, ang. direct epifluoresent filter technique) z wykorzystaniem oranżu akrydyny stanowi jedną z metod badania mikrobiologicznego żywności i wody. Oranż akrydyny znalazł również zastosowanie kliniczne, a jego użycie do barwienia bakterii w hodowlach krwi zyskało szeroką akceptację. W roku 1980 McCarthy i Senne porównali barwienie oranżem akrydyny z metodą ślepych hodowli pochodnych w wykrywaniu dodatnich hodowli krwi. Wyniki ich pracy wykazały, że barwienie oranżem akrydyny jest szybką, niedrogą alternatywą metody ślepych hodowli pochodnych. Stwierdzili oni również, że barwienie oranżem akrydyny wydawało się być bardziej czułe niż barwienie metodą Grama w wykrywaniu drobnoustrojów i umożliwiało wykrycie bakterii w stężeniach ok. 1 x 104 CFU (jednostek tworzących kolonie, ang. colony-forming units)/mL. Lauer, Reller i Mirret porównali barwienie oranżem akrydyny z barwieniem metodą Grama w wykrywaniu drobnoustrojów w płynie mózgowo-rdzeniowym i innych próbkach pochodzenia klinicznego. Uzyskane przez nich wyniki były zgodne z wynikami, które otrzymali McCarthy i Senne, i wykazały, że barwienie oranżem akrydyny jest prostą i szybką metodą barwienia o większej czułości wykrywania drobnoustrojów w próbkach pochodzenia klinicznego niż barwienie metodą Grama. Oranż akrydyny był również stosowany w wykrywaniu Trichomonas vaginalis w wymazach z pochwy, diagnostyce malarii i mykoplazmozy. Oranż akrydyny to fluorochromatyczny barwnik, który wiąże się z kwasami nukleinowymi bakterii i innych komórek.15 W świetle UV oranż akrydyny barwi RNA i jednoniciowy DNA na pomarańczowo, a dwuniciowy DNA na zielono. Oranż akrydyny buforowany przy pH 3,5 - 4,0 umożliwia barwienie różnicowe mikroorganizmów na tle pozostałego materiału komórkowego. Bakterie i grzyby wybarwiają się jednorodnie na kolor jasnopomarańczowy, zaś ludzkie komórki nabłonka i komórki zapalne, a także zanieczyszczenia tła wybarwiają się na kolor od zielonego do żółtego. Jądra aktywowanych leukocytów wybarwiają się na kolor żółty, pomarańczowy lub czerwony w związku z wynikającą z aktywacji zwiększoną produkcją RNA. Erytrocyty albo nie wybarwiają się w ogóle, albo zyskują kolor jasnozielony. Dzięki tej właściwości barwienia różnicowego można dokonywać szybkiego badania przesiewowego barwionych oranżem akrydyny rozmazów próbek pochodzenia klinicznego z zastosowaniem mikroskopii fluorescencyjnej przy powiększeniu 100 - 400x. W badaniu tym fluoryzujące na kolor jasnopomarańczowy drobnoustroje odróżniają się od czarnego lub jasnozielonego do żółtego tła.
Barwienie oranżem akrydyny pozwala uzyskać wstępne informacje na temat obecności i identyfikacji drobnoustrojów mogących znajdować się w próbce. Jako że widoczne w rozmazach drobnoustroje, także nieżywotne, mogą pochodzić ze źródeł zewnętrznych, np. przyrządów do pobierania próbki, szkiełek lub wody użytej do płukania, wynik wszystkich dodatnich rozmazów należy potwierdzić, wykonując hodowle. Liczba drobnoustrojów musi wynosić ok. 104 CFU/mL, aby możliwe było ich wykrycie tą metodą. Oranż akrydyny nie pozwala na rozróżnienie bakterii Gram-dodatnich i Gram-ujemnych. Wynik reakcji Grama można stwierdzić, dokonując barwienia metodą Grama bezpośrednio na oranżu akrydyny po usunięciu olejku immersyjnego. Jądra lub ziarnistości pochodzące z aktywowanych leukocytów, które uległy degradacji, mogą przy mniejszych powiększeniach (np. 100 - 400x) przypominać ziarniaki. Można je odróżnić od drobnoustrojów na podstawie morfologii przy większych powiększeniach, np. 1000x.
Niektóre rodzaje zanieczyszczeń mogą wykazywać fluorescencję w rozmazach barwionych oranżem akrydyny. Zanieczyszczenia te można odróżnić od drobnoustrojów na podstawie morfologii przy większych powiększeniach.
Bakterie i grzyby wybarwiają się na kolor jasnopomarańczowy. Tło ma kolor od czarnego do żółtozielonego. Ludzkie komórki nabłonka i komórki zapalne, a także zanieczyszczenia pochodzące z tkanek wybarwiają się na kolor od jasnozielonego do żółtego. Aktywowane leukocyty wybarwiają się na kolor żółty, pomarańczowy lub czerwony w zależności od poziomu aktywacji i ilości produkowanego RNA, natomiast erytrocyty albo nie wybarwiają się w ogóle, albo zyskują kolor jasnozielony.
Zaletą metody bezpośredniej jest szybkie uzyskanie wyniku na który składna się liczba wszystkich komórek niezależnie od ich wymagań wzrostowych. Natomiast ich wadą jest liczenie żywych i martwych komórek.
Liczenie mikroorganizmów w preparacie mokrym.
Ostatnią z metod bezpośredniego oznaczania liczebności mikroorganizmów jest liczenie w preparacie mokrym.
Kroplę zawiesiny umieszcza się pod szkiełkiem przykrywkowym i liczy średnią liczbę komórek z 20 pól widzenia. Zakłada się, że grubość preparatu wynosi 0,01 mm. Oblicza się powierzchnię pola widzenia mikroskopu (∏r2), jak podano wyżej. Mnożąc powierzchnię pola widzenia przez grubość preparatu, oblicza się objętość walca, w którym obliczono średnią liczbę komórek (a).
Zawartość drobnoustrojów w l cm3 oblicza się ze wzoru:
L = 1000 / 0,01 · ∏r2 · a · n
gdzie:
1000 - przeliczenie na l cm3,
a - średnia zawartość komórek w polu widzenia,
n - rozcieńczenie,
r - promień pola widzenia,
Modyfikacją tej metody jest sposób podany przez Majchrzaka. Pobiera się l cm zawiesiny do pipety i powoli wypuszcza krople, licząc, ile kropli mieści się w l cm . Jedną kroplę umieszcza się pod szkiełkiem przykrywkowym o znanej powierzchni. Oblicza się średnią liczbę komórek z 20 pól widzenia i uwzględniając rozcieńczenia, oblicza się zawartość drobnoustrojów w l cm3 według wzoru:
L = a · p · b ·n / ∏r2 lub L = p / ∏r2 · a · b ·n
gdzie:
a - średnia liczba komórek z 20 pól widzenia,
b - liczba kropli w l cm ,
p - powierzchnia szkiełka przykrywkowego,
n - rozcieńczenie.
Podsumowanie
Oznaczenie liczebności mikroorganizmów w badanym materiale metodami bezpośredniego liczenia możemy dokonać za pomocą komór lub techniki bezpośredniej epifluorescencji
Komory do liczenia drobnoustrojów pod mikroskopem to najczęściej szklane płytki z wyciętym wgłębieniem, podzielonym na kwadraty lub prostokąty o znanej powierzchni. Po naniesieniu rozcieńczenia do komory dokonuje się liczenia komórek widocznych w obrazie mikroskopowym, a następnie przelicza się ich liczbę na 1 cm³ badanego materiału. Najczęściej stosuje się komory BÜRKERA i THOMA
W przypadku metody DEFT, wykonanie oznaczenia obejmuje filtrowanie odpowiednio przygotowanej próby a następnie barwienie osiadłych na filtrze drobnoustrojów fluorescencyjnym barwnikiem (oranżem akrydyny) i policzenie liczby bakterii przy użyciu mikroskopu fluorescencyjnego. W metodzie tej komórki żywe barwią się na kolor zielony, natomiast martwe na kolor pomarańczowy.
Powyżej opisane metody znalazły szerokie zastosowanie w przemyśle, medycynie (ustalanie liczby białych krwinek, produkcja szczepionek), gastronomii, ekologii (badanie jakości wody pitnej np., pod kątem obcności pałeczek bakterii coli) oraz większości dziedzin życia.
Literatura:
Paul Singelton, Bakterie w biologii, biotechnologii i medycynie., Wydawnictwo Naukowe PWN
Chruściak E., Kulińska D., Romanowa I., Russel S. - Ćwiczenia z mikrobiologii. SGGW
Duszkiewicz - Reinhard W. i inni - Teoria i ćwiczenia z mikrobiologii ogólnej i technicznej. Wydawnictwo SGGW.
Kunicki - Goldfinger W. - Życie bakterii.
Różalski A. - Ćwiczenia z mikrobiologii ogólnej. Wydawnictwo Uniw. Łódzkiego.
Zmysłowska I. - Mikrobiologia ogólna i środowiskowa. Teoria i ćwiczenia. - Wydawnictwo UWM Olsztyn
Nowak A. i inni - Przewodnik do ćwiczeń z mikrobiologii. - Wydawnictwo AR w Szczecinie.
Wyszukiwarka
Podobne podstrony:
pwsz kalisz Metody oznaczania mikroorganizmów w powietrzu, inżynieria ochrony środowiska kalisz, a p
pwsz kalisz Metody oznaczania mikroorganizmów w powietrzu, inżynieria ochrony środowiska kalisz, a p
Metody oznaczania ogólnej liczebności drobnoustrojów
2 23 lutego 2011 Izolowanie mikroorganizmów z różnych środowisk naturalnych
2 Izolowanie mikroorganizmów z różnych środowisk naturalnych
Metody oznaczania ogólnej liczebności drobnoustrojów
2 23 lutego 2011 Izolowanie mikroorganizmów z różnych środowisk naturalnych
12 11 maja 2011 Metody oznaczania ogólnej liczebności drobnoustrojów
Środowisko naturalne, a metody wytwarzania energii
Metody recyklingu i odzysku materiałów, ochrona środowiska naturalnego (Piotr Ciepliński)
KURATOR SĄDOWY – KURATELA SĄDOWA, Studia, Uczelnia, Metodyka pracy profilaktyczno - wychowawczej w ś
swietlica a potrzeby, Studia, Uczelnia, Metodyka pracy profilaktyczno - wychowawczej w środowisku
08 Badanie toksyn w środowisku naturalnym
Higiena środowisko naturalne
08 Badanie toksyn w środowisku naturalnym
więcej podobnych podstron